Method Article
Un metodo all'avanguardia per preservare l'udito residuo durante la chirurgia dell'impianto cocleare
In questo articolo
Riepilogo
La conservazione delle strutture cocleari e dell'eventuale udito residuo è un fattore importante da considerare durante l'intervento di impianto cocleare. Qui presentiamo un metodo all'avanguardia per preservare l'udito residuo durante la chirurgia dell'impianto cocleare in anestesia locale.
Abstract
Gli sviluppi nelle tecniche chirurgiche e nella progettazione degli elettrodi per impianti cocleari (CI) hanno ampliato le indicazioni per il trattamento dell'IC. Attualmente, i pazienti con ipoacusia ad alta frequenza possono trarre beneficio dalle IC quando l'udito residuo a bassa frequenza può essere preservato, in quanto ciò consente la stimolazione elettro-acustica combinata (EAS). I possibili vantaggi dell'EAS includono, ad esempio, una migliore qualità del suono, la percezione della musica e l'intelligibilità del parlato nel rumore.
I rischi di traumi all'orecchio interno e di deterioramento o addirittura perdita completa dell'udito residuo variano a seconda della tecnica chirurgica e del tipo di array di elettrodi utilizzati. Gli elettrodi corti a parete laterale con profondità di inserimento angolare inferiori hanno dimostrato tassi di conservazione dell'udito più elevati rispetto agli elettrodi più lunghi. L'inserimento molto lento dell'array di elettrodi attraverso la finestra rotonda della coclea contribuisce all'atraumaticità dell'inserimento e, quindi, può portare a risultati favorevoli per la conservazione dell'udito. Tuttavia, l'udito residuo può essere perso anche dopo un inserimento atraumatico.
L'elettrococleografia (ECochG) può essere utilizzata per monitorare la funzione delle cellule ciliate dell'orecchio interno durante l'inserimento dell'elettrodo. Diversi ricercatori hanno dimostrato che le risposte ECochG durante l'intervento chirurgico possono predire i risultati della conservazione dell'udito postoperatorio.
In uno studio recente, abbiamo correlato la percezione uditiva soggettiva dei pazienti con le risposte ECochG intracocleari registrate simultaneamente durante l'inserimento. Questo è il primo studio che valuta l'associazione tra le risposte ECochG intraoperatorie e la percezione dell'udito in un soggetto sottoposto a impianto cocleare in anestesia locale senza sedazione. La combinazione delle risposte ECochG intraoperatorie con il feedback in tempo reale del paziente agli stimoli sonori ha un'eccellente sensibilità per il monitoraggio intraoperatorio della funzione cocleare. Questo articolo presenta un metodo all'avanguardia per la conservazione dell'udito residuo durante la chirurgia dell'impianto cocleare. Descriviamo questa procedura di trattamento con l'attenzione particolare di eseguire l'intervento chirurgico in anestesia locale, il che rende possibile il monitoraggio dell'udito del paziente durante l'inserimento dell'array di elettrodi.
Introduzione
L'impianto cocleare è l'unico trattamento in uso clinico che ripristina la funzione di un organo sensoriale. Attualmente, l'impianto cocleare viene applicato per trattare l'ipoacusia neurosensoriale da grave a profonda nei bambini e negli adulti. Il sistema di impianto cocleare (CI) è costituito da un dispositivo interno impiantabile combinato con un audioprocessore esterno. Il dispositivo interno viene inserito durante l'intervento chirurgico attraverso la cavità mastoidea. L'incavo facciale viene aperto per accedere all'orecchio medio e alla coclea. L'array di elettrodi viene inserito nella coclea attraverso la timpanotomia posteriore e la finestra rotonda della coclea. L'array di elettrodi fornisce la stimolazione elettrica bypassando le cellule ciliate esterne e interne difettose e stimolando direttamente le cellule gangliari del nervo uditivo.
È stato dimostrato che la conservazione dell'integrità delle strutture dell'orecchio interno dopo un intervento chirurgico di IC può contribuire a esiti uditivi più favorevoli rispetto all'inserimento di elettrodi, che possono causare danni strutturali all'orecchio interno 1,2. Ciò ha portato allo sviluppo di tecniche chirurgiche più delicate e di array di elettrodi più sottili, più flessibili e quindi meno traumatici. Questi sviluppi hanno contribuito a migliorare i risultati dell'udito, portando a un'espansione delle indicazioni per la riabilitazione dell'IC. Anche i pazienti con ipoacusia grave ad alta frequenza (>1,5 kHz) possono trarre beneficio dall'impianto cocleare, soprattutto quando il loro udito naturale nelle basse frequenze può essere preservato (<1 kHz). L'udito a bassa frequenza dopo l'intervento chirurgico consente al paziente di beneficiare della stimolazione elettroacustica (EAS)3,4. L'EAS è una combinazione di stimolazione elettrica alle aree ad alta frequenza della coclea, che si trovano nelle parti basali della coclea, e amplificazione acustica per le aree a bassa frequenza conservate (tipicamente 125-500 Hz) nelle parti apicali della coclea.
I migliori risultati nella chirurgia di conservazione dell'udito (HP) sono stati ottenuti con array di elettrodi più corti, progettati specificamente per i candidati EAS 4,5,6. Ci può essere uno dei principali svantaggi associati agli array di elettrodi corti: la perdita dell'udito residuo (dopo l'intervento chirurgico o successivamente). Il paziente può infine beneficiare di un array di elettrodi più lungo che copre una gamma più ampia di frequenze, soprattutto nei casi in cui si è verificata una sfortunata perdita dell'udito residuo 5,7. Recentemente, l'introduzione dell'inserimento parziale dell'elettrodo più lungo della parete laterale in pazienti con perdita dell'udito moderata a frequenze più alte e perdita dell'udito normale o lieve a frequenze più basse ha creato l'opzione per l'inserimento superficiale iniziale nei candidati EAS, ma facilita anche l'inserimento più profondo con lo stesso array se l'udito residuo viene perso8.
L'elettrococleografia (ECochG) è una metodica che può essere utilizzata per monitorare la funzione cocleare durante l'impianto cocleare ed è stata sempre più sfruttata nell'uso clinico. Attualmente, i tre principali produttori di IC forniscono uno strumento clinicamente approvato, o almeno uno strumento di ricerca, per le misure intracocleari intraoperatorie di ECochG. Uno fornisce una soluzione all-in-one con la stimolazione e la registrazione della risposta integrate in un unico strumento, mentre gli strumenti forniti dagli altri produttori richiedono uno stimolatore separato. ECochG misura la risposta elettrofisiologica dall'orecchio interno e dal nervo uditivo a uno stimolo acustico. Sembra che le ampiezze delle risposte ECochG misurate durante l'inserimento dell'elettrodo possano predire la conservazione dell'udito postoperatorio. Pertanto, la ECochG intraoperatoria sembra rappresentare uno strumento promettente per fornire informazioni che consentano la prevenzione del trauma 9,10,11,12. La ricerca attiva e l'accresciuto interesse clinico nella valutazione delle misurazioni intraoperatorie di ECochG hanno sollevato la questione di come analizzare oggettivamente le risposte ECochG e come reagire ai cambiamenti nell'ampiezza della risposta durante l'inserimento.
La fattibilità e i benefici della chirurgia IC in anestesia locale sono stati riportati in diversi studi 13,14,15,16. I candidati IC con comorbilità significative possono essere operati in anestesia locale, evitando così i rischi legati all'anestesia generale. L'anestesia generale è associata a un aumentato rischio di deterioramento cognitivo, soprattutto nei pazienti anziani, ed è stata anche associata a una maggiore mortalità in questi gruppi17. Quando la chirurgia IC viene eseguita in anestesia locale, il recupero dall'operazione è più rapido e, quindi, il paziente trascorre meno tempo in ospedale rispetto a un'operazione simile eseguita in anestesia generale 14,15,18,19. È stato anche proposto che i pazienti con udito residuo possano essere in grado di monitorare il proprio udito durante l'inserimento, il che potrebbe guidare il chirurgo durante l'inserimento dell'elettrodo CI ed evitare traumi intracocleari14.
Recentemente abbiamo confrontato l'ECochG e la percezione soggettiva del suono come indicatori della conservazione dell'udito nella chirurgia dell'IC in anestesia locale20. I risultati hanno indicato una buona previsione della conservazione dell'udito con entrambi i metodi, e modelli simili sono stati osservati tra la segnalazione soggettiva e il monitoraggio ECochG. Il feedback soggettivo dei pazienti sulla percezione del suono, che era possibile poiché era in uso solo l'anestesia locale, sembrava aiutare a minimizzare il rischio di traumi all'orecchio interno durante l'inserimento, anche nei casi in cui le risposte ECochG non potevano essere misurate durante l'inserimento.
Qui presentiamo un metodo all'avanguardia per preservare l'udito residuo durante la chirurgia dell'impianto cocleare. Descriviamo le procedure di trattamento, comprese le considerazioni speciali associate all'esecuzione dell'intervento chirurgico in anestesia locale (ad esempio, ECochG) e il monitoraggio soggettivo dell'udito.
Protocollo
Il protocollo è stato approvato dall'Institutional Review Board (5551877) e dal Comitato Etico per la Ricerca del Distretto Ospedaliero del Savo Settentrionale (1690/2019) ed è stato realizzato secondo le linee guida della Dichiarazione di Helsinki. Il consenso informato è stato raccolto da tutti i pazienti che si sono offerti volontari per lo studio.
1. Considerazioni preoperatorie
- Valutazione della soglia uditiva residua
- Assicurarsi che le medie di soglia del tono puro (PTA) preoperatorie siano a 0,250-1 kHz a ≤75 dB e che il paziente possa sentire chiaramente lo stimolo a 500 Hz o 1.000 Hz a ≤100 dB (Figura 1).
- Criteri di valutazione-inclusione ed esclusione del paziente
- Assicurarsi che il paziente sia idoneo per la chirurgia IC da eseguire in anestesia locale. Giudicare l'idoneità in base alla capacità del paziente di stare fermo e comprendere la comunicazione durante l'intervento chirurgico e i limiti dell'intervento. Chiedi al chirurgo operativo di condurre un colloquio e un esame meticolosi nella clinica ambulatoriale per valutare se il paziente sarà in grado di rispondere in modo appropriato durante l'intervento.
- Verificare che il paziente abbia un'anatomia normale nella regione temporale sulla base dell'imaging preoperatorio (risonanza magnetica [MRI] e tomografia computerizzata [TC]) e che non vi siano controindicazioni (ad esempio, nervo cocleare mancante o coclea ostruita) per l'intervento di CI.
- Aprire il software per il visualizzatore di immagini per le immagini TC e MRI e, dal menu a discesa, scegliere Ricostruzione multiplanare (MPR).
- Identificare i punti di riferimento anatomici chiave (cellule mastoidee, placca durale della fossa media, seno sigmoideo, nervo facciale, condotto uditivo esterno, coclea, condotto uditivo interno) dallo stack di immagini TC.
- Aprire la risonanza magnetica preoperatoria e assicurarsi che il paziente sia idoneo all'impianto cocleare: la coclea è aperta senza occlusioni e dalla risonanza magnetica viene rilevato un nervo cocleare intatto.
- Valutazione della profondità di inserimento e selezione dell'elettrodo in base alle dimensioni della coclea
- Aprire il visualizzatore di immagini e le scansioni TC preoperatorie. Quindi, scegli MPR dalla barra a discesa.
- Ottenere la vista della coclea dalle immagini TC allineando le immagini nell'MPR in parallelo con la coclea.
- Valutare le misure A e B: la dimensione cocleare, la lunghezza dalla finestra rotonda attraverso il modiolo e l'altezza perpendicolare alla linea A attraverso il modiolo, secondo Escudé et al.21, dalla vista della coclea ottenuta e ad una profondità di inserzione di 270° dalla finestra rotonda della coclea. Misurare la distanza a 270° seguendo il bordo osseo esterno della coclea.
- Scegliere una lunghezza dell'elettrodo tale che ci siano nove contatti intracocleari dell'elettrodo con un angolo di profondità di inserimento (IDA) di 270°-300°.

Figura 1: Audiogramma preoperatorio. Le soglie di indicazione sono presentate come una zona verde. Clicca qui per visualizzare una versione più grande di questa figura.
2. Preparazioni perioperatorie in sala operatoria (OR)
- Assicurarsi che ci sia spazio sufficiente tra il viso del paziente e il drappeggio. Inoltre, verificare che la comunicazione con il paziente sia possibile con il suo apparecchio acustico controlaterale (HA). Collega l'HA in modalità wireless con un microfono remoto fornito all'infermiera. Per l'HA, utilizzare un tubo sonoro lungo per evitare feedback sgradevoli.
- In alternativa, se il paziente non ha la possibilità di un HA controlaterale, utilizzare un tablet per fornirgli una comunicazione scritta. Testare la comunicazione con il paziente.
- Somministrare antibiotici e desametasone (ad es. 1,5 g di cefuroxima e 0,1 mg/kg di desametasone) per via endovenosa prima dell'incisione cutanea.
- Inserire l'auricolare stimolatore ECochG nel condotto uditivo esterno del paziente prima dell'incisione. Sigillare il condotto uditivo esterno nell'auricolare con cera ossea (Figura 2).
NOTA: Alcuni produttori forniscono auricolari in schiuma in confezione sterile. In alternativa, l'auricolare può essere inserito prima del drappeggio e il tubo può essere alimentato sotto il drappeggio al computer ECochG. - Posizionare un foglio di iodoformio sull'area operativa e allineare l'auricolare e il tubo del suono lontano dall'area dell'incisione. Fare attenzione che il drappeggio di iodoformio non pieghi il tubo sonoro durante la preparazione.
3. Mastoidectomia parziale, timpanostomia posteriore e perforazione del letto implantare con un trapano chirurgico
- Praticare la mastoidectomia parziale e la timpanostomia posteriore e preparare il letto implantare.
4. Inserimento
- Per la preparazione dell'ECochG, assicurarsi della presenza di un fisico/ingegnere clinico in sala operatoria, di seguito denominato operatore ECochG.
- Preparare l'attrezzatura per l'esecuzione della stimolazione sonora ECochG (vedere la Tabella dei materiali) e la misurazione della risposta attraverso l'IC; la configurazione varia leggermente a seconda del produttore dell'impianto cocleare.
- Collegare il tubo sonoro allo stimolatore.
- Collegare la bobina dell'impianto e il cavo al dispositivo di misurazione.
- Infilare la bobina di misurazione e il cavo nell'involucro sterile.
- A seconda del produttore, avviare il programma di misura da un laptop o utilizzare un sistema basato su tablet.
- Lo stimolo è un'esplosione di toni e la lunghezza dell'esplosione dipende dalla frequenza dello stimolo. Selezionare la frequenza dello stimolo (di solito, stimoli alla frequenza più alta conservabile di 500 Hz o 1.000 Hz durante l'inserimento), la pressione sonora da utilizzare e l'ampiezza dello stimolo (ad esempio, 80-100 dB nHL in modo che lo stimolo sia ben udito e tollerabile) dal software ECochG. A seconda del produttore, mantenere gli altri parametri di misurazione ai valori predefiniti o modificarli come segue: una finestra di misurazione di 6,5-9,7 ms con un ritardo fino a 2 ms dopo l'inizio dello stimolo e una media di 40-150 registrazioni per punto dati. Idealmente, ripetere lo stimolo con polarità alternata e risposte con condensazione e sottrarre la polarità di rarefazione per estrarre la componente microfonica cocleare (Figura 3).
- Utilizzare il primo o il secondo contatto dell'elettrodo per la misurazione ECochG. Controllare l'impedenza del canale di misura subito dopo che il contatto è nella coclea e prima della prima misurazione.
- Chiedi all'assistente della sala operatoria di andare dal paziente e di ripetergli le istruzioni sulla segnalazione soggettiva dei cambiamenti negli stimoli sonori.
- Testare gli stimoli sonori e confermare dal paziente che possono sentire chiaramente gli stimoli.
- Consigliare al paziente di informare su eventuali deviazioni, come la diminuzione o la scomparsa degli stimoli percepiti.
- Preparare l'attrezzatura per l'esecuzione della stimolazione sonora ECochG (vedere la Tabella dei materiali) e la misurazione della risposta attraverso l'IC; la configurazione varia leggermente a seconda del produttore dell'impianto cocleare.
- Preparazioni del chirurgo prima dell'inserimento
- Prendi il dispositivo CI e posiziona il ricevitore/stimolatore nel letto dell'impianto.
- Aprire la membrana rotonda della finestra della coclea. Fai una fessura con un ago ipodermico nel bordo inferiore della finestra rotonda e solleva con cautela la membrana all'indietro con un gancio microchirurgico. Sciacquare l'area rotonda della finestra con una soluzione di desametasone.
- Controllare l'allineamento del filo conduttore CI all'interno della cavità mastoidea per evitare qualsiasi forza di rotazione sull'elettrodo e sulle strutture intracocleari dal filo conduttore dopo l'inserimento.
- Ottenere una buona posizione ergonomica con il miglior supporto possibile per le mani per facilitare un inserimento lento e controllato.
- Inizio dell'inserimento
- Chiedi al chirurgo di informare l'équipe che l'inserimento sta iniziando e assicurati che tutto sia pronto.
- Prendi l'elettrodo con la pinza di inserimento e inizia l'inserimento dell'elettrodo nella coclea attraverso la finestra rotonda.
- All'inizio dell'inserimento, inserire prima l'elettrodo appena all'interno della coclea (uno o due contatti all'interno della coclea). Far misurare all'operatore ECochG l'impedenza dopo l'inserimento del primo e/o del secondo contatto. Se l'impedenza è molto alta, cambiare il canale di misura.
- Chiedere all'operatore ECochG di avviare la misurazione dopo le misure di impedenza. Assicurarsi che l'elettrodo progredisca molto lentamente con un feedback costante da parte della persona che osserva le risposte ECochG (Figura 4).
NOTA: A seconda del produttore, potrebbe esserci anche un'opzione che prevede che il dispositivo di registrazione fornisca un feedback uditivo, un tono che diventa più forte con una risposta crescente. Tuttavia, questo tono, insieme ad altri rumori in sala operatoria, può disturbare la valutazione soggettiva dello stimolo percepito da parte del paziente. - Chiedere al chirurgo di continuare l'inserimento con avanzamenti di 1-2 mm (un elettrodo). Tra questi progressi, ottenere un feedback dal paziente sul volume degli stimoli sonori percepiti.
- Se le risposte ECochG diventano più deboli o il paziente riferisce una diminuzione del volume percepito degli stimoli sonori, interrompere l'inserimento.
- Attendere 30-60 secondi, quindi informarsi sugli stimoli del paziente. Comunicare contemporaneamente con l'operatore ECochG sullo stato attuale del monitoraggio ECochG (risposta CM).
- Se una delle risposte (l'ECochG o le risposte soggettive) non si riprende quando l'elettrodo è immobile, tirare indietro l'elettrodo gradualmente di uno o due contatti alla volta (il valore di ~2 mm dipende dalla marca di elettrodo utilizzata) e attendere ogni volta la risposta. Tirare indietro l'elettrodo quanto basta fino a quando le risposte non si sono riprese.
- Se le risposte ECochG o il volume percepito non aumentano nuovamente dopo aver regolato l'inserimento, ma è stato raggiunto l'IDA desiderato (270°-300°) (in base alle misurazioni preoperatorie e al numero di elettrodi all'interno della coclea), interrompere l'inserimento. La situazione viene interpretata come un inserimento parziale completato.
- Se le risposte aumentano di nuovo, continuare l'inserimento come descritto sopra (passaggi 4.4.5-4.4.7).
- Sigillare la finestra rotonda con tessuto adiposo raccolto dall'incisione postauricolare.
- Inoltre, utilizzare colla di fibrina e polvere d'ossa per sigillare la scanalatura per il filo conduttore tra il ricevitore/stimolatore e la cavità mastoidea.
- Fissare il filo conduttore all'interno della cavità mastoidea con polvere ossea e colla di fibrina.
- Chiudere la ferita con punti di sutura chirurgici. Monitorare il paziente dopo l'operazione durante un pernottamento in reparto.
5. Cure postoperatorie
- Indirizzare il paziente alla tomografia computerizzata a fascio conico (CBCT) per l'imaging postoperatorio dell'impianto.
- Verificare il posizionamento dell'elettrodo dalle immagini CBCT.
- Aprire le immagini CBCT e scegliere MPR dall'elenco a discesa.
- Ottenere la vista cocleare nell'MPR.
- Verificare l'IDA e la posizione dell'elettrodo scorrendo le immagini nell'MPR. Controllare il numero di elettrodi intracocleari dalla vista cocleare per guidare l'adattamento dell'IC, soprattutto nei casi in cui vi è un inserimento parziale, e identificare gli elettrodi stimolanti.
- Verificare il posizionamento dell'elettrodo dalle immagini CBCT.
- Indirizzare il paziente a un audiogramma postoperatorio per misurare l'udito residuo il primo giorno postoperatorio dopo l'intervento e 1 mese dopo. Misurare regolarmente l'udito residuo durante i follow-up di adattamento.
NOTA: Il follow-up di 1 mese è più affidabile del primo giorno postoperatorio in termini di risultati di conservazione dell'udito.
Risultati
Sia il monitoraggio soggettivo che l'ECochG possono aiutare a prevenire l'insorgenza di traumi da inserzione e, quindi, fornire migliori risultati di conservazione dell'udito dopo l'intervento. Nell'audiogramma, si ritiene che una diminuzione della PTA (125-500 Hz) entro 15 dB dai livelli uditivi preoperatori rappresenti un residuo uditivo preservato e, quindi, un risultato positivo dopo l'intervento chirurgico. Un risultato negativo è la perdita dell'udito residuo: una variazione PTA (125-500 Hz) di oltre 30 dB rispetto all'udito preoperatorio. Tutti i dati riguardanti la fattibilità di preservare l'udito residuo durante l'impianto cocleare con questo protocollo sono stati riportati in precedenza da Linder et al.20. Il ruolo della ECochG nella predizione del trauma da inserzione non è stato ancora confermato. Da un lato, l'udito soggettivo del paziente sembra fornire uno strumento aggiuntivo con alcuni vantaggi rispetto all'ECochG, in quanto non presenta sfide tecniche ed è generalmente sempre di successo; Tuttavia, d'altra parte, è altamente soggettivo. La combinazione di entrambi i metodi offre l'opportunità di interpretare l'ECochG rispetto al feedback del paziente, il che può aiutare il chirurgo a prendere decisioni durante la procedura di inserimento. Sulla base dei dati di fattibilità per 10 pazienti, riteniamo che il feedback soggettivo possa prevedere la conservazione dell'udito residuo. I risultati dell'udito con questo protocollo sono presentati nella Tabella 1.
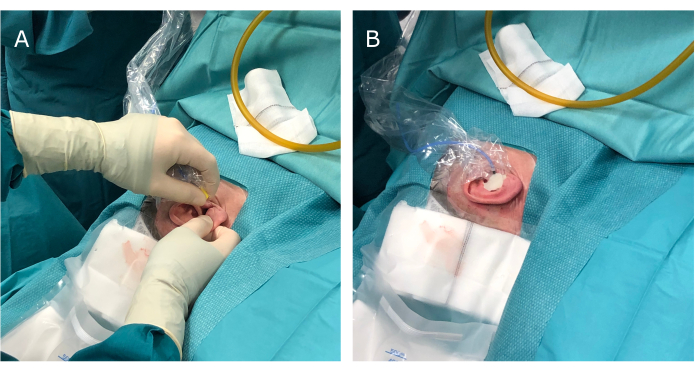
Figura 2: Inserimento dell'auricolare stimolatore ECochG nel condotto uditivo esterno del paziente prima dell'incisione e della sigillatura del condotto uditivo esterno. (A) Inserimento degli auricolari e (B) sigillatura del condotto uditivo esterno e dell'auricolare con cera ossea prima di drappeggiare l'orecchio con un foglio di iodoformio. Abbreviazione: ECochG = elettrococleografia. Clicca qui per visualizzare una versione più grande di questa figura.
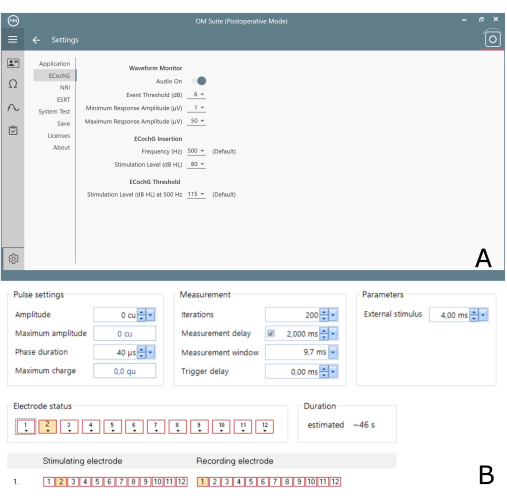
Figura 3: Impostazioni ECochG per entrambi i programmi disponibili in commercio. (A) Vista delle impostazioni per il software Advanced Bionics. (B) Vista delle impostazioni per il software Medel. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Inizio degli inserimenti e immagini di esempio da due diversi inserimenti con entrambi i tipi di software EcochG commerciali. (A) La vista in sala operatoria prima dell'inserimento, con il laptop EcochG davanti. (B) Buone risposte ECochG con il software Advanced Bionics (C) e con il software Medel. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Età dei pazienti, stato di monitoraggio intraoperatorio al termine dell'inserimento e risultati dell'udito come medie dei toni puri a 125-500 Hz prima e dopo l'intervento. Questa tabella è stata modificata da Linder et al.20. I risultati della conservazione dell'udito sono riportati secondo la classificazione utilizzata da Suhling et al.23. Clicca qui per scaricare questa tabella.
Discussione
L'utilizzo ottimale dell'impianto cocleare è importante per una gestione efficace della perdita dell'udito. L'ampliamento delle indicazioni per la riabilitazione con IC ha creato una zona grigia in cui devono essere prese decisioni individualizzate riguardo alle modalità di riabilitazione utilizzate. Al giorno d'oggi, per i pazienti con ipoacusia ad alta frequenza, c'è una tendenza verso la fornitura di IC. Tuttavia, l'udito residuo nelle basse frequenze non può essere preservato in tutti i pazienti. Il monitoraggio cocleare tramite ECochG è stato proposto come un modo per migliorare la conservazione dell'udito. Questo articolo presenta un metodo all'avanguardia per ottenere la conservazione affidabile dell'udito residuo durante l'intervento chirurgico applicando il monitoraggio cocleare basato sia sulle risposte elettrofisiologiche che su quelle di feedback del paziente.
È stato riportato che buone risposte ECochG durante l'intervento chirurgico sono correlate a migliori tassi di conservazione dell'udito 9,10,11,12,19. Un declino della risposta ECochG sembra predire un trauma e la perdita dell'udito residuo, e questo allerta il chirurgo per regolare la procedura di inserimento. ECochG può essere altamente raccomandato per la chirurgia HP in anestesia generale. Lo svantaggio principale dell'ECochG è la sua occasionale incapacità di registrare le risposte, anche se l'audiogramma misurato prima dell'intervento prevede buone risposte19. Anche se l'ECochG è uno strumento prezioso, il ruolo dell'ECochG nella conservazione non è stato completamente esplorato e sono necessarie ulteriori ricerche.
L'interpretazione della CEOCHG non è sempre una procedura semplice. L'ampiezza del segnale ECochG sembra essere abbastanza dipendente dal paziente e/o dalla misurazione. Pertanto, la soglia esatta per la fluttuazione di ampiezza accettata non è stata determinata e ciò giustifica ulteriori studi. Il rumore di misura e gli artefatti derivanti dal movimento dell'array di elettrodi causano diminuzioni a breve termine dell'ampiezza. Nella nostra esperienza, le diminuzioni di ampiezza derivanti dalla pressione sulla membrana basilare o dal danno cocleare sono solitamente sostenute almeno fino a quando l'array non viene spostato per ridurre la pressione.
Il monitoraggio soggettivo dell'udito durante l'inserimento dell'elettrodo è, ad oggi, il metodo più affidabile per evitare traumi cocleari durante l'intervento chirurgico. Naturalmente, il monitoraggio soggettivo dell'udito può essere effettuato solo in anestesia locale senza sedazione indotta da farmaci. Poiché l'inserimento viene eseguito molto lentamente per evitare possibili effetti negativi, e per poter reagire a questi effetti negativi se si verificano, il paziente deve rimanere immobile per 7-10 minuti. Un altro fattore importante da tenere in considerazione è l'utilizzo di stimoli sonori durante l'inserimento, che non devono superare il livello di comfort dell'udito del paziente.
Gli elettrodi corti a parete laterale progettati per la conservazione dell'udito sono generalmente lunghi da 16 mm a 20 mm. Per gli elettrodi da 16 mm, l'IDA tipico è compreso tra 280° e 300°22 e questi elettrodi hanno generalmente buoni risultati di conservazione dell'udito e forniscono buoni risultati uditivi con il protocollo EAS. I risultati in termini di conservazione dell'udito con LW di lunghezza standard tendono ad essere leggermente inferiori rispetto ai risultati con elettrodi corti5. Pertanto, raggiungere almeno lo stesso IDA che si otterrebbe con elettrodi corti è considerato sufficiente per la stimolazione elettrica con i pazienti con EAS. Un volume inferiore della scala timpana nelle parti più profonde aumenta il rischio di traumi durante l'inserimento. L'uso dell'ECochG e del monitoraggio soggettivo consente un inserimento più profondo e migliora la possibilità di preservare l'udito.
I due fattori più importanti per garantire il successo della chirurgia HP in anestesia locale sono la selezione del paziente corretto e la collaborazione dell'équipe chirurgica in sala operatoria. È fondamentale che l'inserimento venga eseguito in modo molto lento e stabile, il che richiede che il paziente non si muova. Un inserimento lento è necessario in modo che il feedback dell'ECochG e dell'udito soggettivo possano essere verificati e le modifiche alla procedura di inserimento possano essere eseguite prima che si verifichi un danno irreversibile. È inoltre necessario che ci sia una comunicazione senza soluzione di continuità in tutta la sala operatoria (tra chirurgo, medico, infermieri e paziente). La consapevolezza della situazione attuale dell'inserimento aiuta tutte le persone coinvolte a orientarsi e a intraprendere le azioni corrette per garantire il successo delle registrazioni e dell'inserimento. Inoltre, poiché il paziente è cosciente, significa che partecipa attivamente all'intervento chirurgico e deve essere altamente motivato a collaborare con l'équipe chirurgica.
In futuro, nuove soluzioni tecniche per consentire al paziente di segnalare cambiamenti negli stimoli senza dover parlare fornirebbero all'équipe chirurgica un accesso più comodo al proprio stato uditivo soggettivo, e questo potrebbe essere automaticamente collegato ai risultati ECochG. Ad esempio, questo potrebbe essere fatto con un interruttore elettronico che il paziente potrebbe premere per rispondere ai cambiamenti nel volume dello stimolo.
Questo è il primo metodo che utilizza il feedback uditivo soggettivo durante l'impianto cocleare. Un buon feedback soggettivo durante l'operazione sembra prevedere la conservazione dell'udito e, inoltre, crea possibilità per comprendere le dinamiche di inserimento e come queste possano essere meglio collegate con le informazioni fornite dall'ECochG. Ciononostante, è evidente che sono necessarie ulteriori ricerche per valutare le possibilità di monitoraggio soggettivo dell'udito durante la procedura di impianto cocleare.
Nel complesso, l'uso simultaneo di ECochG e il monitoraggio soggettivo dell'udito in anestesia locale senza sedazione indotta da farmaci e inserimento parziale di elettrodi sembrano essere associati a risultati affidabili di HP dopo l'intervento.
Divulgazioni
Gli autori non segnalano conflitti di interesse.
Riconoscimenti
Aarno Dietz ha ricevuto sovvenzioni dall'Accademia di Finlandia (Grant numero 333525) e dal North Savo Regional Grant. Pia Linder ha ricevuto una sovvenzione dal governo finlandese per la ricerca (numero di sovvenzione 5551877). Matti Iso-Mustajärvi ha ricevuto sovvenzioni dal governo finlandese per la ricerca (numero di sovvenzione 5551876), dalla Instrumentarium Science Foundation, dalla North Savo Regional Grant e dalla Finnish Society of Ear Surgery.
Materiali
| Name | Company | Catalog Number | Comments |
| EarPhone and sound tube | AB/Cochlear/Medel | Usually provided by the company in sterile packages, can be inserted in ear without sterility issues | |
| Ecocgh program | AB/Cochlear/Medel | AB and Medel provides software for clinical use. Also Cochlear has software for ECochG, atleas for research purposes. | |
| Equipments for Cochlear implantation | Basic setup and instrumentation for Cochlear implantation, not spesific to the ECoGh or Subjective hearing monitoring | ||
| Laptop/tablet | AB/Cochlear/Medel | AB has tablet consept as "AIM" for intraoperative ECochG measuring. It is provided by the company. Cochlear and Medelare operated with laptop | |
| Sound Processor | AB/Cochlear/Medel | Also company-specific, need for the connection to the electrode and measuring during the insertion |
Riferimenti
- Aschendorff, A., Kromeier, J., Klenzner, T., Laszig, R. Quality control after insertion of the nucleus contour and contour advance electrode in adults. Ear and Hearing. 28 (2), 75-79 (2007).
- Holden, L. K., et al. Factors affecting open-set word recognition in adults with cochlear implants. Ear and Hearing. 34 (3), 342-360 (2013).
- Gantz, B. J., Turner, C., Gfeller, K. E., Lowder, M. W. Preservation of hearing in cochlear implant surgery: Advantages of combined electrical and acoustical speech processing. Laryngoscope. 115 (5), 796-802 (2005).
- Lenarz, T., et al. European multi-centre study of the Nucleus Hybrid L24 cochlear implant. International Journal of Audiology. 52 (12), 838-848 (2013).
- Iso-Mustajärvi, M., Sipari, S., Löppönen, H., Dietz, A. Preservation of residual hearing after cochlear implant surgery with slim modiolar electrode. European Archives of Oto-Rhino-Laryngology. 277 (2), 367-375 (2020).
- Roland, J. T., Gantz, B. J., Waltzman, S. B., Parkinson, A. J. Multicenter clinical trial group. United States multicenter clinical trial of the cochlear nucleus hybrid implant system. Laryngoscope. 126 (1), 175-181 (2016).
- Roland, J. T., Gantz, B. J., Waltzman, S. B., Parkinson, A. J. Long-term outcomes of cochlear implantation in patients with high-frequency hearing loss. Laryngoscope. 128 (8), 1939-1945 (2018).
- Lenarz, T., Timm, M. E., Salcher, R., Büchner, A. Individual hearing preservation cochlear implantation using the concept of partial insertion. Otology & Neurotology. 40 (3), 326-335 (2019).
- Calloway, N. H., et al. Intracochlear electrocochleography during cochlear implantation. Otology & Neurotology. 35 (8), 1451-1457 (2014).
- Trecca, E. M., et al. Electrocochleography and cochlear implantation: A systematic review. Otology & Neurotology. 41 (7), 864-878 (2020).
- Mandalà, M., Colletti, L., Tonoli, G., Colletti, V. Electrocochleography during cochlear implantation for hearing preservation. Otolaryngology-Head and Neck Surgery. 146 (5), 774-781 (2012).
- Kim, J. S. Electrocochleography in cochlear implant users with residual acoustic hearing: A systematic review. International Journal of Environmental Research and Public Health. 17 (19), 7043 (2020).
- Alzahrani, M., Martin, F., Bobillier, C., Robier, A., Lescanne, E. Combined local anesthesia and monitored anesthesia care for cochlear implantation. European Annals of Otorhinolaryngology, Head and Neck Diseases. 131 (4), 261-262 (2014).
- Dietz, A., Lenarz, T. Cochlear implantation under local anesthesia in 117 cases: Patients' subjective experience and outcomes. European Archives of Oto-Rhino-Laryngology. 279 (7), 3379-3385 (2021).
- Dietz, A., Wüstefeld, M., Niskanen, M., Löppönen, H. Cochlear implant surgery in the elderly: the feasibility of a modified suprameatal approach under local anesthesia. Otology & Neurotology. 37 (5), 487-491 (2016).
- Hamerschmidt, R., Moreira, A. T. R., Wiemes, G. R. M., Tenório, S. B., Tâmbara, E. M. Cochlear implant surgery with local anesthesia and sedation: comparison with general anesthesia. Otology & Neurotology. 34 (1), 75-78 (2013).
- Strøm, C., Rasmussen, L. S. Challenges in anesthesia for elderly. Singapore Dental Journal. 35, 23-29 (2014).
- Kecskeméti, N., et al. Cochlear implantation under local anesthesia: A possible alternative for elderly patients. European Archives of Oto-Rhino-Laryngology. 276 (6), 1643-1647 (2019).
- Shabashev, S., Fouad, Y., Huncke, T. K., Roland, J. T. Cochlear implantation under conscious sedation with local anesthesia; Safety, efficacy, costs and satisfaction. Cochlear Implants International. 18 (6), 297-303 (2017).
- Linder, P., Iso-Mustajärvi, M., Dietz, A. A comparison of ECochG with the subjective sound perception during cochlear implantation under local anesthesia-A case series study. Otology & Neurotology. 43 (5), 540-547 (2022).
- Escudé, B., et al. The size of the cochlea and predictions of insertion depth angles for cochlear implant electrodes. Audiology and Neurotology. 11 (1), 27-33 (2006).
- Gantz, B., et al. Outcomes of adolescents with a short electrode cochlear implant with preserved residual hearing. Otology & Neurotology. 37 (2), 118-125 (2016).
- Suhling, M. -. C., et al. The impact of electrode array length on hearing preservation in cochlear implantation. Otology & Neurotology. 37 (8), 1006-1015 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.