Method Article
Microscopia elettronica a trasmissione: uno strumento di patologia chirurgica per il neuroblastoma
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I piccoli tumori rotondi pediatrici a cellule blu sono una collezione intrigante e stimolante di neoplasie. Pertanto, la microscopia elettronica a trasmissione (TEM) e la conoscenza professionale dei tumori pediatrici possono essere estremamente preziose in patologia chirurgica. Qui presentiamo un protocollo per eseguire la TEM per la diagnosi del neuroblastoma, uno dei tumori solidi più comuni nell'infanzia.
Abstract
I tumori pediatrici a piccole cellule blu rotonde (PSRBCT) sono una collezione intrigante e stimolante di neoplasie. La microscopia ottica di piccoli tumori rotondi a cellule blu identifica piccole cellule rotonde. Ospitano un nucleo generalmente ipercromatico e un citoplasma basofilo relativamente scarso. I piccoli tumori rotondi pediatrici a cellule blu includono diverse entità. Di solito, incorporano il tumore di Wilms, il neuroblastoma, il rabdomiosarcoma, il sarcoma di Ewing, il retinoblastoma, il linfoma e l'osteosarcoma a piccole cellule, tra gli altri. Anche utilizzando l'immunoistochimica, la diagnosi differenziale di queste neoplasie può essere controversa al microscopio ottico. Una colorazione debole o uno sfondo ambiguo possono dissuadere i patologi dal prendere la decisione diagnostica corretta. Inoltre, la biologia molecolare può fornire una quantità enorme di dati difficili da distinguere, e alcune traslocazioni possono essere osservate in più di una categoria. Pertanto, la microscopia elettronica a trasmissione (TEM) può essere estremamente preziosa. Qui sottolineiamo il protocollo moderno per i dati TEM del neuroblastoma. Le cellule tumorali con grovigli di processi citoplasmatici contenenti granuli neurosecretori possono diagnosticare il neuroblastoma.
Introduzione
Il lavoro di un patologo può essere piuttosto impegnativo sia nel campo della diagnostica clinica che in quello della ricerca. L'evoluzione della microscopia ottica nelXVIII e XIX secolo è stata notevole. La potenza di un microscopio elettronico si basa principalmente sulla lunghezza d'onda degli elettroni, che è più corta della luce 1,2,3. Prima dell'avvento degli anticorpi policlonali e monoclonali e della loro applicazione in immunoistochimica, la TEM ha svolto un ruolo influente nella diagnosi di piccoli tumori rotondi a cellule blu.
A partire dagli anni '90 del secolo scorso, l'approccio immunoistochimico ha sostituito lo strumento morfologico in diagnostica4. Attualmente, ci sono migliaia di nuovi anticorpi policlonali e monoclonali diretti agli antigeni del gruppo dei tumori a piccole cellule blu rotonde 4,6,7,8. Nell'ultimo decennio del 20° secolo e nel primo decennio dell'inizio del 21° secolo, la biologia molecolare, compresa l'ibridazione in situ a fluorescenza, dalle sonde genomiche al sequenziamento di nuova generazione, sembra aver sostituito il ruolo applicativo significativo dell'immunoistochimica in diversi laboratori4. La Food and Drug Administration (FDA) negli Stati Uniti d'America, la Canadian Food Inspection Agency (CFIA) del Canada, l'Environmental Protection Agency (EPA) o enti governativi simili in altri paesi non sempre approvano i protocolli di biologia molecolare9. Sembra che ci siano molte informazioni piuttosto difficili da inserire in un referto patologico che possono essere utilizzate per scopi terapeutici, e la scelta dell'oculato di un sistema informativo di laboratorio ben finanziato e funzionante è fondamentale10. Nel frattempo, l'immunoistochimica ha rivelato numerose insidie, con tumori epiteliali che mostrano marcatori mesenchimali e viceversa11. La transizione epitelio-mesenchimale ha confuso alcuni confini nei gruppi patologici 12,13. Negli ultimi anni, è diventato evidente che la microscopia elettronica ha prosperato in diversi laboratori in tutto il mondo14. In particolare, il tempo di consegna dei campioni di tessuto è diminuito da settimane a soli 3 giorni o anche meno utilizzando diversi protocolli che si avvicinano alla colorazione con anticorpi monoclonali o policlonali 4,10.
Inoltre, l'applicazione di una telecamera elettronica accoppiata al microscopio elettronico ha contribuito a fornire ai patologi un'immagine rapida, versatile in diversi sistemi operativi. Infine, alcuni anticorpi, anche dopo il recupero dell'antigene, sono difficili da rivelare in alcune aree di necrosi o alterazioni correlate all'autofagia/ischemia. Allo stesso tempo, la microscopia elettronica in mani sicure può ancora fornire risultati eccellenti e suggerimenti per la corretta classificazione di tumori patologici sconosciuti15.
Il gruppo pediatrico dei tumori a piccole cellule blu rotonde comprende diversi tumori, principalmente neuroblastoma, tumore di Wilms o nefroblastoma, rabdomiosarcoma e sarcoma di Ewing. I dati di biologia molecolare relativi al gruppo pediatrico di piccoli tumori rotondi a cellule blu possono essere schiaccianti a causa delle tecniche applicate. Le piccole cellule blu rotonde possono non differire molto nelle colorazioni di routine (colorazione con ematossilina ed eosina) e alcuni tumori possono avere caratteristiche immunofenotipiche aberranti. I progressi nella biologia molecolare sono stati enormi dalla scoperta della TEM. Nel gruppo dei piccoli tumori rotondi a cellule blu, alcune neoplasie possono essere riscontrate più frequentemente di altre, ma devono essere considerate. Sebbene il carcinoma papillare a cellule renali non sia essenzialmente un piccolo tumore rotondo a cellule blu, ma presenti principalmente papille, può mostrare alcune aree cellulari rotonde che potrebbero dover essere distinte da altri noti piccoli tumori rotondi a cellule blu (ad esempio, il tumore di Wilms) utilizzando diverse tecniche ausiliarie16. In definitiva, potrebbe essere necessario prendere in considerazione anche i tumori stromali metanefrici17. Il tumore rabdoide è un tumore pediatrico particolarmente maligno, distinto nel sottotipo renale ed extra-renale18.
Il neuroblastoma è una delle neoplasie solide più comuni nell'infanzia e nell'infanzia. Le cellule di neuroblastoma sono le cellule maligne di questo tumore solido che derivano insidiosamente dai derivati della cresta neurale primordiale. La sua diagnosi e la diagnosi differenziale possono essere difficili. La sua biologia naturale ha visto notevoli progressi negli ultimi due decenni. La famiglia dei fattori di trascrizione forkhead è caratterizzata da un dominio "forkhead" distinto (FOXO3/FKHRL1). Questi fattori di trascrizione funzionano come innesco per l'apoptosi (morte cellulare programmata) attraverso l'espressione di geni necessari per la morte cellulare. FOXO3/FKHRL1 è attivato dalla 5-aza-2-deossicitidina e induce la caspasi-8 silenziata, e questo complesso svolge un ruolo cruciale nel neuroblastoma. Nuclear FOXO3 predice gli esiti clinici avversi e promuove l'angiogenesi tumorale nel neuroblastoma 7,19. Nonostante i progressi della patologia molecolare, la classificazione Shimada rimane lo standard di pratica per qualsiasi patologo e oncologo pediatrico. È fondamentale per distinguere tra istologia favorevole e sfavorevole 20,21,22,23.
Il razionale alla base dello sviluppo di un protocollo semplice per la microscopia elettronica di tumori sospetti di neuroblastoma è legato alla fattibilità e alla solidità dell'esame ultrastrutturale del campione di tessuto. Raramente è alterata da problemi comunemente riscontrati con l'immunoistochimica. Il razionale e il protocollo sono stati alla base di diversi libri di testo e contributi scientifici alla patologia pediatrica e alla microscopia elettronica 4,24,25. Questo protocollo abbraccia l'esperienza di tre decenni dell'autore e si concentrerà su alcuni PSRBCT, enfatizzando l'esperienza personale e la revisione della letteratura.
Protocollo
Tutte le procedure eseguite negli studi che hanno coinvolto partecipanti umani sono state conformi agli standard etici del comitato di ricerca istituzionale e/o nazionale e alla Dichiarazione di Helsinki del 1964 e ai suoi successivi emendamenti o standard etici comparabili. Lo studio al microscopio elettronico fa parte della normale routine per l'indagine microscopica dei campioni ricevuti a scopo diagnostico e non richiede l'approvazione del Comitato di Bioetica. Questo studio è retrospettivo e rispetta il completo anonimato dei campioni.
1. Protocollo TEM per il recupero di campioni di tessuto FFPE (fissati in formalina e inclusi in paraffina) e fissati con glutaraldeide
- Recuperare gli ultimi vetrini colorati con ematossilina ed eosina e il blocco di tessuto FFPE.
- Con un pennarello indelebile, selezionare l'area di interesse sul vetrino di tessuto e abbinarla all'area sul blocco di tessuto.
- Ritaglia l'area selezionata con una nuova lama di rasoio dal blocco e tagliala accuratamente a cubetti di 5 mm su carta da filtro.
- Posizionare la carta da filtro con il fazzoletto recuperato in una capsula di Petri etichettata. Immergere la capsula di Petri in un forno a 60-70 °C per 15 minuti, cioè fino a quando la paraffina non si scioglie (la cera di paraffina è costituita da una miscela di idrocarburi solidi a catena lineare con un punto di fusione compreso tra 48 °C e 66 °C (da 120 a 150 °F)) e viene assorbita dalla carta da filtro.
- Trasferire il tessuto recuperato privo di paraffina in una fiala a scintillazione riempita con 4 mL di toluene (metilbenzene) al 100% v/v [100% toluene significa 100 mL di toluene]. Assicurarsi che i campioni ruotino continuamente durante il processo di deparaffinazione (velocità di rotazione: 24 giri/min).
- Passare attraverso due cambi di toluene, 1 ora ciascuno, e un cambio di 4 mL di toluene al 100% 30 minuti ciascuno, utilizzando un dispositivo rotante angolato.
- Procedere con un cambio in 4 mL di etanolo assoluto al 100% (C2H5OH) per 1 ora, quindi due cambi di 4 mL di etanolo assoluto al 100% per 30 minuti ciascuno. Quindi, un altro cambio di 30 minuti in 4 mL di etanolo al 70%.
- Procedere con un cambio di 4 mL di tampone cacodilato di sodio 0,1 M, 30 min. Trasferire i campioni in 4 mL di glutaraldeide al 2,5% e mantenerli a 4 °C fino alla lavorazione.
- Utilizzare i seguenti passaggi in un processatore di tessuti automatizzato per standardizzare il processo: tampone di cacodilato di sodio 0,1 M per 5 minuti, tetrossido di osmio al 2% per 1 ora e 50 minuti, dH2O per 5 minuti, etanolo al 50% per 15 minuti, etanolo al 70% per 30 minuti, etanolo al 100% per 15 minuti (tre volte), etanolo al 100% per 30 minuti (tre volte), Etanolo al 100% per 45 minuti, acetone per 50 minuti, resina per 1 ora (due volte) e resina fresca per una notte. Il volume di tutte le soluzioni è di 15 ml.
- Incorporare con resina fresca appena uscita dal processatore di tessuti.
- Posizionare le capsule di polietilene in un supporto con strisce di carta numerate. Versare la resina fresca nelle capsule, trasferire il campione nei blocchi appropriati e conservare i blocchi per una notte in un forno a 60 °C (140 °F).
- Colorare le sezioni semisottili (500 nm) con l'1% di blu di toluidina sulla piastra calda, temperatura minima per 30 s, risciacquare in dH2O e quindi applicare un vetrino coprioggetti.
- In questo caso, il microtomo Ultracut (UCM) viene utilizzato per il sezionamento di sezioni semisottili.
- Prendi il blocco incorporato in resina e installalo nel supporto del blocco dell'UCM. Quindi, installare il supporto del blocco sul palco dell'UCM e serrarlo.
- Tagliare la resina in eccesso attorno al campione utilizzando una lama di rasoio rivestita con un solo bordo utilizzando gli oculari. Taglia la faccia del blocco in una forma trapezoidale.
- Rimuovere il supporto del blocco dal tavolino e installarlo saldamente nel braccio UCM. Quindi, installare il portalama sul tavolino UCM. Infine, stringere un coltello di vetro sul portalama.
- Utilizzando gli oculari e la luce fornita dall'UCM, far scorrere lentamente il bordo del coltello da vetro, il più vicino possibile, alla superficie del blocco di resina da tagliare. Serrare il portalama in posizione sul tavolino.
- Impostare lo spessore di taglio dell'UCM a 500 nm e rifilare il blocco di resina fino al 75% su tutta la faccia.
- Cambia il coltello di vetro con uno nuovo. Aggiungere acqua sterile nel serbatoio del coltello di vetro.
- Etichettare un vetrino da microscopio con il numero del caso e mettere quattro gocce separate di acqua sterile sul vetrino.
- Sempre con un'impostazione di 500 nm, tagliare quattro sezioni dal blocco. Utilizzando una pinza fine, trasferire 1 sezione alla volta in una delle gocce d'acqua sul vetrino. Ogni goccia sulla diapositiva conterrà una sezione. Asciugare il vetrino su una piastra riscaldante al livello di calore più basso fino a quando non si asciuga (30 s).
- Colorare con il metodo Blu di Toluidina. Sciacquare in acqua e posizionare un vetrino coprioggetti. Esaminare le sezioni di blu di toluidina al microscopio ottico. Se le strutture tissutali desiderate sono visibili, tagliare sezioni ultrasottili. Se le strutture tissutali desiderate non sono visibili, tagliare le sezioni più profonde e colorarle seguendo gli stessi passaggi fino a quando le strutture desiderate non sono esposte e mostrate sul vetrino blu di toluidina.
- Quando l'area desiderata per la microscopia elettronica viene identificata dalle sezioni blu di toluidina, tagliare le sezioni ultrasottili sulle griglie di rame. Tagliare fette ultrasottili utilizzando un ultramicrotomo (i campioni destinati alla visualizzazione nel TEM devono essere tagliati in fette molto sottili (80 nm)).
- Prendi il blocco incorporato in resina e installalo nel supporto del blocco dell'UCM. Quindi, installare il supporto del blocco sul palco dell'UCM e serrarlo.
- Usando gli oculari, tagliare la resina attorno all'area desiderata per la microscopia elettronica utilizzando una lama di rasoio rivestita a filo singolo. Tagliare la faccia del blocco a forma di trapezio, non più grande di 1 mm quadrato. Se l'area desiderata per la microscopia elettronica è difficile da vedere a causa del bagliore della luce, utilizzare una piccola quantità di cloroformio per evidenziare le strutture nel blocco di resina.
- Rimuovere il supporto del blocco dal tavolino e installarlo saldamente nel braccio UCM. Quindi, installare il portalama sul tavolino UCM. Infine, serrare un coltello diamantato sul portalama.
- Utilizzando gli oculari e la luce fornita dall'UCM, far scorrere lentamente il bordo del coltello diamantato, il più vicino possibile, alla superficie del blocco di resina da tagliare. Serrare il portalama in posizione sul tavolino.
- Regolare i diversi angoli del coltello diamantato utilizzando le viti dell'UCM. Assicurarsi che il bordo del coltello diamantato sia allineato il più perfettamente possibile con la superficie del blocco da tagliare. Riempi il serbatoio del coltello diamantato con acqua sterile.
- Impostare l'UCM su uno spessore di 80 nm e una velocità di 1 mm/s. In questo caso, la funzione automatizzata viene utilizzata per il sezionamento ultrasottile. Impostare la finestra di taglio sull'UCM (parte superiore e inferiore della faccia del blocco).
- Premere il pulsante Start dell'UCM per avviare il sezionamento. Le sezioni galleggeranno sul serbatoio sterile del coltello diamantato.
- Quando un numero sufficiente di sezioni è stato tagliato, utilizzare i fumi di cloroformio per raddrizzare le sezioni. Immergi un batuffolo di cotone nel cloroformio e passalo sopra le sezioni senza toccarle.
- Immergere una griglia di rame in alcol al 100% e poi in acqua sterile usando una pinza fine. Pulisci ogni griglia prima di utilizzarla. Scegliete le sezioni su alcune griglie.
- Lasciare le griglie con sezioni su carta da filtro etichettata. Mettere questa carta da filtro in una capsula di Petri e metterla in forno a 60 °C per 30 minuti per consentire alle sezioni di asciugarsi sulle griglie.
- Quindi, eseguire la colorazione con contrasto.
- Colorare le griglie con acetato di uranile o qualsiasi sostituto alternativo ecologico per 1 minuto. Quindi, sciacquarli in acqua sterile per preparazioni iniettabili (40 immersioni in quattro diversi contenitori d'acqua per ogni risciacquo dopo l'acetato di uranile e il citrato di piombo). Anche il passaggio di citrato di piombo è di 1 min.
- Inserire la griglia nel TEM, consentendo l'emissione di un fascio di elettroni ad alta tensione da parte di un catodo e la creazione di lenti magnetiche. Il fascio che è stato parzialmente trasmesso attraverso il campione sottile (elettrone-semitrasparente) forma l'informazione TEM sullo schermo (vedi sotto).
2. Protocollo TEM per la scansione e la fotografia dei campioni
- Dopo che le sezioni sulle griglie sono state colorate, esaminarle con il microscopio elettronico. Al microscopio elettronico, accendere la tensione ACC su un'impostazione prestabilita (200-300 kV), che dipende dal microscopio elettronico utilizzato.
- Al computer, accendere il software della fotocamera digitale e inserire il numero della confezione. Questo è importante perché le microfotografie vengono salvate nel file del caso corrispondente.
- Caricare la griglia nel microscopio elettronico, estrarre il campione della pistola a metà e spostare l'interruttore su AIR per consentire al vuoto della camera della pistola del campione di riempirsi di aria ambiente (ambiente).
- Una volta che è pieno d'aria, estrarre il campione della pistola. Posizionare il campione di pistola sul supporto progettato. Quindi, aprire il supporto della griglia sulla punta della pistola.
- Posiziona la griglia in posizione. Chiudere il supporto della griglia e assicurarsi che la griglia sia fissata.
- Rimettere il campione della pistola nella camera del campione a metà e spostare l'interruttore su EVAC per creare un vuoto nella camera del campione.
- L'indicatore luminoso verde si accende quando viene raggiunto il vuoto nella camera del campione. Quindi, spingere con cautela il campione della pistola nella colonna del microscopio elettronico e assicurarsi di non farlo andare troppo veloce. In caso contrario, danneggerebbe l'oggetto sulla punta del campione di pistola.
- Una volta che la griglia è ben posizionata nella colonna del microscopio elettronico, accendere il filamento sull'impostazione di saturazione intermedia (prestabilita).
- Accendere la fotocamera tramite l'interruttore ON/OFF . Sul computer, fare clic su Live Image nel software di imaging.
- Sul microscopio elettronico, premere il pulsante Basso ingrandimento e aprire l'apertura dell'obiettivo. Ciò consente di scegliere l'area di vagliatura desiderata. Quindi, posizionare l'area desiderata della sezione al centro dello schermo del computer, utilizzando i due controller su entrambi i lati della colonna del microscopio elettronico.
- Sul microscopio elettronico, premere il pulsante Zoom e chiudere l'apertura dell'obiettivo per ottenere un contrasto migliore.
- Inizia la proiezione della sezione scattando microfotografie con un ingrandimento di 2.500x. Quindi, regolare la messa a fuoco utilizzando il pulsante oscillante e il pulsante della luminosità sul microscopio elettronico per garantire la qualità della microfotografia.
- Clicca su Immagine finale sul computer per scattare la microfotografia. Se i colori non sono uniformi, eseguire una correzione dello sfondo sul software della fotocamera. Inoltre, regola il contrasto sull'immagine finale utilizzando il software prima di salvare la microfotografia.
- Quando la microfotografia viene salvata, ricontrollare il numero della confezione e l'ingrandimento per garantire la corretta identificazione delle microfotografie scattate.
NOTA: In alcuni casi, l'utente può anche inserire didascalie aggiuntive e vengono inserite anche le iniziali del tecnico di microscopia elettronica. - Eseguire il processo di micrografia attraverso l'intera area della sezione da schermare. Dopo un ingrandimento sufficiente di 2.500x, le microfotografie vengono salvate per coprire l'area di interesse, acquisire microfotografie con ingrandimento 4.000x e 8.000x e salvarle sul computer con l'identificazione del numero di caso appropriato.
- Fai un primo piano sulla sezione per dettagli ultrastrutturali specifici se vengono fornite istruzioni di screening molto specifiche. Quindi, salva le misurazioni di specifici dettagli ultrastrutturali nel computer considerando ingrandimenti più elevati, se necessario.
- Al termine dello screening del campione, spegnere il filamento, la fotocamera, l'alta tensione e il software della fotocamera in sequenza. Quindi, rimuovere la griglia dalla colonna del microscopio elettronico, lasciando entrare l'aria nella camera del campione della pistola.
- Lima la griglia in una capsula di gelatina e conserva la capsula in una scatola adeguatamente etichettata, insieme ai blocchi di resina della stessa custodia. Rimettere il campione della pistola nella camera della pistola e conservarlo in un ambiente fresco e asciutto per preservare il materiale utilizzato.
- Trasferisci le microfotografie digitali su piattaforme collaborative comuni (ad esempio, SharePoint) o server interni per consentire al patologo di visualizzarle.
- Inserire le unità di lavoro nel Sistema Informativo di Laboratorio (LIS).
- Se sono necessarie microfotografie più specifiche, estrarre la griglia del campo e riutilizzarla per ulteriori screening o domande specifiche.
Risultati
Le caratteristiche distintive TEM del neuroblastoma sono mostrate qui. Qui illustreremo le caratteristiche distintive della TEM del neuroblastoma.
Il neuroblastoma è una delle neoplasie solide più comuni nell'infanzia e nell'infanzia. Le cellule di neuroblastoma sono le cellule maligne di questo tumore solido che derivano insidiosamente dai derivati della cresta neurale primordiale. Questa istogenesi spiega alcune caratteristiche biochimiche e morfologiche di questo tumore blu. Tuttavia, le caratteristiche citopatologiche e istopatologiche deterministiche dei neuroblastomi possono fluttuare in modo specifico in base al grado variabile di differenziazione. Pertanto, la sua diagnosi e la diagnosi differenziale possono essere difficili. La distinzione del neuroblastoma da elementi simili alle cellule gangliari è dimostrata da una quantità crescente di citoplasma cellulare con lo sviluppo di un processo citoplasmatico e un'alterazione dell'immagine nucleare (Figura 1A-D). L'ingrossamento nucleare e un nucleolo visibile sono caratteristici della differenziazione del neuroblastoma. Si può anche notare una differenziazione in elementi simili a cellule di Schwann. L'indagine al microscopio elettronico rivela granuli neurosecretori (diametro medio 100 nm) costantemente presenti con o senza proiezioni citoplasmatiche simili ai neuriti contenenti microtubuli e sottili filamenti intermedi26. La scarsità di glicogeno caratterizza il neuroblastoma e, se si vede raramente, non costruisce mai aggregati. Il grado di differenziazione distingue l'ultrastruttura del neuroblastoma. I granuli neurosecretori o catecolamine sono caratteristici di questa neoplasia, con un diametro di circa 150 nm. I granuli neurosecretori devono essere differenziati dalle strutture simili ai desmosomi. I granuli neurosecretori possono essere visti vicino ai filamenti intracitoplasmatici (neurofilamenti). I processi cellulari sono spesso paffuti e cilindrici e sono comunemente indicati come neuriti (assoni e dendriti). Alcuni processi cellulari contengono mitocondri, che sono fondamentali per il movimento della cellula neoplastica. I neuriti contengono microtubuli, ma possono anche avere mitocondri gonfi. In caso di neuroblastoma scarsamente differenziato, alcune caratteristiche sono più spesso da riscontrare. Esse comprendono una più significativa irregolarità della morfologia nucleare, numerose mitosi e figure apoptotiche, scarsità di microtubuli e processi cellulari, in contrasto con la presenza quasi costante di neurofilamenti, scarsità di neuriti, che contengono più spesso mitocondri che microtubuli, giunzioni sinaptiche assenti o molto poche, assenza di glicogeno, aree di numerosi poliribosomi e scarsità di granuli neurosecretori. I granuli neurosecretori sono fondamentali per differenziare il neuroblastoma da altri PSRBCT, tra cui il rabdomiosarcoma embrionale, il granuloma eosinofilo, l'osteosarcoma a piccole cellule e il sarcoma a cellule del reticolo, che possono causare problemi diagnostici a causa della presenza di granularità citoplasmatica.
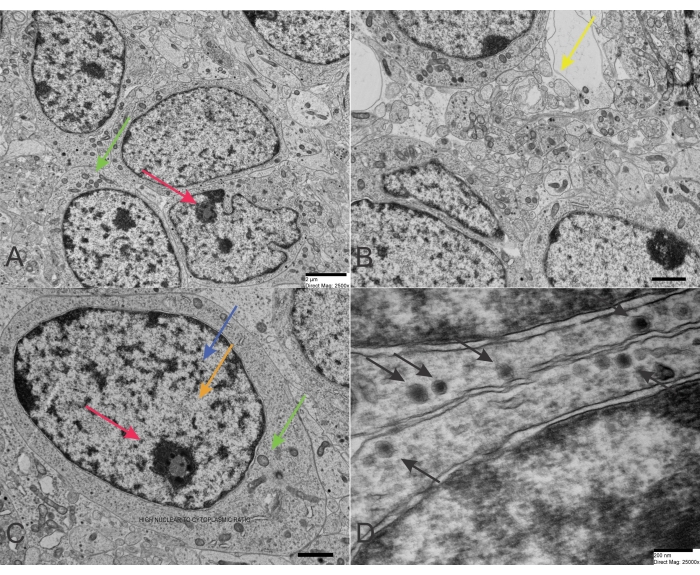
Figura 1: TEM del Neuroblastoma. (A-C) Cellule di neuroblastoma di tipo scarsamente differenziato con un elevato rapporto nucleo/citoplasma e pochi organelli. La cromatina è sparsa nel nucleo ma anche concentrata alla periferia vicino alla membrana nucleare. Un nucleolo è visibile in un nucleo nell'angolo in alto a destra (barra della scala: 2 μm). (D) Cellule di neuroblastoma con granuli neurosecretori che presentano una caratteristica doppia membrana (barra della scala: 200 nm). Le frecce rosse puntano ai nucleoli, le frecce blu rivelano l'eterocromatina, le frecce arancioni rilevano l'eucromatina, le frecce verdi si concentrano sui mitocondri e le frecce gialle puntano su vescicole che assomigliano ai normali terminali presinaptici. Tuttavia, le vescicole nel neuroblastoma sono più grandi e più irregolari rispetto ai classici terminali presinaptici. Infine, le frecce nere rivelano numerosi granuli neurosecretori a nucleo denso. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
In questa revisione narrativa con protocollo associato, abbiamo evidenziato le caratteristiche ultrastrutturali distintive del neuroblastoma. Infine, suggeriamo che la microscopia elettronica è tutt'altro che una tecnica "morta" o antica, postulando la scoperta di un nuovo ruolo se combinata con le tecnologie omiche a singola cellula. Questo contributo vuole sottolineare il ruolo mai antico della microscopia elettronica nella patologia pediatrica 4,27. I passaggi critici, le modifiche e la risoluzione dei problemi della tecnica e le limitazioni sono descritti in dettaglio di seguito.
Ci sono alcuni passaggi critici per questo protocollo. Innanzitutto, è essenziale tagliare l'area desiderata per la microscopia elettronica. Il bordo del diamante deve essere regolato in modo da essere rivolto verso la faccia del blocco il più vicino possibile. Ciò richiede una mano molto ferma. Prestare attenzione durante la raccolta della sezione galleggiante con le griglie di rame.
Le modifiche e la risoluzione dei problemi della tecnica includono alcuni aspetti che devono essere presi in considerazione. Ogni campione è diverso con qualità, come la densità e la natura, che sono variabili. Data la natura e la densità del materiale, non tutti i campioni di tessuto vengono tagliati allo stesso modo. Ad esempio, alcuni campioni di neuroblastoma possono essere indifferenziati o scarsamente differenziati, mentre altri possono rivelare un alto grado di differenziazione e un grado variabile di calcificazioni. Occasionalmente, è necessario tagliare più sezioni per ottenere alcune buone da lavorare ulteriormente. È fondamentale evitare qualsiasi tipo di vibrazione: respirazione, tavolo, compressori dagli ambiti EM. Se si riscontrano frantumazioni sulle sezioni, potrebbe essere fondamentale serrare le viti UCM. Se si notano graffi sulle sezioni, sostituire il coltello diamantato da utilizzare per il taglio. A volte, gli artefatti di taglio sono visibili solo nella fase finale. Se gli artefatti di taglio vengono rilevati al microscopio elettronico, le sezioni ultrasottili devono essere ritagliate dopo aver identificato la causa dell'artefatto.
La TEM ha evidenti limiti e la finestra di osservazione è ancora più piccola rispetto alla vista catturata con la microscopia ottica convenzionale. L'area desiderata per la microscopia elettronica non può essere più grande di un quadrato di 1 mm. A volte, un'area più grande gioverebbe alla schermatura, ma è impossibile tagliare. Non si adatterà alla griglia di rame, danneggerà il coltello diamantato e la qualità della sezione sarà sicuramente inferiore. Bisogna fare alcune scelte e scegliere la struttura o l'area più importante al momento della proiezione. La velocità di taglio non può essere aumentata; Causerà artefatti di taglio sulle sezioni. L'1 mm/sec rimane critico.
Oltre alle caratteristiche classiche sopra elencate (ad esempio, granuli neurosecretori), l'ultrastruttura dei mitocondri nelle cellule di neuroblastoma esaminate mediante TEM mostra spesso notevoli livelli di mitofagia, un meccanismo cellulare selettivo di controllo della qualità mitocondriale che consente la degradazione dei mitocondri, che sono considerati dalle cellule danneggiati e/o superflui28,29. Di conseguenza, i mitocondri ospitano gonfiore, rottura delle cristae e scomparsa delle cristae. Infatti, Radogna et al. hanno trovato una mitofagia efficiente come il meccanismo critico che porta al fallimento dell'attivazione della via di morte cellulare programmatica che aumenta la resistenza di SK-N-AS, una linea cellulare di neuroblastoma con una sintesi potenziata del fattore di crescita insulino-simile II (IFG-II) e dell'IGF-II RNA e che ospita recettori IGF di tipo I per UNBS1450, un cardenolide emisintetico appartenente alla famiglia dei glicosidi steroidei cardiaci, innescando la necroptosi a dosi leggermente più elevate30.
Particolarmente rilevante per la diagnosi differenziale è il ruolo della TEM nel sarcoma di Ewing. Il sarcoma di Ewing è considerato equivalente al tumore delle cellule neuroectodermiche periferiche, anche se in passato si è discusso 31,32,33. In pratica, nelle cellule primitive del sarcoma di Ewing, le caratteristiche principali sono l'abbondante glicogeno citoplasmatico, le giunzioni cellulari poco sviluppate e l'assenza di caratteristiche neurali. C'è una sorprendente somiglianza nel tumore neuroectodermico periferico con il sarcoma di Ewing al microscopio elettronico. Infatti, entrambi i tumori sono considerati la stessa entità e vengono trattati con gli stessi protocolli terapeutici sia nella SIOP (International Society of Pediatric Oncology) che nella COG (Children's Oncology Group) così come nell'UKCCSG (United Kingdom Children Cancer Study Group) perché condividono la stessa traslocazione cromosomica. Tuttavia, in PNET, esistono alcune caratteristiche neurali, inclusi i granuli neurosecretori che sono praticamente assenti nel sarcoma di Ewing. Questa specifica riflette anche il fenotipo immunoistochimico. C'è positività per almeno uno o due marcatori neurali, ad esempio enolasi neurone-specifica, S-100, sinaptofisina o neurofilamenti. Franchi et al. hanno studiato l'ES-PNET31. Nella maggior parte dei casi, le cellule neoplastiche presentavano la tipica ultrastruttura, comprese cellule saldamente impacchettate, scarsamente differenziate, di forma ovale o poligonale. Queste cellule contengono un nucleo rotondo o ovale con cromatina finemente dispersa e uno o due nucleoli. Nel citoplasma, minuscoli organelli che rispecchiano la scarsa differenziazione di queste cellule neoplastiche. Tuttavia, l'attenzione ai dettagli può rivelare la presenza di mitocondri, alcune strutture ruvide del reticolo endoplasmatico (le cosiddette cisterne), lisosomi sporadici e ribosomi liberi. L'accumulo di glicogeno può essere facilmente rilevato. Il glicogeno può essere visto come disperso o accumulato. I filamenti intermedi sono spesso osservati sia nel citoplasma che nei processi citoplasmatici delle cellule tumorali. I microtubuli non sono visibili. Le giunzioni rudimentali possono essere rilevate in circa la metà dei casi per quanto riguarda le connessioni cellulari. Queste strutture sono costituite da desmossomi ben sviluppati con tonofilamenti se le giunzioni sono identificate. Si può riconoscere un certo accumulo di materiale simile alla membrana basale e di fibrille di collagene nella matrice extracellulare. Si possono osservare granuli densi con un diametro simile a quelli osservati nel neuroblastoma. Come le indagini immunoistochimiche dei precedenti autori31, le neoplasie ben differenziate tendono a manifestarsi al di fuori dello scheletro, mentre i tumori scarsamente differenziati insorgono più spesso nell'osso che nei tessuti molli.
In conclusione, la TEM è una tecnologia eccezionale che può avere un enorme potenziale in futuro ed è tutt'altro che morta in medicina. L'introduzione di tecniche di biologia molecolare con i più recenti progressi con il sequenziamento di nuova generazione evidenzia l'incoerenza di un continuum nella diagnostica ma di un'ondata di progresso simile a quella di un canguro. L'introduzione di nuovi metodi non dovrebbe dissuadere i patologi dall'utilizzare la microscopia elettronica in modo coerente, perché sia l'immunoistochimica che le tecniche molecolari possono essere fallaci. Alcuni pattern immunoistochimici e anomalie genetiche non sono specifici del tumore e possono essere scarsamente correlati con l'istologia. Per quanto ne sappiamo, la TEM rimane un metodo robusto, valido e riproducibile in patologia e medicina. La TEM è uno strumento ausiliario per lo studio dei piccoli tumori rotondi a cellule blu ed è una solida prova del risultato immunoistochimico. L'applicazione coerente della GST in una struttura moderna può fornire un elevato punteggio di accordo interindividuale, un'elevata validità e un'affidabilità efficiente. Nel prossimo futuro, i biologi molecolari potrebbero cercare laboratori di microscopia elettronica competenti e validi che possano rispondere a domande specifiche a livello ultrastrutturale. In particolare, vediamo una nuova prospettiva e applicazione della TEM nelle biologie molecolari, come l'accoppiamento della TEM con esperimenti volti a comprendere alcune attuali ricerche su singole cellule.
Divulgazioni
Il primo autore riceve royalties dai seguenti editori: Springer (https://link-springer-com.remotexs.ntu.edu.sg/book/10.1007/978-3-662-59169-7; ISBN: 978-3-662-59169-7) e Nova (https://novapublishers.com/shop/science-culture-and-politics-despair-and-hopes-in-the-time-of-a-pandemic/; ISBN: 978-1-53619-816-4). Tutte le royalties vanno a enti di beneficenza pediatrici.
Riconoscimenti
Abbiamo riconosciuto l'esperienza e il generoso sostegno del Dr. Richard Vriend, ex dipendente dell'Alberta Health Services presso l'University of Alberta Hospital, e di Steven Joy (1972-2019), anche lui ex dipendente dell'Alberta Health Services presso l'University of Alberta Hospital. Dedichiamo questo lavoro alla memoria di Mr. Joy, un tecnologo senior esperto in indagini ultrastrutturali che è tragicamente e prematuramente scomparso alcuni anni fa. Il signor Joy è stato un pilastro per la maggior parte degli studi di microscopia elettronica in Alberta, in Canada. I nostri pensieri e le nostre preghiere per lui e la sua famiglia. Siamo anche in debito con la signora Lesley Burnet per il suo aiuto e i suoi consigli. La ricerca del Dr. C. Sergi è stata finanziata dalla generosità del Children's Hospital of Eastern Ontario, Ottawa, Ontario, e della Stollery Children's Hospital Foundation e dai sostenitori del Lois Hole Hospital for Women attraverso il Women and Children's Health Research Institute (WCHRI, Grant ID #: 2096), Natural Science Foundation of Hubei Province for Hubei University of Technology (100-Talent Grant for Recruitment Program of Foreign Experts Finanziamento totale: Diagnosi digitale basata su PCR e NGS per infezioni e oncologia, 2017-2022), Österreichische Krebshilfe Tyrol (Krebsgesellschaft Tirol, Istituto austriaco per la ricerca sul cancro del Tirolo, 2007 e 2009 - "DMBTI e carcinomi colangiocellulari" e "Hsp70 e HSPBP1 nei carcinomi del pancreas"), Fondo austriaco per la ricerca (Fonds zur Förderung der wissenschaftlichen Forschung, FWF, Grant ID L313-B13), Fondazione canadese per la salute delle donne ("Early Fetal Heart-RES0000928"), Cancer Research Society (espressione genica del fattore von Willebrand nelle cellule tumorali), Canadian Institutes of Health Research (Acidi grassi Omega-3 per il trattamento della malattia epatica associata all'insufficienza intestinale: uno studio di ricerca traslazionale, 2011-2014, CIHR 232514) e l'Ufficio culturale saudita, Ottawa, Canada. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta e nell'analisi dei dati, nella decisione di pubblicare o nella preparazione del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| Acetone, ACS Reagent | Electron Microscopy Sciences | 10014 | Reagent as established by the American Chemical Society (ACS Reagent). |
| Automated tissue processor | Electron Microscopy Sciences | L12600 | LYNX II Automated Tissue Processor for Histology and Microscopy. |
| Digital camera software | Gatan | L12600 | Digital Micrograph |
| Spurr's resin | Electron Microscopy Sciences | 14300 | Embedding resin. It provides excellent penetration for embedding tissues and rapid infiltration. The blocks have excellent trimming and sectioning qualities, while thin sections reveal tough qualities under the electron beam. |
| Ethyl Alcohol | Electron Microscopy Sciences | 15058 | 100% Ethyl alcohol with molecular sieve, 50% and 70%. |
| Glutaraldehyde, 25% EM Grade Aqueous in Serum Vial | Electron Microscopy Sciences | 16214 | 2.5% gluteraldehyde in 0.1 M cacodylate buffer, pH 7.2-7.4 made from 25% gluteraldehyde, primary fixative for TEM tissue specimens. |
| Osmium tetroxide | Electron Microscopy Sciences | 19110 | Second fixative during TEM tissue processing used as OsO4 in distilled water |
| Polyethylene capsules | Electron Microscopy Sciences | 70021 | Flat Bottom Embedding Capsules, Size 00 |
| Scintillator | Electron Microscopy Sciences | 82010 | Phillip Quad Detector |
| Single Edge Razor Blade | Electron Microscopy Sciences | 71952-10 | Blade for Clean Rm., 10/Disp. . |
| Sodium Cacodylate Buffer | Electron Microscopy Sciences | 11655 | Sodium Cacodylate Buffer, 0.4M, pH 7.2, prepared from Sodium Cacodylate Trihydrate |
| Tannic Acid, Reagent, A.C.S., EM Grade | Electron Microscopy Sciences | 21700 | Reagent as established by the American Chemical Society (ACS Reagent). |
| Transmission Electron Microscope (1) | Hitachi | Hitachi 7100 | We use it at the HV 75 setting |
| Transmission Electron Microscope (2) | JEOL | JEM-1010 | We use it at the HV 38 setting |
| Toluene | Electron Microscopy Sciences | 22030 | Reagent as established by the American Chemical Society (ACS Reagent) |
| Ultracut microtome | Leica | 11865766 | Ultramicrotome |
| Uranyl acetate | Electron Microscopy Sciences | 22400 | Uranyless, substitute for uranyl acetate |
Riferimenti
- Nitta, R., Imasaki, T., Nitta, E. Recent progress in structural biology: lessons from our research history. Microscopy (Oxford). 67 (4), 187-195 (2018).
- Moser, T. H., et al. The role of electron irradiation history in liquid cell transmission electron microscopy. Science Advances. 4 (4), (2018).
- Gordon, R. E. Electron microscopy: A brief history and review of current clinical application. Methods in Molecular Biology. 1180, 119-135 (2014).
- Sergi, C. M. Pathology of Childhood and Adolescence. An Illustrated Guide. 1st edn. , Springer. Berlin, Heidelberg. (2020).
- Sergi, C., Dhiman, A., Gray, J. A. Fine needle aspiration cytology for neck masses in childhood. An illustrative approach. Diagnostics (Basel). 8 (2), 28(2018).
- Sergi, C., Kulkarni, K., Stobart, K., Lees, G., Noga, M. Clear cell variant of embryonal rhabdomyosarcoma: report of an unusual retroperitoneal tumor--case report and literature review). European Journal of Pediatric Surgery. 22 (4), 324-328 (2012).
- Hagenbuchner, J., et al. Nuclear FOXO3 predicts adverse clinical outcome and promotes tumor angiogenesis in neuroblastoma. Oncotarget. 7 (47), 77591-77606 (2016).
- Xu, X., Sergi, C. Pediatric adrenal cortical carcinomas: Histopathological criteria and clinical trials. A systematic review. Contemporary Clinical Trials. 50, 37-44 (2016).
- Khan, A., Feulefack, J., Sergi, C. M. Pre-conceptional and prenatal exposure to pesticides and pediatric neuroblastoma. A meta-analysis of nine studies. Environmental Toxicology and Pharmacology. 90, 103790(2022).
- Sergi, C. M. Implementing epic beaker laboratory information system for diagnostics in anatomic pathology. Risk Management and Healthcare Policy. 15, 323-330 (2022).
- D'Cruze, L., et al. The role of immunohistochemistry in the analysis of the spectrum of small round cell tumours at a tertiary care centre. Journal of Clinical Diagnostic Research. 7 (7), 1377-1382 (2013).
- Garcia, E., et al. Epithelial-mesenchymal transition, regulated by beta-catenin and Twist, leads to esophageal wall remodeling in pediatric eosinophilic esophagitis. PLoS One. 17 (3), 0264622(2022).
- Al-Bahrani, R., Nagamori, S., Leng, R., Petryk, A., Sergi, C. Differential expression of sonic hedgehog protein in human hepatocellular carcinoma and intrahepatic cholangiocarcinoma. Pathol and Oncology Research. 21 (4), 901-908 (2015).
- Taweevisit, M., Thorner, P. S. Electron microscopy can still have a role in the diagnosis of selected inborn errors of metabolism. Pediatric and Developmental Pathology. 22 (1), 22-29 (2019).
- Ghadially, F. N. Diagnostic Electron Microscopy of Tumours. , Butterworths. (1980).
- Geiger, K., et al. FOXO3/FKHRL1 is activated by 5-aza-2-deoxycytidine and induces silenced caspase-8 in neuroblastoma. Molecular Biology of the Cell. 23 (11), 2226-2234 (2012).
- Shimada, H. Transmission and scanning electron microscopic studies on the tumors of neuroblastoma group. Acta Pathologica Japonica. 32 (3), 415-426 (1982).
- Samardzija, G., et al. Aggressive human neuroblastomas show a massive increase in the numbers of autophagic vacuoles and damaged mitochondria. Ultrastructural Pathology. 40 (5), 240-248 (2016).
- Suganuma, R., et al. Peripheral neuroblastic tumors with genotype-phenotype discordance: a report from the Children's Oncology Group and the International Neuroblastoma Pathology Committee. Pediatric Blood and Cancer. 60 (3), 363-370 (2013).
- Joshi, V. V. Peripheral neuroblastic tumors: pathologic classification based on recommendations of international neuroblastoma pathology committee (Modification of shimada classification). Pediatric and Developmental Pathology. 3 (2), 184-199 (2000).
- Schultz, T. D., Sergi, C., Grundy, P., Metcalfe, P. D. Papillary renal cell carcinoma: report of a rare entity in childhood with review of the clinical management. Journal of Pediatric Surgery. 46 (6), 31-34 (2011).
- Brisigotti, M., Cozzutto, C., Fabbretti, G., Sergi, C., Callea, F. Metanephric adenoma. Histology and Histopathology. 7 (4), 689-692 (1992).
- McKillop, S. J., et al. Adenovirus necrotizing hepatitis complicating atypical teratoid rhabdoid tumor. Pediatric International. 57 (5), 974-977 (2015).
- Kim, N. R., Ha, S. Y., Cho, H. Y. Utility of transmission electron microscopy in small round cell tumors. Journal of Pathology and Translational Medicine. 49 (2), 93-101 (2015).
- Iida, M., Tsujimoto, S., Nakayama, H., Yagishita, S. Ultrastructural study of neuronal and related tumors in the ventricles. Brain Tumor Pathology. 25 (1), 19-23 (2008).
- Erlandson, R. A., Nesland, J. M. Tumors of the endocrine/neuroendocrine system: an overview. Ultrastructural Pathology. 18 (1-2), 149-170 (1994).
- Sergi, C. Microscopy Science: Last Approaches on Educational Programs and Applied Research.Microscopy. Torres-Hergueta, E., Méndez-Vilas, A. , Formatex Research Center S.L. 101-112 (2018).
- Song, D., et al. FOXO3 promoted mitophagy via nuclear retention induced by manganese chloride in SH-SY5Y cells. Metallomics. 9 (9), 1251-1259 (2017).
- Chiu, B., Jantuan, E., Shen, F., Chiu, B., Sergi, C. Autophagy-inflammasome interplay in heart failure: A systematic review on basics, pathways, and therapeutic perspectives. Annals of Clinical and Laboratory Science. 47 (3), 243-252 (2017).
- Radogna, F., et al. Cell type-dependent ROS and mitophagy response leads to apoptosis or necroptosis in neuroblastoma. Oncogene. 35 (29), 3839-3853 (2016).
- Franchi, A., et al. Immunohistochemical and ultrastructural investigation of neural differentiation in Ewing sarcoma/PNET of bone and soft tissues. Ultrastructural Pathology. 25 (3), 219-225 (2001).
- Llombart-Bosch, A., et al. Soft tissue Ewing sarcoma--peripheral primitive neuroectodermal tumor with atypical clear cell pattern shows a new type of EWS-FEV fusion transcript. Diagnostic Molecular Pathology. 9 (3), 137-144 (2000).
- Parham, D. M., et al. Neuroectodermal differentiation in Ewing's sarcoma family of tumors does not predict tumor behavior. Human Pathology. 30 (8), 911-918 (1999).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon