Method Article
Microscopía electrónica de transmisión: una herramienta de patología quirúrgica para el neuroblastoma
* Estos autores han contribuido por igual
En este artículo
Resumen
Los tumores pediátricos pequeños y redondos de células azules son una colección de neoplasias intrigante y desafiante. Por lo tanto, la microscopía electrónica de transmisión (TEM) y el conocimiento profesional de los tumores pediátricos pueden ser extremadamente valiosos en la patología quirúrgica. En este trabajo presentamos un protocolo para la realización de TEM en el diagnóstico de neuroblastoma, uno de los tumores sólidos más frecuentes en la infancia.
Resumen
Los tumores pediátricos de células azules pequeñas y redondas (PSRBCT, por sus siglas en inglés) son una colección de neoplasias intrigante y desafiante. La microscopía óptica de tumores pequeños y redondos de células azules identifica las células pequeñas y redondas. Albergan un núcleo generalmente hipercromático y un citoplasma basófilo relativamente escaso. Los tumores pediátricos de células azules redondas pequeñas incluyen varias entidades. Por lo general, incorporan tumor de Wilms, neuroblastoma, rabdomiosarcoma, sarcoma de Ewing, retinoblastoma, linfoma y osteosarcoma de células pequeñas, entre otros. Incluso mediante el uso de la inmunohistoquímica, el diagnóstico diferencial de estas neoplasias puede ser controvertido en la microscopía óptica. Una tinción tenue o un fondo ambiguo pueden disuadir a los patólogos de tomar la decisión diagnóstica adecuada. Además, la biología molecular puede proporcionar una cantidad abrumadora de datos difíciles de distinguir, y algunas translocaciones pueden observarse en más de una categoría. Por lo tanto, la microscopía electrónica de transmisión (TEM) puede ser extremadamente valiosa. Aquí destacamos el protocolo moderno para los datos TEM del neuroblastoma. Las células tumorales con ovillos de procesos citoplasmáticos que contienen gránulos neurosecretores pueden diagnosticar neuroblastoma.
Introducción
El trabajo de un patólogo puede ser bastante desafiante tanto en el diagnóstico clínico como en los campos de investigación. La evolución de la microscopía óptica enlos siglos XVIII y XIX fue notable. La potencia de un microscopio electrónico se basa principalmente en la longitud de onda de los electrones, que es más corta que la luz 1,2,3. Antes de la llegada de los anticuerpos policlonales y monoclonales y su aplicación en inmunohistoquímica, la TEM desempeñaba un papel influyente en el diagnóstico de tumores pequeños y redondos de células azules.
A partir de los años 90 del siglo pasado, el abordaje inmunohistoquímico ha sustituido a la herramienta morfológica en el diagnóstico4. En la actualidad, existen miles de nuevos anticuerpos policlonales y monoclonales dirigidos a antígenos del grupo de tumores de células azules pequeñas y redondas 4,6,7,8. En la última década del prolífico sigloXX y la primera década de principiosdel siglo XXI, la biología molecular, incluida la hibridación fluorescente in situ, desde sondas genómicas hasta la secuenciación de nueva generación, parece haber reemplazado el importante papel de aplicación de la inmunohistoquímica en varios laboratorios4. La Administración de Alimentos y Medicamentos (FDA) de los Estados Unidos de América, la Agencia Canadiense de Inspección de Alimentos (CFIA) de Canadá, la Agencia de Protección Ambiental (EPA) u organismos gubernamentales similares de otros países no siempre aprueban los protocolos de biología molecular9. Parece que hay una gran cantidad de información bastante difícil de insertar en un informe de patología que puede ser utilizada con fines terapéuticos, y la elección oculatada de un sistema de información de laboratorio bien financiado y en funcionamiento es crítica10. Mientras tanto, la inmunohistoquímica ha revelado numerosos escollos, con tumores epiteliales que muestran marcadores mesenquimales y viceversa11. La transición epitelio-mesenquimal ha confundido algunas fronteras en los grupos de patología 12,13. En los últimos años, se ha hecho evidente que la microscopía electrónica floreció en varios laboratorios de todo el mundo14. En particular, el tiempo de respuesta de las muestras de tejido ha disminuido de semanas a solo 3 días o incluso menos utilizando varios protocolos que abordan la tinción con anticuerpos monoclonales o policlonales 4,10.
Además, la aplicación de una cámara electrónica acoplada al microscopio electrónico ayudó a proporcionar a los patólogos una imagen rápida, que es versátil en diferentes sistemas operativos. Finalmente, algunos anticuerpos, incluso después de la recuperación de antígenos, son difíciles de revelar en algunas áreas de necrosis o cambios relacionados con la autofagia/isquemia. Al mismo tiempo, la microscopía electrónica en buenas manos aún puede ofrecer excelentes resultados y sugerencias para la correcta clasificación de tumores patológicos desconocidos15.
El grupo de tumores infantiles de células azules redondas pequeñas incluye varios tumores, principalmente neuroblastoma, tumor de Wilms o nefroblastoma, rabdomiosarcoma y sarcoma de Ewing. Los datos de biología molecular relativos al grupo pediátrico de tumores pequeños y redondos de células azules pueden ser abrumadores debido a las técnicas aplicadas. Es posible que las células azules redondas pequeñas no difieran mucho en las tinciones de rutina (tinción de hematoxilina y eosina), y algunos tumores pueden tener características inmunofenotípicas aberrantes. Los avances en biología molecular han sido enormes desde el descubrimiento de TEM. En el grupo de tumores pequeños y redondos de células azules, es posible que algunas neoplasias se encuentren con más frecuencia que otras, pero es necesario tenerlas en cuenta. Aunque el carcinoma papilar de células renales no es esencialmente un tumor pequeño y redondo de células azules, sino que presenta principalmente papilas, puede mostrar algunas áreas de células redondas que pueden necesitar ser distintas de otros tumores pequeños y redondos de células azules bien conocidos (por ejemplo, el tumor de Wilms) utilizando varias técnicas auxiliares16. En última instancia, los tumores del estroma metanéfrico también pueden necesitar ser tomados en cuenta para el diagnóstico diferencial17. El tumor rabdoide es un tumor pediátrico particularmente maligno, que se distingue en el subtipo renal y extrarrenal18.
El neuroblastoma es una de las neoplasias malignas sólidas más comunes en la infancia y la niñez. Las células del neuroblastoma son las células malignas de este tumor sólido que surgen insidiosamente a partir de derivados de la cresta neural primordial. Su diagnóstico y diagnóstico diferencial puede ser difícil. Su biología natural ha experimentado avances notables en las últimas dos décadas. La familia de factores de transcripción forkhead se caracteriza por un dominio "forkhead" distinto (FOXO3/FKHRL1). Estos factores de transcripción funcionan como desencadenantes de la apoptosis (muerte celular programada) a través de la expresión de genes necesarios para la muerte celular. FOXO3/FKHRL1 es activado por la 5-aza-2-desoxicitidina e induce la caspasa-8 silenciada, y este complejo desempeña un papel crucial en el neuroblastoma. El FOXO3 nuclear predice resultados clínicos adversos y promueve la angiogénesis tumoral en el neuroblastoma 7,19. A pesar de los avances en patología molecular, la clasificación de Shimada sigue siendo el estándar de práctica para cualquier patólogo y oncólogo pediátrico. Es fundamental para diferenciar entre histología favorable y desfavorable 20,21,22,23.
La justificación para el desarrollo de un protocolo sencillo para la microscopía electrónica de tumores sospechosos de neuroblastoma está relacionada con la viabilidad y solidez del examen ultraestructural de la muestra de tejido. Rara vez se altera por problemas que se encuentran comúnmente mediante la inmunohistoquímica. La justificación y el protocolo han sido la base de varios libros de texto y contribuciones científicas a la patología pediátrica y a la microscopía electrónica 4,24,25. Este protocolo abarca la experiencia de tres décadas del autor y se centrará en algunos PSRBCT, haciendo hincapié en la experiencia personal y la revisión de la literatura.
Protocolo
Todos los procedimientos realizados en los estudios con participantes humanos se ajustaron a las normas éticas del comité de investigación institucional y/o nacional y a la Declaración de Helsinki de 1964 y sus enmiendas posteriores o normas éticas comparables. El estudio de microscopía electrónica forma parte de la rutina habitual de investigación microscópica de las muestras recibidas con fines diagnósticos y no requiere la aprobación del Comité de Bioética. Este estudio es retrospectivo y respeta el completo anonimato de las muestras.
1. Protocolo TEM para la recuperación de FFPE (fijado en formol e integrado en parafina) y muestras de tejido fijadas en glutaraldehído
- Recupere los últimos portaobjetos teñidos con hematoxilina y eosina y el bloque de tejido FFPE.
- Con un marcador permanente, seleccione el área de interés en el portaobjetos de tejido y hágala coincidir con el área del bloque de tejido.
- Recorta el área seleccionada con una nueva cuchilla de afeitar del bloque y córtala con precisión en cubos de 5 mm sobre papel de filtro.
- Coloque el papel de filtro con el pañuelo recuperado en una placa de Petri etiquetada. Coloque la placa de Petri en un horno a 60-70 °C durante 15 minutos, es decir, hasta que la parafina se derrita (la cera de parafina consiste en una mezcla de hidrocarburos sólidos de cadena lineal con un punto de fusión de 48 °C-66 °C (120 a 150 °F)) y sea absorbida por el papel de filtro.
- Transfiera el tejido recuperado libre de parafina a un vial de centelleo lleno de 4 mL de 100% de tolueno (metilbenceno) v/v [100% de tolueno significa 100 mL de tolueno]. Asegúrese de que las muestras roten continuamente a través del proceso de desparafinación (Velocidad de rotación: 24 rotaciones/min).
- Realice dos cambios de tolueno, de 1 h cada uno, y un cambio de 4 mL de tolueno al 100% de 30 min cada uno, utilizando un dispositivo giratorio en ángulo.
- Proceda con un cambio de 4 mL de etanol absoluto al 100% (C2H5OH) durante 1 h, y luego dos cambios de 4 mL de etanol absoluto al 100% durante 30 min cada uno. Luego, otro cambio de 30 min en 4 mL de etanol al 70%.
- Proceda con un cambio de 4 mL de tampón de cacodilato de sodio 0,1 M, 30 min. Transfiera las muestras en 4 mL de glutaraldehído al 2,5% y manténgalas a 4 °C hasta el procesamiento.
- Utilice los siguientes pasos en un procesador de tejidos automatizado para estandarizar el procesamiento: tampón de cacodilato de sodio 0,1 M durante 5 min, tetróxido de osmio al 2% durante 1 h y 50 min, dH2O durante 5 min, etanol al 50% durante 15 min, etanol al 70% durante 30 min, etanol al 100% durante 15 min (tres veces), etanol al 100% durante 30 min (tres veces), Etanol al 100% durante 45 minutos, acetona durante 50 minutos, resina durante 1 h (dos veces) y resina fresca durante la noche. El volumen de todas las soluciones es de 15 mL.
- Incrustar con resina fresca directamente del procesador de tejidos.
- Coloque las cápsulas de polietileno en un soporte con tiras de papel numeradas. Coloque resina fresca en las cápsulas, transfiera la muestra a los bloques apropiados y manténgalos durante la noche en un horno a 60 °C (140 °F).
- Teñir las secciones semifinas (500 nm) con azul de toluidina al 1% en la placa calefactora, ajustar el calor mínimo durante 30 s, enjuagar en dH2O y luego colocar un cubreobjetos.
- En este caso, el micrótomo Ultracut (UCM) se utiliza para seccionar secciones semifinas.
- Tome el bloque incrustado de resina e instálelo en el soporte de bloques del UCM. A continuación, instale el soporte del bloque en la platina del UCM y apriételo.
- Corta el exceso de resina alrededor de la muestra con una cuchilla de afeitar recubierta de un solo borde con los oculares. Corta la cara del bloque en forma trapezoidal.
- Retire el soporte del bloque de la platina e instálelo en el brazo UCM, apretado. A continuación, instale el portacuchillas en la etapa UCM. Finalmente, apriete un cuchillo de vidrio en el soporte de la hoja.
- Con los oculares y la luz que proporciona el UCM, deslice el filo del cuchillo de vidrio lentamente, lo más cerca posible, de la superficie del bloque de resina a cortar. Apriete el soporte de la cuchilla en su lugar en el escenario.
- Establezca el grosor de corte del UCM en 500 nm y recorte el bloque de resina hasta que el 75% esté completo.
- Cambia el cuchillo de vidrio por uno nuevo. Agregue agua estéril al depósito del cuchillo de vidrio.
- Etiquete un portaobjetos de microscopio con el número de caja y coloque cuatro gotas separadas de agua estéril en el portaobjetos de vidrio.
- Todavía en la configuración de 500 nm, corte cuatro secciones del bloque. Con pinzas finas, transfiera 1 sección a la vez en una de las gotas de agua en el portaobjetos de vidrio. Cada gota en la diapositiva contendrá una sección. Seque el portaobjetos en una placa caliente a la temperatura más baja hasta que se seque (30 s).
- Teñir con el método del azul de toluidina. Enjuague con agua y coloque un cubreobjetos. Examine las secciones de azul de toluidina con un microscopio óptico. Si las estructuras de tejido deseadas son visibles, corte secciones ultrafinas. Si las estructuras de tejido deseadas no son visibles, corte secciones más profundas y tíñalas usando los mismos pasos hasta que las estructuras deseadas queden expuestas y se muestren en el portaobjetos de azul de toluidina.
- Cuando se identifique el área deseada para la microscopía electrónica a partir de las secciones de azul de toluidina, corte las secciones ultradelgadas en las rejillas de cobre. Cortar rodajas ultrafinas con un ultramicrótomo (las muestras destinadas a la visualización en el TEM deben cortarse en rodajas muy finas (80 nm)).
- Tome el bloque incrustado de resina e instálelo en el soporte de bloques del UCM. A continuación, instale el soporte del bloque en la platina del UCM y apriételo.
- Con los oculares, corte la resina alrededor del área deseada para la microscopía electrónica con una hoja de afeitar recubierta de un solo filo. Corta la cara del bloque en forma de trapecio, no más grande de 1 mm cuadrado. Si el área deseada para la microscopía electrónica es difícil de ver debido al resplandor de la luz, use un poco de cloroformo para resaltar las estructuras en el bloque de resina.
- Retire el soporte del bloque de la platina e instálelo en el brazo UCM, apretado. A continuación, instale el portacuchillas en la etapa UCM. Finalmente, apriete un cuchillo de diamante en el soporte de la hoja.
- Utilizando los oculares y la luz proporcionada por el UCM, deslice el filo del cuchillo de diamante lentamente, lo más cerca posible, de la superficie del bloque de resina a cortar. Apriete el soporte de la cuchilla en su lugar en el escenario.
- Ajuste los diferentes ángulos del cuchillo de diamante con los tornillos del UCM. Asegúrese de que el filo del cuchillo de diamante esté alineado lo más perfectamente posible con la superficie del bloque a cortar. Llene el depósito del cuchillo de diamante con agua estéril.
- Ajuste el UCM a 80 nm de grosor y velocidad de 1 mm/s. En este caso, la función automatizada se utiliza para el corte ultrafino. Establezca la ventana de corte en el UCM (parte superior e inferior de la cara del bloque).
- Presione el botón Inicio del UCM para comenzar a seccionar. Las secciones flotarán en el depósito estéril del cuchillo de diamante.
- Cuando se corten suficientes secciones, use vapores de cloroformo para enderezar las secciones. Sumerge un bastoncillo de algodón en cloroformo y pásalo por encima de las secciones sin tocarlas.
- Sumerja una rejilla de cobre en alcohol al 100% y luego agua estéril con pinzas finas. Limpie cada rejilla antes de usarla. Elija las secciones en algunas cuadrículas.
- Deje las cuadrículas con secciones en papel de filtro etiquetado. Coloque este papel de filtro en una placa de Petri y póngalo en el horno a 60 °C durante 30 min para permitir que las secciones se sequen en las rejillas.
- A continuación, realice la tinción de contraste.
- Teñir las rejillas con acetato de uranilo o cualquier sustituto alternativo respetuoso con el medio ambiente durante 1 min. Luego, enjuáguelos en agua estéril para inyección (40 inmersiones en cuatro recipientes de agua diferentes para cada enjuague después del acetato de uranilo y el citrato de plomo). El paso del citrato de plomo también es de 1 min.
- Inserte la rejilla en el TEM, permitiendo que un haz de electrones de alto voltaje sea emitido por un cátodo y creado por lentes magnéticas. El haz que se ha transmitido parcialmente a través de la muestra delgada (semitransparente electrónicamente) forma la información TEM en la pantalla (ver más abajo).
2. Protocolo TEM para escanear y fotografiar los especímenes
- Después de teñir las secciones de las rejillas, examínelas con el microscopio electrónico. En el microscopio electrónico, encienda el voltaje ACC a un ajuste preestablecido (200-300 kV), que depende del microscopio electrónico utilizado.
- En la computadora, encienda el software de la cámara digital e ingrese el número de caso. Esto es importante porque las microfotografías se guardan en el expediente correspondiente.
- Cargue la rejilla en el microscopio electrónico, extraiga la muestra de la pistola hasta la mitad y gire el interruptor a AIR para permitir que el vacío de la cámara de la pistola de muestras se llene con aire ambiente (ambiente).
- Una vez que esté lleno de aire, saca la muestra de la pistola. Coloque la muestra de la pistola en el soporte diseñado. Luego, abra el soporte de rejilla en la punta de la pistola.
- Coloque la rejilla en su lugar. Cierre el soporte de rejilla y asegúrese de que la rejilla esté asegurada.
- Vuelva a colocar la muestra de pistola en la cámara de muestras a mitad de camino y accione el interruptor a EVAC para crear un vacío en la cámara de muestras.
- El indicador de luz verde se encenderá cuando se alcance el vacío en la cámara de muestras. Luego, empuje la muestra de pistola con cuidado en la columna del microscopio electrónico y asegúrese de no permitir que vaya demasiado rápido. De lo contrario, dañaría el objeto en la punta de la muestra del arma.
- Una vez que la rejilla esté bien colocada en la columna del microscopio electrónico, encienda el filamento a la configuración de saturación intermedia (preestablecida).
- Encienda la cámara a través del interruptor ON/OFF . En la computadora, haga clic en Imagen en vivo en el software de imágenes.
- En el microscopio electrónico, presione el botón de aumento bajo y abra la apertura del objetivo. Esto permite elegir el área de cribado deseada. A continuación, coloque el área deseada de la sección en el centro de la pantalla de la computadora, usando los dos controladores a cada lado de la columna del microscopio electrónico.
- En el microscopio electrónico, presione el botón Zoom y cierre la apertura del objetivo para obtener un mejor contraste.
- Comience la proyección de la sección tomando microfotografías con un aumento de 2.500x. A continuación, ajuste el enfoque con el botón de bamboleo y el botón de brillo del microscopio electrónico para garantizar la calidad de la microfotografía.
- Haga clic en Imagen final en la computadora para tomar la microfotografía. Si los colores no son uniformes, realice una corrección de fondo en el software de la cámara. Además, ajuste el contraste en la imagen final usando el software antes de guardar la microfotografía.
- Cuando se guarde la microfotografía, verifique dos veces el número de caja y el aumento para garantizar la identificación adecuada de las microfotografías tomadas.
NOTA: En algunos casos, el usuario también puede ingresar subtítulos adicionales y también se ingresan las iniciales del tecnólogo de microscopía electrónica. - Realizar el proceso de micrografía a través de toda el área de la sección a cribar. Después de un aumento suficiente de 2.500x, las microfotografías se guardan para cubrir el área de interés, capturar microfotografías de 4.000x y 8.000x de aumento y guardarlas en la computadora con la identificación del número de caso apropiado.
- Haga un primer plano de la sección para obtener detalles ultraestructurales específicos si se dan instrucciones de detección muy específicas. A continuación, guarde las mediciones de detalles ultraestructurales específicos en el ordenador considerando aumentos más altos si es necesario.
- Cuando se complete el cribado de la muestra, apague el filamento, la cámara, el alto voltaje y el software de la cámara en secuencia. A continuación, retire la rejilla de la columna del microscopio electrónico, permitiendo la entrada de aire en la cámara de muestras de la pistola.
- Lima la rejilla en una cápsula de gelatina y guarda la cápsula en una caja debidamente etiquetada, junto con los bloques de resina de la misma caja. Vuelva a colocar la muestra de la pistola en la recámara de la pistola y guárdela en un ambiente fresco y seco para preservar el material utilizado.
- Transfiera las microfotografías digitales a plataformas colaborativas comunes (por ejemplo, SharePoint) o servidores internos para permitir que el patólogo las vea.
- Introduzca las unidades de trabajo en el Sistema de Información de Laboratorio (LIS).
- Si se requieren microfotografías más específicas, extraiga la cuadrícula de campo y reutilícelas para una proyección adicional o preguntas específicas.
Resultados
Aquí se muestran las características distintivas de TEM del neuroblastoma. Aquí ilustraremos las características distintivas de la TEM del neuroblastoma.
El neuroblastoma es una de las neoplasias malignas sólidas más comunes en la infancia y la niñez. Las células del neuroblastoma son las células malignas de este tumor sólido que surgen insidiosamente a partir de derivados de la cresta neural primordial. Esta histogénesis explica algunas características bioquímicas y morfológicas de este tumor azul. Sin embargo, las características citopatológicas e histopatológicas deterministas de los neuroblastomas pueden fluctuar específicamente según el grado variable de diferenciación. Por lo tanto, su diagnóstico y diagnóstico diferencial puede ser difícil. La distinción del neuroblastoma con respecto a los elementos similares a las células ganglionares se muestra por una cantidad creciente de citoplasma celular con el desarrollo de un proceso citoplasmático y una alteración de la imagen nuclear (Figura 1A-D). El agrandamiento nuclear y un nucléolo visible son característicos de la diferenciación del neuroblastoma. También se puede notar la diferenciación a elementos similares a las células de Schwann. La investigación de microscopía electrónica revela gránulos neurosecretores (diámetro promedio de 100 nm) constantemente presentes con o sin proyecciones citoplasmáticas tipo neurita que contienen microtúbulos y filamentos intermedios delgados26. La escasez de glucógeno caracteriza al neuroblastoma, y si se observa raramente, nunca forma agregados. El grado de diferenciación distingue la ultraestructura del neuroblastoma. Los gránulos neurosecretores o catecolaminas son característicos de esta neoplasia, con un diámetro de unos 150 nm. Los gránulos neurosecretores deben diferenciarse de las estructuras similares a los desmosomas. Los gránulos neurosecretores se pueden ver cerca de los filamentos intracitoplasmáticos (neurofilamentos). Los procesos celulares son a menudo regordetes y cilíndricos y se conocen comúnmente como neuritas (axones y dendritas). Algunos procesos celulares contienen mitocondrias, que son críticas para el movimiento de la célula neoplásica. Las neuritas contienen microtúbulos, pero también pueden tener mitocondrias inflamadas. En el caso de un neuroblastoma poco diferenciado, algunas características se encuentran con mayor frecuencia. Incluyen una irregularidad más significativa de la morfología nuclear, numerosas mitosis y figuras apoptóticas, escasez de microtúbulos y procesos celulares, en contraste con la presencia casi constante de neurofilamentos, escasez de neuritas, que contienen más a menudo mitocondrias que microtúbulos, nulas o muy pocas uniones sinápticas, ausencia de glucógeno, áreas de numerosos polirribosomas y escasez de gránulos neurosecretores. Los gránulos neurosecretores son fundamentales para diferenciar el neuroblastoma de otros PSRBCT, como el rabdomiosarcoma embrionario, el granuloma eosinofílico, el osteosarcoma de células pequeñas y el sarcoma de células del retículo, que pueden causar dificultades diagnósticas debido a la presencia de granularidad citoplasmática.
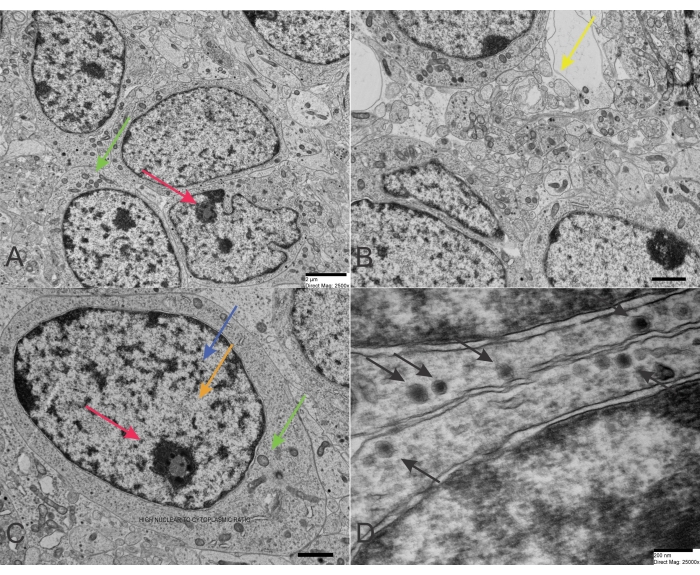
Figura 1: TEM de neuroblastoma. (A-C) Células de neuroblastoma de un tipo pobremente diferenciado con una alta proporción de núcleo a citoplasma y unos pocos orgánulos. La cromatina se dispersa en el núcleo, pero también se concentra en la periferia, cerca de la membrana nuclear. Un nucléolo es visible en un núcleo en la esquina superior derecha (barra de escala: 2 μm). (D) Células de neuroblastoma con gránulos neurosecretores que exhiben una doble membrana característica (barra de escala: 200 nm). Las flechas rojas apuntan a los nucléolos, las flechas azules revelan la heterocromatina, las flechas naranjas detectan la eucromatina, las flechas verdes se centran en las mitocondrias y las flechas amarillas apuntan a vesículas que se asemejan a las terminales presinápticas normales. Sin embargo, las vesículas del neuroblastoma son más grandes e irregulares que las terminales presinápticas clásicas. Por último, las flechas negras revelan numerosos gránulos neurosecretores de núcleo denso. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En esta revisión narrativa con protocolo asociado, destacamos las características ultraestructurales distintivas del neuroblastoma. Al final, sugerimos que la microscopía electrónica está lejos de ser una técnica "muerta" o antigua, postulando el descubrimiento de un nuevo papel si se combina con tecnologías ómicas unicelulares. Esta contribución quiere destacar el papel nunca antiguo de la microscopía electrónica en la patología pediátrica 4,27. A continuación se detallan los pasos críticos, las modificaciones y la solución de problemas de la técnica, así como las limitaciones.
Hay algunos pasos críticos para este protocolo. En primer lugar, es esencial cortar el área deseada para la microscopía electrónica. El borde del diamante debe ajustarse para que mire hacia la cara del bloque lo más cerca posible. Esto requiere una mano muy firme. Se debe tener cuidado al recoger la sección flotante con las rejillas de cobre.
Las modificaciones y la solución de problemas de la técnica incluyen algunos aspectos que deben tenerse en cuenta. Cada muestra es diferente con cualidades, como la densidad y la naturaleza, que son variables. Dada la naturaleza y densidad del material, no todas las muestras de tejido se cortan de la misma manera. Por ejemplo, algunos especímenes de neuroblastoma pueden ser indiferenciados o poco diferenciados, mientras que otros pueden revelar un alto grado de diferenciación y un grado variable de calcificaciones. De vez en cuando, hay que cortar varias secciones para que algunas buenas se procesen más. Es crucial evitar cualquier tipo de vibración: respiración, mesa, compresores de los visores EM. Si se encuentran roturas en las secciones, puede ser clave apretar los tornillos UCM. Si se ven arañazos en las secciones, cambie el cuchillo de diamante que se utilizará para cortar. A veces, los artefactos de corte solo se ven en el paso final. Si se detectan artefactos de corte bajo el microscopio electrónico, las secciones ultrafinas deben volver a cortarse después de identificar la causa del artefacto.
La TEM tiene limitaciones obvias, y la ventana de observación es incluso más pequeña que la vista capturada con microscopía óptica convencional. El área deseada para la microscopía electrónica no puede ser mayor que un cuadrado de 1 mm. A veces, un área más grande beneficiaría la detección, pero es imposible cortarla. No encajará en la rejilla de cobre, dañará el cuchillo de diamante y la calidad de la sección definitivamente será inferior. Hay que tomar algunas decisiones y elegir la estructura o zona más importante en el momento de la proyección. La velocidad de corte no se puede aumentar; Causará artefactos de corte en las secciones. El 1 mm/seg sigue siendo crítico.
Además de las características clásicas enumeradas anteriormente (por ejemplo, gránulos neurosecretores), la ultraestructura de las mitocondrias en las células de neuroblastoma examinadas por TEM a menudo muestra niveles notables de mitofagia, un mecanismo celular selectivo de control de calidad mitocondrial que permite la degradación de las mitocondrias, que las células consideran dañadas y/o superfluas28,29. Como resultado, las mitocondrias albergan hinchazón, ruptura de las crestas y desaparición de las mismas. De hecho, Radogna et al. encontraron una mitofagia eficiente como el mecanismo crítico que conduce a la falla de la activación de la vía de muerte celular programática que aumentó la resistencia de SK-N-AS, una línea celular de neuroblastoma con una síntesis mejorada de factor de crecimiento similar a la insulina II (IFG-II) y ARN de IGF-II y que alberga receptores de IGF de tipo I para UNBS1450, un cardenólido hemisintético perteneciente a la familia de glucósidos esteroides cardíacos. desencadenando la necroptosis a dosis algo más altas30.
Particularmente relevante para el diagnóstico diferencial es la función de la TEM para el sarcoma de Ewing. El sarcoma de Ewing se considera equivalente al tumor de células neuroectodérmicas periféricas, aunque en los últimos 31,32,33 se ha debatido mucho. Prácticamente, en las células primitivas del sarcoma de Ewing, las características principales son abundante glucógeno citoplasmático, uniones celulares poco desarrolladas y ausencia de características neuronales. Existe una sorprendente similitud en el tumor neuroectodérmico periférico con el sarcoma de Ewing en la microscopía electrónica. De hecho, ambos tumores se consideran la misma entidad y se tratan con los mismos protocolos terapéuticos tanto en la SIOP (Sociedad Internacional de Oncología Pediátrica) como en el COG (Grupo de Oncología Infantil) así como en el UKCCSG (Grupo de Estudio del Cáncer Infantil del Reino Unido) porque comparten la misma translocación cromosómica. Sin embargo, en el TNEP, existen algunas características neuronales, como gránulos neurosecretores que están prácticamente ausentes en el sarcoma de Ewing. Esta especificación también refleja el fenotipo inmunohistoquímico. Hay positividad para al menos uno o dos marcadores neuronales, por ejemplo, enolasa neuronal específica, S-100, sinaptofisina o neurofilamentos. Franchi et al. estudiaron el ES-PNET31. En la mayoría de los casos, las células neoplásicas tenían la ultraestructura típica, que incluía células firmemente empaquetadas, poco diferenciadas, de forma ovalada a poligonal. Estas células contienen un núcleo redondo u ovalado con cromatina finamente dispersa y uno o dos nucléolos. En el citoplasma, pequeños orgánulos que reflejan la pobre diferenciación de estas células neoplásicas. Sin embargo, la atención al detalle puede revelar la presencia de mitocondrias, algunas estructuras rugosas del retículo endoplásmico (las llamadas cisternas), lisosomas esporádicos y ribosomas libres. La acumulación de glucógeno puede detectarse fácilmente. El glucógeno puede verse disperso o agrupado. A menudo se observan filamentos intermedios tanto en el citoplasma como en los procesos citoplasmáticos de las células tumorales. Los microtúbulos no se ven. Se pueden detectar uniones rudimentarias en aproximadamente la mitad de los casos alrededor de las conexiones celulares. Estas estructuras están formadas por desmosomas bien desarrollados con tonofilamentos si se identifican las uniones. Se puede reconocer cierta acumulación de material similar a la membrana basal y fibrillas de colágeno en la matriz extracelular. Se pueden observar gránulos gruesos densos con un diámetro similar a los gránulos que se observan en el neuroblastoma. Al igual que las investigaciones inmunohistoquímicas de los autores anteriores31, las neoplasias bien diferenciadas tienden a ocurrir fuera del esqueleto, mientras que los tumores pobremente diferenciados surgen con mayor frecuencia en el hueso que en los tejidos blandos.
En conclusión, TEM es una tecnología excepcional que puede tener un enorme potencial en el futuro y está lejos de estar muerta en medicina. La introducción de técnicas de biología molecular, con el avance más reciente de la secuenciación de próxima generación, pone de manifiesto la inconsistencia de un continuo en los diagnósticos, pero una ola de progreso similar a la de un canguro. La introducción de nuevos métodos no debería disuadir a los patólogos de utilizar la microscopía electrónica de forma sistemática, ya que tanto la inmunohistoquímica como las técnicas moleculares pueden ser falaces. Algunos patrones inmunohistoquímicos y anomalías genéticas no son específicos del tumor y es posible que se correlacionen mal con las características histológicas. Hasta donde sabemos, TEM sigue siendo un método robusto, válido y reproducible en patología y medicina. La TEM es una herramienta auxiliar para la investigación de tumores pequeños y redondos de células azules y es una prueba sólida del resultado inmunohistoquímico. La aplicación de TEM de manera consistente en una instalación moderna puede proporcionar una alta puntuación de acuerdo interindividual, alta validez y confiabilidad eficiente. En un futuro próximo, los biólogos moleculares pueden buscar laboratorios competentes y válidos de microscopía electrónica que puedan responder a preguntas específicas a nivel ultraestructural. En particular, vemos una nueva perspectiva y aplicación de TEM en biologías moleculares, como el acoplamiento de TEM con experimentos destinados a comprender algunas investigaciones actuales de una sola célula.
Divulgaciones
El primer autor recibe regalías de las siguientes editoriales: Springer (https://link-springer-com.remotexs.ntu.edu.sg/book/10.1007/978-3-662-59169-7; ISBN: 978-3-662-59169-7) y Nova (https://novapublishers.com/shop/science-culture-and-politics-despair-and-hopes-in-the-time-of-a-pandemic/; ISBN: 978-1-53619-816-4). Todas las regalías se destinan a organizaciones benéficas pediátricas.
Agradecimientos
Reconocemos la experiencia y el generoso apoyo del Dr. Richard Vriend, ex empleado de los Servicios de Salud de Alberta en el Hospital de la Universidad de Alberta, y de Steven Joy (1972-2019), también empleado de los Servicios de Salud de Alberta en el Hospital de la Universidad de Alberta. Dedicamos este trabajo a la memoria del Sr. Joy, un tecnólogo senior experto en investigaciones ultraestructurales que falleció trágica y prematuramente hace unos años. El Sr. Joy fue un pilar para la mayoría de los estudios de microscopía electrónica en Alberta, Canadá. Nuestros pensamientos y oraciones para él y su familia. También estamos en deuda con la Sra. Lesley Burnet por su ayuda y consejos. La investigación del Dr. C. Sergi ha sido financiada por la generosidad del Hospital de Niños del Este de Ontario, Ottawa, Ontario, y la Fundación del Hospital de Niños Stollery y los partidarios del Hospital Lois Hole para Mujeres a través del Instituto de Investigación de la Salud de la Mujer y el Niño (WCHRI, ID de subvención #: 2096), la Fundación de Ciencias Naturales de la Provincia de Hubei para la Universidad Tecnológica de Hubei (Subvención de 100 talentos para el programa de reclutamiento de expertos extranjeros). PCR digital y diagnóstico basado en NGS para infecciones y oncología, 2017-2022), Österreichische Krebshilfe Tyrol (Krebsgesellschaft Tirol, Instituto Austriaco de Investigación del Cáncer del Tirol, 2007 y 2009 - "DMBTI y carcinomas colangiocelulares" y "Hsp70 y HSPBP1 en carcinomas de páncreas"), Fondo Austriaco de Investigación (Fonds zur Förderung der wissenschaftlichen Forschung, FWF, Grant ID L313-B13), Fundación Canadiense para la Salud de la Mujer ("Early Fetal Heart-RES0000928"), Sociedad de Investigación del Cáncer (von Willebrand factor expresión génica en células cancerosas), Institutos Canadienses de Investigación en Salud (Ácidos grasos omega-3 para el tratamiento de la enfermedad hepática asociada a la insuficiencia intestinal: un estudio de investigación traslacional, 2011-2014, CIHR 232514) y la Oficina Cultural Saudita, Ottawa, Canadá. Los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetone, ACS Reagent | Electron Microscopy Sciences | 10014 | Reagent as established by the American Chemical Society (ACS Reagent). |
| Automated tissue processor | Electron Microscopy Sciences | L12600 | LYNX II Automated Tissue Processor for Histology and Microscopy. |
| Digital camera software | Gatan | L12600 | Digital Micrograph |
| Spurr's resin | Electron Microscopy Sciences | 14300 | Embedding resin. It provides excellent penetration for embedding tissues and rapid infiltration. The blocks have excellent trimming and sectioning qualities, while thin sections reveal tough qualities under the electron beam. |
| Ethyl Alcohol | Electron Microscopy Sciences | 15058 | 100% Ethyl alcohol with molecular sieve, 50% and 70%. |
| Glutaraldehyde, 25% EM Grade Aqueous in Serum Vial | Electron Microscopy Sciences | 16214 | 2.5% gluteraldehyde in 0.1 M cacodylate buffer, pH 7.2-7.4 made from 25% gluteraldehyde, primary fixative for TEM tissue specimens. |
| Osmium tetroxide | Electron Microscopy Sciences | 19110 | Second fixative during TEM tissue processing used as OsO4 in distilled water |
| Polyethylene capsules | Electron Microscopy Sciences | 70021 | Flat Bottom Embedding Capsules, Size 00 |
| Scintillator | Electron Microscopy Sciences | 82010 | Phillip Quad Detector |
| Single Edge Razor Blade | Electron Microscopy Sciences | 71952-10 | Blade for Clean Rm., 10/Disp. . |
| Sodium Cacodylate Buffer | Electron Microscopy Sciences | 11655 | Sodium Cacodylate Buffer, 0.4M, pH 7.2, prepared from Sodium Cacodylate Trihydrate |
| Tannic Acid, Reagent, A.C.S., EM Grade | Electron Microscopy Sciences | 21700 | Reagent as established by the American Chemical Society (ACS Reagent). |
| Transmission Electron Microscope (1) | Hitachi | Hitachi 7100 | We use it at the HV 75 setting |
| Transmission Electron Microscope (2) | JEOL | JEM-1010 | We use it at the HV 38 setting |
| Toluene | Electron Microscopy Sciences | 22030 | Reagent as established by the American Chemical Society (ACS Reagent) |
| Ultracut microtome | Leica | 11865766 | Ultramicrotome |
| Uranyl acetate | Electron Microscopy Sciences | 22400 | Uranyless, substitute for uranyl acetate |
Referencias
- Nitta, R., Imasaki, T., Nitta, E. Recent progress in structural biology: lessons from our research history. Microscopy (Oxford). 67 (4), 187-195 (2018).
- Moser, T. H., et al. The role of electron irradiation history in liquid cell transmission electron microscopy. Science Advances. 4 (4), (2018).
- Gordon, R. E. Electron microscopy: A brief history and review of current clinical application. Methods in Molecular Biology. 1180, 119-135 (2014).
- Sergi, C. M. Pathology of Childhood and Adolescence. An Illustrated Guide. 1st edn. , Springer. Berlin, Heidelberg. (2020).
- Sergi, C., Dhiman, A., Gray, J. A. Fine needle aspiration cytology for neck masses in childhood. An illustrative approach. Diagnostics (Basel). 8 (2), 28(2018).
- Sergi, C., Kulkarni, K., Stobart, K., Lees, G., Noga, M. Clear cell variant of embryonal rhabdomyosarcoma: report of an unusual retroperitoneal tumor--case report and literature review). European Journal of Pediatric Surgery. 22 (4), 324-328 (2012).
- Hagenbuchner, J., et al. Nuclear FOXO3 predicts adverse clinical outcome and promotes tumor angiogenesis in neuroblastoma. Oncotarget. 7 (47), 77591-77606 (2016).
- Xu, X., Sergi, C. Pediatric adrenal cortical carcinomas: Histopathological criteria and clinical trials. A systematic review. Contemporary Clinical Trials. 50, 37-44 (2016).
- Khan, A., Feulefack, J., Sergi, C. M. Pre-conceptional and prenatal exposure to pesticides and pediatric neuroblastoma. A meta-analysis of nine studies. Environmental Toxicology and Pharmacology. 90, 103790(2022).
- Sergi, C. M. Implementing epic beaker laboratory information system for diagnostics in anatomic pathology. Risk Management and Healthcare Policy. 15, 323-330 (2022).
- D'Cruze, L., et al. The role of immunohistochemistry in the analysis of the spectrum of small round cell tumours at a tertiary care centre. Journal of Clinical Diagnostic Research. 7 (7), 1377-1382 (2013).
- Garcia, E., et al. Epithelial-mesenchymal transition, regulated by beta-catenin and Twist, leads to esophageal wall remodeling in pediatric eosinophilic esophagitis. PLoS One. 17 (3), 0264622(2022).
- Al-Bahrani, R., Nagamori, S., Leng, R., Petryk, A., Sergi, C. Differential expression of sonic hedgehog protein in human hepatocellular carcinoma and intrahepatic cholangiocarcinoma. Pathol and Oncology Research. 21 (4), 901-908 (2015).
- Taweevisit, M., Thorner, P. S. Electron microscopy can still have a role in the diagnosis of selected inborn errors of metabolism. Pediatric and Developmental Pathology. 22 (1), 22-29 (2019).
- Ghadially, F. N. Diagnostic Electron Microscopy of Tumours. , Butterworths. (1980).
- Geiger, K., et al. FOXO3/FKHRL1 is activated by 5-aza-2-deoxycytidine and induces silenced caspase-8 in neuroblastoma. Molecular Biology of the Cell. 23 (11), 2226-2234 (2012).
- Shimada, H. Transmission and scanning electron microscopic studies on the tumors of neuroblastoma group. Acta Pathologica Japonica. 32 (3), 415-426 (1982).
- Samardzija, G., et al. Aggressive human neuroblastomas show a massive increase in the numbers of autophagic vacuoles and damaged mitochondria. Ultrastructural Pathology. 40 (5), 240-248 (2016).
- Suganuma, R., et al. Peripheral neuroblastic tumors with genotype-phenotype discordance: a report from the Children's Oncology Group and the International Neuroblastoma Pathology Committee. Pediatric Blood and Cancer. 60 (3), 363-370 (2013).
- Joshi, V. V. Peripheral neuroblastic tumors: pathologic classification based on recommendations of international neuroblastoma pathology committee (Modification of shimada classification). Pediatric and Developmental Pathology. 3 (2), 184-199 (2000).
- Schultz, T. D., Sergi, C., Grundy, P., Metcalfe, P. D. Papillary renal cell carcinoma: report of a rare entity in childhood with review of the clinical management. Journal of Pediatric Surgery. 46 (6), 31-34 (2011).
- Brisigotti, M., Cozzutto, C., Fabbretti, G., Sergi, C., Callea, F. Metanephric adenoma. Histology and Histopathology. 7 (4), 689-692 (1992).
- McKillop, S. J., et al. Adenovirus necrotizing hepatitis complicating atypical teratoid rhabdoid tumor. Pediatric International. 57 (5), 974-977 (2015).
- Kim, N. R., Ha, S. Y., Cho, H. Y. Utility of transmission electron microscopy in small round cell tumors. Journal of Pathology and Translational Medicine. 49 (2), 93-101 (2015).
- Iida, M., Tsujimoto, S., Nakayama, H., Yagishita, S. Ultrastructural study of neuronal and related tumors in the ventricles. Brain Tumor Pathology. 25 (1), 19-23 (2008).
- Erlandson, R. A., Nesland, J. M. Tumors of the endocrine/neuroendocrine system: an overview. Ultrastructural Pathology. 18 (1-2), 149-170 (1994).
- Sergi, C. Microscopy Science: Last Approaches on Educational Programs and Applied Research.Microscopy. Torres-Hergueta, E., Méndez-Vilas, A. , Formatex Research Center S.L. 101-112 (2018).
- Song, D., et al. FOXO3 promoted mitophagy via nuclear retention induced by manganese chloride in SH-SY5Y cells. Metallomics. 9 (9), 1251-1259 (2017).
- Chiu, B., Jantuan, E., Shen, F., Chiu, B., Sergi, C. Autophagy-inflammasome interplay in heart failure: A systematic review on basics, pathways, and therapeutic perspectives. Annals of Clinical and Laboratory Science. 47 (3), 243-252 (2017).
- Radogna, F., et al. Cell type-dependent ROS and mitophagy response leads to apoptosis or necroptosis in neuroblastoma. Oncogene. 35 (29), 3839-3853 (2016).
- Franchi, A., et al. Immunohistochemical and ultrastructural investigation of neural differentiation in Ewing sarcoma/PNET of bone and soft tissues. Ultrastructural Pathology. 25 (3), 219-225 (2001).
- Llombart-Bosch, A., et al. Soft tissue Ewing sarcoma--peripheral primitive neuroectodermal tumor with atypical clear cell pattern shows a new type of EWS-FEV fusion transcript. Diagnostic Molecular Pathology. 9 (3), 137-144 (2000).
- Parham, D. M., et al. Neuroectodermal differentiation in Ewing's sarcoma family of tumors does not predict tumor behavior. Human Pathology. 30 (8), 911-918 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados