Method Article
Tessuti polmonari ingegnerizzati preparati da fette di polmone decellularizzate
In questo articolo
Riepilogo
Questo protocollo descrive un metodo per generare tessuti polmonari ingegnerizzati riproducibili su piccola scala, ripopolando fette polmonari decellularizzate tagliate con precisione con cellule epiteliali alveolari di tipo 2, fibroblasti e cellule endoteliali.
Abstract
C'è bisogno di modelli polmonari tridimensionali (3D) migliorati che ricapitolino la complessità architettonica e cellulare dell'alveolo polmonare nativo ex vivo. Modelli organoidi sviluppati di recente hanno facilitato l'espansione e lo studio dei progenitori epiteliali polmonari in vitro, ma queste piattaforme si basano tipicamente sulla matrice e/o sul siero derivati dal tumore del topo e incorporano solo uno o due lignaggi cellulari. Qui, descriviamo un protocollo per la generazione di tessuti polmonari ingegnerizzati (ELT) basato sulla ricellularizzazione multi-lineage di fette polmonari decellularizzate tagliate con precisione (PCLS). Gli ELT contengono strutture alveolari che comprendono epitelio alveolare, mesenchima ed endotelio, all'interno di un substrato di matrice extracellulare (ECM) molto simile a quello del polmone nativo. Per generare i tessuti, i polmoni di ratto vengono gonfiati con agarosio, affettati in fette spesse 450 μm, tagliati a strisce e decellularizzati. Gli scaffold ECM acellulari risultanti vengono quindi riseminati con cellule endoteliali primarie, fibroblasti e cellule epiteliali alveolari di tipo 2 (AEC2). Gli AEC2 possono essere mantenuti in coltura ELT per almeno 7 giorni con un terreno di crescita privo di siero e chimicamente definito. Durante il processo di preparazione e coltura dei tessuti, le fette vengono ritagliate in un sistema di cassette che facilita la manipolazione e la semina cellulare standardizzata di più PFU in parallelo. Questi PFU rappresentano una piattaforma di coltura organotipica che dovrebbe facilitare le indagini sulle interazioni cellula-cellula e cellula-matrice all'interno dell'alveolo, nonché i segnali biochimici che regolano gli AEC2 e la loro nicchia.
Introduzione
Gli alveoli sono le unità funzionali del polmone distale, che comprende una rete di spazi aerei a scambio di gas rivestiti da cellule epiteliali alveolari di tipo 1 (AEC1) e cellule di tipo 2 (AEC2). Alla base dell'epitelio c'è una fitta rete di capillari e mesenchima di supporto, il tutto sostenuto da un'impalcatura a matrice extracellulare (ECM) che fornisce forza e flessibilità a queste delicate sacche d'aria1. Gli alveoli sono anche il sito di lesioni in numerose patologie polmonari, tra cui la fibrosi polmonare idiopatica2, la sindrome da distress respiratorio acuto3 e la grave malattia da coronavirus-19 (COVID-19)4. Sebbene il lavoro dell'ultimo decennio abbia scoperto una notevole plasticità all'interno dell'epitelio polmonare, i meccanismi che consentono la riparazione polmonare distale in alcuni contesti - e che precludono la riparazione in altri - rimangono un'area di intensa indagine5. Lo sviluppo di piattaforme in vitro migliorate per modellare l'alveolo faciliterebbe gli studi di biologia alveolare, rigenerazione e terapia.
Gli AEC2 si auto-rinnovano e si differenziano in AEC1, e quindi sono considerati la cellula staminale primaria del polmone distale 6,7,8. Tuttavia, queste cellule rappresentano una sfida particolare per lo studio in vitro date le difficoltà associate alla coltura di AEC2 primari senza perdita di fenotipo9. Nella cultura convenzionale a 2 dimensioni (2D), gli AEC2 appiattiscono e adottano alcune caratteristiche delle celle simili ad AEC110. Al contrario, le strategie di coltura 3D, più comunemente organoidi, supportano il mantenimento di caratteristiche differenziate negli AEC2 primari 6,11,12 e consentono la coltura a lungo termine di AEC2 derivati da cellule staminali pluripotenti (PSC) 13,14. Gli organoidi sono stati utilizzati per modellare lo sviluppo polmonare distale15, l'infezione virale 11,15 e la malattia genetica correlata all'AEC2 13,16,17, consentendo importanti approfondimenti sulla biologia e la rigenerazione dell'AEC2. Tuttavia, questi modelli di coltura comprendono in genere solo uno o due lignaggi cellulari e incorporano le cellule in matrici di tipo gel che non riescono a ricapitolare né l'architettura né il substrato ECM dell'alveolo polmonare nativo.
L'ECM è un regolatore critico del fenotipo e del comportamento cellulare tramite segnali molecolari, topologici e meccanici; comprende una componente chiave delle nicchie tessuto-specifiche che regolano il destino delle cellule staminali; e funge da serbatoio che modula la disponibilità di fattori di crescita secreti localmente 18,19,20,21. La coltivazione di cellule su ECM nativo può quindi aumentare la capacità predittiva dei sistemi in vitro di modellare la biologia dei tessuti in vivo. La decellularizzazione, un processo che rimuove il materiale cellulare dai tessuti tramite detergenti, enzimi o metodi fisici o di altro tipo, può preservare in gran parte l'impalcatura ECM di un organo nativo, se eseguita con cura22,23. Tali scaffold possono essere ripopolati con cellule per la coltura biomimetica 3D. Tuttavia, mentre gli scaffold decellularizzati sono ampiamente utilizzati per applicazioni di ingegneria tissutale, il loro uso per la coltura cellulare di routine è stato limitato. Diversi studi precedenti hanno riportato la decellularizzazione e la ricellularizzazione di fette polmonari o piccoli segmenti di tessuto polmonare. Oltre agli studi proof-of-concept24,25,26, sono state utilizzate fette polmonari ripopolate per studiare l'adesione della matrice fibroblastica27,28 e per studiare l'effetto delle matrici polmonari malate sul fenotipo27,29 dei fibroblasti. Con le tecnologie migliorate disponibili per la generazione di fette di tessuto tagliate con precisione, le fette polmonari decellularizzate potrebbero offrire una piattaforma comoda e su piccola scala con cui coltivare le cellule, preservando al contempo le sottostrutture alveolari, delle vie aeree e vascolari. L'incorporazione di più tipi di cellule consentirebbe studi sulle interazioni cellula-cellula all'interno di un ambiente 3D fisiologicamente rilevante. Tuttavia, sono necessarie strategie migliorate per facilitare la manipolazione dei tessuti durante tutto il processo di coltura e per garantire la semina controllata e riproducibile di tessuti con un numero noto di cellule.
Qui, presentiamo un protocollo per generare tessuti polmonari ingegnerizzati (ELT) ripopolando fette polmonari decellularizzate a taglio di precisione (PCLS) con cellule endoteliali primarie, AEC2 e fibroblasti. In un adattamento del nostro sistema di tessuto cardiaco ingegnerizzato precedentemente descritto30 e delle strategie di decellularizzazione-ricellularizzazione dell'intero polmone22,31, descriviamo le procedure per tagliare PCLS dai polmoni di ratto e per agganciare le fette in cassette di coltura tissutale riutilizzabili che semplificano e standardizzano le manipolazioni a valle. Le fette tagliate vengono decellularizzate per formare scaffold ECM acellulari, che vengono ripopolati in bagni di semina personalizzati. Gli scaffold a fette polmonari preservano i componenti e l'architettura ECM critici e supportano la crescita di AEC2 all'interno di strutture alveolari multi-lineage per almeno 7 giorni. Gli ELT rappresentano un nuovo sistema di co-coltura alveolare all'interno di una matrice 3D fisiologicamente rilevante, che dovrebbe supportare lo sviluppo di strategie di ingegneria dei tessuti polmonari, facilitando al contempo gli studi biologici di base degli AEC2 e degli alveoli.
Protocollo
Tutte le procedure sperimentali sugli animali descritte in questo documento sono state approvate dal Comitato istituzionale per la cura e l'uso degli animali di Yale.
1. Creazione di cassette per colture tissutali e bagni di semina
NOTA: Una volta realizzate, le cassette di coltura dei tessuti e i bagni di semina possono essere autoclavati e riutilizzati per ripetuti cicli di coltura ELT.
-
Cassette per colture tissutali
- Utilizzare una taglierina laser per tagliare telai e clip di cassette per colture tissutali in politetrafluoroetilene (PTFE) di spessore 3/32 pollici secondo i disegni forniti rispettivamente nel file supplementare 1 e nel file supplementare 2. Utilizzare una taglierina laser per tagliare le linguette della cassetta di coltura tissutale da 1/16 di pollice di spessore ptFE secondo il file supplementare 3. Taglia i contorni 3x utilizzando l'80% di potenza e il 15% di velocità (per una taglierina laser da 30 W).
-
Bagni di semina
- Utilizzare i file CAD del bagno di semina (file supplementare 4 e file supplementare 5) per stampare in 3D la base e l'anello dello stampo del bagno di semina, rispettivamente, utilizzando resina trasparente.
- Immergere gli stampi in una soluzione di poloxamer 407 al 10% in acqua distillata durante la notte prima dell'uso per aiutare nel rilascio di PDMS. Lasciare asciugare all'aria, quindi montare l'anello sulla base dello stampo e avvolgere in un film plastico flessibile per evitare perdite.
- Preparare almeno 60 g per stampo di polidimetilsilossano (PDMS) mescolando l'elastomero PDMS in un rapporto 10: 1 con agente polimerizzante e versare nello stampo stampato in 3D. Degasare il PDMS in un essiccatore sottovuoto per 30 minuti per rimuovere eventuali bolle d'aria.
- Cuocere bagni di semina a 60 °C per 8 ore.
2. Preparazione di fette polmonari tagliate con precisione da polmoni di ratto
- Prelievo di organi
- Preparare un sistema di perfusione diviso comprendente arti a gravità e a pompa, come illustrato nella Figura 1. Collegare una cannula dell'arteria polmonare (PA) all'estremità del tubo, comprendente un connettore a Y spinato da 1/16 di pollice collegato a un tubo in silicone LS 14 di lunghezza di 1/2 pollice e un connettore luer-lock femmina da 3/32 pollici (vedere figura 1). Non collegare una valvola di ritegno alla cannula in questo momento.
- Innescare le linee con PBS contenente 100 U/mL di eparina e 0,01 mg/mL di nitroprussiato di sodio (SNP) rispettivamente per anticoagulazione e vasodilatazione. Preimpostare la pompa di perfusione a 30 ml/min.
NOTA: Aggiungere SNP fresco alla soluzione di eparina e tenerlo al riparo dalla luce. - Dosare un ratto Sprague-Dawley adulto (8-12 settimane, circa 300-350 g) con un'iniezione intraperitoneale (IP) di 400 U/kg di eparina per l'anticoagulazione, seguita da un'iniezione IP di ketamina (75 mg/kg) e xilazina (5 mg/kg) per anestesia. Confermare un piano chirurgico di anestesia attraverso la mancanza di risposta allo stimolo nocivo (pizzico della punta).
- Taglia il petto e l'addome della pelliccia usando i tagliacapelli. Quindi spruzzare con etanolo al 70% e pulire 3x con il 10% di povidone-iodio.
- Afferrare la pelle sotto il livello del diaframma con una pinza dentale di ratto. Quindi eseguire un'incisione trasversale di 1/2 pollice nella pelle con forbici a punta fine. Afferrare la fascia addominale esposta con la pinza, fare un'incisione trasversale di 1/2 pollice nella fascia, quindi estendere l'incisione attraverso la pelle e la fascia attraverso la larghezza della parte superiore dell'addome.
- Utilizzare la punta delle forbici sottili per fare una piccola incisione (non più di 1/8 di pollice) al centro del diaframma anteriore, causando la retrazione dei polmoni nel torace. Estendere l'incisione nel diaframma su tutta la larghezza del torace.
- Fai due incisioni verticali attraverso l'intera altezza della gabbia toracica verso il collo, facendo attenzione a non danneggiare i polmoni. Estendere l'incisione attraverso le costole sinistre per tagliare la clavicola e lungo il lato del collo fino al livello della laringe, esponendo la trachea.
- Sezionare la trachea libera dal tessuto connettivo circostante e dall'esofago. Fai un'incisione trasversale attraverso la metà anteriore della trachea tra due anelli cartilaginei, vicino alla laringe. Infilare una sutura in polipropilene 4-0 dietro la trachea, sotto il livello dell'incisione, e pre-legare liberamente la prima metà del nodo di un chirurgo con due torsioni.
- Posizionare una cannula composta da un connettore a Y spinato da 1/16 di pollice collegato a una valvola di ritegno unidirezionale e una lunghezza di 1/2 pollice di tubo in silicone LS 14 con un connettore luer-lock femmina da 3/32 pollici (vedere Figura 1) nella trachea inserendo un arto del connettore a Y nell'incisione tracheale verso la direzione dei polmoni.
- Posizionare l'anello di sutura pre-legato attorno alla trachea a livello della cannula inserita e stringere attorno al connettore a Y inserito per fissare la cannula in posizione. Aggiungere due lanci a torsione singola della sutura per completare il nodo.
- Riempire d'aria una siringa da 10 mL e collegarla al luer-lock della cannula tracheale.
- Bloccare la vena cava inferiore vicino al diaframma usando un emostato curvo, quindi iniettare il cuore con 150 U di eparina (1000 U / mL) attraverso il ventricolo destro (RV).
- Aprire parzialmente il rubinetto della linea di gravità, per produrre un gocciolamento lento ma costante di PBS/eparina/SNP dalla cannula PA preparata al punto 2.1.1.
- Infilare l'ago di una sutura in polipropilene 4-0 dietro la base del PA dove esce dal camper. Utilizzare la prima metà del nodo di un chirurgo per pre-legare un anello di sutura sciolto attorno alla base del PA.
- Fai una piccola incisione (non più di 1/8 di pollice) nel camper appena sotto e perpendicolare al PA usando forbici fini, quindi inserisci un arto del connettore a Y della cannula PA nella base del PA. Fissare la sutura attorno al PA e al connettore inserito e aggiungere un lancio a torsione singola per completare il nodo del chirurgo.
NOTA: La cannulazione del PA sotto flusso impedisce l'introduzione di bolle d'aria nella vascolarizzazione che possono precludere un'adeguata pulizia dei polmoni. - Collegare una valvola unidirezionale all'altra estremità del connettore a Y del catetere PA, quindi tagliare l'apice del cuore per consentire l'efflusso del flusso sanguigno attraverso il ventricolo sinistro.
NOTA: La mancata interruzione dell'apice del cuore prima della perfusione attraverso la pompa può causare danni alla barriera emato-gas, con conseguente perdita di fluido negli spazi aerei. - Commutare la linea di perfusione sul lato della pompa utilizzando il rubinetto di arresto che collega le due linee, quindi accendere la pompa a 30 ml / min. Mentre si perfondono i polmoni attraverso il PA, ventilare manualmente i polmoni attraverso la siringa tracheale da 10 ml a circa 10-15 respiri / min, per facilitare la pulizia dei polmoni dal sangue. Perfondere i polmoni fino a quando non diventano per lo più bianchi, di solito richiedendo 40 ml di PBS / eparina / SNP o meno.
NOTA: Un'inadeguata pulizia dei polmoni dal sangue può compromettere la decellularizzazione a valle. - Tagliare la trachea posteriore appena sopra il livello della cannula tracheale, quindi sezionare i polmoni e il cuore liberi da tutto il tessuto connettivo rimanente ed estrarre i polmoni e il cuore in blocco.
- Riempire una siringa da 10 mL con agarosio a basso punto di fusione al 2% nella soluzione salina bilanciata di Hank (HBSS) senza rosso fenolo, preriscaldata a 42 °C.
NOTA: Il volume esatto di agarosio richiesto varia in base alle dimensioni del polmone. I polmoni più grandi (cioè da ratti più grandi di 400 g) richiederanno più di 10 ml di agarosio. - Gonfiare manualmente i polmoni estratti 3 volte con 10 ml di aria (cioè a circa la capacità polmonare totale) attraverso la cannula della trachea per aiutare a reclutare il parenchima collassato.
- Gonfiare immediatamente i polmoni con la siringa preparata di agarosio iniettando manualmente l'agarosio attraverso la cannula della trachea ad una velocità di circa 40 ml / min, solo fino a quando le punte più distali dei lobi polmonari sono gonfiate. Se le regioni distali del polmone rimangono collassate, iniettare ulteriori 1-2 ml di agarosio.
- Tappare la trachea attaccando il cappuccio bianco da un rubinetto a 4 vie al luer-lock femminile della cannula tracheale. Posizionare il polmone in una capsula di Petri da 150 mm su ghiaccio per consentire all'agarosio di solidificarsi.
NOTA: L'inflazione del polmone poco dopo l'estrazione è fondamentale per garantire un riempimento uniforme del parenchima polmonare e il successivo taglio dei tessuti di successo. Se il polmone si gonfia in modo molto irregolare, non procedere con l'affettamento polmonare poiché la qualità della fetta sarà scarsa.
- Affettamento polmonare
NOTA: potrebbe essere necessario adattare l'esatta procedura di affettamento in base al microtomo vibratorio (vibratoma) utilizzato; ulteriori esempi di preparazione PCLS con varie affettatrici di tessuti sono stati pubblicati in precedenza 32,33,34.- Pre-raffreddare il blocco di refrigerazione metallica a -20 °C e mantenere sul ghiaccio quando non si utilizza durante la procedura di affettatura.
- Utilizzare una piccola goccia di colla cianoacrilata per fissare una lama al supporto della lama. Fissare con attenzione il supporto della lama al vibratoma utilizzando una chiave a brugola in modo che si allinei con l'estremità di un tubo campione inserito nel vassoio tampone.
- Preparare piatti a 6 pozzetti con 3 ml per pozzetto sterile HBSS ghiacciato senza rosso fenolo per raccogliere le fette.
- Usando un bisturi, tagliare un pezzo di tessuto polmonare di circa 1-1,5 cm3.
NOTA: il tessuto polmonare dalle porzioni inferiore e centrale del lobo sinistro, così come dai lobi centrali e inferiori destri, produce più facilmente fette di tessuto più grandi che massimizzano l'area alveolare. Se sono presenti regioni di tessuto non gonfiato o aree di tessuto connettivo, tagliare questo tessuto con le forbici o orientarsi verso il basso verso lo stantuffo; tale tessuto tende a non tagliare in modo pulito. - Posizionare una piccola goccia di colla cianoacrilica sullo stantuffo del tubo del campione. Tamponare il tessuto polmonare su una salvietta di carta per rimuovere l'umidità in eccesso, quindi posizionare immediatamente il tessuto polmonare sopra lo stantuffo usando un paio di pinze.
- Far scorrere il tubo metallico del tubo campione fino al livello della parte superiore del tessuto e tenerlo in posizione, con lo stantuffo ritirato. Pipetta preriscaldata al 2% di agarosio in HBSS nella parte superiore del tubo per circondare completamente il tessuto.
- Posizionare il blocco refrigerante ghiacciato attorno al tessuto per circa 1 minuto per consentire all'agarosio di solidificarsi.
- Inserire il tubo campione nel vassoio tampone. Riempire il vassoio con PBS ghiacciato a metà del blocco di tessuto. Ruotare l'interruttore della scatola del motore in avanti veloce (FF) per far avanzare lo stantuffo della scatola del motore in modo che tocchi semplicemente la base del tubo del campione.
- Impostare le impostazioni desiderate per lo spessore della fetta, la velocità di taglio e la frequenza di oscillazione, ad esempio spessore 450 μm, velocità 4 e frequenza di oscillazione 5. Selezionare Modalità continua, quindi ruotare l'interruttore su Attivato per iniziare a eseguire il sezionamento.
- Quando le fette di tessuto cadono nel vassoio tampone, trasferirle sulle piastre a 6 pozzetti preparate usando un anello inoculante o una spatola.
- Interrompere l'affettatura quando circa 2 mm di spessore del tessuto rimangono nel tubo del campione, per evitare di danneggiare la lama o tagliare il tessuto contenente colla.
- Ripetere i passaggi precedenti per affettare ulteriore tessuto polmonare, come desiderato.
- Decellularizzare immediatamente le fette per la preparazione dell'impalcatura o congelare a scatto e conservare a -80 °C per un massimo di 2 mesi. Per congelare, trasferire 4-6 fette in una capsula di Petri da 35 mm e aspirare accuratamente il liquido in eccesso da intorno alle fette. Mettere i piatti in un bagno di ghiaccio secco ed etanolo al 100% per congelare a scatto, quindi avvolgere in un foglio, sigillare in un sacchetto di plastica e trasferire a -80 ° C.
NOTA: non mettere le fette fresche direttamente in un congelatore a -80 °C poiché il tasso relativamente lento di congelamento può causare la formazione di cristalli di ghiaccio che possono danneggiare il tessuto.
3. Preparazione di scaffold di tessuto polmonare
- Preparazione di materiali e soluzioni di decellularizzazione
- Fotogrammi, clip e schede in autoclave.
- Preparare soluzioni di decellularizzazione come indicato nella Tabella 1.
NOTA: Aggiungere la nucleasi benzonasica al tampone preriscaldato immediatamente prima dell'uso e al filtro sterile. Preparare le soluzioni triton x-100 e deossicolato di sodio (SDC) entro 24-48 ore dalla procedura di decellularizzazione. Preparare soluzioni antibiotiche/antimicotiche e tampone benzonasi fino a 30 d in anticipo e conservare a 4 °C.
- Taglio e ritaglio di fette polmonari
NOTA: Mentre il taglio e il clipping possono essere eseguiti in modo non sterile sul banco, le fasi di decellularizzazione di cui al punto 3.3 e tutte le successive manipolazioni degli scaffold tissutali devono essere eseguite in una cappa a flusso laminare.- Riempire una capsula di Petri da 100 mm piena di circa un terzo con PBS. Trasferisci cassette (cornici contenenti due clip ciascuna) e linguette sul piatto usando una pinza.
- Se si utilizzano fette congelate, scongelare un piatto alla volta versando PBS a temperatura ambiente nel piatto per coprire le fette. Mantenere i piatti rimanenti su ghiaccio secco.
- Trasferire una fetta scongelata in una capsula di Petri da 150 mm. Aprire delicatamente la fetta usando una pinza fine, se necessario, in modo che rimanga piatta, quindi aspirare accuratamente il PBS in eccesso da tutto il tessuto.
- Utilizzare una lama di rasoio, con un righello come guida, per tagliare una striscia larga 3 mm dalla fetta premendo saldamente l'intera lunghezza della lama contro il piatto e dondolandola leggermente da un lato all'altro con il bordo della lama tenuto in posizione. In alternativa, utilizzare una fresa rotante retrofittata con 2 lame parallele separate da un distanziatore personalizzato da 3 mm (ad esempio, in acetale [poliossimetilene]) per tagliare strisce di tessuto. Evitare lacrime, buchi, grandi vie aeree o vasi o tessuto connettivo spesso.
NOTA: per un ritaglio di successo, la striscia deve essere lunga almeno 9 mm. - Usando la pinza, trasferire la striscia di tessuto sulla capsula di Petri da 100 mm preparata.
- Agganciare la striscia di tessuto nella cassetta: far galleggiare il tessuto sopra la cassetta, centrando il tessuto per sporgere i fori nelle clip alle due estremità. Con una pinza fine, posizionare una linguetta parzialmente nel foro a un'estremità, raddrizzare delicatamente il tessuto e quindi posizionare la seconda linguetta. Usando una pinza in ogni mano, premere completamente ogni linguetta per fissare il tessuto.
NOTA: Se hai difficoltà a mantenere il tessuto in posizione prima del ritaglio, aspirare un po 'di PBS dal piatto per abbassare il livello del fluido. Fare attenzione a non allungare il tessuto nel posizionare la seconda clip, in quanto ciò potrebbe portare a strappi. - Ripetere la procedura di scongelamento, taglio e ritaglio nei passaggi 3.2.2-3.2.6 per tutti i tessuti desiderati.
- Decellularizzazione delle fette
- Una volta che tutte le fette sono state tagliate, trasferire il piatto da 100 mm contenente le cassette in una cappa a flusso laminare.
- Iniziare la fase 1 del protocollo di decellularizzazione (vedere Tabella 2): utilizzando un emostato curvo per afferrare i lati dentellati di ciascuna cassetta, trasferire le cassette su piastre a 6 pozzetti (2 tessuti / pozzetto) riempite con 3 ml di PBS + ioni + antibiotici / antimicotici per pozzetto (vedere la ricetta della soluzione nella Tabella 1).
- Posizionare le piastre del pozzo su uno shaker orbitale a 30 giri / min per 10 minuti.
- Continuare con la fase 2 del protocollo di decellularizzazione (vedi Tabella 2): aspirare il fluido da ciascun pozzetto, quindi sostituire con ioni PBS + 3 ml / pozzetto, posizionare la piastra sullo shaker orbitale a 30 rpm e incubare per 5 min.
- Ripetere il passaggio 3.3.4 per ciascuna delle soluzioni e le durate corrispondenti come indicato nel protocollo di decellularizzazione nella Tabella 2.
- Dopo la fase finale di risciacquo con PBS + antibiotici /antimicotici (fase 20 della Tabella 2), trasferire i tessuti in piastre sterili a 6 pozzetti con PBS fresco + antibiotici / antimicotici e incubare a 37 °C per 48 ore.
NOTA: Dopo la sterilizzazione con antibiotici/antimicotici, gli scaffold del tessuto polmonare possono essere seminati immediatamente o conservati a 4 °C per un massimo di 30 d.
4. Slice Recellularizzazione e coltura
NOTA: la Figura 2 mostra una linea temporale proposta per la semina e la coltura dei tessuti, in cui le fette vengono seminate prima con cellule endoteliali microvascolari polmonari di ratto e coltivate in mezzo endoteliale a basso siero; quindi seminato con AEC2 di ratto e fibroblasti polmonari di ratto con un mezzo di crescita AEC2 privo di siero (adattato da Jacob et al.13 e You et al.35); vedere le note aggiuntive sulle sorgenti cellulari utilizzate in Risultati e dettagli sui terreni di coltura nella Tabella 3. Questa strategia produce strutture alveolari contenenti monostrati AEC2.
- Preparazione di scaffold tissutali per la semina (Giorno -4 o -3)
- Se si utilizzano scaffold tissutali conservati a 4 °C, incubare gli scaffold durante la notte a 37 °C con PBS fresco + antibiotici/antimicotici (10% penicillina/streptomicina, 4% amfotericina B, 0,4% gentamicina in PBS) prima della semina.
- Risciacquare gli scaffold 3x con PBS sterile (5 ml/pozzetto), 5 min ciascuno.
- Esaminare gli scaffold al microscopio a contrasto di fase con ingrandimento 5x per selezionare i tessuti da seminare.
NOTA: Le migliori impalcature per la semina non hanno strappi o buchi e non contengono grandi vie aeree o vasi. Mentre le impalcature con le caratteristiche possono essere seminate con successo, i modelli di ripopolamento possono differire da quelli osservati nelle aree alveolari.
- Semina a cellule endoteliali (Giorno -3)
- Contare le cellule endoteliali usando un emocitometro e preparare la sospensione cellulare endoteliale in mezzo endoteliale (vedere Tabella 3) a 5 x 106 cellule/mL, con cellule sufficienti per seminare 500.000 cellule endoteliali per fetta (ad esempio, per 12 fette, rieseguire 6 x 106 cellule in mezzo da 1,2 ml).
- Posizionare i bagni di semina autoclavati in piastre di Petri da 100 mm. Trasferire le impalcature risciacquate a testa in giù ai bagni di semina: utilizzare un emostato curvo fine per afferrare una cassetta dai lati dentellati, utilizzare un emostato dritto o una pinza per afferrare un'estremità della cassetta (facendo attenzione a non toccare il tessuto stesso) e capovolgere, quindi afferrare nuovamente la cassetta con le punte dell'emostato curvo fine attraverso i fori lungo i lati dentellati, e mettere in un bagno di semina bene. Ripetere l'operazione per le cassette rimanenti.
NOTA: Se posizionati correttamente, le impalcature saranno centrate, capovolte, nella parte inferiore di ciascun pozzetto. Se necessario, premere delicatamente sull'angolo della cassetta con le punte di un emostato per assicurarsi che la cassetta sia posizionata piatta nel pozzetto. Una seduta impropria della cassetta può portare a una scarsa semina dei tessuti. È accettabile se il pozzo contiene una piccola quantità di PBS. - Ruotare delicatamente la sospensione cellulare preparata per mescolare, quindi utilizzare una pipetta manuale per pipettare cellule da 100 μL direttamente sopra ciascun tessuto alla base del pozzo, facendo attenzione a non danneggiare il tessuto con la punta della pipetta.
- Trasferire i tessuti seminati all'incubatore di colture cellulari a 37 °C/5% CO2.
- Dopo 2 ore, aggiungere 900 μL di terreno di coltura preriscaldato a ciascun pozzetto utilizzando una pipetta manuale, quindi tornare all'incubatore. Se una cassetta diventa spodestata (galleggia) dopo l'aggiunta del mezzo, premere delicatamente sull'angolo della cassetta con la punta della pipetta in modo che si trovi piatta nel pozzetto.
- Cambia media il giorno -2. Rimuovere il mezzo inclinando la capsula di Petri e pipettando manualmente con una punta di pipetta leggermente posizionata nell'angolo del pozzetto, in modo da non disturbare la cassetta. Sostituire con 1 mL di mezzo endoteliale fresco per pozzetto.
- AEC2 e semina dei fibroblasti e coltura tissutale (Giorno 0)
- Contare AEC2 e fibroblasti utilizzando un emocitometro. Preparare una sospensione cellulare 1:1 di AEC2 e fibroblasti nel mezzo di crescita AEC2 (mezzo base epiteliale + integratori AEC2; vedere Tabella 3) a 5 x 106 cellule totali/ml, con cellule sufficienti per seminare 500.000 cellule (250.000 AEC2 e 250.000 fibroblasti) per fetta (ad esempio, per 12 fette, risospese 3 x 106 AEC2 + 3 x 106 fibroblasti insieme in 1,2 mL di terreno).
- Pipettare il mezzo da ciascun pozzetto del bagno di semina come descritto al punto 4.2.6. Ruotare delicatamente la sospensione cellulare preparata per mescolare, quindi pipettare 100 μL di cellule direttamente sopra ciascun tessuto alla base del pozzo.
NOTA: è accettabile se una piccola quantità di mezzo endoteliale rimane nel pozzo prima della semina AEC2/fibroblasti. - Trasferire i tessuti seminati all'incubatore di colture cellulari a 37 °C/5% CO2.
- Dopo 2 ore, aggiungere 900 μL di terreno di crescita AEC2 preriscaldato a ciascun pozzetto, quindi tornare all'incubatore.
- Dopo 24 ore di coltura (giorno 1), preparare una piastra a 12 pozzetti con 1 mL di terreno di coltura AEC2 preriscaldato per pozzetto per cassetta.
- Pipetta 800 μL di mezzo da ciascun pozzetto del bagno di semina. Rimuovere le cassette dal bagno di semina: afferrare ciascuna con un emostato curvo fine attraverso i fori lungo i lati dentellati, trasferire su un emostato dritto o una pinza per afferrare la cassetta a un'estremità e capovolgere, quindi utilizzare l'emostato curvo per afferrare la cassetta attraverso i lati dentellati e trasferire il lato destro verso l'alto, uno per pozzetto, alla piastra a 12 pozzetti preparata.
- Cambiare il terreno di coltura nella piastra a 12 pozzetti a giorni alterni fino al giorno 7 o per la lunghezza desiderata della coltura: utilizzare una pipetta pasteur di vetro per aspirare il mezzo da ciascun pozzetto, facendo attenzione a non toccare il tessuto; pipetta in 1 mL di terreno di crescita fresco AEC2 per pozzetto.
NOTA: Il grado di ripopolamento dei tessuti può essere monitorato tramite microscopia a contrasto di fase con ingrandimento 5x per tutta la durata della coltura.
5. Prelievo di tessuti e analisi dei campioni
- Per fissare gli ELT per l'istologia e la colorazione immunofluorescente, trasferire le cassette di coltura tissutale al 10% di formalina tamponata neutra e incubare per 3-4 ore a temperatura ambiente su un bilanciere. Rimuovere i tessuti dalle cassette utilizzando la punta di una pinza a punta fine per tagliare il tessuto dove incontra le linguette. Elaborare il tessuto secondo metodi di routine per l'incorporamento di paraffina e l'istologia; non sono richieste tecniche specializzate.
- Per elaborare gli ELT per la qRT-PCR, sciacquare i tessuti in cassette in PBS 2x, quindi rimuovere i tessuti e congelare a scatto o procedere con la lisi per l'estrazione dell'RNA.
NOTA: Raggruppare almeno 2 fette seminate con 1 x 106 cellule e coltivate per 7 giorni dovrebbe produrre un ampio RNA per l'analisi PCR a valle.
Risultati
Una panoramica del processo di generazione dei PFU - che comprende l'affettamento polmonare, il taglio e la decellularizzazione delle fette e il ripopolamento delle impalcature - è presentata nella Figura 3. Gli ELT qui presentati sono stati coltivati utilizzando cellule endoteliali microvascolari polmonari di ratto primarie (vedi Tabella dei materiali), AEC2 di ratto neonatale e fibroblasti polmonari di ratto neonatali arricchiti con lipofibroblasti36. Gli AEC2 sono stati appena isolati tramite smistamento magnetico a base di perline come descritto in precedenza37; protocolli di isolamento alternativi sono stati dettagliati e discussi altrove 38,39,40. La purezza degli AEC2 isolati di ratto può essere valutata tramite citometria a flusso per il marcatore di superficie AEC2 specifico per ratto RTII-7041, o tramite colorazione di un campione di cellule citocentrifughe per RTII-70 o proteina C pro-tensioattiva (pSPC). I fibroblasti polmonari di ratto sono stati isolati dai cuccioli di ratto postnatale giorno 7-9 secondo un adattamento di un protocollopubblicato 42 e utilizzato al passaggio 1-2; protocolli di isolamento alternativi sono stati descritti altrove43,44. La purezza dei fibroblasti isolati può essere valutata attraverso la colorazione di cellule in coltura o citocentrifughe per la vimentina marcatore mesenchimale e l'arricchimento dei lipofibroblasti può essere valutato tramite colorazione per Oil Red O45.
Quando il tessuto polmonare è uniformemente gonfiato con agarosio e pezzi di tessuto strategicamente selezionati e orientati per l'affettamento in modo da massimizzare l'area totale e parenchimale del tessuto, un polmone di ratto può produrre tessuto per PFU alveolari >100. Le strisce di PCLS mostrano un'integrità meccanica sufficiente per essere agganciate in cassette di tessuto con pochi (<5%) casi di strappo (Figura 3B).
Il protocollo per la decellularizzazione delle fette polmonari è strettamente basato sul nostro protocollo di decellularizzazione dell'intero polmone precedentemente pubblicato, che per proteomica quantitativa ha dimostrato di preservare molti componenti ECM a livelli non significativamente diversi da quelli del polmone nativo22. Gli scaffold a fette decellularizzati preservano l'architettura nativa degli alveoli, come visto dalla colorazione di ematossilina ed eosina (H & E) (Figura 4A, B) e dalla microscopia a contrasto di fase (Figura 4C). In genere escludiamo le impalcature contenenti grandi vie aeree o vasi (Figura 4D) o lacrime, anche se i primi possono essere inclusi se sono di interesse per il ricercatore. La decellularizzazione porta ad una riduzione del 96% del contenuto di DNA tissutale misurato mediante un test per il DNA a doppio filamento (vedere Tabella dei materiali; 0,50 μg/mg ± 0,073 μg/mg vs 0,018 μg/mg ± 0,0035 μg/mg nel tessuto nativo vs decellularizzato, rispettivamente, ± media) (Figura 5A), senza DNA visibile mediante colorazione ematossilina (Figura 4B). La colorazione istologica e immunofluorescente degli scaffold decellularizzati rivela il mantenimento delle proteine ECM collagene, elastina, collagene IV e laminina con architettura e quantità simili a quelle delle fette polmonari native (Figura 5B-E). Si noti che i nuclei dei tessuti nativi si colorano di blu / nero con macchie di tricomi (per il collagene) ed EVG (per l'elastina). La colorazione immunofluorescente è stata eseguita come descritto in precedenza, utilizzando metodi standard per la colorazione dei tessuti37. Gli anticorpi utilizzati e le rispettive concentrazioni sono elencati nella Tabella 4.
Il successo del ripopolamento dell'impalcatura porta a PFU altamente cellulari dopo 7 giorni, con un modello di ripopolamento alveolare visibile al microscopio ottico (Figura 6A-C). In alcuni casi, con una cellularità molto elevata, possono essere visibili strutture di tipo organoide (Figura 6A,B). La semina tissutale non riuscita può essere visualizzata mediante microscopia a contrasto di fase durante la coltura (Figura 6C). Dopo aver coltivato scaffold tissutali con AEC2, fibroblasti e cellule endoteliali, i PFU vengono densamente ripopolati con strutture alveolari che comprendono tutte e tre le linee cellulari (Figura 6D, E). Al giorno 7 o 8, gli AEC2 mantengono la morfologia cuboidale ed esprimono la proteina B tensioattiva (SPB) e la proteina del corpo lamellare ABCA3, senza evidenza di differenziazione significativa in AEC1 (Figura 6E, F). Gli AEC2 sono altamente proliferativi nei PFU, come dimostrato dall'incorporazione di 5-etinil-2'-deossiuridina (EdU) a seguito di un impulso di 2 ore a 10 μM (Figura 6G).
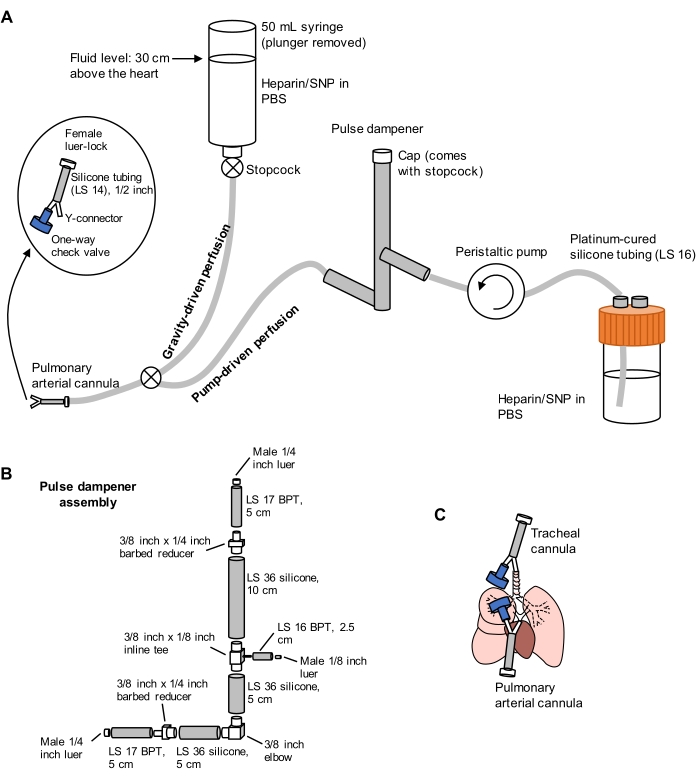
Figura 1: Schema del sistema di perfusione per l'estrazione e la pulizia polmonare. (A) Il sistema di perfusione comprende un arto guidato dalla gravità, utilizzato per la cannulazione iniziale dell'arteria polmonare sotto flusso; e un arto azionato da una pompa, utilizzato per liberare i polmoni in modo efficiente dopo la cannulazione iniziale. La linea della pompa include un "smorzatore di impulsi" che smorza i picchi di pressione causati dalla pompa. Il design delle cannule arteriose tracheali e polmonari è dettagliato a sinistra. SNP = nitroprussiato di sodio. (B) Dettagli del gruppo smorzatore di impulsi. BPT e silicone si riferiscono a tipi di tubi. (C) Posizioni delle cannule arteriose tracheali e polmonari posizionate durante l'estrazione polmonare. Fare clic qui per visualizzare una versione più grande di questa figura.
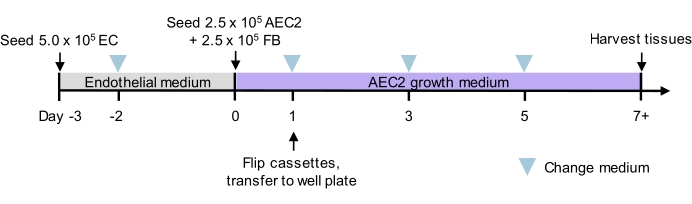
Figura 2: Sequenza temporale della cultura per la ricellularizzazione del tri-lignaggio. Tempistica proposta per la semina e la coltura del PFU tri-lignaggio, compresi i tempi di semina a due fasi. Sono indicati i numeri di cella per la semina e il terreno di coltura per ogni fase. Vedere i dettagli dei media culturali nella tabella 3. AEC2 = cellula epiteliale alveolare di tipo 2. EC = cellula endoteliale. FB = fibroblasti. Fare clic qui per visualizzare una versione più grande di questa figura.
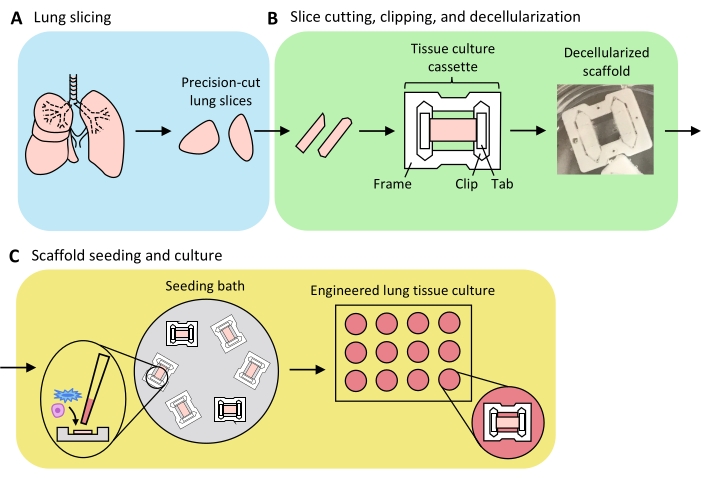
Figura 3: Schema della preparazione del tessuto polmonare ingegnerizzato. (A) Il tessuto polmonare nativo viene tagliato a fette usando un vibratoma. (B) Le fette polmonari tagliate con precisione vengono tagliate in strisce standardizzate larghe 3 mm, tagliate in cassette di coltura tissutale in politetrafluoretilene (PTFE) e decellularizzate con detergente per produrre scaffold a matrice extracellulare acellulare. (C) Gli scaffold vengono riseminati in bagni di semina specializzati che limitano l'area di semina all'area del tessuto e quindi coltivati in un piatto di pozzo standard. Fare clic qui per visualizzare una versione più grande di questa figura.
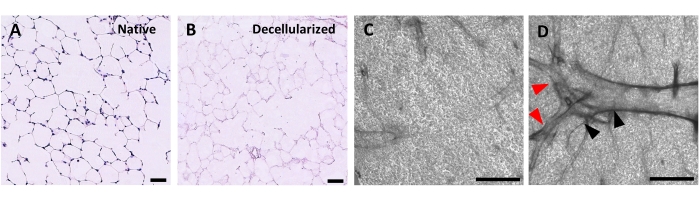
Figura 4: Struttura degli scaffold polmonari decellularizzati. Colorazione H&E di fette polmonari native (A) e decellularizzate (B) che mostrano la conservazione dell'architettura alveolare dopo la decellularizzazione. (C,D) Esempi di scaffold ECM decellularizzati osservati con ingrandimento 5x mediante microscopia a contrasto di fase, comprendenti prevalentemente tessuto alveolare (C) o contenenti grandi vie aeree e vasi ramificati (D, punte di freccia nere e rosse). Barre di scala, 50 μm (A,B); 500 μm (C,D). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Rimozione del DNA e conservazione della matrice in scaffold polmonari decellularizzati. (A) Quantificazione del DNA in fette polmonari native e decellularizzate (media ± SEM, n = 5). Test t di Welch, **P < 0,01. Decell = decellularizzato. (B,C) Colorazione istologica di fette polmonari native e decellularizzate per collagene (B) ed elastina (C). Punte di freccia, elastina conservata in anelli d'ingresso alveolari di tessuto decellularizzato. (D,E) Colorazione immunofluorescente di fette polmonari native e decellularizzate per collagene IV (D) e laminina (E). Barre di scala, 50 μm. In tutti i pannelli, le caselle tratteggiate delineano l'area dell'immagine che viene ingrandita a destra in ciascun pannello. Fare clic qui per visualizzare una versione più grande di questa figura.
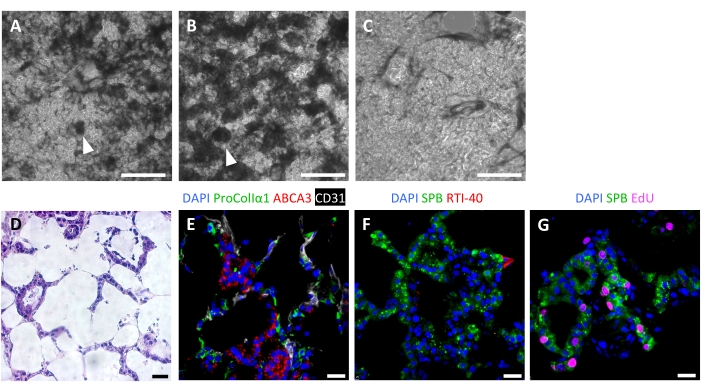
Figura 6: Ripopolamento cellulare di tessuti polmonari ingegnerizzati. (A-C) Esempi di PFU ricellularizzati il giorno 7 della coltura, come visualizzato durante la coltura mediante microscopia a contrasto di fase. Il modello di ricellularizzazione rispecchia la struttura alveolare del tessuto. In alcune aree ad alta cellularità, possono formarsi strutture organoidiche (punte di freccia). (A) e (B) rappresentano un ripopolamento cellulare di successo, mentre (C) rappresenta uno scarso livello di ricellularizzazione dopo 7 giorni di coltura. (D-G) Colorazione di PFU ricellularizzati il giorno 7 o 8 della coltura. (D) Colorazione H&E che mostra il ripopolamento cellulare dei setti alveolari. (E) Le etichette coloranti immunofluorescenti hanno innestato fibroblasti proCollagenIα1+ , ABCA3+ AEC2 e cellule endoteliali CD31+ . (F) I tessuti contengono abbondanti SPB+ AEC2 ma pochi RTI-40 (podoplanina)+ AEC1 in queste condizioni. (G) Molti AEC2 stanno proliferando nei PFU, come misurato dall'incorporazione di EdU. Barre di scala, 500 μm (A-C); 25 μm (D-G). Fare clic qui per visualizzare una versione più grande di questa figura.
Tabella 1: Soluzioni di decellularizzazione. Dettagli di preparazione per soluzioni di decellularizzazione. Fare clic qui per scaricare questa tabella.
Tabella 2: Protocollo di decellularizzazione. Dettagli del protocollo per la decellularizzazione delle fette polmonari. Fare clic qui per scaricare questa tabella.
Tabella 3: Mezzi di coltura. Dettagli di preparazione per i mezzi di crescita endoteliali e AEC2. Fare clic qui per scaricare questa tabella.
Tabella 4: Anticorpi usati per l'immunocolorazione. Dettagli degli anticorpi e delle loro concentrazioni utilizzate per l'immunocolorazione. Fare clic qui per scaricare questa tabella.
Fascicolo complementare 1: Progettazione per il taglio laser di telai per cassette per colture tissutali. Fare clic qui per scaricare questo file.
Fascicolo complementare 2: Progettazione per il taglio laser di clip per cassette per colture tissutali. Fare clic qui per scaricare questo file.
Fascicolo complementare 3: Progettazione per il taglio laser di schede di cassette per colture tissutali. Fare clic qui per scaricare questo file.
Fascicolo complementare 4: File CAD per la semina della base dello stampo del bagno. Fare clic qui per scaricare questo file.
Fascicolo complementare 5: File CAD per la semina dell'anello dello stampo del bagno. Fare clic qui per scaricare questo file.
Discussione
Questo documento descrive l'uso di fette polmonari decellularizzate tagliate con precisione come piattaforma per generare tessuti polmonari ingegnerizzati in vitro, che contengono strutture alveolari multi-lineage. Combinando le strategie che abbiamo precedentemente sviluppato per ripopolare gli scaffold polmonari ECM acellulari ad alta fedeltà per l'ingegneria polmonare intera22,31, con il nostro robusto sistema per la coltura di tessuti cardiaci ingegnerizzati su piccola scala30, questo protocollo consente l'uso di ECM polmonare fisiologicamente rilevante come substrato di coltura tissutale, in modo ripetibile e moderatamente produttivo.
I metodi qui presentati descrivono in dettaglio la preparazione dell'impalcatura del PFU dai polmoni di ratto, che sono facilmente raggiungibili, possono essere estratti in blocco con accesso diretto alle vie aeree intatte per il gonfiaggio dell'agarosio e sono di dimensioni maggiori rispetto al polmone di topo. Tuttavia, qualsiasi tessuto polmonare che può essere gonfiato con agarosio e produrre fette di almeno 9 mm di lunghezza può essere utilizzato all'interno di questo sistema. Indipendentemente dalla fonte tissutale, l'inflazione uniforme del tessuto polmonare con agarosio è il passo più critico per garantire il successo dell'affettamento, del taglio e della manipolazione dei tessuti a valle. Il tessuto polmonare sottogonfiato tende a non affettare in modo pulito, mentre il tessuto sovragonfiato può lacerarsi durante il clipping. Dopo la gelificazione dell'agarosio, le regioni tissutali opportunamente gonfiate sono sode ma forniscono un po 'di dare quando vengono premute delicatamente con una pinza. Per i polmoni di ratto intatti, abbiamo scoperto che il pre-gonfiaggio dei polmoni estratti con l'aria più volte, seguito dal gonfiaggio dell'agarosio il prima possibile dopo l'estrazione, si traduce nei migliori risultati di affettamento e nella migliore qualità delle impalcature tissutali risultanti. Il volume appropriato di agarosio deve essere ottimizzato empiricamente; per un polmone di ratto il volume necessario per gonfiare il polmone alla capacità polmonare totale è di circa 30 ml/kg di massa animale (ad esempio, 10,5 mL di agarosio per i polmoni di un ratto da 350 g). Per i tessuti polmonari resecati più grandi con accesso alle vie aeree meno diretto (come quelli provenienti da donatori umani), potrebbe essere necessaria una risoluzione dei problemi aggiuntiva per gonfiare il tessuto attraverso un bronco32. Durante il successivo taglio polmonare, la selezione e l'orientamento del tessuto sullo stantuffo è un altro passo importante per 1) garantire che le fette siano abbastanza grandi da generare strisce di tessuto che possono essere ritagliate in cassette di coltura tissutale e 2) massimizzare l'area del tessuto parenchimale (alveolare), escluse le grandi vie aeree o vasi.
Il clip del PCLS in cassette di coltura tissutale può essere inizialmente un passo impegnativo, ma le cassette semplificano notevolmente la gestione dei tessuti durante la decellularizzazione e la semina. Due potenziali problemi che possono sorgere sono la lacerazione dei tessuti (durante il processo di ritaglio o durante la decellularizzazione) o il posizionamento dei tessuti nelle clip che si traduce in una scarsa semina a valle (ad esempio, nessuna semina o semina solo alle estremità). Lo strappo può essere il risultato di un'eccessiva inflazione di agarosio, di un eccessivo allungamento del tessuto durante l'inserimento della linguetta o di lasciare troppo poca sporgenza per fornire un'adeguata presa del tessuto durante l'inserimento delle linguette. Si noti che le fette che si strappano a un'estremità della clip possono essere seminate con successo, tuttavia, sono difficili da visualizzare al microscopio durante la coltura poiché il tessuto non è piatto. Una scarsa semina dei tessuti (come quella nella Figura 6C) è probabilmente il risultato della fetta che non giace piatta tra le due clip, e quindi fa scarso contatto con la base del bagno di semina bene quando capovolta. Un'altra possibile causa è la posizione impropria della cassetta sul fondo del pozzo del bagno di semina. In termini di clipping, applicare un po 'più di tensione nel tessuto quando si posiziona la seconda clip per aiutarla a rimanere piatta. Alcune fette hanno una leggera concavità; in questi casi agganciare la fetta con il lato convesso verso l'alto. Con la pratica, in genere sperimentiamo la semina fallita con meno del 2% delle fette.
Una limitazione di questo protocollo è il requisito per alcune attrezzature specializzate - una taglierina laser e una stampante 3D - per generare i materiali iniziali per la preparazione del PFU. Tuttavia, una volta create le cassette di coltura dei tessuti e i bagni di semina, non sono necessari materiali speciali aggiuntivi. Le fasi di affettamento polmonare e decellularizzazione della preparazione dell'impalcatura del PFU sono moderatamente dispendiose in termini di tempo; tuttavia, questi passaggi possono essere eseguiti in anticipo o in numero sufficiente per prepararsi a più esperimenti contemporaneamente. Molti PCLS (>100 se ottimizzati per le regioni parenchimali) possono essere tagliati da un singolo polmone e congelati a scatto per un uso successivo. Mentre un singolo ciclo di congelamento-disgelo può causare danni ultrastrutturali minori all'ECM46, anche più cicli di congelamento-disgelo hanno dimostrato di non causare una perdita significativa in ECM 23,47. PCLS può anche essere tagliato e decellularizzato prima di un esperimento, da utilizzare entro un mese. (In particolare, il protocollo di decellularizzazione descritto può essere realizzato in circa 6 ore, il che rappresenta un vantaggio significativo rispetto ai metodi precedentemente descritti che richiedono un giorno o più27,28.) Una volta preparate le impalcature, il processo di semina cellulare è semplice e veloce e la coltura dei PFU non richiede tecniche specializzate.
Un avvertimento del metodo ELT descritto è la mancanza di semina specifica per regione, cioè la consegna di AEC2 specificamente allo spazio alveolare, o cellule endoteliali specificamente allo spazio vascolare. Tuttavia, sebbene le cellule siano semplicemente seminate sopra le impalcature tissutali, il modello di ricellularizzazione non è casuale, con una parvenza di organizzazione alveolare, compresi gli anelli epiteliali. Sospettiamo che le interazioni cellula-cellula, così come le differenze locali nella composizione e nella geometria dell'ECM20,21, contribuiscano probabilmente ai modelli di ricellularizzazione osservati. A sostegno di questa ipotesi, uno studio precedentemente pubblicato, in cui i fibroblasti sono stati seminati non specificamente su fette polmonari decellularizzate, ha dimostrato che il modello di ripopolamento dei tessuti e i fenotipi cellulari associati variavano significativamente in base alla regione tissutale microscopica e alla fonte di scaffold ECM (ad esempio, sano contro malato)27. I fibroblasti sono stati anche osservati invadere l'interstizio - la posizione in cui risiedono nel tessuto polmonare nativo 1,27. Il metodo alternativo primario che possiamo immaginare per coltivare cellule su fette polmonari in un modo veramente specifico per regione comporterebbe la semina di polmoni decellularizzati intatti attraverso le vie aeree31,48 e i compartimenti vascolari49,50, e quindi affettare il tessuto recellularizzato. Tuttavia, questa alternativa 1) è significativamente più costosa, dispendiosa in termini di costi, tempo e risorse; 2) è un throughput inferiore; 3) richiede un aumento del numero di animali; e 4) è associato ad un aumentato rischio di contaminazione a causa delle sfide dell'intera coltura polmonare e della successiva affettatura del polmone seminato. Pur non ricapitolando tutti gli aspetti dell'organizzazione cellulare nativa, la piattaforma ELT consente la coltura di cellule polmonari su un substrato ECM fisiologicamente rilevante, in un modo accessibile a molti più laboratori.
La flessibilità del sistema ELT è un grande vantaggio di questa piattaforma e dovrebbe consentire la coltura di tessuti polmonari su piccola scala con qualsiasi numero di scaffold, cellule o terreni di coltura di interesse. L'uso di scaffold derivati da tessuto malato o da modelli di lesioni può consentire lo studio delle interazioni cellula-cellula o cellula-matrice nel contesto di ECM 27,29,51 alterato dalla malattia. Tuttavia, si noti che potrebbe essere necessario adattare il protocollo di decellularizzazione per tenere conto delle differenze di matrice tra le specie52. La strategia di semina descritta può essere utilizzata per qualsiasi tipo di cellula e la tempistica di coltura adattata per soddisfare le esigenze del ricercatore. Come punto di partenza, 1 x 106 cellule per impalcatura dovrebbe produrre un tessuto altamente cellulare entro 7 giorni dalla coltura, mentre 1 x 105 cellule totali provocano una scarsa cellularità. In qualsiasi adattamento della linea temporale, le cassette di coltura tissutale devono essere rimosse dal bagno di semina 24 ore dopo l'ultima semina del tessuto. Qui, con l'obiettivo di modellare parte della complessità cellulare dell'alveolo polmonare, descriviamo una strategia di ricellularizzazione in tri-coltura che supporta il mantenimento di AEC2 neonatali ben differenziati in strutture alveolari per almeno 7 giorni. I nostri risultati dimostrano anche il successo dell'attecchimento sia dei fibroblasti che delle cellule endoteliali all'interno degli ELT, sottolineando l'ampia applicabilità del substrato di coltura e la sua idoneità per gli studi di co-coltura. La semina di cellule adulte in PFU può facilitare la modellazione di strutture alveolari più quiescenti, mentre la semina di AEC2 umani derivati da PSC, compresi quelli con modificazioni genetiche, potrebbe facilitare studi traslazionali di malattie umane13,53. In generale, l'approccio bottom-up abilitato dalla piattaforma ELT presenta l'opportunità di indagare i contributi di particolari tipi di cellule alle letture di interesse - come la proliferazione AEC2 o lo stato di differenziazione.
In sintesi, questo protocollo delinea un robusto sistema per la generazione di tessuti polmonari ingegnerizzati per studi di co-coltura di AEC2, fibroblasti e cellule endoteliali all'interno di scaffold acellulari di fette polmonari ECM. Gli ELT rappresentano una nuova strategia di coltura 3D per gli AEC2 primari, che fino ad oggi si sono tipicamente basati su matrici di tipo gel meno fisiologiche per mantenere un fenotipo 6,11,12 ben differenziato. L'attuale piattaforma si basa su precedenti lavori nel ripopolamento di fette polmonari decellularizzate 24,25,26,27,28,29, ma offre diversi vantaggi: 1) un sistema di cassette per colture tissutali per facilitare la gestione dei PFU durante la decellularizzazione, la semina e la coltura; 2) un bagno di semina personalizzato per seminare con precisione un numero noto di cellule su ogni impalcatura della fetta; e 3) una strategia di risemina tricoltura che consente il ripopolamento del tessuto alveolare con cellule epiteliali, mesenchimali ed endoteliali. Pertanto, gli ELT rappresentano un importante passo avanti verso la creazione di modelli riproducibili in vitro che catturano la complessità cellulare e del substrato dell'alveolo nativo e della nicchia delle cellule staminali AEC2.
Divulgazioni
L.E.N. è fondatore e azionista di Humacyte, Inc, che è una società di medicina rigenerativa. Humacyte produce vasi sanguigni ingegnerizzati da cellule muscolari lisce allogeniche per la chirurgia vascolare. Il coniuge di L.E.N. ha equità in Humacyte e L.E.N. fa parte del Consiglio di amministrazione di Humacyte. L.E.N. è un inventore di brevetti concessi in licenza a Humacyte e che producono royalties per L.E.N. L.E.N. ha ricevuto un dono di ricerca illimitato per sostenere la ricerca nel suo laboratorio a Yale. Humacyte non ha influenzato la condotta, la descrizione o l'interpretazione dei risultati di questo rapporto.
Riconoscimenti
Gli autori desiderano ringraziare Lorenzo Sewanan e Jorge Nunez per il loro lavoro di sviluppo del design della cassetta di coltura tissutale utilizzato in questo protocollo, il laboratorio Kaminski per l'uso del loro vibratoma, Maurizio Chioccioli e Jessica Nouws per l'assistenza con l'affettamento polmonare, Allie LaRocco per l'assistenza con gli esperimenti pilota iniziali e Hong Qian per l'attenta lettura del protocollo. Questo lavoro è stato supportato dalle sovvenzioni NIH F30HL143880 (K.L.L.), dal Medical Scientist Training Program Training Grant T32GM136651 (K.L.L.) e U01HL145567 (L.E.N.); e da un dono di ricerca senza restrizioni da Humacyte Inc. (L.E.N.).
Materiali
| Name | Company | Catalog Number | Comments |
| 3D Printer: Form 2 | Formlabs | ||
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | |
| 8-Bromo cAMP | Sigma | B7880 | |
| Agarose, UltraPure LMP | Invitrogen | 15517-014 | |
| Amphotericin B | Sigma | A2942 | |
| Barbed reducer fitting, 3/8 inch x 1/4 inch | McMaster-Carr | 5121K271 | |
| Benzonase nuclease | Sigma | E1014 | |
| Bovine serum albumin (BSA) Fraction V | Gemini | 700-104P | For AEC2 growth medium |
| Bovine serum albumin (BSA), standard grade | Gemini | 700-100P | For benzonase buffer |
| Check valve, polypropylene, 1/8 inch hose barb | Cole-Parmer | SK-98553-10 | |
| CHIR99021 | PeproTech | 2520691 | |
| Clear Resin, 1 L | Formlabs | RS-F2-GPCL-04 | |
| Cyanoacrylate glue, such as Krazy Maximum Bond Permanent Glue | Any hardware, craft, or drug store | KG483 or similar | |
| Dexamethasone | Sigma | D4902 | |
| DMEM (low glucose) | Gibco | 11885-084 | |
| DMEM (high glucose) | Gibco | 11965-092 | |
| DNA assay (Quant-iT PicoGreen dsDNA Assay Kit) | Invitrogen | P7589 | |
| EDTA, 0.5 M, pH 8.0 | AmericanBio | AB00502-01000 | |
| EdU kit (Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647) | Invitrogen | C10340 | Used according to manufacturer's directions |
| Elbow fitting, 3/8 inch | McMaster-Carr | 5121K907 | |
| F12 | Gibco | 11765-054 | |
| Fetal bovine serum (FBS), characterized | Hyclone | SH30071.03 | |
| Gentamicin sulfate | Gemini | 400-100P | Reconstituted in diH2O for a stock solution at 50 mg/mL |
| Hair clippers | Wahl | MiniArco | |
| Hank's balanced salt solution (HBSS), Phenol Red Free | Gibco | 14175-095 | |
| Heparin sodium injection, USP, 1000 U/mL | Sagent | NDC: 25021-400-30 | For intraperitoneal and intracardiac injection |
| Heparin sodium salt | Sigma | H4784 | For pulmonary artery perfusion; prepare stock solution at 100 U/mL in PBS |
| HEPES Buffer | Corning | 25-060-Cl | |
| Inline tee fitting, 3/8 inch x 1/8 inch | McMaster-Carr | 5121K851 | |
| Inoculating loop, disposable | Fisherbrand | 22-363-600 | |
| Insulin from bovine pancreas | Sigma | I6634 | |
| Ketamine injection, 100 mg/mL | Covetrus (Butler Animal Health) | 010177 | |
| KGF, recombinant human | PeproTech | 100-19 | |
| Laser cutter, VLS 3.50 30 watt | Universal Laser Systems | ||
| L-glutamine | Gibco | 25030-081 | |
| Luer-lock, female, 3/32 inch | Cole-Parmer | 45508-02 | |
| Luer-lock, male, 1/8 inch | Cole-Parmer | 30800-24 | |
| Luer-lock, male, 1/4 inch | McMaster-Carr | 51525K146 | |
| MCDB-131 Complete without serum | VEC Technologies | MCDB-131 WOFBS | |
| Magnesium chloride (MgCl2), 1 M | AmericanBio | AB09006-00100 | |
| NaCl | American Bioananalytical | AB01915 | |
| Phosphate buffered saline (PBS), without Ca2+ and Mg2+, 10X | Sigma | D1408 | Reconstitute to 1X with diH2O |
| Phosphate buffered saline (PBS), with Ca2+ and Mg2+ | Gibco | 21300-058 | |
| PDMS - SYLGARD 184 Silicone Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Penicillin/Streptomycin (10,000 U/mL penicillin/10,000 μg/mL streptomycin) | Gibco | 15140-122 | |
| Petri dish, 150 mm | Falcon | 351058 | |
| Plastic film (parafilm) | Bemis | PM-996 | |
| Pharmed BPT tubing, LS 16 | Masterflex | 06508-16 | |
| Pharmed BPT tubing, LS 17 | Masterflex | 06508-17 | |
| Platinum-cured silicone tubing, LS 14 | Masterflex | 96420-14 | |
| Platinum-cured silicone tubing, LS 16 | Masterflex | 96420-16 | |
| Platinum-cured silicone tubing, LS 36 | Masterflex | 96410-36 | |
| Poloxamer 407 (Pluronic F-127) | Sigma | P2443 | |
| Povidone/iodine prep pads, 10% | Dynarex Corporation | 1108 | |
| PTFE sheet, 0.060 inch (1/16 inch) thick | ePlastics | PTFENAT0.060X12X12 | For tissue culture cassette tabs |
| PTFE sheet, 0.093 inch (3/32 inch) thick | ePlastics | PTFENAT0.093X12X12 | For tissue culture cassette frames and clips |
| Peristaltic pump drive: Masterflex L/S Variable-Speed Digital Drive | Cole-Parmer | ZM-07528-30 | |
| Peristaltic pump head: Masterflex L/S Easy-Load II Pump Head | Cole-Parmer | EW-77202-60 | |
| Rat, Sprague Dawley | Charles River | Strain Code: 400 | |
| Razor blade | Any hardware or craft store | Personna 94-120-71 or similar | |
| Retinoic acid | Sigma | R2625 | |
| Rotary blades, 28 mm | Omnigrid | 2046 | |
| Rotary cutter, 28 mm | Olfa | Model 9551 | |
| Sodium deoxycholate (SDC) | Sigma | D6750 | |
| Sodium nitrorusside (SNP) | Sigma | 71778 | |
| Stopcock, 4-way | Edwards | 594WSC | |
| Suture, 4-0 monofilament polypropylene | Covidien | VP-557-X | |
| Syringe, 10 mL | BD | 302995 | |
| Syringe, 50 mL | BD | 309653 | |
| Tissue culture dish, 35 mm | Falcon | 353001 | |
| Tissue culture dish, 100 mm | Corning | 430167 | |
| Tissue culture plate, 6-well | Falcon | 353046 | |
| Tissue culture plate 12-well | Falcon | 353043 | |
| Transferrin human | Sigma | T8158 | |
| Tris, 1 M solution, pH 8.0 | AmericanBio | AB14043-01000 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| Vibratome, Compresstome VF-300-0Z | Precisionary Instruments LLC | ||
| Xylazine, 100 mg/mL | Henry Schein | NDC: 11695-4022-1 | |
| Y-connector, 1/16 inch barbed | Cole-Parmer | 30614-43 |
Riferimenti
- Burri, P. H. Morphology and respiratory function of the alveolar unit. International Archives of Allergy and Applied Immunology. 76, Suppl 1 2-12 (1985).
- Barkauskas, C. E., Noble, P. W. Cellular Mechanisms of Tissue Fibrosis. 7. New insights into the cellular mechanisms of pulmonary fibrosis. American Journal of Physiology. Cell Physiology. 306 (11), 987-996 (2014).
- Taylor, M. S., et al. A Conserved Distal Lung Regenerative Pathway in Acute Lung Injury. American Journal of Pathology. 188 (5), 1149-1160 (2018).
- Carsana, L., et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infectious Diseases. 20 (10), 1135-1140 (2020).
- Basil, M. C., et al. The Cellular and Physiological Basis for Lung Repair and Regeneration: Past, Present, and Future. Cell Stem Cell. 26 (4), 482-502 (2020).
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Desai, T. J., Brownfield, D. G., Krasnow, M. A. Alveolar progenitor and stem cells in lung development, renewal and cancer. Nature. 507 (7491), 190-194 (2014).
- Evans, M. J., Cabral, L. J., Stephens, R. J., Freeman, G. Renewal of alveolar epithelium in the rat following exposure to NO2. The American Journal of Pathology. 70 (2), 1-24 (1973).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Borok, Z., et al. Keratinocyte growth factor modulates alveolar epithelial cell phenotype in vitro: expression of aquaporin 5. American Journal of Respiratory Cell and Molecular Biology. 18 (4), 554-561 (1998).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Sucre, J. M. S., et al. Successful establishment of primary Type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Stem Cell. 21 (4), 472-488 (2017).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nature Methods. 14 (11), 1097-1106 (2017).
- Chen, Y. W., et al. A three-dimensional model of human lung development and disease from pluripotent stem cells. Nature Cell Biology. 19 (5), 542-549 (2017).
- Korogi, Y., et al. In vitro disease modeling of hermansky-pudlak syndrome Type 2 using human induced pluripotent stem cell-derived alveolar organoids. Stem Cell Reports. 12 (3), 431-440 (2019).
- Strikoudis, A., et al. Modeling of fibrotic lung disease using 3D organoids derived from human pluripotent stem cells. Cell Reports. 27 (12), 3709-3723 (2019).
- Bissell, M. J., Hall, H. G., Parry, G. How does the extracellular matrix direct gene expression. Journal of Theoretical Biology. 99 (1), 31-68 (1982).
- Chapman, H. A. Epithelial responses to lung injury: Role of the extracellular matrix. Proceedings of the American Thoracic Society. 9 (3), 89-95 (2012).
- Guilak, F., et al. Control of stem cell fate by physical interactions with the extracellular matrix. Cell Stem Cell. 5 (1), 17-26 (2009).
- Zhou, Y., et al. Extracellular matrix in lung development, homeostasis and disease. Matrix Biology. 73, 77-104 (2018).
- Calle, E. A., et al. Targeted proteomics effectively quantifies differences between native lung and detergent-decellularized lung extracellular matrices. Acta Biomaterialia. 46, 91-100 (2016).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Bonvillain, R. W., et al. A nonhuman primate model of lung regeneration: Detergent-mediated decellularization and initial in vitro recellularization with mesenchymal stem cells. Tissue Engineering Part A. 18 (23-24), 2437-2452 (2012).
- O'Neill, J. D., et al. Decellularization of human and porcine lung tissues for pulmonary tissue engineering. The Annals of Thoracic Surgery. 96 (3), 1055(2013).
- Wagner, D. E., et al. Three-dimensional scaffolds of acellular human and porcine lungs for high throughput studies of lung disease and regeneration. Biomaterials. 35 (9), 2664-2679 (2014).
- Burgstaller, G., et al. Distinct niches within the extracellular matrix dictate fibroblast function in (cell free) 3D lung tissue cultures. American Journal of Physiology-Lung Cellular and Molecular Physiology. 314 (5), 708-723 (2018).
- Sun, H., et al. Fibroblast engraftment in the decellularized mouse lung occurs via a β1-integrin-dependent, FAK-dependent pathway that is mediated by ERK and opposed by AKT. American Journal of Physiology-Lung Cellular and Molecular Physiology. 306 (6), 463-475 (2014).
- Booth, A. J., et al. Acellular normal and fibrotic human lung matrices as a culture system for in vitro investigation. American Journal of Respiratory and Critical Care Medicine. 186 (9), 866-876 (2012).
- Schwan, J., et al. Anisotropic engineered heart tissue made from laser-cut decellularized myocardium. Scientific Reports. 6, 32068(2016).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Gerckens, M., et al. Generation of Human 3D Lung Tissue Cultures (3D-LTCs) for Disease Modeling. Journal of Visualized Experiments. (144), (2019).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465(2017).
- Neuhaus, V., et al. Assessment of the cytotoxic and immunomodulatory effects of substances in human precision-cut lung slices. Journal of Visualized Experiments. (135), e57042(2018).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (6), 1315-1321 (2002).
- Vaccaro, C., Brody, J. S. Ultrastructure of developing alveoli. I. The role of the interstitial fibroblast. The Anatomical Record. 192 (4), 467-479 (1978).
- Calle, E. A., et al. Fate of distal lung epithelium cultured in a decellularized lung extracellular matrix. Tissue Engineering Part A. 21 (11-12), 1916-1928 (2015).
- Dobbs, L. G., Gonzalez, R., Williams, M. C. An improved method for isolating type II cells in high yield and purity. American Review of Respiratory Disease. 134 (1), 141-145 (1986).
- Dobbs, L. G. Isolation and culture of alveolar type II cells. American Journal of Physiology. 258, 134-147 (1990).
- Gonzalez, R. F., Dobbs, L. G. Isolation and culture of alveolar epithelial Type I and Type II cells from rat lungs. Methods in Molecular Biology. 945, 145-159 (2013).
- Dobbs, L. G., Pian, M. S., Maglio, M., Dumars, S., Allen, L. Maintenance of the differentiated type II cell phenotype by culture with an apical air surface. The American Journal of Physiology. 273 (2), 347-354 (1997).
- Bruce, M. C., Honaker, C. E. Transcriptional regulation of tropoelastin expression in rat lung fibroblasts: changes with age and hyperoxia. American Journal of Physiology. 274 (6), 940-950 (1998).
- Berk, J. L., Franzblau, C., Goldstein, R. H. Recombinant interleukin-1 beta inhibits elastin formation by a neonatal rat lung fibroblast subtype. Journal of Biological Chemistry. 266 (5), 3192-3197 (1991).
- Schultz, C. J., Torres, E., Londos, C., Torday, J. S. Role of adipocyte differentiation-related protein in surfactant phospholipid synthesis by type II cells. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (2), 288-296 (2002).
- Maksvytis, H. J., et al. In vitro characteristics of the lipid-filled interstitial cell associated with postnatal lung growth: evidence for fibroblast heterogeneity. Journal of Cellular Physiology. 118, 113-123 (1984).
- Hopkinson, A., et al. Optimization of amniotic membrane (AM) denuding for tissue engineering. Tissue Engineering Part C: Methods. 14 (4), 371-381 (2008).
- Fernandez-Perez, J., Ahearne, M. The impact of decellularization methods on extracellular matrix derived hydrogels. Scientific Reports. 9 (1), 14933(2019).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nature medicine. 16 (8), 927-933 (2010).
- Le, A. V., et al. Efficient and Functional Endothelial Repopulation of Whole Lung Organ Scaffolds. ACS Biomaterials Science & Engineering. 3 (9), 2000-2010 (2017).
- Ren, X., et al. Engineering pulmonary vasculature in decellularized rat and human lungs. Nature Biotechnology. 33 (10), 1097-1102 (2015).
- Wagner, D. E., et al. Comparative decellularization and recellularization of normal versus emphysematous human lungs. Biomaterials. 35 (10), 3281-3297 (2014).
- Balestrini, J. L., et al. Comparative biology of decellularized lung matrix: Implications of species mismatch in regenerative medicine. Biomaterials. 102, 220-230 (2016).
- Alysandratos, K. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636(2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon