Method Article
Technisches Lungengewebe aus dezellularisierten Lungenscheiben
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine Methode zur Erzeugung reproduzierbarer, kleinräumiger künstlicher Lungengewebe, indem dezellularisierte, präzisionsgeschnittene Lungenschnitte mit alveolären Epithel-Typ-2-Zellen, Fibroblasten und Endothelzellen neu besiedelt werden.
Zusammenfassung
Es besteht ein Bedarf an verbesserten 3-dimensionalen (3D) Lungenmodellen, die die architektonische und zelluläre Komplexität des nativen Lungenalveolus ex vivo rekapitulieren. Kürzlich entwickelte Organoidmodelle haben die Expansion und Untersuchung von Lungenepithelvorläufern in vitro erleichtert, aber diese Plattformen basieren typischerweise auf Maustumor-abgeleiteter Matrix und / oder Serum und umfassen nur ein oder zwei zelluläre Linien. Hier beschreiben wir ein Protokoll zur Erzeugung von technisch hergestelltem Lungengewebe (ELTs), das auf der Multi-Lineage-Rezellularisierung von dezellularisierten, präzisionsgeschnittenen Lungenschnitten (PCLS) basiert. ELTs enthalten alveolarähnliche Strukturen, bestehend aus Alveolarepithel, Mesenchym und Endothel, in einem extrazellulären Matrixsubstrat (ECM), das dem der nativen Lunge sehr ähnlich ist. Um das Gewebe zu erzeugen, werden die Lunge der Ratten mit Agarose aufgeblasen, in 450 μm dicke Scheiben geschnitten, in Streifen geschnitten und entzelluliert. Die resultierenden azellulären EZM-Gerüste werden dann mit primären Endothelzellen, Fibroblasten und alveolären Epithel-Typ-2-Zellen (AEC2s) neu gesät. AEC2s können in ELT-Kultur für mindestens 7 Tage mit einem serumfreien, chemisch definierten Wachstumsmedium gehalten werden. Während des gesamten Gewebevorbereitungs- und Kulturprozesses werden die Scheiben in ein Kassettensystem geschnitten, das die Handhabung und standardisierte Zellaussaat mehrerer ELTs parallel ermöglicht. Diese ELTs stellen eine organotypische Kulturplattform dar, die die Untersuchung von Zell-Zell- und Zell-Matrix-Interaktionen innerhalb der Alveole sowie von biochemischen Signalen, die AEC2s und ihre Nische regulieren, erleichtern soll.
Einleitung
Alveolen sind die funktionellen Einheiten der distalen Lunge, die ein Geflecht aus gasaustauschenden Lufträumen umfassen, die von alveolären Epithelzellen (AEC1s) und Typ-2-Zellen (AEC2s) ausgekleidet sind. Dem Epithel liegt ein dichtes Netzwerk von Kapillaren sowie Stützmesenchym zugrunde, die alle durch ein extrazelluläres Matrixgerüst (ECM) gestützt werden, das diesen empfindlichen Luftsäcken sowohl Stärke als auch Flexibilität verleiht1. Die Alveolen sind auch der Ort der Verletzung bei zahlreichen Lungenerkrankungen, einschließlich idiopathischer Lungenfibrose2, akutem Atemnotsyndrom3 und schwerer Coronavirus-Krankheit-19 (COVID-19)4. Obwohl die Arbeit in den letzten zehn Jahren eine bemerkenswerte Plastizität im Lungenepithel aufgedeckt hat, bleiben die Mechanismen, die in einigen Situationen eine distale Lungenreparatur ermöglichen - und die eine Reparatur in anderen ausschließen - ein Bereich intensiver Untersuchungen5. Die Entwicklung verbesserter In-vitro-Plattformen zur Modellierung des Alveolus würde Studien der alveolären Biologie, Regeneration und Therapeutika erleichtern.
AEC2s erneuern sich selbst und differenzieren sich zu AEC1s und gelten somit als primäre Stammzelle der distalen Lunge 6,7,8. Diese Zellen stellen jedoch eine besondere Herausforderung für die In-vitro-Studie dar, da es schwierig ist, primäre AEC2s ohne Verlust des Phänotyps9 zu kultivieren. In konventioneller 2-dimensionaler (2D) Kultur flachen AEC2s ab und übernehmen einige Merkmale von AEC1-ähnlichen Zellen10. Im Gegensatz dazu unterstützen 3D-Kulturstrategien, am häufigsten Organoide, die Aufrechterhaltung differenzierter Merkmale in primären AEC2s 6,11,12 und ermöglichen die langfristige Kultur von pluripotenten Stammzellen (PSC)-abgeleiteten AEC2s13,14. Organoide wurden verwendet, um die distale Lungenentwicklung 15, die Virusinfektion 11,15 und die AEC2-bedingte genetische Erkrankung13,16,17 zu modellieren, was wichtige Einblicke in die Biologie und Regeneration von AEC2 ermöglicht. Diese Kulturmodelle umfassen jedoch typischerweise nur ein oder zwei zelluläre Linien und betten die Zellen in gelartige Matrizen ein, die weder die Architektur noch das ECM-Substrat der nativen Lungenalveole rekapitulieren.
Das ECM ist ein kritischer Regulator des Zellphänotyps und des Verhaltens über molekulare, topologische und mechanische Hinweise; umfasst eine Schlüsselkomponente gewebespezifischer Nischen, die das Stammzellschicksal regeln; und dient als Reservoir, das die Verfügbarkeit von lokal sezernierten Wachstumsfaktoren 18,19,20,21 moduliert. Die Kultivierung von Zellen auf nativem ECM kann somit die Vorhersagefähigkeit von In-vitro-Systemen erhöhen, die Biologie von In-vivo-Geweben zu modellieren. Dezellularisierung, ein Prozess, bei dem Zellmaterial durch Reinigungsmittel, Enzyme oder physikalische oder andere Methoden aus Geweben entfernt wird, kann bei sorgfältiger Durchführung zu einem großen Teil das EZM-Gerüst eines nativen Organs erhalten22,23. Solche Gerüste können mit Zellen für die biomimetische 3D-Kultur wieder bevölkert werden. Während dezellularisierte Gerüste jedoch häufig für Tissue-Engineering-Anwendungen verwendet werden, war ihre Verwendung für die routinemäßige Zellkultur begrenzt. Mehrere frühere Studien haben über die Dezellularisierung und Rezellularisierung von Lungenschnitten oder kleinen Lungengewebesegmenten berichtet. Zusätzlich zu den Proof-of-Concept-Studien 24,25,26 wurden wiederbesiedelte Lungenschnitte verwendet, um die Fibroblasten-Matrix-Adhäsion 27,28 zu untersuchen und die Wirkung erkrankter Lungenmatrizen auf den Fibroblasten-Phänotyp27,29 zu untersuchen. Mit verbesserten Technologien zur Erzeugung von präzisionsgeschnittenen Gewebeschnitten könnten dezellularisierte Lungenschnitte eine bequeme und kleinräumige Plattform bieten, mit der Zellen kultiviert werden können, während Alveolar-, Atemwegs- und Gefäßsubstrukturen erhalten bleiben. Die Einbeziehung mehrerer Zelltypen würde Studien von Zell-Zell-Interaktionen innerhalb einer physiologisch relevanten 3D-Umgebung ermöglichen. Es sind jedoch verbesserte Strategien erforderlich, um die Handhabung von Geweben während des gesamten Kulturprozesses zu erleichtern und eine kontrollierte und reproduzierbare Aussaat von Geweben mit bekannter Anzahl von Zellen sicherzustellen.
Hier stellen wir ein Protokoll zur Erzeugung von künstlich hergestelltem Lungengewebe (ELTs) vor, indem dezellularisierte präzisionsgeschnittene Lungenschnitte (PCLS) mit primären Endothelzellen, AEC2s und Fibroblasten neu besiedelt werden. In einer Adaption unseres zuvor beschriebenen technischen Herzgewebesystems 30 und der Dezellularisierungs-Recellularisierungsstrategien der ganzen Lunge 22,31 beschreiben wir Verfahren zum Schneiden von PCLS aus der Lunge von Ratten und zum Schneidender Scheiben in wiederverwendbare Gewebekulturkassetten, die nachgelagerte Manipulationen vereinfachen und standardisieren. Beschnittene Scheiben werden dezellularisiert, um azelluläre EZM-Gerüste zu bilden, die in maßgeschneiderten Aussaatbädern wieder bevölkert werden. Lungenschnittgerüste bewahren kritische ECM-Komponenten und -Architektur und unterstützen das Wachstum von AEC2s in multi-lineage alveolar-ähnlichen Strukturen für mindestens 7 Tage. ELTs stellen ein neuartiges alveoläres Kokultursystem innerhalb einer physiologisch relevanten 3D-Matrix dar, das die Entwicklung von Lungengewebe-Engineering-Strategien unterstützen und gleichzeitig grundlegende biologische Studien von AEC2s und der Alveole erleichtern soll.
Protokoll
Alle in diesem Papier beschriebenen Tierversuchsverfahren wurden vom Yale Institutional Animal Care and Use Committee genehmigt.
1. Erstellung von Gewebekulturkassetten und Aussaatbädern
HINWEIS: Nach der Herstellung können Gewebekulturkassetten und Aussaatbäder autoklaviert und für wiederholte Runden ELT-Kultur wiederverwendet werden.
-
Gewebekulturkassetten
- Verwenden Sie einen Laserschneider, um Gewebekulturkassettenrahmen und Clips aus 3/32 Zoll dickem Polytetrafluorethylen (PTFE) gemäß den Entwürfen in der Zusatzdatei 1 bzw. der Zusatzdatei 2 zu schneiden. Verwenden Sie einen Laserschneider, um Gewebekulturkassettenlaschen aus 1/16 Zoll dickem PTFE gemäß Supplementary File 3 zu schneiden. Schnittumrisse 3x mit 80% Leistung und 15% Geschwindigkeit (für einen 30 W Laserschneider).
-
Aussaatbäder
- Verwenden Sie die CAD-Dateien des Aussaatbades (Ergänzungsdatei 4 und Zusatzdatei 5), um die Basis bzw. den Ring der Aussaatbadform mit klarem Harz in 3D zu drucken.
- Weichen Sie die Formen in einer Lösung von 10% Poloxamer 407 in destilliertem Wasser über Nacht ein, bevor Sie sie verwenden, um die PDMS-Freisetzung zu unterstützen. An der Luft trocknen lassen, dann den Ring über den Boden der Form legen und in flexible Kunststofffolie wickeln, um ein Auslaufen zu verhindern.
- Bereiten Sie mindestens 60 g Polydimethylsiloxan (PDMS) pro Form vor, indem Sie PDMS-Elastomer im Verhältnis 10: 1 mit Härter mischen und in die 3D-gedruckte Form gießen. Entgasen Sie das PDMS in einem Vakuum-Exsikkator für 30 Minuten, um Luftblasen zu entfernen.
- Aussaatbäder bei 60 °C für 8 h backen.
2. Herstellung von präzisionsgeschnittenen Lungenscheiben aus der Lunge von Ratten
- Organraub
- Bereiten Sie ein Split-Perfusionssystem vor, das schwerkraft- und pumpgetriebene Gliedmaßen umfasst, wie in Abbildung 1 dargestellt. Schließen Sie eine Kanüle der Lungenarterie (PA) an das Ende des Schlauches an, bestehend aus einem 1/16-Zoll-Y-Stecker mit Widerhaken, der an einem LS 14-Silikonschlauch mit einer Länge von 1/2 Zoll befestigt ist, und einem 3/32-Zoll-Luer-Lock-Buchsenanschluss (siehe Abbildung 1). Befestigen Sie zu diesem Zeitpunkt kein Rückschlagventil an der Kanüle.
- Grundierung der Linien mit PBS mit 100 U/ml Heparin und 0,01 mg/ml Natriumnitroprussid (SNP) zur Antikoagulation bzw. Vasodilatation. Stellen Sie die Perfusionspumpe auf 30 ml/min vor.
HINWEIS: Fügen Sie SNP frisch zur Heparinlösung hinzu und schützen Sie es vor Licht. - Einem Erwachsenen (8-12 Wochen alt, ca. 300-350 g) Sprague-Dawley-Ratte mit einer intraperitonealen (IP) Injektion von 400 E/kg Heparin zur Bekämpfung der Koagulation dosieren, gefolgt von einer IP-Injektion von Ketamin (75 mg/kg) und Xylazin (5 mg/kg) zur Anästhesie. Bestätigen Sie eine chirurgische Anästhesieebene durch mangelnde Reaktion auf schädliche Reize (Zehenklemme).
- Schneiden Sie die Brust und den Bauch des Fells mit Haarschneidemaschinen ab. Dann mit 70% Ethanol besprühen und 3x mit 10% Povidon-Jod abwischen.
- Greifen Sie die Haut unterhalb der Höhe des Zwerchfells mit einer Rattenzahnzange. Dann machen Sie einen 1/2 Zoll Querschnitt in der Haut mit einer feinen Schere. Greifen Sie die freiliegende Bauchfaszie mit der Pinzette, machen Sie einen 1/2 Zoll Querschnitt in der Faszie und verlängern Sie dann den Schnitt durch die Haut und Faszie über die Breite des Oberbauchs.
- Verwenden Sie die Spitze der feinen Schere, um einen kleinen Schnitt (nicht mehr als 1/8 Zoll) in der Mitte des vorderen Zwerchfells zu machen, wodurch sich die Lunge im Thorax zurückzieht. Verlängern Sie den Schnitt im Zwerchfell über die gesamte Breite der Brust.
- Machen Sie zwei vertikale Einschnitte durch die volle Höhe des Brustkorbs zum Hals und achten Sie darauf, die Lunge nicht zu beschädigen. Verlängern Sie den Schnitt durch die linken Rippen, um durch das Schlüsselbein und entlang der Seite des Halses auf Höhe des Kehlkopfes zu schneiden, wodurch die Luftröhre freigelegt wird.
- Sezieren Sie die Luftröhre frei von umgebendem Bindegewebe und von der Speiseröhre. Machen Sie einen Querschnitt über die vordere Hälfte der Luftröhre zwischen zwei Knorpelringen in der Nähe des Kehlkopfes. Fädeln Sie eine 4-0-Polypropylennaht hinter der Luftröhre, unterhalb der Höhe des Einschnitts, und binden Sie die erste Hälfte des Knotens eines Chirurgen locker mit zwei Drehungen vor.
- Setzen Sie eine Kanüle, bestehend aus einem 1/16 Zoll Widerhaken-Y-Anschluss, der mit einem Einweg-Rückschlagventil verbunden ist, und einem 1/2 Zoll langen LS 14-Silikonschlauch mit einem 3/32-Zoll-Luer-Lock-Buchsenstecker (siehe Abbildung 1) in die Luftröhre ein, indem Sie ein Glied des Y-Steckers in den Trachealschnitt in Richtung der Lunge einführen.
- Positionieren Sie die vorgebundene Nahtschaufe um die Luftröhre auf Höhe der eingeführten Kanüle und ziehen Sie sie um den eingeführten Y-Stecker fest, um die Kanüle an Ort und Stelle zu befestigen. Fügen Sie zwei Single-Twist-Würfe der Naht hinzu, um den Knoten zu vervollständigen.
- Füllen Sie eine 10 ml Spritze mit Luft und verbinden Sie sie mit dem Luer-Lock der Trachealkanüle.
- Klemmen Sie die untere Hohlvene mit einem gekrümmten Hämostat in die Nähe des Zwerchfells und injizieren Sie dann das Herz mit 150 U Heparin (1000 U / ml) über den rechten Ventrikel (RV).
- Öffnen Sie den Absperrhahn der Schwerkraftlinie teilweise, um ein langsames, aber stetiges Tropfen von PBS/Heparin/SNP aus der in Schritt 2.1.1 vorbereiteten PA-Kanüle zu erzeugen.
- Fädeln Sie die Nadel einer 4-0 Polypropylennaht hinter die Basis der PA, wo sie das RV verlässt. Verwenden Sie die erste Hälfte eines Chirurgenknotens, um eine lose Nahtschnur um die Basis der PA vorzubinden.
- Machen Sie einen kleinen Schnitt (nicht mehr als 1/8 Zoll) im Wohnmobil direkt unter und senkrecht zur PA mit einer feinen Schere und führen Sie dann ein Glied des PA-Kanülen-Y-Steckers in die Basis der PA ein. Befestigen Sie die Naht um das PA und den eingesetzten Stecker und fügen Sie einen Single-Twist-Wurf hinzu, um den Knoten des Chirurgen zu vervollständigen.
HINWEIS: Das Kanülieren des PA-Unterstroms verhindert die Einführung von Luftblasen in das Gefäßsystem, die eine ausreichende Klärung der Lunge verhindern können. - Befestigen Sie ein Einwegventil am anderen Ende des PA-Katheter-Y-Anschlusses und schneiden Sie dann die Spitze des Herzens ab, damit der Blutfluss über den linken Ventrikel fließen kann.
HINWEIS: Wenn die Herzspitze vor dem Eindringen über die Pumpe nicht abgeschnitten wird, kann dies zu einer Schädigung der Blut-Gas-Barriere führen, die zum Austreten von Flüssigkeit in die Lufträume führt. - Schalten Sie die Perfusionsleitung mit dem Absperrhahn, der die beiden Leitungen verbindet, auf die Pumpenseite und schalten Sie die Pumpe dann mit 30 ml/min ein. Während Sie die Lunge über die PA durchbluten, lüften Sie die Lunge manuell über die 10 ml Trachealspritze mit ca. 10-15 Atemzügen / min, um die Blutreinigung der Lunge zu erleichtern. Durchbluten Sie die Lunge, bis sie meist weiß werden, was normalerweise 40 ml PBS / Heparin / SNP oder weniger erfordert.
HINWEIS: Eine unzureichende Blutreinigung der Lunge kann die nachgeschaltete Dezellularisation beeinträchtigen. - Schneiden Sie die hintere Luftröhre knapp über dem Niveau der Trachealkanüle ab und sezieren Sie dann die Lunge und das Herz frei von allem verbleibenden Bindegewebe und extrahieren Sie die Höhle und das Herz en bloc.
- Füllen Sie eine 10 ml Spritze mit 2% niedriger Schmelzpunktagarose in Hank's ausgewogener Salzlösung (HBSS) ohne Phenolrot, vorgewärmt auf 42 °C.
HINWEIS: Das genaue Volumen der benötigten Agarose variiert je nach Lungengröße. Größere Lungen (d.h. von Ratten, die größer als 400 g sind) benötigen mehr als 10 ml Agarose. - Blähen Sie die extrahierten Lungen 3x manuell mit 10 ml Luft (d.h. auf ungefähr die Gesamtlungenkapazität) über die Luftröhrenkanüle auf, um kollabiertes Parenchym zu rekrutieren.
- Blähen Sie die Lunge sofort mit der vorbereiteten Spritze aus Agarose auf, indem Sie die Agarose manuell über die Luftröhrenkanüle mit einer Rate von etwa 40 ml / min injizieren, bis die distalen Spitzen der Lungenlappen aufgeblasen sind. Wenn die distalen Regionen der Lunge kollabiert bleiben, injizieren Sie zusätzliche 1-2 ml Agarose.
- Verschließen Sie die Luftröhre, indem Sie die weiße Kappe eines 4-Wege-Absperrhahns an der weiblichen Luer-Locke der Trachealkanüle befestigen. Legen Sie die Lunge in eine 150 mm große Petrischale auf Eis, damit sich die Agarose verfestigen kann.
HINWEIS: Das Aufblasen der Lunge kurz nach der Extraktion ist entscheidend, um eine gleichmäßige Füllung des Lungenparenchyms und eine anschließende erfolgreiche Gewebezerschneidung zu gewährleisten. Wenn sich die Lunge sehr ungleichmäßig aufbläht, fahren Sie nicht mit dem Schneiden der Lunge fort, da die Schnittqualität schlecht ist.
- Schneiden der Lunge
HINWEIS: Das genaue Schneideverfahren muss möglicherweise basierend auf dem verwendeten Vibrationsmikrotom (Vibratom) angepasst werden. Weitere Beispiele für die PCLS-Präparation mit verschiedenen Gewebeschneidemaschinen wurden zuvorveröffentlicht 32,33,34.- Kühlen Sie den Metallkühlblock bei -20 °C vor und halten Sie ihn auf Eis, wenn er während des gesamten Schneidevorgangs nicht verwendet wird.
- Verwenden Sie einen kleinen Tropfen Cyanacrylatkleber, um eine Klinge am Klingenhalter zu befestigen. Befestigen Sie den Klingenhalter vorsichtig mit einem Inbusschlüssel am Vibratom, so dass er sich einfach mit dem Ende eines in die Pufferschale eingeführten Probenröhrchens ausrichtet.
- Bereiten Sie 6-Well-Platten mit 3 ml pro Well-sterilem eiskaltem HBSS ohne Phenolrot vor, um die Scheiben zu sammeln.
- Schneiden Sie mit einem Skalpell ein Stück Lungengewebe ca. 1-1,5 cm3.
HINWEIS: Lungengewebe aus dem unteren und mittleren Teil des linken Lappens sowie aus dem rechten mittleren und unteren Lappen ergibt am ehesten größere Gewebeschnitte, die die Alveolarfläche maximieren. Wenn aufgeblasene Geweberegionen oder Bereiche des Bindegewebes vorhanden sind, schneiden Sie dieses Gewebe entweder mit einer Schere ab oder orientieren Sie sich nach unten zum Kolben; Solches Gewebe neigt dazu, nicht sauber zu schneiden. - Legen Sie einen kleinen Tropfen Cyanacrylatkleber auf den Kolben des Probenröhrchens. Tupfen Sie Lungengewebe auf ein Papiertuch, um überschüssige Feuchtigkeit zu entfernen, und legen Sie das Lungengewebe dann sofort mit einer Pinzette auf den Kolben.
- Schieben Sie das Metallrohr des Probenröhrchens auf die Höhe der Oberseite des Gewebes und halten Sie es fest, wobei der Kolben zurückgezogen ist. Pipette vorgewärmt 2% Agarose in HBSS in die Oberseite der Röhre, um das Gewebe vollständig zu umgeben.
- Legen Sie den eiskalten Kühlblock etwa 1 Minute um das Gewebe, damit sich die Agarose verfestigen kann.
- Setzen Sie das Probenröhrchen in die Pufferschale ein. Füllen Sie das Tablett mit eiskaltem PBS, um den Gewebeblock in der Mitte zu erhöhen. Drehen Sie den Motorkastenschalter auf Fast Forward (FF), um den Motorkastenkolben so zu bewegen, dass er nur die Basis des Probenrohrs berührt.
- Stellen Sie die gewünschten Einstellungen für Schichtdicke, Schnittgeschwindigkeit und Schwingungsfrequenz ein, z. B. 450 μm Dicke, Geschwindigkeit 4 und Schwingungsfrequenz 5. Wählen Sie Kontinuierlicher Modus aus, und drehen Sie dann den Schalter auf Ein , um mit dem Schneiden zu beginnen.
- Wenn Gewebescheiben in die Pufferschale fallen, übertragen Sie sie mit einer Impfschleife oder einem Spatel auf die vorbereiteten 6-Well-Platten.
- Hören Sie auf zu schneiden, wenn ~ 2 mm Dicke des Gewebes im Probenrohr verbleibt, um eine Beschädigung der Klinge oder das Schneiden von Gewebe, das Kleber enthält, zu vermeiden.
- Wiederholen Sie die obigen Schritte, um bei Bedarf zusätzliches Lungengewebe zu schneiden.
- Scheiben sofort für die Gerüstvorbereitung entzellulieren oder einfrieren und bei -80 °C bis zu 2 Monate lagern. Zum Einfrieren 4-6 Scheiben in eine 35 mm Petrischale geben und überschüssige Flüssigkeit vorsichtig um die Scheiben herum absaugen. Legen Sie das Geschirr in ein Bad aus Trockeneis und 100% Ethanol, um es einzufrieren, dann in Folie zu wickeln, in einer Plastiktüte zu verschließen und auf -80 ° C zu geben.
HINWEIS: Legen Sie frische Scheiben nicht direkt in einen Gefrierschrank von -80 ° C, da die relativ langsame Gefriergeschwindigkeit dazu führen kann, dass sich Eiskristalle bilden, die das Gewebe schädigen können.
3. Vorbereitung von Lungengewebegerüsten
- Vorbereitung von Materialien und Dezellularisierungslösungen
- Autoklavieren Sie Frames, Clips und Registerkarten.
- Bereiten Sie Dezellularisierungslösungen vor, wie in Tabelle 1 beschrieben.
HINWEIS: Fügen Sie Benzonase-Nuklease unmittelbar vor dem Gebrauch in den vorgewärmten Puffer und den sterilen Filter hinzu. Bereiten Sie Triton X-100- und Natriumdesoxycholat (SDC)-Lösungen innerhalb von 24-48 Stunden nach dem Dezellularisierungsverfahren vor. Bereiten Sie antibiotische/antimykotische Lösungen und Benzonasepuffer bis zu 30 d im Voraus vor und lagern Sie sie bei 4 °C.
- Schneiden und Beschneiden von Lungenscheiben
HINWEIS: Während das Schneiden und Clipping nicht steril auf der Tischplatte erfolgen kann, müssen die Dezellularisierungsschritte in Abschnitt 3.3 und alle nachfolgenden Handhabungen der Gewebegerüste in einer laminaren Durchflusshaube durchgeführt werden.- Füllen Sie eine 100 mm Petrischale etwa ein Drittel voll mit PBS. Übertragen Sie Kassetten (Frames mit jeweils zwei Clips) und Tabs mit einer Pinzette auf die Schüssel.
- Wenn Sie gefrorene Scheiben verwenden, tauen Sie ein Gericht nach dem anderen auf, indem Sie PBS bei Raumtemperatur in die Schüssel gießen, um die Scheiben abzudecken. Bewahren Sie das restliche Geschirr auf Trockeneis auf.
- Eine aufgetaute Scheibe in eine 150 mm Petrischale geben. Entfalten Sie die Scheibe vorsichtig mit feinen Pinzetten, falls erforderlich, so dass sie flach liegt, und saugen Sie dann vorsichtig überschüssiges PBS aus dem Gewebe ab.
- Verwenden Sie eine Rasierklinge mit einem Lineal als Führung, um einen 3 mm breiten Streifen aus der Scheibe zu schneiden, indem Sie die gesamte Länge der Klinge fest gegen die Schale drücken und sie leicht von Seite zu Seite schaukeln, wobei die Klingenkante an Ort und Stelle gehalten wird. Alternativ können Sie einen Rotationsschneider verwenden, der mit 2 parallelen Klingen nachgerüstet ist, die durch einen 3 mm großen, maßgeschneiderten Abstandshalter (z. B. aus Acetal [Polyoxymethylen]) getrennt sind, um Gewebestreifen zu schneiden. Vermeiden Sie Risse, Löcher, große Atemwege oder Gefäße oder dickes Bindegewebe.
HINWEIS: Für ein erfolgreiches Clipping muss der Streifen mindestens 9 mm lang sein. - Mit einer Pinzette den Gewebestreifen in die vorbereitete 100 mm Petrischale geben.
- Schneiden Sie den Gewebestreifen in die Kassette: Schweben Sie das Gewebe über die Kassette und zentrieren Sie das Gewebe, um die Löcher in den Clips an beiden Enden zu überhängen. Platzieren Sie mit einer feinen Pinzette eine Lasche teilweise in das Loch an einem Ende, richten Sie das Gewebe vorsichtig auf und platzieren Sie dann die zweite Lasche. Drücken Sie mit einer Pinzette in jeder Hand jede Lasche vollständig ein, um das Gewebe zu sichern.
HINWEIS: Wenn Sie Schwierigkeiten haben, das Gewebe vor dem Clipping an Ort und Stelle zu halten, saugen Sie etwas PBS aus der Schale ab, um den Flüssigkeitsspiegel zu senken. Achten Sie darauf, das Gewebe beim Platzieren des zweiten Clips nicht zu dehnen, da dies zu Rissen führen kann. - Wiederholen Sie den Auftau-, Schneide- und Beschneidvorgang in den Schritten 3.2.2-3.2.6 für beliebig viele Gewebe.
- Slice-Dezellularisierung
- Sobald alle Scheiben beschnitten sind, geben Sie die 100-mm-Schale mit den Kassetten auf eine Laminar-Flow-Haube.
- Beginnen Sie mit Schritt 1 des Dezellularisierungsprotokolls (siehe Tabelle 2): Verwenden Sie einen gekrümmten Hämostat, um die gekerbten Seiten jeder Kassette zu greifen, und übertragen Sie Kassetten auf 6-Well-Platten ( 2 Gewebe / Well), die mit 3 ml PBS + Ionen + Antibiotika / Antimykotika pro Vertiefung gefüllt sind (siehe Lösungsrezept in Tabelle 1).
- Platzieren Sie die Bohrlochplatten bei 30 U / min für 10 min auf einem Orbitalschüttler.
- Fahren Sie mit Schritt 2 des Dezellularisierungsprotokolls fort (siehe Tabelle 2): Saugen Sie die Flüssigkeit aus jeder Vertiefung ab, ersetzen Sie sie dann durch 3 ml / Well PBS + -Ionen, platzieren Sie die Platte bei 30 U / min auf dem Orbitalschüttler und inkubieren Sie für 5 min.
- Wiederholen Sie Schritt 3.3.4 für jede der Lösungen und die entsprechende Dauer, wie im Dezellularisierungsprotokoll in Tabelle 2 beschrieben.
- Nach dem letzten Spülschritt mit PBS + Antibiotika / Antimykotika (Schritt 20 von Tabelle 2) das Gewebe auf sterile 6-Well-Platten mit frischem PBS + Antibiotika / Antimykotika übertragen und bei 37 ° C für 48 h inkubieren.
HINWEIS: Nach der Sterilisation mit Antibiotika/Antimykotika können Lungengewebegerüste sofort ausgesät oder bei 4 °C bis zu 30 d gelagert werden.
4. Slice-Rezellularisierung und -Kultur
HINWEIS: Abbildung 2 zeigt einen vorgeschlagenen Zeitplan für die Gewebeaussaat und -kultur, in der Scheiben zuerst mit mikrovaskulären Endothelzellen der Rattenlunge ausgesät und in serumarmem Endothelmedium kultiviert werden; dann mit Ratten-AEC2s und Rattenlungen-Fibroblasten mit einem serumfreien AEC2-Wachstumsmedium ausgesät (adaptiert von Jacob et al.13 und You et al.35); Siehe zusätzliche Hinweise zu Zellquellen, die in Details zu Ergebnissen und Kulturmedien in Tabelle 3 verwendet werden. Diese Strategie liefert alveolarartige Strukturen, die AEC2-Monoschichten enthalten.
- Vorbereitung von Gewebegerüsten für die Aussaat (Tag -4 oder -3)
- Wenn Sie Gewebegerüste verwenden, die bei 4 ° C gelagert werden, inkubieren Sie die Gerüste über Nacht bei 37 ° C mit frischem PBS + Antibiotika / Antimykotika (10% Penicillin / Streptomycin, 4% Amphotericin B, 0,4% Gentamicin in PBS) vor der Aussaat.
- Spülen Sie Gerüste 3x mit sterilem PBS (5 ml/well), je 5 min.
- Untersuchen Sie Gerüste unter einem Phasenkontrastmikroskop bei 5-facher Vergrößerung, um Gewebe für die Aussaat auszuwählen.
HINWEIS: Die besten Gerüste für die Aussaat haben keine Risse oder Löcher und enthalten keine großen Atemwege oder Gefäße. Während Gerüste mit den Merkmalen erfolgreich ausgesät werden können, können sich die Wiederbesiedlungsmuster von denen unterscheiden, die in alveolären Gebieten beobachtet werden.
- Endothelzellaussaat (Tag -3)
- Zählen Sie Endothelzellen mit einem Hämozytometer und bereiten Sie die Endothelzellsuspension in Endothelmedium (siehe Tabelle 3) bei 5 x 10 6 Zellen/ml vor, wobei genügend Zellen vorhanden sind, um 500.000 Endothelzellen pro Schicht zu säen (z. B. für 12 Scheiben 6 x 106 Zellen in 1,2 ml Medium).
- Legen Sie autoklavierte Aussaatbäder in 100 mm Petrischale. Überführen Sie gespülte Gerüste kopfüber in die Aussaatbäder: Verwenden Sie eine fein gekrümmte Hämostat, um eine Kassette an den gekerbten Seiten zu greifen, verwenden Sie eine gerade Hämostat oder eine Pinzette, um ein Ende der Kassette zu greifen (wobei darauf zu achten ist, das Gewebe selbst nicht zu berühren) und drehen Sie die Kassette dann wieder mit den Spitzen der fein gekrümmten Hämostat über die Löcher entlang der gekerbten Seiten an, und in ein Aussaatbad legen. Wiederholen Sie den Vorgang für die verbleibenden Kassetten.
HINWEIS: Bei korrekter Platzierung werden die Gerüste auf dem Kopf stehend im Boden jedes Brunnens zentriert. Drücken Sie bei Bedarf vorsichtig auf die Ecke der Kassette mit den Spitzen eines Hämostats, um sicherzustellen, dass die Kassette flach im Brunnen sitzt. Unsachgemäßer Sitz der Kassette kann zu einer schlechten Gewebeaussaat führen. Es ist akzeptabel, wenn das Bohrloch eine kleine Menge PBS enthält. - Schwenken Sie die vorbereitete Zellsuspension vorsichtig zum Mischen und verwenden Sie dann eine manuelle Pipette, um 100-μL-Zellen direkt auf jedes Gewebe an der Basis des Brunnens zu pipettieren, wobei Sie darauf achten, das Gewebe nicht mit der Pipettenspitze zu beschädigen.
- Ausgesätes Gewebe bei 37 °C/5% CO2 in den Zellkultur-Inkubator überführen.
- Nach 2 h 900 μL vorgewärmtes Kulturmedium mit einer manuellen Pipette in jede Vertiefung geben und dann zum Inkubator zurückkehren. Wenn sich eine Kassette beim Hinzufügen von Medium löst (schwimmt), drücken Sie vorsichtig auf die Ecke der Kassette mit der Pipettenspitze, so dass sie flach im Brunnen liegt.
- Wechseln Sie das Medium an Tag -2. Entfernen Sie das Medium, indem Sie die Petrischale kippen und manuell mit einer Pipettenspitze pipettieren, die leicht in der Ecke des Brunnens platziert ist, um die Kassette nicht zu stören. Ersetzen Sie durch 1 ml frisches Endothelmedium pro Well.
- AEC2- und Fibroblasten-Seeding und Gewebekultur (Tag 0)
- Zählen Sie AEC2s und Fibroblasten mit einem Hämozytometer. Bereiten Sie eine 1:1-Zellsuspension von AEC2s und Fibroblasten in AEC2-Wachstumsmedium (Epithelbasismedium + AEC2-Ergänzungen; siehe Tabelle 3) bei 5 x 10 6Gesamtzellen/ml vor, wobei genügend Zellen vorhanden sind, um 500.000 Zellen (250.000 AEC2s und 250.000 Fibroblasten) pro Schicht zu säen (z. B. für 12 Scheiben 3 x 10 6 AEC2s + 3 x 106 Fibroblasten zusammen in 1,2 ml Medium).
- Das Medium aus jedem Vertiefungsraum des Aussaatbades pipettieren, wie in Schritt 4.2.6 beschrieben. Schwenken Sie die vorbereitete Zellsuspension vorsichtig zum Mischen und pipettieren Sie dann 100 μL-Zellen direkt auf jedes Gewebe an der Basis des Bohrlochs.
HINWEIS: Es ist akzeptabel, wenn vor der Aussaat von AEC2 / Fibroblasten eine kleine Menge Endothelmedium im Bohrloch verbleibt. - Ausgesätes Gewebe bei 37 °C/5% CO2 in den Zellkultur-Inkubator überführen.
- Nach 2 h 900 μL vorgewärmtes AEC2-Wachstumsmedium in jede Vertiefung geben und dann in den Inkubator zurückkehren.
- Nach 24 Stunden Kultur (Tag 1) bereiten Sie eine 12-Well-Platte mit 1 ml vorgewärmtem AEC2-Wachstumsmedium pro Vertiefung und Kassette vor.
- Pipette 800 μL Medium aus jeder Vertiefung des Aussaatbades. Entfernen Sie Kassetten aus dem Aussaatbad: Greifen Sie jede mit einer fein gekrümmten Hämostat über die Löcher entlang der gekerbten Seiten, geben Sie sie auf eine gerade Hämostat oder Pinzette, um die Kassette an einem Ende zu greifen und umzudrehen, dann verwenden Sie die gekrümmte Hämostat, um die Kassette über die gekerbten Seiten zu greifen und die rechte Seite, eine pro Well, auf die vorbereitete 12-Well-Platte zu übertragen.
- Wechseln Sie das Kulturmedium in der 12-Well-Platte jeden zweiten Tag bis zum 7. Tag oder für die gewünschte Kulturlänge: Verwenden Sie eine Pasteur-Pipette aus Glas, um das Medium aus jedem Brunnen abzusaugen, und achten Sie darauf, das Gewebe nicht zu berühren; Pipette in 1 mL frischem AEC2-Wachstumsmedium pro Welle.
HINWEIS: Der Grad der Geweberepopulation kann während der gesamten Dauer der Kultur mittels Phasenkontrastmikroskopie bei 5-facher Vergrößerung überwacht werden.
5. Gewebeentnahme und Probenanalyse
- Um ELTs für die Histologie und Immunfluoreszenzfärbung zu fixieren, übertragen Sie Gewebekulturkassetten auf 10% neutralgepuffertes Formalin und inkubieren Sie für 3-4 h bei Raumtemperatur auf einer Wippe. Entfernen Sie Gewebe aus Kassetten, indem Sie die Spitze einer feinen Zinkenzange verwenden, um das Gewebe dort zu schneiden, wo es auf die Laschen trifft. Gewebe nach Routinemethoden zur Paraffineinbettung und Histologie verarbeiten; Es sind keine speziellen Techniken erforderlich.
- Um ELTs für die qRT-PCR zu verarbeiten, spülen Sie Gewebe in Kassetten in PBS 2x, entfernen Sie dann Gewebe und schnappen Sie es ein oder fahren Sie mit der Lyse zur RNA-Extraktion fort.
HINWEIS: Das Pooling von mindestens 2 Scheiben, die mit 1 x 106 Zellen ausgesät und für 7 Tage kultiviert wurden, sollte reichlich RNA für die nachgelagerte PCR-Analyse ergeben.
Ergebnisse
Ein Überblick über den Prozess zur Generierung von ELTs - einschließlich Lungenschnitt, Slice-Clipping und Dezellularisierung sowie Gerüst-Repopulation - ist in Abbildung 3 dargestellt. Die hier vorgestellten ELTs wurden unter Verwendung von primären mikrovaskulären Endothelzellen der Rattenlunge (siehe Materialtabelle), neonatalen Ratten-AEC2s und Lipofibroblasten-angereicherten neonatalen Rattenlungenfibroblasten36 kultiviert. AEC2s wurden frisch isoliert durch magnetische Perlensortierung, wie zuvor beschrieben 37; Alternative Isolationsprotokolle wurden detailliert beschrieben und an anderer Stellediskutiert 38,39,40. Die Reinheit isolierter Ratten-AEC2s kann mittels Durchflusszytometrie für den rattenspezifischen AEC2-Oberflächenmarker RTII-7041 oder durch Färbung einer zytozentrifugierten Zellprobe für RTII-70 oder Pro-Tensidprotein C (pSPC) beurteilt werden. Rattenlungenfibroblasten wurden von postnatalen Tag 7-9 Rattenwelpen gemäß einer Anpassung eines veröffentlichten Protokolls42 isoliert und in Passage 1-2 verwendet; Alternative Isolationsprotokolle wurden an anderer Stellebeschrieben 43,44. Die Reinheit isolierter Fibroblasten kann durch Färbung von kultivierten oder zytozentrifugierten Zellen für den mesenchymalen Marker Vimentin beurteilt werden, und die Lipofibroblastenanreicherung kann durch Färbung für Oil Red O45 beurteilt werden.
Wenn das Lungengewebe gleichmäßig mit Agarose aufgeblasen ist und Gewebestücke strategisch ausgewählt und für das Schneiden ausgerichtet sind, um die Gesamt- und Parenchymgewebefläche zu maximieren, kann eine Rattenlunge Gewebe für >100 alveoläre ELTs ergeben. PCLS-Streifen weisen eine ausreichende mechanische Integrität auf, um in Gewebekassetten mit wenigen (<5 %) Rissen (Abbildung 3B) eingeklemmt zu werden.
Das Protokoll zur Dezellularisierung von Lungenschnitten basiert eng auf unserem zuvor veröffentlichten Dezellularisierungsprotokoll für die ganze Lunge, von dem durch quantitative Proteomik gezeigt wurde, dass es viele ECM-Komponenten auf einem Niveau bewahrt, das sich nicht signifikant von denen in der nativen Lunge22 unterscheidet. Dezellularisierte Schichtgerüste bewahren die native Architektur der Alveolen, wie sie durch Hämatoxylin- und Eosin (H & E) -Färbung (Abbildung 4A, B) und durch Phasenkontrastmikroskopie (Abbildung 4C) betrachtet wird. Wir schließen typischerweise Gerüste aus, die große Atemwege oder Gefäße (Abbildung 4D) oder Risse enthalten, obwohl erstere einbezogen werden können, wenn sie für den Forscher von Interesse sind. Die Dezellularisierung führt zu einer 96%igen Reduktion des DNA-Gehalts an Gewebe, gemessen durch einen Assay für doppelsträngige DNA (siehe Materialtabelle; 0,50 μg/mg ± 0,073 μg/mg vs. 0,018 μg/mg ± 0,0035 μg/mg in nativem vs. dezellularisiertem Gewebe, je ± REM) (Abbildung 5A), wobei keine DNA durch Hämatoxylinfärbung sichtbar ist (Abbildung 4B). Die histologische und immunfluoreszierende Färbung von dezellularisierten Gerüsten zeigt die Erhaltung der EZM-Proteine Kollagen, Elastin, Kollagen IV und Laminin mit einer ähnlichen Architektur und Menge wie in nativen Lungenschnitten (Abbildung 5B-E). Beachten Sie, dass die Kerne des nativen Gewebes blau / schwarz mit Trichom (für Kollagen) und EVG (für Elastin) Flecken färben. Die Immunfluoreszenzfärbung wurde wie zuvor beschrieben unter Verwendung von Standardmethoden zur Färbung von Gewebendurchgeführt 37. Die verwendeten Antikörper und ihre jeweiligen Konzentrationen sind in Tabelle 4 aufgeführt.
Eine erfolgreiche Gerüst-Repopulation führt nach 7 Tagen zu hochzelligen ELTs mit einem alveolarartigen Repopulationsmuster, das durch Lichtmikroskopie sichtbar ist (Abbildung 6A-C). In einigen Fällen können bei sehr hoher Zellularität organoidartige Strukturen sichtbar sein (Abbildung 6A,B). Eine erfolglose Gewebeaussaat kann durch Phasenkontrastmikroskopie während der Kultur sichtbar gemacht werden (Abbildung 6C). Nach der Kultivierung von Gewebegerüsten mit AEC2s, Fibroblasten und Endothelzellen werden ELTs dicht mit alveolarähnlichen Strukturen wiederbesiedelt, die alle drei Zelllinien umfassen (Abbildung 6D, E). An Tag 7 oder 8 behalten AEC2s die quaderförmige Morphologie bei und exprimieren Tensidprotein-B (SPB) und das lamellare Körperprotein ABCA3, ohne dass eine signifikante Differenzierung zu AEC1s nachgewiesen wird (Abbildung 6E, F). AEC2s sind in ELTs sehr proliferativ, wie der Einbau von 5-Ethynyl-2'-Desoxyuridin (EdU) nach einem 2-h-Puls bei 10 μM zeigt (Abbildung 6G).
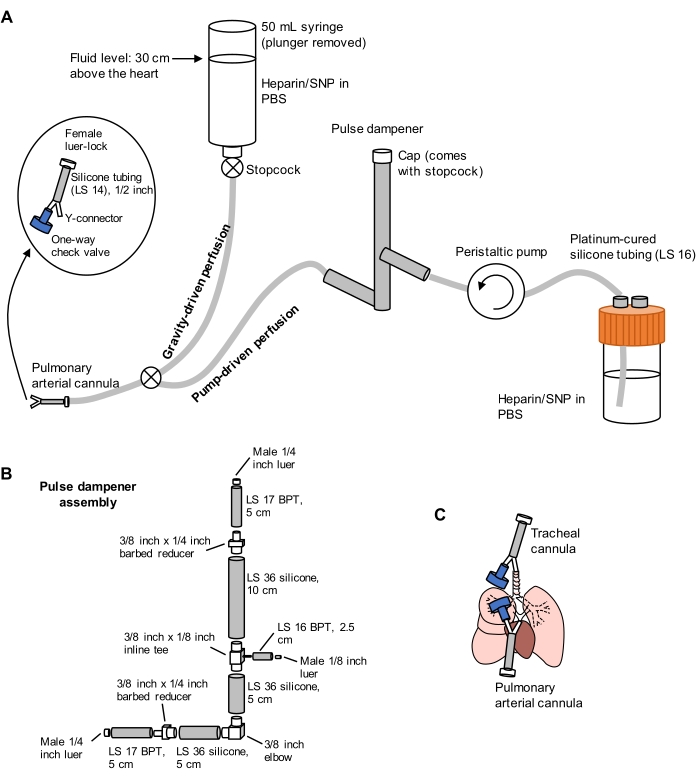
Abbildung 1: Schematische Darstellung des Perfusionssystems für die Lungenextraktion und -reinigung. (A) Das Perfusionssystem besteht aus einer schwerkraftgetriebenen Gliedmaße, die für die anfängliche Kanülierung der Lungenarterie unter Strömung verwendet wird; und ein pumpengetriebenes Glied, das verwendet wird, um die Lunge nach der ersten Kanülierung effizient zu reinigen. Die Pumpenleitung enthält einen "Impulsdämpfer", der die von der Pumpe verursachten Druckspitzen dämpft. Das Design der trachealen und pulmonalen arteriellen Kanülen ist links detailliert. SNP = Natriumnitroprussid. (B) Einzelheiten der Montage des Impulsdämpfers. BPT und Silikon beziehen sich auf Schlauchtypen. (C) Positionen der trachealen und pulmonalen arteriellen Kanülen, die während der Lungenextraktion platziert wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
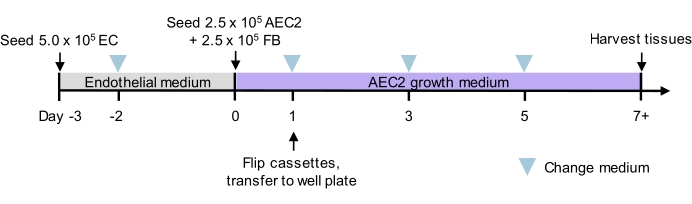
Abbildung 2: Kulturzeitachse für die Tri-Lineage-Rezellularisierung. Vorgeschlagener Zeitplan für die Tri-Lineage-ELT-Aussaat und -Kultur, einschließlich des Zeitpunkts der zweiphasigen Aussaat. Zellnummern für Seeding und Kulturmedium für jede Phase werden angegeben. Details zu Kulturmedien finden Sie in Tabelle 3. AEC2 = alveoläre Epithel-Typ-2-Zelle. EC = Endothelzelle. FB = Fibroblast. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
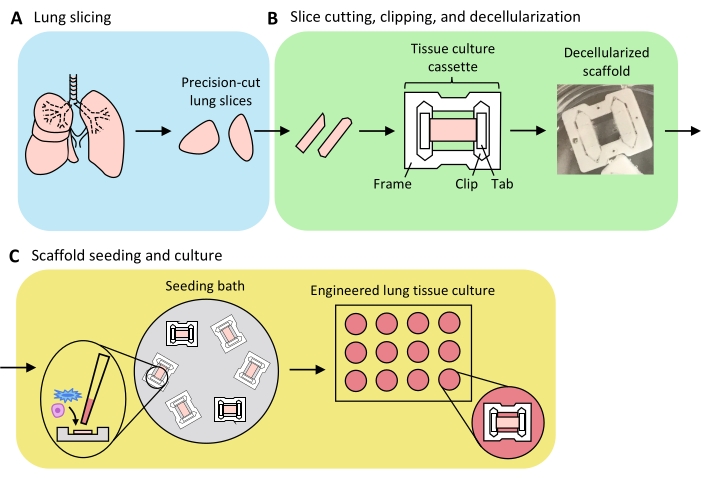
Abbildung 3: Schematische Darstellung der technischen Vorbereitung von Lungengewebe. (A) Natives Lungengewebe wird mit einem Vibratom in Scheiben geschnitten. (B) Präzisionsgeschnittene Lungenscheiben werden in standardisierte 3 mm breite Streifen geschnitten, in Gewebekulturkassetten aus Polytetrafluorethylen (PTFE) geclippt und dezellularisiert, um azelluläre extrazelluläre Matrixgerüste zu erhalten. (C) Gerüste werden in spezialisierten Aussaatbädern, die den Aussaatbereich auf den Bereich des Gewebes beschränken, neu ausgesät und dann in einer Standard-Brunnenplatte kultiviert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
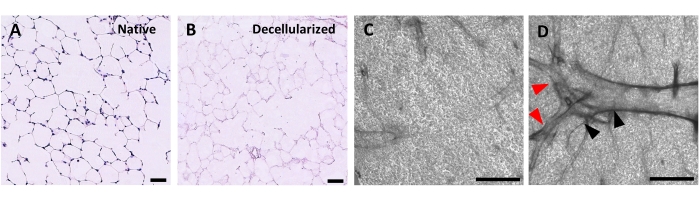
Abbildung 4: Struktur der dezellularisierten Lungengerüste. H & E-Färbung von nativen (A) und dezellularisierten (B) Lungenschnitten, die die Erhaltung der alveolären Architektur nach der Dezellularisierung zeigen. (C,D) Beispiele für dezellularisierte ECM-Gerüste, die bei 5-facher Vergrößerung durch Phasenkontrastmikroskopie betrachtet werden, die überwiegend alveoläres Gewebe (C) umfassen oder große verzweigte Atemwege und Gefäße (D, schwarze und rote Pfeilspitzen) enthalten. Maßstabsstäbe, 50 μm (A,B); 500 μm (C,D). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: DNA-Entfernung und Matrixkonservierung in dezellularisierten Lungengerüsten. (A) Quantifizierung der DNA in nativen und dezellularisierten Lungenschnitten (Mittelwert ± REM, n = 5). Welch's t test, **P < 0,01. Decell = dezellularisiert. (B,C) Histologische Färbung von nativen und dezellularisierten Lungenschnitten auf Kollagen (B) und Elastin (C). Pfeilspitzen, Elastin konserviert in alveolären Eingangsringen von dezellularisiertem Gewebe. (D,E) Immunfluoreszierende Färbung von nativen und dezellularisierten Lungenschnitten für Kollagen IV (D) und Laminin (E). Maßstabsstäbe, 50 μm. In allen Bedienfeldern umreißen gepunktete Kästchen den Bildbereich, der im jeweiligen Panel nach rechts vergrößert wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
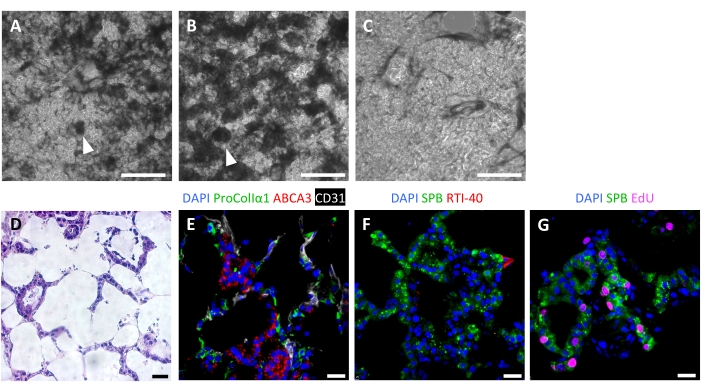
Abbildung 6: Zelluläre Repopulation von künstlich hergestelltem Lungengewebe. (A-C) Beispiele für rezellularisierte ELTs am Tag 7 der Kultur, wie sie während der Kultur durch Phasenkontrastmikroskopie visualisiert wurden. Das Rezellularisationsmuster spiegelt die alveoläre Struktur des Gewebes wider. In einigen Bereichen mit hoher Zellularität können sich organoidartige Strukturen bilden (Pfeilspitzen). (A) und (B) eine erfolgreiche Zellrepopulation darstellen, während (C) nach 7 Tagen Kultur ein schlechtes Maß an Rezellularisierung darstellt. (D-G) Färbung von rezellularisierten ELTs am 7. oder 8. Tag der Kultur. (D) H & E-Färbung, die eine zelluläre Repopulation der Alveolarsepten zeigt. (E) Immunfluoreszierende Färbemarkungen aufgepfropfte proCollagenIα1+ Fibroblasten, ABCA3+ AEC2s und CD31+ Endothelzellen. (F) Gewebe enthalten reichlich SPB+ AEC2, aber nur wenige RTI-40 (Podoplanin) + AEC1 unter diesen Bedingungen. (G) Viele AEC2 vermehren sich in ELTs, gemessen an der EdU-Integration. Maßstabsstäbe, 500 μm (A-C); 25 μm (D-G). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Dezellularisierungslösungen. Vorbereitungsdetails für Dezellularisierungslösungen. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Dezellularisierungsprotokoll Details des Protokolls zur Dezellularisierung von Lungenschnitten. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 3: Kulturmedien. Vorbereitungsdetails für Endothel- und AEC2-Wachstumsmedien. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 4: Antikörper, die zur Immunfärbung verwendet werden. Details zu Antikörpern und deren Konzentrationen, die zur Immunfärbung verwendet werden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Zusatzakte 1: Design für das Laserschneiden von Gewebekulturkassettenrahmen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsakte 2: Design für das Laserschneiden von Tissue-Kultur-Kassettenclips. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsakte 3: Design für das Laserschneiden von Gewebekulturkassetten-Tabs. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Zusatzakte 4: CAD-Datei für die Aussaat von Badformbasis. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Zusatzdossier 5: CAD-Datei zur Aussaat Badformring. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Dieses Papier beschreibt die Verwendung von dezellularisierten, präzisionsgeschnittenen Lungenschnitten als Plattform zur Erzeugung von künstlich hergestelltem Lungengewebe in vitro, das alveolarähnliche Strukturen mit mehreren Linien enthält. Durch die Kombination von Strategien, die wir zuvor entwickelt haben, um hochgenaue azelluläre ECM-Lungengerüste für das gesamte Lungen-Engineering22,31 mit unserem robusten System zur Kultivierung von kleinräumigem Herzgewebe 30 neu zu besiedeln, ermöglicht dieses Protokoll die Verwendung von physiologisch relevanter Lungen-ECM als Gewebekultursubstrat in einer wiederholbaren und moderaten Durchsatzweise.
Die hier vorgestellten Methoden beschreiben die ELT-Gerüstvorbereitung aus Rattenlungen, die leicht erreichbar sind, en bloc mit direktem Zugang zu intakten Atemwegen für Agaroseinflation extrahiert werden können und größer sind als die Mauslunge. Innerhalb dieses Systems kann jedoch jedes Lungengewebe verwendet werden, das mit Agarose aufgeblasen werden kann und Scheiben von mindestens 9 mm Länge ergibt. Unabhängig von der Gewebequelle ist eine gleichmäßige Aufblasung des Lungengewebes mit Agarose der kritischste Schritt, um den Erfolg des nachgeschalteten Gewebeschneidens, Clippings und Gewebehandlings sicherzustellen. Unteraufgeblasenes Lungengewebe neigt dazu, nicht sauber zu schneiden, während überblasenes Gewebe während des Clippings reißen kann. Nach der Agarosegelierung sind entsprechend aufgeblasene Geweberegionen fest, geben aber ein wenig nach, wenn sie sanft mit einer Pinzette gedrückt werden. Für intakte Rattenlungen fanden wir heraus, dass das mehrmalige Voraufblasen der extrahierten Lungen mit Luft, gefolgt von einer Agaroseinflation so bald wie möglich nach der Extraktion, zu den besten Schneideergebnissen und der besten Qualität der resultierenden Gewebegerüste führt. Die entsprechende Menge an Agarose muss empirisch optimiert werden; für eine Rattenlunge beträgt das Volumen, das benötigt wird, um die Lunge zur Gesamtlungenkapazität aufzublasen, etwa 30 ml/kg Tiermasse (z. B. 10,5 ml Agarose für Lungen von einer 350 g Ratte). Bei größeren resezierten Lungengeweben mit weniger einfachem Zugang zu den Atemwegen (z. B. von menschlichen Spendern) kann eine zusätzliche Fehlerbehebung erforderlich sein, um das Gewebe über einen Bronchus32 aufzublasen. Während des anschließenden Lungenschneidens ist die Auswahl und Orientierung des Gewebes auf dem Kolben ein weiterer wichtiger Schritt, um 1) sicherzustellen, dass die Scheiben groß genug sind, um Gewebestreifen zu erzeugen, die in Gewebekulturkassetten geschnitten werden können, und 2) die parenchymale (alveolar) Gewebefläche zu maximieren, mit Ausnahme großer Atemwege oder Gefäße.
Das Einschneiden des PCLS in Gewebekulturkassetten kann zunächst ein schwieriger Schritt sein, aber die Kassetten vereinfachen die Gewebehandhabung während der Dezellularisierung und Aussaat erheblich. Zwei mögliche Probleme, die auftreten können, sind das Reißen von Gewebe (entweder während des Clippings oder während der Dezellularisierung) oder die Gewebepositionierung in den Clips, die zu einer schlechten nachgeschalteten Aussaat führt (z. B. keine Aussaat oder Aussaat nur an den Enden). Ein Reißen kann das Ergebnis einer Überinflation von Agarose, einer Überdehnung des Gewebes während des Einführens der Lasche oder eines zu geringen Überhangs sein, um beim Einsetzen der Laschen einen ausreichenden Gewebegriff zu gewährleisten. Beachten Sie, dass Scheiben, die an einem Clip-Ende reißen, erfolgreich gesät werden können, jedoch sind sie während der Kultur unter dem Mikroskop schwer zu visualisieren, da das Gewebe nicht flach ist. Eine schlechte Gewebeaussaat (wie in Abbildung 6C) ist wahrscheinlich das Ergebnis davon, dass die Scheibe nicht flach zwischen den beiden Clips liegt und somit einen schlechten Kontakt mit der Basis des Aussaatbades hat, wenn sie auf den Kopf gestellt wird. Eine weitere mögliche Ursache ist das unsachgemäße Sitzen der Kassette im Boden des Aussaatbadbrunnens. Wenden Sie in Bezug auf das Clipping etwas mehr Spannung in das Gewebe an, wenn Sie den zweiten Clip platzieren, damit er flach liegt. Einige Scheiben haben eine leichte Konkavität; In diesen Fällen schneiden Sie die Scheibe mit der konvexen Seite nach oben ab. Mit der Praxis erleben wir in der Regel eine fehlgeschlagene Aussaat mit weniger als 2% der Scheiben.
Eine Einschränkung dieses Protokolls ist die Anforderung einiger Spezialgeräte - ein Laserschneider und ein 3D-Drucker -, um die Ausgangsmaterialien für die ELT-Vorbereitung zu generieren. Sobald jedoch die Gewebekulturkassetten und Aussaatbäder erstellt sind, sind keine zusätzlichen Spezialmaterialien erforderlich. Die Lungenschneide- und Dezellularisierungsschritte der ELT-Gerüstvorbereitung sind mäßig zeitaufwendig; Diese Schritte können jedoch im Voraus oder in ausreichender Anzahl durchgeführt werden, um mehrere Experimente gleichzeitig vorzubereiten. Viele PCLS (>100 bei Optimierung für Parenchymregionen) können aus einer einzigen Lunge geschnitten und für den späteren Gebrauch eingefroren werden. Während ein einzelner Frost-Tau-Zyklus geringfügige ultrastrukturelle Schäden am ECM46 verursachen kann, hat sich gezeigt, dass selbst mehrere Frost-Tau-Zyklen keinen signifikanten Verlust in ECM 23,47 verursachen. PCLS kann auch vor einem Experiment abgeschnitten und dezellularisiert werden, um innerhalb eines Monats verwendet zu werden. (Insbesondere kann das beschriebene Dezellularisierungsprotokoll in etwa 6 Stunden durchgeführt werden, was einen erheblichen Vorteil gegenüber zuvor beschriebenen Methoden darstellt, die einen Tag oder mehr erfordern27,28.) Sobald die Gerüste vorbereitet sind, ist der Zellaussaatprozess einfach und schnell, und die Kultur von ELTs erfordert keine speziellen Techniken.
Ein Vorbehalt der beschriebenen ELT-Methode ist das Fehlen einer regionsspezifischen Aussaat, d. h. der Abgabe von AEC2s spezifisch an den Alveolarraum oder Endothelzellen spezifisch an den Gefäßraum. Obwohl Zellen einfach auf den Gewebegerüsten gesät werden, ist das Muster der Rezellularisierung nicht zufällig, mit einem Anschein einer alveolarähnlichen Organisation, einschließlich Epithelringen. Wir vermuten, dass Zell-Zell-Interaktionen sowie lokale Unterschiede in der ECM-Zusammensetzung und -Geometrie20,21 wahrscheinlich zu den beobachteten Rezellularisierungsmustern beitragen. Zur Unterstützung dieser Hypothese zeigte eine zuvor veröffentlichte Studie, in der Fibroblasten unspezifisch auf dezellularisierte Lungenschnitte ausgesät wurden, dass das Muster der Geweberepopulation und der assoziierten zellulären Phänotypen signifikant nach mikroskopischer Geweberegion und ECM-Gerüstquelle (z. B. gesund versus krank) variierte27. Es wurde auch beobachtet, dass Fibroblasten in das Interstitium eindringen - den Ort, an dem sie sich im nativen Lungengewebe befinden 1,27. Die primäre alternative Methode, die wir uns vorstellen können, um Zellen auf Lungenschnitten in einer wirklich regionsspezifischen Weise zu kultivieren, würde darin bestehen, intakte dezellularisierte Lungen über die Atemwege31,48 und Gefäßkompartimente 49,50 zu säen und dann das rezellularisierte Gewebe zu schneiden. Diese Alternative 1) ist jedoch deutlich kosten-, zeit- und ressourcenintensiver; 2) ist ein geringerer Durchsatz; 3) erfordert eine erhöhte Anzahl von Tieren; und 4) ist mit einem erhöhten Kontaminationsrisiko aufgrund der Herausforderungen der gesamten Lungenkultur und des anschließenden Schneidens der ausgesäten Lunge verbunden. Die ELT-Plattform rekapituliert zwar nicht alle Aspekte der nativen zellulären Organisation, ermöglicht jedoch die Lungenzellkultur auf einem physiologisch relevanten ECM-Substrat auf eine Weise, die für viele weitere Labore zugänglich ist.
Die Flexibilität des ELT-Systems ist ein großer Vorteil dieser Plattform und sollte eine kleinräumige Lungengewebekultur mit einer beliebigen Anzahl von Gewebegerüsten, Zellen oder Kulturmedien von Interesse ermöglichen. Die Verwendung von Gerüsten, die aus erkranktem Gewebe oder aus Verletzungsmodellen gewonnen werden, kann die Untersuchung von Zell-Zell- oder Zell-Matrix-Interaktionen unter Berücksichtigung der krankheitsveränderten ECM27,29,51 ermöglichen. Beachten Sie jedoch, dass das Dezellularisierungsprotokoll möglicherweise angepasst werden muss, um Matrixunterschiede zwischen Spezies52 zu berücksichtigen. Die beschriebene Seeding-Strategie kann für jeden Zelltyp verwendet werden, und die Kulturzeitleiste kann an die Bedürfnisse des Forschers angepasst werden. Als Ausgangspunkt sollten 1 x 106 Zellen pro Gerüst innerhalb von 7 Tagen nach der Kultur ein hochzelliges Gewebe ergeben, während 1 x 105 Gesamtzellen zu einer schlechten Zellularität führen. Bei jeder Anpassung des Zeitrahmens sollten die Gewebekulturkassetten 24 h nach der letzten Gewebeaussaat aus dem Aussaatbad entfernt werden. Mit dem Ziel, einen Teil der zellulären Komplexität des Lungenalveolus zu modellieren, beschreiben wir hier eine Trikultur-Rezellularisierungsstrategie, die die Aufrechterhaltung gut differenzierter neonataler AEC2s in alveolarähnlichen Strukturen für mindestens 7 Tage unterstützt. Unsere Ergebnisse zeigen auch die erfolgreiche Transplantation von Fibroblasten und Endothelzellen innerhalb von ELTs, was die breite Anwendbarkeit des Kultursubstrats und seine Eignung für Co-Kulturstudien unterstreicht. Die Aussaat adulter Zellen in ELTs kann die Modellierung ruhigerer alveolarer Strukturen erleichtern, während die Aussaat humaner PSC-abgeleiteter AEC2s, einschließlich solcher mit genetischen Modifikationen, translationale Studien der menschlichen Krankheiterleichtern könnte 13,53. Im Allgemeinen bietet der Bottom-up-Ansatz, der durch die ELT-Plattform ermöglicht wird, die Beiträge bestimmter Zelltypen zu Auslesungen von Interesse zu untersuchen - wie z.B. AEC2-Proliferation oder Differenzierungszustand.
Zusammenfassend skizziert dieses Protokoll ein robustes System zur Erzeugung von künstlichem Lungengewebe für Co-Kulturstudien von AEC2s, Fibroblasten und Endothelzellen in azellulären ECM-Lungenschnittgerüsten. ELTs stellen eine neuartige 3D-Kulturstrategie für primäre AEC2s dar, die sich bisher typischerweise auf weniger physiologische Gel-Matrizen stützten, um einen gut differenzierten Phänotyp 6,11,12 aufrechtzuerhalten. Die aktuelle Plattform baut auf früheren Arbeiten zur Wiederbesiedlung von dezellularisierten Lungenschnitten 24,25,26,27,28,29 auf, bietet aber mehrere Vorteile: 1) ein Gewebekultur-Kassettensystem, um die ELT-Handhabung während der Dezellularisierung, Aussaat und Kultur zu erleichtern; 2) ein maßgeschneidertes Aussaatbad, um eine bekannte Anzahl von Zellen auf jedem Scheibengerüst präzise zu säen; und 3) eine Tri-Kultur-Reseeding-Strategie, die eine Wiederbesiedlung von Alveolargewebe mit Epithel-, mesenchymalen und Endothelzellen ermöglicht. Somit stellen ELTs einen wichtigen Schritt auf dem Weg zur Erstellung reproduzierbarer In-vitro-Modelle dar, die die Zell- und Substratkomplexität der nativen Alveole und der AEC2-Stammzellnische erfassen.
Offenlegungen
L.E.N. ist Gründer und Aktionär von Humacyte, Inc., einem Unternehmen für regenerative Medizin. Humacyte produziert künstliche Blutgefäße aus allogenen glatten Muskelzellen für die Gefäßchirurgie. Der Ehepartner von L.E.N. ist an Humacyte beteiligt, und L.E.N. ist Mitglied des Board of Directors von Humacyte. L.E.N. ist eine Erfinderin von Patenten, die an Humacyte lizenziert sind und Lizenzgebühren für L.E.N. L.E.N. erhalten haben, um die Forschung in ihrem Labor in Yale zu unterstützen. Humacyte hatte keinen Einfluss auf das Verhalten, die Beschreibung oder die Interpretation der Ergebnisse in diesem Bericht.
Danksagungen
Die Autoren danken Lorenzo Sewanan und Jorge Nunez für ihre Arbeit bei der Entwicklung des in diesem Protokoll verwendeten Gewebekulturkassettendesigns, dem Kaminski-Labor für die Verwendung ihres Vibratoms, Maurizio Chioccioli und Jessica Nouws für die Unterstützung beim Lungenschneiden, Allie LaRocco für die Unterstützung bei ersten Pilotexperimenten und Hong Qian für das sorgfältige Lesen des Protokolls. Diese Arbeit wurde durch die NIH-Zuschüsse F30HL143880 (K.L.L.), das Medical Scientist Training Program Training Grant T32GM136651 (K.L.L.) und U01HL145567 (L.E.N.) unterstützt; und durch ein uneingeschränktes Forschungsgeschenk von Humacyte Inc. (L.E.N.).
Materialien
| Name | Company | Catalog Number | Comments |
| 3D Printer: Form 2 | Formlabs | ||
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | |
| 8-Bromo cAMP | Sigma | B7880 | |
| Agarose, UltraPure LMP | Invitrogen | 15517-014 | |
| Amphotericin B | Sigma | A2942 | |
| Barbed reducer fitting, 3/8 inch x 1/4 inch | McMaster-Carr | 5121K271 | |
| Benzonase nuclease | Sigma | E1014 | |
| Bovine serum albumin (BSA) Fraction V | Gemini | 700-104P | For AEC2 growth medium |
| Bovine serum albumin (BSA), standard grade | Gemini | 700-100P | For benzonase buffer |
| Check valve, polypropylene, 1/8 inch hose barb | Cole-Parmer | SK-98553-10 | |
| CHIR99021 | PeproTech | 2520691 | |
| Clear Resin, 1 L | Formlabs | RS-F2-GPCL-04 | |
| Cyanoacrylate glue, such as Krazy Maximum Bond Permanent Glue | Any hardware, craft, or drug store | KG483 or similar | |
| Dexamethasone | Sigma | D4902 | |
| DMEM (low glucose) | Gibco | 11885-084 | |
| DMEM (high glucose) | Gibco | 11965-092 | |
| DNA assay (Quant-iT PicoGreen dsDNA Assay Kit) | Invitrogen | P7589 | |
| EDTA, 0.5 M, pH 8.0 | AmericanBio | AB00502-01000 | |
| EdU kit (Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647) | Invitrogen | C10340 | Used according to manufacturer's directions |
| Elbow fitting, 3/8 inch | McMaster-Carr | 5121K907 | |
| F12 | Gibco | 11765-054 | |
| Fetal bovine serum (FBS), characterized | Hyclone | SH30071.03 | |
| Gentamicin sulfate | Gemini | 400-100P | Reconstituted in diH2O for a stock solution at 50 mg/mL |
| Hair clippers | Wahl | MiniArco | |
| Hank's balanced salt solution (HBSS), Phenol Red Free | Gibco | 14175-095 | |
| Heparin sodium injection, USP, 1000 U/mL | Sagent | NDC: 25021-400-30 | For intraperitoneal and intracardiac injection |
| Heparin sodium salt | Sigma | H4784 | For pulmonary artery perfusion; prepare stock solution at 100 U/mL in PBS |
| HEPES Buffer | Corning | 25-060-Cl | |
| Inline tee fitting, 3/8 inch x 1/8 inch | McMaster-Carr | 5121K851 | |
| Inoculating loop, disposable | Fisherbrand | 22-363-600 | |
| Insulin from bovine pancreas | Sigma | I6634 | |
| Ketamine injection, 100 mg/mL | Covetrus (Butler Animal Health) | 010177 | |
| KGF, recombinant human | PeproTech | 100-19 | |
| Laser cutter, VLS 3.50 30 watt | Universal Laser Systems | ||
| L-glutamine | Gibco | 25030-081 | |
| Luer-lock, female, 3/32 inch | Cole-Parmer | 45508-02 | |
| Luer-lock, male, 1/8 inch | Cole-Parmer | 30800-24 | |
| Luer-lock, male, 1/4 inch | McMaster-Carr | 51525K146 | |
| MCDB-131 Complete without serum | VEC Technologies | MCDB-131 WOFBS | |
| Magnesium chloride (MgCl2), 1 M | AmericanBio | AB09006-00100 | |
| NaCl | American Bioananalytical | AB01915 | |
| Phosphate buffered saline (PBS), without Ca2+ and Mg2+, 10X | Sigma | D1408 | Reconstitute to 1X with diH2O |
| Phosphate buffered saline (PBS), with Ca2+ and Mg2+ | Gibco | 21300-058 | |
| PDMS - SYLGARD 184 Silicone Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Penicillin/Streptomycin (10,000 U/mL penicillin/10,000 μg/mL streptomycin) | Gibco | 15140-122 | |
| Petri dish, 150 mm | Falcon | 351058 | |
| Plastic film (parafilm) | Bemis | PM-996 | |
| Pharmed BPT tubing, LS 16 | Masterflex | 06508-16 | |
| Pharmed BPT tubing, LS 17 | Masterflex | 06508-17 | |
| Platinum-cured silicone tubing, LS 14 | Masterflex | 96420-14 | |
| Platinum-cured silicone tubing, LS 16 | Masterflex | 96420-16 | |
| Platinum-cured silicone tubing, LS 36 | Masterflex | 96410-36 | |
| Poloxamer 407 (Pluronic F-127) | Sigma | P2443 | |
| Povidone/iodine prep pads, 10% | Dynarex Corporation | 1108 | |
| PTFE sheet, 0.060 inch (1/16 inch) thick | ePlastics | PTFENAT0.060X12X12 | For tissue culture cassette tabs |
| PTFE sheet, 0.093 inch (3/32 inch) thick | ePlastics | PTFENAT0.093X12X12 | For tissue culture cassette frames and clips |
| Peristaltic pump drive: Masterflex L/S Variable-Speed Digital Drive | Cole-Parmer | ZM-07528-30 | |
| Peristaltic pump head: Masterflex L/S Easy-Load II Pump Head | Cole-Parmer | EW-77202-60 | |
| Rat, Sprague Dawley | Charles River | Strain Code: 400 | |
| Razor blade | Any hardware or craft store | Personna 94-120-71 or similar | |
| Retinoic acid | Sigma | R2625 | |
| Rotary blades, 28 mm | Omnigrid | 2046 | |
| Rotary cutter, 28 mm | Olfa | Model 9551 | |
| Sodium deoxycholate (SDC) | Sigma | D6750 | |
| Sodium nitrorusside (SNP) | Sigma | 71778 | |
| Stopcock, 4-way | Edwards | 594WSC | |
| Suture, 4-0 monofilament polypropylene | Covidien | VP-557-X | |
| Syringe, 10 mL | BD | 302995 | |
| Syringe, 50 mL | BD | 309653 | |
| Tissue culture dish, 35 mm | Falcon | 353001 | |
| Tissue culture dish, 100 mm | Corning | 430167 | |
| Tissue culture plate, 6-well | Falcon | 353046 | |
| Tissue culture plate 12-well | Falcon | 353043 | |
| Transferrin human | Sigma | T8158 | |
| Tris, 1 M solution, pH 8.0 | AmericanBio | AB14043-01000 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| Vibratome, Compresstome VF-300-0Z | Precisionary Instruments LLC | ||
| Xylazine, 100 mg/mL | Henry Schein | NDC: 11695-4022-1 | |
| Y-connector, 1/16 inch barbed | Cole-Parmer | 30614-43 |
Referenzen
- Burri, P. H. Morphology and respiratory function of the alveolar unit. International Archives of Allergy and Applied Immunology. 76, Suppl 1 2-12 (1985).
- Barkauskas, C. E., Noble, P. W. Cellular Mechanisms of Tissue Fibrosis. 7. New insights into the cellular mechanisms of pulmonary fibrosis. American Journal of Physiology. Cell Physiology. 306 (11), 987-996 (2014).
- Taylor, M. S., et al. A Conserved Distal Lung Regenerative Pathway in Acute Lung Injury. American Journal of Pathology. 188 (5), 1149-1160 (2018).
- Carsana, L., et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infectious Diseases. 20 (10), 1135-1140 (2020).
- Basil, M. C., et al. The Cellular and Physiological Basis for Lung Repair and Regeneration: Past, Present, and Future. Cell Stem Cell. 26 (4), 482-502 (2020).
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Desai, T. J., Brownfield, D. G., Krasnow, M. A. Alveolar progenitor and stem cells in lung development, renewal and cancer. Nature. 507 (7491), 190-194 (2014).
- Evans, M. J., Cabral, L. J., Stephens, R. J., Freeman, G. Renewal of alveolar epithelium in the rat following exposure to NO2. The American Journal of Pathology. 70 (2), 1-24 (1973).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Borok, Z., et al. Keratinocyte growth factor modulates alveolar epithelial cell phenotype in vitro: expression of aquaporin 5. American Journal of Respiratory Cell and Molecular Biology. 18 (4), 554-561 (1998).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Sucre, J. M. S., et al. Successful establishment of primary Type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Stem Cell. 21 (4), 472-488 (2017).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nature Methods. 14 (11), 1097-1106 (2017).
- Chen, Y. W., et al. A three-dimensional model of human lung development and disease from pluripotent stem cells. Nature Cell Biology. 19 (5), 542-549 (2017).
- Korogi, Y., et al. In vitro disease modeling of hermansky-pudlak syndrome Type 2 using human induced pluripotent stem cell-derived alveolar organoids. Stem Cell Reports. 12 (3), 431-440 (2019).
- Strikoudis, A., et al. Modeling of fibrotic lung disease using 3D organoids derived from human pluripotent stem cells. Cell Reports. 27 (12), 3709-3723 (2019).
- Bissell, M. J., Hall, H. G., Parry, G. How does the extracellular matrix direct gene expression. Journal of Theoretical Biology. 99 (1), 31-68 (1982).
- Chapman, H. A. Epithelial responses to lung injury: Role of the extracellular matrix. Proceedings of the American Thoracic Society. 9 (3), 89-95 (2012).
- Guilak, F., et al. Control of stem cell fate by physical interactions with the extracellular matrix. Cell Stem Cell. 5 (1), 17-26 (2009).
- Zhou, Y., et al. Extracellular matrix in lung development, homeostasis and disease. Matrix Biology. 73, 77-104 (2018).
- Calle, E. A., et al. Targeted proteomics effectively quantifies differences between native lung and detergent-decellularized lung extracellular matrices. Acta Biomaterialia. 46, 91-100 (2016).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Bonvillain, R. W., et al. A nonhuman primate model of lung regeneration: Detergent-mediated decellularization and initial in vitro recellularization with mesenchymal stem cells. Tissue Engineering Part A. 18 (23-24), 2437-2452 (2012).
- O'Neill, J. D., et al. Decellularization of human and porcine lung tissues for pulmonary tissue engineering. The Annals of Thoracic Surgery. 96 (3), 1055(2013).
- Wagner, D. E., et al. Three-dimensional scaffolds of acellular human and porcine lungs for high throughput studies of lung disease and regeneration. Biomaterials. 35 (9), 2664-2679 (2014).
- Burgstaller, G., et al. Distinct niches within the extracellular matrix dictate fibroblast function in (cell free) 3D lung tissue cultures. American Journal of Physiology-Lung Cellular and Molecular Physiology. 314 (5), 708-723 (2018).
- Sun, H., et al. Fibroblast engraftment in the decellularized mouse lung occurs via a β1-integrin-dependent, FAK-dependent pathway that is mediated by ERK and opposed by AKT. American Journal of Physiology-Lung Cellular and Molecular Physiology. 306 (6), 463-475 (2014).
- Booth, A. J., et al. Acellular normal and fibrotic human lung matrices as a culture system for in vitro investigation. American Journal of Respiratory and Critical Care Medicine. 186 (9), 866-876 (2012).
- Schwan, J., et al. Anisotropic engineered heart tissue made from laser-cut decellularized myocardium. Scientific Reports. 6, 32068(2016).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Gerckens, M., et al. Generation of Human 3D Lung Tissue Cultures (3D-LTCs) for Disease Modeling. Journal of Visualized Experiments. (144), (2019).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465(2017).
- Neuhaus, V., et al. Assessment of the cytotoxic and immunomodulatory effects of substances in human precision-cut lung slices. Journal of Visualized Experiments. (135), e57042(2018).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (6), 1315-1321 (2002).
- Vaccaro, C., Brody, J. S. Ultrastructure of developing alveoli. I. The role of the interstitial fibroblast. The Anatomical Record. 192 (4), 467-479 (1978).
- Calle, E. A., et al. Fate of distal lung epithelium cultured in a decellularized lung extracellular matrix. Tissue Engineering Part A. 21 (11-12), 1916-1928 (2015).
- Dobbs, L. G., Gonzalez, R., Williams, M. C. An improved method for isolating type II cells in high yield and purity. American Review of Respiratory Disease. 134 (1), 141-145 (1986).
- Dobbs, L. G. Isolation and culture of alveolar type II cells. American Journal of Physiology. 258, 134-147 (1990).
- Gonzalez, R. F., Dobbs, L. G. Isolation and culture of alveolar epithelial Type I and Type II cells from rat lungs. Methods in Molecular Biology. 945, 145-159 (2013).
- Dobbs, L. G., Pian, M. S., Maglio, M., Dumars, S., Allen, L. Maintenance of the differentiated type II cell phenotype by culture with an apical air surface. The American Journal of Physiology. 273 (2), 347-354 (1997).
- Bruce, M. C., Honaker, C. E. Transcriptional regulation of tropoelastin expression in rat lung fibroblasts: changes with age and hyperoxia. American Journal of Physiology. 274 (6), 940-950 (1998).
- Berk, J. L., Franzblau, C., Goldstein, R. H. Recombinant interleukin-1 beta inhibits elastin formation by a neonatal rat lung fibroblast subtype. Journal of Biological Chemistry. 266 (5), 3192-3197 (1991).
- Schultz, C. J., Torres, E., Londos, C., Torday, J. S. Role of adipocyte differentiation-related protein in surfactant phospholipid synthesis by type II cells. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (2), 288-296 (2002).
- Maksvytis, H. J., et al. In vitro characteristics of the lipid-filled interstitial cell associated with postnatal lung growth: evidence for fibroblast heterogeneity. Journal of Cellular Physiology. 118, 113-123 (1984).
- Hopkinson, A., et al. Optimization of amniotic membrane (AM) denuding for tissue engineering. Tissue Engineering Part C: Methods. 14 (4), 371-381 (2008).
- Fernandez-Perez, J., Ahearne, M. The impact of decellularization methods on extracellular matrix derived hydrogels. Scientific Reports. 9 (1), 14933(2019).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nature medicine. 16 (8), 927-933 (2010).
- Le, A. V., et al. Efficient and Functional Endothelial Repopulation of Whole Lung Organ Scaffolds. ACS Biomaterials Science & Engineering. 3 (9), 2000-2010 (2017).
- Ren, X., et al. Engineering pulmonary vasculature in decellularized rat and human lungs. Nature Biotechnology. 33 (10), 1097-1102 (2015).
- Wagner, D. E., et al. Comparative decellularization and recellularization of normal versus emphysematous human lungs. Biomaterials. 35 (10), 3281-3297 (2014).
- Balestrini, J. L., et al. Comparative biology of decellularized lung matrix: Implications of species mismatch in regenerative medicine. Biomaterials. 102, 220-230 (2016).
- Alysandratos, K. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636(2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten