Method Article
Dissezione crio-sezione della zona subependimale adulta per un'analisi quantitativa accurata e profonda del proteoma
In questo articolo
Riepilogo
La dissezione della crio-sezione consente la preparazione fresca e congelata della più grande nicchia neurogena nel cervello murino per l'analisi quantitativa profonda del proteoma. Il metodo è preciso, efficiente e provoca una minima perturbazione tissutale. Pertanto, è ideale per studiare il microambiente molecolare di questa nicchia, così come altri organi, regioni e specie.
Abstract
La nicchia neurogena subependimale è costituita da un nastro paraventricolare della parete ventricolare laterale del ventricolo laterale. La zona subependimale (SEZ) è una regione sottile e distinta esposta ai ventricoli e al liquido cerebrospinale. L'isolamento di questa nicchia consente l'analisi di un microambiente neurogenico di cellule staminali. Tuttavia, l'estrazione di piccoli tessuti per l'analisi del proteoma è impegnativa, soprattutto per il mantenimento di una notevole profondità di misura e il raggiungimento di una robustezza affidabile. Un nuovo metodo chiamato crio-sezione-dissezione (CSD), che combina alta precisione con minima perturbazione tissutale, è stato sviluppato per affrontare queste sfide. Il metodo è compatibile con i metodi di spettrometria di massa (MS) all'avanguardia che consentono il rilevamento di regolatori di nicchia a bassa abbondanza. Questo studio ha confrontato il CSD e i suoi dati sul proteoma con il metodo e i dati ottenuti mediante microdissezione a cattura laser (LCM) e una dissezione standard a montaggio intero. Il metodo CSD ha portato al doppio della profondità di quantificazione in meno della metà del tempo di preparazione rispetto all'LCM e allo stesso tempo ha chiaramente superato la precisione di dissezione dell'intero monte. Quindi, CSD è un metodo superiore per raccogliere la SEZ per l'analisi del proteoma.
Introduzione
Poiché la neurogenesi è limitata nel cervello adulto, varie strategie di riparazione del sistema nervoso centrale trarrebbero grande beneficio da una maggiore comprensione delle basi della sostituzione neurale adulta. I roditori ci hanno aiutato a capire i meccanismi di base della neurogenesi postnatale, anche se va notato che la neurogenesi adulta è fortemente dipendente dalla specie. Nei topi, ci sono tre nicchie di cellule staminali neurali adulte (NSC). L'ipotalamo è una nicchia NSC adulta con potenziale neurogeno1,2, mentre la neurogenesi adulta continua è principalmente limitata all'ippocampo3 e alla SEZ delle pareti laterali dei ventricoli laterali4,5,6. La SEZ è la più grande regione germinale contenente NSC (cellule di tipo B) che si sviluppano in neuroblasti (cellule di tipo A) attraverso cellule progenitrici che amplificano il transito (cellule di tipo C). La SEZ contiene il 20-35% delle cellule di tipo B, l'1-15% delle cellule di tipo C, l'1-30% delle cellule di tipo A e il 25-50% delle cellule ependimali7. La SEZ presenta una microarchitettura complessa, con cellule endoteliali, cellule microgliali e cellule ependimali che risiedono e influenzano la nicchia delle cellule staminali8,9,10. Sebbene i neuroni siano scarsi nella SEZ, gli assoni provenienti da fonti distanti come lo striato, l'area tegmentale ventrale o l'ipotalamo raggiungono e influenzano le cellule di tipo B4. Una caratteristica unica di questa nicchia di cellule staminali è la separazione tra il sito di proliferazione e il sito di differenziazione. Dopo la proliferazione, i progenitori neuronali migrano di diversi millimetri dalla SEZ al bulbo olfattivo, dove si differenziano terminalmente in neuroni e si integrano in circuiti neurali preesistenti. Le indagini sui programmi intrinseci delle cellule associate alla neurogenesi hanno già fornito conoscenze importanti per la riprogrammazione cellulare terapeutica sperimentale e le strategie di trapianto15,16,17,18,19,20. Tuttavia, i segnali estrinseci delle cellule regolano anche la neurogenesi e gli ambienti tissutali possono determinare il destino neurogeno delle cellule staminali11,12,14,21,22,23. Di conseguenza, lo studio del microambiente delle nicchie neurogeniche e della sua interazione con le cellule staminali è di cruciale importanza.
La matrice extracellulare (ECM) e altre proteine secrete sono una grande parte del microambiente. Per un'identificazione e una quantificazione accurate, un approccio proteomico è più adatto di un approccio trascrittomico per determinare la composizione dell'ECM a causa della bassa correlazione tra trascrittoma e livelli proteici per ECM24,25. Inoltre, vi sono prove sostanziali che i regolatori di nicchia nella ZES non sono prodotti esclusivamente da cellule che popolano la nicchia stessa. Posizioni più distanti, come il plesso coroideo, secernono segnali modulatori trasmessi alle cellule staminali attraverso il liquido cerebrospinale22,23. Studiare il proteoma di nicchia può aiutare a identificare regolatori di nicchia presenti nella nicchia indipendentemente dal loro sito di produzione, dato che una parte sostanziale del microambiente extracellulare è assemblata da proteine.
Per raccogliere la zona ventricolare murina per un'analisi proteomica imparziale, è necessario un metodo con alta precisione, catturando il nastro paraventricolare sottile di circa 50 μm contenente cellule staminali escludendo il tessuto dello striato adiacente. Inoltre, la perturbazione tissutale durante la dissezione deve essere ridotta al minimo per analizzare il microambiente extracellulare perché le proteine solubili, compresi i fattori di crescita o le citochine, potrebbero essere lavate via facilmente. Sebbene sia possibile analizzare gli spettri di massa del tessuto fisso, l'agente richiesto, come la paraformaldeide, ridurrà la profondità di identificazione della proteina e potrebbe introdurre modifiche post-traduzionali. Una comune dissezione SEZ integrale, ad esempio per la raccolta di cellule per l'analisi di selezione cellulare attivata dalla fluorescenza, rimuove l'intera SEZ con le forbici26. Questa dissezione standard è veloce con una minima perturbazione tissutale. Tuttavia, la contaminazione striatale dei campioni non può essere evitata. Al contrario, LCM ha l'eccezionale vantaggio di una precisione di dissezione superiore. Tuttavia, LCM può introdurre perturbazioni tissutali, ad esempio, a causa di colorazione di fondo o denaturazione proteica causata dal laser. Per combinare i punti di forza della dissezione a tutto monte e LCM, è stato sviluppato un nuovo metodo compatibile con la SM, chiamato dissezione crio-sezione (CSD) (Figura 1A-D). Il CSD consente l'estrazione della SEZ e la dissezione della SEZ delle pareti mediali dei ventricoli laterali (MEZ), che è una regione di controllo ideale, per lo più non neurogena per la SEZ (vedi il protocollo). Il proteoma di nicchia ottenuto dalla combinazione di CSD e metodi MS all'avanguardia si è rivelato utile per la caratterizzazione e l'identificazione di nuovi regolatori in questa nicchia NSC adulta25. Quindi, questo metodo sarà utile per la determinazione della composizione proteica tissutale SEZ.
Protocollo
Tutte le procedure sperimentali in questo studio sono state eseguite in conformità con le linee guida tedesche e dell'Unione europea e sono state approvate dal comitato istituzionale per la cura degli animali e dal governo dell'alta Baviera (Regierung von Oberbayern). Per gli esperimenti sono stati utilizzati solo topi maschi C57Bl6 di età compresa tra 8 e 10 settimane.
1. Preparazione del cervello del topo (~ 15 min per topo)
- Preparare il mezzo di dissezione aggiungendo 5 mL di 1 M HEPES (concentrazione finale 10 mM) a 500 mL di 1x Hank's Balanced Salt Solution (HBSS).
NOTA: Il tempo di conservazione del mezzo di dissezione (+4 °C) non deve superare le 2 settimane. - Sacrificare i topi per lussazione cervicale e sezionare attentamente il cervello.
NOTA: Quando si indaga sull'ECM, il tessuto deve preferibilmente essere non modificato. La lussazione cervicale mantiene il tempo di dissezione il più breve possibile, prevenendo così il più possibile l'autodigestione enzimatica post-mortale. Se la rimozione del sangue è fondamentale per la domanda di ricerca, è sufficiente perfondere il topo transcardialmente con soluzione salina tamponata con fosfato (PBS) prima di rimuovere il cervello. - Estrarre il cervello mediante dissezione manuale e metterlo in un piatto di coltura contenente un mezzo di dissezione ghiacciato (Figura 1B - 1).
NOTA: Mantenere il cervello in mezzo di dissezione sul ghiaccio per tutta la dissezione. - Rimuovere il bulbo olfattivo (OB) con un bisturi (Figura 1B - 2) con un taglio coronale dritto tra l'OB e il polo anteriore della corteccia.
- Rimuovere il polo anteriore della corteccia con il bisturi usando un taglio coronale per rendere visibili i ventricoli laterali nel piano coronale (Figura 1B - 3).
NOTA: Assicurarsi che il taglio coronale sia fatto ~ 5 mm rostralmente dal chiasma ottico; in caso contrario, la parte rostrale della SEZ/MEZ andrà persa. - Usando le forbici, aprire entrambi i ventricoli laterali dall'alto, iniziando con una sezione sagittale dalla superficie corticale al lume ventricolare, e allungare questo taglio in modo a forma di C dopo la flessione ventricolare (Figura 1B - 4).
- Collegare le estremità caudali dell'incisione sagittale sinistra e destra mediante un ulteriore taglio coronale con le forbici.
NOTA: I tre tagli ora formano un trapezio e faciliteranno la rimozione della corteccia e del corpo calloso nella fase successiva. - Rimuovere la corteccia e il corpo calloso che coprono i ventricoli laterali usando una pinza (Figura 1B - 5). Quindi, rimuovere la corteccia e il corpo calloso che coprono le pareti ventricolari mediali. Qui, fare tagli aggiuntivi se il tessuto è attaccato alle pareti ventricolari mediali, o semplicemente sollevare la corteccia e il corpo calloso con le forbici per rimuovere il tessuto.
- Distribuire con cura le pareti ventricolari con una pinza (Figura 1B - 6). Rimuovere il plesso coroideo con una pinza.
NOTA: la rimozione completa del plesso coroideo è importante per evitare interferenze con le seguenti fasi di dissezione ed evitare potenziali contaminazioni dei campioni SEZ/MEZ. - Metti il cervello su un vetrino e posiziona il vetrino sopra il ghiaccio secco per congelare il cervello. Mantenere le pareti ventricolari nella configurazione aperta.
NOTA: Garantire una distanza sufficiente tra le pareti laterali e mediali del ventricolo per facilitare la dissezione precisa ed esclusiva di SEZ e MEZ. Se il tessuto si contrae di nuovo in una configurazione chiusa, utilizzare la pinza per fissare le pareti nella posizione desiderata durante il congelamento. Evitare qualsiasi danno alla SEZ/MEZ. Prova ad applicare una forza minima, principalmente sul bordo superiore dei ventricoli aperti.
2. Sezionamento del cervello preparato (~ 15 minuti per topo)
- Tagliare sezioni coronali spesse 50-100 μm del cervello fino alla fine del ventricolo laterale usando un criostato e montare le sezioni su vetrini. Assicurarsi che il cervello sia attaccato alla piastra di attacco del criostato al cervello posteriore con mezzo OCT e che nessun OCT entri in contatto con il proencefalo, specialmente nei ventricoli.
NOTA: il supporto dello Strumento di personalizzazione di Office interferirà con le misurazioni MS. Tuttavia, se il tessuto verrà utilizzato per un test anticorpale, non è necessario escludere il mezzo OCT. L'uso di vetrini rivestiti non è raccomandato. I vetrini rivestiti applicano troppa forza di attrazione sul tessuto, impedendo così la traslocazione del campione di tessuto dai vetrini nel tubo microcentrifuga nei passaggi seguenti.
3. Dissezione a mano libera di fette di cervello (~ 30 min per topo)
- Posizionare i vetrini con le sezioni cerebrali sul ghiaccio secco sotto un microscopio di dissezione (Figura 1C - 1).
- Preparare i tubi microcentrifuga su ghiaccio secco e assicurarsi che i tubi rimangano sul ghiaccio secco per almeno 1 minuto per essere sufficientemente freddi prima del trasferimento del campione.
NOTA: utilizzare tubi microcentrifuga di alta qualità, poiché alcuni tubi di bassa qualità possono perdere plastica nelle successive fasi di digestione dei tessuti associate alle misurazioni della SM. - Sollevare le fette dal ghiaccio secco per 15-30 s per ottenere un breve scongelamento incompleto per rendere la mielina compatta dello striato osservabile come punti bianchi densi.
NOTA: La localizzazione del confine tra la SEZ e lo striato diventa fattibile (Figura 1C - 2, vedere figura 2A per l'esclusione della mielina e un confronto con il metodo dell'intero monte). Se lo scongelamento richiede troppo tempo, il processo può essere accelerato premendo un dito coperto di guanti sul lato opposto della diapositiva di vetro. Tuttavia, questa manovra dovrebbe essere praticata in quanto l'eccessivo scongelamento si verifica facilmente. - Separare la SEZ con un bisturi preraffreddato dallo striato adiacente (Figura 1C,D).
- Trasferire la SEZ come pezzo intero o sezionato in 2-4 parti in un tubo microcentrifuga utilizzando il bordo smussato del bisturi raffreddato. Se il tessuto deve essere utilizzato per un altro tipo di analisi diverso dalla SM, trasferire invece il campione di tessuto nel contenitore appropriato (ad esempio, una piastra a 96 pozzetti).
NOTA: il taglio del tessuto completamente congelato può portare a una rapida rottura e caduta del tessuto dal vetrino. Il taglio del tessuto completamente scongelato porta alla disintegrazione del tessuto. Assicurarsi che il tessuto non sia completamente congelato né completamente scongelato.
Risultati
Quando si seguono i passaggi precedenti, i campioni di tessuto nei tubi di microcentrifuga sono pronti e compatibili con la preparazione del campione MS. Dopo la preparazione del campione, abbiamo ottenuto ~ 5-7 μg di peptidi per campione di SEZ o MEZ per topo. Tuttavia, le quantità finali dei peptidi possono dipendere dal metodo di preparazione della SM. Nei confronti con i proteomi riportati di seguito, l'identificazione delle proteine e la profondità di quantificazione (500-1.000 proteine per campione) sono state aumentate abbinando computazionalmente gli spettri peptidici alle librerie di spettri peptidici create per ciascuna regione tissutale25,27. In particolare, il metodo di nano frazionamento senza perdita utilizzato qui per la creazione delle librerie di spettri peptidici non è attualmente disponibile in commercio. I dati grezzi di MS sono stati analizzati utilizzando il software MaxQuant28, ottenendo precisioni di massa nell'intervallo di parti per miliardo29. L'ambiente Max Quant consente la corrispondenza tra le esecuzioni MS. L'abbondanza di proteine è stata quantificata utilizzando un algoritmo di quantificazione privo di etichette30. La colorazione immunoistochimica è stata effettuata su tessuti freschi congelati ed eseguita come precedentemente riportato25 (vedere la Tabella dei materiali).
Crio-sezione-dissezione
La SEZ e la MEZ complete di topi adulti (n = 4) sono state ottenute utilizzando CSD (vedi Figura 1 e protocollo). La corteccia somatosensoriale (Cx) è stata sezionata con forbici chirurgiche. Altri 4 topi sono stati sezionati nello stesso modo; tuttavia, il tessuto sezionato è stato raggruppato in un campione per regione per creare la libreria del proteoma (10.923 proteine identificate) per una maggiore identificazione e quantificazione delle proteine nei singoli campioni25. Nei quattro singoli campioni, (media ± SD) 6.673 ± 317,4 proteine sono state quantificate nella SEZ e 6.747 ± 37,7 nella MEZ. Tutti i dati di proteomica MS sono stati depositati nel Consorzio ProteomeXchange tramite il repository dei partner PRIDE31 e il numero di adesione per i proteomi qui riportati è ProteomeXchange: PXD016632 (http://proteomecentral.proteomexchange.org).
Confronto con la dissezione a montaggio intero
La dissezione a montaggio intero è stata eseguita secondo un protocollo standard26. La dissezione a tutto volume ha rivelato un numero simile di proteine (circa 6.000 per SEZ e 6.000 per Cx, n = 4 per gruppo) rispetto a CSD25. Uno dei miglioramenti previsti dall'utilizzo del CSD per la SEZ, invece di un protocollo di dissezione a tutto volume, è la riduzione della potenziale contaminazione striatale. Nei campioni SEZ contaminati da tessuto di un'altra regione, le proteine candidate rilevate non possono essere assegnate a una regione poiché un arricchimento significativo può derivare dalla regione di interesse e dal contaminatore. Immunoistochimicamente, le capsule interne positive alla glicoproteina associata alla mielina (MAG) dello striato sono state identificate nei campioni integrali, ma raramente nei campioni CSD (Figura 2A). La contaminazione striatale nei campioni di tutto il gruppo potrebbe essere confermata identificando l'arricchimento delle proteine mieliniche nella SEZ rispetto ai campioni di corteccia somatosensoriale (Cx) Grey Matter (GM) (Figura 2B). Si noti che gran parte del Cx GM, in particolare gli strati superiori di Cx, non sono mielinizzati32.
Poiché grandi fasci di fibre passano attraverso lo striato, la contaminazione da parte di questa regione ha provocato l'arricchimento delle proteine mieliniche rispetto al Cx. Le proteine mieliniche utilizzate come marcatori per la contaminazione striatale nei campioni SEZ erano la proteina di base della mielina (MBP), la glicoproteina associata alla mielina (MAG), la proteina proteolipidica 1 (Plp1) e la nucleotide 2',3'-ciclico-nucleotide 3'-fosfodiesterasi (Cnp). Tutte le proteine marcatori mieliniche sono state significativamente arricchite nella SEZ rispetto alla Cx. Al contrario, i confronti per le quattro proteine marcatori mieliniche nel set di dati CSD non hanno prodotto differenze significative quando si confrontano SEZ con Cx (Figura 2B). I dati proteomici dello striato33 supportano l'ipotesi che l'arricchimento delle proteine mieliniche nei campioni SEZ della dissezione dell'intero monte sia stato causato dalla contaminazione con tessuto striatale. Quindi, il CSD ha in gran parte impedito la contaminazione da tessuto striatale (ricco di mielina compatta) rispetto a una dissezione integrale.
L'analisi imparziale del proteoma del tessuto non dissociato può rivelare interessanti proteine extracellulari. Con una migliore dissezione utilizzando il CSD, le proteine associate extracellulari sono state significativamente arricchite nei campioni rispetto ai campioni integrali (Figura 2C, test di arricchimento dell'annotazione). Il CSD e la dissezione a montaggio intero mostrano un arricchimento comparabile dei termini di ontologia genica (GO) "esosoma vescicolare extracellulare" e "parte della regione extracellulare". Tuttavia, il termine GO "matrisome-associated" è leggermente più arricchito nel CSD che nella dissezione integrale. Di conseguenza, l'enzima cross-binding ECM e il regolatore della neurogenesi recentemente scoperto transglutaminasi-2 (Tgm2) sono stati trovati arricchiti nella SEZ rispetto al Cx utilizzando il CSD25. Al contrario, non è stata trovata alcuna differenza tra i campioni SEZ e Cx ottenuti dalla dissezione a tutto monte (Figura 2D). I dati proteomici dello striato33 supportano l'ipotesi che la rilevazione del regolatore della neurogenesi Tgm2 mediante dissezione integrale sia stata ostacolata dalla contaminazione con tessuto striatale. Quindi, nel complesso, la dissezione della crio-sezione è un miglioramento riuscito ma anche necessario alla dissezione standard per l'analisi del proteoma specifico di nicchia.
Confronto con la microscopia a cattura laser
La metà anteriore della SEZ e la MEZ di 3 topi adulti sono state ottenute per LCM (Figura 3A). Nel complesso, il metodo LCM presenta alcuni svantaggi, in particolare per quanto riguarda la perturbazione e l'efficienza dei tessuti. Per visualizzare la regione di interesse al microscopio di dissezione, è necessaria la colorazione di fondo, potenzialmente lavando via proteine piccole o solubili di interesse, ad esempio fattori di crescita, citochine o regolatori ECM come gli enzimi. Inoltre, le diapositive trascorrono tempi variabili a temperatura ambiente durante la rimozione laser. Inoltre, il laser stesso potrebbe denaturare le proteine di interesse.
CSD ha un notevole vantaggio rispetto a LCM per quanto riguarda il tempo e lo sforzo necessari per eseguire la dissezione: la fase 1 del protocollo deve essere eseguita in modo simile sia per CSD che per LCM; senza questo passaggio, le pareti ventricolari rimangono aderenti, rendendo difficile la separazione dei campioni MEZ e SEZ. Dato che le sezioni CSD (100 μm) sono 6-7 volte più spesse dello spessore massimo34 delle sezioni LCM (15 μm), la fase 2 (sezionamento del cervello) e la fase 3 (rimozione del MEZ e della SEZ da ciascuna sezione coronale) richiederanno almeno 6-7 volte più tempo per LCM. La necessaria colorazione di fondo e l'impostazione del microscopio laser consumeranno più tempo. Qui, ci sono voluti tre volte più tempo per raccogliere il 50% della ZES e MEZ di 3 animali da LCM rispetto al 100% della SEZ e MEZ di 4 animali da CSD, costituendo un vantaggio di otto volte la velocità di CSD. In sintesi, LCM non solo richiede una notevole quantità di sforzo aggiuntivo, ma il tessuto è anche sottoposto a un periodo sostanzialmente più lungo di manipolazione e sbalzi di temperatura che possono compromettere la dinamica e l'affidabilità dei dati generati dalle successive analisi.
I risultati MS di CSD sono stati confrontati con i risultati della microdissezione a cattura laser (LCM). Entrambi i set di dati sono stati abbinati alla libreria proteomica generata dal pool di campioni CSD. In media, LCM ha prodotto 3.441 ± 270,0 e 3.613 ± 238,7 singole proteine rispettivamente nella SEZ e nella zona ventricolare mediale (Figura 3B). Data la notevole differenza nell'identificazione delle proteine, l'analisi dei componenti principali (PCA) ha mostrato una separazione distinta secondo il metodo di dissezione (componente 1: 62,7%, non mostrato). La componente 2 ha mostrato la maggiore separazione per SEZ e MEZ tra i campioni LCM (8,5%, Figura 3C). Anche la componente 3 sembra separare LCM e CSD; tuttavia, questa differenza potrebbe derivare da differenze basate sul metodo piuttosto che dal numero di proteine identificate (6,4%). Tuttavia, la separazione regionale complessiva è rimasta sorprendentemente distinta per i dati di crio-dissezione e di gran lunga migliore rispetto a LCM. Questa discrepanza nella dinamica dei dati può derivare da diversi tempi trascorsi dai campioni a temperatura ambiente durante la dissezione laser o da una maggiore suscettibilità di piccoli tessuti pari a variabilità nei successivi protocolli di proteomica e misure di spettrometria di massa.
Per cercare differenze nel profilo proteoma dell'ECM, è stato eseguito un test di arricchimento dell'annotazione 2D tra CSD e LCM per sez e MEZ (Figura 3D). Il calcolo dell'arricchimento relativo dei termini GO tra campioni LCM e CSD consente il confronto della dinamica relativa del proteoma dei cluster proteici ECM tra i due metodi nonostante la quantità ineguale di tessuto e le differenze nel protocollo di dissezione. Le trame rivelano una buona correlazione tra LCM e CSD. Le annotazioni "parte della regione extracellulare" e "organello extracellulare legato alla membrana" sono arricchite in modo simile sia nei metodi che nelle regioni. Quindi, l'aumento della domanda di tempo di LCM non sembra essere compensato da una sensibilità relativamente più elevata per le proteine associate all'ECM. Invece, CSD fornisce un'identificazione / quantificazione più robusta quando si confrontano i dati del campione per la neurogenesi e le proteine ECM associate a SEZ Tgm2, Thrombospondin-4 (Thbs4), S100a6 e Tenacin-C (Tnc) (Figura 3E). Nel caso di TnC, sebbene quantificato in tutti i campioni, solo CSD ha mostrato arricchimento per SEZ rispetto a MEZ. Tuttavia, le proteine di membrana basale Associate a SEZ Nidogen-1 (Nid1), la subunità beta-2 della laminina (Lamb2) e la proteina del nucleo di eparan solfato specifico della membrana basale (Hspg2)35 hanno mostrato un arricchimento ancora più robusto nella SEZ (rispetto alla MEZ) nei campioni LCM rispetto ai campioni CSD (non mostrati). Pertanto, CSD può fornire campioni di tessuto che forniscono un proteoma quantitativo accurato e profondo per la caratterizzazione SEZ in un lasso di tempo ragionevole, senza preoccuparsi dell'integrità tissutale compromessa o della perdita di proteine.
Statistica
Test statistici, test di arricchimento delle annotazioni 2D e PCA sono stati eseguiti nell'ambiente Perseus. Le proteine sono state incluse nell'analisi se è stato rilevato un valore valido per ciascun metodo in almeno un campione. L'abbondanza di proteine e i confronti numerici sono stati visualizzati utilizzando un software di analisi dei dati (vedere la Tabella dei materiali). Un controllo basato sulla permutazione del tasso di falsa scoperta (FDR) (FDR è stato impostato su 0,05, 250 randomizzazioni) è stato impiegato per i confronti proteici. Per i test di arricchimento con annotazioni 2D36, i termini GO visualizzati sono notevolmente arricchiti (FDR è stato impostato su 0,02 utilizzando il metodo di controllo FDR di Benjamini-Hochberg).
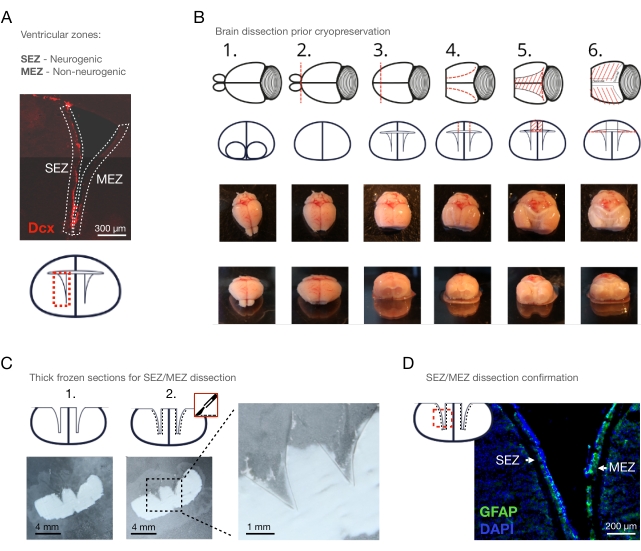
Figura 1: Il metodo Cryo-Section-Dissection. (A) Panoramica della regione di interesse: il ventricolo laterale con la SEZ neurogena e la MEZ non neurogena. Neuroblasti immunocolorati con Dcx. (B) Rimozione graduale dell'OB, del polo anteriore, della corteccia e del corpo calloso sopra i ventricoli e il plesso coroideo: 1. posizionamento nel mezzo di dissezione, 2. rimozione dell'OB, 3. rimozione del polo anteriore della corteccia, 4. incisioni sagittali della parte superiore ventricolare, 5. rimozione della parte superiore ventricolare, 6. diffusione delle pareti ventricolari. (C) 100 μm di fette coronali del cervello di topo appena congelato, (1.) prima e (2.) dopo la rimozione delle pareti ventricolari con un bisturi ghiacciato. Barre della scala = 4 mm (D) Colorazione di una sezione coronale di un ventricolo laterale (GFAP: verde; DAPI: blu), che mostra la SEZ e la MEZ sezionate con il CSD. Barre di scala = 300 μm (A), 200 μm (D). Abbreviazioni: CSD = dissezione crio-sezione; SEZ = zona subependimale; MEZ = zona ependimale mediale; Dcx = Doppiacortina; OB = bulbo olfattivo; GFAP = proteina acida fibrillare gliale; DAPI = 4′,6-diamidino-2-fenilindolo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Precisione di dissezione superiore con la dissezione a sezione criometrica rispetto alla dissezione a montaggio intero. (A) Immagine immunoistochimica di un campione SEZ ottenuto mediante dissezione a montaggio intero (a sinistra). L'inclusione del tessuto striatale ricco di mielina viene visualizzata mediante colorazione contro MAG (verde) . Colorazione di una ZES sezionata con il CSD (a destra). Nel CSD, quasi tutta la mielina striatale (colorazione contro MAG, verde) è esclusa dal nastro campione. I nuclei sono stati visualizzati utilizzando DAPI (blu). (B) Confronto dell'arricchimento del marcatore mielinico in SEZ vs. Cx da intero monte (MBP: p = 0,0074; MAG: p = 0,0016; Plp1: p = 0,0011; CNP: p = 0,0029) e CSD (MBP: p = 0,0667; MAG: p = 0,0236; Plp1: p = 0,3420; CNP: p = 0,1842). (C) Test di arricchimento con annotazioni 2D che confronta l'intero monte-SEZ con i campioni CSD-SEZ. I termini GO spazio extracellulare e matrisoma-associato sono più arricchiti nei dati CSD che nei dati wholemount. (D) L'abbondanza proteica del regolatore NSC Tgm225 tracciata per la dissezione integrale e il CSD. Tgm2 è significativamente arricchito nella SEZ rispetto al Cx in CSD (CSD: p = 0,0029; Interomontaggio: p = 0,1775). Per B e D: Come riferimento, i dati sul proteoma di Sharma et al.33 con misurazioni dello striato e della corteccia tracciati per le proteine corrispondenti visualizzate nei campioni di intero monte e CSD. Barre di scala = 200 μm (A). Abbreviazioni: CSD = dissezione crio-sezione; SEZ = zona subependimale; MAG = glicoproteina associata alla mielina; Cx = corteccia somatosensoriale; MBP = proteina di base della mielina; Plp1 = proteolipide-proteina 1; CNP = 2',3'-nucleotide ciclico 3'-fosfodiesterasi; GO = ontologia genica; NSC = cellula staminale neurale; Tgm2 = tranglutaminasi 2; DAPI = 4′,6-diamidino-2-fenilindolo; LFQ = quantificazione senza etichetta. Fare clic qui per visualizzare una versione più grande di questa figura.
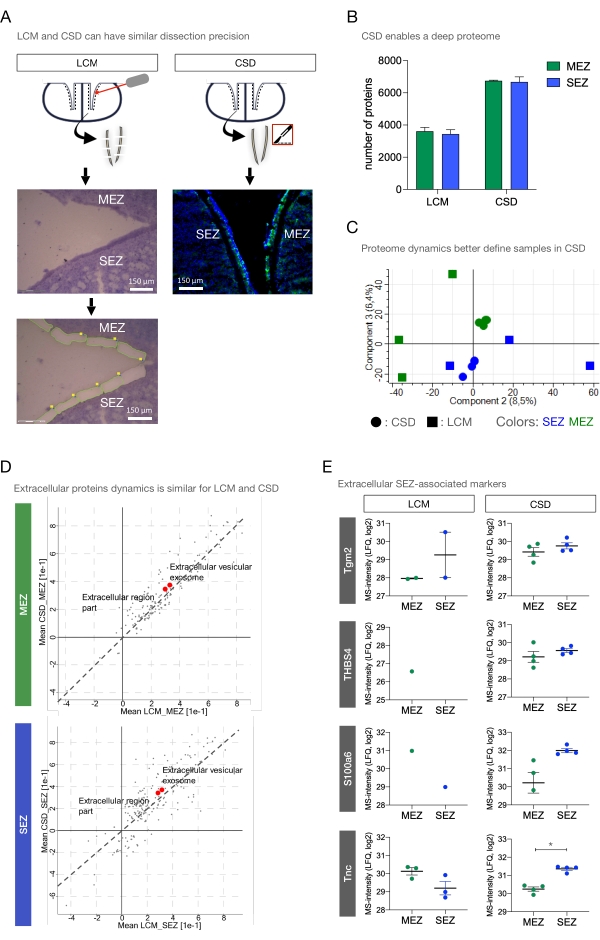
Figura 3: Migliorata la quantificazione delle proteine extracellulari con la dissezione della crio-sezione rispetto a LCM. (A) Colorazione viola Cresyl di un ventricolo laterale prima e dopo la cattura laser della SEZ e della MEZ (a sinistra). Per confronto, l'incisione CSD della SEZ e MEZ (a destra). Barre di scala = 150 μm. (B) Confronto del numero di proteine rilevate nei campioni SEZ e MEZ da CSD e LCM. I dati sono presentati come ± SD. (C) Analisi delle componenti principali dei campioni SEZ e MEZ confrontando CSD e LCM (componente 2: 8,5% della varianza; componente 3: 6,4%). (D) Arricchimento dell'annotazione 2D del MEZ criosezionato e sezionato al laser (in alto) e SEZ (in basso). I termini GO organello extracellulare e parte della regione extracellulare sono significativamente arricchiti (punti rossi). (E) Abbondanza di proteine marcatori extracellulari associate a SEZ in SEZ e MEZ per LCM (Tnc: p = 0,3789) e campioni CSD (Tgm2: p = 0,2940; S100a6: p = 0,0218; THBS4: p = 0,3941; Tnc: p = 0,0004). Abbreviazioni: CSD = dissezione crio-sezione; LCM = microdissezione a cattura laser; SEZ = zona subependimale; MEZ = zona ependimale mediale; GO = ontologia genica; Tnc = Tenacin-C; Tgm2 = transglutaminasi 2; S100a6 = S100 proteina legante il calcio A6; THBS4 = trombospondina-4; LFQ = quantificazione senza etichetta. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il metodo CSD ha permesso di estrarre con precisione il tessuto SEZ e generare un proteoma affidabile con profondità significativa utilizzando MS. CSD mostra un chiaro vantaggio rispetto alla dissezione integrale in termini di contaminazione striatale notevolmente ridotta dei campioni SEZ e arricchimento proteico extracellulare. Poiché è anche possibile rilevare un numero simile di proteine in singoli campioni (~ 6.500 proteine per campione) con CSD e dissezione integrale, il tempo aggiuntivo per CSD vale la pena. LCM fornisce una dissezione SEZ più precisa ma ha raggiunto una profondità del proteoma inferiore, con solo 3.500 proteine per campione nonostante l'utilizzo dello stesso protocollo MS del CSD (corrispondenza della libreria e quantificazione senza etichetta). È importante sottolineare che la variabilità era molto maggiore, probabilmente a causa del tempo di preparazione otto volte più lungo per campione. La PCA dei campioni ottenuti da LCM e CSD rivela una chiara separazione di entrambi i metodi con cluster ristretti specifici per regione robustamente separati l'uno dall'altro. Al contrario, i campioni LCM hanno mostrato una distribuzione più sparsa, che è probabilmente in parte dovuta alla lunghezza della preparazione. Non è chiaro se la raccolta di molti più campioni in un periodo più lungo avrebbe prodotto un proteoma di uguale robustezza e profondità con LCM. Calcolando una stima, la raccolta di un volume di campione simile a quello fatto per CSD richiederebbe 5-8 volte più tempo con LCM, anche fino a 15 volte più a lungo se fossero inclusi campioni forniti per le librerie di spettri peptidici, e gran parte di esso in condizioni scongelate. Inoltre, considerando le perturbazioni aggiuntive del tessuto necessarie per LCM (colorazione di fondo, dissezione laser), LCM ha fornito poco, se non nessuno, guadagno rispetto al CSD. Quindi, csd può essere considerato più adatto per la ricerca sul proteoma extracellulare, in particolare per la SEZ.
In particolare, se la regione di interesse è più piccola della ZES (ad esempio, studiando solo lo strato cellulare ependimale), un approccio a mano libera rimane indietro rispetto all'accuratezza dell'LCM. Ad esempio, l'uso di CSD per separare l'ependimale dallo strato subependimale è difficile in quanto lo strato ependimale è largo solo un diametro cellulare e la demarcazione verso lo strato subependimale non è visibile ad occhio nudo nel tessuto fresco congelato. Quindi, LCM sarà una scelta migliore rispetto a CSD se una dissezione precisa su una scala inferiore a 50 μm è più importante del tessuto indisturbato o mantenere il tempo di dissezione breve. Per le regioni con una larghezza di 50 μm e oltre, tuttavia, la precisione del CSD è paragonabile a quella della LCM per l'analisi delle proteine ECM.
Csd si è già dimostrato utile contribuendo allo studio del ruolo funzionale dell'ECM nella nicchia neurogena25. Quindi, la continua applicazione del CSD nella SEZ per varie indagini su proteine e proteomi (o anche il sequenziamento dell'RNA a nucleo singolo) potrebbe portare al rilevamento di ulteriori regolatori della neurogenesi, marcatori di attivazione delle cellule staminali e una comprensione più profonda della fisiologia di nicchia delle cellule staminali SEZ. Considerando il declino della neurogenesi nell'invecchiamento della SEZ37, un'analisi concisa dei cambiamenti ECM della SEZ di topi anziani rispetto a quelli giovani potrebbe promuovere la comprensione degli esatti meccanismi di nicchia che favoriscono lo sviluppo e il mantenimento di NSC38,39. Inoltre, l'influenza dell'infiammazione e delle lesioni sulla neurogenesi SEZ è ben consolidata40,41,42,43. L'arricchimento del fibrinogeno derivato dal sangue nella SEZ dopo lesione cerebrale corticale e la sua influenza sull'astrogliogenesi SEZ e sulla formazione di cicatrici44 evidenzia la potenziale influenza dei cambiamenti del microambiente indotti da traumi sulla fisiologia delle cellule staminali SEZ. Quindi, studiare il proteoma SEZ-ECM in associazione con lesioni cerebrali usando CSD potrebbe aiutare a chiarire i meccanismi con cui la lesione e l'infiammazione influenzano la neurogenesi. È importante sottolineare che il metodo potrebbe anche essere applicabile alle nicchie neurogeniche del cervello umano in salute e malattia, poiché il tessuto fresco congelato può spesso essere ottenuto da interventi chirurgici. Inoltre, date le differenze di specie nella neurogenesi adulta, sarebbe anche affascinante applicare il metodo CSD ad altre specie, ad esempio in associazione alla neurogenesi striatale. Inoltre, con altri metodi di rilevamento delle proteine, le differenze nei fattori di crescita prodotti localmente possono essere studiate in modo accurato ed efficiente utilizzando CSD per SEZ e MEZ (ad esempio, ELISA).
Infine, la procedura di dissezione potrebbe potenzialmente essere modificata per l'estrazione accurata di altre regioni del cervello, anche per questioni di ricerca non correlate alla neurogenesi. Ad esempio, il CSD include una breve fase di semi-scongelamento, durante la quale la mielina compatta è visibile come aree bianche distinte dal tessuto cerebrale residuo più traslucido. Con una semplice modifica del metodo, questa caratteristica consentirebbe la dissezione precisa del solo tessuto mielinico compatto del corpo calloso, che potrebbe essere sottoposto ad analisi proteomica dei cambiamenti correlati alle lesioni. Un suggerimento di una modifica del protocollo che consentirebbe la dissezione del corpo callosa è quello di omettere i passaggi 1.5-1.9 del protocollo e procedere direttamente alla preparazione delle sezioni coronali invece di aprire i ventricoli per rendere accessibili la SEZ e la MEZ. Quindi, posizionare le sezioni su ghiaccio secco, sollevare brevemente e semi-scongelare le fette e rimuovere semplicemente il corpo calloso con un bisturi. Questa preparazione dovrebbe ora essere pronta per qualsiasi analisi che richieda una dissezione efficiente del tessuto del corpo calloso nativo.
In sintesi, questo studio presenta un metodo di micro-dissezione che potrebbe essere utilizzato per un'analisi affidabile del proteoma di nicchia neurogenico ventricolare. I dati sottolineano la compatibilità e l'utilità del metodo CSD insieme all'analisi proteomica basata su MS del microambiente SEZ. La combinazione di precisione, efficienza e minima perturbazione tissutale rende il CSD una preziosa estensione dei metodi esistenti.
Divulgazioni
Gli autori dichiarano di non avere interessi concorrenti
Riconoscimenti
Desideriamo ringraziare sinceramente Mathias Mann per averci permesso di eseguire gran parte degli esperimenti nel suo laboratorio, Fabian Coscia per l'aiuto con LCM e analisi del proteoma, Tatiana Simon-Ebert per le dissezioni integrali e Korbinian Mayr e Igor Paron per il loro aiuto tecnico. Riconosciamo con gratitudine il finanziamento del Consiglio tedesco della ricerca a MG (SFB870, TFR274), all'UE (Eranet S-700982-5008-001), al CER (aERC "NeuroCentro" a MG), alla società svedese per la ricerca medica (SSMF, a JK) e alle fondazioni e fondi KI (2020-01351, a JK).
Materiali
| Name | Company | Catalog Number | Comments |
| Cryostat CM3050S | Leica | ||
| Dissecting microscope | Leica | ||
| Dumont no. 5SF forceps, Inox super fine tip | Fine Science Tools | cat. no. 11252-00 | |
| Hank’s Balanced Salt Solution with CaCl2 and MgCl2 | Invitrogen | cat. no. 24020 | |
| HEPES buffer solution (1 M) | Invitrogen | cat. no. 15630 | |
| Microscope slides | RS France | cat. no. BPB018 | |
| Safe-lock tubes, PCR clean 2.0 mL | Eppendorf | cat. no. 0030123344 | |
| Spring scissors, Vannas-Tubingen 5 mm | Fine Science Tools | cat. no. 15003-08 | |
| Surgical disposable scalpels | B. Braun | cat. no. 5518083 | |
| Tissue culture dishes 60 mm | Greiner Bio-One | cat. no. 633180 | |
| Antibodies | |||
| Alexa Fluor secondary antibodies (488, 555) (1/1,000) | ThermoFisher Scientific | cat. no. A-11001 | |
| DAPI | Sigma | cat. no. D9542 | |
| guinea pig polyclonal anti-DCX 1:500 | Millipore | cat. no. AB2253, | |
| mouse monoclonal anti-GFAP 1:500 | Sigma | cat. no. G3893 | |
| mouse monoclonal anti-MAG 1:400 | Millipore | cat. no. MAB1567 | |
| Software | |||
| GraphPad Prism version 9 | GraphPad Software, San Diego California USA | www.graphpad.com | |
| Perseus Version 1.6.10.50 | Max-Planck Institute for Biochemistry, Munich Bavaria Germany | https://maxquant.net/perseus/ | |
| ZEN imaging software | Carl Zeiss |
Riferimenti
- Goodman, T., Hajihosseini, M. K. Hypothalamic tanycytes-masters and servants of metabolic, neuroendocrine, and neurogenic functions. Frontiers in Neuroscience. 9, 387 (2015).
- Chaker, Z., et al. Hypothalamic neurogenesis persists in the aging brain and is controlled by energy-sensing IGF-I pathway. Neurobiology of Aging. 41, 64-72 (2016).
- Kuhn, H. G., Toda, T., Gage, F. H. Adult hippocampal neurogenesis: a coming-of-age story. Journal of Neuroscience. 38 (49), 10401-10410 (2018).
- Obernier, K., Alvarez-Buylla, A. Neural stem cells: origin, heterogeneity and regulation in the adult mammalian brain. Development. 146 (4), (2019).
- Obernier, K., et al. Adult neurogenesis is sustained by symmetric self-renewal and differentiation. Cell Stem Cell. 22 (2), 221-234 (2018).
- Bordiuk, O. L., Smith, K., Morin, P. J., Semënov, M. V. Cell proliferation and neurogenesis in adult mouse brain. PloS One. 9 (11), 111453 (2014).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain. Journal of Neuroscience. 17 (13), 5046-5061 (1997).
- Lim, D. A., Alvarez-Buylla, A. The adult ventricular-subventricular zone (V-SVZ) and olfactory bulb (OB) neurogenesis. Cold Spring Harbor Perspectives in Biology. 8 (5), 018820 (2016).
- Sato, K. Effects of microglia on neurogenesis. Glia. 63 (8), 1394-1405 (2015).
- Tavazoie, M., et al. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3 (3), 279-288 (2008).
- Sirko, S., et al. Chondroitin sulfates are required for fibroblast growth factor-2-dependent proliferation and maintenance in neural stem cells and for epidermal growth factor-dependent migration of their progeny. Stem Cells. 28 (4), 775-787 (2010).
- Mercier, F. Fractones: extracellular matrix niche controlling stem cell fate and growth factor activity in the brain in health and disease. Cellular and Molecular Life Sciences: CMLS. 73 (24), 4661-4674 (2016).
- Mercier, F., Kitasako, J. T., Hatton, G. I. Anatomy of the brain neurogenic zones revisited: fractones and the fibroblast/macrophage network. Journal of Comparative Neurology. 451 (2), 170-188 (2002).
- Nascimento, M. A., Sorokin, L., Coelho-Sampaio, T. Fractone bulbs derive from ependymal cells and their laminin composition influence the stem cell niche in the subventricular zone. Journal of Neuroscience. 38 (16), 3880-3889 (2018).
- Chen, G., et al. In vivo reprogramming for brain and spinal cord repair. eNeuro. 2 (5), 0106-0115 (2015).
- Zhang, Q., Chen, W., Tan, S., Lin, T. Stem cells for modeling and therapy of Parkinson's disease. Human Gene Therapy. 28 (1), 85-98 (2017).
- Wei, C., Xiong, S., Cheng, L. Reprogramming of fibroblasts to neural stem cells by a chemical cocktail. Methods in Molecular Biology. 2117, 265-270 (2020).
- Tian, Z., Zhao, Q., Biswas, S., Deng, W. Methods of reactivation and reprogramming of neural stem cells for neural repair. Methods. 133, 3-20 (2018).
- Heinrich, C., et al. Sox2-mediated conversion of NG2 glia into induced neurons in the injured adult cerebral cortex. Stem Cell Reports. 3 (6), 1000-1014 (2014).
- Masserdotti, G., et al. Transcriptional mechanisms of proneural factors and REST in regulating neuronal reprogramming of astrocytes. Cell Stem Cell. 17 (1), 74-88 (2015).
- Seidenfaden, R., Desoeuvre, A., Bosio, A., Virard, I., Cremer, H. Glial conversion of SVZ-derived committed neuronal precursors after ectopic grafting into the adult brain. Molecular and Cellular Neurosciences. 32 (1-2), 187-198 (2006).
- Lepko, T., et al. Choroid plexus-derived miR-204 regulates the number of quiescent neural stem cells in the adult brain. EMBO Journal. 38 (17), 100481 (2019).
- Silva-Vargas, V., Maldonado-Soto, A. R., Mizrak, D., Codega, P., Doetsch, F. Age-dependent niche signals from the choroid plexus regulate adult neural stem cells. Cell Stem Cell. 19 (5), 643-652 (2016).
- Angelidis, I., et al. An atlas of the aging lung mapped by single cell transcriptomics and deep tissue proteomics. Nature Communications. 10 (1), 963 (2019).
- Kjell, J., et al. Defining the adult neural stem cell niche proteome identifies key regulators of adult neurogenesis. Cell Stem Cell. 26 (2), 277-293 (2020).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal flow. Journal of Visualized Experiments: JoVE. (39), e1938 (2010).
- Kulak, N. A., Geyer, P. E., Mann, M. Loss-less nano-fractionator for high sensitivity, high coverage proteomics. Molecular & Cellular Proteomics: MCP. 16 (4), 694-705 (2017).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11 (12), 2301-2319 (2016).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nature Biotechnology. 26 (12), 1367-1372 (2008).
- Cox, J., et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Molecular & Cellular Proteomics: MCP. 13 (9), 2513-2526 (2014).
- Perez-Riverol, Y., et al. The PRIDE database and related tools and resources in 2019: improving support for quantification data. Nucleic Acids Research. 47 (1), 442-450 (2019).
- Tomassy, G. S., et al. Distinct profiles of myelin distribution along single axons of pyramidal neurons in the neocortex. Science. 344 (6181), 319-324 (2014).
- Sharma, K., et al. Cell type- and brain region-resolved mouse brain proteome. Nature Neuroscience. 18 (12), 1819-1831 (2015).
- Datta, S., et al. Laser capture microdissection: Big data from small samples. Histology and Histopathology. 30 (11), 1255-1269 (2015).
- Kerever, A., et al. Novel extracellular matrix structures in the neural stem cell niche capture the neurogenic factor fibroblast growth factor 2 from the extracellular milieu. Stem Cells. 25 (9), 2146-2157 (2007).
- Cox, J., Mann, M. 1D and 2D annotation enrichment: a statistical method integrating quantitative proteomics with complementary high-throughput data. BMC Bioinformatics. 13, 12 (2012).
- Daynac, M., Morizur, L., Chicheportiche, A., Mouthon, M. -. A., Boussin, F. D. Age-related neurogenesis decline in the subventricular zone is associated with specific cell cycle regulation changes in activated neural stem cells. Scientific Reports. 6, 21505 (2016).
- Navarro Negredo, P., Yeo, R. W., Brunet, A. Aging and rejuvenation of neural stem cells and their niches. Cell Stem Cell. 27 (2), 202-223 (2020).
- Smith, L. K., White, C. W., Villeda, S. A. The systemic environment: at the interface of aging and adult neurogenesis. Cell and Tissue Research. 371 (1), 105-113 (2018).
- Neuberger, E. J., Swietek, B., Corrubia, L., Prasanna, A., Santhakumar, V. Enhanced dentate neurogenesis after brain injury undermines long-term neurogenic potential and promotes seizure susceptibility. Stem Cell Reports. 9 (3), 972-984 (2017).
- Fisch, U., Brégère, C., Geier, F., Chicha, L., Guzman, R. Neonatal hypoxia-ischemia in rat elicits a region-specific neurotrophic response in SVZ microglia. Journal of Neuroinflammation. 17 (1), 26 (2020).
- Götz, M., Sirko, S., Beckers, J., Irmler, M. Reactive astrocytes as neural stem or progenitor cells: In vivo lineage, In vitro potential, and Genome-wide expression analysis. Glia. 63 (8), 1452-1468 (2015).
- Kernie, S. G., Parent, J. M. Forebrain neurogenesis after focal Ischemic and traumatic brain injury. Neurobiology of Disease. 37 (2), 267-274 (2010).
- Pous, L., et al. Fibrinogen induces neural stem cell differentiation into astrocytes in the subventricular zone via BMP signaling. Nature Communications. 11 (1), 630 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon