Method Article
冷冻切片解剖成人室管膜下区,用于准确和深入的定量蛋白质组分析
摘要
低温切片解剖允许新鲜,冷冻地制备小鼠大脑中最大的神经源性生态位,以进行深层定量蛋白质组分析。该方法精确,高效,并且引起最小的组织扰动。因此,它非常适合研究该生态位的分子微环境以及其他器官,区域和物种。
摘要
室管膜下神经源性龛位由外侧心室外壁的心室旁带组成。室管膜下区(SEZ)是暴露于脑室和脑脊液的薄而明显的区域。这种生态位的分离允许分析神经源性干细胞微环境。然而,提取小组织进行蛋白质组分析具有挑战性,特别是对于保持相当大的测量深度和实现可靠的稳健性。为了应对这些挑战,开发了一种称为冷冻切片解剖(CSD)的新方法,该方法将高精度与最小的组织扰动相结合。该方法与最先进的质谱(MS)方法兼容,允许检测低丰度的利基调节剂。本研究将CSD及其蛋白质组数据与激光捕获显微解剖(LCM)和标准全贴片解剖获得的方法和数据进行了比较。与LCM相比,CSD方法在不到一半的制备时间内使定量深度增加了一倍,同时明显优于全安装解剖的解剖精度。因此,CSD是收集经济特区进行蛋白质组分析的优越方法。
引言
由于成人大脑中的神经发生受到限制,各种中枢神经系统修复策略将大大受益于对成人神经替代基础的更多理解。啮齿动物帮助我们了解了产后神经发生的基本机制,尽管应该指出的是,成体神经发生在很大程度上依赖于物种。在小鼠中,有三个成体神经干细胞(NSC)生态位。下丘脑是具有神经源性潜力的成年NSC生态位1,2,而连续的成人神经发生主要限于海马体3和侧脑室侧壁的经济特区4,5,6。经济特区是含有NSCs(B型细胞)的最大生发区,通过转运扩增祖细胞(C型细胞)发育成神经母细胞(A型细胞)。经济特区包含20-35%的B型细胞,1-15%的C型细胞,1-30%的A型细胞和25-50%的室管膜细胞7。经济特区具有复杂的微结构,内皮细胞、小胶质细胞和室管膜细胞驻留在干细胞龛中并影响干细胞龛位8,9,10。虽然经济特区中的神经元稀缺,但来自遥远来源(如纹状体、腹侧被盖区或下丘脑)的轴突会到达并影响B型细胞4。这种干细胞生态位的一个独特特征是增殖位点和分化位点之间的分离。增殖后,神经元祖细胞从经济特区迁移到嗅球几毫米,在那里它们最终分化成神经元并整合到预先存在的神经回路中。对与神经发生相关的细胞内在程序的研究已经为实验治疗细胞重编程和移植策略提供了重要的知识15,16,17,18,19,20。然而,细胞外源信号也调节神经发生,组织环境可以决定干细胞的神经源性命运11,12,14,21,22,23。因此,研究神经源性生态位的微环境及其与干细胞的相互作用至关重要。
细胞外基质(ECM)和其他分泌的蛋白质是微环境的重要组成部分。为了进行准确的鉴定和定量,蛋白质组学方法比转录组学方法更适合确定ECM组成,因为转录组与ECM水平之间的相关性较低24,25。此外,有大量证据表明,经济特区中的利基监管机构并不完全由生态位本身的细胞产生。更远的位置,如脉络丛,分泌通过脑脊液传递到干细胞的调节信号22,23。研究生态位蛋白质组可以帮助识别独立于其生产地点的利基调节因子,因为细胞外微环境的很大一部分是由蛋白质组装的。
为了收集小鼠心室区域进行无偏蛋白质组学分析,需要一种高精度的方法,捕获含有干细胞的约50μm薄的心室旁带,同时排除相邻纹状体的组织。此外,解剖过程中的组织扰动必须最小化以分析细胞外微环境,因为可溶性蛋白质,包括生长因子或细胞因子,可以很容易地被洗掉。虽然可以分析固定组织的质谱,但所需的试剂(例如多聚甲醛)会降低蛋白质鉴定深度,并可能引入翻译后修饰。常见的全系列SEZ解剖,例如,用于收集用于荧光激活细胞分选分析的细胞,使用scissors去除整个SEZ26。这种标准解剖速度快,组织扰动最小。然而,无法避免样品的纹状体污染。相反,LCM具有卓越的解剖精度的突出优势。然而,LCM可能会引入组织扰动,例如,由于背景染色或激光引起的蛋白质变性。为了结合全联切除和LCM的优势,开发了一种与MS兼容的新方法,称为冷冻截面解剖(CSD)(图1A-D)。CSD允许提取经济特区和解剖侧心室内侧壁(MEZ)的经济特区,这是经济特区的理想,主要是非神经源性控制区域(见方案)。通过CSD和最先进的MS方法的组合获得的利基蛋白质组被证明可用于表征和鉴定该成人NSC利基中的新型调节因子25。因此,该方法将可用于测定SEZ组织蛋白组成。
研究方案
本研究中的所有实验程序均按照德国和欧盟指南进行,并得到机构动物护理委员会和上巴伐利亚州政府(Regierung von Oberbayern)的批准。实验仅使用年龄在8-10周之间的雄性C57Bl6小鼠。
1. 小鼠大脑的准备(每只小鼠约15分钟)
- 通过将5 mL的1 M HEPES(终浓度10mM)加入500mL的1x Hank平衡盐溶液(HBSS)来准备解剖培养基。
注意:解剖培养基(+4°C)的储存时间不应超过2周。 - 通过颈椎脱位处死小鼠并仔细解剖大脑。
注意:在研究ECM时,组织最好是未修饰的。宫颈脱位使解剖时间尽可能短,从而尽可能防止死后酶促自动消化。如果去除血液对研究问题至关重要,只需在切除大脑之前用磷酸盐缓冲盐水(PBS)经心电图给小鼠灌注即可。 - 通过手动解剖提取大脑并将其置于含有冰冷解剖培养基的培养皿中(图1B - 1)。
注意:在整个解剖过程中,将大脑保持在冰上的解剖介质中。 - 用手术刀(图1B - 2)通过OB和皮层前极之间的直冠切口取出嗅球(OB)。
- 使用冠状切口用手术刀去除皮层的前极,使外侧心室在冠状平面上可见(图1B - 3)。
注意:确保日冕切口从视交叉向约5毫米处进行;否则,经济特区/MEZ的屋顶部分将丢失。 - 使用剪刀,从顶部打开两个侧心室,从皮质表面到心室腔的矢状面开始,并在心室屈曲后以C形方式拉长该切口(图1B - 4)。
- 通过用剪刀切开额外的冠状动脉来连接左右矢状切口的尾端。
注意:这三个切口现在形成梯形,并将促进下一步中皮质和胼胝体的去除。 - 使用镊子去除覆盖外侧心室的皮质和胼胝体(图1B - 5)。然后,去除覆盖内侧心室壁的皮质和胼胝体。在这里,如果组织附着在内侧心室壁上,则进行额外的切割,或者简单地用剪刀抬起皮质和胼胝体以移开组织。
- 用镊子小心地铺开心室壁(图1B - 6)。用镊子切除脉络丛。
注:完全去除脉络丛对于避免干扰以下解剖步骤并避免SEZ / MEZ样品的潜在污染非常重要。 - 将大脑放在载玻片上,将载玻片放在干冰上以冻结大脑。将心室壁保持在开放配置中。
注意:确保心室外侧壁和内侧壁之间有足够的距离,以便于对经济特区和MEZ进行精确和排他性的解剖。如果组织收缩回封闭结构,请在冷冻期间使用镊子将壁固定在所需位置。避免对经济特区/MEZ造成任何损害。尝试施加最小的力,主要是在打开的心室的顶部边缘。
2.切片准备好的大脑(每只小鼠约15分钟)
- 使用低温恒温器切割50-100μm厚的大脑冠状切片,直到侧脑室的末端,并将切片安装到载玻片上。确保大脑与OCT培养基附着在后脑的低温恒温器附着板上,并且没有OCT与前脑接触,特别是在心室。
注意:OCT 培养基会干扰 MS 测量。但是,如果组织将用于抗体测定,则无需排除OCT培养基。不建议使用镀膜载玻片。涂覆的载玻片在组织上施加过多的粘合力,从而在以下步骤中阻碍组织标本从载玻片易位到微量离心管。
3. 徒手解剖脑切片(每只小鼠约30分钟)
- 将载玻片和脑切片放在解剖显微镜下的干冰上(图1C - 1)。
- 在干冰上准备微量离心管,并确保管在干冰上停留至少1分钟,以便在样品转移之前足够冷。
注意:使用高质量的微量离心管,因为一些低质量的离心管可能会在与MS测量相关的后续组织消化步骤中脱落塑料。 - 将切片从干冰中抬起15-30秒,以实现短暂的,不完全的解冻,使纹状体的致密髓鞘可观察到为致密的白点。
注:确定经济特区和纹状体之间的边界变得可行(图1C - 2,参见 图2A ,了解髓鞘的排除以及与全坐方法的比较)。如果解冻时间过长,可以通过将戴手套的手指按压在载玻片的另一侧来加速该过程。但是,由于容易发生过度解冻,因此应练习此操作。 - 用预冷的手术刀将经济特区与相邻的纹状体分开(图1C,D)。
- 使用冷却手术刀的钝边将经济特区作为一个整体或分成2-4个部分转移到微量离心管中。如果组织用于MS以外的其他类型的分析,请将组织标本转移到适当的容器中(例如,96孔板)。
注意:切除完全冷冻的组织可能导致组织迅速断裂并从载玻片上脱落。切割完全解冻的组织会导致组织的分解。确保组织既不完全冷冻也不完全解冻。
结果
当遵循上述步骤时,微量离心管中的组织样品已准备好并与MS样品制备兼容。样品制备后,我们每只小鼠获得约5-7μgSEZ或MEZ样品的肽。然而,肽的最终量可能取决于MS的制备方法。在下面的蛋白质组比较中,通过将肽谱与为每个组织区域创建的肽谱库进行计算匹配,增加了蛋白质鉴定和定量深度(每个样品500-1,000个蛋白质)25,27。值得注意的是,这里用于创建肽谱库的无损纳米分馏方法目前尚未上市。使用MaxQuant软件28分析原始MS数据,实现了十亿分之一范围内的质量精度29。Max Quant 环境允许在 MS 运行之间进行匹配。使用无标记定量算法定量蛋白质丰度30。在新鲜冷冻组织上进行免疫组织化学染色,并如前所述进行25 (见 材料表)。
冷冻切片解剖
使用CSD获得成年小鼠的完整SEZ和MEZ(n = 4)(见 图1 和方案)。用手术剪刀解剖躯体感觉皮层(Cx)。以相同的方式解剖另外4只小鼠;然而,将解剖的组织汇集到每个区域一个样品中,以创建蛋白质组文库(10,923种已鉴定的蛋白质),以增加单个样品中的蛋白质鉴定和定量25。在四个单独的样本中,(平均±SD)在经济特区定量了6,673±317.4个蛋白质,在MEZ中量化了6,747个±37.7个蛋白质。所有MS蛋白质组学数据都通过PRIDE31 合作伙伴存储库存放在ProteomeXchange联盟中,此处报告的蛋白质组的加入号是ProteomeXchange:PXD016632(http://proteomecentral.proteomexchange.org)。
与全挂式解剖的比较
全挂解剖是根据标准协议进行的26。与CSD25相比,Wholemount解剖显示蛋白质数量相似(SEZ约为6,000,Cx约为6,000,每组n = 4)。在经济特区使用CSD而不是全山解剖方案的预期改进之一是减少潜在的纹状体污染。在被来自另一个区域的组织污染的经济特区样品中,检测到的候选蛋白不能分配到一个区域,因为感兴趣的区域和污染者可能会产生显着的富集。在免疫组织化学上,在全山样品中鉴定出纹状体的髓鞘相关糖蛋白(MAG)阳性的富含髓鞘的内部胶囊,但在CSD样品中很少(图2A)。通过鉴定经济特区中髓鞘蛋白的富集与体感皮层(Cx)灰质(GM)样品相比,可以确认全山样品中的纹状体污染(图2B)。请注意,Cx GM的大部分,尤其是上部Cx层,都是无髓鞘的32。
当大纤维束穿过纹状体时,与Cx相比,该区域的污染导致髓鞘蛋白的富集。在SEZ样品中用作纹状体污染标志物的髓鞘蛋白是髓鞘碱性蛋白(MBP),髓鞘相关糖蛋白(MAG),蛋白脂蛋白1(Plp1)和2',3'-环核苷酸3'-磷酸二酯酶(Cnp)。与Cx相比,所有髓鞘标记蛋白在经济特区中均显着富集.相反,在比较SEZ和Cx时,CSD数据集中四种髓鞘标记蛋白的比较没有显着差异(图2B)。纹状体33 的蛋白质组学数据支持以下假设,即全坐体解剖的SEZ样品中髓鞘蛋白的富集是由纹状体组织的污染引起的。因此,与全上部解剖相比,CSD在很大程度上防止了纹状体组织(富含致密髓鞘)的污染。
对非解离组织的无偏蛋白质组分析可以揭示有趣的细胞外蛋白。使用CSD改进解剖,与全山样品相比,样品中的细胞外相关蛋白显着富集(图2C,注释富集测试)。CSD和全上位解剖显示出基因本体(GO)术语"细胞外囊泡外泌体"和"细胞外区域部分"的可比富集。然而,GO术语"母系体相关"在CSD中比在全山解剖中稍微丰富一些。因此,与使用CSD25的Cx相比,在经济特区中发现了ECM交联酶和最近发现的神经发生调节剂谷氨酰胺转移酶-2(Tgm2)。相比之下,通过全安装解剖获得的SEZ和Cx样品之间没有发现差异(图2D)。纹状体33 的蛋白质组学数据支持以下假设,即通过全上部剥离检测神经发生调节剂Tgm2受到纹状体组织污染的阻碍。因此,总体而言,冷冻切片解剖是对用于生态位特异性蛋白质组分析的标准解剖的成功但也是必要的改进。
与激光捕获显微镜的比较
获得LECM的SEZ的前半部分和3只成年小鼠的MEZ(图3A)。总体而言,LCM方法表现出一些缺点,特别是在组织扰动和效率方面。为了在解剖显微镜下可视化感兴趣的区域,需要进行背景染色,可能会洗去感兴趣的小的或可溶性的蛋白质,例如生长因子,细胞因子或ECM调节剂,例如酶。此外,在激光去除过程中,载玻片在室温下花费不同的时间。此外,激光本身可能会使感兴趣的蛋白质变性。
在进行解剖所需的时间和精力方面,CSD比LCM具有相当大的优势:对于CSD和LCM,必须以类似的方式执行协议的步骤1;如果不采取这一步骤,心室壁仍然粘附,使得MEZ和SEZ样本的分离变得困难。鉴于CSD切片(100μm)比LCM切片的最大厚度34 (15μm)厚6-7倍,LCM的步骤2(大脑切片)和步骤3(从每个日冕切片中移除MEZ和SEZ)将至少需要6-7倍的时间。必要的背景染色和设置激光显微镜将消耗额外的时间。在这里,LCM收获3只动物的50%的经济特区和MEZ的时间是CSD的100%和4只动物的MEZ的100%的时间的三倍,构成了CSD的八倍速度优势。总之,LCM不仅需要大量的额外努力,而且组织还受到更长的操作和温度变化,这可能会损害后续分析生成的数据的动态和可靠性。
将CSD的MS结果与激光捕获显微切割(LCM)的结果进行比较。两个数据集都与通过汇集CSD样本生成的蛋白质组学库相匹配。平均而言,LCM在经济特区和内侧心室区分别产生了3,441±270.0和3,613±238.7个单独的蛋白质(图3B)。鉴于蛋白质鉴定的显着差异,主成分分析(PCA)根据解剖方法显示出明显的分离(成分1:62.7%,未显示)。组分2显示LCM样品中经济特区和MEZ的分离最大(8.5%, 图3C)。构成部分3似乎也将LCM和CSD分开;然而,这种差异可能是由基于方法的差异而不是已鉴定蛋白质的数量(6.4%)引起的。尽管如此,冷冻解剖数据的整体区域分离仍然截然不同,并且比LCM要好得多。数据动力学的这种差异可能是由于在激光解剖期间标本在室温下花费的不同时间,或者在随后的蛋白质组学方案和质谱测量中,小组织量对变异性的敏感性较高。
为了寻找ECM蛋白质组剖面的差异,对经济特区和MEZ进行了CSD和LCM之间的2D注释富集测试(图3D)。计算LCM和CSD样品之间GO项的相对富集允许比较两种方法之间ECM蛋白簇的相对蛋白质组动力学,尽管组织数量不等且解剖方案存在差异。这些图揭示了LCM和CSD之间的良好相关性。注释"细胞外区域部分"和"细胞外膜结合细胞器"在方法和区域中同样富集。因此,LCM增加的时间需求似乎并没有得到ECM相关蛋白质相对较高的灵敏度的补偿。相反,在比较神经发生和SEZ相关ECM蛋白Tgm2,血栓消退素-4(Thbs4),S100a6和Tenacin-C(Tnc)的样本数据时,CSD提供了更强大的鉴定/定量(图3E)。就TnC而言,尽管在所有样品中都进行了量化,但与MEZ相比,只有CSD显示出经济特区的富集。然而,与经济特区相关的基底膜蛋白Nidogen-1(Nid1),层粘连蛋白亚基β-2(Lamb2)和基底膜特异性硫酸肝素蛋白聚糖核心蛋白(Hspg2)35在LCM样品中在经济特区(与MEZ相比)显示出比CSD样品(未显示)更强的富集。因此,CSD可以提供组织样品,在合理的时间范围内为经济特区表征提供准确和深入的定量蛋白质组,而不必担心组织完整性受损或蛋白质损失。
统计学
统计测试,2D注释丰富测试和PCA是在Perseus环境中完成的。如果在至少一个样品中检测到每种方法的有效值,则将蛋白质包括在分析中。使用数据分析软件可视化蛋白质丰度和数量比较(见 材料表)。采用基于排列的假发现率(FDR)控制(FDR设置为0.05,250个随机化)进行蛋白质比较。对于 2D 注释扩充测试36,显示的 GO 项显著丰富(使用 Benjamini-Hochberg FDR 控制方法将 FDR 设置为 0.02)。
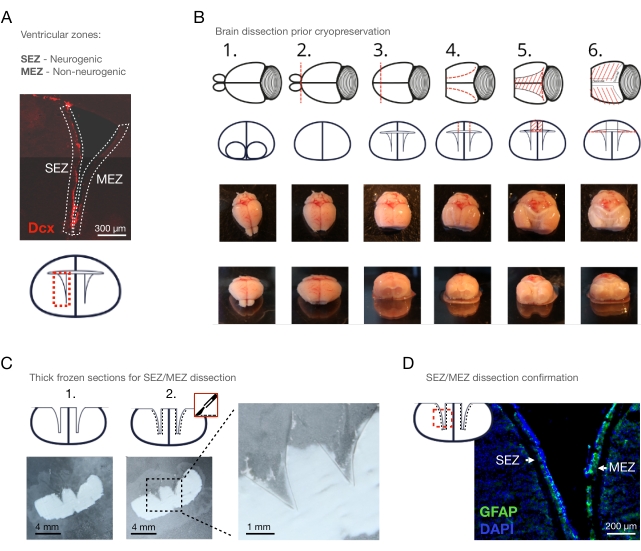
图1: 低温切片解剖法。 (A)感兴趣区域概述:具有神经源性经济特区和非神经源性MEZ的侧脑室。(B)逐步切除OB,前极,皮层和脉络丛上方的胼胝体:1.放置在夹层培养基中,2.切除OB,3.切除皮层前极,4.心室顶部的矢状切口,5.切除心室顶部, 6.心室壁扩散。(C)新鲜冷冻的小鼠大脑的100μm日冕切片,(1.)在用冰冷的手术刀切除心室壁之前和(2.)之后。比例尺 = 4 mm (D) 侧脑室冠状切片染色(GFAP: 绿色;DAPI: 蓝色),显示经济特区和MEZ与CSD剖析。比例尺 = 300 μm (A),200 μm (D)。缩写:CSD = 冷冻切片解剖;经济特区= 室管膜下区;MEZ = 内侧室管膜区;Dcx = 双皮质素;OB = 嗅球;GFAP = 神经胶质纤维酸性蛋白;DAPI = 4′,6-二氨基-2-苯基吲哚。 请点击此处查看此图的放大版本。

图2: 与全上位解剖相比,冷冻截面解剖的解剖精度更高。 (A)通过全上位解剖获得的SEZ样品的免疫组化图像(左)。通过对MAG(绿色)进行染色来可视化富含髓鞘的纹状体组织的内含物。用CSD解剖的经济特区染色(右)。在CSD中,几乎所有的纹状髓鞘(针对MAG的染色,绿色)都从样品带中排除。使用DAPI(蓝色)可视化细胞核。 (B)经济特区髓鞘标记富集与整山Cx的比较(MBP:p = 0.0074;MAG: p = 0.0016;Plp1: p = 0.0011;CNP: p = 0.0029) 和 CSD (MBP: p = 0.0667;MAG: p = 0.0236;Plp1: p = 0.3420;CNP: p = 0.1842)。(C) 将整个山区经济特区与CSD-经济特区样本进行比较的二维注释丰富试验。GO术语细胞外空间和母体相关在CSD数据中比在全装载数据中更丰富。(D)绘制的用于全山解剖和CSD的NSC调节剂Tgm225的蛋白质丰度。与CSD的Cx相比,Tgm2在经济特区中显着丰富(CSD:p = 0.0029;整装:p = 0.1775)。对于 B 和 D:作为参考,来自Sharma等人的蛋白质组数据33 ,以及纹状体和皮层的测量值,绘制了全山和CSD样品中显示的相应蛋白质。比例尺 = 200 μm (A)。缩写:CSD = 冷冻切片解剖;经济特区= 室管膜下区;MAG = 髓鞘相关糖蛋白;Cx = 躯体感觉皮层;MBP = 髓鞘碱性蛋白;Plp1 = 蛋白脂蛋白 1;CNP = 2',3'-环核苷酸 3'-磷酸二酯酶;GO = 基因本体;NSC = 神经干细胞;Tgm2 = 三氟-谷氨酰胺酶 2;DAPI = 4′,6-二氨基-2-苯基吲哚;LFQ = 无标签定量。 请点击此处查看此图的放大版本。
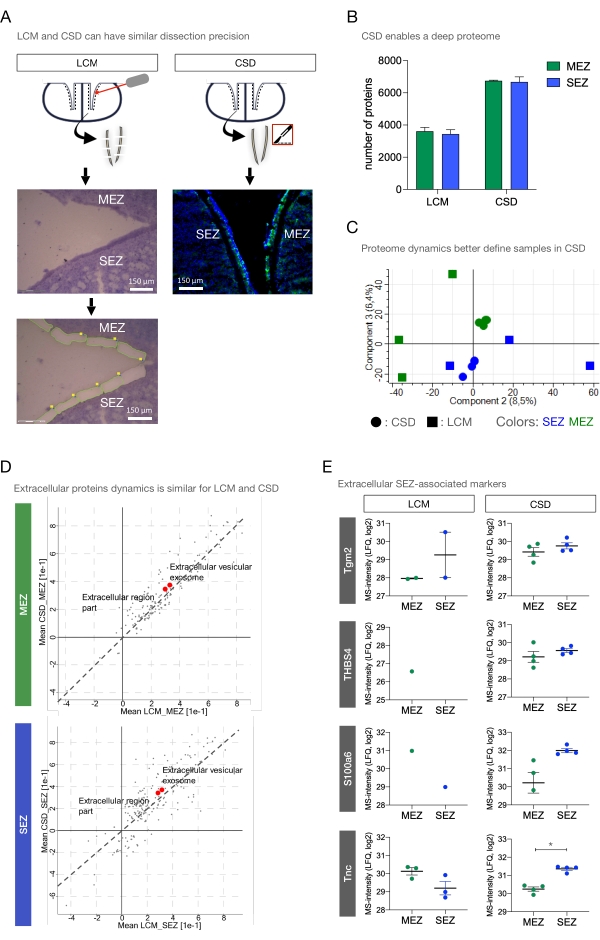
图3:与LCM相比,冷冻切片解剖改善了细胞外蛋白质定量(A)在SEZ和MEZ激光捕获之前和之后对侧心室进行Cresyl紫色染色(左)。相比之下,经济特区和MEZ的CSD切口(右)。比例尺 = 150 μm. (B) 来自 CSD 和 LCM 的经济特区和 MEZ 样品中检测到的蛋白质数量的比较。(C)经济特区 ±和MEZ样本的主成分分析比较CSD和LCM(成分2:方差的8.5%;成分3:6.4%)。(D) 冷冻截面和激光解剖 MEZ(上图)和 SEZ(下图)的 2D 注释富集。GO术语细胞外细胞器和细胞外区域部分明显富集(红点)。(E) 经济特区和MEZ中用于LCM(Tnc:p = 0.3789)和CSD样品(Tgm2:p = 0.2940;S100a6: p = 0.0218;THBS4: p = 0.3941;Tnc: p = 0.0004)。缩写:CSD = 冷冻切片解剖;LCM = 激光捕获显微切割;经济特区= 室管膜下区;MEZ = 内侧室管膜区;GO = 基因本体;Tnc = 替那辛-C;Tgm2 = 谷氨酰胺转移酶 2;S100a6 = S100钙结合蛋白A6;THBS4 = 血小板-4;LFQ = 无标签定量。请点击此处查看此图的放大版本。
讨论
CSD方法使得使用MS精确提取SEZ组织并生成具有显着深度的可靠蛋白质组成为可能.与全上位解剖相比,CSD在大大减少SEZ样品的纹状体污染和细胞外蛋白质富集方面显示出明显的优势。由于使用CSD和全联解剖也可以检测单个样品中相似数量的蛋白质(每个样品约6,500个蛋白质),因此CSD的额外时间非常值得。LCM提供更精确的SEZ解剖,但达到较低的蛋白质组深度,尽管使用与CSD相同的MS方案(文库匹配和无标记定量),但每个样品仅含有3,500个蛋白质。重要的是,变异性要大得多,可能是由于每个样品的制备时间延长了八倍。通过LCM和CSD获得的样品的PCA揭示了两种方法的清晰分离,并且彼此之间有紧密的区域特异性簇。相比之下,LCM样品显示出更分散的分布,这可能部分是由于制备时间长。目前尚不清楚在较长的时间内收集更多的样本是否会产生与LCM具有相同稳健性和深度的蛋白质组。计算估计值,收集与CSD相似的样品体积将需要5-8倍的时间使用LCM,如果包括为肽谱库提供的样品,甚至需要15倍的时间,其中大部分是在解冻条件下。此外,考虑到LCM所需的组织的额外扰动(背景染色,激光解剖),LCM比CSD提供的增益很小(如果有的话)。因此,CSD可以被认为更适合细胞外蛋白质组研究,特别是对于经济特区。
值得注意的是,如果感兴趣的区域小于经济特区(例如,仅研究室管膜细胞层),则自由方法落后于LCM的准确性。例如,使用CSD将室管膜层与室管膜下层分开是困难的,因为室管膜层只有一个细胞直径宽,并且在新鲜冷冻组织中肉眼看不到室管膜下层的分界线。因此,如果在低于50μm的尺度上进行精确解剖比未受干扰的组织或保持较短的解剖时间更重要,则LCM将是比CSD更好的选择。然而,对于宽度为50μm及以上的区域,CSD的精度与LCM蛋白质分析的LCM精度相当。
CSD已经通过有助于研究ECM在神经源性生态位中的功能作用来证明是有用的25。因此,CSD在经济特区中继续应用于各种蛋白质和蛋白质组研究(甚至单核RNA测序)可能会导致进一步检测神经发生调节因子,干细胞活化标记物,并更深入地了解经济特区干细胞生态位生理学。考虑到老化的SEZ37中神经发生的下降,对老年小鼠与年轻小鼠经济特区的ECM变化的简要分析可能会促进对促进NSC发育和维护的确切生态位机制的理解38,39。此外,炎症和损伤对经济特区神经发生的影响已得到充分证实40,41,42,43。皮质脑损伤后经济特区血液来源纤维蛋白原的富集及其对经济特区星形胶质生成和疤痕形成的影响44凸显了创伤诱导的微环境变化对经济特区干细胞生理的潜在影响。因此,使用CSD研究与脑损伤相关的SEZ-ECM蛋白质组可以帮助阐明损伤和炎症影响神经发生的机制。重要的是,该方法还可以应用于健康和疾病中的人脑神经源性生态位,因为通常可以从手术中获得新鲜的冷冻组织。此外,鉴于成虫神经发生的物种差异,将CSD方法应用于其他物种也将是令人着迷的,例如,与纹状体神经发生有关。此外,使用其他蛋白质检测方法,可以使用经济特区和MEZ的CSD(例如ELISA)准确有效地研究当地生产的生长因子的差异。
最后,解剖程序可能会被修改,以准确提取其他大脑区域,也适用于与神经发生无关的研究问题。例如,CSD包括一个简短的半解冻步骤,在此期间,紧凑的髓鞘可见为白色区域,与更半透明的残余脑组织不同。通过对该方法的简单修改,该特征将允许仅精确解剖胼胝体致密髓鞘组织,其可以对损伤相关变化进行蛋白质组学分析。建议进行方案修改,允许冷胼体解剖,省略方案的步骤1.5-1.9,直接继续准备日冕切片,而不是打开心室以使经济特区和MEZ可进入。然后,将切片放在干冰上,短暂抬起并半解冻切片,然后用手术刀简单地取出胼胝体。这种制剂现在应该准备好进行任何需要有效解剖天然胼胝体组织的分析。
总之,本研究提出了一种可用于可靠心室神经源性生态位蛋白质组分析的显微解剖方法。这些数据强调了CSD方法的兼容性和实用性,以及经济特区微环境的基于MS的蛋白质组学分析。精度,效率和最小组织扰动的结合使CSD成为现有方法的宝贵扩展。
披露声明
作者声明没有竞争利益
致谢
我们要衷心感谢Mathias Mann允许我们在他的实验室进行大部分实验,Fabian Coscia帮助LCM和蛋白质组分析,Tatiana Simon-Ebert进行全山解剖,Korbinian Mayr和Igor Paron提供技术帮助。我们非常感谢德国研究委员会对MG(SFB870,TFR274),欧盟(Eranet S-700982-5008-001),ERC(aERC"NeuroCentro"到MG),瑞典医学研究学会(SSMF,到JK)博士后资助,以及KI基金会和基金(2020-01351,到JK)。
材料
| Name | Company | Catalog Number | Comments |
| Cryostat CM3050S | Leica | ||
| Dissecting microscope | Leica | ||
| Dumont no. 5SF forceps, Inox super fine tip | Fine Science Tools | cat. no. 11252-00 | |
| Hank’s Balanced Salt Solution with CaCl2 and MgCl2 | Invitrogen | cat. no. 24020 | |
| HEPES buffer solution (1 M) | Invitrogen | cat. no. 15630 | |
| Microscope slides | RS France | cat. no. BPB018 | |
| Safe-lock tubes, PCR clean 2.0 mL | Eppendorf | cat. no. 0030123344 | |
| Spring scissors, Vannas-Tubingen 5 mm | Fine Science Tools | cat. no. 15003-08 | |
| Surgical disposable scalpels | B. Braun | cat. no. 5518083 | |
| Tissue culture dishes 60 mm | Greiner Bio-One | cat. no. 633180 | |
| Antibodies | |||
| Alexa Fluor secondary antibodies (488, 555) (1/1,000) | ThermoFisher Scientific | cat. no. A-11001 | |
| DAPI | Sigma | cat. no. D9542 | |
| guinea pig polyclonal anti-DCX 1:500 | Millipore | cat. no. AB2253, | |
| mouse monoclonal anti-GFAP 1:500 | Sigma | cat. no. G3893 | |
| mouse monoclonal anti-MAG 1:400 | Millipore | cat. no. MAB1567 | |
| Software | |||
| GraphPad Prism version 9 | GraphPad Software, San Diego California USA | www.graphpad.com | |
| Perseus Version 1.6.10.50 | Max-Planck Institute for Biochemistry, Munich Bavaria Germany | https://maxquant.net/perseus/ | |
| ZEN imaging software | Carl Zeiss |
参考文献
- Goodman, T., Hajihosseini, M. K. Hypothalamic tanycytes-masters and servants of metabolic, neuroendocrine, and neurogenic functions. Frontiers in Neuroscience. 9, 387(2015).
- Chaker, Z., et al. Hypothalamic neurogenesis persists in the aging brain and is controlled by energy-sensing IGF-I pathway. Neurobiology of Aging. 41, 64-72 (2016).
- Kuhn, H. G., Toda, T., Gage, F. H. Adult hippocampal neurogenesis: a coming-of-age story. Journal of Neuroscience. 38 (49), 10401-10410 (2018).
- Obernier, K., Alvarez-Buylla, A. Neural stem cells: origin, heterogeneity and regulation in the adult mammalian brain. Development. 146 (4), (2019).
- Obernier, K., et al. Adult neurogenesis is sustained by symmetric self-renewal and differentiation. Cell Stem Cell. 22 (2), 221-234 (2018).
- Bordiuk, O. L., Smith, K., Morin, P. J., Semënov, M. V. Cell proliferation and neurogenesis in adult mouse brain. PloS One. 9 (11), 111453(2014).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain. Journal of Neuroscience. 17 (13), 5046-5061 (1997).
- Lim, D. A., Alvarez-Buylla, A. The adult ventricular-subventricular zone (V-SVZ) and olfactory bulb (OB) neurogenesis. Cold Spring Harbor Perspectives in Biology. 8 (5), 018820(2016).
- Sato, K. Effects of microglia on neurogenesis. Glia. 63 (8), 1394-1405 (2015).
- Tavazoie, M., et al. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3 (3), 279-288 (2008).
- Sirko, S., et al. Chondroitin sulfates are required for fibroblast growth factor-2-dependent proliferation and maintenance in neural stem cells and for epidermal growth factor-dependent migration of their progeny. Stem Cells. 28 (4), 775-787 (2010).
- Mercier, F. Fractones: extracellular matrix niche controlling stem cell fate and growth factor activity in the brain in health and disease. Cellular and Molecular Life Sciences: CMLS. 73 (24), 4661-4674 (2016).
- Mercier, F., Kitasako, J. T., Hatton, G. I. Anatomy of the brain neurogenic zones revisited: fractones and the fibroblast/macrophage network. Journal of Comparative Neurology. 451 (2), 170-188 (2002).
- Nascimento, M. A., Sorokin, L., Coelho-Sampaio, T. Fractone bulbs derive from ependymal cells and their laminin composition influence the stem cell niche in the subventricular zone. Journal of Neuroscience. 38 (16), 3880-3889 (2018).
- Chen, G., et al. In vivo reprogramming for brain and spinal cord repair. eNeuro. 2 (5), 0106-0115 (2015).
- Zhang, Q., Chen, W., Tan, S., Lin, T. Stem cells for modeling and therapy of Parkinson's disease. Human Gene Therapy. 28 (1), 85-98 (2017).
- Wei, C., Xiong, S., Cheng, L. Reprogramming of fibroblasts to neural stem cells by a chemical cocktail. Methods in Molecular Biology. 2117, 265-270 (2020).
- Tian, Z., Zhao, Q., Biswas, S., Deng, W. Methods of reactivation and reprogramming of neural stem cells for neural repair. Methods. 133, 3-20 (2018).
- Heinrich, C., et al. Sox2-mediated conversion of NG2 glia into induced neurons in the injured adult cerebral cortex. Stem Cell Reports. 3 (6), 1000-1014 (2014).
- Masserdotti, G., et al. Transcriptional mechanisms of proneural factors and REST in regulating neuronal reprogramming of astrocytes. Cell Stem Cell. 17 (1), 74-88 (2015).
- Seidenfaden, R., Desoeuvre, A., Bosio, A., Virard, I., Cremer, H. Glial conversion of SVZ-derived committed neuronal precursors after ectopic grafting into the adult brain. Molecular and Cellular Neurosciences. 32 (1-2), 187-198 (2006).
- Lepko, T., et al. Choroid plexus-derived miR-204 regulates the number of quiescent neural stem cells in the adult brain. EMBO Journal. 38 (17), 100481(2019).
- Silva-Vargas, V., Maldonado-Soto, A. R., Mizrak, D., Codega, P., Doetsch, F. Age-dependent niche signals from the choroid plexus regulate adult neural stem cells. Cell Stem Cell. 19 (5), 643-652 (2016).
- Angelidis, I., et al. An atlas of the aging lung mapped by single cell transcriptomics and deep tissue proteomics. Nature Communications. 10 (1), 963(2019).
- Kjell, J., et al. Defining the adult neural stem cell niche proteome identifies key regulators of adult neurogenesis. Cell Stem Cell. 26 (2), 277-293 (2020).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal flow. Journal of Visualized Experiments: JoVE. (39), e1938(2010).
- Kulak, N. A., Geyer, P. E., Mann, M. Loss-less nano-fractionator for high sensitivity, high coverage proteomics. Molecular & Cellular Proteomics: MCP. 16 (4), 694-705 (2017).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11 (12), 2301-2319 (2016).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nature Biotechnology. 26 (12), 1367-1372 (2008).
- Cox, J., et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Molecular & Cellular Proteomics: MCP. 13 (9), 2513-2526 (2014).
- Perez-Riverol, Y., et al. The PRIDE database and related tools and resources in 2019: improving support for quantification data. Nucleic Acids Research. 47 (1), 442-450 (2019).
- Tomassy, G. S., et al. Distinct profiles of myelin distribution along single axons of pyramidal neurons in the neocortex. Science. 344 (6181), 319-324 (2014).
- Sharma, K., et al. Cell type- and brain region-resolved mouse brain proteome. Nature Neuroscience. 18 (12), 1819-1831 (2015).
- Datta, S., et al. Laser capture microdissection: Big data from small samples. Histology and Histopathology. 30 (11), 1255-1269 (2015).
- Kerever, A., et al. Novel extracellular matrix structures in the neural stem cell niche capture the neurogenic factor fibroblast growth factor 2 from the extracellular milieu. Stem Cells. 25 (9), 2146-2157 (2007).
- Cox, J., Mann, M. 1D and 2D annotation enrichment: a statistical method integrating quantitative proteomics with complementary high-throughput data. BMC Bioinformatics. 13, Suppl 16 12(2012).
- Daynac, M., Morizur, L., Chicheportiche, A., Mouthon, M. -A., Boussin, F. D. Age-related neurogenesis decline in the subventricular zone is associated with specific cell cycle regulation changes in activated neural stem cells. Scientific Reports. 6, 21505(2016).
- Navarro Negredo, P., Yeo, R. W., Brunet, A. Aging and rejuvenation of neural stem cells and their niches. Cell Stem Cell. 27 (2), 202-223 (2020).
- Smith, L. K., White, C. W., Villeda, S. A. The systemic environment: at the interface of aging and adult neurogenesis. Cell and Tissue Research. 371 (1), 105-113 (2018).
- Neuberger, E. J., Swietek, B., Corrubia, L., Prasanna, A., Santhakumar, V. Enhanced dentate neurogenesis after brain injury undermines long-term neurogenic potential and promotes seizure susceptibility. Stem Cell Reports. 9 (3), 972-984 (2017).
- Fisch, U., Brégère, C., Geier, F., Chicha, L., Guzman, R. Neonatal hypoxia-ischemia in rat elicits a region-specific neurotrophic response in SVZ microglia. Journal of Neuroinflammation. 17 (1), 26(2020).
- Götz, M., Sirko, S., Beckers, J., Irmler, M. Reactive astrocytes as neural stem or progenitor cells: In vivo lineage, In vitro potential, and Genome-wide expression analysis. Glia. 63 (8), 1452-1468 (2015).
- Kernie, S. G., Parent, J. M. Forebrain neurogenesis after focal Ischemic and traumatic brain injury. Neurobiology of Disease. 37 (2), 267-274 (2010).
- Pous, L., et al. Fibrinogen induces neural stem cell differentiation into astrocytes in the subventricular zone via BMP signaling. Nature Communications. 11 (1), 630(2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。