Method Article
Ultracentrifugazione a gradiente di densità per lo studio del riciclaggio endocitico nelle cellule di mammifero
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo documento mira a presentare un protocollo per la preparazione del riciclaggio di endosomi da cellule di mammifero utilizzando l'ultracentrifugazione del gradiente di densità del saccarosio.
Abstract
Il traffico endosomiale è un processo cellulare essenziale che regola una vasta gamma di eventi biologici. Le proteine vengono internalizzate dalla membrana plasmatica e quindi trasportate ai primi endosomi. Le proteine internalizzate potrebbero essere transitate al lisosoma per la degradazione o riciclate nella membrana plasmatica. È necessario un robusto percorso di riciclaggio endocitico per bilanciare la rimozione dei materiali di membrana dall'endocitosi. Varie proteine sono segnalate per regolare la via, tra cui ADP-ribosilazione fattore 6 (ARF6). L'ultracentrifugazione del gradiente di densità è un metodo classico per il frazionamento cellulare. Dopo la centrifugazione, gli organelli vengono sedimentati sulla loro superficie isopicnica. Le frazioni vengono raccolte e utilizzate per altre applicazioni a valle. Qui è descritto un protocollo per ottenere una frazione contenente endosomi riciclata da cellule di mammifero trasfettate utilizzando l'ultracentrifugazione del gradiente di densità. Le frazioni isolate sono state sottoposte a western blotting standard per analizzare il loro contenuto proteico. Utilizzando questo metodo, abbiamo identificato che il targeting della membrana plasmatica dell'inghiottimento e della motilità cellulare 1 (ELMO1), un substrato di scambio nucleotidico della tossina botulinica C3 correlato a Ras 1 (Rac1), avviene attraverso il riciclaggio endocitico mediato da ARF6.
Introduzione
Il traffico endosomiale è un processo fisiologico essenziale che coinvolge vari eventi biologici1, ad esempio il trasporto di recettori di segnalazione, canali ionici e molecole di adesione. Le proteine localizzate nella membrana plasmatica sono internalizzate dall'endocitosi2. Le proteine internalizzate vengono quindi selezionate dall'endosoma precoce3. Alcune delle proteine sono mirate ai lisosomi per la degradazione4. Tuttavia, una quantità significativa di proteine viene riciclata sulla superficie cellulare mediante un rapido riciclaggio e processi di riciclaggio lenti. Nel riciclaggio veloce, le proteine lasciano gli endosomi precoci e ritornano direttamente alla membrana plasmatica. Al contrario, nel riciclaggio lento, le proteine vengono prima selezionate nel compartimento di riciclaggio endocitico e quindi trasportate di nuovo alla membrana plasmatica. Varie proteine di carico, ad esempio clatrina, complesso retromero, complesso retriever e proteina della sindrome di Wiskott-Aldrich e complesso SCAR Homologue (WASH), partecipano a tali processi di riciclaggio della membrana4,5,6,7,8,9. L'equilibrio dell'endocitosi e dell'evento di riciclaggio è cruciale per la sopravvivenza cellulare e contribuisce a vari eventi cellulari10, ad esempio, adesione cellulare, migrazione cellulare, polarità cellulare e trasduzione del segnale.
ARF6, una piccola GTPasi, è un regolatore segnalato del traffico endocitico7,11,12. Di interesse, vari gruppi di ricerca hanno illustrato l'importanza dell'ARF6 nel riciclo endocitico13,14,15,16,17. Lo studio mira a studiare la relazione tra la crescita dei neuriti mediata da ARF6 e il riciclaggio endocitico. Il rapporto precedente suggerisce che l'attivazione di ARF6 è a monte dell'attività di Rac1 attraverso l'azione su ELMO1-dedicatore del complesso di citochinesi 1 (DOCK180)18. Tuttavia, il modo in cui ARF6 attiva la segnalazione Rac1 mediata da ELMO1-DOCK180 rimane poco chiaro. L'ultracentrifugazione del gradiente di densità è stata impiegata per studiare il ruolo del riciclaggio endocitico mediato da ARF6 in tale processo. Usando questo, la frazione contenente endosoma di riciclaggio è stata ottenuta da lisati cellulari19. La frazione è stata sottoposta a Western blotting per l'analisi del contenuto proteico. I risultati dell'immunoblot hanno rivelato che sotto la presenza di FE65, una proteina adattatrice arricchita dal cervello, L'ARF6 attivo ha aumentato sostanzialmente il livello di ELMO1 nella frazione contenente endosoma riciclato. Il seguente protocollo include le procedure per (1) trasfettare le cellule di mammifero; (2) preparazione dei campioni e delle colonne del gradiente di densità; e (3) ottenere la frazione contenente endosomi di riciclaggio.
Protocollo
1. Coltura e trasfezione cellulare di mammiferi
- Piastra 2 x 106 celle in una pala di coltura da 100 mm. Utilizzare quattro piatti per ogni trasfezione.
NOTA: il numero di celle necessarie può variare a seconda delle diverse linee di cella. L'ottimizzazione può essere necessaria prima di procedere alla fase di isolamento. - Il giorno successivo, trasfettare le cellule con Lipofectamine secondo le istruzioni del produttore.
2. Raccolta delle cellule
- Scartare il terreno di coltura 48 ore dopo la trasfezione.
- Lavare le cellule con PBS ghiacciato (10 mM fosfati di sodio, 2,68 mM di cloruro di potassio, 140 mM di cloruro di sodio) due volte.
- Aggiungere 1 mL di PBS+ ghiacciato (PBS integrato con 0,5x cocktail inibitore della proteasi e 0,5x cocktail inibitore della fosfatasi) a ciascun piatto.
- Raccogliere le cellule con un raschietto cellulare e trasferire la sospensione cellulare in un tubo centrifugo da 15 ml.
- Pellet le celle mediante centrifugazione utilizzando un rotore a benna oscillante a 400 x g per 5 min.
- Scartare il surnatante e risospesciare delicatamente il pellet cellulare in 5 mL di tampone di omogeneizzazione (HB; 250 mM di saccarosio, 3 mM di imidazolo a pH 7,4, 1 mM di EDTA integrato con 0,03 mM di cicloeximide, 1x cocktail inibitore della proteasi e 1x cocktail inibitore della fosfatasi).
- Raccogliere le cellule per centrifugazione a 1.300 x g per 10 min.
- Risospesso il pellet di cella in 1 mL di HB.
- Omogeneizzare le cellule con un omogeneizzatore Dounce per 15-20 colpi.
NOTA: potrebbero essere utilizzati altri metodi di omogeneizzazione, ad esempio il passaggio del campione attraverso una siringa. L'efficienza di omogeneizzazione potrebbe essere rivelata osservando l'omogeneizzato al microscopio a contrasto di fase. - Trasferire l'omogeneizzato in un tubo di centrifugazione da 2 ml.
NOTA: Raccogliere 50 μL di omogeneizzato con 12,5 μL di tampone campione 5x ed etichettarlo come lisato totale. - Aggiungere 0,7 ml di HB all'omogeneizzato.
- Ruotare l'omogeneizzato diluito a 2.000 x g per 10 minuti a 4 °C.
NOTA: Il pellet contiene nuclei e cellule ininterrotte. - Raccogliere 1,5 ml del surnatante e ripetere il passaggio 2,12 una volta.
- Raccogliere 1,4 ml del surnatante ed etichettarlo come surnatante post-nucleare (PNS).
3. Preparazione della colonna del gradiente di densità
- Trasferire 1,2 mL di PNS a un tubo ultracentrifuga.
- Aggiungere 1 mL di soluzione di saccarosio al 62% (2.351 M di saccarosio, 3 mM di imidazolo a pH 7.4) al campione e mescolare bene con un leggero pipettaggio.
NOTA: La soluzione risultante è una soluzione di saccarosio al 40,6%. - Aggiungere 3,3 mL di soluzione di saccarosio al 35% (1,177 M di saccarosio, 3 mM di imidazolo a pH 7,4) con attenzione sopra il campione.
- Aggiungere 2,2 mL di soluzione di saccarosio al 25% (0,806 M di saccarosio, 3 mM di imidazolo a pH 7,4) con attenzione sulla soluzione di saccarosio al 35%.
NOTA: l'indice di rifrazione delle soluzioni di saccarosio al 62%, 40,6%, 35% e 25% a temperatura ambiente è rispettivamente 1,44, 1,40, 1,39 e 1,37. Gli indici di rifrazione delle soluzioni di saccarosio potrebbero essere controllati con un rifrattometro per garantire la precisione e la coerenza dell'esperimento. - Riempire il tubo di ultracentrifugazione con HB.
NOTA: conservare temporaneamente la colonna del gradiente di densità preparata a 4 °C.
4. Frazionamento e recupero della frazione contenente endosomi riciclata
- Centrifugare la colonna a 210.000 x g per 3 ore a 4 °C.
- Raccogliere 12 frazioni (1 mL ciascuna) con attenzione, partendo dalla cima del gradiente.
NOTA: Gli endosomi di riciclaggio devono essere trovati all'interfaccia tra il 35% e il 25% di soluzioni di saccarosio. Le frazioni raccolte possono essere congelate a scatto in azoto liquido e conservate a -80 °C. - Diluire tutte le frazioni con 1 mL di tampone di diluizione (3 mM di imidazolo a pH 7,4, 1 mM di EDTA).
- Centrifugare il campione diluito a 100.000 x g per 1 ora a 4 °C.
- Aspirare il surnatante e aggiungere 50 μL di 1x tampone campione per raccogliere le frazioni.
- Analizzare il contenuto proteico nelle frazioni mediante western blotting.
Risultati
Dopo aver frazionato le cellule HEK293 non trasfettate mediante ultracentrifugazione del gradiente di densità, sono state raccolte 12 frazioni a partire dalla parte superiore del gradiente. Le frazioni raccolte sono state diluite con il tampone di diluizione in rapporto 1:1 e sottoposte ad un secondo ciclo di centrifugazione. I campioni sono stati quindi sottoposti a western blotting per analizzare il loro contenuto proteico. Come mostrato nella Figura 1, il marcatore endosoma di riciclaggio Rab11 viene rilevato nella frazione 720. Sono stati sondati anche altri marcatori subcellulari, tra cui β-COP, COX IV, GAPDH, EEA1, Rab7 e Lamp1. Un segnale EEA1 positivo viene rilevato anche nella frazione 7. Le intensità di banda di GAPDH, COX IV e Rab11 sia nella frazione 7 che nel PNS sono state misurate con il software ImageLab (Bio-Rad). I rapporti di intensità dei marcatori nella frazione 7 rispetto al PNS sono stati calcolati ed espressi in un grafico a barre ± SD.
Gli studi precedenti suggeriscono che ARF6 ed ELMO1 interagiscono con FE65 per promuovere la crescita dei neuriti mediati da Rac121,22. Poiché ARF6 è un regolatore del riciclo endocitico e il targeting della membrana plasmatica ELMO1 è fondamentale per la successiva attivazione di Rac1, si ipotizza che FE65 colleghi ARF6 ed ELMO1 per mediare il traffico di ELMO1 alla membrana plasmatica. Pertanto, questo metodo è stato impiegato per studiare il livello di ELMO1 negli endosomi isolati di riciclaggio. Le cellule HEK293 sono state trasfettate con ELMO1, ELMO1 + ARF6 Q67L o ELMO1 + ARF6 Q67L + FE65. Non sono stati riscontrati cambiamenti nella distribuzione elmo1 con sovraespressione di ARF6 Q67L e FE65 (Figura 2A). Successivamente, il livello di ELMO1 nella frazione 7 (Rab11-positivo) è stato confrontato tra diverse trasfezioni. La quantità di ELMO1 nella frazione è risultata elevata dopo la co-trasfezione di ARF6 Q67L. Un ulteriore aumento del livello di ELMO1 si osserva quando sia ARF6 Q67L che FE65 sono co-espressi (Figura 2B). Al contrario, il knockout di FE65 ha diminuito l'arricchimento ELMO1 mediato da ARF6 nella frazione 7 (Figura 2C).
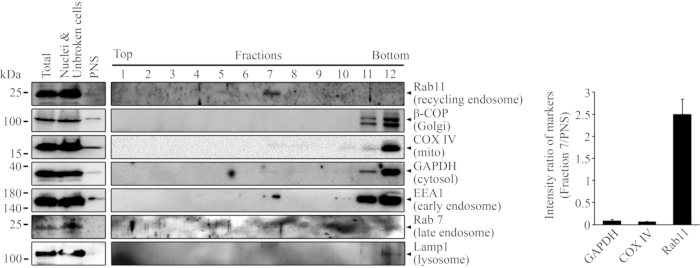
Figura 1: Gli endosomi riciclati si trovano nella frazione 7 dopo l'ultracentrifugazione del gradiente di densità. Le cellule HEK293 non trasfettate sono state frazionate e il contenuto proteico nelle frazioni ottenute è stato analizzato con western blotting. Rab11 viene rilevato nella frazione 7 con un anticorpo anti-Rab11 (1:500). Altri marcatori subcellulari sono stati rilevati con i loro anticorpi specifici, tra cui β-COP (1:1000), COX IV (1:1000), GAPDH (1:10.000), EEA1 (1:1000), Rab7 (1:500) e Lamp1 (1:1000). La frazione 1 è la frazione superiore meno densa, mentre la frazione 12 è la frazione inferiore più densa. Il grafico a barre mostra il rapporto tra GAPDH, COX IV e Rab11 nella frazione 7 e PNS ± SD. Questa figura è stata modificata da Chan, W. W. R. et al.22. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: L'espressione di FE65 promuove il riciclaggio endocitico mediato da ARF6 di ELMO1. (A) Le cellule trasfettate con ELMO1, ELMO1 + ARF6 Q67L o ELMO1 + ARF6 Q67L + FE65 sono state frazionate utilizzando l'ultracentrifugazione del gradiente di densità. Tutte le frazioni sono state sottoposte a western blotting per analizzare le distribuzioni di ELMO1, ARF6 Q67L e FE65. La frazione 1 è la frazione superiore meno densa, mentre la frazione 12 è la frazione inferiore più densa. (B) La frazione Rab11-positiva 7 da diverse trasfezioni è stata analizzata con Western blotting per valutare i livelli di ELMO1 e ARF6 Q67L. La quantità di ELMO1 nella frazione 7 è stata elevata quando le cellule sono state co-trasfettate con ARF6 Q67L. La co-espressione di ARF6 Q67L e FE65 aumenta ulteriormente la quantità di ELMO1 nella frazione. (C) Wildtype HEK293 è stato trasfettato con ELMO1 o ELMO1 + ARF6 Q67L, mentre FE65 KO HEK293 è stato trasfettato con ELMO1 + ARF6 Q67L. L'arricchimento ELMO1 mediato da ARF6 nella frazione 7 è diminuito significativamente nelle cellule FE65 KO. (B-C) Sono stati sondati il marcatore endosomico di riciclaggio Rab11 (1:500) e il marcatore citosol GAPDH (1:10.000). ELMO1, FE65 e ARF6 Q67L sono stati rilevati rispettivamente con anti-ELMO1 B-7 (1:1000), anti-FE65 E-20 (1:1000) e anti-myc 9B11 (1:5000). Il livello relativo di ELMO1 nella frazione 7 è stato espresso come rapporto densitometrico dell'ELMO1 nella frazione 7/ELMO1 totale. I dati per il grafico a barre sono stati ottenuti da tre esperimenti indipendenti. ANOVA unidirezionale con test post hoc Bonferroni è stato impiegato per l'analisi statistica. *p < 0,001. I risultati sono variazione media ± SD22. Questa figura è stata modificata da Chan, W. W. R. et al.22. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il protocollo di cui sopra delinea le procedure per isolare gli endosomi di riciclaggio dalle cellule coltivate mediante ultracentrifugazione. L'affidabilità di questo metodo è stata dimostrata dall'ultima pubblicazione22, dimostrando che gli endosomi di riciclaggio sono isolati con successo da altri organelli (Figura 1), come l'apparato di Golgi e i mitocondri. Alcuni passaggi critici devono essere prestati attenzione per ottenere un buon risultato di separazione. Durante la preparazione delle soluzioni di saccarosio, si consiglia di convalidare gli indici di rifrazione delle soluzioni con un rifrattometro. L'indice di rifrazione delle soluzioni di saccarosio al 62%, 35% e 25% a temperatura ambiente è rispettivamente 1,44, 1,39 e 1,37. Inoltre, le bolle d'aria dovrebbero essere evitate dal gradiente. La presenza di bolle nella colonna può interrompere la continuità del gradiente. I detergenti dovrebbero essere evitati nel processo di omogeneizzazione poiché danneggiano la membrana degli organelli. Ciò porta al rilascio di proteine dagli organelli legati alla membrana e potrebbe causare una grave contaminazione. Inoltre, tutti gli strumenti di omogeneizzazione devono essere pre-raffreddati prima dell'uso per evitare la degradazione delle proteine durante l'omogeneizzazione. Una volta preparato il gradiente, dovrebbe essere usato il prima possibile. Sebbene il gradiente preparato possa essere temporaneamente conservato a 4 °C (1-2 ore), lo stoccaggio prolungato può interferire con il gradiente di densità dovuto alla diffusione.
Il saccarosio è un mezzo gradiente ampiamente utilizzato a causa della sua facile disponibilità. In effetti, ci sono molte altre alternative, tra cui Percoll e Ficoll-40023,24. Questi mezzi hanno proprietà fisiche diverse rispetto al saccarosio. Ad esempio, Percoll ha osmolarità e viscosità inferiori rispetto al saccarosio. Questi consentono una rapida fasciatura delle particelle utilizzando forze centrifughe inferiori. Ficoll-400 ha una minore permeabilità verso le membrane rispetto al saccarosio a causa del suo alto peso molecolare e del basso contenuto di materiale dializzato. Pertanto, la modifica del mezzo gradiente può ottenere una maggiore efficienza di isolamento dell'endosoma.
Oltre all'ultracentrifugazione a gradiente di densità, per il frazionamento cellulare possono essere utilizzati altri metodi, tra cui l'elettroforesi a flusso libero(FFE) 25,la selezione degli organelli attivati dalla fluorescenza (FAOS)26e l'immunoisolazione27. FFE è un metodo di separazione di fase liquida. Il campione scorre attraverso il tampone di separazione sotto l'influenza di un campo elettrico perpendicolare alla direzione del flusso. I livelli di deflessione dei diversi organelli variano in base alle loro cariche superficiali25. La FAOS di solito utilizza un tag fluorescente o un anticorpo per etichettare specifici organelli e poi seguito da citometria a flusso per l'isolamento28,29. L'immunoisolazione si basa sulla rilevazione di antigeni specifici sulla superficie dell'organello bersaglio e sulla successiva precipitazione da parte degli anticorpi30.
Quando si confronta con queste alternative, l'ultracentrifugazione del gradiente di densità ha i suoi vantaggi. Prima di tutto, un profilo di distribuzione della proteina interessata può essere ottenuto eseguendo Western blotting con le frazioni isolate (Figura 2A). Eventuali cambiamenti nella localizzazione subcellulare delle proteine potrebbero essere facilmente rilevati. Inoltre, l'ultracentrifuga è uno strumento standard nella maggior parte degli istituti e il requisito tecnico per il funzionamento della centrifuga è basso. Al contrario, un citometro a flusso e un sistema di elettroforesi specifico sono necessari per il processo di isolamento di FAOS e FFE, rispettivamente. Non è necessaria alcuna attrezzatura specifica per l'immunoisolazione. Tuttavia, viene utilizzato principalmente per isolare gli endosomi da un piccolo numero di cellule. La scala di preparazione dell'ultracentrifugazione è maggiore di quella dell'immunoisolazione. Inoltre, un anticorpo con elevata specificità è necessario per l'immunoisolazione31. Inoltre, il tampone contenente detersivo e ad alto contenuto di sale non può essere utilizzato nelle fasi di lavaggio per garantire l'integrità degli endosomi. Ciò può portare a uno sfondo elevato e ridurre la purezza dell'organello isolato31.
Poiché l'ultracentrifugazione del gradiente di densità separa gli organelli in base alla densità, il suo limite più significativo è quello del potere risolutivo verso gli organelli con densità simile. Come mostrato nella Figura 1, sia Rab11 che EEA1 sono rilevati nella frazione 7 a causa delle proprietà fisiche simili del riciclaggio e degli endosomi precoci. Sono necessari ulteriori saggi per confermare i cambiamenti nel livello della proteina bersaglio nell'endosoma di riciclaggio. Nello studio precedente, la co-immunocolorazione su ELMO1 e Rab11 è stata eseguita nelle cellule22. Oltre a eseguire altri test, è possibile adottare alcune misure per superare questo problema. Un gradiente di densità continuo può risolvere organelli con differenze di densità minori32. Tuttavia, la resa in un gradiente continuo è significativamente inferiore a quella di un gradiente discontinuo. È possibile manipolare la densità dell'endosoma pre-trattando le cellule con perle di lattice33. Le perle sono interiorizzate dalle cellule tramite endocitosi. La densità delle perle contenenti endosomi è significativamente ridotta e può essere separata dagli altri organelli. Di solito, l'aggiunta di un altro livello di isolamento potrebbe migliorare significativamente l'isolamento di organelli con densità simili. Ad esempio, eseguire l'immunoisolazione dalla frazione isolata34. Utilizzando un anticorpo specifico, gli endosomi riciclati possono essere separati dai contaminanti. Anticorpi e sonde marcati con fluorescenza, combinati con l'analisi citometrica a flusso, potrebbero anche essere utilizzati per un isolamento preciso dell'endosoma28. FFE è anche applicabile per separare organelli con densità simili in base alla loro carica superficiale25.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse con i contenuti di questo articolo.
Riconoscimenti
Questo lavoro è stato sostenuto da fondi del Research Grants Council di Hong Kong, del programma di sovvenzioni dirette CUHK, del fondo di dotazione United College e del TUYF Charitable Trust. Le cifre di questo lavoro sono state adattate dalla nostra precedente pubblicazione, "ARF6-Rac1 signaling-mediated neurite outgrowth is potentiated by the neuronal adaptor FE65 through orchestrating ARF6 and ELMO1" pubblicata sul FASEB Journal nell'ottobre 2020.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL, Open-Top Thickwall Polypropylene Tube, 11 x 34 mm | Beckman Coulter | 347287 | |
| 100 mm tissue culture dish | SPL | 20100 | |
| 13.2 mL, Certified Free Open-Top Thinwall Ultra-Clear Tube, 14 x 89 mm | Beckman Coulter | C14277 | |
| 5x Sample Buffer | GenScript | MB01015 | |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Roche | 11873580001 | |
| COX IV (3E11) Rabbit mAb | Cell Signaling Technology | 4850S | Rabbit monoclonal antibody for detecting COX IV. |
| Cycloheximide | Sigma-Aldrich | C1988 | |
| Dounce Tissue Grinder, 7 mL | DWK Life Sciences | 357542 | |
| Dulbecco's Modified Eagle Medium (DMEM) with low glucose | HyClone | SH30021.01 | |
| ELMO1 antibody (B-7) | Santa Cruz Biotechnology | SC-271519 | Mouse monoclonal antibody for detecting ELMO1. |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| FE65 antibody (E-20) | Santa Cruz Biotechnology | SC-19751 | Goat polyclonal antibody for detecting FE65. |
| Fetal Bovine Serum, Research Grade | HyClone | SV30160.03 | |
| GAPDH Monoclonal Antibody (6C5) | Ambion | AM4300 | Mouse monoclonal antibody for detecting GAPDH. |
| ImageLab Software | Bio-Rad | Measurement of band intensity | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Lipofectamine 2000 Transfection Reagent | Invitrogen | 11668019 | |
| Monoclonal Anti-β-COP antibody | Sigma | G6160 | Mouse monoclonal antibody for detecting β-COP. |
| Myc-tag (9B11) mouse mAb | Cell Signaling Technology | 2276S | Mouse monoclonal antibody for detecting myc tagged proteins. |
| OmniPur EDTA, Disodium Salt, Dihydrate | Calbiochem | 4010-OP | |
| Optima L-100 XP | Beckman Coulter | 392050 | |
| Optima MAX-TL | Beckman Coulter | A95761 | |
| Opti-MEM I Reduced Serum Media | Gibco | 31985070 | |
| PBS Tablets | Gibco | 18912014 | |
| PhosSTOP | Roche | 4906845001 | |
| RAB11A-Specific Polyclonal antibody | Proteintech | 20229-1-AP | Rabbit polyclonal antibody for detecting Rab11. |
| Sucrose | Affymetrix | AAJ21931A4 | |
| SW 41 Ti Swinging-Bucket Rotor | Beckman Coulter | 331362 | |
| TLA-120.2 Fixed-Angle Rotor | Beckman Coulter | 362046 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300062 |
Riferimenti
- Elkin, S. R., Lakoduk, A. M., Schmid, S. L. Endocytic pathways and endosomal trafficking: a primer. Wiener Medizinische Wochenschrift. 166 (7-8), 196-204 (2016).
- Kumari, S., Mg, S., Mayor, S. Endocytosis unplugged: multiple ways to enter the cell. Cell Research. 20 (3), 256-275 (2010).
- Naslavsky, N., Caplan, S. The enigmatic endosome - sorting the ins and outs of endocytic trafficking. Journal of Cell Science. 131 (13), (2018).
- Cullen, P. J., Steinberg, F. To degrade or not to degrade: mechanisms and significance of endocytic recycling. Nature Reviews. Molecular Cell Biology. 19, 679-696 (2018).
- Weeratunga, S., Paul, B., Collins, B. M. Recognising the signals for endosomal trafficking. Current Opinion in Cell Biology. 65, 17-27 (2020).
- Khan, I., Steeg, P. S. Endocytosis: a pivotal pathway for regulating metastasis. British Journal of Cancer. 124 (1), 66-75 (2021).
- Grant, B. D., Donaldson, J. G. Pathways and mechanisms of endocytic recycling. Nature Reviews. Molecular Cell Biology. 10 (9), 597-608 (2009).
- Maxfield, F. R., McGraw, T. E. Endocytic recycling. Nature Reviews. Molecular Cell Biology. 5 (2), 121-132 (2004).
- McDonald, F. J. Explosion in the complexity of membrane protein recycling. American Journal of Physiology. Cell Physiology. 320 (4), 483-494 (2021).
- O'Sullivan, M. J., Lindsay, A. J. The Endosomal Recycling pathway-at the crossroads of the cell. International Journal of Molecular Sciences. 21 (17), 6074 (2020).
- D'Souza-Schorey, C., Li, G., Colombo, M. I., Stahl, P. D. A regulatory role for ARF6 in receptor-mediated endocytosis. Science. 267 (5201), 1175-1178 (1995).
- Schweitzer, J. K., Sedgwick, A. E., D'Souza-Schorey, C. ARF6-mediated endocytic recycling impacts cell movement, cell division and lipid homeostasis. Seminars in Cell and Developmental Biology. 22 (1), 39-47 (2011).
- Finicle, B. T., et al. Sphingolipids inhibit endosomal recycling of nutrient transporters by inactivating ARF6. Journal of Cell Science. 131 (12), (2018).
- Lu, H., et al. APE1 upregulates MMP-14 via redox-sensitive ARF6-mediated recycling to promote cell invasion of esophageal adenocarcinoma. Cancer Research. 79 (17), 4426-4438 (2019).
- Qi, S., et al. Arf6-driven endocytic recycling of CD147 determines HCC malignant phenotypes. Journal of Experimental and Clinical Cancer Research. 38 (1), 471 (2019).
- Crupi, M. J. F., et al. GGA3-mediated recycling of the RET receptor tyrosine kinase contributes to cell migration and invasion. Oncogene. 39 (6), 1361-1377 (2020).
- Gamara, J., et al. Assessment of Arf6 deletion in PLB-985 differentiated in neutrophil-like cells and in mouse neutrophils: impact on adhesion and migration. Mediators of Inflammation. 2020, 2713074 (2020).
- Santy, L. C., Ravichandran, K. S., Casanova, J. E. The DOCK180/Elmo complex couples ARNO-mediated Arf6 activation to the downstream activation of Rac1. Current Biology. 15 (19), 1749-1754 (2005).
- Wibo, M., Dumont, J. E., Brown, B. L., Marshall, N. J. Cell fractionation by centrifugation methods. Eukaryotic Cell Function and Growth: Regulation by Intracellular Cyclic Nucleotides. , 1-17 (1976).
- Kelly, E. E., Horgan, C. P., McCaffrey, M. W. Rab11 proteins in health and disease. Biochemical Society Transactions. 40 (6), 1360-1367 (2012).
- Li, W., et al. Neuronal adaptor FE65 stimulates Rac1-mediated neurite outgrowth by recruiting and activating ELMO1. The Journal of Biological Chemistry. 293 (20), 7674-7688 (2018).
- Chan, W. W. R., Li, W., Chang, R. C. C., Lau, K. F. ARF6-Rac1 signaling-mediated neurite outgrowth is potentiated by the neuronal adaptor FE65 through orchestrating ARF6 and ELMO1. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology. 34 (12), 16397-16413 (2020).
- Huber, L. A., Pfaller, K., Vietor, I. Organelle proteomics: implications for subcellular fractionation in proteomics. Circulation Research. 92 (9), 962-968 (2003).
- Fleischer, S., Kervina, M. Subcellular fractionation of rat liver. Methods in Enzymology. 31, 6-41 (1974).
- Marsh, M. Endosome and lysosome purification by free-flow electrophoresis. Methods in Cell Biology. 31, 319-334 (1989).
- Stasyk, T., Huber, L. A. Zooming in: fractionation strategies in proteomics. Proteomics. 4 (12), 3704-3716 (2004).
- Iordachescu, A., Hulley, P., Grover, L. M. A novel method for the collection of nanoscopic vesicles from an organotypic culture model. RSC Advances. 8 (14), 7622-7632 (2018).
- Chavrier, P., vander Sluijs, P., Mishal, Z., Nagelkerken, B., Gorvel, J. P. Early endosome membrane dynamics characterized by flow cytometry. Cytometry. 29 (1), 41-49 (1997).
- Chasan, A. I., Beyer, M., Kurts, C., Burgdorf, S. Isolation of a specialized, antigen-loaded early endosomal subpopulation by flow cytometry. Methods in Molecular Biology. 960, 379-388 (2013).
- Thapa, N., et al. Phosphatidylinositol-3-OH kinase signaling is spatially organized at endosomal compartments by microtubule-associated protein 4. Nature Cell Biology. 22 (11), 1357-1370 (2020).
- Guimaraes de Araujo, M. E., Fialka, I., Huber, L. A. . Endocytic Organelles: Methods For Preparation And Analysis. In eLS. , (2001).
- Rickwood, D., Graham, J. . Centrifugation Techniques. , (2015).
- Lamberti, G., de Araujo, M. E., Huber, L. A. Isolation of macrophage early and late endosomes by latex bead internalization and density gradient centrifugation. Cold Spring Harbor Protocols. 2015 (12), (2015).
- Urbanska, A., Sadowski, L., Kalaidzidis, Y., Miaczynska, M. Biochemical characterization of APPL endosomes: the role of annexin A2 in APPL membrane recruitment. Traffic. 12 (9), 1227-1241 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon