Method Article
密度梯度超速离心研究哺乳动物细胞内吞循环
摘要
本文旨在提出一种利用蔗糖密度梯度超速离心制备哺乳动物细胞内体回收的方案。
摘要
内体运输是调节各种生物事件的重要细胞过程。蛋白质从质膜内化,然后运输到早期内体。内化的蛋白质可以转运到溶酶体进行降解或再循环回质膜。需要一个强大的内吞循环途径来平衡膜材料从内吞作用中的去除。据报道,各种蛋白质可以调节该途径,包括ADP-核糖基化因子6(ARF6)。密度梯度超速离心是细胞分级分离的经典方法。离心后,将细胞器沉淀在其等光表面。这些馏分被收集并用于其他下游应用。这里描述的是使用密度梯度超速离心从转染的哺乳动物细胞中获取回收的含内体部分的方案。对分离的馏分进行标准的蛋白质印迹以分析其蛋白质含量。通过采用该方法,我们发现吞噬和细胞动力1(ELMO1)的质膜靶向,一种与Ras相关的C3肉毒杆菌毒素底物1(Rac1)鸟嘌呤核苷酸交换因子,是通过ARF6介导的内吞循环。
引言
内体运输是一个基本的生理过程,涉及各种生物事件1,例如,信号受体,离子通道和粘附分子的运输。定位于质膜上的蛋白质通过内吞作用2内化。然后由早期内体3对内化蛋白进行分类。一些蛋白质被靶向溶酶体进行降解4。然而,大量的蛋白质通过快速回收和缓慢的回收过程被回收回细胞表面。在快速循环中,蛋白质离开早期内体并直接返回质膜。相反,在缓慢循环中,蛋白质首先被分选到内吞细胞回收室,然后被输送回质膜。各种货物蛋白,例如克拉菊酯、逆转录蛋白复合物、寻回物复合物和Wiskott-Aldrich综合征蛋白,以及SCAR同系物(WASH)复合物,参与这种膜循环过程4、5、6、7、8、9。内吞作用和再循环事件的平衡对细胞存活至关重要,并有助于各种细胞事件10,例如,细胞粘附,细胞迁移,细胞极性和信号转导。
ARF6是一种小型GTP酶,是内吞细胞运输7,11,12的调节因子。有趣的是,各种研究小组已经说明了ARF6在内吞细胞回收中的重要性13,14,15,16,17。该研究旨在研究ARF6介导的神经突生长与内吞细胞循环之间的关系。之前的报告表明,ARF6的激活是通过作用于细胞分裂1(DOCK180)复合物18的ELMO1-奉献物而处于Rac1活性的上游。然而,ARF6如何触发ELMO1-DOCK180介导的Rac1信号仍不清楚。采用密度梯度超速离心研究了ARF6介导的内吞细胞循环在该过程中的作用。通过使用该,从细胞裂解物19获得含有内体的回收部分。对该馏分进行蛋白质印迹以进行蛋白质含量分析。免疫印迹结果表明,在富含脑的接合蛋白FE65存在下,活性ARF6显著提高了ELMO1在含有内体的循环部分中的水平。以下方案包括(1)转染哺乳动物细胞的程序;(2)制备样品和密度梯度柱;(3)获得回收的含内体部分。
研究方案
1. 哺乳动物细胞培养和转染
- 在100mm培养皿中平板2×106 个细胞。每次转染使用四个培养皿。
注意:不同的细胞系所需的细胞数量可能会有所不同。在继续隔离步骤之前,可能需要进行优化。 - 第二天,根据制造商的说明,用利泊酚胺转染细胞。
2. 细胞采集
- 转染后48小时弃置培养基。
- 用冰冷的PBS(10mM磷酸钠,2.68mM氯化钾,140mM氯化钠)洗涤细胞两次。
- 在每道菜中加入1毫升冰冷的PBS +(PBS辅以0.5x蛋白酶抑制剂鸡尾酒和0.5x磷酸酶抑制剂鸡尾酒)。
- 用细胞刮刀收集细胞,并将细胞悬浮液转移到15mL离心管中。
- 使用400×g的摆动斗式转子离心细胞5分钟。
- 弃去上清液并将细胞沉淀轻轻重悬于5mL均质缓冲液(HB;250mM蔗糖,3mM咪唑,pH 7.4,1mM EDTA补充0.03mM环己酰亚胺,1x蛋白酶抑制剂混合物和1x磷酸酶抑制剂混合物)。
- 通过以1,300×g离心10分钟收集细胞。
- 将细胞沉淀重悬于1mL HB中。
- 用Dounce均质机使细胞均质化15-20次。
注:可以使用其他均质化方法,例如,将样品通过注射器。通过在相差显微镜下观察均质,可以揭示均质效率。 - 将匀浆转移到2 mL离心管中。
注意:用12.5μL5x样品缓冲液收获50μL匀浆,并将其标记为总裂解物。 - 向匀浆中加入0.7 mL HB。
- 在4°C下以2,000×g旋转稀释的匀浆10分钟。
注意:沉淀含有细胞核和未破碎的细胞。 - 收集1.5mL上清液并重复步骤2.12一次。
- 收集1.4mL上清液并将其标记为核后上清液(PNS)。
3. 密度梯度柱制备
- 将 1.2 mL PNS 转移到超速离心管中。
- 向样品中加入1mL62%蔗糖溶液(2.351M蔗糖,3mM咪唑,pH 7.4)并通过温和移液充分混合。
注意:所得溶液是40.6%蔗糖溶液。 - 在样品顶部小心地加入3.3mL的35%蔗糖溶液(1.177M蔗糖,3mM咪唑,pH 7.4)。
- 在35%蔗糖溶液上小心地加入2.2mL的25%蔗糖溶液(0.806M蔗糖,3mM咪唑,pH 7.4)。
注:室温下62%、40.6%、35%和25%蔗糖溶液的折射率分别为1.44、1.40、1.39和1.37。蔗糖溶液的折射率可以用折光率仪检查,以确保实验的精度和一致性。 - 用HB填充超速离心管。
注意:将准备好的密度梯度柱暂时储存在4°C。
4. 含内体馏分的回收利用
- 在4°C下以210,000×g离心柱3小时。
- 从梯度的顶部开始,仔细收集12个馏分(每个1 mL)。
注意:回收内体应在35%和25%蔗糖溶液之间的界面处找到。收集的馏分可以在液氮中速冻并储存在-80°C。 - 用1mL稀释缓冲液(3mM咪唑,pH 7.4,1mM EDTA)稀释所有馏分。
- 将稀释的样品在4°C下以100,000×g离心1小时。
- 吸出上清液并加入50μL1x样品缓冲液以收获级分。
- 通过蛋白质印迹分析馏分中的蛋白质含量。
结果
通过密度梯度超速离心对未转染的HEK293细胞进行分馏后,从梯度顶部开始收集12个组分。收获的馏分用稀释缓冲液以1:1的比例稀释并进行第二轮离心。然后将样品进行蛋白质印迹以分析其蛋白质含量。 如图1所示,回收内体标记物Rab11在馏分720中被检测到。还探测了其他亚细胞标志物,包括β-COP,COX IV,GAPDH,EEA1,Rab7和Lamp1。在分数7中也检测到正EEA1信号。GAPDH,COX IV和Rab11在馏分7和PNS中的能带强度是用ImageLab软件(Bio-Rad)测量的。计算分数7与PNS中标记物的强度比,并在SD±条形图中表示。
先前的研究表明,ARF6和ELMO1与FE65相互作用以促进Rac1介导的神经突起21,22。由于ARF6是内吞细胞循环的调节剂,并且ELMO1质膜靶向对于随后的Rac1激活至关重要,因此假设FE65连接ARF6和ELMO1以介导ELMO1向质膜的运输。因此,采用该方法研究了分离的回收内体中的ELMO1水平。HEK293细胞转染ELMO1,ELMO1 + ARF6 Q67L或ELMO1 + ARF6 Q67L + FE65。在具有ARF6 Q67L和FE65过表达的ELMO1分布中没有发现变化(图2A)。接下来,比较不同转染者之间7级(Rab11阳性)中的ELMO1水平。发现馏分中ELMO1的量在ARF6 Q67L共转染后升高。当ARF6 Q67L和FE65共表达时,观察到ELMO1水平进一步增加(图2B)。相反,FE65的敲除减少了部分7中ARF6介导的ELMO1富集(图2C)。
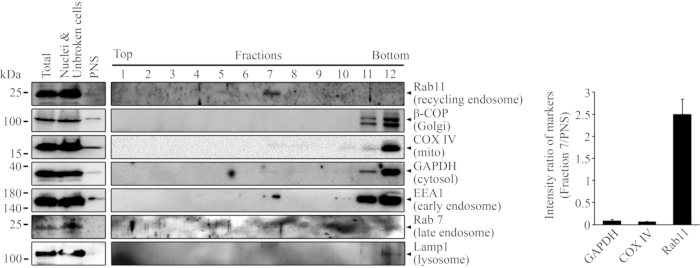
图1:在密度梯度超速离心后,在组分7中发现回收内体。对未转染的HEK293细胞进行分馏,并用蛋白质印迹分析所获得组分中的蛋白质含量。用抗 Rab11 抗体 (1:500) 在馏分 7 中检测到 Rab11。其他亚细胞标志物通过其特异性抗体被检测,包括β-COP(1:1000),COX IV(1:1000),GAPDH(1:10,000),EEA1(1:1000),Rab7(1:500)和Lamp1(1:1000)。分数 1 是密度较低的顶部分数,而分数 12 是密度较低的底部分数。条形图显示了分数 7 中的 GAPDH、COX IV 和 Rab11 与 PNS ± SD 的比率。这个数字是从Chan, W. W. R. et al.22修改而来的。请点击此处查看此图的放大版本。

图2:FE65的表达促进了ARF6介导的ELMO1的内吞细胞再循环。(A)使用密度梯度超速离心对转染有ELMO1,ELMO1 + ARF6 Q67L或ELMO1 + ARF6 Q67L + FE65转染的细胞进行分馏。所有馏分均进行蛋白质印迹,以分析ELMO1,ARF6 Q67L和FE65的分布。分数 1 是密度较低的顶部分数,而分数 12 是密度较低的底部分数。(B) 用蛋白质印迹法分析来自不同转染的 Rab11 阳性组分 7,以评估 ELMO1 和 ARF6 Q67L 的水平。当细胞与ARF6 Q67L共转染时,第7馏分中ELMO1的量升高。ARF6 Q67L和FE65的共表达进一步增加了馏分中ELMO1的量。(C) Wildtype HEK293 转染了 ELMO1 或 ELMO1 + ARF6 Q67L,而 FE65 KO HEK293 转染了 ELMO1 + ARF6 Q67L。在FE65 KO细胞中,ARF6介导的ELMO1在组分7中的富集显着降低。(B-C)探测回收内体标志物Rab11(1:500)和细胞质基质标志物GAPDH(1:10,000)。分别用抗ELMO1 B-7(1:1000),抗FE65 E-20(1:1000)和抗myc 9B11(1:5000)检测ELMO1,FE65和ARF6 Q67L。馏分7中ELMO1的相对水平表示为ELMO1在馏分7/总ELMO1中的密度比。条形图的数据来自三个独立实验。采用单因子方差分析与邦费罗尼事后检验进行统计分析。*p < 0.001。结果是SD22±均值折变化。这个数字是从Chan, W. W. R. et al.22修改而来的。请点击此处查看此图的放大版本。
讨论
上述方案概述了通过超速离心从培养细胞中分离回收内体的程序。这种方法的可靠性已经由最新的出版物22证明,证明回收内体成功地从其他细胞器中分离出来(图1),如高尔基体和线粒体。为了获得良好的分离结果,需要注意一些关键步骤。在制备蔗糖溶液时,建议使用折光率仪验证溶液的折射率。62%、35%和25%蔗糖溶液在室温下的折射率分别为1.44、1.39和1.37。此外,应避免从梯度产生气泡。色谱柱中存在气泡可能会破坏梯度的连续性。在均质过程中应避免使用洗涤剂,因为它们会损坏细胞器的膜。这导致蛋白质从膜结合的细胞器中释放出来,并可能导致严重的污染。此外,所有均质工具在使用前应预先冷却,以避免在均质过程中蛋白质降解。梯度一经准备,应尽快使用。虽然制备的梯度可以暂时储存在4°C(1-2小时),但由于扩散,长时间储存可能会干扰密度梯度。
蔗糖是一种广泛使用的梯度培养基,因为它很容易获得。实际上,还有许多其他选择,包括Percoll和Ficoll-40023,24。与蔗糖相比,这些培养基具有不同的物理性质。例如,Percoll的渗透压和粘度低于蔗糖。这些允许使用较低的离心力快速捆扎颗粒。Ficoll-400对膜的渗透性低于蔗糖,因为它具有高分子量和低可透析材料含量。因此,改变梯度培养基可以实现更高的内体分离效率。
除了密度梯度超速离心外,其他方法可用于细胞分级分离,包括自由流动电泳(FFE)25,荧光活化细胞器分选(FAOS)26和免疫异构化27。FFE是一种液相分离方法。样品在垂直于流动方向的电场的影响过分离缓冲液。不同细胞器的偏转水平根据其表面电荷而变化25。FAOS通常使用荧光标签或抗体来标记特定的细胞器,然后进行流式细胞术进行分离28,29。免疫异构化依赖于检测靶细胞器表面的特异性抗原并随后通过抗体30沉淀。
与这些替代方案相比,密度梯度超速离心有其自身的优势。首先,可以通过用分离的级分进行蛋白质印迹来获得感兴趣蛋白质的分布图(图2A)。蛋白质亚细胞定位的任何变化都可以很容易地检测到。此外,超速离心机是大多数机构的标准仪器,操作离心机的技术要求很低。相比之下,分别需要流式细胞仪和特定的电泳系统进行FAOS和FFE的分离过程。免疫隔离不需要特定的设备。然而,它主要用于从少量细胞中分离内体。超速离心的制备规模大于免疫分离的制备规模。此外,具有高特异性的抗体对于免疫隔离31是必要的。此外,洗涤剂和高含盐缓冲液不能用于洗涤步骤,以确保内体的完整性。这可能导致高背景并降低分离的细胞器31的纯度。
由于密度梯度超速离心根据密度分离细胞器,因此其最显着的限制是向具有相似密度的细胞器分辨能力。如图 1所示,Rab11和EEA1在7级中都被检测到,因为回收和早期内体的物理性质相似。需要进一步的测定来确认循环内体中靶向蛋白质水平的变化。在之前的研究中,在22号细胞中对ELMO1和Rab11进行了共同免疫染色。除了进行其他测定外,还可以采取一些措施来克服这个问题。连续的密度梯度可以解析密度差很小的细胞器32。然而,连续梯度的产量明显低于不连续梯度的产量。可以通过用乳胶珠33预处理细胞来操纵内体的密度。磁珠通过内吞作用被细胞内化。含有内体的微球的密度显着降低,并且可以与其他细胞器分离。通常,增加另一个分离水平可以显着改善具有相似密度的细胞器的分离。例如,从分离的组分34中进行免疫隔离。通过使用特异性抗体,可以从污染物中分离出回收的内体。荧光标记的抗体和探针,结合流式细胞术分析,也可用于精确的内体分离28。FFE也适用于根据其表面电荷25分离具有相似密度的细胞器。
披露声明
作者声明,他们与本文的内容没有利益冲突。
致谢
这项工作得到了香港研究资助局、香港中文大学直接资助计划、联合学院捐赠基金和TUYF慈善信托基金的资助。这项工作中的数字改编自我们之前的出版物,"ARF6-Rac1信号介导的神经突起生长通过编排ARF6和ELMO1由神经元适配器FE65增强"于2020年10月发表在FASEB杂志上。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL, Open-Top Thickwall Polypropylene Tube, 11 x 34 mm | Beckman Coulter | 347287 | |
| 100 mm tissue culture dish | SPL | 20100 | |
| 13.2 mL, Certified Free Open-Top Thinwall Ultra-Clear Tube, 14 x 89 mm | Beckman Coulter | C14277 | |
| 5x Sample Buffer | GenScript | MB01015 | |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Roche | 11873580001 | |
| COX IV (3E11) Rabbit mAb | Cell Signaling Technology | 4850S | Rabbit monoclonal antibody for detecting COX IV. |
| Cycloheximide | Sigma-Aldrich | C1988 | |
| Dounce Tissue Grinder, 7 mL | DWK Life Sciences | 357542 | |
| Dulbecco's Modified Eagle Medium (DMEM) with low glucose | HyClone | SH30021.01 | |
| ELMO1 antibody (B-7) | Santa Cruz Biotechnology | SC-271519 | Mouse monoclonal antibody for detecting ELMO1. |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| FE65 antibody (E-20) | Santa Cruz Biotechnology | SC-19751 | Goat polyclonal antibody for detecting FE65. |
| Fetal Bovine Serum, Research Grade | HyClone | SV30160.03 | |
| GAPDH Monoclonal Antibody (6C5) | Ambion | AM4300 | Mouse monoclonal antibody for detecting GAPDH. |
| ImageLab Software | Bio-Rad | Measurement of band intensity | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Lipofectamine 2000 Transfection Reagent | Invitrogen | 11668019 | |
| Monoclonal Anti-β-COP antibody | Sigma | G6160 | Mouse monoclonal antibody for detecting β-COP. |
| Myc-tag (9B11) mouse mAb | Cell Signaling Technology | 2276S | Mouse monoclonal antibody for detecting myc tagged proteins. |
| OmniPur EDTA, Disodium Salt, Dihydrate | Calbiochem | 4010-OP | |
| Optima L-100 XP | Beckman Coulter | 392050 | |
| Optima MAX-TL | Beckman Coulter | A95761 | |
| Opti-MEM I Reduced Serum Media | Gibco | 31985070 | |
| PBS Tablets | Gibco | 18912014 | |
| PhosSTOP | Roche | 4906845001 | |
| RAB11A-Specific Polyclonal antibody | Proteintech | 20229-1-AP | Rabbit polyclonal antibody for detecting Rab11. |
| Sucrose | Affymetrix | AAJ21931A4 | |
| SW 41 Ti Swinging-Bucket Rotor | Beckman Coulter | 331362 | |
| TLA-120.2 Fixed-Angle Rotor | Beckman Coulter | 362046 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300062 |
参考文献
- Elkin, S. R., Lakoduk, A. M., Schmid, S. L. Endocytic pathways and endosomal trafficking: a primer. Wiener Medizinische Wochenschrift. 166 (7-8), 196-204 (2016).
- Kumari, S., Mg, S., Mayor, S. Endocytosis unplugged: multiple ways to enter the cell. Cell Research. 20 (3), 256-275 (2010).
- Naslavsky, N., Caplan, S. The enigmatic endosome - sorting the ins and outs of endocytic trafficking. Journal of Cell Science. 131 (13), (2018).
- Cullen, P. J., Steinberg, F. To degrade or not to degrade: mechanisms and significance of endocytic recycling. Nature Reviews. Molecular Cell Biology. 19, 679-696 (2018).
- Weeratunga, S., Paul, B., Collins, B. M. Recognising the signals for endosomal trafficking. Current Opinion in Cell Biology. 65, 17-27 (2020).
- Khan, I., Steeg, P. S. Endocytosis: a pivotal pathway for regulating metastasis. British Journal of Cancer. 124 (1), 66-75 (2021).
- Grant, B. D., Donaldson, J. G. Pathways and mechanisms of endocytic recycling. Nature Reviews. Molecular Cell Biology. 10 (9), 597-608 (2009).
- Maxfield, F. R., McGraw, T. E. Endocytic recycling. Nature Reviews. Molecular Cell Biology. 5 (2), 121-132 (2004).
- McDonald, F. J. Explosion in the complexity of membrane protein recycling. American Journal of Physiology. Cell Physiology. 320 (4), 483-494 (2021).
- O'Sullivan, M. J., Lindsay, A. J. The Endosomal Recycling pathway-at the crossroads of the cell. International Journal of Molecular Sciences. 21 (17), 6074 (2020).
- D'Souza-Schorey, C., Li, G., Colombo, M. I., Stahl, P. D. A regulatory role for ARF6 in receptor-mediated endocytosis. Science. 267 (5201), 1175-1178 (1995).
- Schweitzer, J. K., Sedgwick, A. E., D'Souza-Schorey, C. ARF6-mediated endocytic recycling impacts cell movement, cell division and lipid homeostasis. Seminars in Cell and Developmental Biology. 22 (1), 39-47 (2011).
- Finicle, B. T., et al. Sphingolipids inhibit endosomal recycling of nutrient transporters by inactivating ARF6. Journal of Cell Science. 131 (12), (2018).
- Lu, H., et al. APE1 upregulates MMP-14 via redox-sensitive ARF6-mediated recycling to promote cell invasion of esophageal adenocarcinoma. Cancer Research. 79 (17), 4426-4438 (2019).
- Qi, S., et al. Arf6-driven endocytic recycling of CD147 determines HCC malignant phenotypes. Journal of Experimental and Clinical Cancer Research. 38 (1), 471 (2019).
- Crupi, M. J. F., et al. GGA3-mediated recycling of the RET receptor tyrosine kinase contributes to cell migration and invasion. Oncogene. 39 (6), 1361-1377 (2020).
- Gamara, J., et al. Assessment of Arf6 deletion in PLB-985 differentiated in neutrophil-like cells and in mouse neutrophils: impact on adhesion and migration. Mediators of Inflammation. 2020, 2713074 (2020).
- Santy, L. C., Ravichandran, K. S., Casanova, J. E. The DOCK180/Elmo complex couples ARNO-mediated Arf6 activation to the downstream activation of Rac1. Current Biology. 15 (19), 1749-1754 (2005).
- Wibo, M., Dumont, J. E., Brown, B. L., Marshall, N. J. Cell fractionation by centrifugation methods. Eukaryotic Cell Function and Growth: Regulation by Intracellular Cyclic Nucleotides. , 1-17 (1976).
- Kelly, E. E., Horgan, C. P., McCaffrey, M. W. Rab11 proteins in health and disease. Biochemical Society Transactions. 40 (6), 1360-1367 (2012).
- Li, W., et al. Neuronal adaptor FE65 stimulates Rac1-mediated neurite outgrowth by recruiting and activating ELMO1. The Journal of Biological Chemistry. 293 (20), 7674-7688 (2018).
- Chan, W. W. R., Li, W., Chang, R. C. C., Lau, K. F. ARF6-Rac1 signaling-mediated neurite outgrowth is potentiated by the neuronal adaptor FE65 through orchestrating ARF6 and ELMO1. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology. 34 (12), 16397-16413 (2020).
- Huber, L. A., Pfaller, K., Vietor, I. Organelle proteomics: implications for subcellular fractionation in proteomics. Circulation Research. 92 (9), 962-968 (2003).
- Fleischer, S., Kervina, M. Subcellular fractionation of rat liver. Methods in Enzymology. 31, 6-41 (1974).
- Marsh, M. Endosome and lysosome purification by free-flow electrophoresis. Methods in Cell Biology. 31, 319-334 (1989).
- Stasyk, T., Huber, L. A. Zooming in: fractionation strategies in proteomics. Proteomics. 4 (12), 3704-3716 (2004).
- Iordachescu, A., Hulley, P., Grover, L. M. A novel method for the collection of nanoscopic vesicles from an organotypic culture model. RSC Advances. 8 (14), 7622-7632 (2018).
- Chavrier, P., vander Sluijs, P., Mishal, Z., Nagelkerken, B., Gorvel, J. P. Early endosome membrane dynamics characterized by flow cytometry. Cytometry. 29 (1), 41-49 (1997).
- Chasan, A. I., Beyer, M., Kurts, C., Burgdorf, S. Isolation of a specialized, antigen-loaded early endosomal subpopulation by flow cytometry. Methods in Molecular Biology. 960, 379-388 (2013).
- Thapa, N., et al. Phosphatidylinositol-3-OH kinase signaling is spatially organized at endosomal compartments by microtubule-associated protein 4. Nature Cell Biology. 22 (11), 1357-1370 (2020).
- Guimaraes de Araujo, M. E., Fialka, I., Huber, L. A. . Endocytic Organelles: Methods For Preparation And Analysis. In eLS. , (2001).
- Rickwood, D., Graham, J. . Centrifugation Techniques. , (2015).
- Lamberti, G., de Araujo, M. E., Huber, L. A. Isolation of macrophage early and late endosomes by latex bead internalization and density gradient centrifugation. Cold Spring Harbor Protocols. 2015 (12), (2015).
- Urbanska, A., Sadowski, L., Kalaidzidis, Y., Miaczynska, M. Biochemical characterization of APPL endosomes: the role of annexin A2 in APPL membrane recruitment. Traffic. 12 (9), 1227-1241 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。