Method Article
Un modello di trapianto di polmone di ratto di ischemia calda / danno da riperfusione: ottimizzazioni per migliorare i risultati
In questo articolo
Riepilogo
Qui, presentiamo le ottimizzazioni di un modello di trapianto di polmone di ratto che servono a migliorare i risultati. Forniamo una guida alle taglie per i polsini in base al peso corporeo, una strategia di misurazione per accertare il 4° spazio intercostale e metodi di chiusura della ferita e raccolta di liquidi e tessuti BAL (lavaggio broncoalveolare).
Abstract
Dalla nostra esperienza con il trapianto di polmoni di ratto, abbiamo trovato diverse aree di miglioramento. Le informazioni nella letteratura esistente riguardanti i metodi per la scelta delle dimensioni appropriate del bracciale per la vena polmonare (PV), l'arteria polmonare (PA) o il bronco (Br) sono varie, rendendo così la determinazione della corretta dimensione della cuffia durante il trapianto di polmone di ratto un esercizio di tentativi ed errori. Standardizzando la tecnica di cuffing per utilizzare il bracciale efficace più piccolo appropriato per le dimensioni del vaso o del bronco, si può rendere la procedura di trapianto più sicura, più veloce e più efficace. Poiché i diametri di PV, PA e Br sono correlati al peso corporeo del ratto, presentiamo una strategia per scegliere una dimensione appropriata utilizzando una guida basata sul peso. Poiché il volume polmonare è anche correlato al peso corporeo, raccomandiamo che questa relazione debba essere considerata anche quando si sceglie il volume d'aria appropriato per il gonfiaggio polmonare del donatore durante l'ischemia calda e per il volume corretto di PBS da instillare durante la raccolta del liquido di lavaggio broncoalveolare (BAL). Descriviamo anche i metodi per la dissezione dello spazio intercostale 4, la chiusura della ferita e la raccolta di campioni sia dai lobi nativi che da quelli trapiantati.
Introduzione
Per oltre tre decenni, i ricercatori hanno modificato e migliorato i modelli di trapianto di polmone di ratto in modo che i dati generati siano più coerenti e riflettano maggiormente le condizioni cliniche reali. Nel tempo in cui il nostro laboratorio ha eseguito questo modello, abbiamo determinato quattro aree di miglioramento: tecniche di cuffing per anastomosi, identificazione del 4° spazio intercostale del ricevente, gonfiaggio polmonare e chiusura della ferita durante la procedura del ricevente e raccolta di campioni per l'analisi.
Le modifiche alla tecnica di cuffing per le anastomosi possono migliorare l'intera procedura di trapianto riducendo il tempo di manipolazione del polmone donatore 1,2,3,4,5,6 e rendendo la procedura di anastomosi più veloce e tecnicamente più facile per il microchirurgo. Mentre è fondamentale utilizzare i polsini di dimensioni adeguate per fornire il sangue necessario e il flusso d'aria al polmone trapiantato, ci sono indicazioni limitate su come si dovrebbe scegliere la dimensione dei polsini per la vena polmonare (PV), l'arteria polmonare (PA) o il bronco (Br) 5,7,8,9. Poiché i diametri di PV, PA e Br sono correlati al peso corporeo dei ratti donatori e riceventi, proponiamo che la dimensione del bracciale sia basata sul peso corporeo. Questo rapporto fornisce una guida alle taglie per i polsini basata sul peso corporeo di un ratto (da 180 g a oltre 270 g) che serve a ottimizzare l'apporto di sangue e aria al polmone trapiantato (Tabella 1).
Mentre un nuovo microchirurgo può procurarsi con successo e facilmente un polmone donatore durante la procedura del donatore, il trapianto del polmone durante la procedura del ricevente è più complicato e dipende dall'esperienza del microchirurgo. I tentativi di trovare il 4° spazio intercostale per accedere al polmone sinistro del ricevente è uno dei passaggi più difficili che mantiene una certa soggettività e può aumentare il tempo della procedura. Pertanto, introduciamo un metodo semplice e oggettivo per aiutare nell'identificazione della 4° posizione dello spazio intercostale utilizzando le misurazioni del torace e le palpitazioni del cuore per trovare la corretta area della parete toracica per sezionare 4,5,6,10,11,12.
Proponiamo anche un miglioramento dell'inflazione polmonare del donatore, che è una potenziale fonte di lesioni all'organo. Il polmone del donatore viene sgonfiato fino all'inizio della riperfusione. Durante la sutura del 4° spazio intercostale, il polmone donatore viene comunemente gonfiato aumentando la PEEP da 2 cmH 2 O a 6 cmH2O. Al fine di ridurre al minimo il danno polmonare da sovragonfiaggio, proponiamo una tecnica in cui tre suture di nylon 6-0 sono posizionate intorno alla 4 ° costola inferiore alla 5° costola con semplici doppi nodi. Quando è il momento della chiusura della ferita, le estremità delle tre suture vengono tenute con emostatici in entrambe le mani, la ferita viene chiusa tutta in una volta tirando su ciascun lato e la PEEP viene immediatamente ridotta a 2 cmH2O. In questo modo, il polmone può espandersi nel minor tempo possibile10.
Alla conclusione di un esperimento, il ricercatore vuole spesso raccogliere molti tipi di campioni per molti tipi di analisi da ogni trapianto. Ad esempio, il tessuto congelato a scatto, il tessuto fisso di formalina, il tessuto per il rapporto peso umido-secco per determinare l'edema polmonare e il liquido di lavaggio broncoalvelolare (BAL) possono essere utilizzati per valutare quanto bene è andato il trapianto. Il metodo tradizionale di raccolta del liquido BAL consente un campione misto aggregato sia dai lobi nativi del ricevente che dal lobo trapiantato del donatore13,14,15. Per ovviare a questo, presentiamo un metodo di bloccaggio delle aree ilari che può fornire una visione più precisa delle condizioni dei polmoni trapiantati e nativi. Inoltre, il volume di PBS utilizzato per raccogliere il liquido BAL da ciascun lato dei polmoni è importante da considerare perché il fluido BAL contiene numerosi fattori solubili come citochine e chemochine che vengono misurati dalla concentrazione. Normalizzare il volume del fluido instillato al volume stimato della capacità polmonare può aiutare con il confronto. Con quattro lobi sul lato destro e un lobo sul lato sinistro, ciascuno dei cinque lobi del ratto ha un volume e una superficie diversi16. Secondo uno studio precedente sulla misurazione del volume dei lobi polmonari di Backer et al., del volume totale dell'intero polmone il volume dei lobi di destra è del 63% (4400 mm 3) e il lobo sinistro è del 37% (2500 mm3). Pertanto, raccomandiamo che il volume di PBS utilizzato per raccogliere il liquido BAL sia calcolato come il doppio del volume corrente (7,2 ml / kg) moltiplicato per il 63% per il polmone destro e il 37% per il polmone sinistro. Utilizzando questo approccio, è possibile controllare meglio variabili come il peso corporeo e i tempi10,16.
In tutto, in questo rapporto dimostreremo alcune modifiche al modello sperimentale standard di trapianto di polmone di ratto che possono rendere la procedura più efficiente e aumentare la capacità di generare dati più accurati e abbondanti da ogni esperimento.
Protocollo
I ratti maschi di Sprague-Dawley (180-270 g di peso corporeo) sono stati acquistati commercialmente (ad esempio, Envigo) e sono stati ospitati in condizioni prive di agenti patogeni presso la Ohio State University Animal Facility. Tutte le procedure sono state eseguite umanamente secondo il NIH e la Guida del Consiglio nazionale delle ricerche per la cura umana e l'uso degli animali da laboratorio e con l'approvazione del Comitato istituzionale per la cura e l'uso degli animali dell'Ohio State University (protocollo IACUC # 2012A00000135-R2).
1. Configurazione iniziale
- Configurare i dispositivi chirurgici.
NOTA: Questo è un intervento chirurgico di non sopravvivenza. Se deve essere eseguito un intervento chirurgico di sopravvivenza, è necessario intraprendere strumenti sterili e precauzioni di barriera.- Accendere l'apparecchiatura di monitoraggio della frequenza cardiaca/della saturazione di ossigeno e la scheda di riscaldamento a 42 °C.
- Accendere la macchina di ventilazione e anestesia per preriscaldare l'evaporatore di isoflurano.
NOTA: Utilizzare un volume corrente (Td) di 7,2 mL/kg, una pressione espiratoria positiva (PEEP) di 2 cmH2O e una frequenza respiratoria di 80 bpm. - Riempire la siringa per anestesia con 10 ml di isoflurano liquido e montare la siringa sulla macchina di ventilazione e anestesia.
- Accendere il microscopio chirurgico con l'altezza e la messa a fuoco regolate in base alle preferenze del microchirurgo.
- Accendere il dispositivo di elettrocauterizzazione.
- Preparare e disporre gli strumenti chirurgici (Figura 1).
NOTA: Tutti gli strumenti chirurgici sono stati sterilizzati in autoclave a 121 °C per 30 minuti. - Raccogliere e registrare il peso corporeo dei ratti donatori e riceventi.
- Utilizzare la Tabella 1 e il peso corporeo del ratto per determinare il calibro corretto del catetere angio (20, 18, 16 14 o 12 G) da utilizzare per fare le manette.
- Preparare i polsini per l'arteria polmonare (PA), il bronco (Br) e la vena polmonare (PV) utilizzando la guida alle taglie basata sul peso corporeo (Tabella 1 e Figura 2).
- Posizionare un catetere angio-catetere di dimensioni 20 G, 18 G, 16 G, 14 G o 12 G (Figura 2A-E) su una superficie sterile sotto il microscopio chirurgico.
- Quindi utilizzare una lama chirurgica a schiena nervatura #11 (Figura 2F) per tagliare il catetere angio-catetere con un angolo di 90° per formare un corpo del bracciale lungo 2 mm con una linguetta di 1 mm X 1 mm (larghezza x altezza) nella parte superiore del corpo del bracciale (Figura 2G).
- Conservare i polsini in soluzione salina sterile fino al momento dell'uso.
- Preparare soluzioni.
- Preparare una miscela di ketamina e xilazina in un flaconcino sterile per iniezione aggiungendo 1 mL di xilazina (100 mg/ml) a 10 mL di ketamina (100 mg/ml).
NOTA: La data di scadenza per questo cocktail è determinata utilizzando la prima data di scadenza dei componenti utilizzati. - Aspirare nelle siringhe il dosaggio corretto per i ratti (0,1 mL della miscela ketamina/xilazina per 100 g di peso corporeo del ratto; ad esempio, per un ratto da 200 g, verrebbero erogati 0,2 ml di miscela ketamina/xilazina).
NOTA: Questo dosaggio fornirà 91 mg / kg di ketamina e 9,1 mg / kg di xilazina al ratto e dovrebbe mantenere un ratto sedato per 60-80 minuti. - Preparare l'eparina che verrà somministrata alla dose di 1.000 U/kg.
- Conservare la soluzione salina, PBS e di conservazione su ghiaccio (Table of Materials).
- Preparare una miscela di ketamina e xilazina in un flaconcino sterile per iniezione aggiungendo 1 mL di xilazina (100 mg/ml) a 10 mL di ketamina (100 mg/ml).
2. Preparazione del ratto del donatore
- Indurre l'anestesia nel ratto donatore iniettando per via intraperitoneale la miscela di ketamina e xilazina e aspettando ~ 10 minuti per lo sviluppo di un piano chirurgico di anestesia che può essere valutato dalla mancanza di risposta al pizzico del piede.
- Rasare l'area di incisione utilizzando tagliacapelli elettronici.
- Posizionare il ratto donatore in posizione supina sulla tavola riscaldante chirurgica e pulire l'area di incisione con una garza sterile imbevuta di betadine. Quindi pulire l'area con un tampone di alcool isopropilico al 70%. Ripeti 3 volte.
- Fai un'incisione cutanea della linea mediana di 3 o 4 cm a metà collo usando le forbici e seziona attentamente i tessuti e i muscoli sottocutanei usando una pinza (invece delle forbici per evitare il sanguinamento).
- Per l'intubazione endotracheale, infilare la sutura di seta 4-0 intorno alla trachea e inserire un angiocatetere da 16 G nella trachea. Legare saldamente la sutura attorno alla trachea con un doppio nodo, quindi finire con un singolo nodo per tenere in posizione il catetere angioangio.
- Collegare l'angio-catetere al ventilatore e mantenere un piano chirurgico di anestesia nel ratto con l'1-2% di isoflurano.
- Eseguire una laparo-sternotomia come un'incisione combinata della linea mediana e trasversale usando le forbici.
- Iniettare eparina (1.000 U/kg) con una siringa da insulina attraverso la vena cava inferiore (IVC) e lasciare 10 minuti per la circolazione sistemica.
NOTA: Questa somministrazione di eparina previene la formazione di coaguli di sangue nel polmone del donatore. - Sezionare attentamente il diaframma tagliando lungo l'arco toracico, quindi esporre la cavità toracica seguendo lo sterno fino al collo.
3. Ischemia polmonare calda del donatore e approvvigionamento
- Eutanasia il ratto donatore tagliando l'IVC.
- Mentre i polmoni sono ancora in ventilazione, tagliare entrambi i padiglioni auricolari destro e sinistro con micro forbici a molla dissecanti e polmoni a filo gravitazionale con 20 ml di soluzione di conservazione in una siringa appesa a 28 cmH2O per gravità collegata a tubi e un angiocatetere da 18 G che viene introdotto direttamente attraverso l'arteria polmonare.
- Scollegare il ventilatore dal tubo endotracheale e collegarlo a una siringa da 5 mL riempita con un volume d'aria adeguato in base al peso corporeo.
NOTA: Il volume d'aria per gonfiare i polmoni può essere calcolato come con il doppio del volume corrente (Td = 7,2 ml / kg), ad esempio, un ratto di 200 g avrebbe un Td di 1,44 ml e moltiplicandolo per 2 equivarrebbe a 2,88 ml di aria necessaria per gonfiare i polmoni. - Gonfiare i polmoni del donatore.
- Metti un morsetto Yasargil sulla trachea per mantenere i polmoni gonfiati e copri i polmoni e il cuore con una garza di cotone sterile. Idratare la garza con soluzione salina, avvolgere il ratto donatore con un sottocuscinetto e lasciare sulla tavola chirurgica di riscaldamento per 1 ora per indurre ischemia calda nei polmoni (Figura 3).
- Dopo 1 ora di ischemia calda, asportare il blocco cuore-polmone con micro forbici e pinze a molla dissecanti e posizionare su una garza sterile inumidita con PBS ghiacciato su una piastra di Petri sterile su ghiaccio.
NOTA: tutti i seguenti passaggi dovrebbero verificarsi mentre i polmoni sono sulla capsula di Petri sul ghiaccio. - Incidere con cura i legamenti polmonari con micro forbici a molla dissecanti per separare il polmone sinistro dall'esofago e dal lobo post-cavale.
- Tagliare con cura l'area ilare polmonare sinistra con la forbice a molla Vannas-Tubingen e procurarsi il PV sinistro, PA e Br.
- Posizionare i polsini su PV, PA o Br (Figura 4A-C).
- Usa un emostatico di zanzara per afferrare la linguetta del bracciale.
- Utilizzare una pinza fine per afferrare l'estremità distale del PV, PA o Br attraverso il corpo del bracciale appropriato, estromettere il tessuto extra intorno al bracciale e fissare utilizzando 8-0 sutura in nylon. Utilizzare le forbici a molla Vannas-Tubingen per tagliare il tessuto extra e il bracciale intorno al corpo del polsino.
- Tenere il polmone del donatore coperto con una garza inumidita con soluzione salina sulla capsula di Petri su ghiaccio fino a quando non è pronto per essere trapiantato nel ratto ricevente (Figura 4D).
NOTA: Il tempo medio di ischemia fredda è di 84 minuti ± 11 minuti S.D.
4. Preparazione del ratto ricevente
- Indurre l'anestesia nel ratto ricevente allo stesso modo del ratto donatore iniettando per via intraperitoneale la miscela di ketamina e xilazina (0,1 ml per 100 g di ratto) e attendendo 10 minuti per lo sviluppo di un piano chirurgico di anestesia che può essere valutato dalla mancanza di risposta al pizzico del piede.
- Rasare l'area di incisione utilizzando tagliacapelli elettronici.
- Posizionare il ratto donatore in posizione supina e pulire l'area di incisione con una garza sterile imbevuta di betadine. Quindi pulire l'area con un tampone di alcool isopropilico al 70%. Ripeti 3 volte.
- Prima che il ratto sia assicurato alla macchina di ventilazione, disegnare linee sul petto del ratto in preparazione per trovare il 4° spazio intercostale.
- Misurare il torace dalla tacca soprasternale al processo xifoideo e tracciare una linea (Figura 5A).
- Al centro di questa linea, traccia una linea lungo il lato sinistro del torace che misura metà della misurazione dalla tacca soprasternale al processo xifoideo (Figura 5A e B).
- Intubare il ricevente utilizzando un angiocatetere da 16 G tramite visualizzazione utilizzando il cavo in fibra ottica collegato a una luce LED dal kit di intubazione endotracheale.
- Collegare l'angiocatetere al ventilatore e mantenere un piano chirurgico di anestesia con isoflurano all'1-2%.
- Per trovare il 4° spazio intercostale, trova l'area della parete toracica dove si può sentire un forte impulso cardiaco palpabile (Figura 5C, cerchio rosso).
- In questa posizione, incidere la pelle con le forbici e il muscolo con le micro forbici a molla dissecanti e utilizzare il divaricatore per aprire il 4° spazio intercostale il più ampiamente possibile (Figura 5D ed E).
NOTA: Utilizzare cauterizzazione elettrica per evitare o interrompere il sanguinamento durante la dissezione muscolare. - Una volta che lo spazio intercostale è ampiamente aperto, sezionare attentamente i legamenti attorno al polmone sinistro del ricevente usando le forbici a molla Vannas-Tubingen e estrarre il polmone dalla zona del torace usando tamponi di cotone sterili e pinze.
- Posizionare una garza sterile attorno al polmone sinistro e tenerlo con un morsetto per bulldog Dieffenbach.
- Applicare un morsetto Yasargil sull'area ilare del polmone sinistro il più prossimalmente possibile.
5. Anastomosi
- Anastomosi della vena polmonare (PV)
- Posizionare la sutura di nylon 7-0 attorno al PV del destinatario.
- Incidere il PV del ricevente usando le forbici a molla Vannas-Tubingen tagliando trasversalmente le vene segmentali superiore e inferiore il più distalmente possibile e sciacquare il sangue con 0,2 ml di soluzione salina eparinizzata (1 U/ml) usando una siringa da insulina.
- Posizionare il polmone donatore ancora avvolto con una garza sterile bagnata ghiacciata nella cavità toracica.
- Inserire il PV con bracciale del donatore nel PV del ricevente, quindi fissare con la sutura di nylon 7-0 preposizionata (Figura 6).
- Anastomosi bronchiale (Br)
- Posizionare la sutura di nylon 7-0 attorno al Br del destinatario.
- Incidere il Br del ricevente tagliando le vie aeree segmentali superiori e inferiori trasversalmente il più distalmente possibile con le forbici a molla Vannas-Tubingen.
- Inserire il Br ammanettato del donatore nel Br del ricevente e fissarlo con la sutura di nylon 7-0 preposizionata (Figura 6).
- Anastomosi dell'arteria polmonare (PA):
- Posizionare la sutura di nylon 7-0 attorno al PA del destinatario.
- Incidere il PA del ricevente dalla sua guaina avventiziale, incidere metà della circonferenza della nave con le forbici a molla Vannas-Tubingen e quindi lavare il sangue nel PA con 0,2 mL di soluzione salina eparinizzata (1 U / ml) usando una siringa da insulina.
- Inserire il PA ammanettato del donatore nel PA del ricevente e fissare con la sutura in nylon 7-0 preposizionata (Figura 6).
6. Riperfusione
- Rimuovere il morsetto Yasargil sull'ilo per consentire la riperfusione e la ventilazione del polmone donatore trapiantato (Figura 7).
- Sezionare il polmone sinistro nativo del ricevente usando micro forbici e pinze a molla dissecanti.
- Riposizionare con attenzione il polmone sinistro trapiantato nel torace del ricevente.
- Chiudere l'incisione toracotomia utilizzando la sutura di nylon 6-0.
- Posizionare tre suture di nylon 6-0 con semplici doppi nodi attorno alle costole superiori alla 4a costola e inferiori alla 5acostola (Figura 8A).
- Utilizzare emostatici per raccogliere le tre suture insieme (Figura 8B).
- Aumentare il PEEP a 6 cmH2O nelle impostazioni di ventilazione.
- Legare insieme tutti e tre i nodi allo stesso tempo tirando via per chiudere la ferita (Figura 8C).
- Ridurre immediatamente il PEEP a 2 cmH2O.
- Chiudere la pelle con sutura in nylon 6-0.
NOTA: Il nostro laboratorio studia la fase acuta post-trapianto, quindi il ratto ricevente in questo modello è sopravvissuto per 3 ore post-trapianto sotto ventilazione e anestesia e quindi vengono raccolti campioni.
7. Raccolta di campioni sperimentali (plasma, tessuto polmonare)
- Per i campioni di controllo, raccogliere i lobi destri del donatore dopo l'inizio del periodo di riperfusione di 3 ore.
- Congelare a scatto il lobo superiore e il lobo post-cavale per analisi di espressione di proteine o RNA, preservare il lobo medio per l'istologia e utilizzare il lobo inferiore per il rapporto peso umido-secco (Figura 9A).
- A 10 minuti prima della fine del tempo di riperfusione di 3 ore, prepararsi a raccogliere i campioni riceventi iniettando eparina (1.000 U / kg) con una siringa da insulina nella vena giugulare.
NOTA: Questa somministrazione di eparina previene la formazione di coaguli di sangue nei polmoni e consente un lavaggio più completo al momento dell'approvvigionamento. - Raccolta del plasma
- Alla fine del periodo di riperfusione di 3 ore, raccogliere 1 ml di sangue con una siringa tramite l'IVC.
- Conservare su ghiaccio e quindi centrifugare a 2.000 x g per 10 minuti per raccogliere il plasma.
- Eutanasia il ratto ricevente tagliando l'IVC per consentire il dissanguamento.
- Sezionare il diaframma lungo l'arco toracico ed esporre la cavità toracica sezionando la gabbia toracica.
- Raccogliere il liquido BAL dai polmoni nativi o trapiantati, se lo si desidera (opzionale).
NOTA: se il rapporto peso umido-secco o l'istologia viene eseguita sul polmone, la raccolta del liquido BAL non deve essere eseguita poiché può influire sui risultati.- Infilare la sutura di seta 4-0 intorno alla trachea e legare un doppio nodo stretto attorno alla trachea e al tubo di intubazione per evitare perdite di liquido.
- Calcola la quantità di PBS ghiacciato per la raccolta del fluido BAL dai lobi destro e sinistro.
NOTA: Il rapporto di volume per il polmone destro è 63% mentre il rapporto di volume per il polmone sinistro è 37% 16. Pertanto, per determinare la quantità di PBS da instillare in ciascun lato, il volume deve essere calcolato come il doppio del volume corrente (Td = 7,2 ml / kg) moltiplicato per il 63% per il polmone destro e il 37% per il polmone sinistro. - Posizionare un morsetto Yasargil sull'area ilare del polmone sinistro (Figura 10A) e, con una siringa collegata all'angiocatetere, instillare la quantità calcolata di PBS ghiacciato nel polmone destro (lobi nativi del ricevente) e raccogliere il liquido BAL tirando delicatamente verso l'alto sullo stantuffo della siringa. Esegui due volte.
NOTA: Ci si dovrebbe aspettare un recupero del 70-80% del fluido instillato. - Rimuovere il morsetto Yasargil sul polmone sinistro e posizionare il morsetto sull'area ilare del polmone destro (Figura 10B).
- Raccogliere il liquido BAL dal lobo sinistro trapiantato nello stesso modo in cui è stato raccolto per i lobi destri, quindi rimuovere il morsetto sull'area ilare del polmone destro.
- Tagliare i padiglioni auricolari destro e sinistro con microforbici a molla dissecanti e lavare i polmoni per gravità attraverso il PA usando un angiocatetere da 18 G collegato al tubo e una siringa con 20 ml di soluzione di conservazione pre-refrigerata appesa a 28 cmH2O.
- Raccogliere campioni dal polmone del ricevente.
- Congelare a scatto il lobo superiore e il lobo post-cavale per analisi di espressione di proteine o RNA, preservare il lobo medio per l'istologia e utilizzare il lobo inferiore per il rapporto peso umido-secco) (Figura 9A).
- Dividere il lobo sinistro trapiantato a sinistra in tre parti: la regione superiore raccolta per il congelamento a scatto, la regione centrale per l'istologia e la regione inferiore per il rapporto peso umido-secco (Figura 9B).
Risultati
Per misurare l'edema polmonare, è stato calcolato il rapporto peso umido-secco. Il lobo nativo del donatore, il lobo trapiantato e il lobo nativo del ricevente sono stati raccolti come descritto nel protocollo e pesati immediatamente per il peso umido, essiccati a 60 ° C per 48 ore e quindi pesati nuovamente per il peso secco. Un aumento del rapporto peso umido-secco sarebbe indicativo di edema polmonare. I nostri risultati indicano che il lobo trapiantato ha avuto un aumento significativo del rapporto peso umido-secco rispetto al lobo nativo del donatore o del ricevente (p = 0,0050, n = 6 / gruppo; Figura 11).
| Dimensioni del catetere angio per polsini | |||
| Peso corporeo del ratto (g) | BABBO | Br | PV |
| 180-200 | 20 g | 18 g | 16 g |
| 200-230 | 18 g | 16 g | 14 g |
| 230-250 | 18 g | 14 g | 14 g |
| 250-270 | 18 g | 14 g | 12 - 14 g |
| Oltre 270 | 16 g | 14 g | 12 g |
Tabella 1. Guida alle taglie per polsini. La dimensione dell'arteria polmonare (PA), del bronco (Br) o della vena polmonare (PV) è correlata al peso corporeo. A seconda del peso corporeo e del tipo di bracciale che stai producendo, viene fornita la dimensione raccomandata del catetere angio.

Figura 1. Strumenti chirurgici. (A) Forbici sottili, (B) pinze, (C-E) pinze microchirurgiche, (F) pinze sottili Dumont #5, (G) forbici a molla Vannas-Tubingen e micro forbici da dissezione Castroviejo, (H) emostato Halsted-zanzara, (J) divaricatore, (K) morsetti Yasargil, (L) morsetto bulldog Dieffenbach, (M) emostatici curvi e (N) applicatore di morsetto Yasargil. Tutti gli utensili devono essere sterilizzati in autoclave a 121 °C per 30 minuti. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2. Preparazione del bracciale con varie dimensioni di angio-catetere e lama chirurgica rib-back #11. La dimensione dell'angio-catetere scelto per il bracciale è determinata dalla guida alle dimensioni del bracciale (Tabella 1) che tiene conto del peso corporeo del ratto e se il bracciale è per l'arteria polmonare (PA), il bronco (Br) o la vena polmonare (PV). Gli angiocateteri (A) 20 G, (B) 18 G, (C) 16 G, (D) 14 G o (E) 12 G vengono tagliati con una lama chirurgica (F) #11 come descritto nel protocollo e conservati in soluzione salina fino al momento del bisogno. (G) La lunghezza del corpo del bracciale è di 2 mm e una linguetta di 1 mm X 1 mm (larghezza x altezza) è lasciata nella parte superiore del corpo del bracciale per la manipolazione del corpo del bracciale. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3. Ischemia calda. I polmoni vengono lavati con la soluzione di conservazione attraverso l'arteria polmonare, gonfiati con il doppio del volume corrente dell'aria, e quindi avvolti con un sottocuscinetto e tenuti sulla tavola riscaldante dell'intervento chirurgico per mantenere il ratto a temperatura corporea normale per 1 ora. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4. Bracciale del polmone del donatore PV, PA e Fr. (A) Vena polmonare, PV (B) arteria polmonare, PA, o (C) bronco, Br, viene inserito attraverso un bracciale opportunamente dimensionato, estroflesso, fissato con 8-0 sutura di nylon, e (D) poi conservato su garza sterile inumidita con soluzione salina ghiacciata su una piastra di Petri sterile su ghiaccio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
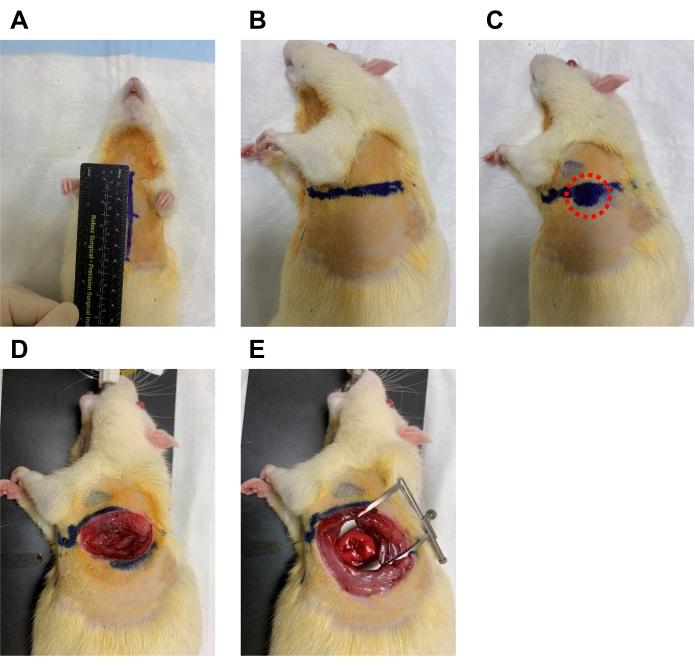
Figura 5. Misurazione e dissezione al 4° spazio intercostale. (A) Il ratto ricevente viene posto supino e il torace viene misurato dalla tacca soprasternale al processo xifoideo e viene tracciata una linea. (B) Nel punto medio di questa linea, un'altra linea sul lato sinistro è tracciata a metà della lunghezza. (C) Lungo questa linea, il microchirurgo dovrebbe sentire un'area in cui l'impulso cardiaco è più forte per garantire la corretta posizione del 4° spazio intercostale (cerchio rosso). (D) La pelle e il muscolo vengono quindi sezionati con forbici sottili. (E) Il divaricatore viene quindi utilizzato per aprire ampiamente lo spazio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
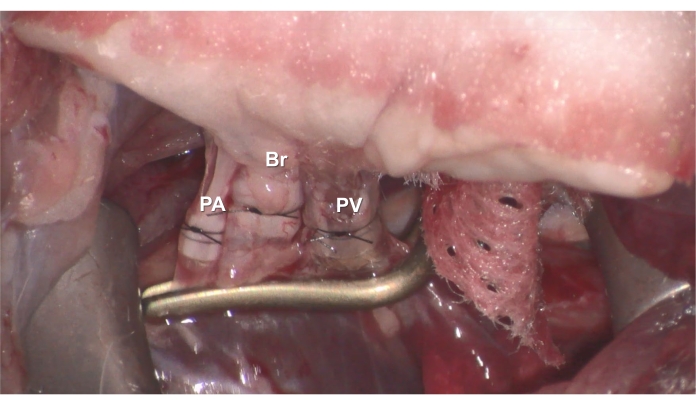
Figura 6. Anastomosi. Il (A) PV (B) Br o (C) PA ammanettato del donatore viene inserito nel PV, Br o PA del ricevente e quindi fissato con sutura di nylon 7-0. Fare clic qui per visualizzare una versione ingrandita di questa figura.
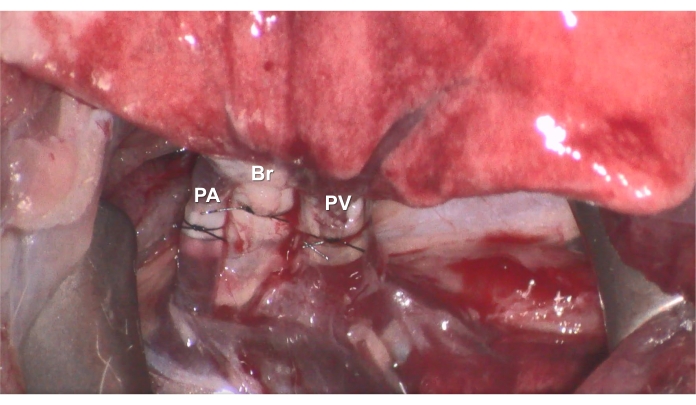
Figura 7. Riperfusione. Dopo che le anastomosi sono complete, la riperfusione può essere avviata rimuovendo il morsetto e il ratto ricevente sopravvive per 3 ore sotto ventilazione e anestesia. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 8. Chiusura della ferita. (A) Tre suture di nylon 6-0 con semplici doppi nodi sono posizionati attorno alle costole superiori alla 4a costola e inferiori alla 5acostola. (B) Utilizzare emostatici in entrambe le mani per raccogliere le tre suture insieme e aumentare il PEEP a 6 cmH2O nelle impostazioni di ventilazione. (C) Legare insieme tutti e tre i nodi allo stesso tempo tirando su e via per chiudere la ferita, ridurre immediatamente il PEEP a 2 cmH2O e chiudere la pelle con una sutura di nylon 6-0. Fare clic qui per visualizzare una versione ingrandita di questa figura.
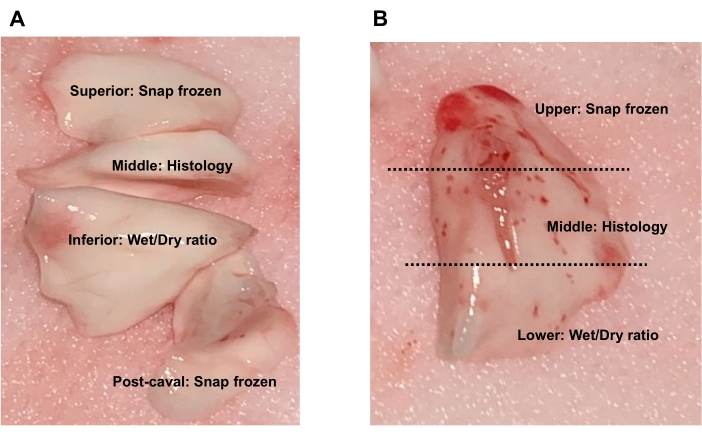
Figura 9. Raccolta di tessuto polmonare. (A) Per i lobi nativi del donatore o del ricevente, il lobo superiore e il lobo post-cavale possono essere congelati a scatto per analisi di espressione di proteine o RNA, il lobo medio può essere conservato per l'istologia e il lobo inferiore può essere utilizzato per il rapporto peso umido-secco. (B) Per il lobo trapiantato, raccogliere la regione superiore per il congelamento a scatto, la regione centrale per l'istologia o la regione inferiore per il rapporto peso umido-secco. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 10. Applicazione del morsetto per la raccolta selettiva del fluido BAL. Per evitare un campione aggregato, il liquido BAL può essere raccolto dal polmone destro (nativo) o sinistro (trapiantato). (A) L'area ilare polmonare sinistra può essere bloccata per raccogliere il liquido BAL dai lobi destri. (B) L'area ilare polmonare destra può essere bloccata per raccogliere il liquido BAL dal lobo sinistro. Fare clic qui per visualizzare una versione ingrandita di questa figura.
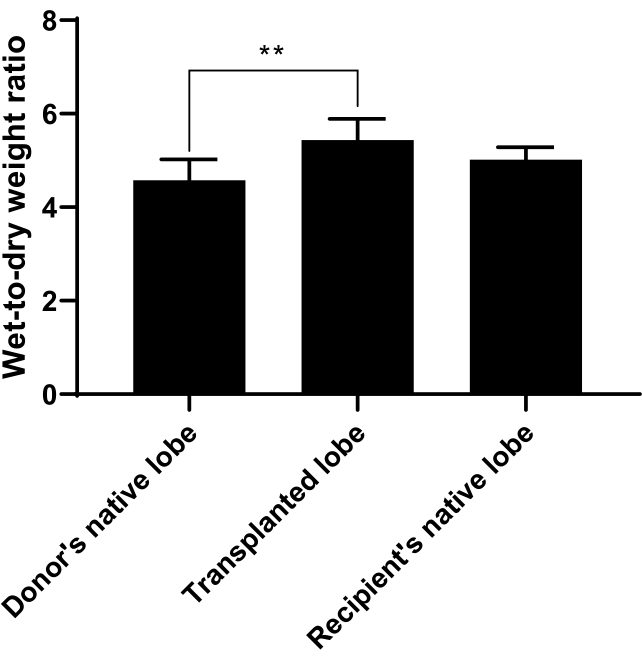
Figura 11. Rapporto peso bagnato/secco. Il rapporto peso umido-secco è stato calcolato per misurare l'edema polmonare e può essere utilizzato per indicare quanto bene è andato il trapianto. Il lobo nativo del donatore, il lobo trapiantato o il lobo nativo del ricevente sono stati raccolti come descritto nel protocollo e pesati immediatamente per il peso umido, essiccati a 60 °C per 48 ore e quindi pesati nuovamente per il peso secco. È stato preso un rapporto tra peso umido e peso secco. Il rapporto per il lobo trapiantato è stato significativamente aumentato rispetto ai lobi nativi del donatore o del ricevente. n = 6 ratti / gruppo e barre rappresentano la media ± SD. L'analisi statistica è stata eseguita utilizzando ANOVA con l'analisi post-hoc di Tukey. ** p<0.01. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
In questo rapporto, siamo intervenuti in diverse fasi critiche in un protocollo di trapianto di polmone di ratto per ottimizzare la procedura. Mentre varie tecniche di cuffing per il trapianto di polmone di ratto sono state riportate 1,2,3,4,5,6,7,8,9,15, il processo può ancora essere soggettivo e difficile da applicare per i microchirurghi. Abbiamo sottolineato che dovrebbe essere utilizzata la dimensione corretta dei polsini per PV e PA per fornire sangue o Br per fornire aria nel polmone trapiantato e abbiamo fornito un modo più obiettivo per determinare la dimensione ottimale del bracciale in base al peso corporeo del ratto. Per indurre in modo più coerente l'ischemia calda dei polmoni, abbiamo dato raccomandazioni sull'inflazione polmonare, sul bloccaggio e su come mantenere il ratto caldo durante il tempo di ischemia calda di 1 ora. Durante la procedura del ricevente, può essere difficile individuare il 4° spazio intercostale. Abbiamo raccomandato che si possa localizzare più accuratamente questa posizione impiegando un metodo di misurazione e sensazione per l'impulso cardiaco. Al momento della riperfusione, per chiudere meglio la ferita, abbiamo anche mostrato una tecnica di gestione delle suture e regolazione della PEEP che può chiudere più rapidamente la ferita e prevenire il gonfiaggio eccessivo e la lesione del polmone. Infine, abbiamo presentato strategie per la raccolta di tessuti e fluidi BAL che consentono una raccolta più obiettiva di campioni che possono essere confrontati tra esperimenti e diversi pesi corporei.
La limitazione più significativa delle tecniche descritte è la curva di apprendimento piuttosto ripida dell'operazione di trapianto in generale. La curva di apprendimento può essere ridotta con una pratica chirurgica coerente e dalla revisione delle tecniche di risoluzione dei problemi in letteratura. Un'altra limitazione è che questo modello studia la fase acuta dell'IRI e del trapianto in cui si verificano i primi cambiamenti biochimici, che è il focus del nostro laboratorio. Studi futuri dovrebbero testare la pervietà bronchiale e vascolare a tempi più lunghi dopo il trapianto.
Nel complesso, un modello praticabile di trapianto di piccoli animali è fondamentale per valutare gli interventi terapeutici per il trapianto e il danno da ischemia-riperfusione (IRI). Il modello di trapianto di polmone di ratto, in particolare, è utile in aggiunta allo studio della perfusione polmonare ex vivo di piccoli animali (EVLP)17. È anche un'alternativa più valida al trapianto di polmone murino, perché le maggiori dimensioni anatomiche consentono al ricercatore di ottenere tessuto sufficiente per analisi più approfondite18. Inoltre, il modello è essenziale per determinare la vitalità degli allotrapianti polmonari del donatore dopo l'intervento terapeutico con nuove terapie a piccole molecole e proteine 19,20,21,22 sia al donatore, all'organo donatore attraverso EVLP 17 o al ricevente e fornisce una potente via per raccogliere dati in vivo. Le ottimizzazioni che descriviamo in questo rapporto sono importanti per i microchirurghi che mirano a ridurre la loro curva di apprendimento e a rimuovere alcune soggettività. Utilizzando un algoritmo standardizzato per le dimensioni delle bracciali polmonari, l'approccio chirurgico può essere semplificato e più obiettivo. Al termine del periodo di riperfusione del trapianto, l'approccio strutturato descritto alla raccolta di liquidi e tessuti BAL fornisce anche un uso responsabile degli animali e un uso efficiente del tempo del microchirurgo massimizzando l'impatto dei dati raccolti per esperimento.
Divulgazioni
BAW, YGL e JLK sono supportati attraverso la sovvenzione R01HL143000 del National Institutes of Health (NIH). BAW è supportato attraverso la sovvenzione del Dipartimento della Difesa (DOD) W81XWH1810787. SMB è supportato tramite la sovvenzione NIH R01DK123475. JM è supportato attraverso le sovvenzioni NIH AR061385, AR070752, DK106394 e AG056919, nonché dalla sovvenzione DOD W81XWH-18-1-0787.
Riconoscimenti
Nessuno.
Materiali
| Name | Company | Catalog Number | Comments |
| 12 Gauge angio-catheter | BD | 382277 | |
| 14 Gauge angio-catheter | B. Braun | 4251717-02 | |
| 16 Gauge angio-catheter | B. Braun | 4252586-02 | |
| 18 Gauge angio-catheter | B. Braun | 4251679-02 | |
| 20 Gauge angio-catheter | B. Braun | 4252527-02 | |
| 4-0 silk suture | Surgical Specialties Corp. | SP116 | |
| 6-0 nylon suture | AD Surgical | S-N618R13 | |
| 7-0 nylon suture | AD Surgical | S-N718SP13 | |
| 8-0 nylon suture | AD Surgical | XXS-N807T6 | |
| Betadine Spray | Avrio Health L.P | UPC 367618160039 | |
| Clippers | VWR | MSPP-023326 | |
| Castroviejo micro dissecting spring scissors | Roboz Surgical Instrument Co | RS-5668 | |
| Dumont #5 - Fine Forceps | Fine Science Tools | 11254-20 | |
| Electrocautery | Macan | MV-7A | |
| Endotracheal intubation kit | Kent Scientific | ETI-MSE | |
| Forceps | Fine Science Tools | 11027-12 | |
| Halsted-mosquito hemostat | Roboz Surgical Instrument Co | RS-7112 | |
| Heparin | Fresnius Medical Care | C504701 | |
| Insulin syringe | Life Technologies | B328446 | |
| Isoflurane | Piramal Critical Care | NDC 66794-017-25 | |
| Isopropyl Alcohol Swabs | BD | 326895 | |
| Ketamine | Hikma Pharmaceuticals PLC | NDC 0413-9505-10 | |
| Dieffenbach Bulldog Clamp | World Precision Instruments | WPI14117 | |
| Needle holder/Forceps, Curved | Micrins | MI1542 | |
| Needle holder/Forceps, Straight | Micrins | MI1540 | |
| Perfadex Plus (Organ Preservation Solution) | XVIVO Perfusion AB | REF# 19950 | |
| PhysioSuite | Kent Scientific | PS-MSTAT-RT | Used to check SpO2 and heartbeat |
| Retractor | Roboz Surgical Instrument Co | RS-6560 | |
| Saline | PP Pharmaceuticals LLC | NDC 63323-186-10 | |
| Scissors | Fine Science Tools | 14090-11 | |
| SomnoSuite Small Animal Anesthesia System | Kent Scientific | SS-MVG-Module | |
| Sterile Cotton Gauze Pad | Fisherbrand | 22-415-469 | |
| Surgical Microscope | Leica | M500-N w/ OHS | |
| Syringe 5mL | BD | 309646 | |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15008-08 | |
| Xylazine | Korn Pharmaceuticals Corp | NDC 59399-110-20 | |
| Yasargil Clamp | Aesculap, Inc | FT351T | Used to clamp bronchus |
| Yasargil Clamp | Aesculap, Inc | FT261T | Used to clamp hilum |
| Yasargil Clamp Applicator | Aesculap, Inc | FT484T |
Riferimenti
- Mizuta, T., Kawaguchi, A., Nakahara, K., Kawashima, Y. Simplified rat lung transplantation using a cuff technique. Journal of Thoracic and Cardiovascular Surgery. 97 (4), 578-581 (1989).
- Zhai, W., et al. Simplified rat lung transplantation by using a modified cuff technique. Journal of Investigative Surgery. 21 (1), 33-37 (2008).
- Goto, T., et al. Simplified rat lung transplantation using a new cuff technique. Annals of Thoracic Surgery. 93 (6), 2078-2080 (2012).
- Guo, H., et al. Improvements of surgical techniques in a rat model of an orthotopic single lung transplant. European Journal of Medical Research. 18, 1(2013).
- Tian, D., Shiiya, H., Sato, M., Nakajima, J. Rat lung transplantation model: modifications of the cuff technique. Annals of Translational Medicine. 8 (6), 407(2020).
- Rajab, T. K. Anastomotic techniques for rat lung transplantation. World Journal of Transplantation. 8 (2), 38-43 (2018).
- Reis, A., Giaid, A., Serrick, C., Shennib, H. Improved outcome of rat lung transplantation with modification of the nonsuture external cuff technique. Journal of Heart and Lung Transplantation. 14 (2), 274-279 (1995).
- Sugimoto, R., et al. Experimental orthotopic lung transplantation model in rats with cold storage. Surgery Today. 39 (7), 641-645 (2009).
- Santana Rodriguez, N., et al. Technical modifications of the orthotopic lung transplantation model in rats with brain-dead donors. Archivos de Bronconeumología. 47 (10), 488-494 (2011).
- Gielis, J. F., et al. A murine model of lung ischemia and reperfusion injury: tricks of the trade. Journal of Surgical Research. 194 (2), 659-666 (2015).
- Rajab, T. K. Techniques for lung transplantation in the rat. Experimental Lung Research. 45 (9-10), 267-274 (2019).
- Iskender, I., et al. Effects of Warm Versus Cold Ischemic Donor Lung Preservation on the Underlying Mechanisms of Injuries During Ischemia and Reperfusion. Transplantation. 102 (5), 760-768 (2018).
- Lin, X., et al. Five-year update on the mouse model of orthotopic lung transplantation: Scientific uses, tricks of the trade, and tips for success. Journal of Thoracic Disease. 4 (3), 247-258 (2012).
- Song, J. A., et al. Standardization of bronchoalveolar lavage method based on suction frequency number and lavage fraction number using rats. Toxicological Research. 26 (3), 203-208 (2010).
- Chang, J. E., Kim, H. J., Yi, E., Jheon, S., Kim, K. Reduction of ischemia-reperfusion injury in a rat lung transplantation model by low-concentration GV1001. European Journal of Cardio-Thoracic Surgery. 50 (5), 972-979 (2016).
- De Backer, J. W., et al. Study of the variability in upper and lower airway morphology in Sprague-Dawley rats using modern micro-CT scan-based segmentation techniques. Anatomical Record. 292 (5), Hoboken. 720-727 (2009).
- Nelson, K., et al. Method of isolated ex vivo lung perfusion in a rat model: lessons learned from developing a rat EVLP program. Journal of Visualized Experiments. (96), e52309(2015).
- Suzuki, H., Fan, L., Wilkes, D. S. Development of obliterative bronchiolitis in a murine model of orthotopic lung transplantation. Journal of Visualized Experiments. (65), e3947(2012).
- Jia, Y., et al. Treatment of acute lung injury by targeting MG53-mediated cell membrane repair. Nature Communications. 5, 4387(2014).
- Kim, J. L., et al. Pegylated-Catalase Is Protective in Lung Ischemic Injury and Oxidative Stress. Annals of Thoracic Surgery. , (2020).
- Beal, E. W., et al. D-Ala(2), D-Leu(5)] Enkephalin Improves Liver Preservation During Normothermic Ex Vivo Perfusion. Journal of Surgical Research. 241 (2), 323-335 (2019).
- Akateh, C., et al. Intrahepatic Delivery of Pegylated Catalase Is Protective in a Rat Ischemia/Reperfusion Injury Model. Journal of Surgical Research. 238, 152-163 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon