Method Article
Un modelo de trasplante de pulmón de rata de lesión por isquemia/reperfusión caliente: optimizaciones para mejorar los resultados
En este artículo
Resumen
Aquí, presentamos optimizaciones para un modelo de trasplante de pulmón de rata que sirven para mejorar los resultados. Proporcionamos una guía de tamaño para los puños basada en el peso corporal, una estrategia de medición para determinar el4º espacio intercostal y métodos de cierre de heridas y recolección de líquido y tejido BAL (lavado broncoalveolar).
Resumen
A partir de nuestra experiencia con el trasplante de pulmón de rata, hemos encontrado varias áreas de mejora. La información en la literatura existente con respecto a los métodos para elegir los tamaños apropiados del manguito para la vena pulmonar (PV), la arteria pulmonar (AP) o el bronquio (Br) es variada, lo que hace que la determinación del tamaño adecuado del manguito durante el trasplante de pulmón de rata sea un ejercicio de prueba y error. Al estandarizar la técnica de manguito para usar el manguito efectivo más pequeño apropiado para el tamaño del vaso o bronquio, se puede hacer que el procedimiento de trasplante sea más seguro, más rápido y más exitoso. Dado que los diámetros de PV, PA y Br están relacionados con el peso corporal de la rata, presentamos una estrategia para elegir un tamaño apropiado utilizando una guía basada en el peso. Dado que el volumen pulmonar también está relacionado con el peso corporal, recomendamos que esta relación también se considere al elegir el volumen adecuado de aire para la inflación pulmonar del donante durante la isquemia caliente, así como para el volumen adecuado de PBS que se instilará durante la recolección de líquido del lavado broncoalveolar (BAL). También describimos métodos para la4ª disección del espacio intercostal, el cierre de la herida y la recolección de muestras de los lóbulos nativos y trasplantados.
Introducción
Durante más de tres décadas, los investigadores han estado modificando y mejorando los modelos de trasplante de pulmón de ratas para que los datos generados sean más consistentes y reflejen mejor la condición clínica real. En el tiempo que nuestro laboratorio realiza este modelo, hemos determinado cuatro áreas de mejora: técnicas de manguito para anastomosis, identificación del4º espacio intercostal del receptor, inflado pulmonar y cierre de la herida durante el procedimiento del receptor, y la recolección de muestras para su análisis.
Las modificaciones de la técnica de manguito para anastomosis pueden mejorar todo el procedimiento de trasplante al acortar el tiempo de manipulación del pulmón del donante 1,2,3,4,5,6 y hacer que el procedimiento de anastomosis sea más rápido y técnicamente más fácil para el microcirujano. Si bien es fundamental usar los manguitos del tamaño adecuado para suministrar la sangre y el flujo de aire necesarios al pulmón trasplantado, existe una orientación limitada con respecto a cómo se debe elegir el tamaño de los manguitos para la vena pulmonar (PV), la arteria pulmonar (PA) o el bronquio (Br)5,7,8,9. Dado que los diámetros de PV, PA y Br están relacionados con el peso corporal de las ratas donantes y receptoras, proponemos que el tamaño del manguito se base en el peso corporal. Este informe proporciona una guía de tamaño para los manguitos basada en el peso corporal de una rata (180 g a más de 270 g) que sirve para optimizar el suministro de sangre y aire al pulmón trasplantado (Tabla 1).
Si bien un microcirujano más nuevo puede obtener con éxito y facilidad un pulmón de un donante durante el procedimiento del donante, trasplantar el pulmón durante el procedimiento del receptor es más complicado y depende de la experiencia del microcirujano. Los intentos de encontrar el4º espacio intercostal para acceder al pulmón izquierdo del receptor es uno de los pasos más difíciles que contiene cierta subjetividad y puede aumentar el tiempo del procedimiento. Por lo tanto, introducimos un método simple y objetivo para ayudar en la identificación de la4ª ubicación del espacio intercostal mediante el uso de mediciones de tórax y las palpitaciones del corazón para encontrar el área correcta de la pared torácica para diseccionar 4,5,6,10,11,12.
También proponemos una mejora en la inflación pulmonar del donante, que es una fuente potencial de lesión en el órgano. El pulmón del donante se desinfla hasta que comienza la reperfusión. Al suturar el4º espacio intercostal, el pulmón del donante se infla comúnmente aumentando la PEEP de 2 cmH 2O a 6 cmH2O. Con el fin de minimizar la lesión pulmonar por sobreinflado, proponemos una técnica en la que se colocan tres suturas de nylon 6-0 alrededor de la4ª costilla inferior a la5ª costilla con nudos dobles simples. Cuando llega el momento del cierre de la herida, los extremos de las tres suturas se sostienen con hemostáticos en ambas manos, la herida se cierra de una vez tirando hacia arriba a cada lado y la PEEP se reduce inmediatamente a 2 cmH2O. De esta manera, se permite que el pulmón se expanda durante el menor tiempo posible10.
Al final de un experimento, el investigador a menudo quiere recolectar muchos tipos de muestras para muchos tipos de análisis de cada trasplante. Por ejemplo, el tejido congelado a presión, el tejido fijo de formalina, el tejido para la relación de peso húmedo a seco para determinar el edema pulmonar y el líquido de lavado broncoalvelolar (BAL) se pueden usar para evaluar qué tan bien fue el trasplante. El método tradicional de recolección de líquido BAL permite una muestra combinada mixta tanto de los lóbulos nativos del receptor como del lóbulo trasplantado del donante13,14,15. Para superar esto, presentamos un método de pinzamiento de las áreas hiliares que puede proporcionar una visión más precisa de la condición de los pulmones trasplantados y nativos. Además, es importante considerar el volumen de PBS utilizado para recolectar líquido BAL de cada lado de los pulmones porque el líquido BAL contiene numerosos factores solubles como citoquinas y quimiocinas que se miden por concentración. Normalizar el volumen del líquido instilado al volumen estimado de capacidad pulmonar puede ayudar con la comparación. Con cuatro lóbulos en el lado derecho y un lóbulo en el lado izquierdo, cada uno de los cinco lóbulos de la rata tiene un volumen y área de superficie diferente16. Según un estudio previo sobre la medición del volumen de los lóbulos pulmonares realizado por Backer et al., del volumen total de todo el pulmón el volumen de los lóbulos derechos es del 63% (4400 mm 3) y el lóbulo izquierdo es del 37% (2500 mm3). Por lo tanto, recomendamos que el volumen de PBS utilizado para recolectar líquido BAL se calcule como el doble del volumen corriente (7,2 ml / kg) multiplicado por 63% para el pulmón derecho y 37% para el pulmón izquierdo. Al usar este enfoque, se puede controlar mejor variables como el peso corporal y el tiempo10,16.
En total, en este informe demostraremos algunas modificaciones al modelo experimental estándar de trasplante de pulmón de rata que pueden hacer que el procedimiento sea más eficiente y aumentar la capacidad de generar datos más precisos y abundantes de cada experimento.
Protocolo
Las ratas Sprague-Dawley macho (180-270 g de peso corporal) se compraron comercialmente (por ejemplo, Envigo) y se alojaron en condiciones libres de patógenos en el Centro de Animales de la Universidad Estatal de Ohio. Todos los procedimientos se realizaron de manera humanitaria de acuerdo con el NIH y la Guía del Consejo Nacional de Investigación para el Cuidado y Uso Humanitario de Animales de Laboratorio y con la aprobación del Comité Institucional de Cuidado y Uso de Animales de la Universidad Estatal de Ohio (Protocolo IACUC # 2012A00000135-R2).
1. Configuración inicial
- Configure dispositivos quirúrgicos.
NOTA: Esta es una cirugía de no supervivencia. Si se va a realizar una cirugía de supervivencia, se deberán tomar medidas estériles y precauciones de barrera.- Encienda el equipo de monitoreo de frecuencia cardíaca / saturación de oxígeno y la tabla de calentamiento a 42 ° C.
- Encienda la máquina de ventilación y anestesia para precalentar el evaporador de isoflurano.
NOTA: Use un volumen corriente (Td) de 7.2 mL/kg, una presión espiratoria final positiva (PEEP) de 2cmH2O, y una frecuencia respiratoria de 80 lpm. - Llene la jeringa de anestesia con 10 ml de isoflurano líquido y monte la jeringa en la máquina de ventilación y anestesia.
- Encienda el microscopio quirúrgico con la altura y el enfoque ajustados a las preferencias del microcirujano.
- Encienda el dispositivo de electrocauterio.
- Prepare y coloque las herramientas quirúrgicas (Figura 1).
NOTA: Todas las herramientas quirúrgicas se esterilizaron en autoclave a 121 °C durante 30 min. - Recolectar y registrar el peso corporal de las ratas donantes y receptoras.
- Use la Tabla 1 y el peso corporal de la rata para determinar el calibre correcto del angiocatéter (20, 18, 16 14 o 12 G) para hacer manguitos.
- Prepare los manguitos para la arteria pulmonar (PA), el bronquio (Br) y la vena pulmonar (PV) utilizando la guía de tamaño basada en el peso corporal (Tabla 1 y Figura 2).
- Coloque un angiocatéter de tamaño 20 G, 18 G, 16 G, 14 G o 12 G (Figura 2A-E) sobre una superficie estéril bajo el microscopio quirúrgico.
- Luego use una cuchilla quirúrgica de costilla #11 (Figura 2F) para cortar el angiocatéter en un ángulo de 90 ° para formar un cuerpo de manguito de 2 mm de longitud con una pestaña de 1 mm X 1 mm (ancho x alto) en la parte superior del cuerpo del manguito (Figura 2G).
- Guarde los manguitos en solución salina estéril hasta que estén listos para usar.
- Preparar soluciones.
- Prepare una mezcla de ketamina y xilazina en un vial de inyección estéril agregando 1 ml de xilazina (100 mg/ml) a 10 ml de ketamina (100 mg/ml).
NOTA: La fecha de caducidad de este cóctel se determina utilizando la fecha de caducidad más temprana de los componentes utilizados. - Extraiga en jeringas la dosis adecuada para las ratas (0,1 ml de la mezcla de ketamina/xilazina por 100 g de peso corporal de la rata; por ejemplo, para una rata de 200 g, se administrarían 0,2 ml de mezcla de ketamina/xilazina).
NOTA: Esta dosis entregará 91 mg / kg de ketamina y 9.1 mg / kg de xilazina a la rata y debe mantener una rata sedada durante 60-80 min. - Preparar heparina que se administrará a una dosis de 1.000 U/kg.
- Almacene la solución salina, PBS y de conservación en hielo (Tabla de materiales).
- Prepare una mezcla de ketamina y xilazina en un vial de inyección estéril agregando 1 ml de xilazina (100 mg/ml) a 10 ml de ketamina (100 mg/ml).
2. Preparación de ratas donantes
- Inducir la anestesia en la rata donante inyectando intraperitonealmente la mezcla de ketamina y xilazina y esperando ~ 10 minutos para que se desarrolle un plano quirúrgico de anestesia que pueda evaluarse por falta de respuesta al pellizco del dedo del pie.
- Afeite el área de la incisión con cortapelos electrónicos.
- Coloque la rata donante en posición supina en la tabla de calentamiento quirúrgico y limpie el área de la incisión con una gasa estéril empapada con betadina. Luego limpie el área con un hisopo de alcohol isopropílico al 70%. Repita 3 veces.
- Haga una incisión de piel de 3 a 4 cm en la línea media del cuello con tijeras y diseccione cuidadosamente los tejidos y músculos subcutáneos con fórceps (en lugar de tijeras para evitar el sangrado).
- Para la intubación endotraqueal, enhebra una sutura de seda 4-0 alrededor de la tráquea e inserte un angiocatéter de 16 G en la tráquea. Ate la sutura alrededor de la tráquea firmemente con un nudo doble y luego termine con un solo nudo para mantener el angiocatéter en su lugar.
- Conecte el angiocatéter al ventilador y mantenga un plano quirúrgico de anestesia en la rata con 1-2% de isoflurano.
- Realizar una laparoesternotomía como una incisión combinada de línea media y transversal usando tijeras.
- Inyecte heparina (1.000 U/kg) con una jeringa de insulina a través de la vena cava inferior (VCI) y espere 10 minutos para la circulación sistémica.
NOTA: Esta administración de heparina previene los coágulos de sangre en el pulmón del donante. - Diseccionar el diafragma cuidadosamente cortando a lo largo del arco torácico y luego exponer la cavidad torácica siguiendo el esternón hasta el cuello.
3. Isquemia tibia pulmonar del donante y obtención
- Eutanasia a la rata donante cortando la IVC.
- Mientras los pulmones aún están ventilando, corte las aurículas derecha e izquierda con tijeras de resorte de micro disección y enjuague los pulmones por gravedad con 20 ml de solución de preservación en una jeringa que cuelgue a 28 cmH2O por gravedad conectada a un tubo y un angiocatéter de 18 G que se introduce directamente a través de la arteria pulmonar.
- Desconecte el ventilador del tubo endotraqueal y conéctelo a una jeringa de 5 ml llena con un volumen adecuado de aire basado en el peso corporal.
NOTA: El volumen de aire para inflar los pulmones se puede calcular como con el doble de volumen corriente (Td = 7.2 ml / kg), por ejemplo, una rata de 200 g tendría un Td de 1.44 ml y multiplicarlo por 2 equivaldría a 2.88 ml de aire necesario para inflar los pulmones. - Inflar los pulmones del donante.
- Coloque una pinza Yasargil en la tráquea para mantener los pulmones inflados, y cubra los pulmones y el corazón con una gasa de algodón estéril. Hidratar la gasa con solución salina, envolver a la rata donante con una almohadilla inferior y dejar en la tabla de cirugía de calentamiento durante 1 h para inducir isquemia caliente en los pulmones (Figura 3).
- Después de 1 h de isquemia tibia, extirpar el bloqueo corazón-pulmón con tijeras de resorte micro disecantes y fórceps y colocar en una gasa estéril humedecida con PBS helado en una placa de Petri estéril sobre hielo.
NOTA: Todos los siguientes pasos deben ocurrir mientras los pulmones están en la placa de Petri sobre hielo. - Incidir cuidadosamente los ligamentos pulmonares con tijeras de resorte de micro disección para separar el pulmón izquierdo del esófago y el lóbulo post-caval.
- Recorte cuidadosamente el área hiliar del pulmón izquierdo con una tijera de resorte Vannas-Tubingen y obtenga el PV, PA y Br izquierdos.
- Coloque los puños en PV, PA o Br (Figura 4A-C).
- Use un hemostático de mosquitos para agarrar la lengüeta del manguito.
- Use pinzas finas para agarrar el extremo distal de la PV, PA o Br a través del cuerpo apropiado del manguito, evert el tejido extra alrededor del manguito y asegurar usando 8-0 sutura de nylon. Use tijeras de resorte Vannas-Tubingen para recortar el tejido adicional y el manguito alrededor del cuerpo del manguito.
- Mantenga el pulmón del donante cubierto con gasa humedecida con solución salina en la placa de Petri sobre hielo hasta que esté listo para ser trasplantado a la rata receptora (Figura 4D).
NOTA: El tiempo promedio de isquemia fría es de 84 min ± 11 min S.D.
4. Preparación de la rata receptora
- Inducir la anestesia en la rata receptora de la misma manera que la rata donante inyectando intraperitonealmente la mezcla de ketamina y xilazina (0,1 ml por 100 g de rata) y esperando 10 minutos para que se desarrolle un plano quirúrgico de anestesia que pueda evaluarse por falta de respuesta al pellizco del dedo del pie.
- Afeite el área de la incisión con cortapelos electrónicos.
- Coloque la rata donante en posición supina y limpie el área de la incisión con una gasa estéril empapada con betadina. Luego limpie el área con un hisopo de alcohol isopropílico al 70%. Repita 3 veces.
- Antes de que la rata esté asegurada a la máquina de ventilación, dibuje líneas en el pecho de la rata en preparación para encontrar el4º espacio intercostal.
- Mida el tórax desde la muesca supraesternal hasta el proceso xifoide y dibuje una línea (Figura 5A).
- En el centro de esta línea, dibuje una línea a lo largo del lado izquierdo del tórax que mida la mitad de la medición desde la muesca supraesternal hasta el proceso xifoideo (Figuras 5A y B).
- Intubar al receptor utilizando un angiocatéter de 16 G mediante visualización utilizando el cable de fibra óptica conectado a una luz LED del kit de intubación endotraqueal.
- Conecte el angiocatéter al ventilador y mantenga un plano quirúrgico de anestesia con isoflurano al 1-2%.
- Para encontrar el4º espacio intercostal, encuentre el área de la pared torácica donde se puede sentir un fuerte impulso cardíaco palpable (Figura 5C, círculo rojo).
- En este lugar, incise la piel con tijeras y el músculo con tijeras de resorte de micro disección, y use el retractor para abrir el4º espacio intercostal lo más ampliamente posible (Figura 5D y E).
NOTA: Use cauterización eléctrica para evitar o detener el sangrado durante la disección muscular. - Una vez que el espacio intercostal se abre ampliamente, diseccione cuidadosamente los ligamentos alrededor del pulmón izquierdo del receptor con tijeras de resorte Vannas-Tubingen y saque el pulmón del área del pecho con hisopos de algodón estériles y fórceps.
- Coloque una gasa estéril alrededor del pulmón izquierdo y sosténgala con una pinza de bulldog Dieffenbach.
- Aplique una pinza Yasargil en el área hiliar del pulmón izquierdo lo más proximalmente posible.
5. Anastomosis
- Anastomosis de la vena pulmonar (PV)
- Coloque la sutura de nylon 7-0 alrededor del PV del receptor.
- Incise la PV del receptor con las tijeras de resorte Vannas-Tubingen cortando transversalmente las venas segmentarias superior e inferior lo más distalmente posible y enjuague la sangre con 0,2 ml de solución salina heparinizada (1 U/ml) con una jeringa de insulina.
- Coloque el pulmón del donante todavía envuelto con una gasa estéril húmeda helada en la cavidad torácica.
- Inserte el PV esposado del donante en el PV del receptor y luego asegúrelo con la sutura de nylon 7-0 preposicionada (Figura 6).
- Anastomosis bronquial (Br)
- Coloque la sutura de nylon 7-0 alrededor del Br. del receptor.
- Incise el Br del recipiente cortando las vías respiratorias segmentarias superiores e inferiores transversalmente lo más distalmente posible con tijeras de resorte Vannas-Tubingen.
- Inserte el Br esposado del donante en el Br del receptor y asegúrelo con la sutura de nylon 7-0 preposicionada (Figura 6).
- Anastomosis de la arteria pulmonar (PA):
- Coloque la sutura de nylon 7-0 alrededor del PA del receptor.
- Incise la AF del receptor de su vaina adventicia, incise la mitad de la circunferencia del vaso con tijeras de resorte Vannas-Tubingen y luego elimine la sangre en la PA con 0,2 ml de solución salina heparinizada (1 U/ml) con una jeringa de insulina.
- Inserte el PA esposado del donante en el PA del receptor y asegúrelo con la sutura de nylon 7-0 preposicionada (Figura 6).
6. Reperfusión
- Retire la pinza de Yasargil en el hilio para permitir la reperfusión y ventilación del pulmón del donante trasplantado (Figura 7).
- Diseccionar el pulmón izquierdo nativo del receptor usando tijeras de resorte y fórceps de micro disección.
- Reposicione cuidadosamente el pulmón izquierdo trasplantado en el tórax del receptor.
- Cierre la incisión de la toracotomía usando una sutura de nylon 6-0.
- Coloque tres suturas de nylon 6-0 con nudos dobles simples alrededor de las costillas superiores a la 4ª costilla e inferiores a la5ª costilla (Figura 8A).
- Use hemostáticos para juntar las tres suturas (Figura 8B).
- Aumentar la PEEP a 6cmH2Oen los ajustes de ventilación.
- Ate los tres nudos al mismo tiempo tirando hacia afuera para cerrar la herida (Figura 8C).
- Disminuya la PEEP a 2cmH2Oinmediatamente.
- Cierre la piel con sutura de nylon 6-0.
NOTA: Nuestro laboratorio estudia la fase aguda post-trasplante, por lo que la rata receptora en este modelo sobrevive durante 3 h post-trasplante bajo ventilación y anestesia y luego se recogen muestras.
7. Recolección de muestras experimentales (plasma, tejido pulmonar)
- Para las muestras de control, recoger los lóbulos derechos del donante después de iniciar el período de reperfusión de 3 h.
- Congele rápidamente el lóbulo superior y el lóbulo postcaval para análisis de expresión de proteínas o ARN, conserve el lóbulo medio para la histología y use el lóbulo inferior para la relación de peso húmedo a seco (Figura 9A).
- A los 10 minutos antes del final del tiempo de reperfusión de 3 horas, prepárese para recoger las muestras receptoras inyectando heparina (1.000 U/kg) con una jeringa de insulina en la vena yugular.
NOTA: Esta administración de heparina previene los coágulos de sangre en los pulmones y permite un lavado más completo en el momento de la obtención. - Recolección de plasma
- Al final del período de reperfusión de 3 h, recoger 1 ml de sangre con una jeringa a través de la VCI.
- Almacenar en hielo y luego centrifugar a 2.000 x g durante 10 minutos para cosechar plasma.
- Eutanasia a la rata receptora cortando la IVC para permitir la exanguinación.
- Diseccionar el diafragma a lo largo del arco torácico y exponer la cavidad torácica diseccionando la caja torácica.
- Recoja el líquido BAL de los pulmones nativos o trasplantados si lo desea (opcional).
NOTA: Si se realiza una relación de peso húmedo a seco o histología en el pulmón, no se debe realizar la recolección de líquido BAL, ya que puede afectar los resultados.- Enhebra la sutura de seda 4-0 alrededor de la tráquea y ate un nudo doble apretado alrededor de la tráquea y el tubo de intubación para evitar fugas de líquido.
- Calcule la cantidad de PBS helado para la acumulación de líquido BAL de los lóbulos derecho y lóbulo izquierdo.
NOTA: La relación de volumen para el pulmón derecho es del 63%, mientras que la relación de volumen para el pulmón izquierdo es del 37%16. Por lo tanto, para determinar la cantidad de PBS a inculcar en cada lado, el volumen debe calcularse como el doble del volumen corriente (Td = 7,2 ml / kg) multiplicado por 63% para el pulmón derecho y 37% para el pulmón izquierdo. - Coloque una pinza de Yasargil en el área hiliar del pulmón izquierdo (Figura 10A) y, con una jeringa conectada al angiocatéter, instilar la cantidad calculada de PBS helado en el pulmón derecho (lóbulos nativos del receptor) y recolecte el líquido BAL tirando suavemente del émbolo de la jeringa. Realizar dos veces.
NOTA: Uno debe esperar una recuperación del 70-80% del líquido instilado. - Retire la pinza Yasargil en el pulmón izquierdo y coloque la pinza en el área hiliar del pulmón derecho (Figura 10B).
- Recoja el líquido BAL del lóbulo izquierdo trasplantado de la misma manera que se recolectó para los lóbulos derechos, y luego retire la pinza en el área hiliar del pulmón derecho.
- Cortar las aurículas derecha e izquierda con tijeras de resorte de micro disección y enjuagar los pulmones por gravedad a través del PA utilizando un angiocatéter de 18 G conectado a un tubo y una jeringa con 20 ml de solución de preservación preenfriada colgando a 28 cmH2O.
- Recolectar muestras del pulmón del receptor.
- Congelar rápidamente el lóbulo superior y el lóbulo postcaval para análisis de expresión de proteínas o ARN, preservar el lóbulo medio para la histología y usar el lóbulo inferior para la relación de peso húmedo a seco) (Figura 9A).
- Divida el lóbulo izquierdo trasplantado izquierdo en tres partes: la región superior recolectada para la congelación instantánea, la región media para la histología y la región inferior para la relación de peso húmedo a seco (Figura 9B).
Resultados
Para medir el edema pulmonar, se calculó la relación peso húmedo a seco. El lóbulo nativo del donante, el lóbulo trasplantado y el lóbulo nativo del receptor se recolectaron como se describe en el protocolo y se pesaron inmediatamente para el peso húmedo, se secaron a 60 ° C durante 48 h y luego se pesaron nuevamente para el peso seco. Un aumento de la proporción de peso húmedo a seco sería indicativo de edema pulmonar. Nuestros resultados indican que el lóbulo trasplantado sí tuvo un aumento significativo en la relación peso húmedo-seco en comparación con el lóbulo nativo del donante o receptor (p=0,0050, n=6/grupo; Figura 11).
| Tamaño del angiocatéter para los manguitos | |||
| Peso corporal de la rata (g) | PAPÁ | Br | PV |
| 180-200 | 20 g | 18 g | 16 g |
| 200-230 | 18 g | 16 g | 14 g |
| 230-250 | 18 g | 14 g | 14 g |
| 250-270 | 18 g | 14 g | 12 - 14 g |
| Más de 270 | 16 g | 14 g | 12 g |
Tabla 1. Guía de tallas para puños. El tamaño de la arteria pulmonar (PA), el bronquio (Br) o la vena pulmonar (PV) está relacionado con el peso corporal. Dependiendo del peso corporal y del tipo de manguito que esté fabricando, se le da el tamaño recomendado del angiocatéter.

Figura 1. Herramientas quirúrgicas. (A) Tijeras finas, (B) fórceps, (C-E) pinzas microquirúrgicas, (F) pinzas finas Dumont #5, (G) tijeras de resorte Vannas-Tubingen y tijeras de micro disección Castroviejo, (H) hemostático de mosquito Halsted, (J) retractor, (K) pinzas Yasargil, (L) pinza de bulldog Dieffenbach, (M) hemostáticos curvos y (N) aplicador de abrazadera Yasargil. Todas las herramientas deben esterilizarse en autoclave a 121 °C durante 30 min. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Preparación del manguito con varios tamaños de angiocatéter y cuchilla quirúrgica de la espalda de costilla #11. El tamaño del angiocatéter elegido para el manguito está determinado por la guía de tamaño del manguito (Tabla 1) que tiene en cuenta el peso corporal de la rata y si el manguito es para la arteria pulmonar (PA), bronquio (Br) o vena pulmonar (PV). Los angiocatéteres (A) 20 G, (B) 18 G, (C) 16 G, (D) 14 G o (E) 12 G se cortan con una cuchilla quirúrgica (F) de costilla #11 como se describe en el protocolo, y se almacenan en solución salina hasta que sea necesario. (G) La longitud del cuerpo del manguito es de 2 mm y se deja una lengüeta de 1 mm X 1 mm (ancho x alto) en la parte superior del cuerpo del manguito para manipular el cuerpo del manguito. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Isquemia caliente. Los pulmones se lavan con la solución de preservación a través de la arteria pulmonar, se inflan con el doble del volumen corriente de aire, y luego se envuelven con una almohadilla inferior y se mantienen en la tabla de calentamiento de la cirugía para mantener a la rata a temperatura corporal normal durante 1 h. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Manguito de pulmón donante PV, PA y Br. (A) La vena pulmonar, PV (B) arteria pulmonar, PA, o (C) bronquio, Br, se inserta a través de un manguito de tamaño adecuado, everted, asegurado con 8-0 sutura de nylon, y (D) luego se almacena en una gasa estéril humedecida con solución salina helada en una placa de Petri estéril sobre hielo. Haga clic aquí para ver una versión más grande de esta figura.
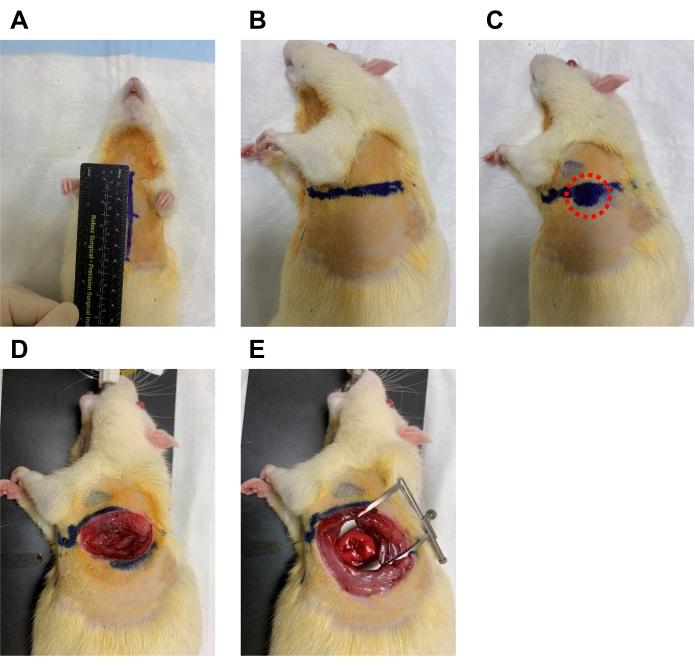
Figura 5. Medición y disección en el 4º espacio intercostal. (A) La rata receptora se coloca en decúbito supino, y el pecho se mide desde la muesca supraesternal hasta el proceso xifoideo y se dibuja una línea. (B) En el punto medio de esta línea, otra línea al lado izquierdo se dibuja a la mitad de la longitud. (C) A lo largo de esta línea, el microcirujano debe sentir un área donde el impulso cardíaco es más fuerte para asegurar la ubicación adecuada del4º espacio intercostal (círculo rojo). (D) La piel y el músculo se diseccionan con tijeras finas. (E) El retractor se utiliza entonces para abrir el espacio ampliamente. Haga clic aquí para ver una versión más grande de esta figura.
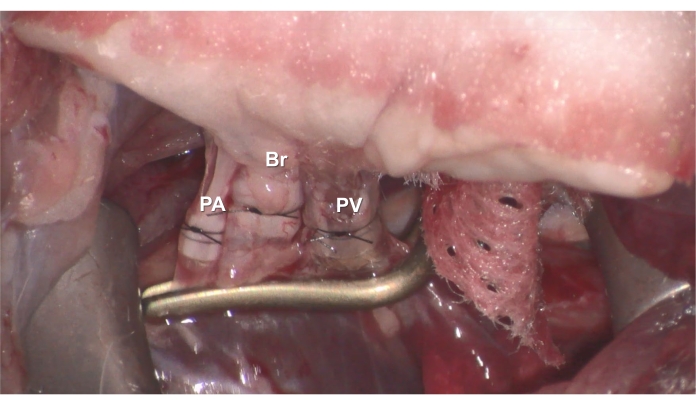
Figura 6. Anastomosis. El manguito (A) PV (B) Br o (C) PA del donante se inserta en el PV, Br o PA del receptor, y luego se asegura con una sutura de nylon 7-0. Haga clic aquí para ver una versión más grande de esta figura.
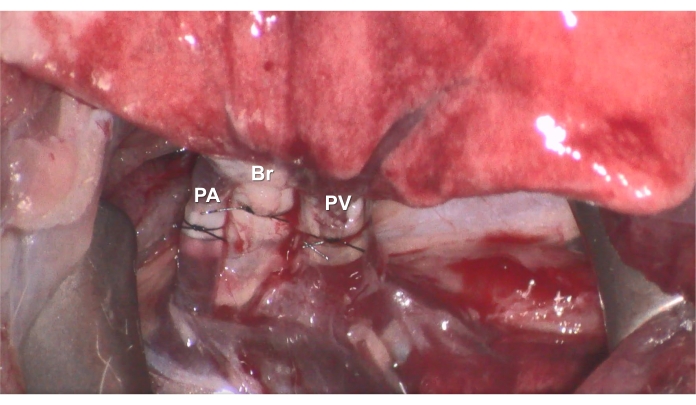
Figura 7. Reperfusión. Después de que se completen las anastomosis, la reperfusión se puede iniciar retirando la pinza, y la rata receptora sobrevive durante 3 h bajo ventilación y anestesia. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8. Cierre de heridas. (A) Tres suturas de nylon 6-0 con nudos dobles simples se colocan alrededor de las costillas superiores a la4ª costilla e inferiores a la5ª costilla. (B) Use hemostáticos en ambas manos para juntar las tres suturas y aumentar la PEEP a 6 cmH2O en los ajustes de ventilación. (C) Ate los tres nudos al mismo tiempo tirando hacia arriba y lejos para cerrar la herida, disminuya la PEEP a 2 cmH2O inmediatamente y cierre la piel con sutura de nylon 6-0. Haga clic aquí para ver una versión más grande de esta figura.
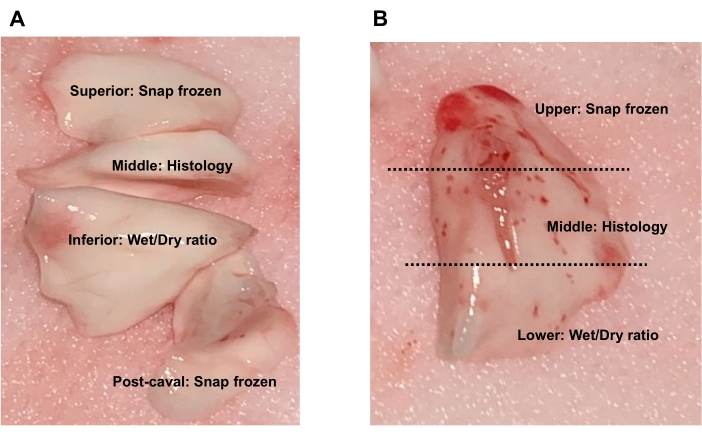
Figura 9. Recolección de tejido pulmonar. (A) Para los lóbulos nativos del donante o del receptor, el lóbulo superior y el lóbulo post-caval se pueden congelar a presión para análisis de expresión de proteínas o ARN, el lóbulo medio se puede preservar para la histología y el lóbulo inferior se puede usar para la proporción de peso húmedo a seco. (B) Para el lóbulo trasplantado, recoja la región superior para la congelación instantánea, la región media para la histología o la región inferior para la proporción de peso húmedo a seco. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10. Aplicación de la pinza para la recogida selectiva de fluido BAL. Para evitar una muestra agrupada, el líquido BAL se puede recolectar del pulmón derecho (nativo) o izquierdo (trasplantado). (A) El área hiliar del pulmón izquierdo se puede sujetar para recoger el líquido BAL de los lóbulos derechos. (B) El área hiliar del pulmón derecho se puede sujetar para recoger el líquido BAL del lóbulo izquierdo. Haga clic aquí para ver una versión más grande de esta figura.
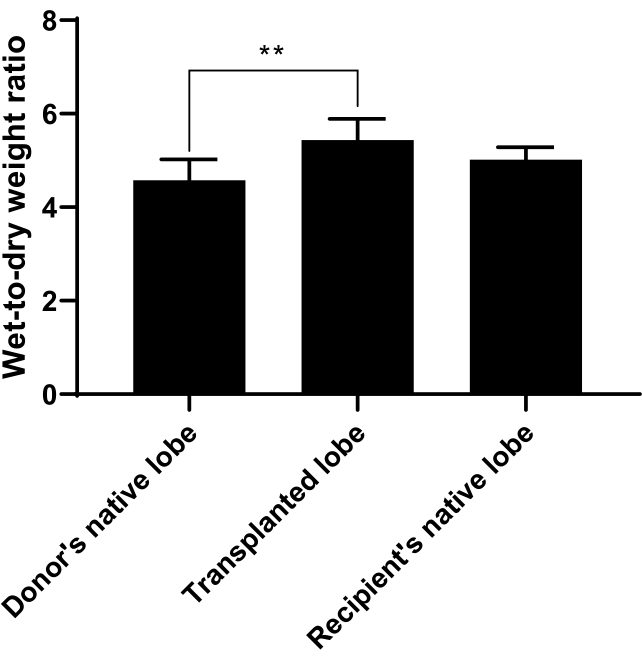
Figura 11. Relación peso húmedo a seco. La relación de peso húmedo a seco se calculó para medir el edema pulmonar y se puede utilizar para indicar qué tan bien fue el trasplante. El lóbulo nativo del donante, el lóbulo trasplantado o el lóbulo nativo del receptor se recolectó como se describe en el protocolo y se pesó inmediatamente para el peso húmedo, se secó a 60 ° C durante 48 h y luego se pesó nuevamente para el peso seco. Se tomó una relación entre peso húmedo y peso seco. La proporción para el lóbulo trasplantado aumentó significativamente en comparación con los lóbulos nativos del donante o receptor. n = 6 ratas/grupo y barras representan la media ± DE. El análisis estadístico se realizó utilizando ANOVA con el análisis post-hoc de Tukey. ** p<0.01. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este informe, hemos intervenido en varios pasos críticos en un protocolo de trasplante de pulmón de rata para optimizar el procedimiento. Si bien se han reportado varias técnicas de manguito para el trasplante de pulmón de rata 1,2,3,4,5,6,7,8,9,15, el proceso aún puede ser subjetivo y difícil de aplicar para los microcirujanos. Hemos enfatizado que se debe usar el tamaño adecuado de los manguitos para PV y PA para proporcionar sangre o Br para proporcionar aire al pulmón trasplantado, y hemos proporcionado una forma más objetiva de determinar el tamaño óptimo del manguito en función del peso corporal de la rata. Para inducir de manera más consistente la isquemia caliente de los pulmones, hemos dado recomendaciones de inflado pulmonar, pinzamiento y cómo mantener a la rata caliente durante el tiempo de isquemia caliente de 1 h. Durante el procedimiento del receptor, puede ser difícil localizar el4º espacio intercostal. Hemos recomendado que uno puede localizar con mayor precisión esta posición empleando un método de medición y sensación para el impulso cardíaco. En el momento de la reperfusión, para cerrar mejor la herida, también mostramos una técnica de manejo de suturas y ajuste de PEEP que puede cerrar más rápidamente la herida y prevenir el sobreinflado y la lesión del pulmón. Finalmente, hemos presentado estrategias para la recolección de tejidos y fluidos BAL que permiten una recolección más objetiva de muestras que se pueden comparar entre experimentos y diferentes pesos corporales.
La limitación más significativa de las técnicas descritas es la curva de aprendizaje bastante pronunciada de la operación de trasplante en general. La curva de aprendizaje es una que se puede reducir con una práctica quirúrgica consistente y a partir de la revisión de las técnicas de solución de problemas en la literatura. Otra limitación es que este modelo estudia la fase aguda de IRI y trasplante donde se producen cambios bioquímicos por primera vez, que es el foco de nuestro laboratorio. Los estudios futuros deben evaluar la permeabilidad bronquial y vascular en plazos más largos después del trasplante.
En general, un modelo viable de trasplante de animales pequeños es fundamental para evaluar las intervenciones terapéuticas para el trasplante y la lesión por isquemia-reperfusión (IRI). El modelo de trasplante pulmonar de rata, en particular, es útil como complemento para el estudio de la perfusión pulmonar ex vivo (EVLP) de animales pequeños17. También es una alternativa más viable al trasplante pulmonar murino, ya que el mayor tamaño anatómico permite al investigador obtener suficiente tejido para análisis másprofundos 18. Además, el modelo es esencial para determinar la viabilidad de los aloinjertos pulmonares del donante después de la intervención terapéutica con nuevas terapias de moléculas pequeñas y proteínas 19,20,21,22 ya sea para el donante, para el órgano donante a través de EVLP17, o para el receptor y proporciona una poderosa vía para recopilar datos in vivo. Las optimizaciones que describimos en este informe son importantes para los microcirujanos que tienen como objetivo disminuir su curva de aprendizaje y eliminar algo de subjetividad. Al utilizar un algoritmo estandarizado del tamaño del manguito pulmonar, el enfoque quirúrgico puede simplificarse y ser más objetivo. Al final del período de reperfusión del trasplante, el enfoque estructurado descrito para la recolección de líquido y tejido BAL también proporciona un uso responsable de los animales y un uso eficiente del tiempo del microcirujano al maximizar el impacto de los datos recopilados por experimento.
Divulgaciones
BAW, YGL y JLK reciben apoyo a través de la subvención R01HL143000 de los Institutos Nacionales de Salud (NIH). BAW es apoyado a través de la subvención W81XWH1810787 del Departamento de Defensa (DOD). SMB recibe apoyo a través de la subvención R01DK123475 de los NIH. JM cuenta con el apoyo de las subvenciones de los NIH AR061385, AR070752, DK106394 y AG056919, así como de la subvención W81XWH-18-1-0787 del Departamento de Defensa.
Agradecimientos
Ninguno.
Materiales
| Name | Company | Catalog Number | Comments |
| 12 Gauge angio-catheter | BD | 382277 | |
| 14 Gauge angio-catheter | B. Braun | 4251717-02 | |
| 16 Gauge angio-catheter | B. Braun | 4252586-02 | |
| 18 Gauge angio-catheter | B. Braun | 4251679-02 | |
| 20 Gauge angio-catheter | B. Braun | 4252527-02 | |
| 4-0 silk suture | Surgical Specialties Corp. | SP116 | |
| 6-0 nylon suture | AD Surgical | S-N618R13 | |
| 7-0 nylon suture | AD Surgical | S-N718SP13 | |
| 8-0 nylon suture | AD Surgical | XXS-N807T6 | |
| Betadine Spray | Avrio Health L.P | UPC 367618160039 | |
| Clippers | VWR | MSPP-023326 | |
| Castroviejo micro dissecting spring scissors | Roboz Surgical Instrument Co | RS-5668 | |
| Dumont #5 - Fine Forceps | Fine Science Tools | 11254-20 | |
| Electrocautery | Macan | MV-7A | |
| Endotracheal intubation kit | Kent Scientific | ETI-MSE | |
| Forceps | Fine Science Tools | 11027-12 | |
| Halsted-mosquito hemostat | Roboz Surgical Instrument Co | RS-7112 | |
| Heparin | Fresnius Medical Care | C504701 | |
| Insulin syringe | Life Technologies | B328446 | |
| Isoflurane | Piramal Critical Care | NDC 66794-017-25 | |
| Isopropyl Alcohol Swabs | BD | 326895 | |
| Ketamine | Hikma Pharmaceuticals PLC | NDC 0413-9505-10 | |
| Dieffenbach Bulldog Clamp | World Precision Instruments | WPI14117 | |
| Needle holder/Forceps, Curved | Micrins | MI1542 | |
| Needle holder/Forceps, Straight | Micrins | MI1540 | |
| Perfadex Plus (Organ Preservation Solution) | XVIVO Perfusion AB | REF# 19950 | |
| PhysioSuite | Kent Scientific | PS-MSTAT-RT | Used to check SpO2 and heartbeat |
| Retractor | Roboz Surgical Instrument Co | RS-6560 | |
| Saline | PP Pharmaceuticals LLC | NDC 63323-186-10 | |
| Scissors | Fine Science Tools | 14090-11 | |
| SomnoSuite Small Animal Anesthesia System | Kent Scientific | SS-MVG-Module | |
| Sterile Cotton Gauze Pad | Fisherbrand | 22-415-469 | |
| Surgical Microscope | Leica | M500-N w/ OHS | |
| Syringe 5mL | BD | 309646 | |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15008-08 | |
| Xylazine | Korn Pharmaceuticals Corp | NDC 59399-110-20 | |
| Yasargil Clamp | Aesculap, Inc | FT351T | Used to clamp bronchus |
| Yasargil Clamp | Aesculap, Inc | FT261T | Used to clamp hilum |
| Yasargil Clamp Applicator | Aesculap, Inc | FT484T |
Referencias
- Mizuta, T., Kawaguchi, A., Nakahara, K., Kawashima, Y. Simplified rat lung transplantation using a cuff technique. Journal of Thoracic and Cardiovascular Surgery. 97 (4), 578-581 (1989).
- Zhai, W., et al. Simplified rat lung transplantation by using a modified cuff technique. Journal of Investigative Surgery. 21 (1), 33-37 (2008).
- Goto, T., et al. Simplified rat lung transplantation using a new cuff technique. Annals of Thoracic Surgery. 93 (6), 2078-2080 (2012).
- Guo, H., et al. Improvements of surgical techniques in a rat model of an orthotopic single lung transplant. European Journal of Medical Research. 18, 1(2013).
- Tian, D., Shiiya, H., Sato, M., Nakajima, J. Rat lung transplantation model: modifications of the cuff technique. Annals of Translational Medicine. 8 (6), 407(2020).
- Rajab, T. K. Anastomotic techniques for rat lung transplantation. World Journal of Transplantation. 8 (2), 38-43 (2018).
- Reis, A., Giaid, A., Serrick, C., Shennib, H. Improved outcome of rat lung transplantation with modification of the nonsuture external cuff technique. Journal of Heart and Lung Transplantation. 14 (2), 274-279 (1995).
- Sugimoto, R., et al. Experimental orthotopic lung transplantation model in rats with cold storage. Surgery Today. 39 (7), 641-645 (2009).
- Santana Rodriguez, N., et al. Technical modifications of the orthotopic lung transplantation model in rats with brain-dead donors. Archivos de Bronconeumología. 47 (10), 488-494 (2011).
- Gielis, J. F., et al. A murine model of lung ischemia and reperfusion injury: tricks of the trade. Journal of Surgical Research. 194 (2), 659-666 (2015).
- Rajab, T. K. Techniques for lung transplantation in the rat. Experimental Lung Research. 45 (9-10), 267-274 (2019).
- Iskender, I., et al. Effects of Warm Versus Cold Ischemic Donor Lung Preservation on the Underlying Mechanisms of Injuries During Ischemia and Reperfusion. Transplantation. 102 (5), 760-768 (2018).
- Lin, X., et al. Five-year update on the mouse model of orthotopic lung transplantation: Scientific uses, tricks of the trade, and tips for success. Journal of Thoracic Disease. 4 (3), 247-258 (2012).
- Song, J. A., et al. Standardization of bronchoalveolar lavage method based on suction frequency number and lavage fraction number using rats. Toxicological Research. 26 (3), 203-208 (2010).
- Chang, J. E., Kim, H. J., Yi, E., Jheon, S., Kim, K. Reduction of ischemia-reperfusion injury in a rat lung transplantation model by low-concentration GV1001. European Journal of Cardio-Thoracic Surgery. 50 (5), 972-979 (2016).
- De Backer, J. W., et al. Study of the variability in upper and lower airway morphology in Sprague-Dawley rats using modern micro-CT scan-based segmentation techniques. Anatomical Record. 292 (5), Hoboken. 720-727 (2009).
- Nelson, K., et al. Method of isolated ex vivo lung perfusion in a rat model: lessons learned from developing a rat EVLP program. Journal of Visualized Experiments. (96), e52309(2015).
- Suzuki, H., Fan, L., Wilkes, D. S. Development of obliterative bronchiolitis in a murine model of orthotopic lung transplantation. Journal of Visualized Experiments. (65), e3947(2012).
- Jia, Y., et al. Treatment of acute lung injury by targeting MG53-mediated cell membrane repair. Nature Communications. 5, 4387(2014).
- Kim, J. L., et al. Pegylated-Catalase Is Protective in Lung Ischemic Injury and Oxidative Stress. Annals of Thoracic Surgery. , (2020).
- Beal, E. W., et al. D-Ala(2), D-Leu(5)] Enkephalin Improves Liver Preservation During Normothermic Ex Vivo Perfusion. Journal of Surgical Research. 241 (2), 323-335 (2019).
- Akateh, C., et al. Intrahepatic Delivery of Pegylated Catalase Is Protective in a Rat Ischemia/Reperfusion Injury Model. Journal of Surgical Research. 238, 152-163 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados