Method Article
Funzionalizzazione di compositi argento/biossido di titanio in rivestimenti a base di chitosano e loro prestazioni di conservazione delle uova
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Per migliorare la stabilità e la sterilizzabilità dei rivestimenti a base di chitosano ed espandere l'applicazione di nanoparticelle specifiche nella conservazione degli alimenti, i compositi Ag/TiO2 sono sintetizzati per funzionalizzare i rivestimenti di chitosano per la conservazione delle uova. La morfologia del guscio d'uovo, la perdita di peso, l'unità di Haugh e il pH dell'albume sono utilizzati per caratterizzare le prestazioni di conservazione dei rivestimenti.
Abstract
Le uova sono un'ottima fonte di proteine, minerali e vitamine, che sono state comunemente consumate nella dieta quotidiana in tutto il mondo. I micropori e le microfessure sui gusci delle uova, tuttavia, portano alla perdita di umidità e alla fuoriuscita di CO2, con conseguente accelerazione del deterioramento delle uova e perdita economica. Per migliorare la stabilità e la sterilizzabilità dei materiali di rivestimento esistenti a base di chitosano e per sviluppare nuovi nano-compositi multifunzionali per la conservazione antibatterica e delle uova, i compositi argento/biossido di titanio (Ag/TiO2) vengono sintetizzati e applicati per modificare il chitosano per prolungare la durata di conservazione dell'uovo. Le immagini al microscopio elettronico (SEM) vengono utilizzate per analizzare la struttura e la morfologia delle particelle composite e la morfologia dei gusci d'uovo rivestiti. Le prestazioni di conservazione dei rivestimenti compositi sono valutate in base a vari parametri: perdita di peso, unità di Haugh, pH dell'albume e morfologie del guscio d'uovo dei campioni. L'adozione di compositi Ag/TiO2 contribuisce a un effetto sinergico del chitosano, che potrebbe prolungare ulteriormente il periodo di conservazione. Le prestazioni del rivestimento in chitosano, tuttavia, sono attualmente limitate dalle specie e dalla concentrazione di particelle esistenti, il che richiede un'ottimizzazione in studi futuri. I metodi di questo studio esaminano nuovi materiali di rivestimento, che potrebbero essere creati aggiungendo nanoparticelle specifiche nel precursore di rivestimento, per ottenere gli effetti combinativi della nanoparticella e del precursore, nonché per preparare nuovi rivestimenti multifunzionali nel campo della conservazione degli alimenti.
Introduzione
Essendo fonti eccellenti e popolari di proteine, sale inorganico e vitamine, le uova sono fornitori popolari per l'alimentazione umana, che vengono prodotte e consumate in tutto il mondo su larga scala 1,2. Sebbene i gusci d'uovo siano barriere protettive naturali, sono troppo fragili per mantenere la loro integrità durante il trasporto e la conservazione delle uova. Lo scambio gassoso e la penetrazione microbica tra l'albume d'uovo e l'ambiente, che può avvenire facilmente attraverso minuscoli pori sui gusci d'uovo, porterebbero alla perdita di CO2 e al deterioramento della qualità degli ovuli 3,4. Inoltre, minuscole crepe sui gusci delle uova aumenterebbero il rischio di contaminazione microbica. Pertanto, è necessario sviluppare urgentemente metodi efficaci di conservazione degli ovuli a vantaggio economico e della salute umana.
Attualmente, ci sono due tipi di percorsi per la conservazione degli ovuli. Il primo modo è disattivare i microrganismi sui gusci d'uovo 5,6,7,8. Il processo di disattivazione prolunga il periodo di conservazione dell'uovo liberando la superficie del guscio dall'erosione dei microrganismi ambientali e dall'umidità. D'altra parte, rivestire i minuscoli pori e le crepe sul guscio d'uovo con materiali funzionali specifici potrebbe anche servire come metodo eccellente per prevenire la perdita di vapore acqueo e CO2 dall'albume d'uovo, nonché per proteggere il guscio d'uovo dalla distruzione dei microrganismi. Essendo semplici, efficaci e a risparmio energetico, i rivestimenti stanno attirando sempre più attenzione per la conservazione delle uova. I principi fondamentali che i materiali di rivestimento idonei dovrebbero soddisfare sono la stabilità chimica, l'efficace permeabilità, l'ampia disponibilità e la sicurezza affidabile. I materiali di rivestimento più studiati sono l'olio 9,10, le proteine11, i biopolimeri3 e il chitosano12.
Il chitosano è stato considerato un materiale di rivestimento popolare per le sue eccellenti proprietà di formazione del film, attività antibatterica e sicurezza13. È stato dimostrato che i cambiamenti fisico-chimici e la contaminazione microbica dell'uovo sono protetti da un rivestimento in chitosano, che è servito come un modo efficiente per la conservazione degli ovociti. Tuttavia, essendo un polimero idrofilo con scarsa barriera al vapore acqueo e assorbimento dell'umidità, il chitosano è instabile in un ambiente ad alta umidità, limitando gli effetti di conservazione e riducendo la durata di conservazione delle uova in una certa misura.
Per ovviare a questo problema e promuovere le prestazioni di conservazione del chitosano, sono state utilizzate specifiche nanoparticelle come adulterante nei rivestimenti a base di chitosano. Pertanto, come nano filler con carattere antibatterico14, il nano argento (Ag) è stato drogato in chitosano. L'aggiunta di Ag potrebbe non solo migliorare la proprietà barriera del film di chitosano, ma anche migliorare il suo effetto antibatterico, che ha dimostrato di migliorare l'effetto di conservazione del rivestimento. La facile aggregazione e la struttura semplice delle particelle di Ag, tuttavia, possono ridurre la stabilità e la durata del film di chitosano, che è stato verificato per essere migliorato depositando nanoparticelle specifiche. Il biossido di titanio (TiO2) è un tipico composto di ossidi metallici con eccellenti proprietà come stabilità chimica, bassa tossicità e costi ragionevoli. Queste proprietà funzionali conferiscono al TiO2 un grande potenziale in molti campi di ricerca15. Ad esempio, le particelle di TiO2 potrebbero fungere da additivi nei dispositivi medici e nei biomateriali grazie alla loro adesività e attività battericida. L'applicazione effettiva delle particelle di TiO2 , tuttavia, è in gran parte limitata dalla loro termodinamica instabile e dall'andamento degli agglomerati. Pertanto, è stato proposto di drogare materiali funzionali specifici in TiO2 per ottenere l'effetto combinativo di attività antibatterica, migliore disperdibilità e termostabilità.
In questo studio, i compositi antibatterici Ag/TiO2 vengono sintetizzati e applicati in un rivestimento di chitosano per la conservazione delle uova. Le immagini SEM vengono utilizzate per analizzare la struttura e la morfologia delle particelle di Ag/TiO2 e dei gusci d'uovo. Le prestazioni di conservazione del rivestimento vengono valutate e confrontate in base alla perdita di peso, all'unità di Haugh, al pH dell'albume e alle morfologie del guscio d'uovo. Questo studio dimostra la possibilità e il potenziale dei rivestimenti in chitosano miscelato nanocomposito nella conservazione degli alimenti.
Protocollo
1. Sintesi di compositi nano Ag/TiO2
- Per preparare il sol di nano-argento, combinare 100 mL di soluzione AgNO3 , 100 mL di agente protettivo e 50 mL di NaBH4 in un rompitore da 500 mL.
- Miscelare acido acetico e acido metanoico (grado analitico) con un rapporto in volume di 1:1 per ottenere 100 mL di soluzione acida complessa come precursore dell'agente protettivo. Diluire la soluzione acida con acqua deionizzata (18 MΩ•cm) a 500 mL come agente protettivo.
- Aggiungere la soluzione di AgNO3 (0,3 mol/L) nell'agente protettivo risultante agitando energicamente, fino a quando i soluti di AgNO3 non sono uniformemente dispersi nella soluzione protettiva. Aggiungere 0,4 g di NaBH4 per ottenere l'Agsol ben disperso dopo aver fatto reagire la miscela per 1 ora a temperatura ambiente.
ATTENZIONE: La dimensione delle particelle del nano-argento potrebbe essere regolata dalla concentrazione dell'agente protettivo e dalla velocità di agitazione nel passaggio 1.1.2.
- Combinare Ag in una soluzione di tetrabutil titanato (TBOT)-etanolo sotto agitazione e quindi aggiungere 80 mL di catalizzatore acido goccia a goccia.
- Combinare 500 μl di acido benzensolfonico (BA) e acido acetico glaciale (AA) per ottenere la soluzione miscelata (BA e AA al rapporto in volume di 1:2). Diluire la soluzione in 100 mL di acqua deionizzata (18 MΩ•cm) per preparare il catalizzatore acido.
- Aggiungere l'Ag sol risultante nella soluzione di tetrabutil titanato (TBOT)-etanolo pre-disperso (2,5 di TBOT in 100 mL di soluzione di etanolo) e agitare per 1 ora per ottenere il sol miscelato. Successivamente, aggiungere il sol goccia a goccia in 80 mL di catalizzatore acido e agitare per 4 ore a 70 °C.
- Mescolare continuamente la miscela per 48 ore a temperatura ambiente per produrre il composito finale Ag/TiO2 .
CATIONE: L'agitazione vigorosa può causare schizzi di gocce di soluzione. Utilizzare dispositivi di protezione per garantire la sicurezza, come una maschera protettiva oro-nasale, un camice da laboratorio e guanti. Non esiste uno standard rigoroso per la velocità di rotazione nelle procedure sopra menzionate.
2. Preparazione del rivestimento di chitosano
- Sciogliere il chitosano in acido acetico all'1% (vol) e agitare per 24 ore a 25 °C per preparare la soluzione di rivestimento (assicurarsi che la concentrazione di chitosano sia dello 0,5% (wt) nella soluzione risultante.
- Aggiungere separatamente particelle di Ag/TiO2 nella sospensione (0, 0,5, 1 e 1,5 g di Ag/TiO2 in 50 g di soluzione di chitosano, rispettivamente), per ottenere soluzioni di Ag/TiO 2-chitosano allo 0%, 1%, 2% e 3% (wt), denominate Ag/TiO2-CS0, Ag/TiO2-CS1, Ag/TiO2-CS2 e Ag/TiO2-CS3, rispettivamente.
ATTENZIONE: Non esiste uno standard rigoroso per la velocità di rotazione nelle procedure sopra menzionate.
3. Osservazione al microscopio elettronico a scansione (SEM)
- Tagliare il guscio d'uovo sperimentale a pezzi (dimensioni quadrate di circa 2-3 mm).
- Immobilizzare i pezzi di guscio d'uovo su un tronchetto di metallo con un adesivo conduttivo (ad esempio, nastro biadesivo conduttivo in carbonio o altri materiali simili). Utilizzare guanti durante la preparazione del campione per evitare qualsiasi contaminazione del campione da parte delle mani. Contrassegnare il campione (ad esempio, con un graffio a forma di L utilizzando un taglierino a penna diamantata).
- In alternativa, applicare un rivestimento sputtered con materiale conduttivo (~10 nm di spessore) per evitare effetti di carica.
- Acquisire almeno tre micrografie SEM ad alta risoluzione (idealmente, un minimo di cinque) da una vista dall'alto del campione. Assicurarsi che ogni immagine visualizzi un'area di almeno 25 μm x 25 μm, con un rapporto di risoluzione di 20 μm. Evitare di scattare immagini da regioni superficiali con difetti superficiali macroscopici.
- Utilizzare i seguenti parametri SEM: tensione di esercizio di 30 kV. La risoluzione della seconda immagine elettronica può raggiungere i 2 nm utilizzando un cannone elettronico a emissione di campo in un microscopio elettronico a scansione di alta qualità (la densità di corrente del fascio ionico è di circa 105 A/cm2).
- Annotare la posizione esatta di ogni immagine rispetto all'indicatore a forma di L.
4. Esperimenti di conservazione degli ovuli
NOTA: Le uova appena deposte sono uova di gallina fornite da una fattoria locale a Shenzhen, in Cina.
- Screening sperimentale delle uova escludendo le uova con crepe, macule o sabbie sulla loro superficie per garantire un processo sperimentale di conservazione delle uova propizio.
- Dividi le uova appena deposte in cinque gruppi con 30 uova in ogni gruppo. Progettare i quattro gruppi rivestiti, che sono rivestiti dal chitosano, Ag/TiO 2-chitosano drogato con 0%, 1%, 2% e 3% (peso) rispettivamente come Ag/TiO2-CS0, Ag/TiO2-CS1, Ag/TiO2-CS2 e Ag/TiO2-CS3.
- Eseguire il processo di rivestimento per immergere le uova in diverse soluzioni di rivestimento per 5 minuti e asciugarle in condizioni ambientali per 24 ore. Imposta le uova lavate con acqua (WE) come esperimento di controllo. Dopo i trattamenti sopra indicati, conservare gli ovuli trattati a 25 °C. Prendi le cinque uova contrassegnate per misurare la perdita di peso, l'unità di Haugh, il pH dell'albume e le morfologie del guscio d'uovo per valutare e confrontare le prestazioni di conservazione.
- Ottenere la perdita di peso (%) dell'uovo calcolando la differenza di peso in percentuale dell'uovo rispetto al primo giorno. Misurare il peso delle uova in ciascun gruppo ogni 5 giorni.
- Calcola l'unità di Haugh per mettere in relazione il peso dell'uovo con lo spessore dell'albume (Equazione 1)12.
HU = 100 log (H-1,7W0,37+7,6) (1)
dove H rappresenta l'altezza dell'albume (mm) e W rappresenta il peso dell'uovo (g).- In base al valore dell'unità di Haugh, classificare le uova al grado AA, A e B quando l'unità di Haugh di un uovo è superiore a 72, rispettivamente tra 71-60 e inferiore a 60 (gli standard degli Stati Uniti per la qualità delle singole uova in guscio).
- Separare l'albume dal tuorlo e utilizzare un pHmetro digitale per misurare i valori di pH dell'albume.
- Osservare le morfologie delle superfici dei gusci d'uovo utilizzando un microscopio elettronico a scansione dopo lo sputtering del platino dei campioni.
CATIONE: I gusci d'uovo sono sostanze fragili che non sopportano impatti violenti. Pertanto, fare attenzione a non danneggiare i gusci d'uovo. Inoltre, le procedure del passaggio 4.3.4 sono le stesse del passaggio 3.
Risultati
La dimensione delle particelle dei compositi Ag/TiO2 varia da 100 a 300 nm, che è influenzata dalle condizioni di sintesi (Figura 1).

Figura 1: Immagini SEM di particelle composite Ag/TiO2 con diversi rapporti di risoluzione (500 nm). Clicca qui per visualizzare una versione più grande di questa figura.
Le perdite di peso di diversi campioni di uova durante la conservazione sono mostrate nella Tabella 1. La perdita di peso in continuo aumento è dovuta alla fuoriuscita di albume CO2 e vapore acqueo attraverso i pori dei gusci d'uovo, che porta al deterioramento della qualità delle uova. Le perdite di peso delle uova WE sono molto più elevate rispetto ad altri gruppi, indicando la capacità protettiva dei rivestimenti a base di chitosano per la qualità delle uova. Dopo il rivestimento con chitosano, le crepe sul guscio d'uovo sono visibilmente diminuite, il che limita la perdita di CO2 e vapore acqueo.
| Tempo di conservazione (giorno) | Perdita di peso (in peso) | ||||
| NOI | Ag/TiO 2-CS0 | Ag/TiO 2-CS1 | Ag/TiO 2-CS2 | Ag/TiO 2-CS3 | |
| 6 | 0,78±0,09 C | 0,69±0,09 C | 0,53±0,12 A | 0,49±0,21a,b | 0,48±0,06A |
| 11 | 1,85±0,13b | 1,54±0,18 C | 1.34±0.15a | 1.28±0.13a,b | 1.26±0.21a |
| 16 | 2,53±0,21b | 2,34±0,27 C | 1,95±0,21b | 1,93±0,35 A | 1,89±0,38 A |
| 21 | 4.01±0.25c | 3,63±0,32b | 3,21±0,09b | 3.18±0.22a | 3.09±0.16a |
| 26 | 4,86±0,34b | 4,18±0,25b | 4,09±0,39b | 4.05±0.29A | 3.98±0.21a,b |
| 31 | 5.62±0.41a | 5,01±0,51b | 4,76±0,48 A | 4.69±0.17a | 4,58±0,35A |
| Nella stessa riga con diverse lettere sovrascritte sono significativamente diverse. | |||||
Tabella 1: La variazione della perdita di peso di uova diverse durante il periodo di conservazione.
Inoltre, i rivestimenti di chitosano drogati con particelle di Ag/TiO2 sono più efficaci nel sigillare i pori e formare strati densi, portando a una notevole inibizione della perdita di peso. Maggiore è il dosaggio delle particelle Ag/TiO2 , maggiore è l'effetto del rivestimento corrispondente per ridurre la perdita di CO2 e vapore (Figura 2).

Figura 2: Immagini SEM delle superfici dei gusci d'uovo grezzi e delle superfici dei gusci d'uovo trattati con chitosano ai giorni 0, 11, 16 e 31. (A) le superfici dei gusci d'uovo grezzi; (B) superfici di gusci d'uovo trattate con chitosano. Clicca qui per visualizzare una versione più grande di questa figura.
L'unità di Haugh è calcolata dai cambiamenti legati all'età delle proteine bianche, che riflettono la variazione di assottigliamento dell'albume, che è strettamente correlata alla proteolisi proteica e al pH dell'albumina. La diminuzione più rapida e i valori invariabilmente più bassi dell'unità Haugh nel gruppo WE rispetto ai gruppi di rivestimento del chitosano indicano l'efficace capacità protettiva del chitosano. Le uova nei gruppi trattati con chitosano mantengono il grado A superiore per 26 giorni, mentre il gruppo WE degrada al grado B dopo il giorno 6. I valori dell'unità di Haugh in Ag/TiO 2-CS1 sono sempre i più alti tra tutti i gruppi trattati, indicando che: (i) l'aggiunta di particelle di Ag/TiO2 contribuisce ad un effetto sinergico con il chitosano, che sono più efficaci per la stabilizzazione del rivestimento e il controllo batterico; mentre (ii) un eccesso di particelle di Ag/TiO2 distruggerebbe la struttura stratificata del rivestimento di chitosano, portando a una minore capacità di conservazione. Secondo i risultati della Tabella 2, il chitosano drogato con particelle di Ag/TiO2 all'1% (wt) mostra le migliori prestazioni nel rallentare il deterioramento delle proteine dell'albume, prolungando così la durata di conservazione fino a 30 giorni.
| Tempo di conservazione (giorno) | Unità Haugh | ||||
| NOI | Ag/TiO 2-CS0 | Ag/TiO 2-CS1 | Ag/TiO 2-CS2 | Ag/TiO 2-CS3 | |
| 6 | 73,23±0,68 C | 80,32±0,59b | 83.34±0.12a,b | 81.60±1.41a | 77.06±0.35a |
| 11 | 69.86±3.25c | 75.64±1.27b | 77.18±2.45a,b | 76.05±3.13a,b | 74.32±1.41a |
| 16 | 67.31±2.43b | 73.88±2.06b | 75.36±1.34a | 75.61±2.15a | 71.53±2.18a |
| 21 | 62.93±5.32c | 71.06±3.88c | 73.20±3.09a | 72.94±3.52a | 69.35±1.34a,b |
| 26 | 58,55±2,89b | 69.85±1.53c | 71.85±2.39A | 70.34±4.19a,b | 66.21±2.10a |
| 31 | 55.24±3.04a | 65,26±0,51a | 69.31±3.18a | 68.96±1.17a | 62.64±4.03a |
| Nella stessa riga con diverse lettere in apice sono significativamente diverse | |||||
Tabella 2: La variazione dell'unità di Haugh di uova diverse durante il periodo di conservazione.
La variazione del pH dell'albume è causata dall'evacuazione di CO2, che porta ad un lento aumento dei valori di pH con il tempo di conservazione. Il pH dell'albume delle uova di WE aumenta bruscamente entro 10 giorni e raggiunge fino a 9,5 al giorno 30. La degradazione delle proteine in grassi e peptoni porta ad una diminuzione del pH. Dopo essere stato protetto da un rivestimento di chitosano, il pH dell'albume presenta andamenti simili entro 20 giorni, che si stabilizzano intorno a pH 8,0-8,2. Dopo il giorno 20, i valori di pH di Ag/TiO 2-CS0 e Ag/TiO2-CS1 mostrano una leggera fluttuazione intorno a pH 8,2 e si stabilizzano tra pH 7,5-8,0 per Ag/TiO2-CS2 e Ag/TiO2-CS3. Il pH dell'albume relativamente stabile dei gruppi trattati rispetto al gruppo WE illustra l'efficace riduzione della perdita di CO2 nell'albume (Figura 3). L'aggiunta di particelle Ag/TiO2 favorisce la stabilità del chitosano, che potrebbe mantenere una buona stabilità fino a 31 giorni (Figura 4).
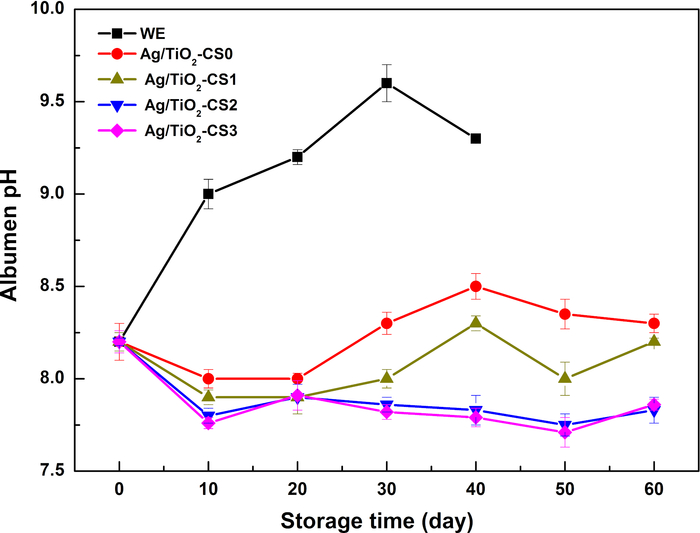
Figura 3: Variazioni del pH dell'albume di uova diverse durante il periodo di conservazione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Immagini SEM di superfici di gusci d'uovo rivestite di Ag/TiO2-CS ai giorni 0, 11, 16 e 31. a) Ag/TiO 2-CS1; b) Ag/TiO 2-CS2; (c) Ag/TiO 2-CS3. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
I problemi di conservazione della qualità delle proteine dell'uovo potrebbero essere alleviati dal rivestimento in chitosano, che si è dimostrato un modo efficace per prolungare la durata di conservazione dell'uovo. L'utilizzo di un solo rivestimento di chitosano, però, crea diversi problemi come l'instabilità, la limitazione del periodo di conservazione e l'effettiva applicazione di rivestimenti a base di chitosano. In particolare, è stato proposto di drogare specifiche nanoparticelle antibatteriche nel chitosano per prolungare ulteriormente la durata di conservazione. In questo studio, le particelle di Ag/TiO2 vengono sintetizzate con successo e drogate in un rivestimento di chitosano, che potrebbe prolungare il periodo di conservazione ad almeno 30 giorni.
Le immagini SEM vengono utilizzate per analizzare la struttura e la morfologia delle particelle Ag/TiO2 , nonché la morfologia dei gusci d'uovo rivestiti. Le prestazioni di conservazione dei rivestimenti compositi sono valutate in base alla perdita di peso, all'unità di Haugh, al pH dell'albume e alle morfologie del guscio d'uovo dei campioni. L'adozione di compositi Ag/TiO2 contribuisce a un effetto sinergico del chitosano, che potrebbe prolungare ulteriormente il periodo di conservazione.
Le dimensioni delle particelle dei compositi Ag/TiO2 sono comprese tra 100 e 300 nm (controllate dalla condizione di sintesi), il che potrebbe ostruire i pori sulla parte superiore del guscio d'uovo e migliorare le prestazioni di conservazione. Tuttavia, un eccesso di particelle di Ag/TiO2 distruggerebbe la struttura stratificata del rivestimento di chitosano, con conseguente minore capacità di conservazione.
Al momento, le prestazioni del rivestimento di chitosano in questo studio, tuttavia, sono limitate dalle specie e dalle concentrazioni di particelle esistenti, il che richiede un'ottimizzazione in studi futuri.
I metodi in questo studio dimostrano nuovi materiali di rivestimento, che potrebbero essere mescolati da specifiche nanoparticelle nel precursore del rivestimento, per ottenere effetti combinativi di nanoparticelle e precursore, nonché per preparare nuovi rivestimenti multifunzionali nel campo della conservazione degli alimenti.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal Guangxi Key Laboratory of New Energy and Building Energy Saving Foundation (n. 19-J-21-17, 19-J-21-30), dal Guangxi Universities Scientific Research Project (2020KY06029) e dal Wuhan University of Technology-Tibet University Joint Innovation Fund (LZJ2020003).
Materiali
| Name | Company | Catalog Number | Comments |
| acetate | Aladdin | 64-19-7 | GR, 99.8% |
| Benzenesulfonic acid | Aladdin | 03/11/1998 | 98% |
| Chitosan | Aladdin | 9012-76-4 | <200 mPa•s |
| Deionized water | prepared by ourselves | - | 18 MΩ•cm |
| Electronic precision balance | Sartorius | BSA124S-CW | |
| Ethanol | Aladdin | 64-17-5 | ≥99.8% |
| Formate | Aladdin | 64-18-6 | Standard for GC, >99% |
| pH meter | HeYi | PHS-25 | |
| Scanning electron microscope | Hiatchi | SU8010 | |
| Silver nitrate (AgNO3) | Aladdin | 7761-88-8 | ≥99.9% |
| Sodium borohydride (NaBH4 ) | Aladdin | 16940-66-2 | 98% |
| Temperature humidity chamber | YiHeng | LHS-50CH | |
| Titanium butoxide (TBOT) | Aladdin | 5593-70-4 | CP,98% |
Riferimenti
- Kuroli, S., Kanoo, T., Itoh, H., Ohkawa, Y. Nondestructive measurement of yolk viscosity in lightly heated chicken shelleggs. Journal of Food Engineering. 205, 18-24 (2017).
- Kostogrys, R. B., et al. Effect of dietary pomegranate seed oil on laying hen performance and physicochemical properties of eggs. Food Chemistry. 221, 1096-1103 (2017).
- Morsy, M. K., Sharoba, A. M., Khalaf, H. H., El-Tanahy, H. H., Cutter, C. N. Efficacy of antimicrobial pullulan-based coating to improve internal quality and shelf-life of chicken eggs during storage. Journal of Food Science. 80, 1066-1074 (2015).
- Damaziak, K., et al. Effect of dietary canthaxanthin and iodine on the production performance and egg quality of laying hens. Journal of Poultry Science. , (2018).
- Sert, D., Aygun, A., Demir, M. K. Effects of ultrasonic treatment and storage temperature on egg quality. Journal of Poultry Science. 90, 869-875 (2011).
- Yaceer, M., Aday, M. S., Caner, C. Ozone treatment of shell eggs to preserve functional quality and enhance shelf life during storage. Journal of the Science of Food and Agriculture. 96, 2755-2763 (2016).
- Viswanathan, K., Priyadharshini, M. L. M., Nirmala, K., Raman, M., Raj, G. D. Bactericidal paper trays doped with silver nanoparticles for egg storing applications. Bulletin of Materials Science. 39, 819-826 (2016).
- Aygun, A., Sert, D. Effects of vacuum packing on eggshell microbial activity and egg quality in table eggs under different storage temperatures. Journal of the Science of Food and Agriculture. 93, 1626-1632 (2013).
- Ryu, K. N., No, H. K., Prinyawiwatkul, W. Internal quality and shelf life of eggs coated with oils from different sources. Journal of Food Science. 76, 325-329 (2011).
- Figueiredo, T. C., et al. Effects of packaging, mineral oil coating, and storage time on biogenic amine levels and internal quality of eggs. Journal of Poultry Science. 93, 3171-3178 (2014).
- Caner, C., Ydceer, M. Efficacy of various protein-based coating on enhancing the shelf life of fresh eggs during storage. Journal of Poultry Science. 94, 1665-1677 (2015).
- Xu, D., Wang, J., Ren, D., Wu, X. Y. Effects of chitosan coating structure and changes during storage on their egg preservation performance. Coatings. 8, 317 (2018).
- Kopacic, S., Bauer, W., Walzl, A., Leitner, E., Zankel, A. Alginate and chitosan as a functional barrier for paper-based packaging materials. Coatings. 8, 235 (2018).
- Sagnelli, D., et al. Cross-linked amylose bio-plastic:A transgenic-based compostable plastic alternative. International Journal of Molecular Sciences. 18, 2075 (2017).
- Megan, T., Robert, C. P., Ivan, P. P., Clara, P. Nanostructured titanium dioxide coatings prepared by aerosol assisted chemical vapour deposition (AACVD). Journal of Phothchemistry and Photobiology A-Chemistry. 400, 112727 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon