Method Article
Fonctionnalisation des composites argent/dioxyde de titane dans les revêtements à base de chitosane et leurs performances de conservation des œufs
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Afin d’améliorer la stabilité et la stérilisabilité des revêtements à base de chitosane et d’étendre l’application de nanoparticules spécifiques dans la conservation des aliments, les composites Ag/TiO2 sont synthétisés pour fonctionnaliser les revêtements de chitosane pour la conservation des œufs. La morphologie de la coquille d’œuf, la perte de poids, l’unité de Haugh et le pH de l’albumen sont utilisés pour caractériser les performances de conservation des enrobages.
Résumé
Les œufs sont une excellente source de protéines, de minéraux et de vitamines, qui ont été couramment consommés dans l’alimentation quotidienne dans le monde entier. Cependant, les micropores et les microfissures sur les coquilles d’œufs entraînent une perte d’humidité et une fuite de CO2, ce qui accélère la détérioration des œufs et la perte économique. Afin d’améliorer la stabilité et la stérilisabilité des matériaux de revêtement à base de chitosane existants et de développer de nouveaux nanocomposites multifonctionnels pour l’antibactérien et la conservation des œufs, des composites argent/dioxyde de titane (Ag/TiO2) sont synthétisés et appliqués pour modifier le chitosane afin de prolonger la durée de conservation des œufs. Les images au microscope électronique (MEB) sont utilisées pour analyser la structure et la morphologie des particules composites ainsi que la morphologie des coquilles d’œufs enrobées. Les performances de conservation des revêtements composites sont évaluées par différents paramètres : perte de poids, unité de Haugh, pH de l’albumen et morphologies des coquilles d’œufs. L’adoption de composites Ag/TiO2 contribue à un effet synergique sur le chitosane, ce qui pourrait prolonger davantage la période de conservation. Les performances du revêtement de chitosane sont toutefois actuellement limitées par l’espèce et la concentration de particules existantes, ce qui nécessite une optimisation dans les études futures. Les méthodes de cette étude examinent de nouveaux matériaux de revêtement, qui pourraient être créés en ajoutant des nanoparticules spécifiques dans le précurseur de revêtement, afin d’obtenir les effets combinatoires de la nanoparticule et du précurseur, ainsi que de préparer de nouveaux revêtements multifonctionnels dans le domaine de la conservation des aliments.
Introduction
En tant qu’excellentes sources populaires de protéines, de sel inorganique et de vitamines, les œufs sont des fournisseurs populaires pour la nutrition humaine, qui sont produites et consommées dans le monde entier à grande échelle 1,2. Bien que les coquilles d’œufs soient des barrières protectrices naturelles, elles sont trop fragiles pour conserver leur intégrité pendant le transport et l’entreposage des œufs. L’échange gazeux et la pénétration microbienne entre le blanc d’œuf et l’environnement, qui peuvent se produire facilement à travers de minuscules pores sur les coquilles d’œufs, entraîneraient une perte de CO2 ainsi qu’une détérioration de la qualité des œufs 3,4. De plus, de minuscules fissures sur les coquilles des œufs augmenteraient le risque de contamination microbienne. Par conséquent, des méthodes efficaces de conservation des ovules doivent être développées de toute urgence pour des avantages économiques et la santé humaine.
À l’heure actuelle, il existe deux types de voies de conservation des œufs. La première consiste à désactiver les micro-organismes sur les coquilles d’œufs 5,6,7,8. Le processus de désactivation prolonge la période de conservation des œufs en dégageant la surface de la coquille de l’œuf à l’abri de l’érosion des micro-organismes environnementaux et de l’humidité. D’autre part, le revêtement des minuscules pores et fissures de la coquille d’œuf avec des matériaux fonctionnels spécifiques pourrait également constituer une excellente méthode pour prévenir la perte de vapeur d’eau et de CO2 du blanc d’œuf, ainsi que pour protéger la coquille de l’œuf de la destruction par les micro-organismes. Parce qu’ils sont simples, efficaces et économes en énergie, les revêtements attirent de plus en plus l’attention pour la conservation des œufs. Les principaux principes auxquels doivent répondre les matériaux de revêtement appropriés sont la stabilité chimique, la perméabilité efficace, la grande disponibilité et la sécurité fiable. Les matériaux de revêtement les plus étudiés sont l’huile 9,10, les protéines11, les biopolymères3 et le chitosane12.
Le chitosane a été considéré comme un matériau de revêtement populaire en raison de ses excellentes propriétés de formation de film, d’activité antibactérienne et de sécurité13. Il a été prouvé que les changements physicochimiques de l’œuf et la contamination microbienne sont protégés par un enrobage de chitosane, qui a servi de moyen efficace pour la conservation des œufs. Cependant, en tant que polymère hydrophile avec une mauvaise barrière à la vapeur d’eau et une mauvaise adsorption de l’humidité, le chitosane est instable dans un environnement très humide, ce qui limite les effets de conservation et réduit la durée de conservation des œufs dans une certaine mesure.
Pour surmonter ce problème et promouvoir les performances de conservation du chitosane, des nanoparticules spécifiques ont été utilisées comme adultérant dans les revêtements à base de chitosane. Ainsi, en tant que nano-charge à caractère antibactérien14, le nano-argent (Ag) a été dopé au chitosane. L’ajout d’Ag pourrait non seulement améliorer la propriété barrière du film de chitosane, mais également renforcer son effet antibactérien, dont il a été prouvé qu’il améliore l’effet de préservation du revêtement. Cependant, l’agrégation facile et la structure simple des particules d’Ag peuvent diminuer la stabilité et la durabilité du film de chitosane, dont il a été vérifié qu’elles étaient améliorées par le dépôt de nanoparticules spécifiques. Le dioxyde de titane (TiO2) est un composé d’oxyde métallique typique avec d’excellentes propriétés telles que la stabilité chimique, une faible toxicité ainsi que des coûts raisonnables. Ces propriétés fonctionnelles confèrent au TiO2 un grand potentiel dans de nombreux domaines de recherche15. Par exemple, les particules de TiO2 pourraient servir d’additifs dans les dispositifs médicaux et les biomatériaux en raison de leur adhérence et de leurs activités bactéricides. L’application réelle des particules de TiO2 , cependant, est largement limitée par leur thermodynamique instable et leurs tendances d’agglomérat. Par conséquent, le dopage de matériaux fonctionnels spécifiques dans le TiO2 a été proposé pour obtenir l’effet combiné de l’activité antibactérienne, de l’amélioration de la dispersibilité et de la thermostabilité.
Dans cette étude, des composites antibactériens Ag/TiO2 sont synthétisés et appliqués dans un revêtement de chitosane pour la conservation des œufs. Les images MEB sont utilisées pour analyser la structure et la morphologie des particules d’Ag/TiO2 et des coquilles d’œufs. Les performances de conservation de l’enrobage sont évaluées et comparées en fonction de la perte de poids, de l’unité de Haugh, du pH de l’albumen et de la morphologie de la coquille de l’œuf. Cette étude démontre la possibilité et le potentiel des enrobages de chitosane mélangés à des nanocomposites dans la conservation des aliments.
Protocole
1. Synthèse de composites nano Ag/TiO2
- Pour préparer le sol nano-argentique, combinez 100 mL de solution d’AgNO3 , 100 mL d’agent protecteur et 50 mL de NaBH4 dans un brise-roche de 500 mL.
- Mélanger l’acide acétique et l’acide méthanoïque (qualité analytique) dans un rapport volumique de 1:1 pour obtenir 100 mL de solution acide complexe comme précurseur de l’agent protecteur. Diluer la solution acide avec de l’eau déminéralisée (18 MΩ•cm) à 500 mL comme agent protecteur.
- Ajouter la solution d’AgNO3 (0,3 mol/L) dans l’agent protecteur résultant en agitant vigoureusement, jusqu’à ce que les solutés d’AgNO3 soient uniformément dispersés dans la solution protectrice. Ajouter 0,4 g de NaBH4 pour obtenir l’Ag sol bien dispersé après avoir fait réagir le mélange pendant 1 h à température ambiante.
ATTENTION : La taille des particules de nano-argent peut être ajustée en fonction de la concentration de l’agent protecteur et de la vitesse d’agitation à l’étape 1.1.2.
- Mélanger l’Ag dans une solution de titanate de tétrabutyle (TBOT)-éthanol en agitant, puis ajouter 80 ml de catalyseur acide goutte à goutte.
- Combiner 500 μL d’acide benzènesulfonique (BA) et d’acide acétique glacial (AA) pour obtenir la solution mélangée (BA et AA au rapport volumique de 1:2). Diluer la solution dans 100 mL d’eau désionisée (18 MΩ•cm) pour préparer le catalyseur acide.
- Ajouter l’Ag sol résultant dans la solution de titanate de tétrabutyle prédispersé (TBOT)-éthanol (2,5 de TBOT dans une solution d’éthanol de 100 ml) et agiter pendant 1 h pour obtenir le sol mélangé. Ensuite, ajoutez le sol goutte à goutte dans 80 mL de catalyseur acide et remuez pendant 4 h à 70 °C.
- Mélangez continuellement pendant 48 h à température ambiante pour obtenir le composite Ag/TiO 2 final.
CATION : Un brassage vigoureux peut provoquer des éclaboussures de gouttes de solution. Utilisez des dispositifs de protection pour assurer la sécurité, tels qu’un masque de protection bucco-nasal, une blouse de laboratoire et des gants. Il n’existe pas de norme stricte pour la vitesse de rotation dans les procédures mentionnées ci-dessus.
2. Préparation de l’enrobage de chitosane
- Dissoudre le chitosane dans de l’acide acétique à 1 % (vol) et agiter pendant 24 h à 25 °C pour préparer la solution d’enrobage (s’assurer que la concentration de chitosane est de 0,5 % (en poids) dans la solution résultante.
- Ajouter séparément des particules d’Ag/TiO2 dans la suspension (0, 0,5, 1 et 1,5 g d’Ag/TiO2 dans 50 g de solution de chitosane), pour obtenir des solutions Ag/TiO2-chitosane de 0 %, 1 %, 2 % et 3 % (en poids), désignées Ag/TiO 2-CS0, Ag/TiO 2-CS1, Ag/TiO2-CS2 et Ag/TiO2-CS3, respectivement.
ATTENTION : Il n’y a pas de norme stricte pour la vitesse de rotation dans les procédures mentionnées ci-dessus.
3. Observation par microscopie électronique à balayage (MEB)
- Coupez la coquille d’œuf expérimentale en morceaux (dimensions carrées d’environ 2-3 mm).
- Immobilisez les morceaux de coquille d’œuf sur un bout de métal à l’aide d’un adhésif conducteur (c.-à-d. du ruban conducteur de carbone double face ou d’autres matériaux similaires). Utilisez des gants pendant la préparation de l’échantillon pour éviter toute contamination de l’échantillon par les mains. Marquez l’échantillon (par exemple, avec une rayure en forme de L à l’aide d’un coupe-stylo diamanté).
- Vous pouvez également appliquer un revêtement pulvérisé avec un matériau conducteur (~10 nm d’épaisseur) pour éviter les effets de charge.
- Acquérez au moins trois micrographies MEB haute résolution (idéalement, un minimum de cinq) à partir d’une vue de dessus de l’échantillon. Assurez-vous que chaque image affiche une zone d’au moins 25 μm x 25 μm, avec un rapport de résolution de 20 μm. Évitez de prendre des images à partir de régions de surface présentant des défauts de surface macroscopiques.
- Utilisez les paramètres SEM suivants : tension de fonctionnement de 30 kV. La résolution de la deuxième image électronique peut atteindre 2 nm en utilisant un canon à électrons à émission de champ dans un microscope électronique à balayage de haute qualité (la densité de courant du faisceau d’ions est d’environ 105 A/cm2).
- Notez la position exacte de chaque image par rapport au marqueur en forme de L.
4. Expériences de conservation des ovules
REMARQUE : Les œufs fraîchement pondus sont des œufs de poule fournis par une ferme locale à Shenzhen, en Chine.
- Criblez les œufs expérimentaux en excluant les œufs présentant des fissures, des macula ou des sables à leur surface afin d’assurer un processus expérimental propice à la conservation des œufs.
- Divisez les œufs fraîchement pondus en cinq groupes de 30 œufs dans chaque groupe. Concevoir les quatre groupes enrobés, qui sont enrobés par le chitosane, Ag/TiO 2-chitosane dopé à 0 %, 1 %, 2 % et 3 % (poids) comme Ag/TiO2-CS0, Ag/TiO2-CS1, Ag/TiO2-CS2 et Ag/TiO2-CS3, respectivement.
- Effectuer le processus d’enrobage pour immerger les œufs dans différentes solutions d’enrobage pendant 5 min et les sécher à température ambiante pendant 24 h. Réglez les œufs lavés à l’eau (WE) comme expérience de contrôle. Après les traitements mentionnés ci-dessus, conservez les ovules traités à 25 °C. Prenez les cinq œufs marqués pour mesurer la perte de poids, l’unité de Haugh, le pH de l’albumen et la morphologie des coquilles d’œufs afin d’évaluer et de comparer les performances de conservation.
- Obtenez la perte de poids ( %) de l’œuf en calculant la différence de poids en pourcentage de l’œuf par rapport au premier jour. Mesurez le poids des œufs dans chaque groupe tous les 5 jours.
- Calculez l’unité de Haugh pour relier le poids de l’œuf à l’épaisseur de l’albumen (équation 1)12.
HU = 100 log (H-1,7W0,37+7,6) (1)
où H représente la hauteur de l’albumen (mm) et W représente le poids de l’œuf (g).- Selon la valeur de l’unité Haugh, classez les œufs dans les catégories AA, A et B lorsque l’unité Haugh d’un œuf est supérieure à 72, entre 71 et 60 et inférieure à 60, respectivement (les normes des États-Unis pour la qualité des œufs en coquille individuelle).
- Séparez l’albumen du jaune et utilisez un pH-mètre numérique pour mesurer les valeurs de pH de l’albumen.
- Observez les morphologies des surfaces des coquilles d’œufs à l’aide d’un microscope électronique à balayage après pulvérisation du platine des échantillons.
CATION : Les coquilles d’œufs sont des substances cassantes qui ne supportent pas les chocs violents. Par conséquent, veillez à ne pas endommager les coquilles d’œufs. De plus, les procédures de l’étape 4.3.4 sont les mêmes que celles de l’étape 3.
Résultats
La taille des particules des composites Ag/TiO2 varie de 100 à 300 nm, ce qui est affecté par les conditions de synthèse (Figure 1).

Figure 1 : Images MEB de particules composites Ag/TiO2 à différents rapports de résolution (500 nm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le tableau 1 montre les pertes de poids de différents échantillons d’œufs pendant l’entreposage. L’augmentation continue de la perte de poids est due à la fuite d’albumine CO2 et de vapeur d’eau à travers les pores des coquilles d’œufs, ce qui entraîne une détérioration de la qualité des œufs. Les pertes de poids des œufs WE sont beaucoup plus élevées que pour les autres groupes, ce qui indique la capacité protectrice des enrobages à base de chitosane pour la qualité des œufs. Après enrobage par chitosane, les fissures sur la coquille de l’œuf sont visiblement diminuées, ce qui limite la perte de CO2 et de vapeur d’eau.
| Temps de stockage (jour) | Perte de poids ( % en poids) | ||||
| NOUS | Ag/TiO 2-CS0 | Ag/TiO 2-CS1 | Ag/TiO 2-CS2 | Ag/TiO 2-CS3 | |
| 6 | 0,78±0,09c | 0,69±0,09c | 0,53±0,12a | 0,49±0,21a,b | 0,48±0,06A |
| 11 | 1,85±0,13b | 1.54±0.18c | 1.34±0.15a | 1.28±0.13a,b | 1.26±0.21a |
| 16 | 2.53±0.21b | 2.34±0.27c | 1,95±0,21b | 1.93±0.35a | 1.89±0.38a |
| 21 | 4.01±0.25c | 3.63±0.32b | 3.21±0.09b | 3.18±0.22a | 3.09±0.16a |
| 26 | 4.86±0.34b | 4.18±0.25b | 4.09±0.39b | 4.05±0.29a | 3,98±0,21a,b |
| 31 | 5.62±0.41a | 5.01±0.51b | 4.76±0.48a | 4.69±0.17a | 4.58±0.35a |
| Dans la même rangée avec différentes lettres super-imprimées sont significativement différentes. | |||||
Tableau 1 : La variation de la perte de poids des différents œufs pendant le temps de stockage.
De plus, les revêtements de chitosane dopés avec des particules d’Ag/TiO2 sont plus efficaces pour sceller les pores et former des couches denses, ce qui entraîne une perte de poids considérablement inhibée. Plus le dosage des particules Ag/TiO2 est important, plus l’effet du revêtement correspondant pour réduire les pertes de CO2 et de vapeur est fort (Figure 2).

Figure 2 : Images MEB des surfaces de coquilles d’œufs crues et des surfaces de coquilles d’œufs traitées au chitosane aux jours 0, 11, 16 et 31. (A) les surfaces de la coquille d’œuf crue ; (B) surfaces de coquille d’œuf traitées au chitosane. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’unité de Haugh est calculée par les changements liés à l’âge des protéines blanches, reflétant la variation de l’amincissement de l’albumine, qui est étroitement liée à la protéolyse des protéines et au pH de l’albumine. La diminution plus rapide et les valeurs invariablement plus faibles de l’unité Haugh dans le groupe WE que dans les groupes d’enrobage de chitosane indiquent la capacité protectrice efficace du chitosane. Les œufs des groupes traités au chitosane conservent la classe supérieure A pendant 26 jours, tandis que le groupe WE se dégrade en catégorie B après le 6e jour. Les valeurs de l’unité Haugh dans Ag/TiO 2-CS1 sont toujours les plus élevées parmi tous les groupes traités, indiquant que : (i) l’ajout de particules Ag/TiO2 contribue à un effet synergique avec le chitosane, qui sont plus efficaces pour la stabilisation du revêtement et le contrôle bactérien ; tandis que (ii) l’excès de particules Ag/TiO2 détruirait la structure en couches de l’enrobage de chitosane, entraînant une capacité de conservation plus faible. Selon les résultats du tableau 2, le chitosane dopé avec des particules Ag/TiO 2 à 1 % (en poids) présente les meilleures performances pour ralentir la détérioration des protéines albumineuses, prolongeant ainsi la durée de conservation jusqu’à 30 jours.
| Temps de stockage (jour) | Unité Haugh | ||||
| NOUS | Ag/TiO 2-CS0 | Ag/TiO 2-CS1 | Ag/TiO 2-CS2 | Ag/TiO 2-CS3 | |
| 6 | 73.23±0.68c | 80.32±0.59b | 83.34±0.12a,b | 81.60±1.41a | 77.06±0.35a |
| 11 | 69.86±3.25c | 75.64±1.27b | 77.18±2.45a,b | 76.05±3.13a,b | 74.32±1.41a |
| 16 | 67.31±2.43b | 73.88±2.06B | 75.36±1.34a | 75.61±2.15a | 71.53±2.18a |
| 21 | 62.93±5.32c | 71.06±3.88c | 73.20±3.09a | 72.94±3.52a | 69.35±1.34a,b |
| 26 | 58.55±2.89b | 69,85±1,53C | 71.85±2.39a | 70.34±4.19a,b | 66.21±2.10a |
| 31 | 55.24±3.04a | 65.26±0.51a | 69.31±3.18a | 68.96±1.17a | 62.64±4.03a |
| Dans la même rangée avec des lettres en exposant différentes, elles sont significativement différentes | |||||
Tableau 2 : La variation de l’unité Haugh des différents œufs pendant le temps de stockage.
La variation du pH de l’albumen est causée par l’évacuation du CO2, entraînant une lente augmentation des valeurs de pH avec le temps de stockage. Le pH albuminé des œufs WE augmente fortement en 10 jours et atteint jusqu’à 9,5 au jour 30. La dégradation des protéines en graisse et en peptone entraîne une diminution du pH. Après avoir été protégé par un enrobage de chitosane, le pH de l’albumen présente des tendances similaires dans les 20 jours, qui se stabilisent autour de pH 8,0-8,2. Après le 20e jour, les valeurs de pH de Ag/TiO 2-CS0 et Ag/TiO2-CS1 montrent une légère fluctuation autour de pH 8,2 et se stabilisent entre pH 7,5-8,0 pour Ag/TiO2-CS2 et Ag/TiO2-CS3. Le pH relativement stable de l’albumen des groupes traités par rapport au groupe WE illustre la réduction efficace de la perte de CO2 dans l’albumen (Figure 3). L’ajout de la particule Ag/TiO2 favorise la stabilité du chitosane, qui pourrait maintenir une bonne stabilité jusqu’à 31 jours (Figure 4).
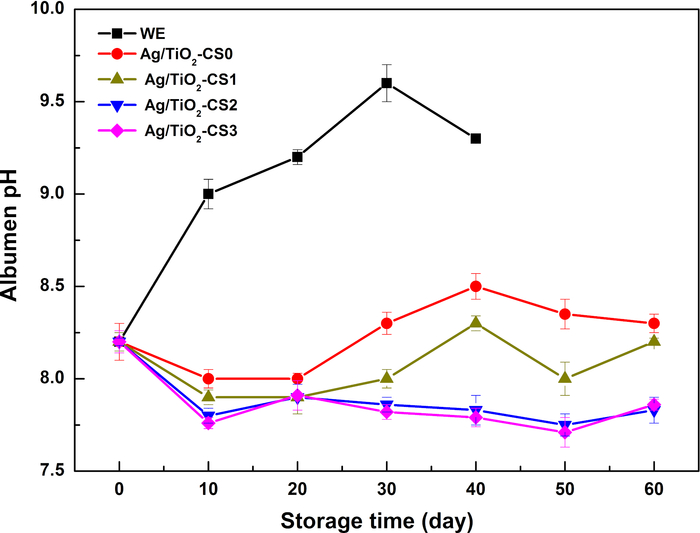
Figure 3 : Changements du pH de l’albumen de différents œufs pendant la période de stockage. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Images MEB de surfaces de coquilles d’œufs recouvertes d’Ag/TiO2-CS aux jours 0, 11, 16 et 31. a) Ag/TiO 2-CS1 ; b) Ag/TiO 2-CS2 ; (C) Ag/TiO 2-CS3. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les problèmes de préservation de la qualité des protéines d’œuf pourraient être soulagés par l’enrobage de chitosane, qui s’est avéré être un moyen efficace de prolonger la durée de conservation des œufs. L’utilisation d’un seul enrobage de chitosane crée cependant plusieurs problèmes tels que l’instabilité, la limitation de la durée de conservation et l’application effective des enrobages à base de chitosane. Notamment, le dopage de nanoparticules antibactériennes spécifiques dans le chitosane a été proposé pour prolonger encore la durée de conservation. Dans cette étude, les particules d’Ag/TiO2 sont synthétisées et dopées avec succès dans un revêtement de chitosane, ce qui pourrait prolonger la période de conservation à au moins 30 jours.
Les images MEB sont utilisées pour analyser la structure et la morphologie des particules Ag/TiO2 , ainsi que la morphologie des coquilles d’œufs enrobées. Les performances de conservation des revêtements composites sont évaluées par la perte de poids, l’unité de Haugh, le pH de l’albumen et la morphologie de la coquille d’œuf des échantillons. L’adoption de composites Ag/TiO2 contribue à un effet synergique sur le chitosane, ce qui pourrait prolonger davantage la période de conservation.
La taille des particules des composites Ag/TiO2 est de l’ordre de 100 à 300 nm (contrôlée par la condition de synthèse), ce qui pourrait bloquer les pores sur le dessus de la coquille de l’œuf et améliorer les performances de conservation. Cependant, un excès de particules Ag/TiO2 détruirait la structure en couches de l’enrobage de chitosane, ce qui entraînerait une capacité de conservation plus faible.
À l’heure actuelle, les performances de l’enrobage de chitosane dans cette étude sont toutefois limitées par les espèces et les concentrations de particules existantes, ce qui nécessite une optimisation dans les études futures.
Les méthodes de cette étude démontrent de nouveaux matériaux de revêtement, qui pourraient être mélangés par des nanoparticules spécifiques dans le précurseur du revêtement, afin d’obtenir des effets combinatoires de la nanoparticule et du précurseur, ainsi que de préparer de nouveaux revêtements multifonctionnels dans le domaine de la conservation des aliments.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le Guangxi Key Laboratory of New Energy and Building Energy Saving Foundation (n° 19-J-21-17, 19-J-21-30), le projet de recherche scientifique des universités du Guangxi (2020KY06029) et le Fonds d’innovation conjoint de l’Université de technologie de Wuhan et de l’Université du Tibet (LZJ2020003).
matériels
| Name | Company | Catalog Number | Comments |
| acetate | Aladdin | 64-19-7 | GR, 99.8% |
| Benzenesulfonic acid | Aladdin | 03/11/1998 | 98% |
| Chitosan | Aladdin | 9012-76-4 | <200 mPa•s |
| Deionized water | prepared by ourselves | - | 18 MΩ•cm |
| Electronic precision balance | Sartorius | BSA124S-CW | |
| Ethanol | Aladdin | 64-17-5 | ≥99.8% |
| Formate | Aladdin | 64-18-6 | Standard for GC, >99% |
| pH meter | HeYi | PHS-25 | |
| Scanning electron microscope | Hiatchi | SU8010 | |
| Silver nitrate (AgNO3) | Aladdin | 7761-88-8 | ≥99.9% |
| Sodium borohydride (NaBH4 ) | Aladdin | 16940-66-2 | 98% |
| Temperature humidity chamber | YiHeng | LHS-50CH | |
| Titanium butoxide (TBOT) | Aladdin | 5593-70-4 | CP,98% |
Références
- Kuroli, S., Kanoo, T., Itoh, H., Ohkawa, Y. Nondestructive measurement of yolk viscosity in lightly heated chicken shelleggs. Journal of Food Engineering. 205, 18-24 (2017).
- Kostogrys, R. B., et al. Effect of dietary pomegranate seed oil on laying hen performance and physicochemical properties of eggs. Food Chemistry. 221, 1096-1103 (2017).
- Morsy, M. K., Sharoba, A. M., Khalaf, H. H., El-Tanahy, H. H., Cutter, C. N. Efficacy of antimicrobial pullulan-based coating to improve internal quality and shelf-life of chicken eggs during storage. Journal of Food Science. 80, 1066-1074 (2015).
- Damaziak, K., et al. Effect of dietary canthaxanthin and iodine on the production performance and egg quality of laying hens. Journal of Poultry Science. , (2018).
- Sert, D., Aygun, A., Demir, M. K. Effects of ultrasonic treatment and storage temperature on egg quality. Journal of Poultry Science. 90, 869-875 (2011).
- Yaceer, M., Aday, M. S., Caner, C. Ozone treatment of shell eggs to preserve functional quality and enhance shelf life during storage. Journal of the Science of Food and Agriculture. 96, 2755-2763 (2016).
- Viswanathan, K., Priyadharshini, M. L. M., Nirmala, K., Raman, M., Raj, G. D. Bactericidal paper trays doped with silver nanoparticles for egg storing applications. Bulletin of Materials Science. 39, 819-826 (2016).
- Aygun, A., Sert, D. Effects of vacuum packing on eggshell microbial activity and egg quality in table eggs under different storage temperatures. Journal of the Science of Food and Agriculture. 93, 1626-1632 (2013).
- Ryu, K. N., No, H. K., Prinyawiwatkul, W. Internal quality and shelf life of eggs coated with oils from different sources. Journal of Food Science. 76, 325-329 (2011).
- Figueiredo, T. C., et al. Effects of packaging, mineral oil coating, and storage time on biogenic amine levels and internal quality of eggs. Journal of Poultry Science. 93, 3171-3178 (2014).
- Caner, C., Ydceer, M. Efficacy of various protein-based coating on enhancing the shelf life of fresh eggs during storage. Journal of Poultry Science. 94, 1665-1677 (2015).
- Xu, D., Wang, J., Ren, D., Wu, X. Y. Effects of chitosan coating structure and changes during storage on their egg preservation performance. Coatings. 8, 317 (2018).
- Kopacic, S., Bauer, W., Walzl, A., Leitner, E., Zankel, A. Alginate and chitosan as a functional barrier for paper-based packaging materials. Coatings. 8, 235 (2018).
- Sagnelli, D., et al. Cross-linked amylose bio-plastic:A transgenic-based compostable plastic alternative. International Journal of Molecular Sciences. 18, 2075 (2017).
- Megan, T., Robert, C. P., Ivan, P. P., Clara, P. Nanostructured titanium dioxide coatings prepared by aerosol assisted chemical vapour deposition (AACVD). Journal of Phothchemistry and Photobiology A-Chemistry. 400, 112727 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.