Method Article
Un'immagine guidata Transtral Valve Opuscolo Puntura Modello di Puntura del Sovraccarico di Volume Controllato da Rigurgitazione Mitrale nel Ratto
In questo articolo
Riepilogo
Viene riportato un modello di roditore di sovraccarico del volume del cuore sinistro dal rigurgito mitrale. Il rigurgito mitrale della gravità controllata viene indotto avanzando un ago di dimensioni definite nel volantino anteriore della valvola mitrale, in un cuore pulsante, con guida ecografica.
Abstract
Il rigurgito mitrale (MR) è una lesione valvolare cardiaca ampiamente prevalente, che causa il rimodellamento cardiaco e porta a insufficienza cardiaca congestizia. Anche se i rischi di RM non corretta e la sua prognosi infausta sono noti, i cambiamenti longitudinali nella funzione cardiaca, nella struttura e nel rimodellamento sono incompleti. Questa lacuna di conoscenze ha limitato la nostra comprensione dei tempi ottimali per la correzione MR e del vantaggio che la correzione precoce rispetto a quella tardiva può avere sul ventricolo sinistro. Per studiare i meccanismi molecolari alla base del rimodellamento ventricolare sinistro nell'impostazione della MR, sono necessari modelli animali. Tradizionalmente, il modello di fistola aorto-cavallo è stato utilizzato per indurre il sovraccarico di volume, che differisce da lesioni clinicamente rilevanti come la MR. LA MR rappresenta uno stress emodinamico di sovraccarico di volume a bassa pressione, che richiede modelli animali che imitano questa condizione. Qui, descriviamo un modello di roditore di GRAVE MR in cui il volantino anteriore della valvola mitrale del ratto è perforato con un ago 23G, in un cuore pulsante, con una guida ecocardiografica dell'immagine. La gravità della MR viene valutata e confermata con l'ecocardiografia e viene riportata la riproducibilità del modello.
Introduzione
Il rigurgito mitrale (MR) è una lesione valvolare cardiaca comune, diagnosticata nell'1,7% della popolazione generale degli Stati Uniti e nel 9% della popolazione anziana superiore ai 65 anni di età1. In questa lesione valvolare cardiaca, la chiusura impropria dei volantini della valvola mitrale in sistole, provoca il rigurgito del sangue dal ventricolo sinistro nell'atrio sinistro. Mr può verificarsi a causa di varie eziologie; tuttavia, le lesioni primarie della valvola mitrale (MR primario) vengono diagnosticate e trattate più frequentemente rispetto alla MR2secondaria. MR primario isolato è spesso il risultato della degenerazione mixomatous della valvola mitrale, con conseguente allungamento dei volantini o corde tendinee, o rottura di alcune corde, che contribuiscono alla perdita di coaptazione sistolica della valvola.
MR risultante da tali lesioni valvolari eleva il volume di sangue che riempie il ventricolo sinistro in ogni battito cardiaco, aumentando lo stress della parete diastolica finale e fornendo uno stressante emodinamico che incita all'adattamento e al rimodellamento cardiaco. Il rimodellamento cardiaco in questa lesione è spesso caratterizzato da un significativo allargamento della camera3,4, lieve ipertrofia da parete, con funzione contrattile conservata per periodi di tempo prolungati. Poiché la frazione di espulsione è spesso conservata, la correzione della MR con mezzi chirurgici o transcatetere è spesso ritardata, fino all'insorgenza di sintomi come dispnea, insufficienza cardiaca e aritmie. Tuttavia, la MR non corretta è associata ad alti rischi di eventi avversi cardiaci, anche se attualmente le conoscenze riguardanti i cambiamenti ultrastrutturali alla base di questi eventi sono sconosciute.
I modelli animali di MR forniscono un modello prezioso per studiare tali cambiamenti ultrastrutturali nel cuore e studiare la progressione longitudinale della malattia. In precedenza, i ricercatori hanno indotto la MR in animali di grandi dimensioni, tra cui suini, cani e pecore, creando un ventriculo-atriale shunt5esterno , rottura accordianale intracardiaca6, o perfazione opuscolo7. Mentre le tecniche chirurgiche sono più facili negli animali di grandi dimensioni, questi studi sono stati limitati al follow-up sub-cronico in una piccola dimensione del campione, a causa degli elevati costi di esecuzione di tali studi in animali di grandi dimensioni. Inoltre, l'analisi molecolare del tessuto di questi modelli è spesso difficile a causa di anticorpi specifici per specie limitati e librerie di genomi annotati per l'allineamento.
Piccoli modelli animali di MR possono fornire un'alternativa adatta per studiare questa lesione valvolare e il suo impatto sul rimodellamento cardiaco. Storicamente, è stato utilizzato il modello di ratto della fistola aorto-cavalla (ACF) del sovraccarico del volume cardiaco. Descritta per la prima volta nel 1973 da Stumpe et al.8, una fistola arterio-venosa viene creata chirurgicamente per bypassare il sangue arterioso ad alta pressione dall'aorta discendente nella vena cava inferiore a bassa pressione. L'elevata portata nella fistola induce un drastico sovraccarico di volume su entrambi i lati del cuore, causando significative iperstrofia e disfunzione ventricolare destra e sinistra che si verificano entro pochi giorni dalla creazione dell'ACF9. Nonostante il suo successo, ACF non imita l'emodinamica della MR, un sovraccarico di volume a bassa pressione, che eleva il precarico ma riduce anche il post-carico. A causa di tali limitazioni del modello ACF, abbiamo cercato di sviluppare e caratterizzare un modello di MR che imita meglio il sovraccarico di volume a bassa pressione.
Qui, descriviamo il protocollo per un modello di puntura del volantino valvolare mitrale per creare gravi MR nei ratti10,11. Un ago ipodermico è stato introdotto nel cuore del ratto che batte, e avanzato nel volantino della valvola mitrale anteriore sotto la guida ecocardiografica in tempo reale. La tecnica è altamente riproducibile e un modello relativamente buono che imita la MMr come si vede nei pazienti. La gravità MR è controllata dalle dimensioni dell'ago utilizzato per perforare il foglietto illustrativo mitrale e la gravità della MR può essere valutata utilizzando l'ecocardiografia transesofagea (TEE).
Protocollo
Le procedure sono state approvate dall'Animal Care and Use Program dell'Università Emory con il numero di protocollo EM63Rr, data di approvazione 06/06/2017.
1. Preparazione pre-chirurgica
- Sterilizzare a vapore gli strumenti chirurgici prima della procedura.
- Il giorno della procedura, trasferire i ratti dall'alloggiamento alla chirurgia e pesarli.
- Disegnare farmaci pre-operatori e post-operatori in base al peso: due dosi di Carprofen (2,5 mg/kg ciascuna), una dose di Gentamycina (6 mg/kg) e una dose di Buprenorfina (0,02 mg/kg).
- Assicurarsi un volume adeguato di isoflurane nel miscelatore di gas, e l'ossigeno nei serbatoi sono disponibili per l'intervento chirurgico. Un serbatoio pieno di ossigeno (24 ft3)è spesso adeguato.
2. Preparazione degli animali
NOTA: in questo studio sono stati utilizzati ratti maschi Sprague-Dawley adulti del peso di 350-400 g. Le tecniche chirurgiche sono suscettibili di animali leggermente più piccoli o più grandi, se lo si desidera.
- Sedare il ratto in una camera di induzione con 5% di isoflurane mescolato in 1 LPM (litro al minuto) di 100% di ossigeno. Determinare un livello adeguato di sedazione da una frequenza respiratoria più lenta sotto l'osservazione visiva e la perdita di contrazione dopo aver pizzicato la dita del topo del topo.
- Intubare il ratto con un 16 Ggiocath, montato per l'uso come tubo endotracheale.
- Visualizza la trachea e le corde vocali usando un otoscopio e usa un applicatore di punta di cotone per cancellare le secrezioni di faringeali.
- Introdurre il tubo endotracheale su un filo guida da 0,034 pollici, nelle corde vocali. Una volta che il tubo è posizionato in modo appropriato nella trachea, spingere il tubo verso l'interno e ritirare il filo (Figura1).
- Posizionare il ratto sul cuscinetto chirurgico riscaldato mantenuto a 37 gradi centigradi e collegare il tubo endotracheale a un ventilatore meccanico. Immettere il peso del ratto nel software di controllo del ventilatore, che calcola il tasso di ventilazione e il volume delle maree. In questo studio sono stati utilizzati 66 respiri al minuto con un volume di marea di 1 mL/100 g di peso corporeo (Figura 1D).
- Utilizzare ossigeno al 100% (1 LPM) mescolato con 2-2,5% isoflurane come anestetico inalante e confermare il livello di anestesia con perdita di tono della mascella e perdita di risposta al pizzico.
- Si noti che se correttamente intubato, il movimento del torace dovrebbe sincronizzarsi con il ventilatore.
- Se intubato in modo improprio, il movimento del torace non si sincronizza con il ventilatore. Per verificare l'intubazione impropria, comprimere l'addome del ratto, che crea retropressione sul ventilatore, generando un allarme di sovrapressione. In questo scenario, ritrarre delicatamente l'angiocath e riportare il ratto alla camera di induzione con 5% isoflurane per pochi minuti per garantire che il ratto sia sufficientemente anetizzato e re-intubare il ratto.
- Una volta intubato correttamente, fissare il tubo endotracheale suturando l'estremità prossimale del tubo sulla guancia del ratto con una sutura di seta 4-0 per evitare l'estubazione durante la procedura.
- Inserire una sonda di temperatura rettale per monitorare la temperatura corporea e un elettrocardiogramma a quattro terminali per monitorare l'ECG durante l'intera procedura.
- Utilizzare una lampada riscaldante in testa se il calore proveniente dalla piattaforma chirurgica è insufficiente. Spegnere la lampada se la temperatura corporea supera i 37 gradi centigradi.
- Valutare visivamente l'elettrocardiogramma per eventuali aritmie o segni di ischemia miocardiale. Se non sono presenti, registrare l'elettrocardiogramma di base.
- Eseguire l'ecocardiografia transtoracica (TTE) per la funzione cardiaca di base (Figura 2A).
- Ruotare il topo in una posizione supina e radere il lato sinistro del torace. Per ottenere una vista chiara eco, rimuovere i capelli utilizzando una crema depilatoria.
- Utilizzare qualsiasi sistema a ultrasuoni con frequenza adeguata per l'imaging ad alta frequenza cardiaca. In questo studio abbiamo usato il sistema Visualsonics 2100 con una sonda da 21 MHz, appropriata per l'imaging cardiaco nei ratti.
- Ottenere immagini in modalità B nel piano parasternale dell'asse lungo, per calcolare i volumi ventricolari a sinistra. Nello stesso piano, ottenere immagini in modalità M per misurare le dimensioni del muro.
- Ruotare la sonda di 90 gradi e ottenere viste ad asse corto in modalità B e in modalità M a livello medio-papillare per misurare le dimensioni delle pareti trasversali.
- Eseguire l'ecocardiografia transesofagea (TEE) per l'imaging di base (Figura 2B).
- Posizionare il ratto nella giusta posizione decubito e inserire una sonda ad ultrasuoni intracardiaca di 8 Fr (8 MHz) nell'esofago del ratto con una piccola quantità di gel applicato sulla punta. La frequenza della sonda ICE (ecocardiografia intracardiaca) è sufficiente per ottenere 4-6 fotogrammi per battito cardiaco, che sono adeguati per visualizzare il movimento della valvola.
NOTA: Un sistema GE Vivid I o Siemens SC2000 prime può essere utilizzato per l'imaging ICE. - Ottenere una vista elevata esofagea per ottenere una vista a due camere del lato sinistro del cuore. Questa vista è ideale per visualizzare l'atrio sinistro, la valvola mitrale e il ventricolo sinistro. Posizionare la sonda in modo tale che i volantini anteriori e posteriori siano visualizzati e la coaptazione sia centrale. Questo angolo consente anche di eseguire misurazioni Doppler attraverso la valvola mitrale, senza correzione dell'angolo.
- In questa vista, misurare l'area atriale sinistra e le dimensioni dell'annullamento della valvola mitrale.
- Eseguire l'imaging Doppler di colore per confermare la competenza della valvola e la mancanza di MR al basale. Eseguire l'imaging Doppler a onde pulsate e continue per quantificare l'afflusso mitrale e confermare la mancanza di flusso rigurgitante.
- Eseguire l'imaging Doppler a onde B e pulsate dell'aorta per misurare il diametro della radice aortica e calcolare il flusso aortico.
- Eseguire l'imaging doppler onda pulsata della vena polmonare per misurare il flusso veterinario polmonare.
- Posizionare il ratto nella giusta posizione decubito e inserire una sonda ad ultrasuoni intracardiaca di 8 Fr (8 MHz) nell'esofago del ratto con una piccola quantità di gel applicato sulla punta. La frequenza della sonda ICE (ecocardiografia intracardiaca) è sufficiente per ottenere 4-6 fotogrammi per battito cardiaco, che sono adeguati per visualizzare il movimento della valvola.
- Iniettare una singola dose di Carprofen (2,5 mg/kg, SQ, antinfiammatorio non steroideo), Gentamycin (6 mg/kg, SQ, antibiotico) e salina sterile (1 mL, SQ) per compensare preventivamente la perdita di sangue durante la procedura.
- Rasare il lato sinistro del torace come necessario per rimuovere i capelli rimanenti dal campo chirurgico. La rasatura dalla regione del collo inferiore allo xifoide e dal braccio sinistro fino allo sterno medio dovrebbe essere sufficiente a garantire un campo privo di capelli e ridurre il rischio di contaminazione del sito chirurgico.
- Scrub l'area chirurgica con una garza imbevuta di Betadine, seguita da una garza imbevuta di 70% etanolo. Scrub l'area in movimenti circolari sulla pelle, in modo che la garza non contatto un'area precedentemente strofiata.
- Ripetere questo passaggio tre volte per ottenere un campo adeguatamente sterile per la chirurgia.
- Drappo l'animale con coperture sterili, aprendo una finestra per accedere all'area chirurgica sterile.
3. Toracotomia sinistra
- Eseguire l'intera procedura chirurgica utilizzando tecniche asettiche, con isoflurane mantenuto al 2-2,5% in 1 LPM di ossigeno. Mettere tutti gli strumenti in un vassoio sterile e riporre nel vassoio dopo ogni utilizzo.
- Indossare guanti sterili, una maschera e un berretto chirurgico dal chirurgo per l'intera procedura. Un abito chirurgico sterile può essere indossato pure, ma è facoltativo a meno che non sia prevista la contaminazione.
- Utilizzare un bisturi chirurgico con una lama No #15 per fare un'incisione cutanea sul lato sinistro del torace, circa 1 cm prossimale allo xifoide. Utilizzare una punta di dissezione smussata forbici per separare lo strato cutaneo dallo strato muscolare e fare un'incisione longitudinale.
- Dissezionare gli strati muscolari nello stesso modo fino a quando le costole sono esposte.
- Fare con attenzione un'incisione longitudinale di 2-3 cm nel quinto spazio intercostale, adeguato per inserire retrattili ed esporre il cuore.
- Utilizzare pinze sottili a punta per sollevare il pericardio e micro forbici per eccitarlo nella regione che circonda l'apice del cuore. Questo passaggio aiuta a evitare le adesioni post-chirurgiche del cuore alle pareti del torace e del diaframma.
NOTA: Evitare incisioni chirurgiche vicine allo sterno per ridurre al minimo il sanguinamento. Trasmettere le arterie mammarie interne che corrono lungo lo sterno, può causare un'eccessiva emorragia. Se incontrato con tale sanguinamento, identificare l'emorragia e cauterizzare esso.
4. Procedura MR guidata Echo(Figura 3 e Figura 4)
- Utilizzare una sutura prolene 6-0 e un supporto a microaghi, per posizionare una sutura a corda di borsa sull'apice del ventricolo sinistro. Se necessario, utilizzare micro pinze per stabilizzare il cuore.
- Legare delicatamente la sutura apicale per stabilizzare l'apice e inserire un ago da 23 G (lavato con salina e con un tappo alla fine distale) al centro della sutura della corda della borsa, nella cavità ventricolare sinistra.
- Usa una mano per tenere stabilmente e guidare l'ago, e l'altra mano per manipolare simultaneamente la sonda eco transesofagea per ottenere una vista eco ottimale per visualizzare l'ago, come descritto sopra.
- Con la guida ecografica in tempo reale, far avanzare l'ago verso il lato ventricolare del volantino mitrale anteriore. Una volta confermata la posizione dell'ago con gli ultrasuoni, far avanzare l'ago in un movimento sottile attraverso il volantino della valvola. Se si avverte una resistenza, ruotare l'ago mentre viene avanzato nel volantino per perforarlo.
NOTA: L'avanzamento dell'ago troppo lontano nell'atrio sinistro potrebbe comportare la perforazione atriale sinistra, causando un eccessivo sanguinamento e la morte animale. L'ago deve essere visualizzato in ecografia in ogni momento. - Ritrarre l'ago nella camera ventricolare sinistra, lontano dalla valvola mitrale, e confermare LA MR attivando l'imaging Doppler a colori.
- Se la RM non viene visualizzata nell'imaging Doppler a colori, ripetere i passaggi 4.4 e 4.5. Regolare la sonda eco se necessario per ottenere una visualizzazione migliore. Dopo la pratica in pochi ratti, è possibile indurre una puntura del volantino in un movimento dell'ago, inducendo un foro che è la dimensione del diametro esterno dell'ago. Questo è stato confermato dopo la necropsia dei cuori di ratto.
- Una volta che il MR è confermato, ritrarre l'ago dalla cavità ventricolare sinistra e legare delicatamente la sutura della corda della borsa.
- Utilizzare una garza sterile per assorbire qualsiasi sangue sull'apice e nella cavità toracica.
NOTA: Toccare la sonda eco con i guanti chirurgici può causare la contaminazione dell'ambiente sterile. Spruzzare i guanti con il 70% di etanolo o sostituire i guanti con quelli nuovi, in modo appropriato.
5. Recupero degli animali e cure post-operatorie
- Dopo 5-10 minuti di funzione cardiaca stabile (ECG normale e frequenza cardiaca), chiudere la toracotomia negli strati con 4-0 vicryl, riducendo l'isoflurane a passi.
- Utilizzare una sutura interrotta per approssimare le costole, con isoflurane mantenuto al 2%. Inserire un tubo toracico nel sesto spazio intercostale e fissarlo alle tende sterili per evitare l'avanzamento involontario del tubo nella cavità toracica.
- Utilizzare una sutura continua per chiudere lo strato muscolare con isoflurane mantenuto all'1,5%.
- Utilizzare una sutura continua per chiudere lo strato cutaneo con isoflurane mantenuto all'1%.
- Collegare una siringa con punta della valvola Luer da 10 mL al tubo toracico e scolare 10-12 mL di aria dalla cavità toracica e quindi rimuovere il tubo toracico.
- Somministrare una dose finale di Carprofen (2,5 mg/kg, SQ) e spegnere l'isoflurane.
- Continuare la ventilazione meccanica mentre il ratto scia dall'anestesia, monitorando i segni vitali (SpO2 e frequenza cardiaca). All'inizio della respirazione spontanea, spegnere la ventilazione per testare la capacità del ratto di mantenere tale respirazione e buona SpO2.
- Se i livelli di SpO2 iniziano a scendere al di sotto del 90%, accendere il ventilatore. Una volta che il ratto è in grado di mantenere i livelli di SpO2 senza ventilazione, la sutura di ancoraggio al tubo endotracheale viene tagliata e l'animale viene preparato per l'estubazione.
- Una volta che il ratto mostra segni di vigilanza tra cui baffi o movimenti oculari, estubare l'animale.
- Mettere un cono naso con ossigeno al 100% fino a quando il ratto è ambulatorio.
- Trasferire il topo in una gabbia pulita con biancheria da letto minima e continuare a monitorare i segni vitali utilizzando un monitor Palcale SpO2, posto sul piede o sulla coda del topo, fino a quando il ratto non è ambulatorio.
NOTA: Se si osservano effetti avversi dell'intervento chirurgico, gli animali possono avere un tempo di recupero più lungo e possono richiedere più tempo per contenere alti livelli di SpO2. In questo caso, un cono naso con 100% di ossigeno può essere applicato fino a quando i livelli di SpO2 sono stabili. - Per ridurre il rischio di lesioni al sito chirurgico ed evitare il rischio di infezione, ratti monocasa dopo l'intervento chirurgico.
- Somministrare Buprenorphine entro 3 h dopo che il ratto è sveglio e sufficientemente ambulatorio. La buprenorfina può causare angoscia respiratoria quando somministrata all'inizio del periodo di recupero perioperatorio, quindi ritardarla fino a quando il ratto respira senza difficoltà.
- Dopo l'intervento chirurgico, tutti gli animali ricevono i seguenti farmaci: gentamicina (6 mg/kg, SQ, SID POD 1-3) e rimadyl (5 mg/kg, SQ, SID POD 1-3). Tutti gli animali sono osservati una volta al giorno per cinque giorni dopo l'intervento chirurgico per l'esame dei siti di incisione, e una volta al giorno per le prime due settimane dopo l'intervento chirurgico per la valutazione del dolore.
6. Convalida della gravità MR con ecocardiografia (Figura 5)
- Ripetere TEE due settimane dopo l'intervento chirurgico, seguendo la stessa procedura specificata nella sezione 2.7. Due settimane dopo la chirurgia è il tempo sufficiente per stabilizzare l'emodinamica.
- Ottenere l'imaging Doppler di colore su una vista a 2 camere utilizzando l'imaging ecografico transesofagea, visualizzando il ventricolo sinistro e l'atrio sinistro. Misurare l'area dell'atrio sinistro e del getto MR. Calcolare la frazione dell'area del getto MR utilizzando
 (1)
(1)
Grave MR è definito come zona getto MR - 30%. - Approssimare l'area dell'orifizio rigurgitante calcolando l'area di 23 G ago, utilizzando il diametro esterno dell'ago. Questa equazione presuppone che l'area dell'orifizio rigurgitante sia uguale all'area dell'ago 23G.
 (2)
(2) - Ottenere l'imaging Doppler a onde continue con la porta Doppler presso l'orifizio del getto rigurgitante. Tracciare la forma d'onda per calcolare il VTI del getto rigurgitante. Il volume MR può essere stimato
 (3)
(3)
Grave MR è definito come volume MR 95 . - Ottenere l'imaging Doppler onda impulso della vena polmonare ruotando la sonda eco lateralmente, in senso orario. Misurare le velocità dell'onda sistolica e diastolica e utilizzare l'equazione seguente per calcolare il rapporto.
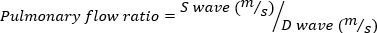 (4)
(4)
Un rapporto di flusso polmonare negativo indica una risonanza magnetica grave.
7. Chirurgia della Sham
- Eseguire le sezioni 1-3 come descritto.
- La sezione di modifica 4 è stata modificata in modo che l'ago da 23 G venga inserito nella camera ventricolare sinistra, attraverso una sutura della corda di perlustrazione sull'apice ventricolare sinistro, ma non avanzata nella valvola mitrale per creare MR. Inserire l'ago nella camera ventricolare sinistra e ritrarsi immediatamente, in seguito a serrare e chiudere l'apice ventricolare.
- Eseguire la sezione 5 come descritto.
- Eseguire la valutazione della valvola mitrale come descritto nella sezione 6. Tuttavia, la MR non dovrebbe essere presente in nessuno degli animali, pertanto la quantificazione come descritto non è necessaria.
Risultati
Fattibilità e riproducibilità
Il modello MR proposto è altamente riproducibile, con un foro ben definito nel foglietto illustrativo mitrale raggiunto nel 100% dei ratti utilizzati in questo studio. Figura 6A illustra la direzione dell'ago come viene inserito nella valvola mitrale. Figura 6B raffigura un foro nel volantino valvolare mitrale da un ratto rappresentativo espiantato a 2 settimane dopo la procedura.
Sopravvivenza ed eventi avversi
Sedici ratti sono stati indotti con MR utilizzando i metodi descritti. Grave MR è stato creato in tutti i ratti. Un ratto è morto entro un'ora dalla creazione di MR per insufficienza respiratoria acuta. Pertanto, la sopravvivenza complessiva a 2 settimane dopo la creazione di MR è stata del 93,75%. La mortalità o i principali eventi avversi cardiaci, come sanguinamento, aritmie o ictus non sono stati osservati in alcun animale nelle due settimane di osservazione.
Gravità del rigurgito mitrale
La tabella 1 riassume il profilo emodinamico del cuore sinistro al basale e 2 settimane dopo l'introduzione del MR. È stato utilizzato un t-test accoppiato per determinare la significatività statistica tra la linea di base e la gravità MR a 2 settimane, con un significato statistico definito come p < 0,05. Un jet MR era vivido a due settimane dopo l'intervento, con una superficie media di 21,15 x 8,11 mm2 (p < 0,0001 rispetto al basale) e un tempo medio di velocità integrale di 39,72 x 7,52 cm. La gravità della MR era adeguata per indurre l'inversione del flusso polmonare, con una diminuzione del rapporto S/D da 0,91 - 0,17 al basale a -0,69 x 0,65 a 2 settimane (p < 0,0001).
Rimodellamento della camera cardiaca
Figura 7 mostra cambiamenti morfologici in un cuore rappresentativo dopo grave MR per 2 settimane, rispetto a un cuore da un ratto che ha subito un intervento chirurgico finto. Dopo due settimane dopo l'intervento chirurgico, il cuore del ratto con MR era sferico e gravemente dilatato, con un aumento del 29,65% del volume diastolico finale (EDV di base: 462,49 x 39,62L; e dopo la settimana 2 EDV: 599,79 x 58,59 , p < 0,0001). Il volume sistolico finale è aumentato del 10,06%, passando da 153,90 x 18,78 al basale, a 169,36 , 24,64 L (p - 0,01) a 2 settimane dopo l'induzione della MR. L'ipercontrattualità del cuore è stata osservata nelle prime due settimane come previsto, a causa della riduzione del postload, come evidente da una frazione di espulsione elevata (66,77 x 2,02% al basale al 71,82% 2,31% a 2 settimane (p < 0,0001)). L'esposizione alla MR per due settimane ha aumentato l'area atriale di sinistra del 99,59% (p < 0,0001).

Figura 1: Tecnica dell'intubazione. (A) Un angiocath da 16 G con un filo guida utilizzato per l'intubazione endotracheale in questo modello di ratto; (B) Immagine della vista faringea leve utilizzando un otoscopio e della regione bersaglio per inserire il tubo endotracheale; (C) Configurazione finale del tubo endotracheale; (D) Attacco del tubo endotracheale al ventilatore meccanico. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Imaging transeoracico e transesofageo. Imaging transtooracico: (A1) Impostazione per l'imaging transtoracico del ratto, raffigurante l'angolo della sonda di imaging; (A2) Parasterna lunga vista dell'asse del cuore; (A3) Breve vista dell'asse del cuore. Imaging transesofageo: (B1) 8 Sonda eco intracardiaca Fr con sonda inserita nell'esofago mentre l'animale è intubato; (B2) Alte vedute esofagee del cuore sinistro, raffiguranti l'atrio sinistro, la valvola mitrale e il ventricolo sinistro. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Procedura chirurgica. (A) Layout chirurgico che mostra la toracotomia sinistra a 5th spazio intercostale, e catetere ICE nell'esofago del ratto per la guida dell'immagine, e un ago da 23 G inserito nell'apice LV in cui è posizionata la sutura della corda della gabbia. (B) Vista chirurgica durante la perforazione guidata dell'eco transesofagea. (C) Immagine ecocardiografica dell'inserimento dell'ago nel ventricolo sinistro in diastolo. (D) Immagine ecocardiografica dell'inserimento dell'ago nel ventricolo sinistro in sistole. (E) Immagine cardiografica dell'ago trafitto attraverso il volantino anteriore. Fare clic qui per visualizzare una versione più grande di questa figura.
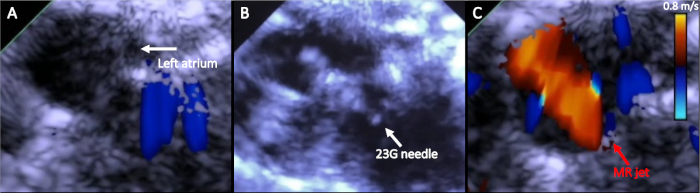
Figura 4: Imaging della procedura. (A) Eco di base 2 vista della camera prima di creare MR; (B) 23 G ago, visualizzato sull'eco durante il battito cardiaco, avanzato nell'atrio sinistro attraverso il volantino della valvola mitrale anteriore; (C) Color Doppler imaging che mostra getto MR visto in sistole. Fare clic qui per visualizzare una versione più grande di questa figura.
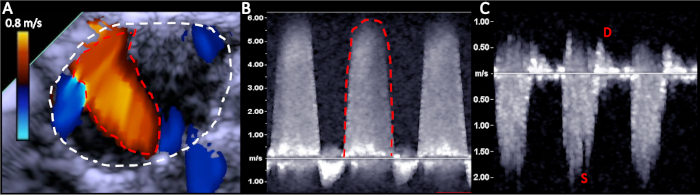
Figura 5: Rappresentative delle immagini eco per convalidare la gravità MR a 2 settimane dopo l'intervento chirurgico. (A) Area atriale sinistra tracciata in bianco e nell'area del getto MR tracciata in rosso; (B) MR VTI traccia in rosso; (C) Flusso polmonare che mostra l'inversione sistolica. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: puntura dell'ago. (A) Orientamento della puntura dell'ago su un cuore ex vivo. L'ago ha forato l'apice dell'LV ad angolo, una sezione longitudinale dell'LV con l'ago diretto verso il volantino della valvola mitrale e l'ago che passa attraverso il volantino della valvola mitrale nello spazio atriale. (B) Fotografia rappresentativa dell'espiantato raffigurante un foro nel volantino mitrale anteriore. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: morfologia lorda di interi cuori di un topo di controllo operato (A) e di un ratto che ha subito un intervento chirurgico MR (B) 2 settimane dopo l'intervento chirurgico. Il ratto con grave MR ha una significativa dilatazione ventricolare sinistra e l'allargamento della camera rispetto al controllo della finta funzione. Fare clic qui per visualizzare una versione più grande di questa figura.
| Previsione (n - 15) | 2wk MR (n : 15) | valore p | |
| Area atriale sinistra (mm2) | 25,03 x 8,70 | 49,95 x 14,78 | p < 0.0001 |
| Area del getto MR (mm2) | 0 | 21.15 - 8,11 | p < 0.0001 |
| Frazione MR (%) | 0 | 41,91 - 8,30 | p < 0.0001 |
| MR VTI (cm) | 0 | 39,72 x 7,52 | p < 0.0001 |
| Onda S (m/s) | 0,39 x 0,07 | -0,51 - 0,41 | p < 0.0001 |
| Onda D (m/s) | 0,44 x 0,04 | 0,70 - 0,17 | p < 0.0001 |
| Rapporto onda S/D | 0,91 - 0,17 | -0,69 x 0,65 | p < 0.0001 |
Tabella 1: Caratteristiche del rigurgito mitrale.
Discussione
Viene segnalato un modello di roditore riproducibile di grave MR con buona sopravvivenza (93,75% di sopravvivenza dopo l'intervento chirurgico) e senza significative complicazioni post-operatorie. L'imaging in tempo reale con ecocardiografia transesofagea e l'introduzione di un ago nel cuore pulsante per forare il volantino mitrale sono fattibili e possono essere insegnate. Grave MR è stato prodotto con la dimensione dell'ago 23 G in questo studio, che può essere variato come desiderato utilizzando un ago più piccolo o più grande. La MR indotta in questo modello crea un sovraccarico di volume a bassa pressione sul ventricolo sinistro, che è una migliore rappresentazione delle lesioni valvolari mitrali osservate clinicamente. Grave dilatazione ventricolare atriale e sinistra è osservata entro due settimane dall'insorgenza di MR in questo modello, ma senza disfunzione contrattuale misurata dalla frazione di espulsione. Analoghi a tale situazione sono i pazienti con MR primario, che rimangono asintomatici senza insufficienza cardiaca per periodi prolungati, nonostante la dilatazione progressiva delle loro camere cardiache laterali sinistre.
Questo modello MR di sovraccarico di volume differisce in diversi modi dal modello di fistola aorto-caval ampiamente usato del sovraccarico di volume. Facilità procedurale di ACF, che richiede una semplice laparotomia senza la necessità di intubazione e ventilazione meccanica, ha incoraggiato la sua adozione da parte della comunità scientifica12. Nonostante i suoi evidenti vantaggi procedurali, le fistole arteriose evitano un grande volume di sangue nella vena cava, che sovraccarica il serbatoio venoso, e anche il ventricolo destro. Una pressione venosa centrale elevata da congestione venosa può indurre congestione epatica e filtrazione renale non ottimale, che può causare fibrosi epatica o attivazione del sistema renin-angiotensin-aldosterone (RAAS). L'effetto di confusione del sistema RAAS sull'accoppiamento ventricolare-arterioso è noto, e quindi il modello ACF non riesce a presentare un vero sovraccarico di volume sul ventricolo sinistro come si vede nell'impostazione del rigurgito mitrale. Rispetto al modello di difetto della valvola mitrale, la mancanza di riduzione del postcarico diverge ulteriormente questo modello dalla situazione clinica di MR.13
Oltre alla novità di introdurre MR con un ago stick, il nostro modello ha più applicazioni nel rispondere a domande clinicamente importanti. I pazienti con MR primario che emerge da una lesione valvolare mitrale sono spesso asintomatici per lunghi periodi e ricevono la correzione della loro MR solo all'inizio di sintomi di insufficienza polmonare o cardiaca. Dati clinici recenti indicano che tale correzione ritardata della MR non consente il recupero funzionale del ventricolo sinistro, nonostante il sollievo della fatica e dei sintomi14. In uno studio recente che utilizza questo modello di roditore, abbiamo dimostrato che la MR introduce un rimodellamento rapido e precoce della matrice extracellulare cardiaca, che è un precursore dei cambiamenti strutturali nel ventricolo sinistro10. Tali intuizioni meccanicistiche che forniscono una base fisiologica per l'intervento della valvola mitrale possono essere sviluppate utilizzando questo modello. In combinazione con l'imaging cardiaco, è possibile sviluppare biomarcatori che rappresentano questi cambiamenti ventricolari a sinistra precoce per guidare i tempi di intervento. Inoltre, questo modello di MR può essere combinato con cardiomiopatie ventricolari come ischemici ischemici, non ischemici e altre eziologie, per capire l'effetto della RISONANZa magnetica sul rimodellamento dei ventricoli singhiozzanti. Ad esempio, la MR secondaria, un evento frequente nei ventricoli miopatici dopo un infarto o con ischemia cronica, è una lesione clinicamente difficile da gestire. Se la MR è un passante in questo stato di malattia e un prodotto di disfunzione LV, o se contribuisce attivamente al rimodellamento cardiaco sono controversi. Recentemente abbiamo esteso questo modello di MR per studiare se i cuori post-infarto con MR differiscono nel loro potenziale di rimodellamento cardiaco rispetto a quelli senza MR11, chiarire i potenziali meccanismi coinvolti nel peggioramento dell'insufficienza cardiaca nei pazienti con MR. Questo modello fornisce la flessibilità per studiare l'impatto dell'esordio precoce rispetto all'insorgenza tardiva della RM sul rimodellamento cardiaco al fallimento, che potrebbe avere un impatto clinico significativo nell'guidare gli interventi.
Come con qualsiasi modello sperimentale, ci sono alcuni vantaggi e limitazioni che dovrebbero essere considerati quando si applicano i risultati dagli animali agli esseri umani. Il chiaro vantaggio di questo modello è la gravità riproducibile della MR, che aiuta a comprendere il rimodellamento della camera cardiaca in condizioni diagnosticate clinicamente come la MR primaria dalla rottura accordiale. L'aumento dei volumi delle camere cardiache osservato in questo modello e nel rimodellamento a matrice extracellulare osservato nel miocardio rappresentano i cambiamenti osservati in precedenza negli animali più grandi e negli esseri umani con MR primario14,15. La limitazione di questo modello di perforazione a fogliamine è che la MR si sviluppa acutamente, rappresentando solo un sottoinsieme di pazienti con MR primario da rottura acuta degli accordi. Nonostante i limiti, l'acuta insorgenza della MR rappresenta una popolazione di pazienti significativamente grande che subisce interventi valvolari mitrali, e questo modello è molto rilevante per una situazione del genere. Un'altra limitazione di questo modello è che la MR non è reversibile o riparabile, il che non consente studi sull'effetto o la tempistica dell'intervento sul rimodellamento cardiaco.
Divulgazioni
M.P è consulente di Heart Repair Technologies (HRT), per il quale ha ricevuto commissioni di consulenza. LA TOS non ha avuto alcun ruolo in questo studio, né ha fornito alcun finanziamento a sostegno di questo lavoro.
Riconoscimenti
Questo lavoro è stato finanziato dalla sovvenzione 19PRE34380625 e 14SDG20380081 dall'American Heart Association a D. Corporan e M. Padala rispettivamente, concede HL135145, HL133667 e HL140325 dai National Institutes of Health a M. Padala, e finanziamenti infrastrutturali dal Carlyle Fraser Heart Center presso l'Ospedale Universitario Emory di Midtown a M. Padala.
Materiali
| Name | Company | Catalog Number | Comments |
| 23G needle | Mckesson | 16-N231 | |
| 25G needle, 5/8 inch | McKesson | 1031797 | |
| 4-0 vicryl | Ethicon | J496H | |
| 6-0 prolene | Ethicon | 8307H | |
| 70% ethanol | McKesson | 350600 | |
| ACE Light Source | Schott | A20500 | |
| ACUSON AcuNav Ultrasound probe | Biosense Webster | 10135936 | 8Fr Intracardiac echo probe |
| ACUSON PRIME Ultrasound System | Siemens | SC2000 | |
| Betadine | McKesson | 1073829 | |
| Blunted microdissecting scissors | Roboz | RS5990 | |
| Buprenorphine | Patterson Veterinary | 99628 | |
| Carprofen | Patterson Veterinary | 7847425 | |
| Chest tube (16G angiocath) | Terumo | SR-OX1651CA | |
| Disposable Surgical drapes | Med-Vet | SMS40 | |
| Electric Razor | Oster | 78400-XXX | |
| Gentamycin | Patterson Veterinary | 78057791 | |
| Heat lamp with table clamp | Braintree Scientific | HL-1 120V | |
| Hemostatic forceps, curved | Roboz | RS7341 | |
| Hemostatic forceps, straight | Roboz | RS7110 | |
| Induction chamber | Braintree Scientific | EZ-1785 | |
| Injection Plug, Cap, Luer Lock | Exel | 26539 | |
| Isoflurane | Patterson Veterinary | 6679401725 | |
| Mechanical ventilator | Harvard Apparatus | Inspira ASV | |
| Microdissecting forceps | Roboz | RS5135 | |
| Microdissecting spring scissors | Roboz | RS5603 | |
| Needle holder | Roboz | RS6417 | |
| No. 15 surgical blade | McKesson | 1642 | |
| Non-woven sponges | McKesson | 446036 | |
| Otoscope | Welch Allyn | 23862 | |
| Oxygen | Airgas Healthcare | UN1072 | |
| Pulse Oximeter | Nonin Medical | 2500A VET | |
| Retractor, Blunt 4x4 | Roboz | RS6524 | |
| Rodent Surgical Monitor | Indus Instruments | 113970 | The integrated platform allows for monitoring of vital signs and surgical warming |
| Scale | Salter Brecknell | LPS 150 | |
| Scalpel Handle | Roboz | RS9843 | |
| Silk suture 3-0 | McKesson | 220263 | |
| Small Animal Anesthesia System | Ohio Medical | AKDL03882 | |
| Sterile saline (0.9%) | Baxter | 281322 | |
| Sugical Mask | McKesson | 188696 | |
| Surgical cap | McKesson | 852952 | |
| Surgical gloves | McKesson | 854486 | |
| Syringe 10mL | McKesson | 1031801 | |
| Syringe 1mL | McKesson | 1031817 | |
| Ultra-high frequency probe | Fujifilm Visualsonics | MS250 | |
| Ultrasound gel | McKesson | 150690 | |
| VEVO Ultrasound System | Fujifilm Visualsonics | VEVO 2100 |
Riferimenti
- Nkomo, V. T., et al. Burden of valvular heart diseases: a population-based study. Lancet. 368 (9540), 1005-1011 (2006).
- Zamorano, J. L., et al. Mechanism and Severity of Mitral Regurgitation: Are There any Differences Between Primary and Secondary Mitral Regurgitation? The Journal of Heart Valve Disease. 25 (6), 724-729 (2016).
- Grossman, W., Jones, D., McLaurin, L. P. Wall stress and patterns of hypertrophy in the human left ventricle. Journal of Clinical Investigation. 56 (1), 56-64 (1975).
- Carabello, B. A. Concentric versus eccentric remodeling. Journal of Cardiac Failure. 8 (6), S258-S263 (2002).
- Braunwald, E., Welch, G. H., Sarnoff, S. J. Hemodynamic effects of quantitatively varied experimental mitral regurgitation. Circulation Research. 5 (5), 539-545 (1957).
- Sasayama, S., Kubo, S., Kusukawa, R. Hemodynamic and angiocardiographic studies on cardiodynamics: experimental mitral insufficiency. Japanese Circulation Journal. 34 (6), 513-530 (1970).
- Hennein, H., Jones, M., Stone, C., Clark, R. Left ventricular function in experimental mitral regurgitation with intact chordae tendineae. Journal of Thoracic and Cardiovascular Surgery. 105 (4), 624-632 (1993).
- Stumpe, K. O., Sölle, H., Klein, H., Krück, F. Mechanism of sodium and water retention in rats with experimental heart failure. Kidney International. 4 (5), 309-317 (1973).
- Abassi, Z., Goltsman, I., Karram, T., Winaver, J., Hoffman, A. Aortocaval fistula in rat: A unique model of volume-overload congestive heart failure and cardiac hypertrophy. Journal of Biomedicine and Biotechnology. 2011 (January), 1-13 (2011).
- Corporan, D., Onohara, D., Hernandez-Merlo, R., Sielicka, A., Padala, M. Temporal changes in myocardial collagen, matrix metalloproteinases, and their tissue inhibitors in the left ventricular myocardium in experimental chronic mitral regurgitation in rodents. American Journal of Physiology - Heart and Circulatory Physiology. 315 (5), H1269-H1278 (2018).
- Onohara, D., Corporan, D., Hernandez-Merlo, R., Guyton, R. A., Padala, M. Mitral Regurgitation Worsens Cardiac Remodeling in Ischemic Cardiomyopathy in an Experimental Model. The Journal of Thoracic and Cardiovascular Surgery. , (2019).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovascular Research. 24 (5), 430-432 (1990).
- Brower, G. L., Janicki, J. S. Contribution of ventricular remodeling to pathogenesis of heart failure in rats. American Journal of Physiology-Heart and Circulatory Physiology. 280 (2), H674-H683 (2001).
- McCutcheon, K., et al. Dynamic changes in the molecular signature of adverse left ventricular remodeling in patients with compensated and decompensated chronic primary mitral regurgitation. Circulation Heart Failure. 12 (9), (2019).
- McCutcheon, K., Manga, P. Left ventricular remodeling in chronic primary mitral regurgitation. Cardiovascular Journal of Africa. 29 (1), 51-64 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon