Method Article
Ein Bild geführte transapical Mitral Valve Leaflet Puncture Modell der kontrollierten Volumenüberlastung von Mitral Regurgitation in der Ratte
In diesem Artikel
Zusammenfassung
Ein Nagetiermodell der Überlastung des linken Herzvolumens durch Mitralregurgitation wird berichtet. Die Mitralregurgitation kontrollierter Schwere wird induziert, indem eine Nadel von definierten Dimensionen in die vordere Packungsbeilage der Mitralklappe, in ein schlagendes Herz, mit Ultraschallführung vorrückt wird.
Zusammenfassung
Mitralregurgitation (MR) ist eine weit verbreitete Herzklappenläsion, die einen Herzumbau verursacht und zu kongestiver Herzinsuffizienz führt. Obwohl die Risiken einer unkorrigierten MR und ihrer schlechten Prognose bekannt sind, sind die Längsveränderungen in Herzfunktion, Struktur und Umbau unvollständig verstanden. Diese Wissenslücke hat unser Verständnis des optimalen Timings für die MR-Korrektur und den Nutzen, den eine frühe oder späte MR-Korrektur auf dem linken Ventrikel haben kann, eingeschränkt. Um die molekularen Mechanismen zu untersuchen, die der linksventrikulären Umgestaltung bei der Einstellung von MR zugrunde liegen, sind Tiermodelle notwendig. Traditionell wurde das Aorto-Kavalen-Fisteln-Modell verwendet, um Eine Volumenüberlastung auszulösen, die sich von klinisch relevanten Läsionen wie MR unterscheidet. MR stellt einen hämodynamischen Stressor mit niedrigem Druckvolumenüberlast dar, der Tiermodelle erfordert, die diesen Zustand imitieren. Dabei beschreiben wir ein Nagetiermodell schwerer MR, bei dem die vordere Packungsbeilage der Mitralklappe der Ratte mit einer 23G-Nadel in einem schlagenden Herzen mit echokardiographischer Bildführung perforiert ist. Die Schwere von MR wird mit der Echokardiographie bewertet und bestätigt, und die Reproduzierbarkeit des Modells wird berichtet.
Einleitung
Mitralregurgitation (MR) ist eine häufige Herzklappenläsion, diagnostiziert in 1,7% der allgemeinen US-Bevölkerung und bei 9% der älteren Bevölkerung älter als 65 Jahre1. In dieser Herzklappenläsion, unsachgemäßer Verschluss der Mitralklappen in Systole, verursacht Regurgitation von Blut aus der linken Herzkammer in den linken Vorhof. MR kann aufgrund verschiedener Ätiologien auftreten; Jedoch werden primäre Läsionen der Mitralklappe (primäre MR) diagnostiziert und häufiger behandelt als sekundäre MR2. Isolierte primäre MR ist oft eine Folge der myxomatorischen Degeneration der Mitralklappe, was zu einer Dehnung der Flugblätter oder Chordae tendineae, oder Bruch einer Chordae, die alle zum Verlust der systolischen Kotaufe der Klappe beitragen.
MR, die aus solchen Ventilläsionen resultiert, erhöht das Blutvolumen, das den linken Ventrikel in jedem Herzschlag füllt, erhöht den diastolischen Wandstress am Ende und sorgt für einen hämodynamischen Stressor, der zu einer Herzanpassung und Umgestaltung anregt. Herzumbau in dieser Läsion ist oft durch signifikante Kammervergrößerunggekennzeichnet 3,4, milde Wandhypertrophie, mit erhaltener kontraktiler Funktion für längere Zeit. Da die Auswurffraktion oft erhalten bleibt, wird die Mr-Korrektur mit chirurgischen oder transkatheteren Mitteln oft verzögert, bis Symptome wie Dyspnoe, Herzinsuffizienz und Arrhythmien auftreten. Unkorrigierte MR ist jedoch mit einem hohen Risiko von kardialen unerwünschten Ereignissen verbunden, obwohl derzeit Kenntnisse über die ultrastrukturellen Veränderungen, die diesen Ereignissen zugrunde liegen, unbekannt sind.
Tiermodelle von MR bieten ein wertvolles Modell, um solche ultrastrukturellen Veränderungen im Herzen zu untersuchen und das Längsprogressionsfortschreiten der Krankheit zu untersuchen. Zuvor, Forscher haben MR bei großen Tieren wie Schweinen, Hunden und Schafen induziert, indem sie eine externe ventriculo-atrial ehunt5, intradiale Chordal rupture6, oder Packungsbeilage Perforation7. Während chirurgische Techniken bei großen Tieren einfacher sind, beschränkten sich diese Studien auf subchronische Nachbeobachtungen in einer kleinen Stichprobengröße, da solche Studien bei großen Tieren hohe Kosten verursachten. Darüber hinaus ist die molekulare Analyse von Gewebe aus diesen Modellen aufgrund begrenzter artspezifischer Antikörper und anmerkungsbedingter Genombibliotheken für die Ausrichtung oft eine Herausforderung.
Kleine Tiermodelle von MR können eine geeignete Alternative bieten, um diese Ventilläsion und ihre Auswirkungen auf den Herzumbau zu untersuchen. Historisch wurde das Rattenmodell der Aorto-Kavallerie-Fisteln (ACF) der Kardialvolumenüberlastung verwendet. Erstmals 1973 von Stumpe et al.8beschrieben, wird eine arterio-venöse Fistel chirurgisch geschaffen, um Hochdruckarterienblut von der absteigenden Aorta in die untere Vena cava mit niedrigem Druck zu umgehen. Die hohe Durchflussrate in der Fistel induziert eine drastische Volumenüberlastung auf beiden Seiten des Herzens, was zu einer signifikanten rechten und linken ventrikulären Hypertrophie und Dysfunktion führt, die innerhalb von Tagen nach der Erstellung des ACF9auftritt. Trotz seines Erfolgs imitiert ACF nicht die Hämodynamik von MR, einer Niederdruck-Volumenüberlastung, die die Vorspannung erhöht, aber auch die Nachlast reduziert. Aufgrund dieser Einschränkungen des ACF-Modells haben wir versucht, ein MR-Modell zu entwickeln und zu charakterisieren, das die Niederdruck-Volumenüberlastung besser nachahmt.
Hierin beschreiben wir das Protokoll für ein Modell der Mitralklappenpunktion, um schwere MR bei Ratten zu schaffen10,11. Eine hypodermische Nadel wurde in das schlagende Rattenherz eingeführt und gelangte unter echokardiographischer Führung in die vordere Mitralklappenbroschüre. Die Technik ist sehr reproduzierbar und ein relativ gutes Modell, das MR nachahmt, wie es bei Patienten zu beobachten ist. Der Schweregrad des MR wird durch die Größe der Nadel gesteuert, die zur Perforation der Mitralpackung verwendet wird, und die Schwere der MR kann mit der transösophagealen Echokardiographie (TEE) beurteilt werden.
Protokoll
Die Verfahren wurden vom Animal Care and Use Program an der Emory University unter der Protokollnummer EM63Rr, Zulassungsdatum 06/06/2017, genehmigt.
1. Prächirurgische Präparation
- Dampf sterilisieren chirurgische Instrumente vor dem Eingriff.
- Am Eingriffstag Ratten vom Gehäuse in die Chirurgie bringen und wiegen.
- Zeichnen Sie präoperative und postoperative Medikamente nach dem Gewicht: zwei Dosen Carprofen (je 2,5 mg/kg), eine Dosis Gentamycin (6 mg/kg) und eine Dosis Buprenorphin (0,02 mg/kg).
- Stellen Sie sicher, dass im Gasmischer ausreichend Isofluran vorhanden ist und Sauerstoff in den Tanks für die Operation zur Verfügung steht. Ein voller Tank mit Sauerstoff (24 ft3) ist oft ausreichend.
2. Tierzubereitung
HINWEIS: Erwachsene Sprague-Dawley männliche Ratten mit einem Gewicht von 350-400 g wurden in dieser Studie verwendet. Die chirurgischen Techniken sind auf Wunsch für etwas kleinere oder größere Tiere geeignet.
- Sedate die Ratte in einer Induktionskammer mit 5% Isofluran in 1 LPM (Liter pro Minute) von 100% Sauerstoff gemischt. Bestimmen Sie ein angemessenes Sedierungsniveau von einer langsameren Atemfrequenz unter visueller Beobachtung und Verlust des Zuckens beim Kneifen der Ratte.
- Intubieren Sie die Ratte mit einem 16 G Angiocath, der für den Einsatz als Endotrachealrohr ausgestattet ist.
- Visualisieren Sie die Luftröhre und Stimmbänder mit einem Otoscope, und verwenden Sie einen Baumwollspitzen-Applikator, um Pharyngealsekrete zu löschen.
- Führen Sie das Endotrachealrohr auf einem 0,034-Zoll-Führungsdraht in die Stimmbänder ein. Sobald das Rohr in der Luftröhre entsprechend platziert ist, schieben Sie das Rohr nach innen und ziehen Sie den Draht zurück (Abbildung1).
- Legen Sie die Ratte auf das beheizte operationsbelagte Pad, das bei 37 °C gehalten wird, und schließen Sie das Endotrachealrohr an ein mechanisches Beatmungsgerät an. Geben Sie das Gewicht der Ratte in die Beatmungssteuerungssoftware ein, die die Belüftungsrate und das Gezeitenvolumen berechnet. In dieser Studie wurden 66 Atemzüge pro Minute mit einem Gezeitenvolumen von 1 ml/100 g Körpergewicht verwendet (Abbildung 1D).
- Verwenden Sie 100% Sauerstoff (1 LPM) gemischt mit 2-2,5% Isofluran als anhalant anesthetik und bestätigen Sie das Niveau der Anästhesie mit Verlust des Kiefertons und Verlust der Reaktion auf Zehenkneifung.
- Beachten Sie, dass bei richtiger Intubierung die Brustbewegung mit dem Beatmungsgerät synchronisiert werden sollte.
- Bei unsachgemäßer Intubierung wird die Brustbewegung nicht mit dem Beatmungsgerät synchronisiert. Um eine unsachgemäße Intubation zu testen, komprimieren Sie den Bauch der Ratte, wodurch ein Gegendruck auf das Beatmungsgerät entsteht und ein Überdruckalarm erzeugt wird. In diesem Szenario ziehen Sie den Angiocath sanft zurück und bringen Sie die Ratte für einige Minuten in die Induktionskammer mit 5% Isofluran zurück, um sicherzustellen, dass die Ratte ausreichend beästhebt ist, und die Ratte wieder intubieren.
- Einmal richtig intubiert, sichern Sie die Endotrachealröhre, indem Sie das proximale Ende des Rohres mit einer 4-0 Seidennaht an die Wange der Ratte nähen, um eine Extubation während des Eingriffs zu vermeiden.
- Setzen Sie eine rektale Temperatursonde ein, um die Körpertemperatur zu überwachen, und ein vierterminales Elektrokardiogramm, um das EKG während des gesamten Vorgangs zu überwachen.
- Verwenden Sie eine Deckenheizungslampe, wenn die Wärme von der chirurgischen Plattform nicht ausreicht. Schalten Sie die Lampe aus, wenn die Körpertemperatur über 37 °C steigt.
- Bewerten Sie das Elektrokardiogramm visuell für Arrhythmien oder Anzeichen einer Myokard-Ischämie. Wenn keine vorhanden sind, notieren Sie das Basiselektrokardiogramm.
- Transthorakale Echokardiographie (TTE) für die Herz-Grundfunktion (Abbildung 2A).
- Drehen Sie die Ratte in eine Supine-Position und rasieren Sie die linke Seite des Thorax. Um klare Echoansichten zu erhalten, entfernen Sie das Haar mit einer Enthaarungscreme.
- Verwenden Sie jedes Ultraschallsystem mit ausreichender Frequenz für die Bildgebung mit hoher Herzfrequenz. In dieser Studie verwendeten wir das Visualsonics 2100 System mit einer 21 MHz Sonde, die für die Kardialbildgebung bei Ratten geeignet ist.
- Erhalten Sie B-Modus-Bilder in der parasternalen Langachsenebene, um die linken ventrikulären Volumina zu berechnen. Erhalten Sie in derselben Ebene M-Modus-Bilder, um Wandabmessungen zu messen.
- Drehen Sie die Sonde um 90°, und erhalten Sie B-Modus und M-Modus parasternale Kurzachsenansichten auf der mittleren Papillarebene, um Querschnittswandabmessungen zu messen.
- Transösophageale Echokardiographie (TEE) für die Grundbildgebung durchführen (Abbildung 2B).
- Legen Sie die Ratte in die rechte Dekubitusposition und legen Sie eine 8 Fr intrakardiale Ultraschallsonde (8 MHz) mit einer kleinen Menge Gel auf die Spitze in die Speiseröhre der Ratte ein. Die Frequenz der ICE-Sonde (intrakardiale Echokardiographie) reicht aus, um 4-6 Bilder pro Herzschlag zu erhalten, die ausreichen, um die Ventilbewegung zu visualisieren.
HINWEIS: Ein GE Vivid I- oder Siemens SC2000 Prime-System kann für die ICE-Bildgebung verwendet werden. - Erhalten Sie eine hohe Ösophasollteansicht, um eine Zweikammeransicht der linken Seite des Herzens zu erhalten. Diese Ansicht ist ideal, um das linke Atrium, die Mitralklappe und den linken Ventrikel zu visualisieren. Positionieren Sie die Sonde so, dass vordere und hintere Flugblätter visualisiert werden und die Koaptation zentral ist. Dieser Winkel ermöglicht auch Dopplermessungen über das Mitralventil, ohne Winkelkorrektur.
- Messen Sie in dieser Ansicht linke Vorhofflächen und Mitralklappen-Annulus-Dimensionen.
- Führen Sie Farb-Doppler-Bildgebung durch, um die Ventilkompetenz und den Mangel an MR an der Basislinie zu bestätigen. Führen Sie gepulste Wellen- und kontinuierliche Doppler-Bildgebung durch, um den Mitralzufluss zu quantifizieren und den Mangel an regurgitanten Fluss zu bestätigen.
- Führen Sie eine B-Modus- und gepulste Wellen-Doppler-Bildgebung der Aorta durch, um den Aortenwurzeldurchmesser zu messen und den Aortenstrom zu berechnen.
- Führen Sie gepulste Wellen-Doppler-Bildgebung der Lungenvene durch, um den pulmonalen Venenfluss zu messen.
- Legen Sie die Ratte in die rechte Dekubitusposition und legen Sie eine 8 Fr intrakardiale Ultraschallsonde (8 MHz) mit einer kleinen Menge Gel auf die Spitze in die Speiseröhre der Ratte ein. Die Frequenz der ICE-Sonde (intrakardiale Echokardiographie) reicht aus, um 4-6 Bilder pro Herzschlag zu erhalten, die ausreichen, um die Ventilbewegung zu visualisieren.
- Injizieren Sie eine Einzeldosis Von Carprofen (2,5 mg/kg, SQ, nichtsteroidal entzündungshemmend), Gentamycin (6 mg/kg, SQ, Antibiotikum) und steriler Saline (1 ml, SQ), um den Blutverlust während des Eingriffs präventiv auszugleichen.
- Rasieren Sie die linke Seite des Thorax nach Bedarf, um alle verbleibenden Haare aus dem chirurgischen Feld zu entfernen. Die Rasur vom unteren Halsbereich bis zum Xyphoiden und vom linken Arm bis zum Mittleren Sternum sollte ausreichen, um ein haarfreies Feld zu gewährleisten und das Risiko einer Kontamination an den chirurgischen Stellen zu verringern.
- Schrubben Sie den Operationsbereich mit einer in Betadine getränkten Gaze, gefolgt von einer Gaze, die in 70% Ethanol getränkt ist. Schrubben Sie den Bereich in kreisförmigen Bewegungen auf der Haut, so dass die Gaze keinen zuvor geschrubbten Bereich kontaktiert.
- Wiederholen Sie diesen Schritt dreimal, um ein ausreichend steriles Feld für eine Operation zu erreichen.
- Das Tier mit sterilen Abdeckungen drapieren und ein Fenster öffnen, um in den sterilen Operationsbereich zu greifen.
3. Linke Thorakotomie
- Führen Sie den gesamten chirurgischen Eingriff mit aseptischen Techniken durch, wobei Isofluran bei 2-2,5% in 1 LPM Sauerstoff gehalten wird. Legen Sie alle Instrumente in ein steriles Fach und legen Sie sie nach jedem Gebrauch wieder in das Tablett.
- Tragen Sie sterile Handschuhe, eine Maske und eine chirurgische Kappe durch den Chirurgen für den gesamten Eingriff. Ein steriles OP-Kleid kann auch getragen werden, aber es ist optional, es sei denn, eine Kontamination ist zu erwarten.
- Verwenden Sie ein chirurgisches Skalpell mit einer No #15 Klinge, um einen Hautschnitt auf der linken Seite des Thorax zu machen, ca. 1 cm proximal zum Xyphoiden. Verwenden Sie eine stumpfe Trennspitze Schere, um die Hautschicht von der Muskelschicht zu trennen und einen Längsschnitt zu machen.
- Sezieren Sie die Muskelschichten auf die gleiche Weise, bis die Rippen freigelegt werden.
- Machen Sie vorsichtig einen 2-3 cm Längsschnitt im fünften interkostalen Raum, ausreichend, um Retraktoren einzusetzen und das Herz freizulegen.
- Verwenden Sie feine gekippte Zange, um das Perikard zu heben, und Mikroschere, um es in der Region um die Spitze des Herzens zu verbrauchen. Dieser Schritt hilft, postoperative Verklebungen des Herzens an den Brustwänden und Zwerchfell zu vermeiden.
HINWEIS: Vermeiden Sie chirurgische Schnitte in der Nähe des Brustbeins, um Blutungen zu minimieren. Die Transecting der inneren Brustarterien, die entlang des Brustbeins verlaufen, kann übermäßige Blutungen verursachen. Wenn sie mit solchen Blutungen auftreten, identifizieren Sie den Bluter und kauterisieren Sie ihn.
4. Echo geführte MR-Prozedur (Abbildung 3 & Abbildung 4)
- Verwenden Sie eine 6-0 Prolen-Naht und einen Mikronadelhalter, um eine Geldbörse Naitennaht auf der Spitze der linken Herzkammer zu platzieren. Verwenden Sie bei Bedarf Mikrozange, um das Herz zu stabilisieren.
- Binden Sie vorsichtig die apikale Naht, um den Scheitelpunkt zu stabilisieren und legen Sie eine 23 G Nadel (mit Herzigkeit gespült, und mit einem Hahn an seinem distalen Ende) in der Mitte der Geldbörse String Naht, in die linke ventrikuläre Höhle.
- Verwenden Sie eine Hand, um die Nadel stabil zu halten und zu führen, und die andere Hand, um gleichzeitig die transösophageale Echosonde zu manipulieren, um eine optimale Echoansicht zu erzielen, um die Nadel zu visualisieren, wie oben beschrieben.
- Mit Echtzeit-Ultraschallführung, bewegen Sie die Nadel in Richtung der ventrikulären Seite der vorderen Mitral-Broschüre. Sobald die Nadelposition auf Ultraschall bestätigt ist, fördern Sie die Nadel in einer feinen Bewegung durch die Ventilpackung. Wenn ein Widerstand gefühlt wird, drehen Sie die Nadel, wie sie in die Packungsbeilage vorgeschoben wird, um sie zu perforieren.
HINWEIS: Das Vorrücken der Nadel in das linke Atrium könnte zu einer vorgerichtlichen Perforation führen, was zu übermäßigen Blutungen und tiertodt. Die Nadel sollte jederzeit auf Ultraschall visualisiert werden. - Ziehen Sie die Nadel in die linke ventrikuläre Kammer, weg von der Mitralklappe, und bestätigen Sie MR, indem Sie die Farb-Doppler-Bildgebung aktivieren.
- Wenn MR bei der Farb-Doppler-Bildgebung nicht zu sehen ist, wiederholen Sie die Schritte 4.4 und 4.5. Passen Sie die Echosonde bei Bedarf an, um eine bessere Ansicht zu erhalten. Nach der Praxis bei wenigen Ratten ist es möglich, eine Packungsbeilage in einer Bewegung der Nadel zu induzieren, was ein Loch induziert, das die Größe des Äußeren Durchmessers der Nadel hat. Dies wurde nach der Nekropsie der Rattenherzen bestätigt.
- Sobald MR bestätigt ist, ziehen Sie die Nadel aus der linken ventrikulären Höhle und binden Sie vorsichtig die Geldbörse String Naht.
- Verwenden Sie eine sterile Gaze, um Blut auf der Spitze und in der Brusthöhle einzuweichen.
HINWEIS: Das Berühren der Echosonde mit den chirurgischen Handschuhen kann zu einer Kontamination der sterilen Umgebung führen. Sprühen Sie Ihre Handschuhe mit 70% Ethanol oder ersetzen Sie die Handschuhe durch neue, entsprechend.
5. Tierrückgewinnung und postoperative Pflege
- Nach 5-10 Minuten stabiler Herzfunktion (normales EKG und Herzfrequenz) die Thorakotomie in Schichten mit 4-0 Vicryl schließen und Isofluran in Schritten reduzieren.
- Verwenden Sie eine unterbrochene Naht, um die Rippen anzunähern, wobei Isofluran bei 2% gehalten wird. Setzen Sie ein Brustrohr in den sechsten interkostalen Raum ein und sichern Sie es an den sterilen Vorhängen, um ein unbeabsichtigtes Eindringen des Rohres in die Brusthöhle zu vermeiden.
- Verwenden Sie eine kontinuierliche Naht, um die Muskelschicht mit Isofluran bei 1,5% zu schließen.
- Verwenden Sie eine kontinuierliche Naht, um die Hautschicht mit Isofluran zu schließen, der bei 1% gehalten wird.
- Schließen Sie eine 10 ml Luer-Lock-Ventil-Kippspritze an das Brustrohr an und entleeren Sie 10-12 ml Luft aus der Brusthöhle und entfernen Sie dann das Brustrohr.
- Eine Enddosis Carprofen (2,5 mg/kg, SQ) verabreichen und Isofluran ausschalten.
- Setzen Sie die mechanische Beatmung fort, während die Ratte von der Anästhesie entwöhnt wird, und überwachen Sie die Vitalzeichen (SpO2 und Herzfrequenz). Zu Beginn der spontanen Atmung, schalten Sie die Beatmung aus, um die Fähigkeit der Ratte zu testen, eine solche Atmung und gute SpO2aufrechtzuerhalten.
- Wenn die SpO2-Pegel unter 90 % fallen, schalten Sie das Beatmungsgerät ein. Sobald die Ratte in der Lage ist, SpO2-Pegel ohne Belüftung zu halten, wird die Verankerungsnaht am Endotrachealrohr geschnitten und das Tier für die Extubation vorbereitet.
- Sobald die Ratte Anzeichen von Wachsamkeit zeigt, einschließlich Schnurrbart oder Augenbewegungen, extubieren Sie das Tier.
- Legen Sie einen Nasenkegel mit 100% Sauerstoff, bis die Ratte ambulant ist.
- Übertragen Sie die Ratte in einen sauberen Käfig mit minimaler Bettwäsche und überwachen Sie weiterhin Vitalzeichen mit einem Handmonitor SpO2, der auf den Fuß oder Schwanz der Ratte gelegt wird, bis die Ratte ambulant ist.
HINWEIS: Wenn Nebenwirkungen der Operation beobachtet werden, können Tiere eine längere Erholungszeit haben und länger dauern, um hohe SpO2-Spiegel zu halten. In diesem Fall kann ein Nasenkegel mit 100% Sauerstoff aufgetragen werden, bis die SpO2-Spiegel stabil sind. - Um das Verletzungsrisiko an der operationsfolgenden Stelle zu reduzieren und das Infektionsrisiko zu vermeiden, ratten nach der Operation.
- Verabreichen Sie Buprenorphin innerhalb von 3 h, nachdem die Ratte wach und ausreichend ambulant ist. Buprenorphin kann Atemnot verursachen, wenn es früh in der perioperativen Erholungsphase verabreicht wird, und verzögert es daher, bis die Ratte ohne Schwierigkeiten atmet.
- Nach der Operation erhalten alle Tiere folgende Medikamente: Gentamicin (6 mg/kg, SQ, SID POD 1-3) und Rimadyl (5 mg/kg, SQ, SID POD 1-3). Alle Tiere werden einmal täglich für fünf Tage nach der Operation zur Untersuchung von Schnittstellen und einmal täglich für die ersten zwei Wochen nach der Operation zur Schmerzbeurteilung beobachtet.
6. Validierung des MR-Schweregrads mit Echokardiographie (Abbildung 5)
- Wiederholen Sie TEE nach zwei Wochen nach der Operation mit den gleichen Schritten gemäß Abschnitt 2.7. Zwei Wochen nach der Operation ist ausreichend Zeit für die Hämodynamik zu stabilisieren.
- Erhalten Sie Farb-Doppler-Bildgebung auf einer 2-Kammer-Ansicht mit transösophagealer Ultraschall-Bildgebung, die visualisierung den linken Ventrikel und linken Vorhof. Messen Sie die Fläche des linken Atriums und des MR-Jets. Berechnen Sie den MR-Jet-Flächenanteil mit
 (1)
(1)
Schwere MR ist definiert als MR-Jet-Fläche von 30%. - Ungefähre Fläche der regurgitanten Öffnung durch Berechnung der Fläche von 23 G Nadel, mit dem Außendurchmesser der Nadel. Diese Gleichung geht davon aus, dass die Fläche der regurgitanten Öffnung gleich der Fläche der 23G-Nadel ist.
 (2)
(2) - Erhalten Sie eine kontinuierliche Doppler-Bildgebung mit dem Doppler-Tor an der Öffnung des regurgitanten Strahls. Verfolgen Sie die Wellenform, um VTI des regurgitanten Jets zu berechnen. Das MR-Volumen kann mit
 (3)
(3)
Schwere MR ist definiert als MR-Volumen von 95 L. - Erhalten Sie pulswellen-Doppler-Bildgebung der Lungenvene, indem Sie die Echosonde seitlich im Uhrzeigersinn drehen. Messen Sie die systolischen und diastolischen Wellengeschwindigkeiten und verwenden Sie die folgende Gleichung, um das Verhältnis zu berechnen.
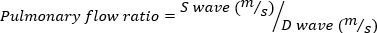 (4)
(4)
Ein negatives Lungendurchflussverhältnis weist auf eine schwere MR hin.
7. Scheinchirurgie
- Führen Sie die Abschnitte 1-3 wie beschrieben aus.
- Änderung Abschnitt 4 wurde so modifiziert, dass die 23 G Nadel in die linke ventrikuläre Kammer eingeführt wird, durch eine Geldbörse String Naht auf der linken ventrikulären Spitze, aber nicht in die Mitralklappe vorgerückt, um MR zu erstellen. Setzen Sie die Nadel in die linke ventrikuläre Kammer und ziehen Sie sofort, nach dem Anziehen und Verschluss der ventrikulären Spitze.
- Führen Sie Abschnitt 5 wie beschrieben aus.
- Führen Sie eine Mitralklappenbewertung durch, wie in Abschnitt 6 beschrieben. MR sollte jedoch bei keinem der Tiere vorhanden sein, daher ist eine Quantifizierung wie beschrieben nicht erforderlich.
Ergebnisse
Machbarkeit und Reproduzierbarkeit
Das vorgeschlagene MR-Modell ist sehr reproduzierbar, wobei ein gut definiertes Loch in der Mitralpackung bei 100% der in dieser Studie verwendeten Ratten erreicht wird. Abbildung 6A zeigt die Richtung der Nadel, wie sie in die Mitralklappe eingeführt wird. Abbildung 6B zeigt ein Loch in der Mitralklappenbroschüre einer repräsentativen Ratte, die 2 Wochen nach dem Eingriff explantiert wurde.
Überleben & unerwünschte Ereignisse
Sechzehn Ratten wurden mit DEN beschriebenen Methoden mit MR induziert. Schwere MR wurde in allen Ratten erstellt. Eine Ratte starb innerhalb einer Stunde nach der Entstehung von MR an akutem Atemversagen. Daher betrug das Gesamtüberleben nach 2 Wochen nach der Erstellung von MR 93,75%. Mortalität oder größere kardiale Nebenwirkungen wie Blutungen, Arrhythmien oder Schlaganfall wurden bei keinem Tier in den zwei Wochen der Beobachtung beobachtet.
Schweregrad der Mitralregurgitation
Tabelle 1 fasst das hämodynamische Profil des linken Herzens zu Beginn und 2 Wochen nach der Induktion von MR zusammen. Ein gepaarter t-Test wurde verwendet, um die statistische Signifikanz zwischen Baseline und MR-Schweregrad nach 2 Wochen zu bestimmen, mit einer statistischen Signifikanz, die als p < 0,05 definiert ist. Ein MR-Jet war zwei Wochen nach der Operation lebhaft, mit einer durchschnittlichen Fläche von 21,15 x 8,11 mm2 (p < 0,0001 im Vergleich zum Ausgangswert) und einem mittleren Geschwindigkeitszeitintegral von 39,72 x 7,52 cm. Die normalisierte MR-Fraktion nach 2 Wochen betrug 41,91 x 8,3 %, was nach den Richtlinien der American Society of Echocardiography als streng gilt. Der Schweregrad von MR war ausreichend, um eine Lungenflussumkehr zu induzieren, mit einer Abnahme des S/D-Verhältnisses von 0,91 x 0,17 zu Beginn auf -0,69 bis 0,65 nach 2 Wochen (p < 0,0001).
Herzkammerumbau
Abbildung 7 zeigt morphologische Veränderungen in einem repräsentativen Herzen nach schwerer MR für 2 Wochen, im Vergleich zu einem Herz von einer Ratte, die sich einer Scheinoperation unterzog. Nach zwei Wochen nach der Operation war das Herz der Ratte mit MR kugelförmig und stark erweitert, mit einem Anstieg des Enddiastolischen Volumens um 29,65 % (Basis-EDV: 462,49 x 39,62 l; und nach 2 Wochen MR EDV: 599,79 x 58,59 ,L, p < 0,0001). Das Endsystolvolumen erhöhte sich um 10,06 %, von 153,90 bis 18,78 l zu Beginn, auf 169,36 x 24,64 l (p = 0,01) nach 2 Wochen nach der MR-Induktion. Die Hyperkontraktilität des Herzens wurde in den ersten zwei Wochen erwartungsgemäß aufgrund einer Nachlastreduktion beobachtet, wie sich aus einer erhöhten Auswurffraktion ergibt (66,77 x 2,02 % zu Beginn bis 71,82 x 2,31 % nach 2 Wochen (p < 0,0001)). Die Exposition gegenüber MR für zwei Wochen erhöhte den linken Vorhofbereich um 99,59% (p < 0.0001).

Abbildung 1: Intubationstechnik. (A) A 16 G Angiocath mit einem Führungsdraht, der für die endotracheale Intubation in diesem Rattenmodell verwendet wird; (B) Bild der Pharyngealansicht mit einem Otoscope und des Zielbereichs zum Einfügen des Endotrachealrohrs; (C) Endgültige Konfiguration des Endotrachealrohrs; (D) Befestigung des Endotrachealrohres am mechanischen Beatmungsgerät. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Transthorakale und transösophageale Bildgebung. Transthorakale Bildgebung: (A1) Einrichtung für transthorakale Abbildung der Ratte, die den Winkel der Bildsonde darstellt; (A2) Parasternale Lange-Achsen-Ansicht des Herzens; (A3) Kurze Achsenansicht des Herzens. Transösophageale Bildgebung: (B1) 8 Fr intrakardiale Echosonde mit Sonde, die in die Speiseröhre eingeführt wird, während das Tier intubiert ist; (B2) Hohe Ösophatraumansichten des linken Herzens, die das linke Vorhöf, die Mitralklappe und den linken Ventrikel darstellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Chirurgischer Eingriff. (A) Chirurgisches Layout mit linker Thorakotomie im5. interkostalen Raum und ICE-Katheter in die Speiseröhre der Ratte zur Bildführung und eine 23 G Nadel, die in die LV-Spitze eingeführt wird, wo die Zahnersatz-Nähte platziert werden. (B) Chirurgische Ansicht während der transösophagealen Echo geführte Prospektperforation. (C) Echokardiographisches Bild der Nadeleinfügung in den linken Ventrikel in Diastole. (D) Echokardiographisches Bild der Nadeleinfügung in den linken Ventrikel in Systole. (E) Echokardiographisches Bild der Nadel durchbohrt durch die vordere Packungsbeilage. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
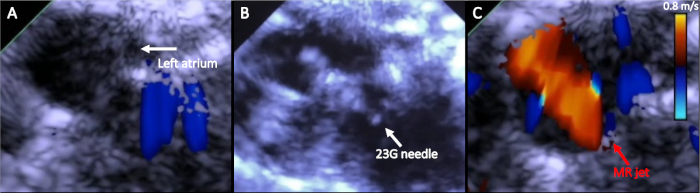
Abbildung 4: Abbildung des Verfahrens. (A) Baseline Echo 2 Kammeransicht vor der Erstellung von MR; (B) 23 G Nadel, visualisiert auf Echo während schlagen des Herzens, in das linke Vorhof durch die vordere Mitralklappe Blattblatt vorgerückt; (C) Farbdoppler-Bildgebung, die MR-Jet in Systole zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
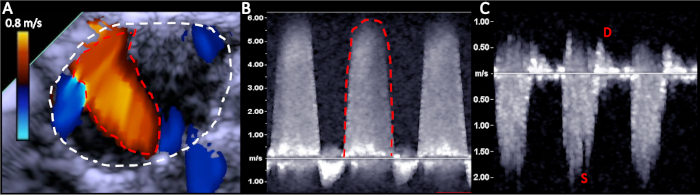
Abbildung 5: Repräsentative Echobilder zur Validierung des MR-Schweregrads nach 2 Wochen nach der Operation. (A) Linke Strialfläche in weiß und MR-Jet-Bereich in rot zurückverfolgt; (B) MR VTI-Spur rot; (C) Lungenfluss mit systolischer Umkehrung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Nadelpunktion. (A) Ausrichtung der Nadelpunktion auf einem ex vivo Herz. Nadel durchbohrt durch Spitze des LV in einem Winkel, ein Längsabschnitt des LV mit der Nadel in Richtung der Mitralklappe Blattblatt gerichtet, und die Nadel durch die Mitralklappe Packungsbeilage in den Vorhofraum durchbohrt. (B) Repräsentatives Explant-Foto, das ein Loch in der vorderen Mitralbroschüre zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Bruttomorphologie ganzer Herzen einer scheinbetriebenen Kontrollratte (A) und einer Ratte, die sich 2 Wochen nach der Operation einer MR-Operation (B) unterzog. Die Ratte mit schwerer MR hat eine signifikante linksventrikuläre Dilatation und Kammervergrößerung im Vergleich zur Scheinkontrolle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Ausgangsbasis (n = 15) | 2wk MR (n = 15) | p-Wert | |
| Linker Vorhofbereich (mm2) | 25,03 € 8,70 | 49,95 € 14,78 | p < 0,0001 |
| MR-Strahlfläche (mm2) | 0 | 21,15 € 8,11 | p < 0,0001 |
| MR-Anteil (%) | 0 | 41,91 x 8,30 | p < 0,0001 |
| MR VTI (cm) | 0 | 39,72 € 7,52 | p < 0,0001 |
| S-Welle (m/s) | 0,39 € 0,07 | -0,51 € 0,41 | p < 0,0001 |
| D-Welle (m/s) | 0,44 € 0,04 | 0,70 € 0,17 | p < 0,0001 |
| S/D-Wellenverhältnis | 0,91 € 0,17 | -0,69 € 0,65 | p < 0,0001 |
Tabelle 1: Mitralregurgitationseigenschaften.
Diskussion
Es wird ein reproduzierbares Nagetiermodell schwerer MR mit gutem Überleben (93,75% Überleben nach einer Operation) und ohne signifikante postoperative Komplikationen berichtet. Echtzeit-Bildgebung mit transösophagealer Echokardiographie und die Einführung einer Nadel in das schlagende Herz zur Punktion der Mitralbroschüre sind machbar und können gelehrt werden. Schwere MR wurde mit der 23 G Nadelgröße in dieser Studie hergestellt, die nach Belieben mit einer kleineren oder größeren Nadel variiert werden kann. MR induziert in diesem Modell erzeugt eine Niederdruckvolumenüberlastung auf dem linken Ventrikel, die eine bessere Darstellung der klinisch beobachteten Mitralklappenläsionen ist. Schwere linke Vorhof- und linksventrikuläre Dilatation werden innerhalb von zwei Wochen nach MR-Beginn in diesem Modell beobachtet, jedoch ohne kontraktile Dysfunktion, gemessen durch Auswurffraktion. Analog zu einer solchen Situation sind Patienten mit primärer MR, die asymptomatisch ohne Herzinsuffizienz für längere Zeit bleiben, trotz fortschreitender Erweiterung ihrer linken Herzkammern.
Dieses MR-Modell der Volumenüberlast unterscheidet sich in mehrfacher Hinsicht vom weit verbreiteten Aorto-Kavalenfizistel-Modell der Volumenüberlast. Die Verfahrenserleichterung von ACF, die eine einfache Laparotomie ohne Intubation und mechanische Belüftung erfordert, hat seine Annahme durch die wissenschaftliche Gemeinschaft gefördert12. Trotz seiner klaren verfahrenstechnischen Vorteile schiebt die arterio-venöse Fistel eine große Menge Blut in die Vena cava, die das venöse Reservoir und auch den rechten Ventrikel überlastet. Erhöhter zentraler venöser Druck durch venöse Verstopfung kann Leberverstopfung und suboptimale Nierenfiltration verursachen, die Leberfibrose oder Aktivierung des Renin-Angiotensin-Aldosteron (RAAS)-Systems verursachen kann. Die verwirrende Wirkung des RAAS-Systems auf die ventrikuläre arterielle Kopplung ist bekannt, so dass das ACF-Modell keine echte Volumenüberlastung des linken Ventrikels zeigt, wie es bei der Einstellung der Mitralregurgitation zu sehen ist. Im Vergleich zum Mitralklappen-Defektmodell unterscheidet der Mangel an Nachlastreduktion dieses Modell weiter von der klinischen Situation von MR. Insgesamt führt eine signifikante unterschiedliche hämodynamische Belastung des LV im ACF-Modell zu schnellen Veränderungen mit ausgeprägter Hypertrophie, Dilatation und Dysfunktion, die in unserem Modell13nicht beobachtet wurden.
Neben der Neuheit, MR mit einem Nadelstab einzuführen, hat unser Modell mehrere Anwendungen bei der Beantwortung klinisch wichtiger Fragen. Patienten mit primärer MR, die aus einer Mitralklappenläsion hervorgehen, sind oft über einen längeren Zeitraum asymptomatisch und erhalten erst zu Beginn der Lungen- oder Herzinsuffizienzsymptome eine Korrektur ihrer MR. Jüngste klinische Daten deuten darauf hin, dass eine solche verzögerte Mr-Korrektur trotz Ermüdungsentlastung und Symptomen keine funktionelle Wiederherstellung des linken Ventrikels ermöglicht14. In einer aktuellen Studie mit diesem Nagetiermodell haben wir gezeigt, dass MR eine schnelle und frühzeitige Umgestaltung der kardialen extrazellulären Matrix einführt, die ein Vorläufer struktureller Veränderungen in der linken Herzkammer10ist. Solche mechanistischen Erkenntnisse, die eine physiologische Grundlage für die Intervention mitderraler Ventile bieten, können mit diesem Modell entwickelt werden. In Kombination mit der kardialen Bildgebung ist es möglich, Biomarker zu entwickeln, die diese frühen linksventrikulären Veränderungen darstellen, um den Zeitpunkt der Intervention zu leiten. Darüber hinaus kann dieses MR-Modell mit ventrikulären Kardiomyopathien wie ischämischen, nicht-ischämischen und anderen Ätiologien kombiniert werden, um die Wirkung von MR auf den Umbau von erkrankten linken Ventrikeln zu verstehen. Zum Beispiel ist sekundäre MR, ein häufiges Auftreten in myopathischen Ventrikeln nach einem Infarkt oder mit chronischer Ischämie, eine Läsion, die klinisch schwierig zu handhaben ist. Ob MR ein Zuschauer in diesem Krankheitszustand und ein Produkt von LV Dysfunktion ist, oder ob es aktiv zum Herzumbau beiträgt, sind umstritten. Kürzlich haben wir dieses MR-Modell erweitert, um zu untersuchen, ob sich die Herz-Infarkt-Herzen mit MR in ihrem kardialen Remodellierungspotenzial im Vergleich zu denen ohne MR11unterscheiden, um mögliche Mechanismen zur Verschlechterung der Herzinsuffizienz bei Patienten mit MR aufzuklären.
Wie bei jedem experimentellen Modell gibt es einige Vorteile und Einschränkungen, die bei der Anwendung von Ergebnissen von Tieren auf den Menschen berücksichtigt werden sollten. Der klare Vorteil dieses Modells ist die reproduzierbare Schwere von MR, die hilft, Herzkammer-Umgestaltung bei klinisch diagnostizierten Erkrankungen wie primäre MR von Chordalbruch zu verstehen. Der in diesem Modell beobachtete Anstieg der Herzkammervolumina und die im Myokard beobachtete extrazelluläre Matrixumgestaltung stellen die zuvor beobachteten Veränderungen bei größeren Tieren und Menschen mit primärem MR14,15dar. Die Einschränkung dieses Prospektperforationsmodells besteht darin, dass sich MR akut entwickelt und nur eine Untergruppe von Patienten mit primärem MR an akutem Chordalbruch darstellt. Ungeachtet der Einschränkungen ist der akute Beginn der MR für eine signifikant große Patientenpopulation, die sich Mitralklappeneingriffen unterziehen, und dieses Modell ist für eine solche Situation sehr relevant. Eine weitere Einschränkung dieses Modells ist, dass MR nicht reversibel oder reparierbar ist, was keine Studien über die Wirkung oder den Zeitpunkt eines Eingriffs auf den Herzumbau ermöglicht.
Offenlegungen
M.P ist Berater von Heart Repair Technologies (HRT), für den er Beratungshonorare erhalten hat. HRT spielte in dieser Studie keine Rolle und stellte auch keine Mittel zur Unterstützung dieser Arbeit bereit.
Danksagungen
Diese Arbeit wurde durch Zuschüsse 19PRE34380625 und 14SDG20380081 von der American Heart Association an D finanziert. Corporan bzw. M. Padala gewährt M135145, HL133667 und HL140325 von den National Institutes of Health und M. Padala Infrastrukturfinanzierungen vom Carlyle Fraser Heart Center am Emory University Hospital Midtown.
Materialien
| Name | Company | Catalog Number | Comments |
| 23G needle | Mckesson | 16-N231 | |
| 25G needle, 5/8 inch | McKesson | 1031797 | |
| 4-0 vicryl | Ethicon | J496H | |
| 6-0 prolene | Ethicon | 8307H | |
| 70% ethanol | McKesson | 350600 | |
| ACE Light Source | Schott | A20500 | |
| ACUSON AcuNav Ultrasound probe | Biosense Webster | 10135936 | 8Fr Intracardiac echo probe |
| ACUSON PRIME Ultrasound System | Siemens | SC2000 | |
| Betadine | McKesson | 1073829 | |
| Blunted microdissecting scissors | Roboz | RS5990 | |
| Buprenorphine | Patterson Veterinary | 99628 | |
| Carprofen | Patterson Veterinary | 7847425 | |
| Chest tube (16G angiocath) | Terumo | SR-OX1651CA | |
| Disposable Surgical drapes | Med-Vet | SMS40 | |
| Electric Razor | Oster | 78400-XXX | |
| Gentamycin | Patterson Veterinary | 78057791 | |
| Heat lamp with table clamp | Braintree Scientific | HL-1 120V | |
| Hemostatic forceps, curved | Roboz | RS7341 | |
| Hemostatic forceps, straight | Roboz | RS7110 | |
| Induction chamber | Braintree Scientific | EZ-1785 | |
| Injection Plug, Cap, Luer Lock | Exel | 26539 | |
| Isoflurane | Patterson Veterinary | 6679401725 | |
| Mechanical ventilator | Harvard Apparatus | Inspira ASV | |
| Microdissecting forceps | Roboz | RS5135 | |
| Microdissecting spring scissors | Roboz | RS5603 | |
| Needle holder | Roboz | RS6417 | |
| No. 15 surgical blade | McKesson | 1642 | |
| Non-woven sponges | McKesson | 446036 | |
| Otoscope | Welch Allyn | 23862 | |
| Oxygen | Airgas Healthcare | UN1072 | |
| Pulse Oximeter | Nonin Medical | 2500A VET | |
| Retractor, Blunt 4x4 | Roboz | RS6524 | |
| Rodent Surgical Monitor | Indus Instruments | 113970 | The integrated platform allows for monitoring of vital signs and surgical warming |
| Scale | Salter Brecknell | LPS 150 | |
| Scalpel Handle | Roboz | RS9843 | |
| Silk suture 3-0 | McKesson | 220263 | |
| Small Animal Anesthesia System | Ohio Medical | AKDL03882 | |
| Sterile saline (0.9%) | Baxter | 281322 | |
| Sugical Mask | McKesson | 188696 | |
| Surgical cap | McKesson | 852952 | |
| Surgical gloves | McKesson | 854486 | |
| Syringe 10mL | McKesson | 1031801 | |
| Syringe 1mL | McKesson | 1031817 | |
| Ultra-high frequency probe | Fujifilm Visualsonics | MS250 | |
| Ultrasound gel | McKesson | 150690 | |
| VEVO Ultrasound System | Fujifilm Visualsonics | VEVO 2100 |
Referenzen
- Nkomo, V. T., et al. Burden of valvular heart diseases: a population-based study. Lancet. 368 (9540), 1005-1011 (2006).
- Zamorano, J. L., et al. Mechanism and Severity of Mitral Regurgitation: Are There any Differences Between Primary and Secondary Mitral Regurgitation? The Journal of Heart Valve Disease. 25 (6), 724-729 (2016).
- Grossman, W., Jones, D., McLaurin, L. P. Wall stress and patterns of hypertrophy in the human left ventricle. Journal of Clinical Investigation. 56 (1), 56-64 (1975).
- Carabello, B. A. Concentric versus eccentric remodeling. Journal of Cardiac Failure. 8 (6), S258-S263 (2002).
- Braunwald, E., Welch, G. H., Sarnoff, S. J. Hemodynamic effects of quantitatively varied experimental mitral regurgitation. Circulation Research. 5 (5), 539-545 (1957).
- Sasayama, S., Kubo, S., Kusukawa, R. Hemodynamic and angiocardiographic studies on cardiodynamics: experimental mitral insufficiency. Japanese Circulation Journal. 34 (6), 513-530 (1970).
- Hennein, H., Jones, M., Stone, C., Clark, R. Left ventricular function in experimental mitral regurgitation with intact chordae tendineae. Journal of Thoracic and Cardiovascular Surgery. 105 (4), 624-632 (1993).
- Stumpe, K. O., Sölle, H., Klein, H., Krück, F. Mechanism of sodium and water retention in rats with experimental heart failure. Kidney International. 4 (5), 309-317 (1973).
- Abassi, Z., Goltsman, I., Karram, T., Winaver, J., Hoffman, A. Aortocaval fistula in rat: A unique model of volume-overload congestive heart failure and cardiac hypertrophy. Journal of Biomedicine and Biotechnology. 2011 (January), 1-13 (2011).
- Corporan, D., Onohara, D., Hernandez-Merlo, R., Sielicka, A., Padala, M. Temporal changes in myocardial collagen, matrix metalloproteinases, and their tissue inhibitors in the left ventricular myocardium in experimental chronic mitral regurgitation in rodents. American Journal of Physiology - Heart and Circulatory Physiology. 315 (5), H1269-H1278 (2018).
- Onohara, D., Corporan, D., Hernandez-Merlo, R., Guyton, R. A., Padala, M. Mitral Regurgitation Worsens Cardiac Remodeling in Ischemic Cardiomyopathy in an Experimental Model. The Journal of Thoracic and Cardiovascular Surgery. , (2019).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovascular Research. 24 (5), 430-432 (1990).
- Brower, G. L., Janicki, J. S. Contribution of ventricular remodeling to pathogenesis of heart failure in rats. American Journal of Physiology-Heart and Circulatory Physiology. 280 (2), H674-H683 (2001).
- McCutcheon, K., et al. Dynamic changes in the molecular signature of adverse left ventricular remodeling in patients with compensated and decompensated chronic primary mitral regurgitation. Circulation Heart Failure. 12 (9), (2019).
- McCutcheon, K., Manga, P. Left ventricular remodeling in chronic primary mitral regurgitation. Cardiovascular Journal of Africa. 29 (1), 51-64 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten