Method Article
Analisi della funzione cellulare satellitare durante la rigenerazione muscolare scheletrica mediante lesione cardiotossina e iniezione di siRNA auto-consegnante In Vivo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Descriviamo un metodo in vivo per studiare la perdita funzionale di un gene specifico nelle cellule satellitari utilizzando una combinazione di lesione mediata dalla cardiotossina del muscolo scheletrico e l'iniezione di un siRNA auto-disporsi.
Abstract
Il muscolo scheletrico possiede un'enorme capacità di rigenerarsi dopo un infortunio. Questo processo è guidato principalmente da cellule staminali muscolari, anche definite cellule satellitari. Le cellule satellitari sono caratterizzate dall'espressione del fattore di trascrizione Pax7 e dalla loro posizione sotto la lamina basale nel muscolo scheletrico a riposo. In caso di lesioni, le cellule satellitari si attivano, subiscono l'auto-rinnovamento o la differenziazione per formare nuove miofibre o per fondersi con quelle danneggiate. La funzionalità delle cellule satellitari in vivo può essere studiata utilizzando un modello di lesione basato sulla cardiotossina del muscolo scheletrico. Per studiare la funzione di un gene durante la rigenerazione del muscolo scheletrico, vengono utilizzati principalmente modelli murini transgenici. Qui, presentiamo un metodo alternativo ai topi transgenici, per studiare la funzione genica nelle cellule satellitari durante la rigenerazione, ad esempio nei casi in cui i topi transgenici non sono disponibili. Uniamo la lesione mediata dalla cardiotossina di uno specifico muscolo scheletrico con l'iniezione di un siRNA auto-condurso nel muscolo rigenerante che viene poi assorbito dalle cellule satellitari tra le altre cellule. Di conseguenza, forniamo un metodo per analizzare la funzione genica nelle cellule satellitari durante la rigenerazione in condizioni fisiologiche senza la necessità di topi transgenici.
Introduzione
Il muscolo scheletrico è il tessuto più grande del corpo che rappresenta circa il 40% del peso corporeo totale che consente la locomozione volontaria. L'architettura tissutale del muscolo scheletrico è composta principalmente da miofibre postmitotiche, differenziate terminalmente e multinulettive, nonché da varie altre cellule del sistema nervoso periferico, del sistema vascolare e delle cellule interstitiali1. È importante sottolineare che il muscolo scheletrico ha un'enorme capacità di rigenerare e ripristinare la funzione in caso di lesioni o danni2. Questo processo dipende dal tessuto residente cellule staminali muscolari chiamate anche cellule satellitari3,4. Le cellule satellitari si trovano tra la miofibra e la lamina basale e caratterizzate dall'espressione del fattore di trascrizione Pax75,6,7. In condizioni omeostatiche, le cellule satellitari sono quiescenti ma si attivano a causa di lesioni traumatiche, ad esempio, attraverso esercizi eccentrici o sperimentalmente attraverso l'iniezione del veleno di serpente cardiotossina6,8. Una volta attivate, le cellule satellitari positive Pax7 coesprimono MyoD e Myf5, che impegna le cellule staminali alla differenziazione miogenica. Le cellule satellitari che resistono all'apmappa dei fattori di impegno manterranno il loro potenziale di stelo e torneranno a quiescenza per ricostituire il pool di cellule staminali per le esigenze future. Dopo l'espansione del pool di progenitori miogenici, le reti trascrizionali sono attivate da fattori di differenziazione come La miogenina per avviare l'uscita del ciclo cellulare e la differenziazione dei terminali. Questi mioprogenitori si fondono l'uno con l'altro o con le miofibre esistenti che contribuiscono ai mionuclei per mantenere le dimensioni del dominio mionucleare. Le miofibre esprimono geni di differenziazione muscolare terminale come Myosin Heavy Chain. Infine, le miofibre appena formate crescono e maturano per costruire le unità funzionali del muscolo scheletrico9,10.
La rigenerazione del muscolo scheletrico può essere influenzata da varie condizioni tra cui malattie muscolari o invecchiamento11,12, che vanno da lievi menomazioni a condizioni di pericolo di vita, ad esempio, nella distrofia muscolare di Duchenne13 , 14.Pertanto, la medicina rigenerativa mira a ripristinare il tessuto muscolare scheletrico danneggiato o malfunzionante utilizzando la sua potenza rigenerativa intrinseca prendendo di mira la funzione cellulare satellitare15,16. Per utilizzare il suo pieno potenziale è necessaria una comprensione completa delle cellule satellitari nella loro nicchia endogena durante la rigenerazione del muscolo scheletrico. Sebbene esistano approcci sperimentali per isolare le cellule satellitari adiacenti alle loro miofibre17,la piena complessità delle interazioni cellulari e sistemiche delle cellule satellitari con il loro ambiente può essere riassunta solo in vivo. A tale proposito, grande conoscenza della rigenerazione muscolare scheletrica è stata acquisita utilizzando i modelli di lesioni del topo2,18.
Qui introduciamo uno specifico modello sperimentale di lesione del topo per studiare la rigenerazione mediata delle cellule staminali del danno indotto dalla cardiotossina del muscolo anteriore tibialis in vivo. La cardiotossina, una tossina citolitica derivata da serpente che causa la depolarizzazione della miofibra e la necrosi, viene iniettata nel muscolo tibialis anteriore, che a sua volta innescherà la degenerazione del tessuto seguita dalla rigenerazione. Per analizzare la funzione dei geni durante la rigenerazione acuta, i siRNA auto-consegnanti vengono iniettati il giorno 3 dopo la lesione, al culmine dell'espansione delle cellule satellitari. Gli animali sperimentali vengono sacrificati in vari momenti e i muscoli anteriori tibiali vengono raccolti. I muscoli sezionati vengono congelati ed elaborati per un'ulteriore crio-sezione. La microscopia a immunofluorescenza viene quindi utilizzata per analizzare i marcatori di rigenerazione. Questo metodo consente di sforare la funzione di un singolo gene durante la rigenerazione del muscolo scheletrico guidato da cellule satellitari utilizzando topi di tipo selvatico.
Protocollo
Tutte le procedure sugli animali sono state approvate dal Dipartimento per il Benessere Animale del Landesamt f'r Lebensmittelsichecherheit und Verbraucherschutz (03-048/16; TLV; Bad Langensalza, Germania).
1. Lesione muscolare indotta da cardiotossina
NOT: Eseguire tutti gli esperimenti che coinvolgono topi viventi in conformità con la legge nazionale sul benessere degli animali e in condizioni asettiche appropriate. Inoltre, il sacrificio degli animali deve essere effettuato in conformità con la legge nazionale sul benessere degli animali.
- Disinfettare la scatola di inalazione utilizzata per l'anestesia per inalazione e l'area di chirurgia con il 70% di etanolo. Posizionare un panno chirurgico sterile sul pad di riscaldamento dove avrà luogo l'intervento chirurgico.
- Accendere il riscaldamento a 37 gradi centigradi.
- Somministrare analgesici (ad esempio, 1 mg/kg di peso corporeo meloxicam sottocutaneamente) 15 min prima dell'inizio dell'intervento.
NOT: Per un esperimento tipico, utilizzare topi che sono di almeno 6 settimane, sex-matched e in una buona condizione fisica generale. - Preparare la soluzione di cardiotossina (20 M in 0,9 % NaCl), conservare la soluzione a -20 gradi centigradi.
- Consentire alla soluzione di cardiotossina di raggiungere la temperatura ambiente (RT).
- Trasferire il topo nella casella di inalazione e indurre l'anestesia con isoflurane (inizio 3,5 – 5 % in ossigeno puro). Controllare la profondità dell'anestesia con una mancanza di risposta a un pizzico di punta.
- Posizionare il mouse su un tovagliolo di carta pulito e mantenere l'anestesia con una maschera per il naso (1,5 – 3 % di isoflurane in ossigeno puro). Rasare l'area di iniezione della parte inferiore cranica (dal ginocchio alla zampa, Figura 1A). Rimuovere tutti i capelli sciolti eccessivi.
NOT: Separare fisicamente l'area di rasatura e iniezione nella stanza fornirà condizioni più sterili per le iniezioni. - Posizionare il mouse nella posizione reclinata laterale sul pad di riscaldamento coperto con un panno chirurgico sterile e mantenere l'anestesia con una maschera naso (1,5 – 3% isoflurane in ossigeno puro).
- Disinfettare l'area di iniezione della parte inferiore cranica (dal ginocchio alla zampa) con il 70% di etanolo.
- Eseguire un pizzico di dita dei dei imminici prima di iniziare l'iniezione intramuscolare per garantire un'adeguata profondità di anestesia.
- Iniettare nel muscolo anteriore della tibialis 50 -L con un ago calibro 29. In primo luogo, forare la pelle appena dissorare del ginocchio.
- Inserire completamente l'ago nel muscolo (in miofibra/parallelo all'osso tibia) e iniettare la cardiotossina lentamente (10-20 s) lungo l'intera lunghezza del muscolo mentre si muove l'ago avanti e indietro per consentire una distribuzione uniforme della cardiotossina in modo da ferendo l'intero muscolo anteriore tibialis (Figura 1B,C).
NOT: Ferire il muscolo anteriore tibialis da una sola gamba, il muscolo anteriore tibialis contralaterale può servire come controllo interno per determinare che i muscoli scheletrici non sono stati colpiti patologicamente prima della lesione cardiotossina. - Trasferire il mouse nella gabbia posta su un pad di riscaldamento e monitorare il processo di recupero fino a quando l'animale è cosciente e diventa ambulatorio.
NOT: I topi mostreranno solo un leggero zoppicare. Se i topi zoppiccano pesantemente e non mettono peso sulla gamba a tutti, sacrificare il mouse. - Somministrare analgesici durante i due giorni successivi (ad esempio, 1 mg/kg di peso corporeo meloxicam sottocutaneamente, ogni 24 h) e monitorarli su base settimanale.
2. Iniezione di siRNA auto-condurinissi nel muscolo anteriore rigenerante tibialis (Al terzo giorno lesione post cardiotossina)
- Preparare la soluzione di siRNA rispendendo il siRNA (ad esempio, il pool intelligente del siRNA) in 0,9% NaCl (concentrazione finale di 2 g/l) secondo le istruzioni del produttore.
NOT: Il siRNA è modificato chimicamente per facilitare l'assorbimento passivo da parte delle cellule e proteggerlo dalla degradazione di nucleato. Non sono necessari reagenti di trasfezione, riducendo così la tossicità. L'utilizzo di un pool intelligente di quattro sequenze di siRNA indipendenti rivolte allo stesso gene aumenta l'efficienza del knockdown. - Conservare il siRNA a -20 gradi centigradi e trasferirlo sul ghiaccio nella sala operatoria.
- Disinfettare la scatola di inalazione utilizzata per l'anestesia per inalazione e l'area di chirurgia con il 70% di etanolo. Posizionare un panno chirurgico sterile sul pad di riscaldamento dove avrà luogo l'intervento chirurgico.
- Accendere il riscaldamento a 37 gradi centigradi.
- Trasferire il topo nella casella di inalazione e indurre l'anestesia con isoflurane (inizio 3.5 – 5% in ossigeno puro). Controllare la profondità dell'anestesia con una mancanza di risposta a un pizzico di punta.
- Posizionare il mouse nella posizione reclinata laterale sul pad di riscaldamento coperto con un panno chirurgico sterile e mantenere l'anestesia con una maschera naso (1,5 – 3% isoflurane in ossigeno puro).
- Disinfettare l'area di iniezione della parte inferiore cranica (dal ginocchio alla zampa).
- Eseguire un pizzico di dita dei dei imminici prima di iniziare l'iniezione intramuscolare per garantire un'adeguata profondità di anestesia.
- Iniettare fino a una soluzione di siRNA fino a 50 gradi (fino a 100 g in totale in 0,9% NaCl; diretto contro il gene bersaglio; utilizzare il siRNA criptato come controllo) nel muscolo tibialis anteriori maleso utilizzando una siringa di insulina con un ago da 29 G. In primo luogo, forare la pelle appena distale del ginocchio, quindi inserire l'ago nel muscolo anteriore tibialis.
- Inserire completamente l'ago nel muscolo (in miofibra/parallelo all'osso tibia) e iniettare lentamente la soluzione siRNA (10 – 20 s) per tutta la lunghezza del muscolo mentre si sposta l'ago avanti e indietro per consentire una distribuzione uniforme del siRNA lungo il intero muscolo anteriore tibialis.
- Trasferire il mouse nella gabbia posta su un pad di riscaldamento e monitorare il processo di recupero fino a quando l'animale è cosciente e diventa ambulatorio.
NOT: L'analgesia non sta necessariamente seguendo l'iniezione di siRNA.
3. Dissezione del muscolo anteriore tibiale
- Preparare la soluzione di congelamento (2 parti OCT composto e 1 parte 30% saccarosio in acqua deionizzata) almeno 12 h prima dell'uso per evitare bolle d'aria.
- Preparare stampi di congelamento avvolgendo un foglio di alluminio intorno a una matita e sigillarlo con del nastro adesivo. È importante che il fondo dello stampo fornisca una superficie uniforme e chiusa.
NOT: Stampi di congelamento più piccoli consentono il congelamento più veloce del muscolo evitando artefatti di congelamento. - Sacrificare il topo, ad esempio per inalazione di CO2, al rispettivo punto temporale di rigenerazione e spruzzare l'intero strumento di dissezione e mouse con il 70% di etanolo.
NOT: La lussazione cervicale può essere applicata, inoltre, per evitare un'eccessiva emorragia alla gamba quando isola il muscolo anteriore tibialis. - Rimuovere la pelliccia e la pelle dall'arto posteriore ferito tagliando la pelle alla caviglia con forbici più fini (bordo di taglio: 13 mm) e tirando la pelle verso il ginocchio con pinze.
- Per esporre il tendine anteriore tibialis alla caviglia, tirare la pelle rimanente verso il piede o tagliare con forbici affilate.
NOT: Il mouse può essere appuntato a una scheda di supporto per consentire una migliore fissazione. - Prima di raccogliere il muscolo anteriore tibialis, rimuovere la fascia con pinze sottili (Dumont 5 o 7, dritto o curvo). Pizzicare le pinze chiuse attraverso la fascia accanto all'osso della tibia alla caviglia della gamba ferita (Figura 2A). Spostare le pinze verso il ginocchio strappando così la fascia ed esponendo il muscolo anteriore tibialis (Figura 2B).
- Per isolare il muscolo anteriore tibialis, esporre il tendine distale e afferrarlo con pinze sottili (Dumont 7, curvo). Tagliare il tendine con le forbici a molla (bordo di taglio: 5 mm, diametro della punta: 0,35 mm) e tirare il muscolo (tenendolo al tendine) verso il ginocchio.
- Per raccogliere il muscolo anteriore tibialis, tagliarlo il più vicino possibile al ginocchio utilizzando forbici affilate.
- Prima del congelamento, tagliare il muscolo anteriore tibialis nella regione media del ventre del muscolo con forbici dritte in due metà di uguale dimensione per consentire l'analisi della regione del ventre medio (Figura 2C,D).
- Riempire lo stampo di congelamento a metà con la soluzione di congelamento.
- Inserire le due metà del muscolo anteriore tibialis nello stampo di congelamento con la regione del ventre medio rivolta verso il fondo dello stampo (Figura 2E). Assicurarsi che le metà anteriori tibialis siano inserite in una posizione eretta appoggiata alla parete dello stampo congelante per evitare di ribaltarsi il muscolo.
NOT: La soluzione più congelante è nello stampo, più a lungo il congelamento prenderà, aumentando così il rischio di crio-artefatti. - Tenere lo stampo di congelamento utilizzando la pinze e trasferirlo a metà in azoto liquido (Figura 2F). Assicurarsi che nessun azoto liquido sta entrando nello stampo di congelamento durante il processo di congelamento.
- Osservare il processo di congelamento, il mezzo di congelamento cambia colore da trasparente a bianco e diventa solido. Sommerse lo stampo di congelamento in azoto liquido per alcuni secondi e trasferite lo stampo di congelamento in un congelatore a -80 gradi centigradi o a asciugare il ghiaccio per la lavorazione futura.
- Conservare i muscoli congelati negli stampi di congelamento a -80 gradi centigradi fino a un ulteriore utilizzo.
NOT: Gli stampi di congelamento si adattano bene in piastre da 24 pozzi o tubi di reazione da 1,5 ml che consentono l'etichettatura e lo stoccaggio organizzato. - Maneggiare il muscolo negli stampi di congelamento per un ulteriore utilizzo sempre su ghiaccio secco.
4. Criosezione del Muscolo Anteriore Tibialis Rigenerante
- Prima di partire per la sezionamento, impostare la temperatura della camera del criostato su -21 gradi centigradi, la temperatura dell'oggetto su -20 gradi centigradi e lo spessore di taglio a 10, 12 o 14 m (a seconda delle applicazioni future) (Figura 3A).
- Trasferire il campione muscolare nello stampo di congelamento nel criostato e lasciarlo regolare alla temperatura per diversi minuti. Durante questo periodo, etichettare i vetrini del microscopio.
- Rimuovere la pellicola intorno al muscolo incorporato utilizzando pinze preraffreddate all'interno del criostato. Evitare di toccare il campione come il criomedio inizia a scongelare facilmente.
- Montare il campione con la regione del ventre medio del muscolo anteriore tibialis diretto verso l'alto sul supporto del campione metallico del criostato utilizzando il criomedio. Questo assicura che il sito di taglio del muscolo (fondo dello stampo) sia rivolto verso lo sperimentatore.
- Inserire il supporto del campione con il campione montato nel meccanismo di sezionamento.
NOT: Per garantire una corretta sezionamento del campione, utilizzare una nuova lama prima di iniziare. - In primo luogo, tagliare il blocco di esempio (30 m) per ottenere un piano di sezionamento uniforme e per raggiungere la rispettiva regione del muscolo (Figura 3B).
- Dopo il taglio, tagliare sezioni consecutive del rispettivo spessore (ad es. 14 m).
- Raccogliere le sezioni su vetrini di vetro al microscopio tenendo la diapositiva a faccia in giù sopra la sezione. La sezione è collegata alla diapositiva (Figura 3C).
- Conservare le sezioni a -80 o -20 gradi centigradi fino a un ulteriore utilizzo o uso diretto per l'immunofluorescenza o l'immunohistochimica.
5. Immunostaining per marcatori di rigenerazione
- Eseguire tutti i passaggi aggiuntivi in una camera umida.
- In breve, equilibrate le sezioni a temperatura ambiente.
- Correggere le sezioni con 1 mL di 2% PFA (in PBS, pH 7.4) per diapositiva per 5 min a RT.
- Rimuovere la soluzione PFA del 2% versandola nel rispettivo contenitore dei rifiuti.
- Lavare 3 volte con 1 mL di PBS (pH 7.4) per 5 min a RT.
- Rimuovere il PBS versandolo in un contenitore di rifiuti.
- Per diapositiva, aggiungere 1 mL della soluzione di permeabilizzazione (0,1 % Triton X-100, 0,1 M glicina in PBS pH 7,4) per 10 min.
- Rimuovere la soluzione di permeabilizzazione versandola in un contenitore di rifiuti.
- Aggiungere 150 l della soluzione di blocco (M.O.M. 1:40 in PBS pH 7.4) per diapositiva e coprire con la coverslip. Incubare per 1 h a RT.
- Rimuovere il coverslip e la soluzione di blocco, applicare 100 l della soluzione anticorpale primaria [PAX7, DSHB, mouse IgG1, undiluted o devMHC, DSHB, undiluito, mouse IgG1 and laminin (coniglio, 1:1,000)] per diapositiva. Coprire con coverslip. Incubare O/N (pernottamento) a 4 gradi centigradi.
NOT: Eseguire una colorazione di controllo omettendo gli anticorpi primari, incubare la sezione con soluzione di blocco. - Lavare 3 volte con 1 mL di PBS (pH 7.4) per 5 min a RT.
- Rimuovere pbS versandolo in un contenitore di rifiuti.
- Aggiungere 100 l della soluzione anticorpale secondaria (Alexa Fluor 546 capra anti-tono IgG1 e Alexa Fluor 488 asino anti-coniglio anti-coniglio IgG in soluzione di blocco, 1: 1.000) per vetrino e coperchio con la coverslip. Incubare per 1 h a RT.
- Incubare i vetrini al buio, ad esempio, utilizzare un foglio di alluminio per coprire o utilizzare una camera umidificata nera.
NOT: D'ora in poi tutti i passi dovrebbero essere eseguiti in condizioni di luce ridotta poiché alcuni anticorpi secondari sono sensibili alla luce. - Rimuovere il coperchio e la soluzione anticorpale secondaria.
- Lavare 3 volte con 1 mL di PBS (pH 7.4) per 5 min a RT.
- Rimuovere il PBS versandolo in un contenitore di rifiuti.
- Eseguire la colorazione DAPI aggiungendo 1 mL della soluzione per diapositiva a una concentrazione finale di 10 g/mL per 5 min a RT.
- Rimuovere la soluzione di colorazione DAPI versandola in un contenitore di rifiuti.
- Lavare 3 volte con 1 mL PBS (pH 7.4) per 5 min a RT.
- Rimuovere completamente il PBS utilizzato per il lavaggio.
- Applicare da 2 a 3 gocce di supporto di montaggio acquoso e coprire direttamente il vetrino con un nuovo coverslip.
- Lasciare asciugare i vetrini per 1 h a RT al buio.
- Conservare le sezioni colorate a 4 gradi centigradi al buio fino a un'ulteriore analisi utilizzando un microscopio a fluorescenza.
6. Colorazione ematossina ed Eosina
- Eseguire tutti i passaggi aggiuntivi in una camera umida.
- Correggere le sezioni con 1 mL di 2% PFA (in PBS, pH 7.4) per diapositiva per 5 min a RT.
- Rimuovere la soluzione PFA del 2% versandola nel rispettivo contenitore dei rifiuti.
- Trasferire le diapositive in un barattolo Coplin.
- Sciacquare delicatamente gli scivoli con acqua del rubinetto.
NOT: Non accendere il rubinetto troppo alto poiché ciò potrebbe danneggiare le sezioni. - Trasferire le diapositive nella camera umidificata. Rimuovere il liquido.
- Applicare 1 mL di soluzione di colorazione ematossilina (Gill No 3) per 2 min.
- Trasferire le diapositive in un barattolo Coplin.
- Sciacquare delicatamente i vetrini con l'acqua del rubinetto fino a quando i nuclei diventano blu.
NOT: Non accendere il rubinetto troppo in alto poiché ciò potrebbe danneggiare le sezioni. - Trasferire le diapositive nella camera umidificata. Rimuovere il liquido.
- Applicare 1 mL di soluzione Eosin Y e incubare per 2 min.
- Trasferire le diapositive in un barattolo Coplin.
- Sciacquare delicatamente gli scivoli con acqua del rubinetto fino a quando l'acqua del rubinetto che esce dagli scivoli è chiara.
- Rimuovere tutto il liquido e lasciare asciugare i vetrini per 2 min.
- Montaggio in mezzo di montaggio adatto per l'immunohistochimica.
Risultati
Un risultato tipico di una colorazione ematossia ed eosina (H&E) di un tibialis lesione anteriore prima e dopo la cardiotossina mediata è presentato in Figura 4A, B. Nei muscoli di controllo, l'architettura del muscolo è intatta come visto dalla localizzazione dei nuclei nella periferia della miofibra e dalla mancanza di accumulo di cellule mononucleate nello spazio interstiziale (Figura 4A). 7 giorni dopo la lesione mediata dalla cardiotosina si formano nuove miofibre contrassegnate da nuclei situati in posizione centrale (Figura 4B). Inoltre, si può osservare un accumulo di cellule mononleate, costituite principalmente da cellule satellitari ma anche da cellule non miogeniche come le cellule immunitarie. L'intero muscolo deve essere ferito caratterizzato dalla posizione centrale di tutti i mionuclei e dall'accumulo di cellule mononuclate su tutta la sezione muscolare.
Per caratterizzare la progressione e il successo del processo di rigenerazione, possono essere eseguite diverse colorazioni immunofluorescenti utilizzando marcatori di rigenerazione. Il numero di cellule satellitari può essere valutato mediante colorazione per Pax7, il marcatore canonico per le cellule satellitari (Figura 4C,D). Tre giorni dopo la lesione aumenta il numero di cellule satellitari (Figura 4D), le cellule satellitari non si trovano più sotto la lamina basale. Per analizzare ulteriormente il processo di rigenerazione, le miofibre di nuova formazione possono essere macchiate con anticorpi diretti alla miosina dello sviluppo (Figura 4E). Le miofibre di nuova formazione mostrano nuclei situati in posizione centrale e una forte espressione della miosina dello sviluppo. Man mano che le miofibre maturano, l'espressione della miosina dello sviluppo diminuisce, il diametro della miofibra aumenta mentre i nuclei migrano verso la periferia delle miofibre.
L'influenza di un singolo gene sul processo di rigenerazione può essere studiata usando topi transgenici o come mostrato qui per iniezione di un siRNA auto-consegnante. Fluorescentemente etichettato auto-consegna siRNA di controllo strapazzato è stato iniettato nel muscolo tibialis rigenerante anteriore al giorno 3 dopo l'infortunio, il punto del momento in cui la proliferazione delle cellule satellitari raggiunge picchi. Due giorni dopo l'iniezione delle cellule satellitari del siRNA sono state analizzate per la presenza del siRNA fluorescentmente etichettato (Figura 4F). Abbiamo analizzato quante cellule satellitari avevano assunto il siRNA fluorescente due giorni dopo l'iniezione nel muscolo rigenerante (Figura 5). Circa il 75% di tutte le cellule satellitari nel muscolo rigenerante era positivo per il siRNA fluorescente. Inoltre, abbiamo determinato che circa il 74% di tutte le mifose rigeneranti erano positive per il siRNA fluorescente, suggerendo che il 74% delle miofibre rigeneranti aveva assorbito il siRNA o che le cellule satellitari siRNA-positive si erano fuse con l'un l'altro per formare nuove miofibre o che si è verificata la fusione con miofibre rigeneranti già esistenti (Figura 5). Ciò suggerisce che le cellule satellitari occupano il siRNA auto-conroganti e che il siRNA persiste nelle cellule satellitari per almeno due giorni.

Figura 1: Iniezione di cardiotossina nel muscolo anteriore tibialis. (A) I topi sono anestesizzati per inalazione di isoflurane e l'arto inferiore è rasato. (B) Un ago da 29 G viene iniettato nel muscolo anteriore tibiale (C) e spostato lungo l'osso della tibia durante l'iniezione della soluzione di cardiotossina. Fare clic qui per visualizzare una versione più grande di questa figura.
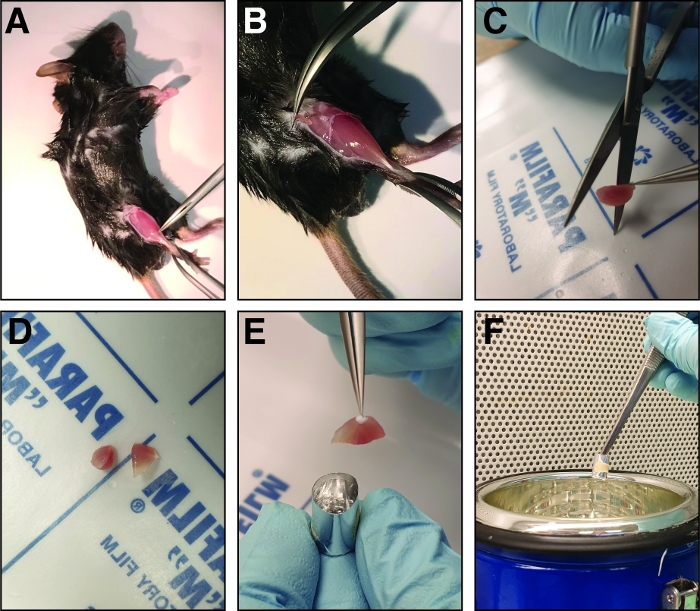
Figura 2: Passi coinvolti nella dissezione e congelamento del muscolo anteriore tibialis ferito. (A) I muscoli degli arti posteriori sono esposti (B) e la fascia che circonda il muscolo anteriore tibialis viene strappata per esporre il muscolo. (C) Dopo aver rimosso il muscolo, viene tagliato nella regione del ventre medio in due metà di dimensioni simili utilizzando forbici dritte affilate (D). (E) Le metà del muscolo sezionato sono incorporate in uno stampo in alluminio riempito con soluzione di congelamento e congelato in azoto liquido (F). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Attrezzature e passaggi coinvolti nella criosezione dei muscoli anteriori tibiali. (A) La temperatura della camera del criostato è impostata su -21 . (B) Il muscolo anteriore tibialis nella soluzione di congelamento è montato sul supporto del campione. (C) Le sezioni di spessore di 14 m sono attaccate ai vetrini del microscopio in vetro. Fare clic qui per visualizzare una versione più grande di questa figura.
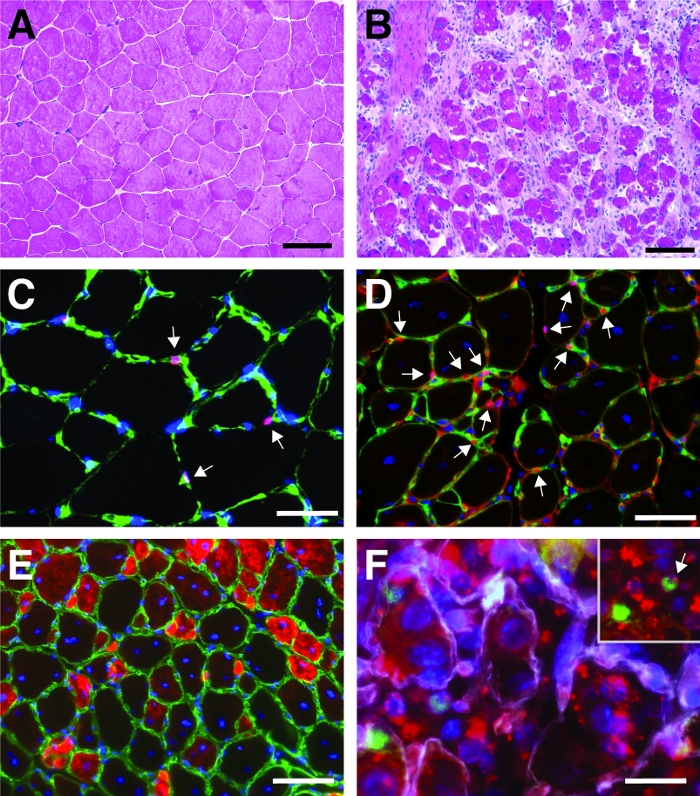
Figura 4: Immagini rappresentative dei muscoli anteriori rigeneranti tibiali. Macchie H&E dei muscoli anteriori della tibialis prima (A) e 7 giorni dopo l'infortunio di cardiotossina (B). (C) Nel muscolo non ferito Pax7 cellule satellitari positive (in rosso) si trovano sotto la lamina basale contrassegnata da laminina (in verde). I nuclei sono controordinati con DAPI (in blu). Le celle pax7 positive sono contrassegnate da una freccia. (D) Dopo 10 giorni di rigenerazione, le miofibre sono caratterizzate da nuclei situati in posizione centrale (in blu), Pax7 è mostrato in rosso, laminina in verde. Le celle pax7 positive sono contrassegnate da una freccia. (E) Le miofibre appena formate esprimono la miosina dello sviluppo (in rosso), laminina in verde, i nuclei sono contrastati con DAPI (in blu). (F) Il siRNA auto-consegna etichettato fluorescente (siRED, raffigurato in rosso) si trova ancora nelle cellule satellitari (Pax7 positivo, in verde, contrassegnato da una freccia nell'insenatura) 2 giorni dopo l'iniezione del siRNA auto-consegnante nella rigenerazione del tibialis anteriore muscolo (iniezione al giorno 3 dopo lesione mediata dalla cardiotossina). La laminina è mostrata in bianco, i nuclei sono controregistrati con DAPI (in blu). Barra della scala: 100 m (A e B), 50 m (C-E), 25 m (F). Fare clic qui per visualizzare una versione più grande di questa figura.
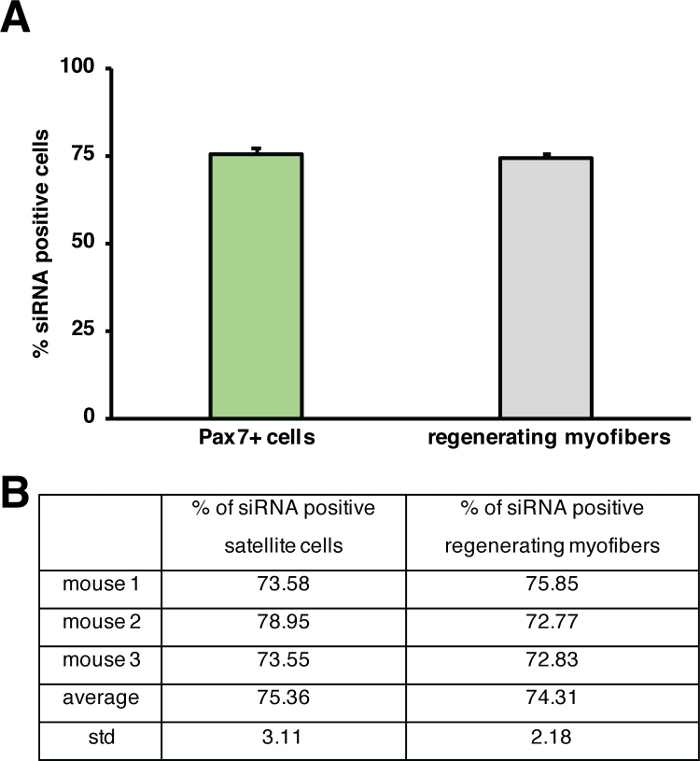
Figura 5: Quantificazione dell'assorbimento del siRNA fluorescente. (A) Quantificazione dell'assorbimento di siRNA da parte delle cellule satellitari (cellule Pax7) e rigenerazione delle miofibre 2 giorni dopo l'iniezione nel muscolo scheletrico rigenerante. L'iniezione è stata eseguita al giorno 3 dopo la lesione mediata dalla cardiotossina. n - 3, le barre di errore mostrano la quantificazione SEM. (B) sottostante il grafico raffigurato in (A). Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Qui presentiamo un metodo per studiare la funzione di un gene specifico durante la rigenerazione del muscolo scheletrico senza la necessità di animali transgenici. Ciò è ottenuto dalla combinazione di lesione muscolare indotta dalla cardiotossina con l'iniezione di un siRNA auto-condurso nel muscolo scheletrico rigenerante al giorno 3 dopo l'infortunio. Abbiamo descritto in dettaglio le procedure di lesione muscolare per cardiotossina, l'iniezione del siRNA auto-consegnante e l'elaborazione dei muscoli raccolti per analizzare il progresso della rigenerazione. Dimostriamo che l'iniezione del veleno di serpente cardiotossina nel muscolo scheletrico ferisce efficacemente l'intero muscolo e che i siRNA auto-consegnanti si trovano in circa il 75% di tutte le cellule satellitari tra le altre cellule due giorni dopo la loro iniezione nel rigenerazione del muscolo scheletrico (Figura 4, Figura 5).
Particolare attenzione dovrebbe essere focalizzata su una lesione omogenea del muscolo anteriore tibialis poiché diversi gradi di lesione influenzano l'esito della rigenerazione e quindi potrebbe essere influenzato anche l'effetto del siRNA. Inoltre, è di fondamentale importanza che l'intera area rigenerante venga iniettata con il siRNA auto-conrogante. Per l'analisi del processo di rigenerazione, si consiglia di confrontare sempre aree simili del muscolo scheletrico rigenerante, quindi, il muscolo anteriore tibialis dovrebbe essere tagliato a metà per confrontare sempre la regione del ventre medio del muscolo. Quando si analizza il muscolo, l'intera criosezione deve essere analizzata poiché la composizione della miofibra differisce nel muscolo anteriore tibialis e potrebbe quindi rigenerarsi in modo diverso.
La funzione delle cellule satellitari può essere studiata da varie procedure sperimentali tra cui la loro coltura sulle miofibre singole isolate adiacenti17, mediante trapianto e analizzando la rigenerazione del muscolo scheletrico dopo lesioni indotte 18,19. Lo studio della funzione delle cellule satellitari utilizzando un modello di lesione indotta in vivo, ad esempio l'iniezione di cardiotossina, fornisce la possibilità di analizzare la funzione delle cellule satellitari anche in termini di interazione con altri tipi di cellule, come macrofagi e l'indagine sull'influenza dei fattori sistemici2. Lesioni del muscolo scheletrico possono essere eseguite con vari mezzi, ad esempio, esercizio eccentrico, lesioni da congelamento, iniezione di BaCl2 o iniezione di veleni di serpente come la cardiotossina o la notexina18. Mentre l'esercizio eccentrico è probabilmente il metodo di lesioni più fisiologico, la lesione a un particolare muscolo è limitata solo20. Le lesioni da congelamento possono essere applicate quando la migrazione delle cellule satellitari verso il sito di lesioni è lo scopo dello studio o solo una parte specifica del muscolo dovrebbe essere ferita. Sperimentalmente lo svantaggio delle lesioni da congelamento è la chirurgia aperta che deve essere eseguita per applicare la sonda metallica preraffreddata. L'iniezione di BaCl2 o veleni di serpente è il metodo più drammatico di lesione, sfidando così la funzione cellulare satellitare più difficile. Inoltre, l'iniezione è minimamente invasiva, il tempo di chirurgia, in generale, è inferiore a cinque minuti e non comporta sutura, ecc. riducendo così al minimo il rischio di infezioni.
Lesione muscolare è per lo più utilizzato per studiare le conseguenze funzionali della perdita delle funzioni geniche, ad esempio, la perdita di Pax77,21. Soprattutto se i topi di vecchiaia sono al centro della questione scientifica, la generazione o l'uso di topi transgenici spesso non è fattibile. L'iniezione di siRNA auto-consegnanti mirati a un gene specifico è un'alternativa praticabile in questi casi ed è stata utilizzata con successo22. In breve, il muscolo tibialis anteriore dei topi è stato ferito per iniezione di cardiotossina e siRNA auto-consegnanti diretti contro la fibronectina (FN) sono stati iniettati al giorno 3 dopo l'infortunio. I muscoli sono stati analizzati 10 giorni dopo l'infortunio e una significativa diminuzione del numero di cellule satellitari è stata osservata nelle condizioni di controllo del siRNA strapazzate. L'efficienza di knockdown è stata determinata nei lismi muscolari interi dalla PCR quantitativa in tempo reale 2 giorni dopo l'iniezione di siRNA, è stata raggiunta una riduzione dei livelli di espressione del 58% suggerendo che l'efficienza di consegna e knockdown è sufficiente per l'efficienza funzionale analisi22. Le alternative per testare l'efficienza del knockdown sono le analisi dell'immunoblot o dell'immunofluorescenza con anticorpi diretti contro il gene bersaglio. L'efficienza e la specificità del siRNA utilizzato per le iniezioni in vivo devono essere determinate prima dell'iniezione nei topi, ad esempio testando l'efficienza nelle cellule satellitari isolate o nei mioblasti primari. L'uso di un pool intelligente composto da 4 siRNA diversi rispetto a un singolo siRNA aumenta l'efficienza del knockdown, ma aumenta anche il rischio di targeting non specifico. La specificità di tutte le sequenze di siRNA utilizzate deve essere testata nella coltura cellulare per evitare effetti fuori bersaglio. Come controllo, un siRNA criptato non mirato deve essere usato poiché l'iniezione di un siRNA di per sé potrebbe influenzare il processo di rigenerazione a causa dell'iniezione e, di conseguenza, danni aggiuntivi del muscolo. Il punto temporale dell'iniezione del siRNA dipende dalla questione scientifica e dal profilo di espressione del gene bersaglio. Generalmente, un'iniezione di siRNA auto-confortante al giorno 3 dopo che la lesione da cardiotossina riguarda la maggior parte dei geni importanti per la proliferazione delle cellule satellitari poiché la proliferazione delle cellule satellitari raggiunge il terzo giorno dopo l'infortunio. Il punto temporale per la prima iniezione di siRNA non deve essere inferiore a 48 h dopo la lesione da cardiotossina poiché il volume di iniezione di cardiotossina è piuttosto alto e la riassorbimento del liquido dovrebbe aver avuto luogo prima di iniettare soluzioni aggiuntive nel muscolo. In generale, più iniezioni di siRNA o una combinazione di siRNA diversi è possibile, anche se si deve considerare che ogni iniezione nel muscolo rigenerante sta causando ulteriori danni.
Una limitazione del metodo descritto è il fatto, che l'effetto osservato non è necessariamente solo a seconda dell'abbattimenti del gene bersaglio nelle cellule satellitari, ma potrebbe essere attribuito ad altri tipi di cellule come le cellule immunitarie o le cellule progenitrici fibro-adipogeni. Pertanto, è necessario combinare questi esperimenti con esperimenti che studiano una popolazione pura di cellule satellitari. Si possono o eseguire esperimenti utilizzando colture galleggianti di miofibra, dove le cellule satellitari vengono coltivate sulle miofibre adiacenti o eseguire esperimenti di trapianto utilizzando cellule satellitari isolate17.
Un'alternativa all'iniezione di siRNA auto-consegnanti è l'iniezione di inibitori di piccole molecole o proteine ricombinanti che possono essere eseguite, a seconda della questione scientifica. Ad esempio, l'iniezione della fibrocellina della proteina extracellulare o degli inibitori di piccole molecole della segnalazione JAK/STAT è stata eseguita con successo nei topi invecchiati15,16. L'analisi di una particolare funzione genica in un tipo specifico di cellula durante la rigenerazione del muscolo scheletrico, ad esempio, nelle cellule satellitari, è possibile solo attraverso l'uso di un modello murino genetico inducibile. Le iniezioni di siRNA auto-consegnanti, proteine ricombinanti o inibitori di piccole molecole potrebbero influenzare più tipi di cellule nel muscolo scheletrico rigenerante.
Divulgazioni
Ringraziamo Christina Picker e Christine Poser per l'eccellente assistenza tecnica e Saskia Steiner per l'aiuto nella determinazione dell'efficienza della trasfezione del siRNA. Ringraziamo il servizio di base histologia per un grande supporto tecnico, in particolare Sabine Landmann e Linda Rothenburger. Ringraziamo anche il topo di impianto animale presso la FLI per un eccellente supporto. Questo lavoro è stato sostenuto dalle sovvenzioni della Deutsche Forschungsgemeinschaft (MA-3975/2-1) e della Deutsche Krebshilfe (DKH-JvM-861005) a J.v.M.
Riconoscimenti
Gli autori non dichiarano interessi finanziari concorrenti.
Materiali
| Name | Company | Catalog Number | Comments |
| Isoflurane | Henry Schein | Isothesia | inhalation narcotics |
| Hot Plate 062 | Labotect | 13854 | |
| Anesthesia System (Tec 7) with inhalation box + nose masks | Tem Sega | Minihub | |
| Shaver for rodents | isis | GT420 | |
| Cardiotoxin | Latoxan | L8102 | snake venom needed for muscle injury |
| Accell siRNA smart pool | Dharmacon | depending on your target gene | self delivering siRNA |
| Alexa Fluor 488 donkey anti-rabbit IgG | Thermo Fisher | A-21206 | secondary antibody |
| Alexa Fluor 546 goat anti-mouse IgG1 | Thermo Fisher | A-21123 | secondary antibody |
| Coverslips | VWR | 631-1574 | |
| CV Mount | Leica | 14046430011 | mounting medium for immunohistochemistry |
| DAPI | Sigma Aldrich | D9542 | nuclear staining |
| devMHC antibody | DHSB | F.1652 | |
| Eosin Y | Thermo Fisher | 73104 | |
| Haematoxylin Gill No3 | Sigma-Aldrich | GHS316-500ML | |
| Insulin syringe (29 g) | Terumo | 3SS05M2813 | syringue used for muscle injections |
| Laminin antibody | Sigma Aldrich | L9393 | |
| M.O.M blocking reagent | Vector labs | MKB-2213 | blocking for immunofluorescent staining |
| Meloxicam | Boehringer Ingelheim | Metacam | analgesics |
| OCT | Thermo Fisher | 6502 | tissue embedding |
| Pax7 antibody | DSHB | PAX7 | satellite cell specific antibody |
| ProLong Gold Antifade Mountant | Thermo Fisher | P36934 | aequos mounting medium |
| Sucrose | Carl Roth | 4621.1 | tissue embedding |
| Superfrost plus | Thermo Scientific | J1830AMNZ | microscope slides |
| TritonX-100 | Amresco | 0694-1L | permeabilization reagent |
| Dissection tools | |||
| Dumont 5, straight | Fine Science Tools | 11295-10 | |
| Dumont 7, curved | Fine Science Tools | 11272-40 | |
| Extra fine Bonn scissors (cutting edge: 13 mm) | Fine Science Tools | 14084-08 | |
| Narrow pattern forceps | Fine Science Tools | 11002-16 | |
| Spring scissors (cutting edge: 5 mm, tip diameter: 0.35 mm) | Fine Science Tools | 91500-09 |
Riferimenti
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Schmidt, M., Schuler, S. C., Huttner, S. S., von Eyss, B., von Maltzahn, J. Adult stem cells at work: regenerating skeletal muscle. Cellular and Molecular Life Sciences. , (2019).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytolology. 9, 493-495 (1961).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- von Maltzahn, J., Jones, A. E., Parks, R. J., Rudnicki, M. A. Pax7 is critical for the normal function of satellite cells in adult skeletal muscle. Proceedings of the National Academy of Sciences of the United States of America U S A. 110 (41), 16474-16479 (2013).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Bentzinger, C. F., Wang, Y. X., Rudnicki, M. A. Building muscle: molecular regulation of myogenesis. Cold Spring Harb Perspectives in Biology. 4 (2), (2012).
- Schworer, S., et al. Epigenetic stress responses induce muscle stem-cell ageing by Hoxa9 developmental signals. Nature. 540 (7633), 428-432 (2016).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506 (7488), 316-321 (2014).
- Dumont, N. A., et al. Dystrophin expression in muscle stem cells regulates their polarity and asymmetric division. Nature Medicine. 21 (12), 1455-1463 (2015).
- von Maltzahn, J., Renaud, J. M., Parise, G., Rudnicki, M. A. Wnt7a treatment ameliorates muscular dystrophy. Proceedings of the National Academy of Sciences of the United States of America U S A. 109 (50), 20614-20619 (2012).
- Price, F. D., et al. Inhibition of JAK-STAT signaling stimulates adult satellite cell function. Nature Medicine. 20 (10), 1174-1181 (2014).
- Lukjanenko, L., et al. Loss of fibronectin from the aged stem cell niche affects the regenerative capacity of skeletal muscle in mice. Nature Medicine. 22 (8), 897-905 (2016).
- Huttner, S. S., et al. Isolation and Culture of Individual Myofibers and Their Adjacent Muscle Stem Cells from Aged and Adult Skeletal Muscle. Methods in Molecular Biology. , (2019).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PLoS One. 11 (1), e0147198(2016).
- Hall, M. N., et al. Transplantation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 1556, 237-244 (2017).
- Dueweke, J. J., Awan, T. M., Mendias, C. L. Regeneration of Skeletal Muscle After Eccentric Injury. Journal of Sport Rehabilitation. 26 (2), 171-179 (2017).
- Lepper, C., Conway, S. J., Fan, C. M. Adult satellite cells and embryonic muscle progenitors have distinct genetic requirements. Nature. 460 (7255), 627-631 (2009).
- Bentzinger, C. F., et al. Fibronectin regulates Wnt7a signaling and satellite cell expansion. Cell Stem Cell. 12 (1), 75-87 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon