Method Article
ניתוח תא לווין פונקציה במהלך התחדשות שריר השלד על ידי פציעה קרדיאטוקסין הזרקה של העצמי הספק siRNA ב Vivo
In This Article
Summary
אנו מתארים בשיטה vivo לחקור את אובדן פונקציונלי של גן ספציפי בתאי לווין באמצעות שילוב של קרדיאטוקסין בתיווך הפציעה של שריר השלד ואת הזריקה של siRNA הספק.
Abstract
שריר השלד בעל קיבולת עצומה להתחדש לאחר הפציעה. תהליך זה מונע בעיקר על ידי תאי גזע שרירים, הנקרא גם תאי לווין. תאי לווין מאופיינים בביטוי של שעתוק גורם Pax7 ומיקומם מתחת הבסיס לאמה בשריר השלד המנוחה. בעת הפציעה, תאי לווין מופעלים, עוברים התחדשות עצמית או בידול ליצירת סיבי מיואלה חדשים או לנתיך עם שנפגעו. הפונקציונליות של תאי לווין ב vivo ניתן לחקור באמצעות מודל פציעה מבוסס קרדיאטוקסין של שריר השלד. כדי ללמוד את הפונקציה של גן אחד במהלך התחדשות של שריר השלד, מודלים העכבר הטרנסגניים משמשים בעיקר. כאן, אנו מציגים שיטה חלופית לעכברים טרנסגניים, כדי לחקור את פונקציית הגן בתאי לווין במהלך התחדשות, למשל, במקרים בהם עכברים טרנסגניים אינם זמינים. אנו משלבים את הפציעה קרדיאטוקסין תיווך של שריר השלד מסוים עם הזריקה של הספק העצמי siRNA לתוך השריר מתחדשות אשר נלקח לאחר מכן על ידי תאי לווין בין תאים אחרים. כך, אנו מספקים שיטה לנתח פונקציה גנטית בתאי לווין במהלך התחדשות בתנאים פיסיולוגיים ללא צורך עכברים טרנסגניים.
Introduction
שריר השלד הוא הרקמה הגדולה ביותר של הגוף המייצג כ 40% ממשקל הגוף הכולל המאפשר התנדבותי תנועה. האדריכלות רקמה של שריר השלד מורכב בעיקר של postmitotic, סופני הבדיל, מיוקלאוסין סיבים, כמו גם תאים אחרים שונים ממערכת העצבים ההיקפית, כלי דם מערכת, ו ביניים בתאים1. חשוב מכך, שריר השלד יש יכולת אדירה להתחדש ולשחזר פונקציה על פציעה או נזק2. תהליך זה תלוי בתאי גזע השריר תושב הרקמה המכונה גם תאים לווין3,4. תאי לווין ממוקמים בין המויוסיבים לבין הבסיס לאמינה ומאופיין בביטוי של הגורם התמלול Pax75,6,7. תחת תנאים הומסטטיים, תאי לווין הם השקט אבל להיות מופעל עקב פציעה טראומטית, למשל, דרך תרגיל תמהוני או ניסוי באמצעות הזרקה של ארס נחש קרדיאטוקסין6,8. לאחר הפעלת, Pax7 חיובי תאים לווין co-express MyoD ו-Myf5, אשר מבצע את תאי גזע לבידול מיוגני. תאי לווין המתנגדים לupregulation של גורמי מחויבות ישמרו על פוטנציאל הסטדיות שלהם ויחזרו לשקט כדי לחדש את בריכת תאי הגזע לדרישות עתידיות. לאחר התרחבות בריכת הקדמון מיוגני, רשתות מופעלות על ידי גורמי בידול כמו מיוגנמין כדי ליזום את יציאת מחזור התא ובידול מסוף. הmyoprogenitors האלה מנתיך זה לזה או לסיבים הקיימים שתורמים ליוקליאני כדי לשמור על הגודל של התחום היורור. מיוסיבים לבטא שריר מסוף בידול גנים כמו שרשרת כבד רירן. לבסוף, החדש שנוצר מיוסיבים לגדול ובוגרת כדי לבנות את יחידות פונקציונלי של שריר השלד9,10.
התחדשות של שריר השלד יכול להיות מושפע מתנאים שונים, כולל מחלות שריר אוהזדקנות 11,12, החל ליקויים מתון לתנאים סכנת חיים, למשל, ב ניוון שרירים duchenne13 , 14. לכן, הרפואה הרגנרטיבית שואפת לשחזר נזק פגום או בתפקוד שרירי השלד באמצעותכוח ההתחדשות הטבועה שלה על ידי התמקדות בתפקוד תאלווין 15,16. כדי להשתמש בפוטנציאל המלא שלה הבנה מקיפה של תאי לווין נישה אנדוגניים שלהם במהלך התחדשות של שריר השלד נדרש. למרות שגישות נסיוניות קיימות כדי לבודד תאי לווין הסמוכים לסיבים שלהם17, המורכבות המלאה של אינטראקציה תאית ומערכתית של תאי לווין עם הסביבה שלהם יכולה להיות רק לכידה בvivo. בהקשר זה, הידע הגדול על התחדשות שריר השלד נרכשה באמצעות מודלים לפגיעה בעכבר2,18.
כאן אנו מציגים מודל מסוים העכבר הניסיוני פציעה כדי ללמוד את תא גזע מתווך התחדשות של נזק קרדיאטוקסין המושרה של השריר הטישורי הקדמי ב vivo. קרדיאטוקסין, נחש המופק הרעלן cytolytic הגורם מיופולריזציה ו נמק, הוא מוזרק לתוך השריר הקדמי התחדשות, אשר בתורו יגרום ניוון רקמות ואחריו התחדשות. כדי לנתח את הפונקציה של גנים במהלך התחדשות חריפה, הספק העצמי siRNAs מוזרק ביום 3 לאחר הפציעה, בשיא של הרחבת התא לווין. בעלי חיים ניסיוניים מוקרבים בנקודות זמן שונות, והשרירים הקדמי העושורי נאספים. שרירי הגזור קפואים ומעובדים עבור הקפאה נוספת. מיקרוסקופ immunofluorescence משמש לניתוח סמנים של התחדשות. שיטה זו מאפשרת חקירה של הפונקציה של גן יחיד במהלך התחדשות תא לווין מונחה שריר השלד באמצעות עכברים סוג פראי.
Protocol
כל הליכי בעלי החיים אושרו על ידי מחלקת הרווחה של בעלי החיים של התנגר לנדסברג Lebensmittelsicherheit und ורראוצ'רשיץ (03-048/16; TLV Bad Langensalza, גרמניה).
1. קרדיאטוקסין פגיעה שרירים הנגרמת
הערה: בצע את כל הניסויים הכרוכים בעכברים חיים בהתאם לחוק הלאומי לרווחת בעלי חיים ותחת תנאים אספטי מתאימים. כמו כן, יש להקריב את הקרבת בעלי חיים בהתאם לחוק הלאומי למען רווחת בעלי חיים.
- לחטא את תיבת האינהלציה המשמש הרדמה אינהלציה ואת אזור הניתוח עם 70% אתנול. מניחים בד כירורגי סטרילי על משטח החימום שבו הניתוח יתקיים.
- הפעל את משטח החימום ב-37 ° c.
- ניהול משככי כאבים (למשל, 1 מ"ג/ק"ג משקל הגוף מלוקסיאם תת-עורי) 15 דקות לפני תחילת הניתוח.
הערה: לניסוי טיפוסי, השתמשו בעכברים שנמצאים לפחות 6 שבועות, מתאימים למין ובמצב גופני כללי טוב. - הכן את הפתרון הקרדיאטוקסין (20 μM ב-0.9%), אחסן את הפתרון ב-20 ° c.
- אפשר לפתרון הקרדיאטוקסין להגיע לטמפרטורת החדר (RT).
- העבר את העכבר לתוך תיבת האינהלציה ולגרום הרדמה עם isofלאנה (ייזום 3.5 – 5% חמצן טהור). בדוק את עומק ההרדמה עם חוסר תגובה לצביטה בבוהן.
- הניחו את העכבר על מגבת נייר נקייה ושמרו על הרדמה בעזרת מסכת אף (1.5 – 3% isofלוריאן בחמצן טהור). לגלח את אזור ההזרקה של הרגל התחתונה הגולגולת (מברך עד כפה, איור 1A). להסיר את כל שיער רופף מוגזם.
הערה: הפרדת הגילוח ואזור ההזרקה בחדר יספקו תנאים סטריליים יותר לזריקות. - מניחים את העכבר בתנוחה שכיבה לרוחב על כרית החימום מכוסה בד כירורגי סטרילי ולשמור על הרדמה עם מסכה אף (1.5 – 3% isofלוריאן בחמצן טהור).
- לחטא את אזור ההזרקה של הרגל התחתונה הגולגולת (מברך אל כפה) עם 70% אתנול.
- לבצע צביטה בבוהן לפני תחילת הזריקה התוך שרירי כדי להבטיח עומק הולם של הרדמה.
- להזריק 50 μL קרדיאטוקסין (20 μM ב 0.9% הנאל) לתוך השריר הקדמי ה באמצעות מזרק אינסולין עם מחט של 29 מטרים. קודם כל, לנקב את העור. בדיוק באמצע הברך
- הכנס את המחט לגמרי לתוך השריר (התמצאות במקביל/מקבילה לעצם השוקה) והכנס את קרדיאטוקסין לאט (10-20 s) לאורך האורך המלא של השריר תוך הזזת המחט הלוך ושוב כדי לאפשר הפצה אפילו של קרדיאטוקסין ובכך פצעו את כל השריר הקדמי החישורי (איור 1ב, ג).
הערה: לפגוע השריר הפיזי הקדמי מרגל אחת בלבד, שריר השדרה הקדמי שרירי הגוף יכול לשמש כפקד פנימי כדי לקבוע כי שרירי השלד לא הושפעו באופן פתולוגי לפני פציעה קרדיאטוקסין. - להעביר את העכבר בחזרה לכלוב שלו ממוקם על כרית החימום לפקח על תהליך ההחלמה עד החיה הוא מודע והופך אמבולטורי.
הערה: . העכברים יראו צליעה קלה אם עכברים הם צולע בכבדות לא לשים משקל על הרגל בכלל, להקריב את העכבר. - ניהול משככי כאבים במהלך 2 הימים הבאים (למשל, 1 מ"ג/ק"ג משקל הגוף מלוקסיאם תת-עורי, כל 24 h) ולעקוב אותם על בסיס שבועי.
2. הזרקה של העצמי הספק siRNA לתוך להתחדשות שריר קדמי התחדשות (ביום 3 Post קרדיאטוקסין פציעה)
- הכן את הפתרון siRNA על ידי השעיית מחדש את siRNA (למשל, siRNA בריכה חכמה) ב 0.9% (הריכוז הסופי של 2 μg/μL) על פי הוראות היצרן.
הערה: Sirna שונה כימית כדי להקל על ספיגת פסיבי על ידי תאים ולהגן עליו מפני נוקלאז השפלה. אין צורך בריאגנטים להפחתת מחלות, ובכך מפחית רעילות. באמצעות בריכה חכמה של ארבעה רצפי siRNA עצמאיים מיקוד אותו הגן מגביר את היעילות. - אחסן את siRNA ב-20 ° c והעבר אותו על הקרח לחדר הניתוח.
- לחטא את תיבת האינהלציה המשמש הרדמה אינהלציה ואת אזור הניתוח עם 70% אתנול. מניחים בד כירורגי סטרילי על משטח החימום שבו הניתוח יתקיים.
- הפעל את משטח החימום ב-37 ° c.
- העבר את העכבר לתוך תיבת האינהלציה ולגרום הרדמה עם isofלאנה (ייזום 3.5 – 5% חמצן טהור). בדוק את עומק ההרדמה עם חוסר תגובה לצביטה בבוהן.
- מניחים את העכבר בתנוחה שכיבה לרוחב על כרית החימום מכוסה בד כירורגי סטרילי ולשמור על הרדמה עם מסכה אף (1.5 – 3% isofלוריאן בחמצן טהור).
- לחטא את אזור ההזרקה של הרגל התחתונה הגולגולת (מברך אל כפה).
- לבצע צביטה בבוהן לפני תחילת הזריקה התוך שרירי כדי להבטיח עומק הולם של הרדמה.
- להזריק עד 50 μL סינא פתרון (עד 100 μg הסכום ב 0.9% הנאל; מופנה נגד הגן היעד; השתמש siRNA מעורבל כפקד) לתוך השריר הפיזי הפצוע באמצעות מזרק אינסולין עם מחט של 29 גרם. ראשית, לנקב את העור בדיוק של הברך, ואז להכניס את המחט לתוך השריר הקדמי הפיזי.
- הכנס את המחט לגמרי לתוך השריר (בכיוון מיוכי סיבים/במקביל לעצם השוקה) והכנס את הפתרון sirna לאט (10 – 20 s) לאורך האורך המלא של השריר תוך הזזת המחט הלוך ושוב כדי לאפשר הפצה אפילו של sirna לאורך ה שריר קדמי הפיזי כולו.
- להעביר את העכבר בחזרה לכלוב שלו ממוקם על כרית החימום לפקח על תהליך ההחלמה עד החיה הוא מודע והופך אמבולטורי.
הערה: כאבים לא בהכרח בעקבות ההזרקה של siRNA.
3. חיתוך השריר הקדמי החישורי
- הכינו את פתרון ההקפאה (2 חלקים מתחם OCT וחלק אחד 30% סוכות במים מוהים) לפחות 12 שעות לפני השימוש כדי למנוע בועות אוויר.
- הכינו תבניות הקפאה על ידי גלישת רדיד אלומיניום סביב עיפרון ואטמו אותו בקלטת. חשוב שהחלק התחתון של העובש מספק משטח סגור ואפילו.
הערה: הקפאה קטנה יותר של השריר מאפשרת קיפאון מהיר יותר של שריר הימנעות חפצים מוקפאים. - להקריב את העכבר, למשל, על ידי שאיפת CO2 , בנקודת הזמן המתאימה של התחדשות וריסוס העכבר כולו וכלים לחיתוך עם 70% אתנול.
הערה: פריקה צוואר הרחם ניתן להחיל, בנוסף, כדי למנוע דימום מופרז ברגל בעת בידוד השריר הקדמי הפיזי. - הסירו את הפרווה והעור מהגפיים הפגועים על ידי חיתוך העור בקרסול עם מספריים חדים במיוחד (חוד החיתוך: 13 מ"מ) ומשיכת העור לעבר הברך באמצעות מלקחיים.
- כדי לחשוף את הגיד הקדמי התפקודי על הקרסול, למשוך את העור הנותר לכיוון כף הרגל או לחתוך עם מספריים חדים.
הערה: ניתן להצמיד את העכבר ללוח תמיכה כדי לאפשר קיבעון טוב יותר. - לפני לקצור את השריר הקדמי הפיזי, להסיר את הfascia באמצעות מלקחיים עדינים (דומונט 5 או 7, ישר או מעוקל). צבוט את מלקחיים סגורים דרך fascia ליד עצם השוקה בקרסול של הרגל הפצועה (איור 2A). הזיזו את הלקחיים לכיוון הברך ובכך קרעו את הfascia וחושפים את השריר הקדמי החישורי (איור 2B).
- כדי לבודד את השריר הקדמי החישורי, לחשוף את הגיד המרוחק ולתפוס אותו עם מלקחיים עדינים (דומונט 7, מעוקל). חותכים את הגיד באמצעות מספריים באביב (חוד החיתוך: 5 מ"מ, בקוטר קצה: 0.35 מ"מ) ולמשוך את השריר (להחזיק אותו על הגיד) לעבר הברך.
- כדי לקצור את השריר הקדמי החישורי, לחתוך אותו קרוב לברך ככל האפשר באמצעות מספריים חדים.
- לפני ההקפאה, לחתוך את השריר הפיזי הקדמי באזור הבטן האמצעית של השריר עם מספריים ישר לשני חצאים של גודל שווה כדי לאפשר ניתוח של אזור הבטן האמצעית (איור 2ג, ד).
- ממלאים את עובש ההקפאה. בחצי הדרך עם התמיסה הקפואה
- הכנס את שני החצאים של השריר הקדמי החישורי לתוך עובש ההקפאה עם אזור הבטן האמצעית מול החלק התחתון של העובש (איור 2E). ודא את החצאים הקדמי הפיזי מוכנסים לתנוחה זקופה נשען על הקיר של עובש ההקפאה כדי למנוע התהפכה של השריר.
הערה: הפתרון המקפיא יותר הוא בתבנית, ככל שההקפאה תארך זמן רב יותר, כך מגבירה את הסיכון לחפצי-ההקפאה. - להחזיק את עובש ההקפאה באמצעות מלקחיים ולהעביר אותו בחצי הדרך לתוך חנקן נוזלי (איור 2F). ודאו שאין חנקן נוזלי שנכנס לתבנית ההקפאה במהלך תהליך ההקפאה.
- שימו לב לתהליך ההקפאה, בינוני המקפיא משנה צבע משקוף ללבן והופך למוצק. משקה את תבנית ההקפאה בחנקן נוזלי לכמה שניות ומעביר את תבנית ההקפאה למקפיא של מ80 ° c או לקרח יבש לצורך עיבוד עתידי.
- אחסן את השרירים הקפואים בתבניות ההקפאה ב-80 ° צ' עד שימוש נוסף.
הערה: תבניות ההקפאה מתאימות היטב לצלחות 24-ובכן או 1.5 מ ל שפופרות תגובה המאפשרות תיוג ואחסון מאורגן. - לטפל בשריר בתבניות ההקפאה לשימוש נוסף תמיד על קרח יבש.
4. קריוסיב של התחדשות שריר קדמי הפיזי
- לפני התחלת הניתוק, הגדר את טמפרטורת החדר של הקריוסטט ל-21 ° צ', טמפרטורת האובייקט ל-20 ° c ועובי החיתוך ל-10, 12 או 14 יקרומטר (בהתאם ליישומים העתידיים) (איור 3a).
- להעביר את דגימת השריר בתבנית ההקפאה לתוך קריוסטט ולתת לו להתאים את הטמפרטורה במשך כמה דקות. , במהלך הזמן הזה. תייג את שקופיות המיקרוסקופ
- הסירו את רדיד האלומיניום סביב השריר המוטבע באמצעות מלקחיים מקורר בתוך הקריוסטט. להימנע מנגיעה של המדגם כמו cryomedium מתחיל להפשיר בקלות.
- הר את המדגם עם אזור הבטן האמצעית של השריר הקדמי הפיזי מכוון כלפי מעלה על מחזיק דגימת מתכת של קריוסטט באמצעות cryomedium. זה מבטיח כי האתר חיתוך של השריר (החלק התחתון של העובש) עומד בפני ניסויים.
- הכנס את מחזיק המדגם עם המדגם הנטען לתוך המנגנון המוצב.
הערה: כדי להבטיח הפחתה מתאימה של המדגם, השתמש בלהב חדש לפני תחילת השימוש. - ראשון, לקצץ את בלוק לדוגמה (30 μm) כדי לקבל מטוס אפילו מוכן להגיע לאזור המתאים של השריר (איור 3B).
- לאחר חיתוך, לגזור קטעים רצופים של עובי בהתאמה (למשל, 14 μm).
- לאסוף את הסעיפים על שקופיות זכוכית מיקרוסקופ על ידי החזקת השקופית הפנים מטה מעל המקטע. המקטע מצרף לשקופית (איור 3C).
- החנות מקטעים ב-80 ° צ' או-20 ° c עד שימוש נוסף או לשימוש ישיר לאימונולואוכימיה או אימונוהיסטוכולוגיה.
5. כתמים חיסוני עבור סמנים של התחדשות
- בצע את כל השלבים הבאים בחדר מחולל.
- בקצרה, למדוד את החלקים בטמפרטורת החדר.
- תקן מקטעים עם 1 מ ל של 2% בתחתית (ב-PBS, pH 7.4) לכל שקופית עבור 5 דקות ב-RT.
- להסיר את הפתרון 2% בכיוון ההפוך על ידי שפיכת אותו לתוך המיכל פסולת בהתאמה.
- לשטוף 3 פעמים עם 1 מ ל של PBS (pH 7.4) עבור 5 דקות ב RT.
- הוציאו את הערוץ הPBS. על ידי הפיכת המיכל לפסולת
- לכל שקופית, הוסף 1 מ ל של פתרון החדירות (0.1% טריטון X-100, 0.1 M גליצין ב-PBS pH 7.4) במשך 10 דקות.
- הסר את פתרון החדירות על ידי שפיכת אותו למיכל פסולת.
- הוסף 150 μL של פתרון חסימת (M.O.M. 1:40 ב-PBS pH 7.4) לכל שקופית ולכסות עם שמיכות. . מודטה בשביל 1 h ב-RT
- להסיר את coverslip ואת הפתרון חסימת, להחיל 100 μl של פתרון הנוגדן העיקרי [PAX7, dshb, IgG1 העכבר, הולות דולל או devmhc, dshb, הולות דולל, עכבר IgG1and למינציה (ארנב, 1:1000)] לכל שקופית. . כיסוי עם שמיכות דגירה O/N (לילה) ב 4 ° c.
הערה: לבצע מכתים שליטה על ידי השמטת נוגדנים הראשי, מודקות את המקטע עם פתרון חסימת במקום. - לשטוף 3 פעמים עם 1 מ ל של PBS (pH 7.4) עבור 5 דקות ב RT.
- הסירו את הPBS על ידי שפכו אותו למיכל פסולת.
- הוסף 100 μL של פתרון הנוגדן המשני (אלקסה Fluor 546 עז אנטי עכבר IgG1 ו-אלקסה Fluor 488 החמור נגד ארנב IgG בפתרון חסימה, 1:1,000) לכל שקופית וכיסוי עם העטיפה. . מודטה בשביל 1 h ב-RT
- מודיית את השקופיות בחושך, למשל, להשתמש ברדיד אלומיניום כדי לכסות או להשתמש בחדר מחולל שחור.
הערה: מעתה והלאה יש לבצע את הפעולות בתנאי תאורה מופחתים מאחר שנוגדנים משניים רגישים לאור. - להסיר את הכיסויים ואת הפתרון נוגדן משני.
- לשטוף 3 פעמים עם 1 מ ל של PBS (pH 7.4) עבור 5 דקות ב RT.
- הוציאו את הערוץ הPBS. על ידי הפיכת המיכל לפסולת
- לבצע הצביעת DAPI על ידי הוספת 1 mL של הפתרון לכל שקופית לריכוז הסופי של 10 μg/mL עבור 5 דקות ב RT.
- הסר את פתרון ה-DAPI מכתים על ידי שפיכת אותו למיכל פסולת.
- לשטוף 3 פעמים עם 1 מ"ל PBS (pH 7.4) עבור 5 דקות ב RT.
- להסיר לחלוטין את ה-PBS משמש לכביסה.
- החל 2 – 3 טיפות של בינונית הרכבה מימית, ישירות לכסות את השקופית עם שמיכות חדש.
- תנו לשקופיות להתייבש. במשך 1 שעות בחשיכה
- אחסנו את החלקים המוכתמים ב -4 ° c בחשכה עד לניתוח נוסף בעזרת מיקרוסקופ פלואורסצנטית.
6. המטאוקסילין ואאוזין צביעת
- בצע את כל השלבים הבאים בחדר מחולל.
- תקן מקטעים עם 1 מ ל של 2% בתחתית (ב-PBS, pH 7.4) לכל שקופית עבור 5 דקות ב-RT.
- להסיר את הפתרון 2% בכיוון ההפוך על ידי שפיכת אותו לתוך המיכל פסולת בהתאמה.
- העבר את השקופיות. לצנצנת של קופלין
- שטוף בעדינות את השקופיות עם מי ברז.
הערה: אל תדליק את הברז גבוה מדי מאחר שעלול לגרום נזק לסעיפים. - העבר את השקופיות לחדר המחולל. . הסירו את הנוזל
- החלת 1 מ ל של המטאוקסילין פתרון (גיל מס ' 3) למשך 2 דקות.
- העבר את השקופיות. לצנצנת של קופלין
- שטפו בעדינות את השקופיות עם מי הברז עד שגרעינים מופכים לכחולים.
הערה: אל תדליק את הברז גבוה מדי מאחר שעלול לגרום נזק לסעיפים שלך. - העבר את השקופיות לחדר המחולל. . הסירו את הנוזל
- החל 1 mL של פתרון אאוזין Y ו-הדגירה עבור 2 דקות.
- העבר את השקופיות. לצנצנת של קופלין
- שטוף בעדינות את השקופיות עם מי ברז עד שהמים ההברז שמגיעים מהשקופיות ברורים.
- הסירו את כל הנוזלים ותנו לשקופיות להתייבש 2 דקות.
- הר ב הרכבה בינונית מתאים לאימונוהיסטוכימיה.
תוצאות
תוצאה אופיינית של המטאוקסילין ו אאוזין (H & E) מכתים את השריר הקדמי הטישורי לפני ואחרי הפציעה קרדיאטוקסין בתיווך מוצג באיור 4א, ב. בשרירי השליטה, הארכיטקטורה של השריר שלמה כנראה על ידי לוקליזציה של גרעינים בפריפריה של סיבים מיואיים וחוסר הצטברות של תאים מונונותים בחלל ביניים (איור 4A). 7 ימים לאחר קרדיאטוקסין מתווכת פציעה סיבים חדשים נוצרות מסומנים על ידי גרעיני מרכזי הממוקם (איור 4B). יתר על כן, הצטברות של תאים מונונותים ניתן לצפות, המורכב בעיקר של תאי לווין, אך גם תאים לא מיוגניים כמו תאים חיסוניים. השריר כולו צריך להיפגע על ידי המיקום המרכזי של כל והצטברות של תאים מונונוקלאואיים בחלק השריר כולו.
כדי לאפיין את ההתקדמות וההצלחה של תהליך ההתחדשות, מספר מעבדים אימונוofor, שימוש בסמנים של התחדשות ניתן לבצע. את מספר תאי הלווין ניתן להעריך על ידי כתמים עבור Pax7, סמן קאנוני עבור תאי לווין (איור 4ג, ד). שלושה ימים לאחר הפציעה מספר התאים לווין עולה (איור 4D), תאי לווין אינם נמצאים תחת הבסיס לאמנה יותר. כדי לנתח עוד יותר את תהליך ההתחדשות, סיבים מיותמים שנוצרו לאחרונה יכול להיות מוכתם עם נוגדנים מכוונים רירן התפתחותית (איור 4E). מיוסיבים שנוצרו לאחרונה להציג גרעינים מרכזי ממוקם ביטוי חזק של רירן התפתחותית. כמו סיבי מיוהים בוגרת, הביטוי של הרירן פוחתת התפתחותית, קוטרו של מיויוסיבי גדל בעוד גרעיני הם מגירה לפריפריה של סיבי מיוכן.
ההשפעה של גן יחיד על תהליך של התחדשות יכול להיות נחקר באמצעות עכברים טרנסגניים או כפי שמוצג כאן על ידי הזרקה של siRNA לספק את עצמו. Fluorescently התווית עצמית שליטה השליטה מקושקשות siRNA הוזרק לתוך השריר להתחדשות התחדשות הקדמית ביום 3 לאחר הפציעה, נקודת הזמן כאשר התפשטות של תאים לווין פסגות. יומיים לאחר ההזרקה של התאים siRNA לווין נותחו עבור נוכחות של siRNA המסומן בדגל (איור 4F). ניתחנו כמה תאי לווין לקחו את התווית באופן fluorescently כיום לאחר ההזרקה לתוך השריר מתחדשות (איור 5). כ 75% של כל תאי הלווין בשריר מיוצר מתחדשות היו חיוביים עבור התווית siRNA שכותרתו. יתר על כן, קבענו כי כ 74% של כל הסיבים להתחדשות מיותהיו חיוביים עבור התווית siRNA המסומן באופן מרומז כי או 74% הסיבים התחדשות מיועלה לקח את siRNA או כי התאים siRNA-חיובית לווין או התמזגו עם זה לזה כדי ליצור סיבים חדשים או היתוך עם הסיבים הקיימים כבר מחדש מחדש שהתרחשו (איור 5). זה מרמז כי תאים לווין לקחת את הספק העצמי siRNA וכי siRNA נמשכת בתאי הלווין לפחות יומיים.

איור 1: הזרקת קרדיאטוקסין לתוך השריר הקדמי הפיזי. (א) עכברים מורדם על ידי שאיפת isofלאנה והגפיים התחתונות מגולחים. (ב) 29 גרם מחט מוזרק לתוך השריר הקדמי הטישורי (C) והועבר לאורך עצם השוקה במהלך ההזרקה של הפתרון קרדיאטוקסין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
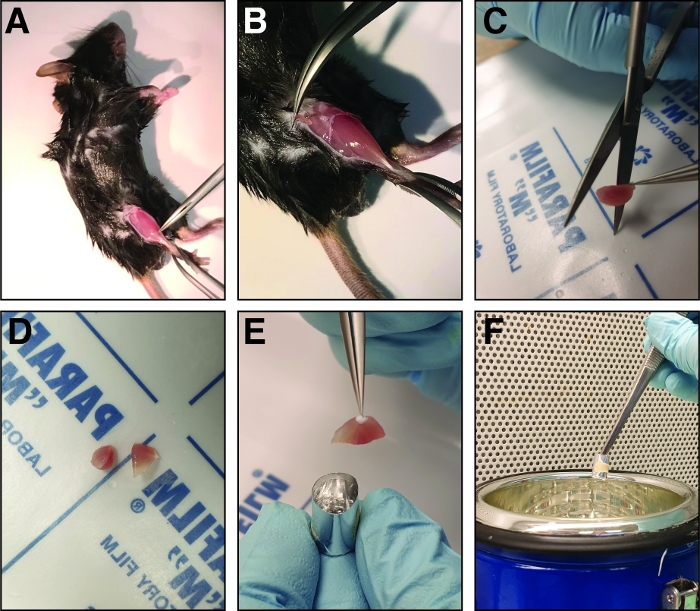
איור 2: שלבים המעורבים בניתוח והקפאת השריר הקדמי הפצוע. (א) שרירי הגפיים האחוריות חשופים (ב) ו fascia המקיפים את השריר הקדמי החישורי נקרע כדי לחשוף את השריר. (ג) לאחר הסרת השריר, הוא נחתך באזור הבטן האמצעית לשני חצאים של גודל דומה באמצעות מספריים ישרים חדה (D). (ה) החצאים של השריר הגזור מוטבעים בעובש רדיד אלומיניום מלא בתמיסה קפואה וקפוא בחנקן נוזלי (F). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: ציוד ושלבים המעורבים בהקפאה של השרירים הקדמי השרישורי. (א) הטמפרטורה הקאמרית של הקריוסטט מוגדרת ל-21 ° c. (ב) השריר החישורי הקדמי בתמיסת ההקפאה מותקן על מחזיק המדגם. (ג) סעיפים 14 יקרומטר מחוברים שקופיות מיקרוסקופ זכוכית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
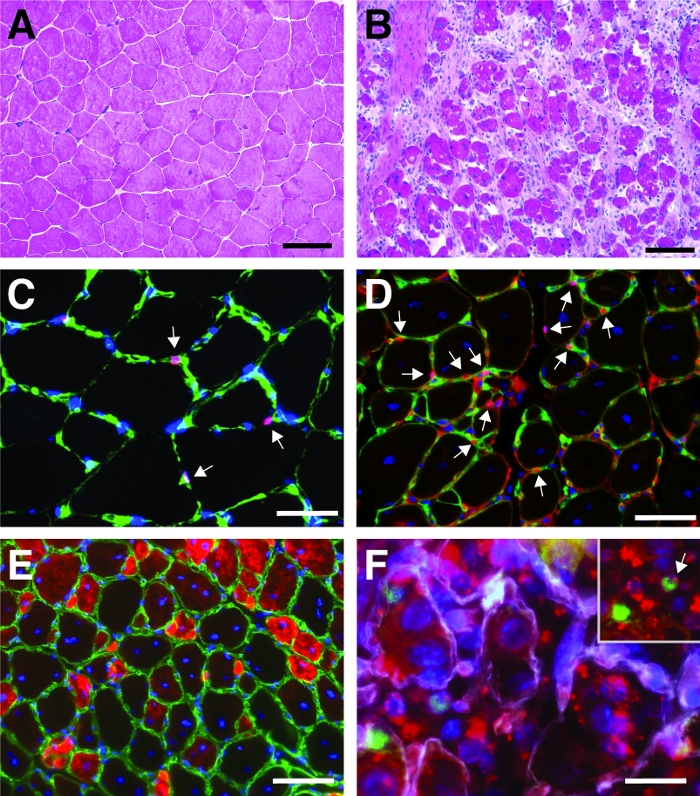
איור 4: תמונות מייצגות של מתחדשות השרירים הקדמי השרישורי. H & E כתמים של השרירים הקדמי הקרדיאטוקסין לפני (A) ו -7 ימים לאחר פציעה (ב). (ג) בתאי לווין שPax7 חיוביים (באדום) ממוקמים מתחת ללאטינה הבסיס המסומן על ידי למינציה (בירוק). גרעינים מוכתם נגד DAPI (בכחול). Pax7 תאים חיוביים מסומנים בחץ. (ד) לאחר 10 ימים של התחדשות, סיבי מיוים מאופיינים על ידי גרעין ממוקם במרכז (בכחול), Pax7 מוצג באדום, למינציה בירוק. Pax7 תאים חיוביים מסומנים בחץ. (ה) שנוצר מחדש סיבים התפתחותיים רירן (באדום), הלמינציה בירוק, גרעינים מוכתם נגד dapi (בכחול). (ו) באמצעות התווית העצמית שכותרתו Sirna (sired, מתואר באדום) עדיין נמצא בתאי לווין (Pax7 חיוביים, בירוק, מסומן על ידי חץ בכניסה) 2 ימים לאחר ההזרקה של העצמי הספק sirna לתוך ליצור מתחדשות הקדמי הבריא שריר (הזרקה ביום 3 לאחר פציעה קרדיאטוקסין מתווכת). הלמינציה מוצגת בלבן, גרעינים מוכתמים באמצעות DAPI (בכחול). סרגל בקנה מידה = 100 יקרומטר (A ו-B), 50 יקרומטר (C-E), 25 יקרומטר (F). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
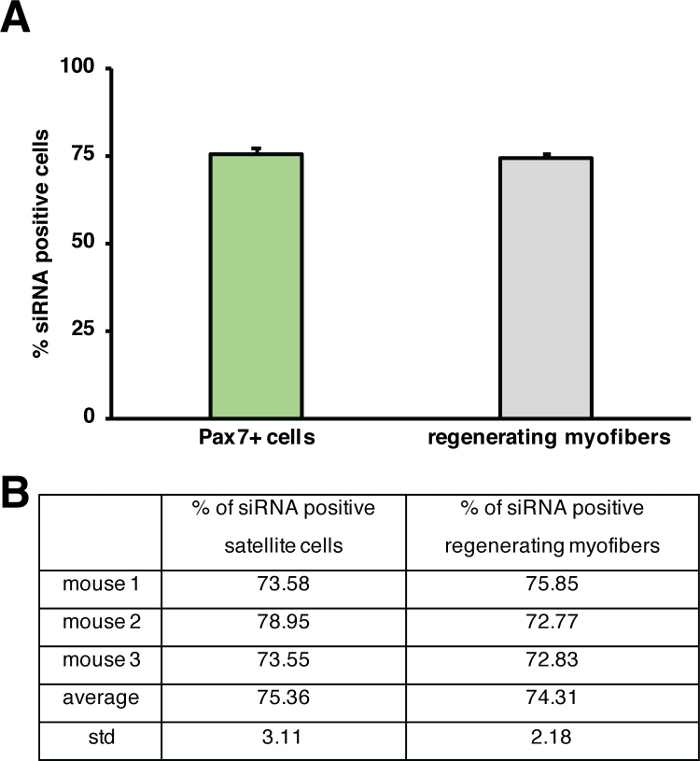
איור 5: כימות הספיגה של siRNA המסומנת בדגל. (א) כימות של ספיגת sirna על ידי תאי לווין (Pax7 + תאים) ומתחדשות מיואיים 2 ימים לאחר ההזרקה לתוך שריר השלד מתחדשות. הזריקה בוצעה ביום 3 לאחר קרדיאטוקסין מתווכת פציעה. n = 3, קווי שגיאה מציגים את ה-SEM. (B) כבסיס לגרף המתואר ב-(א). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
כאן אנו מציגים שיטה לחקור את הפונקציה של גן מסוים במהלך התחדשות של שריר השלד ללא צורך בעלי חיים טרנסגניים. זה מושגת על ידי שילוב של פגיעה קרדיאטוקסין שרירים המושרה עם הזריקה של הספק העצמי siRNA לתוך שריר השלד מתחדשות ביום 3 לאחר הפציעה. תיארנו בפרוטרוט את ההליכים של פגיעה בשריר ידי קרדיאטוקסין, ההזרקה של הספק העצמי siRNA ועיבוד של השרירים שנקטפו לנתח את ההתקדמות של התחדשות. אנו מדגימים כי הזרקה של ארס נחש קרדיאטוקסין לתוך שריר השלד ביעילות פוגעת השריר כולו, כי האספקה עצמית sirnas נמצאים סביב 75% של כל תאי הלווין בין סוגי תאים אחרים יומיים לאחר ההזרקה שלהם לתוך ה מתחדשות שריר השלד (איור 4, איור 5).
תשומת לב מיוחדת צריך להיות ממוקד על פציעה הומוגנית של השריר הקדמי התחדשות מאז דרגות שונות של פגיעה בתוצאת ההתחדשות ובכך גם את ההשפעה של siRNA עשוי להיות מושפע. יתר על כן, חשוב בצורה קריטית כי כל האזור מתחדשות מוזרק עם הספק העצמי siRNA. לניתוח של תהליך ההתחדשות, מומלץ תמיד להשוות אזורים דומים של שריר השלד מתחדשות, ולכן, השריר הקדמי הפיזי צריך להיות חתוך במחצית להשוות תמיד את אזור הבטן האמצעית של השריר. כאשר לנתח את השריר, את כל הקריודור כל צריך להיות מנותח מאז הרכב מיוכי סיבים שונה השריר הקדמי החדש ולכן עשוי להתחדש באופן שונה.
הפונקציה של תאי לווין יכול להיות נחקר על ידי הליכים ניסיוניים שונים, כולל התרבות שלהם על הסמוך המבודד היחיד מיוסיבים17, על ידי השתלת ועל ידי ניתוח התחדשות של שריר השלד לאחר פציעה מושרה 18,19. חקירת הפונקציה של תאי לווין באמצעות מודל פציעה vivo מושרה, למשל, הזרקה של קרדיאטוקסין, מספק את היכולת לנתח את הפונקציה תא לווין גם במונחים של האינטראקציה שלהם עם סוגי תאים אחרים כגון מקרופאגים ו חקירת השפעת גורמים מערכתית2. הפציעה של שריר השלד יכול להתבצע על ידי אמצעים שונים, למשל, תרגיל תמהוני, הקפאת פציעה, הזרקה של bacl2 או הזרקה של מסוכנים נחש כגון קרדיאטוקסין או notexin18. בעוד תרגיל מוזר הוא כנראה שיטת הפציעה הפיזיולוגית ביותר, הפגיעה בשריר אחד מסוים מוגבלת רק20. פציעות הקפאה ניתן להחיל כאשר הגירה של תאי לווין לכיוון האתר של פציעה הוא מטרת המחקר או רק חלק ספציפי של השריר צריך להיפגע. ניסויים בחיסרון של פציעות הקפאה הוא הניתוח הפתוח שצריך לבצע כדי ליישם את הבדיקה מתכת מקורר. הזרקה של bacl2 או מסוכנים נחש היא השיטה הדרמטית ביותר של פציעה, ובכך מאתגר תא לווין הפונקציה ביותר. יתר על כן, הזריקה היא פולשנית מינימלית, זמן ניתוח, באופן כללי, הוא פחות מחמש דקות ואינו כרוך suturing, וכו '. ובכך למזער את הסיכון של זיהומים.
פגיעה בשריר משמשת בעיקר כדי לחקור את ההשלכות הפונקציונליות של אובדן של פונקציות גנים, למשל, אובדן של Pax77,21. במיוחד אם עכברים מיושנים הם המוקד של השאלה המדעית, הדור או השימוש בעכברים טרנסגניים הוא לעתים קרובות לא ריאלי. הזרקה של הספק העצמי siRNAs המיקוד גן ספציפי הוא חלופה קיימא במקרים אלה והשתמשו בהצלחה22. בקצרה, השרירים הקדמי הפרושורי של עכברים נפצע על ידי הזרקה של קרדיאטוקסין והספק העצמי siRNAs מכוון נגד fibronectin (FN) הוזרק ביום 3 לאחר הפציעה. שרירים נותחו 10 ימים לאחר הפציעה וירידה משמעותית במספרים תא לווין נצפתה siFN לעומת התנאים siRNA שליטה מקושקשות. היעילות של הנוק-אין נקבע ב-lysates שרירים שלמים על ידי ה-PCR בזמן אמת כמותי 2 ימים לאחר הזרקת siRNA, ירידה ברמות הביטוי של 58% הושג כי מסירה ו-מציאה יעילות מספיקים עבור פונקציונלי ניתוח22. חלופות לבדיקת יעילות הנוק-אין הן או כתמי החיסונית או ניתוח חיסוני או נוגדנים המכוונים נגד הגן היעד. את היעילות ואת הספציפיות של siRNA המשמש זריקות vivo צריך להיקבע לפני הזרקה לתוך עכברים, למשל, על ידי בדיקת היעילות בתאי לווין מבודדים או myoblasts חזיק ראשוני. השימוש במאגר חכם המורכב 4 siRNAs שונים לעומת Sirnas יחיד מגביר את היעילות של הסתרה, אך גם מגביר את הסיכון של המיקוד לא ספציפי. הספציפיות של כל רצפי siRNA המשמשים צריך להיבדק בתרבות התא כדי למנוע אפקטים מחוץ ליעד. כפקד, לא מיקוד מקושקשות siRNA יש להשתמש מאז ההזרקה של siRNA למשל עלול להשפיע על תהליך התחדשות בשל הזריקה, ובכך, נזק נוסף של השריר. נקודת הזמן של הזרקת siRNA היא בהתאם לשאלה המדעית ועל פרופיל הביטוי של הגן היעד. באופן כללי, הזרקה של הספק עצמית siRNA ביום 3 לאחר קרדיאטוקסין פציעה מטרות רוב הגנים חשוב עבור התפשטות תא לווין מאז פסגות לווין הפצת התפשטות סביב היום 3 לאחר הפציעה. נקודת הזמן עבור הזרקת siRNA הראשון לא צריך להיות פחות מ 48 h לאחר פציעה קרדיאטוקסין מאז נפח ההזרקה של קרדיאטוקסין הוא גבוה למדי וספיגה מחדש של הנוזל היה צריך להתרחש לפני הזרקת פתרונות נוספים לתוך השריר. באופן כללי, זריקות מרובות של siRNAs או שילוב של siRNAs שונים אפשרי למרות שצריך לשקול כי כל הזרקה לתוך השריר מחדש גורם נזק נוסף.
מגבלה אחת של השיטה המתוארת היא העובדה, כי ההשפעה נצפתה היא לא בהכרח רק תלוי בנוק של הגן היעד בתאי לווין, אבל יכול להיות מיוחס סוגים אחרים של תאים כגון תאים חיסוניים או בתאי מחולל הזרע fibro. לכן, יש צורך לשלב ניסויים אלה עם ניסויים בחקירת אוכלוסייה טהורה של תאי לווין. אפשר לבצע ניסויים באמצעות תרבויות מיוסיבים צף, שבו תאי לווין הם מתורבתים על הסיבים הסמוכים שלהם או לבצע ניסויים השתלת באמצעות תאי לווין מבודדים17.
חלופה להזרקה של הספק העצמי siRNAs היא הזרקה של מעכבי מולקולה קטנה או חלבונים רקומביננטי אשר ניתן לבצע, בהתאם לשאלה המדעית. למשל, ההזרקה של חלבון מטריקס fibronectin או מולקולה קטנה מעכבי של JAK/STAT איתות בוצע בהצלחה עכברים בגילאי15,16. ניתוח של פונקציה גנטית מסוימת סוג תא אחד במהלך התחדשות של שריר השלד, למשל, בתאי לווין, ניתן רק באמצעות שימוש של מודל העכבר הגנטי inducible. זריקות של הספק העצמי siRNAs, חלבונים רקומביננטי או מעכבי מולקולה קטנה עשויה להשפיע על סוגי תאים מרובים להתחדשות שריר השלד.
Disclosures
היינו רוצים להודות לכריסטינה בוחר וכריסטין מתחזה לסיוע טכני מעולה ו Saskia שטיינר לעזרה עם קביעת היעילות של הטיפול siRNA. אנו מודים לשירות הליבה היסטולוגיה לתמיכה טכנית גדולה, במיוחד סבין לנדמן ולינדה רות'נבורגר. אנחנו גם מודים לעכבר מתקן החי ב FLI לתמיכה מעולה. עבודה זו נתמכה על ידי מענקים מתוך הגרמני Forsch, מייסמייססלססרמייישסביםף (MA-3975/2-1) והגרמני (DKH-JvM-861005) לJ.v.M.
Acknowledgements
המחברים לא מצהירים על אינטרסים פיננסיים מתחרים.
Materials
| Name | Company | Catalog Number | Comments |
| Isoflurane | Henry Schein | Isothesia | inhalation narcotics |
| Hot Plate 062 | Labotect | 13854 | |
| Anesthesia System (Tec 7) with inhalation box + nose masks | Tem Sega | Minihub | |
| Shaver for rodents | isis | GT420 | |
| Cardiotoxin | Latoxan | L8102 | snake venom needed for muscle injury |
| Accell siRNA smart pool | Dharmacon | depending on your target gene | self delivering siRNA |
| Alexa Fluor 488 donkey anti-rabbit IgG | Thermo Fisher | A-21206 | secondary antibody |
| Alexa Fluor 546 goat anti-mouse IgG1 | Thermo Fisher | A-21123 | secondary antibody |
| Coverslips | VWR | 631-1574 | |
| CV Mount | Leica | 14046430011 | mounting medium for immunohistochemistry |
| DAPI | Sigma Aldrich | D9542 | nuclear staining |
| devMHC antibody | DHSB | F.1652 | |
| Eosin Y | Thermo Fisher | 73104 | |
| Haematoxylin Gill No3 | Sigma-Aldrich | GHS316-500ML | |
| Insulin syringe (29 g) | Terumo | 3SS05M2813 | syringue used for muscle injections |
| Laminin antibody | Sigma Aldrich | L9393 | |
| M.O.M blocking reagent | Vector labs | MKB-2213 | blocking for immunofluorescent staining |
| Meloxicam | Boehringer Ingelheim | Metacam | analgesics |
| OCT | Thermo Fisher | 6502 | tissue embedding |
| Pax7 antibody | DSHB | PAX7 | satellite cell specific antibody |
| ProLong Gold Antifade Mountant | Thermo Fisher | P36934 | aequos mounting medium |
| Sucrose | Carl Roth | 4621.1 | tissue embedding |
| Superfrost plus | Thermo Scientific | J1830AMNZ | microscope slides |
| TritonX-100 | Amresco | 0694-1L | permeabilization reagent |
| Dissection tools | |||
| Dumont 5, straight | Fine Science Tools | 11295-10 | |
| Dumont 7, curved | Fine Science Tools | 11272-40 | |
| Extra fine Bonn scissors (cutting edge: 13 mm) | Fine Science Tools | 14084-08 | |
| Narrow pattern forceps | Fine Science Tools | 11002-16 | |
| Spring scissors (cutting edge: 5 mm, tip diameter: 0.35 mm) | Fine Science Tools | 91500-09 |
References
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Schmidt, M., Schuler, S. C., Huttner, S. S., von Eyss, B., von Maltzahn, J. Adult stem cells at work: regenerating skeletal muscle. Cellular and Molecular Life Sciences. , (2019).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytolology. 9, 493-495 (1961).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- von Maltzahn, J., Jones, A. E., Parks, R. J., Rudnicki, M. A. Pax7 is critical for the normal function of satellite cells in adult skeletal muscle. Proceedings of the National Academy of Sciences of the United States of America U S A. 110 (41), 16474-16479 (2013).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Bentzinger, C. F., Wang, Y. X., Rudnicki, M. A. Building muscle: molecular regulation of myogenesis. Cold Spring Harb Perspectives in Biology. 4 (2), (2012).
- Schworer, S., et al. Epigenetic stress responses induce muscle stem-cell ageing by Hoxa9 developmental signals. Nature. 540 (7633), 428-432 (2016).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506 (7488), 316-321 (2014).
- Dumont, N. A., et al. Dystrophin expression in muscle stem cells regulates their polarity and asymmetric division. Nature Medicine. 21 (12), 1455-1463 (2015).
- von Maltzahn, J., Renaud, J. M., Parise, G., Rudnicki, M. A. Wnt7a treatment ameliorates muscular dystrophy. Proceedings of the National Academy of Sciences of the United States of America U S A. 109 (50), 20614-20619 (2012).
- Price, F. D., et al. Inhibition of JAK-STAT signaling stimulates adult satellite cell function. Nature Medicine. 20 (10), 1174-1181 (2014).
- Lukjanenko, L., et al. Loss of fibronectin from the aged stem cell niche affects the regenerative capacity of skeletal muscle in mice. Nature Medicine. 22 (8), 897-905 (2016).
- Huttner, S. S., et al. Isolation and Culture of Individual Myofibers and Their Adjacent Muscle Stem Cells from Aged and Adult Skeletal Muscle. Methods in Molecular Biology. , (2019).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PLoS One. 11 (1), e0147198 (2016).
- Hall, M. N., et al. Transplantation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 1556, 237-244 (2017).
- Dueweke, J. J., Awan, T. M., Mendias, C. L. Regeneration of Skeletal Muscle After Eccentric Injury. Journal of Sport Rehabilitation. 26 (2), 171-179 (2017).
- Lepper, C., Conway, S. J., Fan, C. M. Adult satellite cells and embryonic muscle progenitors have distinct genetic requirements. Nature. 460 (7255), 627-631 (2009).
- Bentzinger, C. F., et al. Fibronectin regulates Wnt7a signaling and satellite cell expansion. Cell Stem Cell. 12 (1), 75-87 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved