Method Article
Caratterizzare il carico mutazionale e la composizione clonale del sangue umano
In questo articolo
Riepilogo
I modelli di mutazione somatica nelle cellule riflettono una precedente esposizione mutagena e possono rivelare relazioni di lignaggio dello sviluppo. Qui è presentata una metodologia per catalogare e analizzare le mutazioni somatiche nelle singole cellule staminali ematopoietiche e progenitrici.
Abstract
Le cellule staminali ematopoietiche e progenitrici (HPG) accumulano gradualmente mutazioni del DNA durante una vita, che possono contribuire a malattie associate all'età come la leucemia. Caratterizzare l'accumulo di mutazioni può migliorare la comprensione dell'eziologia delle malattie associate all'età. Presentato qui è un metodo per catalogare le mutazioni somatiche nei singoli HSPC, che si basa sul sequenziamento dell'intero genoma (WGS) delle colture cellulari primarie clonali. Le mutazioni presenti nella cellula originale sono condivise da tutte le cellule della coltura clonale, mentre le mutazioni acquisite in vitro dopo lo smistamento delle cellule sono presenti in un sottoinsieme di cellule. Pertanto, questo metodo consente di rilevare accuratamente le mutazioni somatiche presenti nei genomi dei singoli HSPC, che si accumulano durante la vita. Questi cataloghi di mutazioni somatiche possono fornire preziose informazioni sui processi mutazionali attivi nel tessuto ematopoietico e su come questi processi contribuiscono alla leucemogenesi. Inoltre, valutando le mutazioni somatiche condivise tra più HPC dello stesso individuo, è possibile determinare le relazioni di lignaggio clonale e le dinamiche della popolazione delle popolazioni ematiche. Poiché questo approccio si basa sull'espansione in vitro di singole cellule, il metodo è limitato alle cellule ematopoietiche con un potenziale replicativo sufficiente.
Introduzione
L'esposizione di cellule staminali ematopoietiche e progenitrici (HPG) a fonti mutagene endogene o estrinseche contribuisce al graduale accumulo di mutazioni nel DNA durante una vita1. L'accumulo graduale di mutazioni negli HSPC1 può provocare l'ematopoiesi clonale legata all'età (ARCH)2,3, che è una condizione non sintomatica guidata da HSPC che trasportano mutazioni leucemia-driver. Inizialmente, si è pensato che gli individui con ARCH hanno un aumentato rischio di leucemia2,3. Tuttavia, studi recenti hanno dimostrato un'incidenza del 95% di ARCH negli individui anziani4, rendendo meno chiara l'associazione con le neoplasie e sollevando la questione del motivo per cui alcuni individui con ARCH alla fine sviluppano neoplasie. Ciò nonostante, le mutazioni somatiche negli HSPC possono comportare gravi rischi per la salute, poiché i disturbi della mielidisticità e la leucemia sono caratterizzati dalla presenza di specifiche mutazioni del driver del cancro.
Per identificare i processi mutazionali e studiare la clonalità del sangue, è necessario caratterizzare l'accumulo di mutazioni nei singoli HSPC. I processi mutazionali lasciano modelli caratteristici nel genoma, le cosiddette firme mutazionali, che possono essere identificate e quantificate in raccolte di mutazioni a livello di genoma5. Ad esempio, l'esposizione alla luce UV, gli agenti alchilanti e i difetti nelle vie di riparazione del DNA sono stati associati a una diversa firma mutazionale6,7. Inoltre, a causa della natura stocastica degli accumuli di mutazione, la maggior parte (se non tutte) delle mutazioni acquisite sono uniche tra le cellule. Se le mutazioni sono condivise tra più cellule dello stesso individuo, indica che queste cellule condividono un antenato comune8. Pertanto, valutando le mutazioni condivise, le relazioni di lignaggio possono essere determinate tra le cellule e un albero di lignaggio dello sviluppo può essere costruito ramo per ramo. Tuttavia, catalogare rare mutazioni somatiche nelle cellule fisiologicamente normali è tecnicamente impegnativo a causa della natura policlonale dei tessuti sani.
Presentato qui è un metodo per identificare e determinare con precisione le mutazioni somatiche nei genomi dei singoli HSPC. Ciò comporta l'isolamento e l'espansione clonale degli HSPC in vitro. Queste colture clonali riflettono la composizione genetica della cellula originale (cioè le mutazioni nella cellula originale saranno condivise da tutte le altre cellule della coltura). Questo approccio ci permette di ottenere DNA sufficiente per il sequenziamento dell'intero genoma (WGS). Abbiamo dimostrato in precedenza che le mutazioni accumulate in vitro durante la coltura clonale saranno condivise da un sottoinsieme di cellule. Ciò consente il filtraggio di tutte le mutazioni in vitro, in quanto queste saranno presenti in una frazione più piccola di letture rispetto alle mutazioni acquisite in vivo9. I metodi precedenti hanno ottenuto DNA sufficiente da una singola cellula per il WGS utilizzando l'amplificazione dell'intero genoma (WGA)10. Tuttavia, lo svantaggio principale di WGA è la sua amplificazione relativamente soggetta a errori e sbilanciata del genoma, che può provocare abbandoni degli alleli11. Ciò nonostante, poiché questo approccio si basa sull'espansione in vitro di singole cellule, è limitato alle cellule del sangue con un potenziale replicativo sufficiente, che non è il caso per i metodi dipendenti da WGA. Gli sforzi precedenti di sequenziamento delle colture clonali si sono affidati all'utilizzo di strati di alimentazione per garantire l'amplificazione clonale di singoli HSPC12. Tuttavia, il DNA proveniente dagli strati dell'alimentatore può potenzialmente contaminare il DNA delle colture clonali, confondendo la successiva chiamata e filtraggio della mutazione. Il metodo qui presentato si basa esclusivamente su un mezzo specificato per espandere clonalmente singoli HSPC, evitando quindi il problema della contaminazione del DNA. Fino ad ora, abbiamo applicato con successo questo metodo sul midollo osseo umano, sul sangue del cordone, sul midollo osseo congelato e sul sangue periferico.
Protocollo
I campioni devono essere ottenuti in conformità con i protocolli etici appropriati e i donatori devono dare il consenso informato prima della procedura.
1. Preparazione del materiale campione
NOT: Quando si lavora con materiale appena ottenuto, iniziare con il passaggio 1.1. Quando si lavora con materiale congelato, iniziare con il passaggio 1.2.
-
Preparazione del midollo osseo fresco, del sangue cordonale o del sangue periferico
- Isolare la frazione mononucleare dal campione utilizzando la separazione del gradiente di densità seguendo le istruzioni dei produttori (vedere Tabella dei materiali) e contare le cellule mononucleari utilizzando un emocitometro. Dopo l'isolamento delle cellule mononucleari, proseguire con il passaggio 1.3.
- FACOLTATIVO: Il numero consigliato di celle necessarie per ordinare una piastra completa di 384 pozze lunanti è 1–2 x 107. Se più cellule sono isolate durante la centrifugazione del gradiente di densità, immagazzinare l'eccedenza di cellule nell'azoto liquido.
- Risospendere le celle in 5000 % di IMDM - 10% FBS per 1 x 107 celle, e aggiungere goccia per goccia un volume uguale di IMDM - 30% FBS - 20% DMSO per ottenere una sospensione di 1 x 107 celle in 1 mL di IMDM - 20% FBS - 10% DMSO.
- Trasferire immediatamente le cellule mononucleari a 1 mL di fiale criogeniche e congelare le cellule a -80 gradi centigradi in un contenitore di congelamento delle cellule a velocità controllata durante la notte. Trasferire le cellule il giorno successivo in una conservazione di azoto liquido dopo un'ulteriore lavorazione.
-
Preparazione di cellule mononucleari congelate da midollo osseo, sangue cordonale o sangue periferico
- Preparare 50 mL di mezzo di scongelamento cellulare contenente 45 mL del mezzo dell'aquila modificato di Iscove (IMDM) e 5 mL di siero bovino fetale (FBS), e riscaldare in bagno d'acqua a 37 gradi centigradi.
- Prendere la fiala contenente il campione dalla conservazione liquida dell'azoto, trasferire il campione in ghiaccio asciutto e scongelare il più rapidamente possibile in un bagno d'acqua a 37 gradi centigradi.
- Quando il campione è quasi scongelato, pulire la fiala con il 70% di etanolo e trasferirne il contenuto in un tubo conico da 50 mL. Sciacquare la fiala con 1 mL di IMDM preriscaldato - 10% FBS per raccogliere le cellule rimanenti, e aggiungere questa soluzione dropwise (5 s per goccia) al campione scongelato mentre vorticoso delicatamente il tubo.
- Aggiungere al campione un ulteriore 15 mL preriscaldato di IMDM al 10% FBS dropwise mentre gira delicatamente il tubo.
- Pellet le cellule per centrifugazione per 5 min a 350 x g.
- Rimuovere tutti tranne 3 mL del super-natante. Risospendere le cellule nel restante supernatante e diluire aggiungendo 20 mL di IMDM - 10% FBS goccia dopo goccia mentre scuote delicatamente il tubo.
- Prendere 10 l della sospensione cellulare per il conteggio delle celle. Diluire questi 10 L aggiungendo 20 L di 0,4% soluzione blu trypan e contare le celle utilizzando un emocitometro. Il numero di cellule può diminuire allo scongelamento, con fino al 50% di perdita di cellule dopo lo scongelamento. La vitalità cellulare dovrebbe variare tra il 70% e il 90%.
- Se si lavora con midollo osseo o cellule del sangue del cordone ombelicale, assumere 5 x 106 cellule mononucleari per la coltura MSC (passaggio 2.1). Se si lavora con il sangue periferico, assumere 2–5 x 106 cellule per l'isolamento delle cellule T (passaggio 2.2)
- Pellet rimanente celle 5 min a 350 x g e resuspend in 3 mL di buffer FACS (0.05% BSA - 1 mM EDTA in PBS).
- Trasferire 1 x 105 cellule in un microtubo riempito con 200 l di tampone FACS, che servirà come controllo negativo per la citometria di flusso (passaggio 3.8), e mantenere il ghiaccio.
2. Cultura cellulare
NOT: Per ottenere cataloghi di mutazioni somaticamente acquisite, è necessario filtrare la variazione germinale specifica del donatore. Quando si inizia con biopsie del midollo osseo o sangue del cordone ombelicale, le cellule stromali mesenchymal (MSC) possono essere utilizzate come controllo abbinato per filtrare per la variazione germinale. In questo caso, seguire la sezione 2.1. Quando si utilizza il sangue periferico (mobilizzato) seguire il passaggio 2.2 per isolare e utilizzare le cellule T come campione di controllo corrispondente per filtrare la variazione germinale (Figura 1). La popolazione di massima cellule T condividerà la stessa relazione di lignaggio degli HSPC.
-
Cultura MSC
- Preparare 50 mL di supporto MSC contenente 45 mL di mezzo DMEM/F12, 10% FBS, 500 L di trippsina o trippsina alternativa, e 500 L di soluzione penicillina/streptomicina.
- Piastra approssimativamente 5 x 105 celle mononucleari in 1,5 mL di MSC medio per pozzo. Collocare le cellule in un'incubatrice umidificata a 37 gradi centigradi con il 5% di CO2.
- Sostituire il mezzo dopo 24 h e successivamente sostituire il medio ogni 3 giorni per garantire che tutte le cellule ematopoietiche vengano lavate via. Continuare a fare cultura fino a quando la confluenza è del 100%.
- Se le MSC sono confluenti, lavare le cellule con 1 mL di PBS e raccogliere i MSC aggiungendo 200 - L di trypsin o trypsin alternativa per pozzo. Incubano le cellule per 5 min a 37 . Aggiungere 800 l di mezzo MSC e pipet le cellule su e giù per allentare le cellule dalla piastra del pozzo.
- Trasferire MSC nel tubo di microcentrifuga e pellet le cellule per centrifugazione per 5 min a 350 x g. Rimuovere il supernatante e continuare con l'isolamento del DNA o conservare il pellet a -20 gradi centigradi per un successivo isolamento del DNA (sezione 4).
-
Isolamento delle celle a T
NOT: Se si utilizza sangue periferico (mobilizzato), i litorali possono essere isolati e utilizzati come controllo germinale.- Risospendere il pellet cellulare in 100 l di soluzione di colorazione anti-CD3 (1:100 diluizione di anticorpi anti-CD nel buffer FACS).
- Lavare le celle aggiungendo 1 mL di buffer FACS. Pellet le cellule per centrifugazione per 5 min a 350 x g e resospendere in 300 .
- Isolare almeno 5 x 105 cellule CD3 utilizzando un sorter FACS in un tubo di polistirolo da 5 mL pre-riempito con 1 mL di FBS.
- Pellet le cellule ordinate utilizzando la centrifugazione per 5 min a 350 x g, rimuovere il supernatante, e continuare direttamente con l'isolamento del DNA (sezione 4) o conservare il pellet a -20 gradi centigradi per un successivo isolamento del DNA.
3. Isolamento, ordinamento e cultura HSPC
- Ruotare verso il basso a 1-2 x 107 celle mononucleari per 5 min a 350 x g e risospendere in 50 : L di buffer FACS (vedi passo 2.2.1). Trasferire le cellule in un tubo di microcentrifuga.
NOT: Durante l'ordinamento con >2 x 107 cellule, aumentare di conseguenza la miscela di anticorpi e i volumi del buffer FACS. - Preparare 50 l di 2x HSC colorazione mix secondo la ricetta vista nella tabella 1.
| anticorpo | volume [L] |
| BV421-CD34 | 5 Del numero 3( |
| Mix FITC-Lineage (CD3/14/19/20/56) | 5 Del numero 3( |
| PE-CD38 | 2 Il nome del sistema |
| APC- CD90 | 0,5 0,5 |
| PerCP/Cy5.5 - CD45RA | 5 Del numero 3( |
| PE/Cy7- CD49f | 1 : il nome del |
| FITC -CD16 | 1 : il nome del |
| FITC-CD11 | 5 Del numero 3( |
| Buffer FACS | 25,5 Anni |
Tabella 1: miscela di ordinamento HSC. Mostrato è una tabella che indica le diluizioni degli anticorpi utilizzati per ordinare gli HSC.
- Mescolare 50 l di soluzione cellulare con la miscela di colorazione HSC preparata e incubare le cellule per 15 min a temperatura ambiente (RT) o per 1 h sul ghiaccio per gli anticorpi da legare.
- Lavare le cellule aggiungendo 1 mL di buffer FACS e pellet centrifugando per 5 min a 350 x g.
- Risospendere le cellule in 300 o L di TAC tampone e filtrare la sospensione cellulare attraverso un tubo di polistirolo da 5 ml di cellule da 35 m per rimuovere i grumi cellulari prima dello smistamento delle cellule attivato dalla fluorescenza (FACS).
- Preparare 25 mL di hSPC coltura medio, costituito da 1x SFEM medio integrato con 100 ng/mL SCF, 100 ng/mL Flt3, 50 ng/mL TPO, 10 ng/mL IL-3, 20 ng/mL IL- 6 e 100 ng/mL formulazione antibiotica (vedere Tabella dei materiali).
- Riempire una piastra di coltura cellulare 384 bene con 75 L di HSPC coltura medio in ogni pozzo.
NOT: Per evitare l'evaporazione del mezzo nei pozzetti esterni, riempire i pozzetti esterni con 75 - L di acqua sterile o PBS, e non utilizzare questi pozzi per lo smistamento cellulare. -
Ordinamento di singoli HSPC
- Impostare i gate per l'ordinamento HSPC in base a un controllo non colorato (passaggio 1.9) e 10.000 celle dal campione colorato. Un risultato rappresentativo per l'impostazione dei cancelli è illustrato nella Figura 1. Cancello singole celle disegnando un cancello intorno alla frazione lineare FSC-height vs FSC-area. Utilizzare la frazione di controllo non macchiato per disegnare cancello per lignaggio- frazione. Disegnare i gate per CD34- celle e caratterizzare ulteriormente questo sottoinsieme impostando un cancello specifico per le celle CD38- CD45RA- .
- Caricare la piastra 384 pozzo sulla macchina FACS e ordinare singole celle.
NOT: Se applicabile alla macchina FACS, attivare l'opzione per mantenere i dati di ordinamento dell'indice per consentire la ritraccia delle celle ordinate.
-
Culturing HSC ordinati in modo singing
- Trasferire direttamente la piastra 384 bene su un'incubatrice umidificata di 37 gradi centigradi con il 5% di CO2.
NOT: Per evitare l'evaporazione durante la coltura, avvolgere la piastra di coltura 384 ben (con coperchio) in involucro trasparente di polietilene. - Tenere la piastra 384 bene nell'incubatrice per 3-4 settimane fino a quando non appaiono cloni visibili. Immagini rappresentative della cultura clonale sono illustrate nella figura 2. In base alle condizioni del materiale di input 5%–30% delle celle ordinate si espande clonalmente.
- Trasferire direttamente la piastra 384 bene su un'incubatrice umidificata di 37 gradi centigradi con il 5% di CO2.
4. Raccolta di cloni HSPC
- Dopo 4 settimane di coltura, determinare quali pozzi hanno una confluenza del 30% o superiore.
- Pre-riempimento (per ogni escrescenza clonale) 1,5 mL microtubi con 1 mL di 1% BSA in PBS ed etichettare il tubo in base al pozzo corrispondente.
- Pre-bagnata una punta di pipetta con 1% BSA in PBS per ridurre al minimo il numero di cellule che si attaccano alla punta della pipetta.
- Pipet su/giù il mezzo nel pozzo ferocemente (almeno 5 volte) con una pipetta 200 L (impostato a 75 l) e raschiare il fondo del pozzo per allentare le cellule nel pozzo, e raccogliere la sospensione cellulare nel microtubo etichettato corrispondente al pozzo.
- Prendere 75 - L di fresco 1% BSA in PBS e ripetere il pipettaggio nel pozzo per garantire il massimo assorbimento delle cellule.
NOT: Le cellule clonalmente coltivate possono attaccarsi al fondo del pozzo. Ispezionare i pozzetti utilizzando un microscopio luminoso invertito standard per verificare se tutte le cellule sono state raccolte. - Se sono stati raccolti tutti i pozzi con confluenza >30%, rimettere la piastra 384 in incubatrice. Le culture clonali possono proliferare fino a 5 settimane.
- Girare verso il basso la sospensione cellulare per 5 min a 350 x g. Un piccolo pellet dovrebbe essere visibile.
- Rimuovere con cautela tutti, tranne circa 5 - L di supernatali. I pellet cellulari possono essere congelati a -20 gradi centigradi e conservati per più mesi prima dell'isolamento del DNA.
5. Isolamento del DNA
-
Isolare il DNA HSPC e MSC/T-cell utilizzando un kit di isolamento del DNA su microscala secondo le istruzioni del produttore con le seguenti regolazioni:
- Aggiungere 2 - L di RNase A dopo l'aggiunta di buffer AL durante la sezione 2. Incubare per 2 min prima di aggiungere la proteinasi K.
- Incubare per 30 min a 56 gradi centigradi invece di 10 min.
- Eluire il DNA caricando la colonna con 50 gradi di buffer TE con EDTA basso (10 mM Tris, 0,1 mM EDTA). Per un'eluizione ottimale, ricaricare nuovamente l'eluate sulla colonna e ruotare di nuovo.
- Determinare la concentrazione di DNA utilizzando un DNA misurando 2 l per clone. La resa del DNA varia in genere tra 0,5-3 ng/L.
6. Sequenziamento
- Eseguire il sequenziamento del DNA come descritto da Jager et al.
7. Mappatura e chiamata di mutazione somatica
- Mappare l'output dei file di sequenziamento (file FASTQ) al genoma di riferimento e chiamare le mutazioni come descritto in Jager et al.
- Ispezionare i dati per le modifiche cariopiciche aberranti nei cloni in sequenza e nei dati collettivi utilizzando uno strumento di analisi dei numeri di copia, ad esempio Control-FreeC14. Fino ad ora, non abbiamo segnalato alcun HSPC con aberofi cariotipici.
- Generare una blacklist, costituita da un pannello di campioni normali senza corrispondenza a scopo di filtro da un proprio set di campioni, come descritto in precedenza13,oppure utilizzare la seguente blacklist caricata: .
- Filtrare le variazioni di singolo nucleotide utilizzando SNVFI .
- File SNVFI.config preimpostato, in modo che tutti i percorsi delle funzioni di supporto siano corretti.
- Eseguire SNVFI con il file ini configurato in base alle impostazioni visualizzate nel file supplementare 1 (SNVFI.ini). Per escludere mutazioni invise in vitro filtriamo per un VAF 0,39.
- Controllare l'output della frazione di allele variante (VAF) di SNVFI (Figura 4). Verificare se il picco del grafico di densità è vicino a 0,5, a indicare che il campione è clonale.
-
FACOLTATIVO: Per determinare la parte del genoma che viene coperta durante il filtraggio, determinare le regioni richiamabili lungo germinale e il controllo utilizzando CallableLoci da GATK (Genome Analysis ToolKit):
Java -jar GenomeAnalysisTK.jar
-T CallableLoci
-R riferimento.fasta
-Io myreads.bam
-Summary table.txt
-o callable_status.bed -
FACOLTATIVO: Recuperare le aree callable dall'output CallableLoci ed eseguire intersezioni a coppie tra gli esempi e la massa utilizzando lo script python CallableLoci_processor.py presente in https://github.com/ToolsVanBox/CallableLoci_processor . I file del letto risultanti possono essere utilizzati per filtrare ulteriormente l'uscita di SNVFI e per ispezionare il profilo mutazionale nella sezione 9:
CallableLoci_processor.py dir_in dir_out nome_esempio nome_bulk –samples sample1 sample2 sample3
8. Chiamata Indel
- Selezionare tutti gli inserimenti e le eliminazioni (Indels) nel file raw_variants.vcf utilizzando GATK SelectVariants:
Java -Xmx12G
-jar GenomeAnalysisTK.jar
-T SelectVariants
-R reference_genome.fasta
-V raw_variants.vcf
-o raw_INDELs.vcf
-selectType INDEL - Filtrare l'elenco raw_INDELS.vcf utilizzando INDELFI :
perl INDELFI.pl -i input.vcf (dal punto 8.1)
-s esempio di test della colonna
Esempio di controllo colonna -c
9. Ispezione del profilo mutazionale
- Utilizzare i file .vcf risultanti dall'output SNVFI del passaggio 7.6 (o dal passaggio 7.9 con analisi del loci richiamabile opzionale) per analizzare il profilo mutazionale genomico, i tipi di mutazione e l'analisi delle firme utilizzando il pacchetto R MutationalPatterns15: . Per un output rappresentativo che può essere prodotto con il file vcf risultante, ad esempio uno spettro mutazionale di 96 trinucleotidi, vedere La Figura 5.
10. Costruzione di un albero di lignaggio dello sviluppo utilizzando sostituzioni di base
- Per costruire un albero di lignaggio dello sviluppo, rileva mutazioni condivise tra i cloni. Le mutazioni presenti nei primi rami dell'albero di lignaggio possono anche essere presenti sottoclonalmente nel campione di massa (MSC/cellule T). I lignaggi ramificati successivi saranno definiti da mutazioni condivise solo dai cloni HSPC.
- Per identificare le mutazioni presenti in un sottoinsieme dei cloni e presenti sottoclonalmente nella massa, eseguire le operazioni seguenti.
- Per filtrare le mutazioni somatiche condivise tra i cloni, eseguire lo script filterSomatic.py in un terminale basato su Unix. Lo script è disponibile allhttps://github.com/ToolsVanBox/filterSomatic . Prima di eseguire questo script, modificare il file filterSomatic.ini (vedere File supplementare 2) per impostare i percorsi e regolare gli altri parametri.
- Eseguire filterSomatic.py (python3 filterSomatic.py -i filterSomatic.ini).
- Filtrare le mutazioni che sono presenti subclonalmente nella massa utilizzando determine_lowVAF_bulk. script R in un terminale basato su Unix.R script in a Unix-based terminal. Lo script è disponibile in https://github.com/ToolsVanBox/Identify_lowVAF_bulk_muts. Verrà generato file vcf separati per SNV condivisi e univoci:
Rscript Determine_lowVAF_bulk. R
--vcf Percorso/A/Filtro_somatic_output.vcf
--bulk_name (nome_bulk)
--sample_name nome-esempio
--genere [M F]
--out_dir out_dir - Determinare tutte le mutazioni condivise tra cloni che non sono presenti nel campione di massa sovrapponendo tutte le posizioni di mutazione (concatenare le colonne 1 e 2 dell'output SNVFI).
- Escludere i falsi positivi ottenuti durante i passaggi 10.5 e 10.6 mediante l'ispezione manuale mediante IGV16. Le mutazioni sono considerate false quando non sono presenti, quando la mutazione è presente nella linea germinale o quando è presente in regioni scarsamente mappate, vedere La figura 7.
NOT: Si consiglia vivamente di ri-sequenziare tutti i loci condivisi in modo indipendente utilizzando mirato o sequenziamento sanger. - Utilizzare le mutazioni condivise ottenute durante i passaggi 10.1 e 10.2 per costruire una tabella binaria di mutazioni rispetto ai cloni sequenziati, con 0 che indica che la mutazione non è presente e 1 che indica la presenza della mutazione.
- Eseguire l'output della tabella binaria di mutazione come in una mappa termica insieme a un dendrogramma che indica le relazioni di lignaggio tra le celle utilizzando R. La mappa termica indica lo stato delle mutazioni per ogni cella. Vedere l'output di questa funzione (Figura 6).
Cloni <- read.table("Path/To/BinaryTable")
my_palette <- colorRampPalette(c("#cccccc", "#333333"))(n : 2)
col_breaks <- c(0,0,5,1)
heatmap.2(clones, distfun-function(x) dist(x,method : 'binary'),
hclustfun-function(x) hclust(x,method : media),
dendrogramma - "colonna", Rowv - F,
col-my_palette, breaks-col_breaks,
trace""none", density.info"none")
Risultati
Procedura sperimentale
Il flusso di lavoro sperimentale è illustrato nella Figura 1. In base al tipo di materiale di input, è necessario seguire diversi passaggi. Nella Figura 2 è raffigurata una produzione citometrica di flusso di un tipo di cellule del sangue cordonale. In primo luogo, tutte le celle monocitiche vengono selezionate disegnando vagamente un cancello intorno a questa popolazione. Quindi, i singlet vengono isolati selezionando le celle con un rapporto lineare FSC-H/FSC-A, poiché un rapporto FSC-H/FSC-A più basso include doppie o ciuffi di cellule. Il campione di controllo non colorato viene utilizzato per definire i gate di ordinamento delle celle per il lignaggio-, CD34,CD38-, CD45RA-. Inoltre, CD90 e CD49f possono essere utilizzati per distinguere tra cellule progenitrici o cellule staminali auto-rinnovanti17 (Figura 2). L'ordinamento degli indici consente di ritracciare le singole celle e le celle ordinate sono rappresentate come punti marroni. Durante la coltura cellulare, i singoli cloni possono espandersi a un ritmo diverso, con alcuni cloni che si espandono entro 3 settimane, mentre altri cloni sono completamente estesi solo fino alla quinta settimana di cultura. Vedere la figura 3A,B per la escrescenza della colonia rappresentativa. Viene mostrato un quadro rappresentativo di una cultura di massa MSC quasi confluente a 11 giorni dopo la placcatura (Figura 3C).
Controllo della qualità dopo il sequenziamento e l'analisi delle mutazioni
L'esempio è un output di esempio dell'analisi del numero di copia generata da Control-FreeC14 per verificare la presenza di alterazioni dei numeri di copia (Figura 4). Le informazioni karyotipiche possono indicare quali cromosomi escludere durante una corsa SNVFI (passaggio 7.6). Il grafico VAF creato da SNVFI (Figura 5) è un istogramma delle frequenze di alleli varianti nel campione. Un picco nel grafico di densità a 0,5 indica che il campione è clonale. Per ottenere maggiori informazioni sulle cause biologiche sottostanti dietro le mutazioni, queste possono essere analizzate utilizzando il pacchetto R MutationalPatterns15. Qui è illustrata un'analisi tipica che produce un grafico a 96 trinucleotidi (Figura 6). Oltre alla quantificazione di diversi tipi di mutazione, l'estrazione della firma può essere eseguita anche con questo strumento.
Costruzione di un albero di lignaggio dello sviluppo
Le mutazioni condivise tra i cloni o presenti in un clone (e a basso VAF) nel controllo della linea germinale vengono convalidate utilizzando IGV. Le mutazioni sono considerate vere quando presenti nel campione e non ad alti livelli di VAF nella linea germinale (Figura 7A). Le mutazioni sono considerate false quando non sono presenti in IGV, che può verificarsi in regioni scarsamente mappate (Figura 7B). In altri casi, gli eventi rilevati dalla SNVFI vengono perse mutazioni germinali (Figura 7C). La ri-sequenziazione indipendente delle mutazioni mediante un ri-sequenziamento mirato è altamente raccomandata per queste mutazioni nei cloni selezionati. Dopo il rilevamento di mutazioni somatiche condivise tra cloni, viene generata una matrice binaria (passaggio 10.8). Viene costruita una mappa di calore contenente cellule con e senza le mutazioni condivise A-M. Sopra questa mappa di calore è indicato l'albero di lignaggio dello sviluppo (Figura 8).
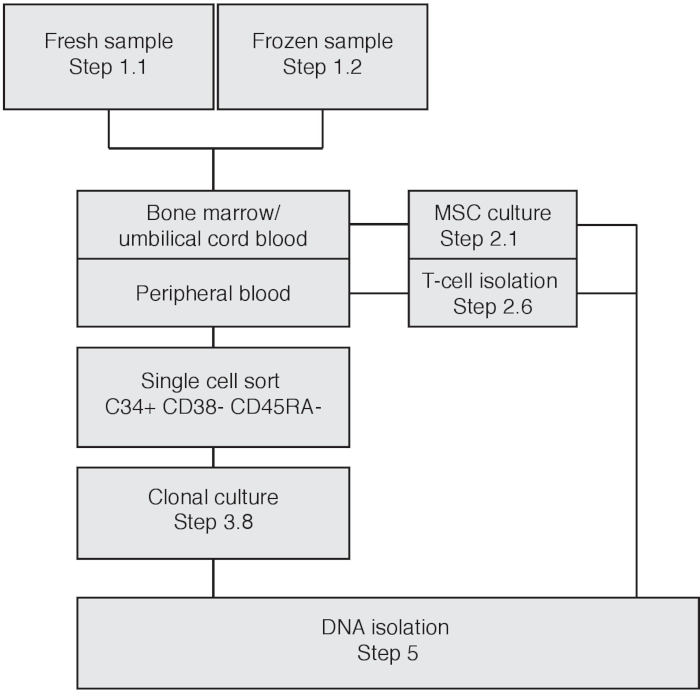
Figura 1: Diagramma di flusso che illustra la procedura sperimentale basata sul materiale di input. Fare clic qui per visualizzare una versione più grande di questa figura.
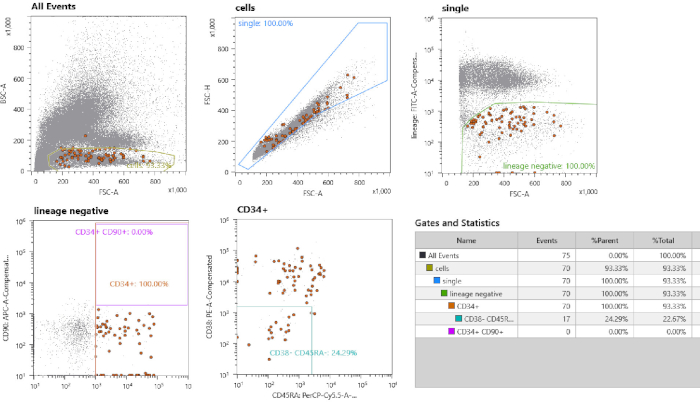
Figura 2: Strategia di ordinamento delle celle. In primo luogo, il gating viene eseguito su piccole celle mononucleari. In secondo luogo, le singole celle sono gated dalla selezione della frazione lineare. Le cellule negative di lignaggio sono recintate. Tutte le celle CD34- CD38- CD45- sono ordinate a cella singola. La frazione di celle in marrone dovrebbe essere notato, che sono le celle ordinate evidenziate dall'opzione "ordinamento indice". Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Risultati della coltura cellulare rappresentativa. Rappresentante HSPC cloni in un 384 piastra di pozzo a (A) 2 settimane dopo placcatura e (B) 4 settimane dopo placcatura. (C) cultura MSC dopo 2 settimane di sostituzione media. Barra della scala: 100 m. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Karyotypes. (A) Esempio di massa MSC per colture HSPC clonale e (B), di massa di MSC. I cariotipi sono stati determinati da un'analisi di lettura. Entrambi i grafici indicano un campione cariotipico normale. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Istogramma delle frequenze degli alleli varianti. Istogramma delle frequenze allele varianti delle varianti in un clone prima dell'ultimo passaggio di filtraggio di SNVFI (VAF >0.3). Un picco a VAF - 0,5 indica che il campione è clonale. Le mutazioni subclonali con vaF basso sono escluse durante l'ultima fase di filtraggio di SNVFI (VAF >0.3). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Analisi rappresentativa dello spettro mutazionale delle mutazioni somatiche in un campione HSPC. Rappresentato è il contributo relativo di ogni cambiamento trinucleotide (di cui la base centrale è mutata) allo spettro totale. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: Ispezione manuale delle mutazioni mediante IGV16. (A) Le mutazioni sono considerate vere quando sono presenti nel clone e non nel campione di massa. (B) Le mutazioni sono considerate falsi positivi quando sono presenti in una regione scarsamente mappata. (C) Le mutazioni sono considerate falsi positivi quando sono presenti in un controllo germinale. La linea verticale indica la posizione di una mutazione chiamata. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: Costruzione di un albero di lignaggio dello sviluppo. Rappresentato è un dendrogramma che indica linee di sviluppo che si sciolgono durante lo sviluppo. La mappa termica sotto il dendrogramma indica la presenza di mutazioni in diversi cloni. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Presentato qui è un metodo per rilevare le mutazioni che si sono accumulate durante la vita nei singoli HSPC e per costruire un albero di lignaggio dello sviluppo precoce utilizzando questi dati di mutazione.
Per eseguire correttamente questi saggi, è necessario soddisfare diversi requisiti critici. In primo luogo, deve essere garantita la fattibilità del campione. La gestione rapida del campione è fondamentale per garantire l'efficienza della procedura. In secondo luogo, la perdita di potenza del fattore di crescita influenzerà negativamente l'espansione clonale degli HSPC. Per garantire un elevato fattore di crescita, è importante evitare cicli di congelamento-scongelamento e preparare aliquote monouso. In terzo luogo, dopo aver eseguito WGS, chiamata di mutazione e filtraggio, è fondamentale convalidare la clonalità della coltura clonale. Per confermare la clonalità della coltura, il VAF delle mutazioni dovrebbe accoppiarsi intorno a 0,5 in un campione cariotipico normale (Figura 3). Nelle cellule con un basso carico mutazionale, come gli HSPC del sangue cordonale, è più difficile determinare la clonalità a causa dei bassi numeri di mutazione.
Il nostro approccio si basa sull'espansione in vitro di singole cellule per consentire il WGS. Pertanto, il nostro approccio è limitato alle cellule che hanno il potenziale replicativo di espandersi clonalmente, ad esempio gli HSPC. Nelle nostre mani, circa il 5%-30% di tutte le cellule singole sono in grado di espandersi adeguatamente. La riduzione dei tassi di crescita può potenzialmente comportare una distorsione della selezione. Come discusso in precedenza, i metodi che utilizzano WGA possono superare questa distorsione di selezione in quanto questa tecnica non si basa sull'espansione delle celle. Tuttavia, WGA ha le sue carenze, e l'amplificazione clonale rimane l'unico metodo per determinare con precisione il numero di mutazioni nell'intero genoma senza abbandoni allelici e una copertura equa lungo il genoma, soprattutto in campioni con bassa vera somatica numeri di mutazione.
I dati generati utilizzando questo approccio possono essere utilizzati per determinare le filogenie del sistema ematopoietico, in quanto le mutazioni rilevate nelle singole cellule possono essere utilizzate per sezionare le linee cellulari, come illustrato nella Figura 6. In genere, una o due mutazioni possono definire ogni ramo in un donatore sano1. Poiché i lignaggi si ramificano all'inizio del concepimento, le mutazioni che definiscono questi primi rami saranno presenti anche con un vaF basso nel campione normale abbinato che è stato utilizzato per filtrare le varianti germinali1,18,19. In questo caso, l'uso di cellule non ematopoietiche, come le MSC, è preferito in quanto si prevede che si separino molto presto durante lo sviluppo dal sistema ematopoietico. Poiché le cellule T sono di origine ematopoietica, l'uso di queste cellule come campione normale corrispondente per filtrare le varianti germinali potrebbe quindi confondere la costruzione della prima ramificazione dell'albero di lignaggio dello sviluppo. La presenza subclonale di mutazioni specifiche dei rami in alcune popolazioni di sangue maturo, che può essere misurata mediante sequenziamento profondo mirato, indicherà che la progenie di quel ramo può dare origine a quel tipo di cellula matura. Inoltre, il nostro approccio consente di valutare le conseguenze mutazionali dell'esposizione mutagena in vivo e, in ultima analisi, di come ciò possa contribuire allo sviluppo della leucemia.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato sostenuto da una sovvenzione VIDI dell'Organizzazione olandese per la ricerca scientifica (NWO) (n. 016.Vidi.171.023) a R. v. B.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.20 µm syringe filter | Corning | 431219 | |
| 50 mL Syringe, Luer lock | BD | 613-3925 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647-50G | |
| CD11c FITC | BioLegend | 301603 | Clone 3.9 |
| CD16 FITC | BioLegend | 302005 | Clone 3G8 |
| CD3 BV650 | Biolegend | 300467 | Clone UCHT1 |
| CD34 BV421 | BioLegend | 343609 | 561 |
| CD38 PE | BioLegend | 303505 | Clone HIT2 |
| CD45RA PerCP/Cy5.5 | BioLegend | 304121 | Clone HI100 |
| CD49f PE/Cy7 | BioLegend | 313621 | Clone GoH3 |
| CD90 APC | BioLegend | 328113 | Clone 5E10 |
| Cell Strainer 5 mL tube | Corning | 352235 | |
| CELLSTAR plate, 384w, 130 µL, F-bottom, TC, cover | Greiner | 781182 | |
| Cryogenic vial | Corning | 430487 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| DMEM/F12 | ThermoFisher | 61965059 | |
| EDTA | Sigma-Aldrich | E4884-500G | |
| Fetal Bovine Serum | ThermoFisher | 10500 | |
| GlutaMAX | ThermoFisher | 25030081 | |
| Human Flt3-Ligand, premium grade | Miltenyi Biotech | 130-096-479 | Reconsititute in single-use aliquots (25 μL) at 100 μg/mL in 0.1% BSA in PBS |
| Human Recombinant IL-3 (E. coli-expressed) | Stem Cell Technologies | 78040.1 | Reconsititute in single-use aliquots (2.5 μL) at 100 μg/mL in 0.1% BSA in PBS |
| Human Recombinant IL-6 (E. coli-expressed) | Stem Cell Technologies | 78050.1 | Reconsititute in single-use aliquots (5 μL) at 100 μg/mL in 0.1% BSA in PBS |
| Human SCF, premium grade | Miltenyi Biotech | 130-096-695 | Reconsititute in single-use aliquots (25 μL) at 100 μg/mL in 0.1% BSA in PBS |
| Human TPO, premium grade | Miltenyi Biotech | 130-095-752 | Reconsititute in single-use aliquots (12.5 μL) at 100 μg/mL in 0.1% BSA in PBS |
| Integrative Genomics Viewer 2.4 | Broad Institute | https://software.broadinstitute.org/software/igv/download | |
| Iscove's Modified Eagle's Medium | ThermoFisher | 12440061 | |
| Lineage (CD3/14/19/20/56) FITC | BioLegend | 348701 | Clones: UCHT1, HCD14, HIB19, 2H7, HCD56 |
| Lymphoprep | Stem Cell Technologies | #07861 | Used for Density gradient separation |
| PBS | Made in at Institute's facility. Commerically available PBS can also be used | ||
| Penicillin-Streptomycin | ThermoFisher | 15140122 | |
| Primocin | Invivogen | ant-pm-1 | Antibiotic formulation |
| QIAamp DNA Micro Kit | Qiagen | 56304 | |
| Qubit 2.0 fluorometer | ThermoFisher | Q32866 | |
| Qubit dsDNA HS Assay Kit | ThermoFisher | Q32854 | |
| RNAse A | Qiagen | 19101 | |
| SH800S Cell Sorter | Sony | SH800S | |
| StemSpan SFEM, 500 mL | Stem Cell Technologies | 9650 | |
| TE BUFFER PH 8.0, LOW EDTA | G-Biosciences | 786-151 | |
| TrypLE Express | ThermoFisher | 12605-10 |
Riferimenti
- Osorio, F. G., et al. Somatic Mutations Reveal Lineage Relationships and Age-Related Mutagenesis in Human Hematopoiesis. Cell Reports. 25, 2308-2316 (2018).
- Genovese, G., et al. Clonal Hematopoiesis and Blood-Cancer Risk Inferred from Blood DNA Sequence. New England Journal of Medicine. 371, 2477-2487 (2014).
- Jaiswal, S., et al. Age-Related Clonal Hematopoiesis Associated with Adverse Outcomes. New England Journal of Medicine. 371, 2488-2498 (2014).
- Young, A. L., Challen, G. A., Birmann, B. M., Druley, T. E. Clonal haematopoiesis harbouring AML-associated mutations is ubiquitous in healthy adults. Nature Communications. 7, 1-7 (2016).
- Alexandrov, L. B., Nik-Zainal, S., Wedge, D. C., Campbell, P. J., Stratton, M. R. Deciphering Signatures of Mutational Processes Operative in Human Cancer. Cell Reports. 3, 246-259 (2013).
- Alexandrov, L. B., et al. Signatures of mutational processes in human cancer. Nature. 500, 415-421 (2013).
- Alexandrov, L., et al. The Repertoire of Mutational Signatures in Human Cancer. bioRxiv. , (2018).
- Behjati, S., et al. Genome sequencing of normal cells reveals developmental lineages and mutational processes. Nature. 513, 422-425 (2014).
- Blokzijl, F., et al. Tissue-specific mutation accumulation in human adult stem cells during life. Nature. 538, 260-264 (2016).
- Gawad, C., Koh, W., Quake, S. R. Single-cell genome sequencing: Current state of the science. Nature Reviews Genetics. 17, 175-188 (2016).
- Dong, X., et al. Accurate identification of single-nucleotide variants in whole-genome-amplified single cells. Nature Methods. 14, 491-493 (2017).
- Welch, J. S., et al. The origin and evolution of mutations in acute myeloid leukemia. Cell. 150, (2012).
- Jager, M., et al. Measuring mutation accumulation in single human adult stem cells by whole-genome sequencing of organoid cultures. Nature Protocols. 13, 59-78 (2018).
- Boeva, V., et al. Control-FREEC: A tool for assessing copy number and allelic content using next-generation sequencing data. Bioinformatics. 28, 423-425 (2012).
- Blokzijl, F., Janssen, R., van Boxtel, R., Cuppen, E. MutationalPatterns: Comprehensive genome-wide analysis of mutational processes. Genome Medicine. 10, 1-11 (2018).
- Thorvaldsdóttir, H., Robinson, J. T., Mesirov, J. P. Integrative Genomics Viewer (IGV): High-performance genomics data visualization and exploration. Briefings in Bioinformatics. 14, 178-192 (2013).
- Notta, F., et al. Isolation of single human hematopoietic stem cells capable of long-term multilineage engraftment. Science. , (2011).
- Lee-Six, H., et al. Population dynamics of normal human blood inferred from somatic mutations. Nature. 561, 473-478 (2018).
- Behjati, S., et al. Genome sequencing of normal cells reveals developmental lineages and mutational processes. Nature. , (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon