Method Article
وصف الحمل النفيوى والتركيب الكلونى للدم البشري
In This Article
Summary
تعكس أنماط الطفرة الجسدية في الخلايا التعرض السابق للطفرات ويمكن أن تكشف عن علاقات النسب التنموي. تُعرض هنا منهجية لفهرسة وتحليل الطفرات الجسدية في الخلايا الجذعية المكونة للدم والخلايا السلفية الفردية.
Abstract
تتراكم تدريجيا ً طفرات الحمض النووي خلال العمر، والتي يمكن أن تسهم في الأمراض المرتبطة بالعمر مثل سرطان الدم. يمكن أن يؤدي توصيف تراكم الطفرات إلى تحسين فهم مسببات الأمراض المرتبطة بالعمر. وتُعرض هنا طريقة لفهرسة الطفرات الجسدية في الـ HSPCs الفردية، التي تستند إلى تسلسل الجينوم الكامل (WGS) لثقافات الخلايا الأولية الكلونية. يتم مشاركة الطفرات الموجودة في الخلية الأصلية من قبل جميع الخلايا في الثقافة clonal، في حين أن الطفرات المكتسبة في المختبر بعد فرز الخلايا موجودة في مجموعة فرعية من الخلايا. ولذلك، فإن هذه الطريقة تسمح للكشف الدقيق عن الطفرات الجسدية الموجودة في جينوم اتّصال اتّصالات الـ HSPCs الفردية، والتي تتراكم أثناء الحياة. هذه الكتالوجات من الطفرات الجسدية يمكن أن توفر رؤى قيمة في العمليات الطفرة النشطة في أنسجة المكونة للدم وكيف تسهم هذه العمليات في تكوين الكريات. وبالإضافة إلى ذلك، من خلال تقييم الطفرات الجسدية التي يتم تقاسمها بين HSPCs متعددة من نفس الفرد، يمكن تحديد علاقات النسب الكلونال والديناميات السكانية لتجمعات الدم. وبما أن هذا النهج يعتمد على التوسع في المختبر للخلايا المفردة، فإن الطريقة تقتصر على الخلايا المكونة للدم ذات الإمكانات التنسخية الكافية.
Introduction
التعرض للجذع المكون للدم والخلايا السلف (HSPCs) للمصادر الذاتية أو الطاردة يساهم في التراكم التدريجي للطفرات في الحمض النووي خلال عمر1. تراكم الطفرة التدريجيفي HSPCs1 يمكن أن يؤدي إلى التهاب الدم المتصل بالعمر (ARCH)2،3، وهو حالة غير أعراض مدفوعة من قبل HSPCs تحمل طفرات سرطان الدم السائق. في البداية، كان يعتقد أن الأفراد مع ARCH لديهم خطر متزايد لسرطان الدم2،3. ومع ذلك، أظهرت الدراسات الحديثة حدوث 95٪ من ARCH في الأفراد المسنين4، مما يجعل الارتباط مع الأورام الخبيثة أقل وضوحا ويثير مسألة لماذا بعض الأفراد مع ARCH في نهاية المطاف القيام أو لا تتطور الأورام الخبيثة. ومع ذلك، يمكن أن تشكل الطفرات الجسدية في HSPCs مخاطر صحية خطيرة، حيث تتميز اضطرابات خلل التنسج النقوي وابيضاض الدم بوجود طفرات محددة لسائق السرطان.
ولتحديد العمليات النتغيرات ودراسة لون الدم، يجب أن يكون تراكم الطفرات في هذه الـ100 من الـ HSPCs الفردية مُميَّزًا. وتترك العمليات التحوجية أنماطاً مميزة في الجينوم، ما يسمى بالتوقيعات النتغيراتية، التي يمكن تحديدها وتحديدها كمياً في مجموعات الطفرات على نطاق الجينوم5. على سبيل المثال، تم ربط التعرض للأشعة فوق البنفسجية، ووكلاء الألكيلات،والعيوب في مسارات إصلاح الحمض النووي مع توقيع طفرة مختلفة 6،7. وبالإضافة إلى ذلك، بسبب الطبيعة العشوائية لتراكمات الطفرة، فإن معظم (إن لم يكن كل) الطفرات المكتسبة فريدة من نوعها بين الخلايا. إذا تم مشاركة الطفرات بين خلايا متعددة من نفس الفرد، فإنه يشير إلى أن هذه الخلايا تشترك في سلف مشترك8. لذلك، من خلال تقييم الطفرات المشتركة، يمكن تحديد علاقات النسب بين الخلايا ويمكن بناء شجرة النسب التنموية فرعا ً فرعاً. ومع ذلك، فإن فهرسة الطفرات الجسدية النادرة في الخلايا الطبيعية من الناحية الفسيولوجية هو أمر صعب من الناحية الفنية بسبب الطبيعة المتعددة الكلونية للأنسجة الصحية.
المعروضة هنا هي طريقة لتحديد وتحديد الطفرات الجسدية بدقة في الجينوم من HSPCs الفردية. وهذا ينطوي على عزل وتوسيع كلونال من HSPCs في المختبر. تعكس هذه الثقافات الكلونية التركيب الوراثي للخلية الأصلية (أي أن الطفرات في الخلية الأصلية سيتم تقاسمها من قبل جميع الخلايا الأخرى في الثقافة). يسمح لنا هذا النهج بالحصول على ما يكفي من الحمض النووي لتسلسل الجينوم الكامل (WGS). لقد أظهرنا في السابق أن الطفرات المتراكمة في المختبر خلال الثقافة الكلونية سيتم تقاسمها من قبل مجموعة فرعية من الخلايا. وهذا يتيح تصفية جميع الطفرات في المختبر، كما أن هذه سوف تكون موجودة في جزء أصغر من القراءة بالمقارنة مع الطفرات المكتسبة في الجسم الحي9. وقد حصلت الأساليب السابقة على ما يكفي من الحمض النووي من خلية واحدة لWGS باستخدام تضخيم الجينوم الكامل (WGA)10. ومع ذلك، فإن العيب الرئيسي للWGA هو تضخيمها نسبيا عرضة للخطأ وغير متوازن من الجينوم، والتي يمكن أن تؤدي إلى تسرب الأليل11. ومع ذلك، وبما أن هذا النهج يعتمد على التوسع في المختبر للخلايا المفردة، فإنه يقتصر على خلايا الدم ذات الإمكانات التنسخية الكافية، وهذا ليس هو الحال بالنسبة للأساليب المعتمدة على WGA. وقد اعتمدت الجهود السابقة لتسلسل الثقافات clonal على استخدام طبقات التغذية لضمان تضخيم كلونال من HSPCs واحد12. ومع ذلك، يمكن للحمض النووي من طبقات التغذية أن يلوث الحمض النووي للثقافات الكلونية، مما يخلط بين الطفرة اللاحقة التي تدعو وتصفية. وتعتمد الطريقة المعروضة هنا فقط على وسيلة محددة لتوسيع مركبات الـ HSPCs الأحادية، وبالتالي تتجنب مسألة تلوث الحمض النووي. حتى الآن، قمنا بتطبيق هذه الطريقة بنجاح على نخاع العظم البشري، ودم الحبل السري، ونخاع العظام المجمدة بشكل جيد، والدم المحيطي.
Protocol
ويجب الحصول على العينات وفقا لبروتوكولات الأخلاقيات المناسبة، ويجب على الجهات المانحة أن تعطي موافقة مستنيرة قبل الإجراء.
1. إعداد المواد عينة
ملاحظة: عند العمل مع المواد التي تم الحصول عليها حديثا، تبدأ مع الخطوة 1.1. عند العمل مع المواد المجمدة، تبدأ مع الخطوة 1.2.
-
تحضير نخاع العظم الطازج أو دم الحبل السري أو الدم المحيطي
- عزل الكسر أحادي النووي من العينة باستخدام فصل تدرج الكثافة باتباع تعليمات الشركات المصنعة (انظر جدولالمواد)، وعد الخلايا أحادية النووية باستخدام مقياس الهيموميترومتر. بعد عزل الخلايا أحادية النووية، تابع الخطوة 1.3.
- اختياري: العدد الموصى به من الخلايا المطلوبة لفرز لوحة كاملة 384 جيدا من HSPCs هو 1-2 × 107. إذا تم عزل المزيد من الخلايا أثناء الكثافة التدرج الطرد المركزي، تخزين فائض الخلايا في النيتروجين السائل.
- إعادة تعليق الخلايا في 500 درجة مئوية من IMDM + 10٪ FBS لكل 1 × 107 خلايا، وإضافة قطرة بقطرة حجم متساو من IMDM + 30٪ FBS + 20٪ DMSO لتحقيق تعليق 1 × 107 خلايا في 1 مل من IMDM + 20٪ FBS + 10٪ DMSO.
- نقل الخلايا أحادية النووية على الفور إلى 1 مل قارورة المبردة وتجميد الخلايا في -80 درجة مئوية في حاوية تجميد الخلية ذات المعدل الخاضع للرقابة بين عشية وضحاها. نقل الخلايا في اليوم التالي إلى تخزين النيتروجين السائل عند مزيد من المعالجة.
-
إعداد الخلايا أحادية النووية المجمدة من نخاع العظم أو دم الحبل السري أو الدم المحيطي
- إعداد 50 مل من خلية ذوبان المتوسطة التي تحتوي على 45 مل من المتوسط النسر المعدلة في Iscove (IMDM) و 5 مل من المصل البقري الجنيني (FBS)، ودافئة في حمام المياه 37 درجة مئوية.
- خذ القارورة التي تحتوي على العينة من تخزين النيتروجين السائل، ونقل العينة إلى الجليد الجاف، وذوبان في أسرع وقت ممكن في حمام مائي 37 درجة مئوية.
- عندما يتم إذابة العينة تقريبا، ومسح القارورة مع الإيثانول 70٪ ونقل محتوياتها إلى أنبوب مخروطي 50 مل. شطف القارورة مع 1 مل من IMDM قبل تسخينها + 10٪ FBS لجمع الخلايا المتبقية، وإضافة هذا الحل قطرة (5 ثانية لكل قطرة) إلى العينة المذابة في حين تدور بلطف الأنبوب.
- إضافة إضافية قبل تسخينها 15 مل من IMDM + 10٪ FBS قطرة إلى العينة في حين تدور بلطف الأنبوب.
- بيليه الخلايا عن طريق الطرد المركزي لمدة 5 دقائق في 350 × ز.
- إزالة كل ما عدا ± 3 مل من supernatant. إعادة تعليق الخلايا في supernatant المتبقية والمخففة عن طريق إضافة 20 مل من IMDM + 10٪ FBS قطرة بقطرة في حين يهز بلطف الأنبوب.
- خذ 10 ميكرولتر من تعليق الخلية لعد الخلايا. تخفيف هذه 10 درجة مئوية عن طريق إضافة 20 درجة مئوية من 0.4٪ trypan الحل الأزرق وعد الخلايا باستخدام مقياس الهيموكيتوميومتر. يمكن أن ينخفض عدد الخلايا عند الذوبان، مع ما يصل إلى 50٪ من فقدان الخلايا بعد الذوبان. يجب أن تتراوح صلاحية الخلية بين 70% و90%.
- إذا كنت تعمل مع نخاع العظم أو خلايا دم الحبل السري، تناول 5 × 106 خلايا أحادية نووية لثقافة MSC (الخطوة 2.1). إذا كنت تعمل مع الدم المحيطي، تناول 2-5 × 106 خلايا لعزل الخلايا T (الخطوة 2.2)
- بيليه الخلايا المتبقية 5 دقائق في 350 × ز وإعادة تعليق في 3 مل من المخزن المؤقت FACS (0.05٪ BSA + 1 M EDTA في PBS).
- نقل 1 × 105 خلايا إلى ميكروتوب مليئة 200 ميكرول من المخزن المؤقت FACS، والتي سوف تكون بمثابة مراقبة سلبية لتدفق قياس الخلايا (الخطوة 3.8)، والحفاظ على الجليد.
2. خلية الثقافة
ملاحظة: للحصول على كتالوجات من الطفرات المكتسبة جسديًا، يجب تصفية التباين الجرثومي الخاص بالجهات المانحة. عند البدء بخزعات نخاع العظم أو دم الحبل السري، يمكن استخدام الخلايا السترومالية mesenchymal (MSCs) كتحكم مطابق لتصفية التباين الجرثومي. وفي هذه الحالة، اتبع الفرع 2-1. عند استخدام (تعبئة) الدم المحيطي اتبع الخطوة 2.2 لعزل واستخدام الخلايا T كعينة التحكم المتطابقة لتصفية لاختلاف الجراثيم (الشكل1). سوف يشارك عدد السكان الجزء الأكبر من الخلايا T نفس علاقة النسب مثل HSPCs.
-
ثقافة MSC
- إعداد 50 مل من MSC المتوسطة التي تحتوي على 45 مل من DMEM /F12 المتوسطة، 10٪ FBS، 500 ميكرولتر من التربسين أو البديل تريبسين، و 500 ميكرولتر من محلول البنسلين / العقدية.
- لوحة ما يقرب من 5 × 105 الخلايا أحادية النووية في 1.5 مل من MSC المتوسطة لكل بئر. وضع الخلايا في حاضنة رطبة في 37درجة مئوية مع 5٪ CO 2.
- استبدال المتوسطة بعد 24 ساعة، وبعد ذلك استبدال المتوسطة كل 3 أيام لضمان أن يتم غسلجميع الخلايا المكونة للدم قبالة. الاستمرار في الثقافة حتى الملاءمة هو 100٪.
- إذا كانت MSCs هي confluent، وغسل الخلايا مع 1 مل من PBS وحصاد MSCs عن طريق إضافة 200 ميكرولتر من التربسين أو البديل التربسين لكل بئر. حضانة الخلايا لمدة 5 دقائق عند 37 درجة مئوية. إضافة 800 درجة مئوية من MSC المتوسطة، وpipet الخلايا صعودا وهبوطا لتخفيف الخلايا من لوحة جيدا.
- نقل MSCs إلى أنبوب الطرد المركزي الدقيق وبيليه الخلايا عن طريق الطرد المركزي لمدة 5 دقائق في 350 × ز. إزالة supernatant والاستمرار مع عزل الحمض النووي أو تخزين بيليه في -20 درجة مئوية لعزل الحمض النووي في وقت لاحق (القسم 4).
-
عزل الخلايا T
ملاحظة: إذا كان استخدام (تعبئة) الدم المحيطي، يمكن عزل الخلايا T واستخدامها كتحكم في الجرثومة.- إعادة تعليق بيليه الخلية في 100 درجة مئوية من الحل تلطيخ CD3 المضادة (1:100 تخفيف الأجسام المضادة للقرص المضغوط في المخزن المؤقت FACS).
- غسل الخلايا عن طريق إضافة 1 مل من المخزن المؤقت FACS. بيليه الخلايا عن طريق الطرد المركزي لمدة 5 دقائق في 350 × ز وإعادة تعليق في 300 درجة مئوية من المخزن المؤقت FACS.
- عزل ما لا يقل عن 5 × 105 CD3 + الخلايا باستخدام فارز FACS في أنبوب البوليسترين 5 مل شغلها مسبقا مع 1 مل من FBS.
- بيليه الخلايا التي تم فرزها باستخدام الطرد المركزي لمدة 5 دقائق في 350 × ز، وإزالة supernatant، ومواصلة مباشرة مع عزل الحمض النووي (القسم 4) أو تخزين بيليه في -20 درجة مئوية لعزل الحمض النووي في وقت لاحق.
3. HSPC العزلة والفرز والثقافة
- قم بالدوران عند 1-2 × 107 خلايا أحادية نووية لمدة 5 دقائق عند 350 × ز وإعادة تعليقها في 50 ميكرولتر من المخزن المؤقت FACS (انظر الخطوة 2.2.1). نقل الخلايا إلى أنبوب الطرد المركزي الصغير.
ملاحظة: عند الفرز باستخدام > 2 × 107 خلايا، قم بزيادة مزيج الأجسام المضادة وأحجام التخزين المؤقت FACS وفقًا لذلك. - إعداد 50 ميكرولتر من 2X HSC تلطيخ مزيج وفقا للوصفة ينظر في الجدول1.
| جسم | حجم [ميكرولتر] |
| BV421-CD34 | 5 |
| مزيج نسب FITC (CD3/14/19/20/56) | 5 |
| PE-CD38 | 2 |
| APC- CD90 | 0.5 0.5 |
| PerCP/Cy5.5 - CD45RA | 5 |
| PE/Cy7-CD49f | 1 |
| فيتك -CD16 | 1 |
| فيتك-CD11 | 5 |
| المخزن المؤقت لـ FACS | 25.5 |
الجدول 1: مزيج فرز HSC. يظهر جدول يشير إلى تمييع الأجسام المضادة المستخدمة لفرز HSCs.
- مزيج 50 درجة مئوية من محلول الخلية مع مزيج تلطيخ HSC أعدت واحتضان الخلايا لمدة 15 دقيقة في درجة حرارة الغرفة (RT) أو لمدة 1 ساعة على الجليد للأجسام المضادة لربط.
- غسل الخلايا عن طريق إضافة 1 مل من FACS العازلة وبيليه عن طريق الطرد المركزي لمدة 5 دقائق في 350 × ز.
- إعادة تعليق الخلايا في 300 درجة مئوية من المخزن المؤقت FACS وتصفية تعليق الخلية من خلال أنبوب البوليسترين 5 mstyre المغطاة بمصفاة الخلايا 35 م لإزالة كتل الخلايا قبل فرز الخلايا المنشطة الفلورية (FACS).
- إعداد 25 مل من متوسط ثقافة HSPC، تتكون من 1x SFEM المتوسطة المكملة بـ 100 نانوغرام/مل SCF، 100 نانوغرام/مل Flt3، 50 نانوغرام/مل TPO، 10 نانوغرام/مل IL-3، 20 نانوغرام/مل IL-6، و100 نانوغرام/مل تركيبة المضادات الحيوية (انظر جدولالمواد).
- ملء لوحة ثقافة الخلية جيدا 384 مع 75 درجة مئوية من HSPC ثقافة المتوسطة في كل بئر.
ملاحظة: لمنع تبخر المتوسط في الآبار الخارجية، ملء الآبار الخارجية مع 75 ميكرولتر من المياه المعقمة أو PBS، ولا تستخدم هذه الآبار لفرز الخلايا. -
فرز الـ HSPCs المفرد
- تعيين بوابات لفرز HSPC استناداً إلى عنصر تحكم غير ملطخ (الخطوة 1.9) و 10,000 خلية من العينة الملونة. يتم تصوير نتيجة تمثيلية لوضع البوابات في الشكل 1. بوابة خلايا واحدة عن طريق رسم بوابة حول الخطية FSC-الارتفاع مقابل كسر منطقة FSC. استخدام كسر التحكم غير ملطخة لرسم بوابة للسلالة- كسر. رسم بوابات لCD34+ الخلايا ومزيد من توصيف هذه المجموعة الفرعية عن طريق تعيين بوابة محددة لCD38- CD45RA- الخلايا.
- تحميل لوحة جيدا 384 على آلة FACS وفرز الخلايا واحدة.
ملاحظة: إذا كان ذلك قابلاً للتطبيق على الجهاز FACS، قم بالتبديل على خيار الاحتفاظ ببيانات فرز الفهرس لتمكين إعادة تتبع الخلايا التي تم فرزها.
-
[كولرينغ] [سّينغ-كلّينغ] [هسك]
- نقل مباشرة لوحة 384 جيدا إلى حاضنة 37 درجةمئوية رطبة مع 5٪ CO 2.
ملاحظة: لمنع التبخر أثناء الزراعة، التفاف لوحة ثقافة الآبار 384 (مع غطاء) في التفاف البولي ايثيلين شفافة. - احتفظ بطبق البئر 384 في الحاضنة لمدة 3-4 أسابيع حتى تظهر الحيوانات المستنسخة المرئية. يتم تصوير الصور التمثيلية للثقافة الكلونية في الشكل 2. على أساس حالة المواد المدخلة 5٪ -30٪ من الخلايا التي تم فرزها سوف توسع clonally.
- نقل مباشرة لوحة 384 جيدا إلى حاضنة 37 درجةمئوية رطبة مع 5٪ CO 2.
4. حصاد استنساخ HSPC
- بعد 4 أسابيع من الزراعة، وتحديد الآبار التي لديها الملاءمة من 30٪ أو أعلى.
- قبل ملء (لكل نمو كلي) 1.5 مل microtubes مع 1 مل من 1٪ BSA في PBS وتسمية الأنبوب وفقا للبئر المقابلة.
- قبل الرطب طرف ماصة مع 1٪ BSA في PBS لتقليل عدد الخلايا العالقة إلى طرف ماصة.
- Pipet أعلى / أسفل المتوسطة في بئر بشراسة (على الأقل 5 مرات) مع ماصة 200 درجة مئوية (مجموعة في 75 درجة مئوية) وكشط الجزء السفلي من البئر لتخفيف الخلايا في البئر، وجمع تعليق الخلية في microtube المسمى المقابلة للبئر.
- تناول 75 ميكرولتر من BSA 1٪ الطازجة في PBS وتكرار الأنابيب في البئر لضمان أقصى قدر من الاستفادة من الخلايا.
ملاحظة: الخلايا المثقفة Clonally يمكن التمسك الجزء السفلي من جيدا. فحص الآبار باستخدام المجهر الضوئي المقلوب القياسية للتأكد من ما إذا كان قد تم جمع جميع الخلايا. - إذا تم حصاد جميع الآبار مع > 30٪ من الملاءمة، ضع لوحة الآبار 384 مرة أخرى في الحاضنة. يمكن أن تنتشر الثقافات Clonal لمدة تصل إلى 5 أسابيع.
- تدور أسفل تعليق الخلية لمدة 5 دقائق في 350 × ز. يجب أن تكون بيليه صغيرة مرئية.
- إزالة بعناية كل ما عدا حوالي 5 ميكرولتر من supernatant. يمكن تجميد الكريات الخلية عند -20 درجة مئوية وتخزينها لعدة أشهر قبل عزل الحمض النووي.
5. عزل الحمض النووي
-
عزل HSPC وMSC/T-خلية الحمض النووي باستخدام مجموعة عزل الحمض النووي على نطاق صغير وفقا لتعليمات الشركة المصنعة مع التعديلات التالية:
- إضافة 2 μL من RNase A بعد إضافة المخزن المؤقت AL أثناء القسم 2. الحضانة لمدة 2 دقيقة قبل إضافة بروتينK.
- حضانة لمدة 30 دقيقة عند 56 درجة مئوية بدلا من 10 دقائق.
- Elute الحمض النووي عن طريق تحميل العمود مع 50 درجة مئوية من المخزن المؤقت TE مع EDTA منخفضة (10 MTs، 0.1 m EDTA). للحصول على الإلوطي الأمثل، قم بإعادة تحميل eluate مرة أخرى على العمود وتدور مرة أخرى.
- تحديد تركيز الحمض النووي باستخدام الحمض النووي قياس 2 ميكرولتر لكل استنساخ. عادة ما يتراوح عائد الحمض النووي بين 0.5-3 نانوغرام/ميكرولتر.
6- التسلسل
- إجراء تسلسل الحمض النووي على النحو الذي وصفه جاغر وآخرون13
7. رسم الخرائط والدعوة الطفرة الجسدية
- رسم خريطة لمخرجات التسلسل (ملفات FASTQ) إلى الجينوم المرجعي واستدعاء الطفرات على النحو المبين في Jager et al.13
- فحص البيانات للتغييرات karyotypic aberrant في استنساخ متسلسلة والبيانات المجمعة باستخدام أداة تحليل رقم نسخة، مثل Control-FreeC14. حتى الآن، لم نبلغ عن أي من الـ HSPCs مع الaberrances karyotypic.
- إنشاء قائمة سوداء، والتي تتكون من لوحة من العينات العادية لا مثيل لها لأغراض التصفية من مجموعة خاصة من العينات، كما هو موضح سابقا13، أو استخدام القائمة السوداء التالية التي تم تحميلها: .
- تصفية الاختلافات النيوكليوتيد اتّصال واحد باستخدام SNVFI .
- مسبقا ً SNVFI.config ملف، بحيث تكون كافة المسارات إلى وظائف المساعد صحيحة.
- تشغيل SNVFI مع ملف .ini تكوين استناداً إلى الإعدادات التي شوهدت في ملف تكميلي 1 (SNVFI.ini). لاستبعاد الطفرات المستحثة في المختبر نحن تصفية لVAF ≥ 0.39.
- تحقق من جزء الأليل البديل (VAF)الإخراج من SNVFI (الشكل 4). تحقق ما إذا كانت ذروة قطعة الكثافة بالقرب من 0.5، مما يشير إلى أن العينة هي clonal.
-
اختياري: لتحديد جزء الجينوم الذي يتم تغطيته أثناء التصفية، حدد المناطق القابلة للاستدعاء على طول الجراثيم والتحكم باستخدام CallableLoci من GATK (أداة تحليل الجينوم):
جافا جرة جينومتحليلTK.jar \
-T كالبللوكي \
-R المرجعية.fasta \
-أنا myreads.bam \
-ملخص الجدول.txt \
-o callable_status.bed -
اختياري: استرداد المناطق القابلة للاستدعاء من إخراج CallableLoci وتنفيذ تقاطعات ثنائية بين العينات والجزء الأكبر باستخدام البرنامج النصي الثعبان CallableLoci_processor.py موجودة في https://github.com/ToolsVanBox/CallableLoci_processor . يمكن استخدام ملفات السرير الناتجة لزيادة تصفية مخرجات SNVFI وفحص الملف التحوّي في القسم 9:
CallableLoci_processor.py dir_in dir_out sample_name bulk_name -samples1 sample2 sample3
8. إندل الدعوة
- حدد كافة عمليات الإدراج والحذف (Indels) في الملف raw_variants.vcf باستخدام GATK SelectVariants:
جافا -Xmx12G \
-جرة جينومتحليلTK.jar \
-T تحديد المتغيرات \
-R reference_genome.fasta \
-V raw_variants.vcf \
-o raw_INDELs.vcf \
-selectنوع INDEL - تصفية القائمة raw_INDELS.vcf باستخدام INDELFI :
بيرل INDELFI.pl -i input.vcf (من الخطوة 8.1) \
-s نموذج اختبار العمود \
-c عينة التحكم العمود
9. فحص الملف الشخصي التحوّي
- استخدم ملفات .vcf الناتجة من إخراج SNVFI من الخطوة 7.6 (أو من الخطوة 7.9 مع تحليل loci الاختياري القابل للاستدعاء) لتحليل ملف تعريف الطفرة الجينية وأنواع الطفرات وتحليل التوقيع باستخدام حزمة R MutationalPatterns15: . للحصول على خرج تمثيلي يمكن إنتاجه باستخدام ملف .vcf الناتج مثل طيف طفرة 96-trinucleotide، راجع الشكل 5.
10. بناء شجرة سلالة تنموية باستخدام بدائل قاعدة
- لبناء شجرة سلالة تنموية، الكشف عن الطفرات المشتركة بين الحيوانات المستنسخة. الطفرات الموجودة في الفروع الأولى من شجرة النسب يمكن أيضا أن تكون موجودة تحت الكلون في العينة السائبة (MSCs / T-الخلايا). سيتم تعريف السلالات المتفرعة في وقت لاحق من خلال الطفرات المشتركة من قبل استنساخ HSPC فقط.
- لتحديد الطفرات الموجودة في مجموعة فرعية من النسخ والموجودة تحت كلونيا في الجزء الأكبر، قم بتنفيذ الخطوات التالية.
- من أجل تصفية الطفرات الجسدية المشتركة بين الحيوانات المستنسخة، قم بتشغيل البرنامج النصي filterSomatic.py في محطة طرفية تستند إلى Unix. يمكن العثور على البرنامج النصي في https://github.com/ToolsVanBox/filterSomatic. قبل تشغيل هذا البرنامج النصي، قم لتحرير الملف filterSomatic.ini (راجع الملف التكميلي2) لتعيين المسارات وضبط المعلمات الأخرى.
- تشغيل filterSomatic.py(python3 filterSomatic.py -i filterSomatic.ini).
- تصفية الطفرات الموجودة تحت كلونفي الجزء الأكبر باستخدام Determine_lowVAF_bulk. R البرنامج النصي في محطة طرفية المستندة إلى Unix. يمكن العثور على البرنامج النصي في https://github.com/ToolsVanBox/Identify_lowVAF_bulk_muts. سيؤدي هذا إلى إنشاء ملفات .vcf منفصلة لـ SNVs المشتركة والفريدة:
Rscript Determine_lowVAF_bulk. R
--vcf المسار / إلى / Filter_somatic_output.vcf
--السائبة bulk_name
--sample_name اسم العينة
-نوع الجنس [M| [و]
هل أنت ِ بخير؟ - تحديد كافة الطفرات المشتركة بين الحيوانات المستنسخة التي لا توجد في العينة السائبة عن طريق تداخل كافة مواضع الطفرة (العمود 1 و2 من إخراج SNVFI).
- استبعاد الإيجابيات الخاطئة التي تم الحصول عليها أثناء الخطوتين 10.5 و10.6 عن طريق التفتيش اليدوي باستخدام IGV16. تعتبر الطفرات كاذبة عندما لا تكون موجودة، عندما تكون الطفرة موجودة في الجرثومية أو عندما تكون موجودة في مناطق سيئة المعينة، انظر الشكل 7.
ملاحظة: نوصي بشدة بإعادة تسلسل كافة المواقع المشتركة بشكل مستقل باستخدام التسلسل المستهدف أو تسلسل السنجر. - استخدم الطفرات المشتركة التي تم الحصول عليها خلال الخطوتين 10.1 و10.2 لبناء جدول ثنائي للطفرات مقابل الحيوانات المستنسخة المتسلسلة، مع إشارة 0 إلى أن الطفرة غير موجودة و1 تشير إلى وجود الطفرة.
- إخراج الجدول ثنائي الطفرة كما هو الحال في خريطة الحرارة جنبا إلى جنب مع dendrogram تشير إلى علاقات النسب بين الخلايا باستخدام R. تشير خريطة الحرارة إلى حالة الطفرات لكل خلية. انظر إخراج هذه الوظيفة (الشكل 6).
استنساخ <- read.table ("المسار/إلى/ثنائي تابل")
my_palette <- colorRampPalette(c("#cccccc", "#333333")(n = 2)
col_breaks <- c (0,0.5,1)
heatmap.2 (استنساخ، distfun = وظيفة (س) dist(x)، الأسلوب = 'ثنائي')،
hclustfun = وظيفة (س) hclust (س، الأسلوب = المتوسط)،
[دندروغرم] = "عمود", [روف] =[ف],
col =my_palette، فواصل = col_breaks،
تتبع = "لا شيء"، كثافة.info = "لا شيء")
النتائج
الإجراء التجريبي
يتم تصوير سير العمل التجريبي في الشكل 1. استناداً إلى نوع مواد الإدخال، يجب اتباع خطوات مختلفة. في الشكل 2 يتم تصوير إخراج مقياس التدفق من نوع خلايا دم الحبل السري. أولا، يتم اختيار جميع الخلايا الأحادية عن طريق رسم فضفاضة بوابة حول هذه المجموعة السكانية. ثم، يتم عزل singlets عن طريق تحديد الخلايا ذات نسبة FSC-H/FSC-A الخطية، حيث أن نسبة FSC-H/FSC-A أقل تتضمن مزدوجة أو كتل خلايا. يتم استخدام نموذج التحكم غير ملطخة لتعريف بوابات فرز الخلايا للسلالة-، CD34+، CD38-، CD45RA-. بالإضافة إلى ذلك، يمكن استخدام CD90 و CD49f للتمييز بين خلايا السلفأو الخلايا الجذعية ذاتية التجديد17 (الشكل 2). يتيح فرز الفهرس إعادة تتبع الخلايا الفردية، ويتم تصوير الخلايا التي تم فرزها كنقاط بنية اللون. خلال زراعة الخلايا، يمكن أن تتوسع الحيوانات المستنسخة الفردية بوتيرة مختلفة، مع توسع بعض الحيوانات المستنسخة في غضون 3 أسابيع، في حين يتم توسيع الحيوانات المستنسخة الأخرى بشكل كامل حتى الأسبوع الخامس من الثقافة. انظر الشكل 3A،B للاطلاع على نمو المستعمرة التمثيلي. وتظهر صورة تمثيلية لثقافة السائبة MSC confluent تقريبا في 11 يوما بعد الطلاء (الشكل3C).
التحقق من الجودة بعد التسلسل وتحليل الطفرة
يظهر مثال على إخراج تحليل رقم النسخة الذي تم إنشاؤه بواسطة Control-FreeC14 للتحقق من وجود تعديلات في رقم النسخ (الشكل 4). يمكن أن تشير معلومات Karyotypic إلى الكروموسومات التي يجب استبعادها أثناء تشغيل SNVFI (الخطوة 7.6). مؤامرة VAF التي أنشأتها SNVFI (الشكل 5) هو الرسم البياني لترددات الأليل البديل في العينة. تشير الذروة في قطعة الكثافة عند 0.5 إلى أن العينة هي clonal. للحصول على مزيد من البصيرة في الأسباب البيولوجية الكامنة وراء الطفرات، ويمكن تحليل هذه باستخدام حزمة R MutationalPatterns15. يصور هنا هو تحليل نموذجي تنتج مؤامرة 96-trinucleotide (الشكل6). بالإضافة إلى التحديد الكمي لأنواع الطفرات المختلفة، يمكن أيضًا إجراء استخراج التوقيع باستخدام هذه الأداة.
بناء شجرة سلالة تنموية
يتم التحقق من صحة الطفرات المشتركة بين الحيوانات المستنسخة أو الموجودة في استنساخ (وعند VAF منخفضة) في التحكم الجرثومي باستخدام IGV. تعتبر الطفرات صحيحة عند وجودها في العينة وليس على مستويات عالية VAF في الجرثومة (الشكل7A). تعتبر الطفرات كاذبة عندما لا تكون موجودة في IGV، والتي يمكن أن تحدث في المناطق التي تم تعيينها بشكل سيئ (الشكل7B). في حالات أخرى، يتم الكشف عن الأحداث التي تم الكشف عنها من قبل SNVFI الطفرات الجرثومية (الشكل7C). ويوصى بشدة بإعادة التسلسل المستقل للطفرات عن طريق إعادة التسلسل المستهدف لهذه الطفرات في عمليات استنساخ مختارة. بعد الكشف عن الطفرات الجسدية المشتركة بين المستنسخين، يتم إنشاء مصفوفة ثنائية (الخطوة 10.8). يتم إنشاء خريطة الحرارة التي تحتوي على الخلايا مع وبدون الطفرات المشتركة A-M. وفوق هذه الخريطة الحرارية يشارإلى شجرة النسب التنموية (الشكل 8).
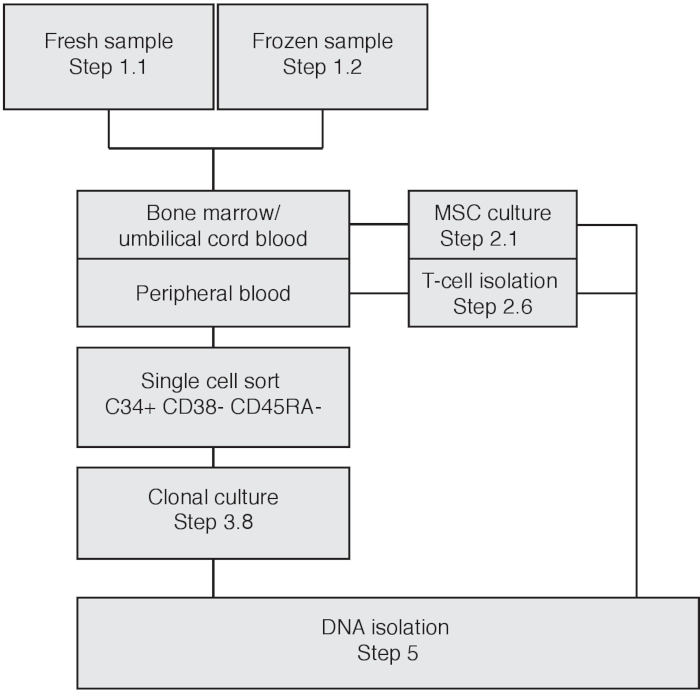
الشكل 1: مخطط انسيابي يصور الإجراء التجريبي القائم على مواد الإدخال. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
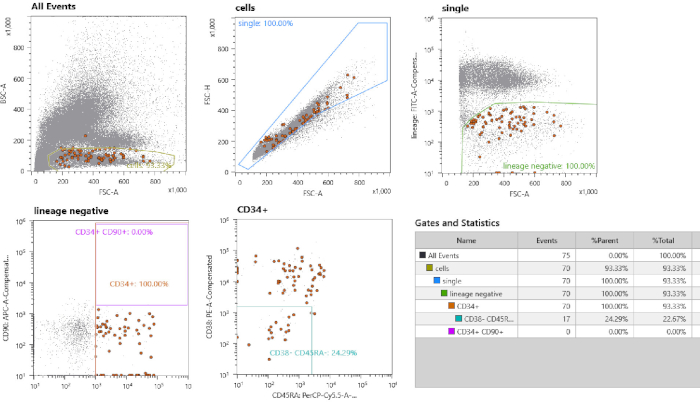
الشكل 2: استراتيجية فرز الخلايا. أولاً، يتم تنفيذ التجشّر على الخلايا أحادية النووية الصغيرة. ثانياً، يتم بوابات الخلايا المفردة عن طريق اختيار الكسر الخطي. الخلايا السالبة النسبية مسورة. يتم فرز كافة CD34+ CD38- CD45- الخلايا المفردة. وتجدر الإشارة إلى جزء من الخلايا باللون البني، وهي الخلايا التي تم فرزها التي تم تمييزها بواسطة خيار "فهرس الفرز". الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: نتائج ثقافة الخلية التمثيلية. ممثل HSPC استنساخ في لوحة 384 جيدا في (A) 2 أسابيع بعد الطلاء و (B) 4 أسابيع بعد الطلاء. (C) ثقافة MSC بعد 2 أسابيع من استبدال المتوسطة. شريط مقياس = 100 درجة مئوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: أنواع الكاريو. (A) Clonal HSPC الثقافة و (B) MSC عينة السائبة. تم تحديد أنواع الكاريوتايب من خلال تحليل عمق القراءة. كلا الرسمين البيانيين يشيرإلى عينة karyotypically العادي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: الرسم البياني لترددات الأليل المتغيرة. الرسم البياني لترددات الأليل البديل من المتغيرات في استنساخ قبل الخطوة الأخيرة تصفية SNVFI (VAF >0.3). تشير الذروة في VAF = 0.5 إلى أن العينة clonal. يتم استبعاد الطفرات تحت الكلل مع VAF منخفضة أثناء الخطوة الأخيرة تصفية SNVFI (VAF >0.3). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: تحليل الطيف الطفرة التمثيلي للطفرات الجسدية في عينة من HSPC. يصور هو المساهمة النسبية لكل تغيير trinucleotide (التي يتم تغيير القاعدة الوسطى) إلى الطيف الكلي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: الفحص اليدوي للطفرات باستخدام IGV16. (أ) تعتبر الطفرات صحيحة عندما تكون موجودة في استنساخ وليس في عينة السائبة. (ب) تعتبر الطفرات إيجابية خاطئة عندما تكون موجودة في منطقة سيئة المعينة. (C) تعتبر الطفرات إيجابيات كاذبة عند وجودها في السيطرة على الجرثومة. يشير الخط العمودي إلى موضع طفرة تسمى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: بناء شجرة سلالة تنموية. يصور هو مخطط الأسنان التي تشير إلى السلالات التنموية تقسيم قبالة أثناء التنمية. تشير الخريطة الحرارية تحت مخطط الأسنان إلى وجود طفرات في مختلف الحيوانات المستنسخة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
المعروضة هنا هي طريقة للكشف عن الطفرات التي تراكمت خلال الحياة في HSPCs الفردية وبناء شجرة النسب التنموية المبكرة باستخدام هذه البيانات الطفرة.
ويجب استيفاء العديد من المتطلبات الحاسمة من أجل إجراء هذه الاختبارات بنجاح. أولا، يجب ضمان صلاحية العينة. التعامل السريع مع العينة هو المفتاح لضمان كفاءة الإجراء. ثانياً، سيؤثر فقدان قوة عامل النمو سلباً على التوسع الكلوني لـ HSPCs. لضمان فعالية عامل النمو العالي، من المهم تجنب دورات ذوبان التجميد وإعداد aliquots للاستخدام الواحد. ثالثا، بعد إجراء WGS، استدعاء التحول والتصفية، فمن الأهمية بمكان للتحقق من كلونية الثقافة clonal. لتأكيد كلونية الثقافة، يجب أن تتجمع VAF من الطفرات حول 0.5 في عينة طبيعية karyotypically (الشكل3). في الخلايا ذات الحمل الطفرة المنخفضة، مثل HSPCs دم الحبل السري، يكون من الأصعب تحديد الكلونية بسبب انخفاض أعداد الطفرات.
نهجنا يعتمد على التوسع في المختبر من الخلايا المفردة للسماح لWGS. لذلك، يقتصر نهجنا على الخلايا التي لديها القدرة على النسخ المتماثل لتوسيع clonally، مثل HSPCs. في أيدينا، حوالي 5٪ -30٪ من جميع الخلايا واحدة فرزها قادرة على التوسع بشكل كاف. ويمكن أن يؤدي انخفاض معدلات النمو في الخارج إلى تحيز في الاختيار. كما نوقش سابقا، يمكن للأساليب التي تستخدم WGA التغلب على هذا التحيز الاختيار لأن هذه التقنية لا تعتمد على توسيع الخلايا. ومع ذلك، فإن WGA له أوجه قصور خاصة به، ويبقى التضخيم الكلوني الطريقة الوحيدة لتحديد عدد الطفرات في الجينوم كله بدقة دون تسرب الاليليك والتغطية المتساوية على طول الجينوم، وخاصة في العينات ذات الجسدية الحقيقية المنخفضة أرقام الطفرة.
ويمكن استخدام البيانات التي يتم إنشاؤها باستخدام هذا النهج لتحديد الفيلوجينات في نظام المكونة للدم، حيث يمكن استخدام الطفرات المكتشفة في خلايا واحدة لتشريح سلالات الخلايا، كما هو موضح في الشكل 6. عادة، واحد أو اثنين من الطفرات يمكن أن تحدد كل فرع في متبرع صحي1. منذ فروع السلالات في وقت مبكر بعد الحمل، والطفرات التي تحدد هذه الفروع الأولى سوف تكون موجودة أيضا مع VAF منخفضة في العينة العادية المتطابقة التي استخدمت لتصفية المتغيرات الجرثومية1،18،19. في هذه الحالة ، يفضل استخدام الخلايا غير المكونة للدم ، مثل MSCs ، حيث من المتوقع أن تنفصل في وقت مبكر جدا أثناء التنمية عن نظام المكونة للدم. بما أنّ [ت-سلّس] يكون من أصل المكونة للدم, الإستعمال من هذا خلايا كيماثل عينة عاديّة أن ييصفّي [جرمنين] [فرينت] استطاع لذلك يخلط البناء من التفريع مبكّرة من ال [أنفيس تري] تنمويّة. إن وجود الطفرات الخاصة بالفرع في بعض مجموعات الدم الناضجة، والتي يمكن قياسها بالتسلسل العميق المستهدف، سيشير إلى أن ذرية ذلك الفرع يمكن أن تؤدي إلى هذا النوع من الخلايا الناضجة. وبالإضافة إلى ذلك، يسمح نهجنا لتقييم العواقب الطفرة للتعرض للطفرات في الجسم الحي، وفي نهاية المطاف كيف يمكن أن يسهم ذلك في نمو ابيضاض الدم.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد دعمت هذه الدراسة بمنحة من المنظمة الهولندية للبحث العلمي من المنظمة الهولندية للبحوث العلمية (رقم 016.Vidi.171.023) إلى R. v. V.
Materials
| Name | Company | Catalog Number | Comments |
| 0.20 µm syringe filter | Corning | 431219 | |
| 50 mL Syringe, Luer lock | BD | 613-3925 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647-50G | |
| CD11c FITC | BioLegend | 301603 | Clone 3.9 |
| CD16 FITC | BioLegend | 302005 | Clone 3G8 |
| CD3 BV650 | Biolegend | 300467 | Clone UCHT1 |
| CD34 BV421 | BioLegend | 343609 | 561 |
| CD38 PE | BioLegend | 303505 | Clone HIT2 |
| CD45RA PerCP/Cy5.5 | BioLegend | 304121 | Clone HI100 |
| CD49f PE/Cy7 | BioLegend | 313621 | Clone GoH3 |
| CD90 APC | BioLegend | 328113 | Clone 5E10 |
| Cell Strainer 5 mL tube | Corning | 352235 | |
| CELLSTAR plate, 384w, 130 µL, F-bottom, TC, cover | Greiner | 781182 | |
| Cryogenic vial | Corning | 430487 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| DMEM/F12 | ThermoFisher | 61965059 | |
| EDTA | Sigma-Aldrich | E4884-500G | |
| Fetal Bovine Serum | ThermoFisher | 10500 | |
| GlutaMAX | ThermoFisher | 25030081 | |
| Human Flt3-Ligand, premium grade | Miltenyi Biotech | 130-096-479 | Reconsititute in single-use aliquots (25 μL) at 100 μg/mL in 0.1% BSA in PBS |
| Human Recombinant IL-3 (E. coli-expressed) | Stem Cell Technologies | 78040.1 | Reconsititute in single-use aliquots (2.5 μL) at 100 μg/mL in 0.1% BSA in PBS |
| Human Recombinant IL-6 (E. coli-expressed) | Stem Cell Technologies | 78050.1 | Reconsititute in single-use aliquots (5 μL) at 100 μg/mL in 0.1% BSA in PBS |
| Human SCF, premium grade | Miltenyi Biotech | 130-096-695 | Reconsititute in single-use aliquots (25 μL) at 100 μg/mL in 0.1% BSA in PBS |
| Human TPO, premium grade | Miltenyi Biotech | 130-095-752 | Reconsititute in single-use aliquots (12.5 μL) at 100 μg/mL in 0.1% BSA in PBS |
| Integrative Genomics Viewer 2.4 | Broad Institute | https://software.broadinstitute.org/software/igv/download | |
| Iscove's Modified Eagle's Medium | ThermoFisher | 12440061 | |
| Lineage (CD3/14/19/20/56) FITC | BioLegend | 348701 | Clones: UCHT1, HCD14, HIB19, 2H7, HCD56 |
| Lymphoprep | Stem Cell Technologies | #07861 | Used for Density gradient separation |
| PBS | Made in at Institute's facility. Commerically available PBS can also be used | ||
| Penicillin-Streptomycin | ThermoFisher | 15140122 | |
| Primocin | Invivogen | ant-pm-1 | Antibiotic formulation |
| QIAamp DNA Micro Kit | Qiagen | 56304 | |
| Qubit 2.0 fluorometer | ThermoFisher | Q32866 | |
| Qubit dsDNA HS Assay Kit | ThermoFisher | Q32854 | |
| RNAse A | Qiagen | 19101 | |
| SH800S Cell Sorter | Sony | SH800S | |
| StemSpan SFEM, 500 mL | Stem Cell Technologies | 9650 | |
| TE BUFFER PH 8.0, LOW EDTA | G-Biosciences | 786-151 | |
| TrypLE Express | ThermoFisher | 12605-10 |
References
- Osorio, F. G., et al. Somatic Mutations Reveal Lineage Relationships and Age-Related Mutagenesis in Human Hematopoiesis. Cell Reports. 25, 2308-2316 (2018).
- Genovese, G., et al. Clonal Hematopoiesis and Blood-Cancer Risk Inferred from Blood DNA Sequence. New England Journal of Medicine. 371, 2477-2487 (2014).
- Jaiswal, S., et al. Age-Related Clonal Hematopoiesis Associated with Adverse Outcomes. New England Journal of Medicine. 371, 2488-2498 (2014).
- Young, A. L., Challen, G. A., Birmann, B. M., Druley, T. E. Clonal haematopoiesis harbouring AML-associated mutations is ubiquitous in healthy adults. Nature Communications. 7, 1-7 (2016).
- Alexandrov, L. B., Nik-Zainal, S., Wedge, D. C., Campbell, P. J., Stratton, M. R. Deciphering Signatures of Mutational Processes Operative in Human Cancer. Cell Reports. 3, 246-259 (2013).
- Alexandrov, L. B., et al. Signatures of mutational processes in human cancer. Nature. 500, 415-421 (2013).
- Alexandrov, L., et al. The Repertoire of Mutational Signatures in Human Cancer. bioRxiv. , (2018).
- Behjati, S., et al. Genome sequencing of normal cells reveals developmental lineages and mutational processes. Nature. 513, 422-425 (2014).
- Blokzijl, F., et al. Tissue-specific mutation accumulation in human adult stem cells during life. Nature. 538, 260-264 (2016).
- Gawad, C., Koh, W., Quake, S. R. Single-cell genome sequencing: Current state of the science. Nature Reviews Genetics. 17, 175-188 (2016).
- Dong, X., et al. Accurate identification of single-nucleotide variants in whole-genome-amplified single cells. Nature Methods. 14, 491-493 (2017).
- Welch, J. S., et al. The origin and evolution of mutations in acute myeloid leukemia. Cell. 150, (2012).
- Jager, M., et al. Measuring mutation accumulation in single human adult stem cells by whole-genome sequencing of organoid cultures. Nature Protocols. 13, 59-78 (2018).
- Boeva, V., et al. Control-FREEC: A tool for assessing copy number and allelic content using next-generation sequencing data. Bioinformatics. 28, 423-425 (2012).
- Blokzijl, F., Janssen, R., van Boxtel, R., Cuppen, E. MutationalPatterns: Comprehensive genome-wide analysis of mutational processes. Genome Medicine. 10, 1-11 (2018).
- Thorvaldsdóttir, H., Robinson, J. T., Mesirov, J. P. Integrative Genomics Viewer (IGV): High-performance genomics data visualization and exploration. Briefings in Bioinformatics. 14, 178-192 (2013).
- Notta, F., et al. Isolation of single human hematopoietic stem cells capable of long-term multilineage engraftment. Science. , (2011).
- Lee-Six, H., et al. Population dynamics of normal human blood inferred from somatic mutations. Nature. 561, 473-478 (2018).
- Behjati, S., et al. Genome sequencing of normal cells reveals developmental lineages and mutational processes. Nature. , (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved