Method Article
Uso della tecnologia di MHC di singola catena di indagare Co-agonismo in umano CD8 + attivazione delle cellule T
In questo articolo
Riepilogo
Questo protocollo descrive l'uso di singola catena MHC di classe I complessi di indagare interazioni molecolari nell'attivazione di cellule T CD8 + umano: generazione di cellule che esprimono la catena singola presentanti l'antigene ingegnerizzato costruisce, cultura del clone di cellule T CD8 + umano ed esperimenti di attivazione delle cellule T.
Abstract
Complessi di MHC (pMHC) del peptide self non-stimolatore non inducono funzioni di attivazione ed effettrici delle cellule T, ma possono migliorare le risposte delle cellule T a pMHC agonista, attraverso un processo chiamato co-agonismo. Questo protocollo descrive un sperimentale sistema per indagare co-agonismo durante l'attivazione delle cellule di T di CD8 + umana esprimendo umano MHC classe I molecole che presentano peptidi pre-determinati come singola polipeptidi (singola catena MHC) in una linea cellulare xenogeniche. Abbiamo espresso la singola catena MHCs nelle circostanze dove i bassi livelli di complessi di agonista singola catena p-MHC e alti livelli di complessi p-MHC non-stimolatore singola catena sono stati espressi. Uso di questo sistema sperimentale ci ha permesso di confrontare risposte a cellula T CD8 + a pMHC agonista in presenza o assenza di non-stimolatore pMHC. Il protocollo descrive la transfezione di linea cellulare con costrutti di singola catena MHC, generazione di cellulari stabili linee, coltura di cellule T CD8 + umane di epatite B virus-specifici e l'attivazione delle cellule T esperimenti contemporaneamente quantificare la produzione di citochine e degranulazione. I metodi presentati utilizzabile per la ricerca sui diversi aspetti dell'attivazione delle cellule T CD8 + in sistemi umano delle cellule T con specificità noti peptidi MHC.
Introduzione
MHC di classe I (MHC-I) molecole presentano peptidi breve (8-10 aminoacidi) derivati da proteine sintetizzate da ogni cella. MHC-sono molecole sulle cellule sane presentano auto peptidi derivati da proteine endogene. Infezione virale conduce alla presentazione dei peptidi di virus-derivati non-sé su MHC-I, ma anche infetti cellule presenti non-sé peptidi in presenza di grandi quantità di peptide-MHC self (pMHC). MHC-ho è riconosciuto da T cell receptor (TCR) e il CD8 e co-recettore sulle cellule di T. Affinità di legame del TCR al peptide pMHC è fortemente dipendente dalla sequenza dei peptidi presentati, considerando che l'associazione CD8 è indipendente dal peptide. Associazione di TCR da agonista non-sé pMHC complesso conduce alle funzioni di attivazione ed effettrici delle cellule T. Non-stimolatore pMHC auto complessi non inducono funzioni di attivazione ed effettrici delle cellule T, ma possono migliorare le risposte delle cellule T a pMHC agonista, attraverso un processo chiamato co-agonismo1,2,3. Co-agonismo è stata osservata nel topo le cellule di T di CD4 +4,5,6 , così come in mouse e umano CD8 + T cellule7,8,9,10, 11 , 12 , 13. in condizioni fisiologiche, le cellule T necessario riconoscere quantità limitate di agonista pMHC sull'antigene che presenta le cellule (APCs) Co-che presenta elevati livelli di non-stimolatore pMHC complessi, suggerendo che co-agonismo contribuisce alla T ottimale risposte delle cellule in vivo. Totale delle cellule superficiali MHC di classe I livelli sono frequentemente downregulated durante le infezioni virali14 e il15di tumori. Questa strategia di evasione immune diminuisce presentazione pMHC agonista, ma riduce anche la quantità di co-agonista pMHC sono disponibili per il potenziamento di attivazione delle cellule T. Inoltre, i livelli di espressione di superficie di alta cella del MHC di classe I molecola HLA-C sono stati indicati per correlare con migliorata HIV controllo16, suggerendo un ruolo critico per totale MHC di classe I espressione nell'attivazione delle cellule T. Nonostante il significato fisiologico di co-agonismo, il suo meccanismo molecolare è ancora in modo incompleto capito. Questo è in gran parte a causa di problemi tecnici di controllare sperimentalmente la quantità di pMHC presentato co-agonista mantenendo agonista pMHC costante.
Abbiamo sviluppato un sperimentale sistema per indagare co-agonismo durante l'attivazione delle cellule di T di CD8 + umana esprimendo umano MHC di classe I molecole che presentano pre-determinato peptide come singolo polipeptide (singola catena MHC-I, Figura 1A) in una cella xenogeniche linea9,10. PMHC agonista singola catena (sc) è stato espresso sotto controllo del promotore inducibile tetraciclina nella linea cellulare CHO T-REx criceto-derivato esprimendo repressore tetraciclina; in questo modo "colanti" molto bassa espressione di sc agonista pMHC in assenza di tetraciclina e alta sc agonista pMHC espressione dopo l'aggiunta di tetraciclina (Figura 1BC). Le cellule di T-REx CHO che esprimono pMHC sc agonista erano allora supertransfected con non-stimolatore, co-agonista sc pMHC-ho sotto controllo di un promotore costitutivamente attivo (Figura 1BC). Uso di questo sistema sperimentale ci ha permesso di confrontare risposte a cellula T CD8 + a pMHC agonista in presenza o assenza di alti livelli di non-stimolatore pMHC. Criticamente, dal peptide e MHC-ho catena pesante sono legati covalentemente alla scMHC-ho formato, questo permette di introduzioni di mutazioni nelle molecole di MHC che presenta peptidi pre-determinati. Uso di scMHC-ho tecnologia ha permesso così di specificamente modulare TCR o CD8-associazione proprietà di agonista o co-agonista pMHC.
Co-agonismo nell'attivazione delle cellule T CD8 + è stato osservato usando purificato MHC-I complessi che presentano agonista e co-agonista peptidi in forma di eterodimeri11,17 o presente sul quantum dots12,13. Primi lavori su co-agonismo nell'attivazione delle cellule di T di CD8 + nel contesto del riconoscimento pMHC agonista su APC utilizzate linee cellulari TAP2-carenti come APC. TAP è richiesto per il trasporto di peptidi dal citoplasma al reticolo endoplasmatico e deficit di TAP riduce gravemente il pool di peptidi associazione di disponibile MHC classe. In assenza di peptidi, il nascente complesso di MHC di classe I catena pesante e β2- microglobulina è instabile, con conseguente bassissimo MHC-I cellulare espressione di superficie. Inizialmente, confronto delle cellule T stimolate con antigene caricato su TAP-sufficiente e - mouse carente RMA e linee cellulari di RMA-S, rispettivamente, come APC, non ha rivelato alcuna prova per co-agonismo durante del mouse di attivazione delle cellule T18. Tuttavia, uso di questo sistema sperimentale non ha consentito un controllo preciso della quantità di agonista pMHC presentato indipendentemente dal non-stimolatore pMHC auto. Inoltre, queste due linee cellulari possono anche differire in espressione di altre molecole che modulano l'attivazione delle cellule T, come ligandi per recettori di co-stimolatori o inibitori delle cellule T, o molecole di adesione.
Successivamente, abbiamo sviluppato un protocollo per il caricamento di cellule TAP2-carenti RMA-S con peptidi esogeni per consentire la presentazione di un importo fisso di pMHC agonista in presenza o assenza di non-stimolatore pMHC. Questo è stato raggiunto attraverso i seguenti: incubazione di TAP2-carenti RMA-S cellule a basse temperature (28 ° C, anziché il solito 37 ° C) per stabilizzare vuoto MHC classe I pesante catena/β2 microglobulina complessi19; incubazione a 28 ° C con peptide agonista esogeno; incubazione a 28 ° C in presenza o assenza del peptide non-stimolatore esogeno; e incubazione a 37 ° C per ridurre l'espressione di superficie delle cellule di vuoto MHC di classe I complessi8,9. L'uso di questo set-up sperimentale ha rivelato che la presenza di non-stimolatore pMHC l'attivazione di timociti di topo, cellule di T di CD8 + periferiche ingenuo e CTL8aumentata. Meccanicistico, la presenza di pMHC non-stimolatore può indurre CD8 reclutamento alla sinapsi immunitaria cellulare: APC T anche in assenza di agonista pMHC, e pMHC non-stimolatore può migliorare l'interazione di TCR con CD8 corecettore7,8. Tuttavia, questo sistema sperimentale non consente test i contributi relativi di TCR e CD8 associazione coreceptor da agonista e co-agonista pMHC nel mediare la valorizzazione di attivazione, come eventuali modifiche alterando associazione TCR o CD8 MHC di classe che i ' d interessare tutte le molecole di MHC, indipendentemente dal fatto il peptide presentato. Quindi abbiamo usato MHC di classe I singolo tecnologia catena per superare questo problema.
La classe di MHC singola catena (sc) ho formato è stata utilizzata prima per migliorare la presentazione antigenica pMHC per strategie terapeutiche e per rispondere a domande fondamentali sui meccanismi di attivazione delle cellule del recettore TCR e NK e funzionare20,21 . scMHC-I consiste di peptide, β2- microglobulina e MHC-ho catena pesante affiancato da due flessibile ricco/glicina-serina linker (Figura 1A), diverse sequenze di linker differenti sono stati sviluppati e testati22. scMHC-posso piegare indipendentemente il rubinetto complesso e chaperon proteine richieste per pMHC convenzionale assemblaggio complesso20. scMHC-mi è stato mostrato per piegare correttamente, come determinato mediante anticorpi conformazione-specifici22 e risolvendo struttura sc con cristallografia a raggi x23. La base scMHC-ho design è stato modificato per migliorare il legame di affinità bassa peptidi24,25.
Questo protocollo descrive l'uso di scMHC umano-di indagare co-agonismo durante umano CTL clonare l'attivazione. Il protocollo è stato ottimizzato per clone umano CTL specifico per un epitopo del virus dell'epatite B (HBV). HBV è un grave onere sanitario in tutto il mondo, come ci sono 350 milioni persone infettate da HBV e infezione da HBV cronica possono condurre allo sviluppo di carcinoma epatocellulare (HCC). Le cellule di HCC derivando dall'infezione di HBV possono di solito presentano epitopi HBV-derivato e possono essere riconosciute da specifiche cellule T umane. Liquidazione di HBV e HCC si basa sulla cellula T umano risposte26, ma pazienti con HCC spesso soffrono di esaurimento delle cellule T e riduttrice delle cellule di T risposte27. Introduzione di TCR specifico HBV in cellule di T di HBV è stato provato come una potenziale strategia di immunoterapia per eliminare di infezione cronica da HBV28. Tuttavia, non si sa se questo metodo sarà efficace in un contesto clinico, a causa dei bassi livelli di superficie MHC-I in epatociti umani29. Pertanto, la comprensione del meccanismo di coagonism possono fornire prospettive alternative per immunoterapia di HBV, possibilmente migliorando la presentazione di pMHC endogeno di indurre risposte di co-agonismo-mediata delle cellule di T. Il protocollo riguarda tutte le misure necessarie per la ricerca su umano co-agonismo: transfezione delle cellule di T-REx CHO con pMHC sc agonista e co-agonista, generazione di linee di cellule di T-REx CHO stabile, cultura della linea a cellula T CD8 + CTL umana HBV specifici e l'attivazione di CTL esperimenti di quantificare la produzione di citochine e degranulazione in risposta alle cellule di T-REx CHO. Anche se ci concentriamo sull'utilizzo del MHC sc classe I tecnologia per indagare co-agonismo durante l'attivazione delle cellule T HBV, si deve constatare che i metodi presentati possono essere facilmente adattati per la ricerca su altri aspetti dell'attivazione delle cellule T nei sistemi di cellula T umano con noti pMHC-ho specificità.
Questo protocollo utilizza un umano CD8 + CTL linea specifico per HBV-derivato il peptide E183-91 (FLLTRILTI: "E183")30 presentato il HLA-A2. molecole HLA di SC che consiste di una sequenza di segnale da umano β2-microglobulina, un peptide di associazione HLA-A2 di interesse, un linker di glicina/della serina, un umano β2-microglobulina, un linker di glicina/serina e una A2 catena pesante può essere commercialmente sintetizzato (Figura 1A ). Plasmidi codifica scA2 costrutti con peptide E183 agonista, o coagonist HIV GAG (SLYNTVATL)31 peptidi sono disponibili da parte degli autori su richiesta. La sequenza del peptide può essere modificata utilizzando mutagenesi sito. Un vettore tetraciclina-inducibile pcDNA5/a è stato utilizzato per esprimere la catena singola agonista HLA-A2 con E183 peptide (sc E183-HLA-A2). In presenza di repressore di tetraciclina, la pcDNA5/a plasmide permette solo molto basso, "colante" espressione della proteina di interesse; alta espressione può essere indotta tramite l'aggiunta di tetraciclina (Figura 1BC). Utilizzo di un sistema di espressione inducibile tetraciclina permette controllo sulla quantità di espressione di pMHC agonista di superficie delle cellule. Un pcDNA3.1 di plasmide di espressione costitutiva è stata utilizzata per esprimere coagonist scA2 con GAG peptide (sc GAG-HLA-A2). L'espressione di tetraciclina-regolato linea cellulare CHO (T-REx) (linea cellulare di criceto, non MHC umano endogeno) è stato utilizzato per esprimere costrutti di sc-HLA-A2 agonista e co-agonista. Questo sistema sperimentale permette un controllo preciso sulla presentazione pMHC (Figura 1): nessuna presentazione di pMHC (untransfected T-REx), una quantità elevata di presentazione di co-agonista pMHC (sc costitutiva espressione GAG-HLA-A2), una bassa quantità di agonista pMHC presentazione (sc E183-HLA-A2 in assenza della tetraciclina), una quantità elevata di presentazione di agonista pMHC (sc E183-HLA-A2 in presenza di tetraciclina), una bassa quantità di presentazione pMHC agonista e alta espressione del co-agonista pMHC (sc E183-HLA-A2 nella assenza di tetraciclina e costitutiva sc espressione GAG-HLA-A2). Uso di questo sistema sperimentale consente un controllo preciso di importi della superficie delle cellule di agonista e coagonist pMHC.
Protocollo
Nota: Tutti i passaggi che coinvolgono uso delle cellule dal vivere, non fissa deve essere eseguita in una cappa di biosicurezza, e tutti i rifiuti a rischio biologico devono essere eliminati secondo le locali norme di salute e sicurezza.
1. CHO transfezione delle cellule e la generazione di linee di cellule CHO stabile
-
Transfezione delle cellule CHO
Nota: questa sezione descrive la transfezione di cellule CHO utilizzando polyethylenimine (PEI). Tuttavia, metodi alternativi possono essere utilizzati, come cellule CHO sono relativamente facili da transfect utilizzando reagenti di transfezione del lipido commercialmente disponibili.- Cultura CHO cells in completa F12 (cF12, F12 completati con 5% di FBS, 100 U/mL di penicillina, 100 μg/mL di streptomicina e 10 µ g/mL Consciousness per mantenere l'espressione del repressore di tetraciclina). Le cellule del passaggio ogni 3-4 giorni presso un 01:10 ratio.
- Un giorno prima di transfezione, preparare la sospensione di cellule CHO. Cellule di CHO lavare nel pallone utilizzando PBS (10 mL per PBS per un pallone da T75, 5 mL di PBS per un pallone da T25). Aggiungere 0.05% Trypsin/0.02% EDTA in PBS (2 mL per un pallone da T75, 1 mL per una boccetta di T25) al pallone e incubare per 5-10 min a temperatura ambiente (TA). Utilizzando un microscopio ottico, verifica che le cellule hanno staccato e smettere di trypsinization aggiungendo cF12 al pallone (8 mL per un pallone da T75, 4 mL per una boccetta di T25).
- Trasferire la sospensione di cellule CHO per un tubo da 15 mL e centrifugare a 300-400 x g per 5 min a 4 ° C o RT. Remove sovranatante, risospendere in cF12 (10 mL per un pallone da T75, 5 mL per una boccetta di T25) e contare utilizzando un emocitometro.
- Regolare la concentrazione di cellule di CHO 60.000-100.000 cellule/mL. Aggiungere 5 mL della sospensione di cellule CHO (300.000-500.000 cellule CHO) per pozzetto in un piatto ben 6. Incubare per una notte a 37 ° C, 5% CO2.
- Il giorno della transfezione, aggiungere 400 μL di privo di siero F12 media o media di basso del siero in una provetta da 1,5 mL. Aggiungere 3 μg di plasmide 400 μL di media. Mescolare pipettando. Aggiungere 6 μg di PEI (6 μL di soluzione di 1 mg/mL PEI) per il mix di media/DNA e vortice immediatamente per 10 s.
- Incubare le combinazioni di media/DNA/PEI alla RT per 10-15 min. Durante questa incubazione, sostituire media delle cellule CHO nella piastra di ben 6 con 5 mL di fresco cF12 media.
- Aggiungere la soluzione di media/DNA/PEI in cellule CHO. Aggiungere la soluzione goccia a goccia e uniformemente sopra il pozzo. Incubare per una notte a 37 ° C, 5% CO2.
-
Generazione di linee di cellule CHO stabile
- Un giorno dopo la trasfezione rimuovere supporti dai pozzetti e aggiungere 5 mL di cF12 contenente gli antibiotici di scelta appropriata ad ogni pozzetto. Utilizzare igromicina 0,3 mg/mL per plasmidi basato su pcDNA5TO e geneticin 1 mg/mL per plasmidi pcDNA3-basato.
- Se la portata di cellule più di confluency di 90% a 24 h post transfezione, tripsinizzano le cellule.
- Lavare i pozzetti con 1 mL di PBS per bene, aggiungere 1 mL di 0.05% trypsin/0.02% EDTA in PBS e incubare per 5-10 min a RT. usando un microscopio ottico, verifica che le cellule hanno staccato e smettere di trypsinization con l'aggiunta di 3-4 mL di cF12 per pozzetto.
- Trasferire la sospensione di cellule CHO per un tubo da 15 mL e centrifugare a 300-400 x g per 5 min a 4 ° C o RT. rimuovere il surnatante e risospendere in 10 mL di cF12. Aggiungere 5 mL della sospensione di cellule per pozzetto in lamiera di ben 6. Utilizzare due pozzi per massimizzare il rendimento delle cellule trasfettate.
- Incubare le piastre a pozzetti 6 a 37 ° C, 5% CO2. Monitorare la morte delle cellule e la crescita delle colonie resistenti usando un microscopio ottico. Rimuovere i supporti e sostituirlo con fresco supporto contenente gli antibiotici adatti dopo 4-5 giorni, o quando significativo delle cellule morte è osservata.
- Una volta che la portata di cellule resistenti oltre il 70% confluenza, tripsinizzano le celle come descritto nel passaggio 1.2.2 e trasferire in un pallone di T25 per espansione. La selezione antibiotica richiede 1-2 settimane.
- Una volta che le cellule CHO antibiotico-resistenti nel matraccio T25 raggiungono 70-80% confluenza, eseguire macchiatura dell'anticorpo per verificare l'espressione di superficie delle cellule dei costrutti di interesse. Un giorno prima di macchiatura dell'anticorpo, tripsinizzano le celle come descritto al punto 1.2.2 e regolare la concentrazione di cellule a 200.000 cellule/mL e aggiungere 1 mL di sospensione cellulare alla piastra ben 12. Per l'analisi dei costrutti di tetraciclina-inducibile, aggiungere 50-60 ng/mL della tetraciclina. Incubare per una notte a 37 ° C, 5% CO2.
- Utilizzare cella raschietto per staccare le cellule CHO dal fondo del pozzo. Questo metodo è preferibile trypsinization, poiché riduce il rischio di danni di epitopo a causa di clivaggio proteolitico.
- Trasferire 1 mL di supporti che contengono le cellule CHO in una provetta di FACS. Rotazione verso il basso a 300-400 x g, 4 ° C per 5 min. Risospendere in 100 µ l di anticorpo anti-HLA diluito in FWB. Incubare 30 min a 4 ° C sul ghiaccio. Eseguire questa macchiatura con l'anticorpo anti-A2 per rilevare i livelli totali di espressione di superficie di cella A2 e TCR-come l'anticorpo specifico per A2 in complesso con il peptide E183 per rilevare pMHC agonista-I cellulare livelli di espressione di superficie.
- Dopo verifica espressione di MHC, FACS-Ordina le cellule positive e mantenere le cellule ordinate nei media con antibiotici per ridurre la perdita del transgene. Per le cellule CHO che esprimono pMHC agonista, singola cella ordinamento è consigliabile, per garantire paragonabile agonista pMHC espressione con e senza supertransfection con pMHC co-agonista. 2-3 settimane sono necessarie per la crescita delle cellule CHO seguendo l'ordinamento della singola cella.
2. HBV specifici CTL cultura
-
Preparazione di PBMCs come alimentatori per umana ri-stimolazione di CTL HBV-specifica
Nota: per il clone CTL A2-E183-specifici, ri-stimolazione con PBMCs appena isolato, piuttosto che scongelati PBMCs, dà i risultati migliori.
Attenzione: Ottenere tutte le necessarie approvazioni etiche prima di reclutare volontari per le donazioni di sangue. Ai fini di questo lavoro, PBMC sono stati raccolti da volontari sani sotto il protocollo approvato dalla IRB di NUS. Consenso informato è stato ottenuto da tutti i donatori. Seguire tutte le precauzioni quando si lavora con sangue umano per ridurre il rischio di trasmissione di malattie a carico del sangue.- Prima di iniziare, impostare la temperatura di centrifuga a 19-20 ° C e pre-riscaldare il gradiente di densità (ad es., Ficoll) a RT.
- Aggiungere 15 mL di pendenza di densità temperatura tubo da 50 mL. Centrifuga a 400 x g per 5 min a 19-20 ° C. Questo è per assicurare che non c'è nessun gradiente di densità sul lato del tubo.
- Raccogliere 20 mL di sangue da un donatore volontario sano tramite prelievo venoso. Aggiungere 15 mL di PBS a 20 mL di sangue in una provetta da 50 mL. Mescolare pipettando su e giù.
- Lentamente, aggiungere 35 mL di sangue diluito in PBS sopra i 15 mL di pendenza di densità dal punto 2.1.2. Assicurarsi che il sangue ed il gradiente di densità non si mescolano. Centrifugare le provette a 19 ° C, 1.200 x g per 20 min con i freni fuori.
- Rimuovere circa il 70% del livello del plasma. Aspirare accuratamente il livello contenente i PBMC (lo strato nuvoloso sopra lo strato di gradienti di densità chiara) usando un Pasteur pipetta e metterlo in una nuova provetta da 50 mL.
- Aggiungere PBS PBMCs per ottenere un volume totale di 50 mL. Centrifugare la provetta a 4 ° C, 300-400 x g per 10 min. con attenzione, rimuovere il supernatante utilizzando l'aspiratore e vetro sterile pipetta Pasteur o di decantazione.
- Risospendere le cellule in 50 mL di PBS. Centrifugare la provetta a 4 ° C, 300 x g per 10 min. con attenzione, rimuovere il supernatante utilizzando l'aspiratore e vetro sterile pipetta Pasteur o di decantazione.
- Risospendere le cellule in 2 mL di cellula T umano completo media (media liberi del siero, completati con 2% di siero umano). Contare le celle utilizzando un emocitometro. Questo protocollo dà in media 1-2 x 106 PBMCs per 1 mL di sangue utilizzata.
-
Re-stimolazione CTL utilizzando PBMCs come cellule di alimentatore
- Irradiare PBMCs a 30 Gy per inibire la proliferazione in risposta a stimolazione successiva.
Attenzione: Assicurare una formazione adeguata e la conformità con il laboratorio di requisiti di sicurezza quando si utilizza l'irradiatore. - Risospendere i PBMCs irradiati a cellula T umano completo media a 2 x 106 cellule/mL. Aggiungere lectin e citochine da Phaseolus vulgaris (PHA) per la ri-stimolazione di CTL alle 2 concentrazione di x nella sospensione PBMC. Il finale di citochina e concentrazioni di PHA sono: 20 U/mL ricombinante umano il-2, ricombinante di 10 ng/mL IL-7, 10 ng/mL ricombinante umano IL-15 e 1,5 mg/mL PHA.
- Scongelare il flaconcino CTL congelato in bagnomaria a 37 ° C. Trasferire le cellule scongelate in una provetta da 15 mL con 10 mL di cellula T umano completo media. Rotazione verso il basso a 300-400 x g a 4 ° C per 5 min. con attenzione, rimuovere il supernatante utilizzando l'aspiratore e vetro sterile pipetta Pasteur o di decantazione.
- Risospendere i CTL in 2 mL di media completa umano delle cellule T. Contare le celle utilizzando un emocitometro. Aggiungere file multimediali di cellula T umano completo per ottenere la concentrazione cellulare di 106 cellule/mL.
- In un piatto ben 24, aggiungere 0,5 mL di PBMCs irradiati (106 cellule) con 2 x cytokines e PHA (punto 2.2.2) e 0,5 mL di CTL (0,5 x 106 cellule) per pozzetto. Il numero di pozzetti utilizzati dipende dal numero totale di CTL o PBMCs disponibili. Incubare a 37 ° C, 5% CO2.
- Dopo 4-5 giorni, quando scoppi CTL sono visibili e i mezzi di comunicazione diventa giallo, trasferire le culture in 6 piastre a pozzetti e integrare il volume iniziale 1 mL con 4 mL di cellula T umano completo media con 20 U/mL IL-2, 10 ng/mL IL-7 e 10 ng/mL IL-15 (no PHA).
- Dopo 2-3 giorni, trasferire le culture in un matraccio T75, aggiungere 40 mL di cellula T umano completo media con citochine (punto 2.2.2, nessun PHA) e cultura in posizione verticale.
- Mantenere CTLs ad una concentrazione di 1-2 x 106 cellule/mL aggiungendo media fresco completati con citochine (punto 2.2.2, nessun PHA) ad un volume uguale a quella del volume cultura esistente presso ogni altro giorno. CTL possono essere utilizzati per esperimenti di 7-14 giorni dopo re-stimolo.
- Irradiare PBMCs a 30 Gy per inibire la proliferazione in risposta a stimolazione successiva.
3. esperimenti di attivazione delle cellule T
Nota: Un tipico esperimento richiede diverse linee T-RExCHO: untransfected T-REx CHO cells (controllo negativo), T-REx CHO cellule esprimenti pMHC non-stimolatore solo (scA2-GAG; controllo negativo), T-REx CHO cellule esprimenti basse quantità di agonista pMHC-io ( scA2-ENV senza tetraciclina, campione sperimentale), T-REx CHO cellule che esprimono gli importi bassi di agonista pMHC e di elevate quantità di non-stimolatore co-agonista pMHC (scA2-ENV e scA2-GAG, senza tetraciclina, campione sperimentale), e cellule di T-REx CHO esprimendo le quantità elevate di agonista pMHC-ho scA2-ENV con tetraciclina, controllo positivo), come mostrato in Figura 1D.
-
Placcatura di cellule CHO come cellule presentanti l'antigene
- Cellule di CHO di cultura in T75 pallone, come descritto al punto 1.1.1. Utilizzare celle alla confluenza di 70-90% per ottenere i migliori risultati. Sperimentare un giorno prima dell'attivazione delle cellule T, tripsinizzano le celle come descritto nella sezione 1.1.2. Dopo trypsinization, trasferire la sospensione cellulare in una provetta da 15 mL, centrifuga a 400 x g per 5 min a 4 ° C o RT, rimuovere il surnatante pipettando o decantazione.
- Risospendere il pellet cellulare in 5 mL di cF12. Contare le celle CHO utilizzando un emocitometro.
- Regolare la concentrazione cellulare di 2 x 105/ml utilizzando cF12. Aggiungere 50-60 ng/mL di tetraciclina per l'agonista solo campioni per indurre quantità elevate di agonista pMHC-ho espressione come controllo positivo (Figura 1). Cellule CHO si stabilizzeranno in provette da 15 mL, quindi assicuratevi di mescolarle pipettando o vortex prima di placcatura.
- Per analisi di attivazione delle cellule T, aggiungere 100 μL della sospensione delle cellule CHO per pozzetto al fondo U 96 ben piatto e utilizzare triplici copie per linea cellulare CHO. Per CHO macchiatura delle cellule anti-MHC, aggiungere 1 mL di sospensione cellulare alla piastra ben 12 e utilizzare triplici copie per cellula. Incubare per una notte a 37 ° C, 5% CO2.
-
Analisi di attivazione delle cellule t
Nota: questa analisi di attivazione delle cellule T permette la quantificazione simultanea di degranulation delle cellule di T (CD107a colorazione, una misura di citotossicità delle cellule di T) e la produzione di citochine.- Il giorno prima dell'esperimento, centrifugare le cellule CTL a 400 x g a 4 ° C per 5 min, contare utilizzando emocitometro e risospendere le cellule a 106 cellule/mL a cellula T umano completo media senza citochine o PHA. Incubare a 37 ° C, 5% CO2. Lo scopo di questa fase di riposo è di ridurre la sensibilità CTL, come abbiamo osservato massima attivazione in risposta a basse quantità di antigene senza questo passaggio.
- Il giorno dell'esperimento, centrifuga T cellule a 400 x g a 4 ° C per 5 min, decantazione o pipettaggio per rimuovere il supernatante e risospendere le cellule in media di siero senza completa di 2 mL (senza citochine o PHA). Contare le cellule di T dal vivo utilizzando un emocitometro e regolare la concentrazione di cellule T a 106 live cellule/mL utilizzando supporti di cellula T umano completo (senza citochine o PHA).
- Aggiungere un anticorpo anti-umane CD107a a una diluizione di 1: 100 (concentrazione finale di 2,5 μg/mL), brefeldina A una diluizione di 1: 1000 (concentrazione finale di 1 μg/mL).
- Rimuovere il supporto dalle cellule CHO nella piastra ben 96 aspirando con vetro pipetta Pasteur o scorrendo la piastra. Ogni pozzetto, aggiungere 200 μL la cellula T sospensione (0.2 x 106 cellule) contenenti anti-CD107a e brefeldina A. co-coltura delle cellule di T con cellule CHO per 3-4 h.
- Alla fine della co-cultura, eseguire delle cellule T antigene di superficie di colorazione. Rotazione verso il basso la 96 ben piastra a 300-400 x g, 5 min a 4 ° C ed eliminare il surnatante tramite aspirazione o sfogliando. Aggiungere 2,5 µ l di CD3 e 2,5 µ l di anticorpi CD8 in 50 μL di 0,5% BSA in PBS (tampone di lavaggio di flusso, FWB) per pozzetto per la macchiatura di antigene di superficie delle cellule. Incubare i campioni in ghiaccio per 30 minuti al buio.
- Lavare i campioni con l'aggiunta di 150 μL di FWB per pozzetto. Rotazione verso il basso la 96 ben piastra a 300-400 x g, 5 min a 4 ° C ed eliminare il surnatante tramite aspirazione o sfogliando.
- Eseguire i passaggi di fissazione/permeabilizzazione utilizzando un kit di fissaggio/permeabilizzazione. Aggiungere 100 µ l di soluzione di fissazione/permeabilizzazione (dal kit di fissaggio/permeabilizzazione) per pozzetto, Miscelare pipettando. Incubare in ghiaccio per 20 min.
- Centrifugare a 300-400 x g e a 4 ° C per 5 min ed eliminare il surnatante tramite aspirazione o sfogliando. Aggiungere 200 μL di tampone di lavaggio/perm 1x (diluire il 10 x perm/wash buffer stock dal precedente kit da utilizzare) per pozzetto. Ripetere questo passaggio.
- Risospendere il pellet cellulare in 50 μL di tampone perm/lavaggio 1x contenente anticorpi anti-IFN-γ a 0,3 μg/mL. Incubare in ghiaccio per 30 minuti nel buio.
- Aggiungere 150 µ l di tampone di perm/lavaggio 1X. Centrifugare a 300-400 x g per a 4 ° C per 5 min ed eliminare il surnatante tramite aspirazione o sfogliando. Aggiungere 200 μL di tampone di lavaggio/perm, 1x centrifugare 300-400 x g per a 4 ° C per 5 min ed eliminare il surnatante tramite aspirazione o sfogliando.
- Risospendere ciascun campione in 200 μL di FWB. Procedere con l'analisi cytometric di flusso.
-
CHO cellula MHC di classe I di colorazione
Nota: è fondamentale per verificare scMHC-I cellulare livelli superfici sulle cellule utilizzate su ogni esperimento, come linee cellulari possono perdere l'espressione del transgene. Durante la preparazione ben 96 PORTATARGA per stimolazione delle cellule T, impostare ben 12 piastra per la colorazione delle cellule CHO, come descritto nella sezione 3.1.4.- Utilizzare un raschietto di cella per staccare le cellule CHO dal fondo del pozzo. Questo metodo è preferibile trypsinization, poiché riduce il rischio di danni di epitopo a causa di clivaggio proteolitico.
- Trasferire 1 mL di supporti che contengono le cellule CHO per il tubo di FACS. Rotazione verso il basso a 300-400 x g a 4 ° C per 5 min. Risospendere in 100 µ l di anticorpo anti-HLA diluito in FWB. Incubare per 30 min a 4 ° C sul ghiaccio.
- Eseguire questa macchiatura con l'anticorpo anti-A2 per rilevare i livelli totali di espressione di superficie di cella A2 e TCR-come l'anticorpo specifico per A2 in complesso con E183 peptide32 per rilevare pMHC agonista-I cellulare livelli di espressione di superficie.
- Aggiungere 1 mL di FWB per ciascun campione CHO, gira giù a 300-400 x g, 4 ° C, 5 min e poi ri-sospendere il campione in 0,3 mL di FWB. Procedere con l'analisi di citometria a flusso.
Risultati
La sc MHC di classe I tecnologia usata qui permette un controllo preciso dell'espressione di superficie delle cellule di MHC di classe I con peptidi noti, covalentemente, per indurre l'attivazione delle cellule T. Abbiamo generato un sistema ingegnerizzato per APC xenogeniche (Figura 1A, B, C) che consente la presentazione di bassi livelli di pMHC agonista in presenza o assenza di co-agonista pMHC (Figura 1, E). Criticamente, abbiamo usato un TCR-come anticorpo specifici per HLA-A2 presentazione E183 peptide per mostrare quella presentazione dell'agonista sc che e183-HLA-A2 non è alterata da co-espressione di co-agonista sc GAG-HLA-A2 (Figura 1E). Tuttavia, si deve constatare che l'anticorpo specifico del TCR-come E183-HLA-A2 Mostra qualche associazione HLA-A2, presentando GAG peptide (Figura 1E). Simile derivati dal antigene che presenta sistemi cellulari può essere costruito utilizzando diversi peptidi o molecole di MHC per indagare i requisiti molecolari per interazioni TCR e/o corecettore in cellule T umane con diverse specificità.
Abbiamo usato questi APCs ingegnerizzati per stimolare un E183-HLA-A2-specific CD8 + T cell clone umano. Sono stati utilizzati tre controlli negativi: le cellule di T-REx CHO untransfected, sola le cellule di T e cellule di T-REx CHO che esprimono quantità elevate di co-agonista sc GAG-HLA-A2 per verificare la potenziale T attivazione della cellula da qualsiasi molecole espresse su cellule CHO T-REx (untransfected T-REx CHO cellule rispetto a cellula T solo) e per l'attivazione delle cellule T da sc-GAG-HLA-A2 (cellule di T-REx CHO che esprimono alti livelli di sc-GAG-HLA-A2 rispetto alle cellule di T-REx CHO untransfected). Cellule di T-REx CHO untransfected o le cellule di T-REx CHO che esprimono sc-GAG-HLA-A2 non hanno indotto l'attivazione del clone CTL CD8 + E183-HLA-A2-specifici, come determinato da quantificare la produzione di IFN-γ e l'espressione del marcatore di degranulazione CD107a come misura della cellula T citotossicità (Figura 2AB). Espressione di alti livelli di agonista sc E183-HLA-A2, usato come controllo positivo, indotto molto efficiente produzione di IFN-γ e degranulazione (Figura 2AB), dimostrando che il costrutto di HLA-A2 sc possa essere riconosciuto da un TCR specifico per attivare Funzioni effettrici delle cellule t. Espressione di bassi livelli di sc E183-HLA-A2 ha indotto i livelli più bassi di produzione di IFN-γ e degranulazione, e questa è stata migliorata dalla presenza di co-agonista sc GAG-HLA-A2 (Figura 2AB). Deve essere notato che molto alte percentuali di cellule T CD107a + sono state osservate anche in risposta a bassi livelli di pMHC antigenica (Figura 2B), coerente con i rapporti precedenti di requisiti relativamente bassi per la quantità di pMHC agonista per l'induzione di cellule T citotossicità33. Il MFI CD107a, che indica la quantità di degranulazione su base singola cella, fornisce una migliore gamma dinamica (Figura 2B). L'analisi di attivazione delle cellule T utilizzato permette la quantificazione simultanea di due funzioni effettrici principali: citochina produzione e citotossicità e consente la lettura molto sensibile con buona gamma dinamica.
Abbiamo utilizzato la tecnologia di singola catena per verificare se l'associazione TCR a co-agonista pMHC è necessaria per il miglioramento della co-agonista attivazione pMHC-dipendente. Abbiamo mutato valina alla posizione 152 al bordo della scanalatura di associazione di peptidi HLA-A2 (Figura 3B) in acido glutammico per creare V152E mutante, come questa mutazione è stata segnalata ad abolire associazione TCR a HLA-A234. Abbiamo poi verificato se la mutazione di V152E può abolire TCR vincolante per il clone di E183-HLA-A2 CTL usato, l'introduzione di questa mutazione in agonista sc E183-HLA-A2 ed esprimendo il costrutto di sc agonista mutante in cellule CHO T-REx. Wild type, ma non V152E, sc E183-HLA-A2 indotta da attivazione del clone CTL E183-HLA-A2-specifici utilizzato (Figura 3A). Si deve notare che alcuna mutazione di TCR-associazione il MHC di classe I deve essere testato separatamente per ogni singolo clone delle cellule TCR/T usato, come l'effetto della mutazione dipenderà molto precise interazioni molecolari tra TCR e complesso di pMHC, e questi variano tra TCR diversi. Ad esempio, abbiamo testato Otto mutazioni, uno precedentemente segnalato TCR-associazione mutazioni o mutazioni prevedute per interrompere associazione TCR senza abrogare il legame del peptide in HLA-A2. Di questi, V152E era l'unica mutazione che abolito l'attivazione del clone delle cellule T specifiche per E183 usato10. Abbiamo quindi introdotto la mutazione di V152E nella sc co-agonista GAG-HLA-A2 e co-espressi WT o V152E sc GAG-HLA-A2 con bassi livelli di agonista sc E183-HLA-A2. Sc sia WT e V152E GAG-HLA-A2 migliorato la produzione di IFN-γ e degranulazione (Figura 3D), suggerendo che associazione TCR a pMHC co-agonista non è richiesto per esaltazione di attivazione di co-agonista pMHC-dipendente CD8 + T cell. Singola catena MHC classe I tecnologia, come presentato qui, può essere utilizzato per modificare TCR e/o corecettore associazione a MHC di classe I con peptide conosciuto per studiare i requisiti molecolari per il riconoscimento dell'antigene delle cellule T e attivazione.

Figura 1: singola catena HLA-A2 costrutti utilizzata per indagare co-agonista in umano attivazione di cellule T CD8 +. (A) rappresentazione schematica di un costrutto scHLA-A2, consistente in covalenza sequenza del segnale da fuso umano β2 microglobulina, peptide della scelta, del linker flessibile glicina-serina (GGGGSGGGGS GGGGS), umano β2 microglobulina, flessibile glicina-serina linker e catena pesante di HLA-A2. (B) diagramma schematico dei plasmidi utilizzati per generare cellule per studiare co-agonismo nell'attivazione a cellula T di CD8 + umano presentanti l'antigene ingegnerizzato: repressore di tetraciclina, agonista sc E183-HLA-A2 sotto controllo del promotore inducibile tetraciclina, non-stimolatore co-agonista sc GAG-HLA-A2 sotto controllo del promotore costitutivamente attiva. Il diagramma schematico (C) dell'antigene ingegnerizzato che presenta celle utilizzate per indagare co-agonismo: cellule CHO T-REx (nessuna espressione di MHC umana), cellule di T-REx CHO che esprimono costitutivamente alti livelli di sc GAG-HLA-A2 (non-stimolatore co-agonista pMHC), Le cellule di T-REx CHO che esprimono bassi livelli "colanti" di sc E183-HLA-A2 in assenza di tetraciclina (basso livello di peptide agonista), cellule di T-REx CHO che esprimono alti livelli di sc E183-HLA-A2 in presenza di tetraciclina (alto livello di peptide agonista), T-REx CHO cells che esprimono bassi livelli di sc E183-HLA-A2 e alti livelli di sc GAG-HLA-A2 (basso livello di peptide agonista) e alto livello di peptide co-agonista. (D) Cell marcatura di superficie dell'antigene ingegnerizzato che presenta linee cellulari con anticorpi anti-HLA-A2. I numeri visualizzati indicano valori di IFM per la macchia di MHC nel cancello cellule vive. Dati rappresentativi di 5 esperimenti indipendenti (E) delle cellule superficiali macchiatura dell'antigene ingegnerizzato che presenta linee cellulari usando TCR-come l'anticorpo specifico contro HLA-A2 presentazione E183 peptide. I numeri visualizzati indicano valori di IFM per la macchia di MHC nel cancello cellule vive. Dati rappresentativi di 5 esperimenti indipendenti. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: presenza di co-agonista pMHC migliorato la produzione di citochine e degranulazione dei clone umano di CD8 + CTL E183-HLA-A2-specifico. (A) intracellulare IFN-γ macchiatura del clone di CD8 + CTL umano HLA-A2-specifico dopo stimolazione di 3 h con indicato ingegnerizzato cellule presentanti l'antigene. I numeri visualizzati indicano la percentuale positiva per la macchiatura di IFN-γ. Dati rappresentativi di 3 esperimenti indipendenti, ognuno eseguito con tecniche triplici copie. (B) cella di superficie CD107a macchiatura del clone di CD8 + CTL umano HLA-A2-specifico dopo stimolazione di 3 h con indicato ingegnerizzato cellule presentanti l'antigene. I numeri visualizzati denotano la percentuale positiva per la colorazione di CD107a o CD107a IFM per la popolazione delle cellule di T di CD8 +. Dati rappresentativi di 3 esperimenti indipendenti, ognuno eseguito con tecniche triplici copie. Clicca qui per visualizzare una versione più grande di questa figura.
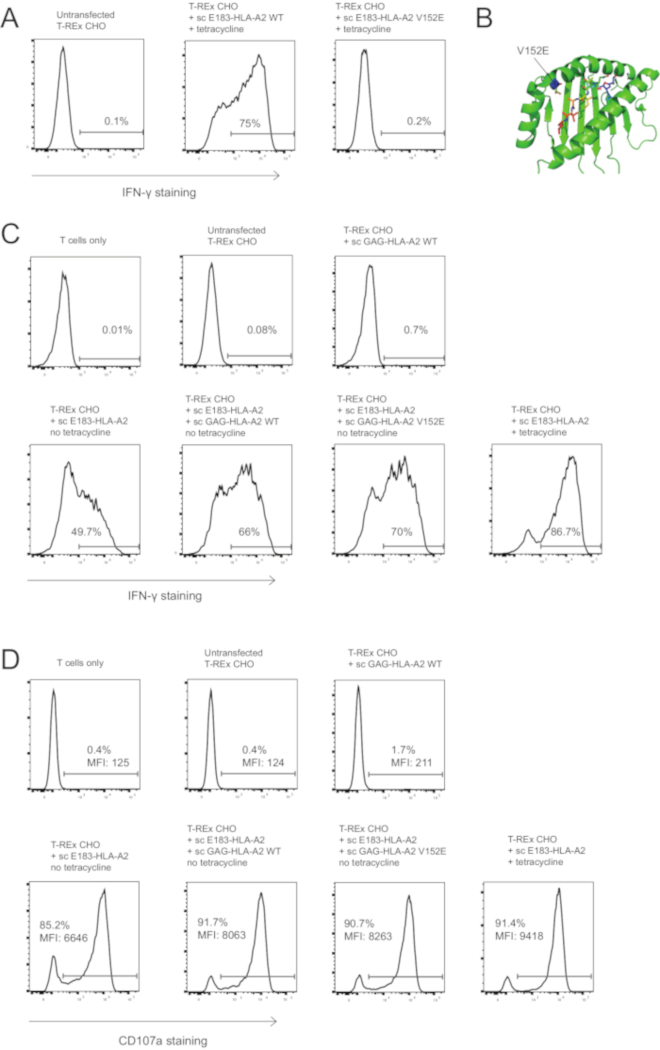
Figura 3: co-agonista – valorizzazione di attivazione delle cellule T mediata non richiede associazione TCR per la pMHC di co-agonista complesso. (A) V152E mutazione in sc E183-HLA-A2 abolisce l'attivazione del clone umano CD8 + CTL E183-HLA-A2-specifico. Cellule di T-REx CHO che esprimono alti livelli (induzione di tetraciclina) del WT o V152E mutante sc E183-HLA-A2 sono state utilizzate per stimolare il clone umano di CD8 + CTL E183-HLA-A2-specifico per 3h. L'attivazione delle cellule t è stato quantificato mediante colorazione intracellulare di IFN-γ. I numeri visualizzati indicano la percentuale positiva per la macchiatura di IFN-γ. Dati rappresentativi di 3 esperimenti indipendenti, ognuno eseguito con tecniche triplici copie. (B) posizione della mutazione di V152E all'interno della scanalatura di legame del peptide di HLA-A2. (C) V152E mutazione su sc GAG-HLA-A2 co-agonista pMHC complesso non abolisce la valorizzazione di attivazione co-agonist-dipendente. Colorazione intracellulare IFN-γ del clone di CD8 + CTL umano HLA-A2-specifico dopo stimolazione di 4h con indicato ingegnerizzato cellule presentanti l'antigene. I numeri visualizzati indicano la percentuale positiva per la macchiatura di IFN-γ. Dati rappresentativi di 3 esperimenti indipendenti, ognuno eseguito con tecniche triplici copie. (D) V152E mutazione su sc GAG-HLA-A2 co-agonista pMHC complesso non abolisce la valorizzazione di attivazione co-agonist-dipendente. Delle cellule superficiali CD107a macchiatura del clone di CD8 + CTL umano HLA-A2-specifico dopo stimolazione di 3h con indicato ingegnerizzato cellule presentanti l'antigene. I numeri visualizzati denotano la percentuale positiva per la colorazione di CD107a o CD107a IFM per la popolazione delle cellule di T di CD8 +. Dati rappresentativi di 3 esperimenti indipendenti, ognuno eseguito con tecniche triplici copie. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il protocollo presentato prevede un robusto strumento studio delle interazioni molecolari durante l'attivazione delle cellule di T di CD8 + umano. Un passo fondamentale per indagine co-agonismo durante l'attivazione delle cellule T umane è controllo sopra agonista pMHC cella espressione superficiale per garantire uguale agonista pMHC presentazione su APC con o senza espressione pMHC co-agonista. Nel nostro sistema sperimentale, questo viene raggiunto utilizzando un clone di singola cellula che esprimono gli importi bassi di agonista pMHC, seguita da supertransfection con un co-agonista pMHC costrutto e agonista pMHC quantificazione tramite TCR-come anticorpo10, 32. come espressione di agonista sc pMHC può cambiare nel tempo, è fondamentale per quantificare l'espressione di superficie pMHC agonista su APCs utilizzati in ogni esperimento usando TCR-come gli anticorpi. Se non vi sono anticorpi specifici TCR-come sono disponibili, agonista scMHC-posso essere espresso come fusione di proteina fluorescente, e la sua espressione di superficie delle cellule quindi può essere quantificata utilizzando un metodo di microscopia sensibili, quali la microscopia di fluorescenza di riflessione interna totale 35 , 36. Inoltre, espressione di superficie delle cellule di pMHC co-agonista diminuisce nel tempo, a causa di metilazione-dipendente e - indipendenti silenziamento del promotore CMV37e deve essere monitorata mediante analisi di citometria a flusso e la macchiatura dell'anticorpo, con ripetute FACS-ordinamento quando necessario. Noi abbiamo coltivato le cellule CHO per fino a 5 settimane con relativamente limitata perdita di espressione di pMHC sc. Consigliamo vivamente di congelamento delle cellule CHO presto dopo la selezione/cernita per garantire un affidabile stock di celle con l'espressione di MHC noto sc.
I diversi passaggi dei protocolli presentati possono essere modificati, a seconda della disponibilità di attrezzature, o a seconda degli obiettivi specifici di ricerca. Ad esempio, proliferazione di PBMC potenziale può essere inibita (punto 3.2.1) utilizzando metodi alternativi che non richiedono una gamma (o X-) irradiatore, quali il trattamento con mitomicina C38. Un buffer di dissociazione non enzimatica delle cellule contenenti dei chelatori del metallo39 può essere utilizzato invece cella raschiatura al punto 3.3.1. Inoltre, l'antigene che presenta il sistema può essere modificato per renderlo più adatto per molecole umano CTL cloni che esprimono TCR. CHO diverse cellule criceto espresso MHC di classe I, e anche se queste sono irrilevanti per la linea CTL studiata qui (Figura 2A e Figura 3A, abbiamo non osservato nessun risposte delle cellule T a untransfected cellule CHO), c'è la possibilità che altri TCR umano può mostrare alcune xenoreactivity. In che caso, criceto MHC di classe I espressione può essere ridotto battendo fuori criceto β2-microglubulin o tocca utilizzando CRISPR/Cas9; o una linea APC umana può essere utilizzata dopo CRISPR/Cas9-mediata β2-microglubulin o tocca mettere fuori.
Il sistema sperimentale qui presentato consente un controllo preciso del TCR e CD8 interazioni con molecole di MHC che presenta peptidi pre-definiti. Ad esempio, in precedenza abbiamo dimostrato che mutazioni abolendo CD8 associazione40 a coagonist pMHC eliminato valorizzazione coagonist-ha mediato l'attivazione in murine ed umane CD8 + T cellule9,10, considerando che abroga TCR interazione con pMHC co-agonista non ha avuto effetto su coagonist-ha mediato l'attivazione valorizzazione10. Tuttavia, l'utilizzo di costrutti di singola catena MHC presenta diverse limitazioni. Ad esempio, è il momento e che consumano manodopera per testare più del peptide co-agonista sequenze utilizzando questo sistema sperimentale, poiché si tratta di generazione dei plasmidi più codifica sc MHC con peptidi differenti e successivi transfezioni e ordinamento delle cellule. In precedenza, abbiamo usato la linea cellulare murina di TAP-carenti RMA-S per testare più peptidi co-agonista nel topo l'attivazione delle cellule T8,9, ma questo approccio non è riuscito con il TAP-carenti umano T2 cella linea10, più probabile a causa della presentazione di TAP-indipendente peptidi41. Un'altra limitazione del nostro sistema sperimentale è che è non fornisce un metodo veloce per modificare la quantità di molecole di pMHC co-agonista ai fini della determinazione della quantità critica di pMHC co-agonista necessaria a provocare l'attivazione delle cellule T. Inoltre, il sistema di tetraciclina-viscoelastico utilizzato non consente titolazione di agonista quantità di pMHC a livello di singola cellula modificando la concentrazione di tetraciclina, come diversa concentrazione di tetraciclina altera la proporzione di cellule positive HLA-A2, piuttosto che i livelli di HLA-A2 su base per cella. Un approccio alternativo che attualmente stiamo studiando è l'utilizzo supportati lipidi bilayer42, precedentemente utilizzato per indagare co-agonismo durante attivazione murino delle cellule di CD4 + T4 o perline presentazione importo fisso di agonista pMHC nella presenza di quantità variabili di pMHC co-agonista. Quando utilizzato in combinazione con UV-spaccabili peptide tecnologia4,43, questi sistemi sperimentali alternativi dovrebbero consentire la verifica veloce di più sequenze peptidiche co-agonista, nonché diverse quantità di co-agonista pMHC .
La tecnologia di MHC sc può essere anche applicabile all'indagine dei co-agonismo in cellule di T di CD4 umane o murine, come molecole a catena singola MHC classe II che presenta peptidi sono stati correttamente espressi su cellule di mammifero superfici44predeterminato. Inoltre, l'uso della tecnologia sc MHC può essere estesa alla ricerca di molecole di MHC non-classica come HLA-E. SC HLA-E è stato descritto prima, e la sua espressione è stato indicato per inibire l'attivazione di cellule T umane45. Un'altra molecola MHC non-classica di interesse è CD1, che presenta lipidi anziché peptidi46. Costrutti di SC composto da catena pesante CD1 e β2-microglobulina sono stati indicati per essere espressi sulla superficie delle cellule e per associare lipidi pertinenti ligandi47. Catena singola tecnologia di MHC ha un grande potenziale come strumento di ricerca per lo studio di interazioni molecolari durante l'attivazione delle cellule T e NK.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Questa ricerca è stata sostenuta dal Consiglio di ricerca medica nazionale di Singapore Ministero della salute sotto sua CBRG/0064/2014 al N.R.J.G., da CREATE sotto sua R571-002-012-592 a P.A.M., National Research Foundation Investigatorship R571-000-272-281 a P.A.M . e di un premio di investigatore di ricerca traslazionale (STaR) (NMRC/STaR/013/2012) Singapore a A.B. Siamo grati a Dr. Paul Hutchinson e Mr. Teo Guo Hui da NUS immunologia programma Flow funzione di memoria per la selezione di esperti delle cellule. Siamo grati a Elijah Chen per lettura critica del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| Aim-V (serum free media) | Gibco | 12055091 | |
| Blasticidin | Gibco | R21001 | |
| Cytofix/Cytoperm (fixation/permealibisation kit) | BD | 554714 | |
| F12 | Gibco | 10565-018 | |
| Fetal bovine serum (FBS) | HyClone | SH3007103 | |
| Geneticin | Gibco | 10131035 | |
| GolgiPlug (Brefeldin A) | BD | 555029 | |
| Human serum | Sigma-Aldrich | H4522 | |
| Hygromycin | Gibco | 10687010 | |
| Lectin from Phaseolus vulgaris (PHA) | Sigma-Aldrich | L4144 | |
| Opti-MEM (low serum media) | Bibco | 31985070 | |
| 10x PBS | Vivantis | PB0344 – 1L | |
| Penicillin/Streptomycin | HyClone | SV30010 | |
| Polyethylenimine (PEI) | Sigma-Aldrich | 408727 | |
| Recombinant human IL2 | R&D Systems | 202-IL | |
| Recombinant human IL7 | R&D Systems | 207-IL | |
| Recombinant human IL15 | R&D Systems | 247-ILB | |
| Tetracycline | Sigma-Aldrich | T7660 | |
| T-REx CHO cell line | Thermo Fisher Scientific | R71807 | |
| 10 x Trypsin/EDTA | Gibco | 15400054 | |
| Antibodies | |||
| CD3 | BD | 347347 | Clone SK7, RRID:AB_400287 |
| CD8α | BD | 563795 | Clone RPA-T8, RRID:AB_2722501 |
| CD107a | BD | 566261 | Clone H4A3, RRID:AB_2739639 |
| HLA-A2 | eBioscience | 17-9876-41 | Clone BB7.2, RRID:AB_11151522 |
| IFN-γ | eBioscience | 12-7319-41 | Clone 4S.B3, RRID:AB_1311250 |
Riferimenti
- Gascoigne, N. R. Do T cells need endogenous peptides for activation?. Nature Reviews. Immunology. 8 (11), 895-900 (2008).
- Gascoigne, N. R., Zal, T., Yachi, P. P., Hoerter, J. A. Co-receptors and recognition of self at the immunological synapse. Current Topics in Microbiology and Immunology. 340, 171-189 (2010).
- Krogsgaard, M., Juang, J., Davis, M. M. A role for "self" in T-cell activation. Seminars in Immunology. 19 (4), 236-244 (2007).
- Krogsgaard, M., et al. Agonist/endogenous peptide-MHC heterodimers drive T cell activation and sensitivity. Nature. 434 (7030), 238-243 (2005).
- Ebert, P. J., Jiang, S., Xie, J., Li, Q. J., Davis, M. M. An endogenous positively selecting peptide enhances mature T cell responses and becomes an autoantigen in the absence of microRNA miR-181a. Nature Immunology. 10 (11), 1162-1169 (2009).
- Lo, W. L., et al. An endogenous peptide positively selects and augments the activation and survival of peripheral CD4+ T cells. Nature Immunology. 10 (11), 1155-1161 (2009).
- Yachi, P. P., Ampudia, J., Gascoigne, N. R., Zal, T. Nonstimulatory peptides contribute to antigen-induced CD8-T cell receptor interaction at the immunological synapse. Nature Immunology. 6 (8), 785-792 (2005).
- Yachi, P. P., Lotz, C., Ampudia, J., Gascoigne, N. R. T cell activation enhancement by endogenous pMHC acts for both weak and strong agonists but varies with differentiation state. The Journal of Experimental Medicine. 204 (11), 2747-2757 (2007).
- Hoerter, J. A., et al. Coreceptor affinity for MHC defines peptide specificity requirements for TCR interaction with coagonist peptide-MHC. The Journal of Experimental Medicine. 210 (9), 1807-1821 (2013).
- Zhao, X., et al. Nonstimulatory peptide-MHC enhances human T-cell antigen-specific responses by amplifying proximal TCR signaling. Nature Communications. 9 (1), 2716 (2018).
- Juang, J., et al. Peptide-MHC heterodimers show that thymic positive selection requires a more restricted set of self-peptides than negative selection. The Journal of Experimental Medicine. 207 (6), 1223-1234 (2010).
- Anikeeva, N., et al. Quantum dot/peptide-MHC biosensors reveal strong CD8-dependent cooperation between self and viral antigens that augment the T cell response. Proceedings of the National Academy of Sciences of the United States of America. 103 (45), 16846-16851 (2006).
- Anikeeva, N., Gakamsky, D., Scholler, J., Sykulev, Y. Evidence that the density of self peptide-MHC ligands regulates T-cell receptor signaling. PloS One. 7 (8), e41466 (2012).
- Schuren, A. B., Costa, A. I., Wiertz, E. J. Recent advances in viral evasion of the MHC Class I processing pathway. Current Opinion in Immunology. 40, 43-50 (2016).
- Bubenik, J. MHC class I down regulation, tumour escape from immune surveillance and design of therapeutic strategies. Folia Biologica. 51 (1), 1-2 (2005).
- Apps, R., et al. Influence of HLA-C expression level on HIV control. Science. 340 (6128), 87-91 (2013).
- Cebecauer, M., et al. CD8+ cytotoxic T lymphocyte activation by soluble major histocompatibility complex-peptide dimers. The Journal of Biological Chemistry. 280 (25), 23820-23828 (2005).
- Sporri, R., Reis e Sousa, C. Self peptide/MHC class I complexes have a negligible effect on the response of some CD8+ T cells to foreign antigen. European Journal of Immunology. 32 (11), 3161-3170 (2002).
- Ljunggren, H. G., et al. Empty MHC class I molecules come out in the cold. Nature. 346 (6283), 476-480 (1990).
- Kotsiou, E., Brzostek, J., Gould, K. G. Properties and applications of single-chain major histocompatibility complex class I molecules. Antioxidants & Redox Signaling. 15 (3), 645-655 (2011).
- Hansen, T. H., Connolly, J. M., Gould, K. G., Fremont, D. H. Basic and translational applications of engineered MHC class I proteins. Trends in Immunology. 31 (10), 363-369 (2010).
- Yu, Y. Y., Netuschil, N., Lybarger, L., Connolly, J. M., Hansen, T. H. Cutting edge: single-chain trimers of MHC class I molecules form stable structures that potently stimulate antigen-specific T cells and B cells. Journal of Immunology. 168 (7), 3145-3149 (2002).
- Mitaksov, V., et al. Structural engineering of pMHC reagents for T cell vaccines and diagnostics. Chemistry & Biology. 14 (8), 909-922 (2007).
- Truscott, S. M., et al. Disulfide bond engineering to trap peptides in the MHC class I binding groove. Journal of Immunology. 178 (10), 6280-6289 (2007).
- Truscott, S. M., et al. Human major histocompatibility complex (MHC) class I molecules with disulfide traps secure disease-related antigenic peptides and exclude competitor peptides. The Journal of Biological Chemistry. 283 (12), 7480-7490 (2008).
- Bertoletti, A., Ferrari, C. Innate and adaptive immune responses in chronic hepatitis B virus infections: towards restoration of immune control of viral infection. Postgraduate Medical Journal. 89 (1051), 294-304 (2013).
- Boni, C., et al. Characterization of hepatitis B virus (HBV)-specific T-cell dysfunction in chronic HBV infection. Journal of Virology. 81 (8), 4215-4225 (2007).
- Gehring, A. J., et al. Engineering virus-specific T cells that target HBV infected hepatocytes and hepatocellular carcinoma cell lines. Journal of Hepatology. 55 (1), 103-110 (2011).
- Gehring, A. J., et al. The level of viral antigen presented by hepatocytes influences CD8 T-cell function. Journal of Virology. 81 (6), 2940-2949 (2007).
- Bertoni, R., et al. Human histocompatibility leukocyte antigen-binding supermotifs predict broadly cross-reactive cytotoxic T lymphocyte responses in patients with acute hepatitis. The Journal of Clinical Investigation. 100 (3), 503-513 (1997).
- Goulder, P. J., et al. Patterns of immunodominance in HIV-1-specific cytotoxic T lymphocyte responses in two human histocompatibility leukocyte antigens (HLA)-identical siblings with HLA-A*0201 are influenced by epitope mutation. The Journal of Experimental Medicine. 185 (8), 1423-1433 (1997).
- Sastry, K. S., et al. Targeting hepatitis B virus-infected cells with a T-cell receptor-like antibody. Journal of Virology. 85 (5), 1935-1942 (2011).
- vanden Berg, H. A., et al. Cellular-level versus receptor-level response threshold hierarchies in T-cell activation. Frontiers in Immunology. 4, 250 (2013).
- Moots, R. J., Matsui, M., Pazmany, L., McMichael, A. J., Frelinger, J. A. A cluster of mutations in HLA-A2 alpha 2 helix abolishes peptide recognition by T cells. Immunogenetics. 34 (3), 141-148 (1991).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. Journal of Visualized Experiments. (61), (2012).
- Axmann, M., Schutz, G. J., Huppa, J. B. Single Molecule Fluorescence Microscopy on Planar Supported Bilayers. Journal of Visualized Experiments. (105), e53158 (2015).
- Mariati, E. Y., Koh, J. H., Yeo, S. C., Ho, Y., Yang, Toward stable gene expression in CHO cells. Bioengineered. 5 (5), 340-345 (2014).
- Matsushita, S., Tanaka, Y., Matsuoka, T., Nakashima, T. Clonal expansion of freshly isolated CD4T cells by randomized peptides and identification of peptide ligands using combinatorial peptide libraries. European Journal of Immunology. 31 (8), 2395-2402 (2001).
- Heng, B. C., Cowan, C. M., Basu, S. Comparison of enzymatic and non-enzymatic means of dissociating adherent monolayers of mesenchymal stem cells. Biological Procedures Online. 11, 161-169 (2009).
- Smith, K., et al. Sensory adaptation in naive peripheral CD4 T cells. The Journal of Experimental Medicine. 194 (9), 1253-1261 (2001).
- Wei, M. L., Cresswell, P. HLA-A2 molecules in an antigen-processing mutant cell contain signal sequence-derived peptides. Nature. 356 (6368), 443-446 (1992).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. Journal of Visualized Experiments. (19), (2008).
- Bakker, A. H., et al. Conditional MHC class I ligands and peptide exchange technology for the human MHC gene products HLA-A1, -A3, -A11, and -B7. Proceedings of the National Academy of Sciences of the United States of America. 105 (10), 3825-3830 (2008).
- Rhode, P. R., et al. Single-chain MHC class II molecules induce T cell activation and apoptosis. Journal of Immunology. 157 (11), 4885-4891 (1996).
- Crew, M. D., Cannon, M. J., Phanavanh, B., Garcia-Borges, C. N. An HLA-E single chain trimer inhibits human NK cell reactivity towards porcine cells. Molecular Immunology. 42 (10), 1205-1214 (2005).
- Van Kaer, L., Wu, L., Joyce, S. Mechanisms and Consequences of Antigen Presentation by CD1. Trends in Immunology. 37 (11), 738-754 (2016).
- Im, J. S., et al. Direct measurement of antigen binding properties of CD1 proteins using fluorescent lipid probes. The Journal of Biological Chemistry. 279 (1), 299-310 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon