Method Article
单链 mhc 技术在人 cd8+ t 细胞活化中的相关研究
摘要
该协议描述了利用单链 mhc i 类复合物研究人类 cd8 + t 细胞激活过程中的分子相互作用: 生成表达单链结构的工程抗原呈现细胞, 培养人类 cd8 + t 细胞克隆和 t 细胞活化实验。
摘要
非刺激自肽 mhc (pmhc) 复合物不诱导 t 细胞活化和效应功能, 但可以通过一种称为共激动剂的过程增强 t 细胞对激动剂 pmhc 的反应。该协议描述了一个实验系统, 通过表达人类 mhc i 类分子将预先确定的肽表示为单个多肽 (单链 mhc) 在异种细胞系中的共同激动作用。我们表达了单链 mhc 的条件下, 低浓度的激动剂单链 p-mhc 复合物和高水平的非刺激单链 p-mhc 复合物表达。使用这个实验系统, 使我们能够比较 cd8+ t 细胞对激动剂 pmhc 的反应, 在存在或不存在非刺激 pmhc。该协议描述了单链 mhc 结构的细胞系转染、稳定细胞系的生成、乙型肝炎病毒特异性人类 cd8+ t 细胞的培养以及 t 细胞活化实验, 同时定量地测定细胞因子的产生和实验。去造粒。该方法可用于已知肽 mhc 特异性的人 t 细胞系统中 cd8+ t 细胞活化的不同方面的研究。
引言
mhc i 类 (mhc-i) 分子存在从每个细胞合成的蛋白质中提取的短 (8-10 氨基酸) 肽。健康细胞上的 mhc-i 分子产生来自内源性蛋白质的自肽。病毒感染导致非病毒衍生肽在 mhc-i 上出现, 但即使是受感染的细胞在存在大量自肽-mhc (pmhc) 的情况下也会出现非自肽。mhc-i 是由 t 细胞受体 (tcr) 和 cd8 在 t 细胞上的共受体识别。tcr 与肽 pmhc 的结合亲和力在很大程度上依赖于所呈现的多肽序列, 而 cd8 结合与肽无关。tcr 结合到非自激动剂 pmhc 复合物导致 t 细胞活化和效应因子功能。非刺激自 pmhc 复合物不诱导 t 细胞活化和效应因子功能, 但可以通过称为共激动剂1,2,3的过程增强 t 细胞对激动剂 pmhc 的反应。在小鼠 cd4 + t 细胞4、5、6以及小鼠 cd8 + t 细胞7、8、9、10中观察到了同体病。11,12,13. 在生理条件下, t 细胞需要在抗原呈现细胞 (apc) 上识别有限数量的抗物质 pmhc, 同时呈现高水平的非刺激 pmhc 复合物, 这表明共激动剂有助于最佳 t 型细胞细胞在体内的反应。在病毒感染14和肿瘤15期间, 总细胞表面 mhc i 级水平经常被降低。这种免疫逃避策略减少激动剂 pmhc 的呈现, 但也减少了可用于 t 细胞活化增强的共激动剂 pmhc i 的量。此外, mhc i 类分子 hla-c 的高细胞表面表达水平已被证明与改善的 hiv 控制相关16, 这表明 mhc i 类表达在 t 细胞活化中的总表达作用至关重要。尽管共激动有生理意义, 但其分子机制仍未完全了解。这在很大程度上是由于在保持激动剂 pmhc 不变的同时, 对共用激动剂 pmhc 的含量进行实验控制的技术挑战。
我们开发了一个实验系统, 通过将人类 mhc i 类分子表示为单个多肽 (单链 mhc-i,图 1a), 研究人类 cd8 + t 细胞活化过程中的共激动性第9行,第10行。单链 (sc) 激动剂 pmhc 在四环素抑制的仓鼠衍生 t-rex cho 细胞系中, 在四环素诱导启动子的控制下表达;这使得 sc 激动剂 pmhc 在没有四环素的情况下表达非常低的 "泄漏" pmhc, 在添加四环素后, sc 激动剂 pmhc 表达 (图 1b, c)。然后在一个有组织活性的启动子 (图1b, c) 的控制下, 用非刺激、共同激动剂 pMHC-expressing 超输转染 sc pMHC-expressing。使用这个实验系统, 使我们能够比较 cd8+ t 细胞对激动剂 pmhc 的反应, 在存在或不存在高水平的非刺激 pmhc。关键的是, 由于肽和 mhc-i 重链在 schc-i 格式中是共价连接的, 因此可以将突变引入 mhc 分子中, 呈现预先确定的肽。因此, 使用 scMHC-I 技术使我们能够专门调节激动剂或共激动剂 pmhc 的 tcr 或 cd8 结合特性。
cd8 + t 细胞活化中的共激动剂是用纯化的 mhc-i 复合物观察到的, 它以杂二的形式呈现激动剂和共激动肽11, 17 或在量子点12,13上呈现。早期在 apc 上的激动剂 pmhc 识别背景下 cd8+ t 细胞活化中的共激动性工作, 以 tap2 缺陷细胞系为 apc。tap 是从细胞质到内质网的多肽输运所必需的, tap 缺乏严重减少了可用 mhc i 型结合肽的池。在没有多肽的情况下, mhc i 类重链和β2-微球蛋白的新生复合物不稳定, 导致 mhc-i 细胞表面表达极低。最初, t 细胞的刺激抗原分别加载到 tap 足够和缺乏的小鼠 rma 和 rma-s 细胞系, 作为 apc, 没有发现任何证据表明在小鼠 t 细胞活化18期间共同激动。然而, 使用这个实验系统不允许精确控制的激动剂 pmhc 的数量提出独立于非刺激自我 pmhc。此外, 这两个细胞系在调节 t 细胞活化的其他分子的表达上也可能不同, 例如与 t 细胞共刺激或抑制受体的配体, 或粘附分子。
随后, 我们开发了一种将 tap2 缺乏的 rma-s 细胞与外源肽一起加载的协议, 以便在存在或不存在非刺激 pmhc 的情况下呈现固定数量的激动剂 pmhc。这是通过以下途径实现的: 在低温 (28°c, 而不是通常的 37°c) 下培养缺乏 tap2 的 rma-s 细胞, 以稳定空的 mhc i 类重链-2 微球蛋白复合物 19;外源性激动肽在28°c 孵育;在存在或不存在外源性非刺激肽的情况下, 在28°c 孵育;在37°c 孵育, 以减少空 mhc i 类复合物8,9的细胞表面表达。该实验装置的使用表明, 非刺激 pmhc 的存在增强了小鼠胸腺细胞、天真的外周 c8 + t 细胞和 ctl8的激活。在机械上, 非刺激 pmhc 的存在可以诱导 cd8 招募到 t 细胞: apc 免疫突触即使在没有激动剂 pmhc 的情况下, 非刺激 pmhc 也能增强与 cd8 受体7,8的 tcr 相互作用。然而, 这个实验系统不允许测试 tcr 和 cd8 受体结合激动剂和共激动剂 pmhc 在介导激活增强方面的相对贡献, 因为任何改变 tcr 或 cd8 结合到 mhc i 类的修改都会影响所有 mhc 分子, 而不考虑所呈现的肽。因此, 我们使用 mhc i 类单链技术来克服这个问题。
单链 (sc) mhc i 类格式已被用于改进抗原 pmhc 的治疗策略的呈现, 并回答有关 tcr 和 nk 细胞受体激活机制和功能20, 21 的基本问题.scMHC-I 由肽、β2-微球蛋白和 mhc-i 重链组成, 由两个灵活的富含糖的血清 (图 1a) 连接, 开发并测试了几种不同的链接剂序列22。scMHC-I 可以独立于传统 pmhc 复合物组装20所需的 tap 复合物和伴侣蛋白折叠.scMHC-I 已被证明是正确折叠, 这是用符合特异性抗体染色22和通过 x 射线晶体学解决 sc 结构23确定的。对基本的 scMHC-I 设计进行了改进, 以提高低亲和力肽24、25 的结合。
该协议描述了使用人 scMHC-I 来研究人 ctl 克隆激活过程中的共激动性。该协议针对乙型肝炎病毒表位的人 ctl 克隆进行了优化。乙肝病毒是全世界严重的医疗负担, 因为有3.5亿人感染了乙肝病毒, 慢性乙肝病毒感染可导致肝细胞癌 (hcc) 的发展。hbv 感染引起的 hcc 细胞通常会出现 hbv 衍生的表位, 并可被特定的人 t 细胞识别。hbv 和 hcc 清除依赖于人 t 细胞的反应26, 但 hcc 患者往往患有 t 细胞衰竭和减少 t细胞反应27。将 hbv 特异性 tcr 引入乙肝病毒 t 细胞已被尝试作为消除慢性乙肝病毒感染的潜在免疫治疗策略28。然而, 尚不清楚这种方法在临床环境中是否有效, 因为人类肝细胞29中的表面 mhc-i 水平较低。因此, 了解同角病的机制可以为乙肝病毒的免疫治疗提供替代的视角, 可能通过增强内源性 pmhc 的表达来诱导共视体介导的 t 细胞反应。该协议涵盖了研究人共激动症的所有必要步骤: t-rex cho 细胞与激动剂和共激动剂 pmhc 转染、生成稳定的 t-rex cho 细胞株、hbvva 特定人类 ctl ct8 + t 细胞株的培养和 ctl 激活实验量化细胞因子的产生和脱粒反应 t-rex cho 细胞。虽然我们专注于使用 sc mhc i 类技术来研究 hbv t 细胞激活过程中的共对抗, 但必须指出的是, 所提出的方法可以很容易地适应于已知的 pMHC-I 的人 t 细胞激活的其他方面的研究特 异性。
该协议使用 hla-a2 上介绍的 hla-a2 上介绍的 hlv 衍生肽 e183-91 (fllrilti: "e183")30的人类 cd8 + ctl 线。sc hla 分子由来自人β2-微球蛋白的信号序列、感兴趣的 hla-a2 结合肽、甘氨酸酶链剂、人β-2-微球蛋白、甘氨酸衬里链接剂和 a2 重链组成, 可进行商业合成 (图 1 a)).作者可根据要求提供编码 sca2 结构的激动剂 e183 肽或异源 hiv gag (slyntvatl)31肽。多肽序列可以通过位点定向诱变改变。用四环素诱导载体 pcDNA5/TO 用 e183 肽 (sc e183-hla-a2) 表达了激动剂单链 hla-a2。在四环素抑制剂的存在下, pcDNA5/TO 到质粒只允许很低的、"漏水" 表达的蛋白质感兴趣;四环素的加入可以诱导高表达 (图 1b, c)。使用四联素诱导表达系统可以控制细胞表面激动剂 pmhc 表达的量。用 gag 肽 (sc gag-hla-a2) 表达辅酶的表达质粒 pcdna3.1。四环素调控表达 (t-rex) cho 细胞系 (仓鼠细胞系, 没有内源性人 mhc) 被用来表达激动剂和共效剂 sca-hla-a2 结构。该实验系统允许精确控制 pmhc 演示 (图 1c): 无 pmhc 演示 (未转染 t-rex), 大量的共激动剂 pmhc 演示 (本构 sc gag-hla-a2 表达式), 少量的激动剂 pmhc介绍 (sc e183-hla-a2 在没有四环素的情况下), 大量的激动剂 pmhc 表达 (sc e183-hla-a2 在四环素的存在下), 少量的激动剂 pmhc 表达和高表达的共效剂 pmhc (sc e183 hla-a2)。四环素的缺失, 和本构 sc gag-hla-a2 表达)。使用该实验系统可以精确控制细胞表面的激动剂和辅剂 pmhc 量。
研究方案
请注意:所有涉及使用活的、非固定的细胞的步骤都应在生物安全的情况下进行, 任何生物危险废物都应根据当地的卫生和安全条例加以丢弃。
1. cho 细胞转染与稳定 cho 细胞系的生成
-
cho 细胞转染
注:本节介绍使用聚乙二醇酰胺 (pei) 进行 cho 细胞转染。然而, 可以使用替代方法, 因为 cho 细胞相对容易通过市售的脂质转染试剂进行转染。- 培养完整的 f12 (f12, f12 加 5% fbs, 100 uml 青霉素, 100μgml 链霉素和 10μgml blbl曲西定, 以保持四环素抑制剂的表达)。每3-4天以1:10 的比例通过一次细胞。
- 转染前一天, 准备 cho 细胞悬浮液。使用 pbs 清洗烧瓶中的 cho 细胞 (t75 烧瓶为 pbs 为 10 ml, t25 瓶为 5 ml pbs)。在 pbs 中加入 0.05% Trypsin/0.02 edta (t75 烧瓶为2毫升, t25 烧瓶为 1 ml), 在室温下孵育 5-10 (rt)。使用光学显微镜, 检查细胞是否已分离, 并通过在烧瓶中添加 cf12 来停止胰蛋白酶化 (t75 烧瓶为8毫升, t25 烧瓶为4毫升)。
- 将 cho 细胞悬浮液转移到15毫升管中, 离心机在4°c 或 rt 下以 300-400 x g 为 5分钟, 在4°c 或 rt下取出上清液, 在 cf12 中重新悬浮 (t75 烧瓶10毫升, t25 烧瓶5毫升), 并使用血细胞计计数。
- 将细胞浓度调整为 60000-100000 cho cellsl。在6井板中, 每口井加入5毫升 cho 细胞悬浮液 (30000-500000 cho 细胞)。在 37°c, 5% co2下过夜。
- 在转染当天, 在 1.5 ml 管中加入400μl 无血清 f12 培养基或低血清培养基。在400μl 介质中加入3微克质粒。通过移液混合。在 media/DNA 混合物中加入 6μg (6μl 的 1 mgml pei 溶液), 并立即产生10。
- 在 rt 中培养媒体 dname/peei 混合物10-15。在此孵育过程中, 用5毫升新鲜的 cf12 培养基取代6孔板中的 cho 细胞培养基。
- 在 cho 细胞中加入 media/dnama/pei 溶液。在井上滴、均匀地添加溶液。在 37°c, 5% co2下过夜。
-
稳定的 cho 细胞系的生成
- 转染一天后, 从井中取出介质, 在每口井中添加含有适当选择抗生素的5毫升的 cf12。使用 0.3 mgml hygromycin 治疗 pcdna 5to 基质粒, 用 1 mg/ml 基因素治疗 pcdna 3 基质粒。
- 如果细胞在转染后24小时内达到90% 以上的融合, 则对细胞进行胰蛋白酶化。
- 用每口井1毫升的 pbs 清洗井, 在 pbs 中加入1毫升 0.02% edta, 在 rt 孵育 5-10, 用光学显微镜检查细胞是否分离, 并通过每口井添加3-4 毫升的 cf12 来阻止胰蛋白酶。
- 将 cho 细胞悬浮液转移到15毫升管中, 离心机在4°c 或 rt 下以 300-400 x克g 的速度进行 5分钟, 取出上清液, 在 cf12 的10毫升中重新悬浮。在6井板中加入每口井5毫升的细胞悬浮液。使用两口井, 以最大限度地提高转染细胞的产量。
- 在 37°c 5% co 2 下培育6个井板.用光学显微镜监测细胞死亡和耐药菌落的生长。在4-5 后, 或在观察到明显的细胞死亡时, 取出培养基并将其替换为含有适当抗生素的新鲜培养基。
- 一旦耐药细胞达到70% 以上的融合, 就按照步骤1.2.2 中所述, 对细胞进行胰蛋白酶化, 并转移到 t25 烧瓶进行扩张。抗生素选择需要1-2周。
- 一旦 t25 瓶中的抗生素耐药 cho 细胞达到70-80% 的融合, 进行抗体染色, 以验证细胞表面表达的结构感兴趣的。抗体染色前一天, 如步骤1.2.2 所述, 对细胞进行胰蛋白酶化处理, 将细胞浓度调整为 200, 000 细胞, 并在12孔板中加入1毫升的细胞悬浮液。为检测四环素诱导结构, 加入 50-60 ng\ l 四环素。在 37°c, 5% co2下过夜。
- 使用细胞刮刀将 cho 细胞从井底分离。这种方法比胰蛋白酶更可取, 因为它降低了由于蛋白溶解裂解而造成表位损伤的风险。
- 将含有 cho 细胞的1毫升介质转移到流式细胞仪管中。在 300-400 x克,4°c 下旋 5分钟, 在 fwb 稀释的100μl 抗 hla 抗体中重新悬浮。在4°c 的冰上孵化30分钟。用抗 a2 抗体进行染色, 检测总 a2 细胞表面表达水平, 并检测与 e183 肽复合物中 a2 的 tcr 样抗体, 以检测激动剂 pMHC-I 细胞表面表达水平。
- 在验证 mhc 表达后, facs 对阳性细胞进行排序, 并在培养基中使用抗生素维持已分类的细胞, 以减少转基因丢失。对于表达激动剂 pmhc 的 cho 细胞, 建议单细胞分选, 以确保类似的激动剂 pmhc 表达, 并与共激动剂 pmhc 进行超转染。单细胞分类后, cho 细胞生长需要2-3周。
2. hbv 特有的 ctl 培养
-
制备 pbmc 作为 hbv 特异性人 ctl 再刺激的饲料
注:对于 a2-e183 特定的 ctl 克隆, 使用新隔离的 pbmc 重新刺激, 而不是解冻的 pbmc, 可提供最佳效果。
注意事项:在招募献血志愿者之前, 获得所有必要的道德认证。为了这项工作的目的, 根据 nus irb 批准的协议, 从健康志愿者那里收集了 pbmc。获得了所有捐助方的知情同意。在使用人类血液时, 请遵循所有必要的预防措施, 以降低血液传播疾病的风险。- 开始之前, 将离心机温度设置为 19-20, 并将密度梯度 (例如, 菲卡尔) 预热至 rt。
- 在50毫升管中加入15毫升的室温密度梯度。在19-20 下, 以 400 x g 离心5分钟。这是为了确保管的一侧没有密度梯度。
- 通过静脉穿刺从一个健康的志愿者捐献者那里收集20毫升的血液。在50毫升管中加入15毫升的 pbs 到20毫升的血液中。通过上下移液混合。
- 慢慢地, 在2.1.2 的15毫升密度梯度的顶部加入在 pbs 中稀释的35毫升血液。确保血液和密度梯度不混合。在19°c 下离心管, 在刹车关闭的情况下, 在20分钟内离心管。
- 去除约70% 的等离子体层。使用巴斯德移液器小心地吸气包含 pbmc (透明密度梯度层顶部的多云层) 的层, 并将其放置在新的 50 ml 管中。
- 将 pbs 添加到 pbmc 中, 以获得50毫升的总体积。在4°c、300-400 x g 的温度下离心管 10分钟, 使用真空吸尘器和无菌玻璃巴斯德移液器或通过脱脂等方法小心地取出上清液。
- 在 pbs 50 毫升中重新悬浮细胞。在4°c、300 x g 的温度下离心管 10分钟, 使用真空吸尘器和无菌玻璃巴斯德移液器或通过脱脂等方法小心地取出上清液。
- 在2毫升的完整的人 t 细胞培养基中重新悬浮细胞 (无血清培养基补充2% 的人血清)。使用血细胞仪计数细胞。该协议平均每使用1毫升血液 1-2 x 10 6 pbmc。
-
以 pbmc 为供体细胞的 ctl 再刺激
- 在 30 gy 时辐照 pbmc, 以抑制增殖, 以应对随后的刺激。
注意: 使用散热器时, 确保充分的培训并符合实验室安全要求。 - 在 2 x 10 6 细胞中重新悬浮整个人体 t 细胞培养基中的辐照 pbmc. 加入细胞因子和黄曲霉 (pha)凝集素, 在2倍浓度下再刺激 ctl 进入 pbmc 悬浮液。最终的细胞因子和 pha 浓度为:20 uml 重组人 il-2、10 ngml 重组人 il-7、10 ngml 重组人 il-15 和 1.5 mg/ml pha。
- 在37°c 的水浴中解冻冷冻 ctl 小瓶。将解冻的细胞转移到一个15毫升管中, 其中含有10毫升的完整的人 t 细胞培养基。在4°c 下, 在 300-400 x克的温度下旋转 5分钟, 请使用真空吸尘器和无菌玻璃巴斯德移液器或通过脱脂方式取出上清液。
- 在完整的人 t 细胞介质中重新悬浮 ctl。使用血细胞仪计数细胞。加入完整的人 t 细胞培养基, 获得 106 细胞浓度。
- 在24孔板中, 加入 0.5 ml 的辐照 pmc (10个6个细胞), 每口井有2倍细胞因子和 pha (步骤 2.2.2), 每口井添加 0.5 ml ctl (0.5 x10个6个细胞)。使用的井数取决于可用的 ctl 或 pbmc 的总数。在37°c 下培养, 5% co2。
- 4-5 后, 当 ctl 爆炸可见, 介质变黄, 将培养物转移到6个井板中, 并用 20 u/ml il-2、10 ngml il-7 和 10 ngml il-15 (无 pha) 用 4 ml 完整的人 t 细胞介质补充初始 1 ml 体积。
- 2-3天后, 将培养物转移到 t75 烧瓶中, 添加40毫升的完整的人 t 细胞培养基, 具有细胞因子 (步骤 2.2.2, 无 pha), 并在直立的位置培养。
- 将 ctl 保持在 1-2 x 10 6 cells/mL 的浓度, 方法是在每隔一天的体积上添加新鲜的培养基 (步骤 2.2.2, 无 pha)。ctl 可用于重新刺激后7-14 的实验。
- 在 30 gy 时辐照 pbmc, 以抑制增殖, 以应对随后的刺激。
3. t 细胞活化实验
请注意:一个典型的实验需要几个不同的 t-rexcho 线: 未转染的 t-rex cho 细胞 (负对照), t-rex cho 细胞仅表示非刺激 pmhc (sca2-gag; 阴性对照), t-rex cho 细胞表达少量的促性腺激素 pmhc-i (没有四环素的 sca2-env, 实验样本)、t-rex cho 细胞表达少量的激动剂 pmhc 和大量的非刺激联合激动剂 pmhc (sca2-env 和 sca2-gag, 不含四环素, 实验样品) 和 t-rex cho 细胞表达大量的激动剂 pMHC-I sca2-env 与四环素, 阳性控制), 如图 1c, d所示。
-
将 cho 细胞作为抗原表达细胞的电镀
- 培养 t75 烧瓶中的 cho 细胞, 如步骤1.1.1 中所述。使用细胞在70-90% 汇合, 以获得最佳效果。在 t 细胞激活实验的前一天, 对细胞进行胰蛋白酶化, 如1.1.2 部分所述。胰蛋白酶化后, 将细胞悬浮液转移到15毫升管中, 在4°c 或 rt 下, 以 400 x g的离心机 5分钟, 通过移液或脱脂去除上清液。
- 在 cf12 的5毫升中重新悬浮细胞颗粒。使用血细胞仪计数 cho 细胞。
- 使用 cf12 将细胞浓度调整到 2x 10 5/ml.在仅在激动剂样品中加入 50-60 ng\ ml, 诱导大量激动剂 pMHC-I 表达为阳性对照 (图 1c)。cho 细胞将在15毫升管中沉淀, 因此在电镀前一定要通过移液或涡流混合。
- 对于 t 细胞活化试验, 在 u-底部96井板上加入100μl 的 cho 细胞悬浮液, 并在每个 cho 细胞系中使用三重奏。对于 cho 细胞抗 mhc 染色, 在12孔板中加入1毫升细胞悬浮液, 并在每个细胞系中使用三重奏。在 37°c, 5% co2下过夜。
-
t 细胞活化试验
注:这种 t 细胞活化方法允许同时定量 t 细胞脱粒 (cd107a 染色, t 细胞毒性的测量) 和细胞因子的产生。- 实验前一天, 在4°c 时, 在400xg 的离心机 ctl 细胞中进行5分钟的计数, 使用血细胞计计数, 并在没有细胞因子或 pha 的完整的 t 细胞培养基中的 10 6 细胞中重新悬浮细胞。在37°c 下培养, 5% co2。此其余步骤的目的是降低 ctl 灵敏度, 因为我们观察到最大激活响应低数量的抗原, 而无需此步骤。
- 实验当天, 在4°c 下, 在 400 x g的离心 t 细胞中, 5分钟, 通过脱脂或移液去除上清液, 并在2毫升完整无血清介质中重新悬浮细胞 (不含细胞因子或 pha)。使用血细胞仪计数活 t 细胞, 并使用完整的人 t 细胞培养基 (不含细胞因子或 pha) 将 t 细胞浓度调整为 106 活细胞。
- 在1:100 稀释 (最终浓度为 2.5μg/ml) 时加入抗人类 cd107a 抗体, 在1:100 稀释 (最终浓度为 1μg/ml) 时加入 brefeldin a。
- 通过玻璃巴斯德移液器吸气或滑动板, 从96井板的 cho 细胞中取出介质。每口井, 加入含有抗 cd107a 和 brefeldin a. 与 cho 细胞共培养3-4小时的 t 细胞的 t 细胞 200μl (0.2 x 10 6 细胞)。
- 在共培养结束时, 进行 t 细胞表面抗原染色。在 300-400 x g下拉96井板, 在4°c 下 5分钟, 通过吸气或闪烁去除上清液。在 pbs (流洗液缓冲液, fwb) 中, 每口在 pbs (流洗液缓冲液, fwb) 中, 每口添加2.5μl 的 cd3 和 2.5μl cd8 抗体, 用于细胞表面抗原染色。在黑暗中在冰上加层30分钟。
- 每口加入150μl 的 fwb 来清洗样品。在 300-400 x g下拉96井板, 在4°c 下 5分钟, 通过吸气或闪烁去除上清液。
- 使用固定/渗透装置执行固定/渗透步骤。每口加入100μl 的固定-渗透性溶液 (从固定/渗透剂), 通过移液混合。在冰上孵化20分钟。
- 在 300-400 x克和4°c 离心 5分钟, 并通过吸气或闪烁去除上清液。在每口井中加入200μl 的 1x perm·dhk 清洗缓冲液 (在使用前稀释试剂盒中的 10倍 perm·huthask 缓冲液)。重复此步骤。
- 在含有抗 ifn-γ抗体的液位为50μl 的1μl 中重新悬浮细胞颗粒。在黑暗中在冰上孵化30分钟。
- 加入150μl 的 1x perm/洗净缓冲液。在4°c 下以 300-400 x克离心 5分钟, 并通过吸气或闪烁去除上清液。加入200μl 的 1x perm/dhk 缓冲液, 离心机在4°c 下使用 300-400 x g 5分钟, 并通过吸气或闪烁去除上清液。
- 在200μl 的 fwb 中重新悬浮每个样品。继续进行流式细胞仪分析。
-
cho 细胞 mhc 类 i 染色
注:在每个实验中使用的细胞上验证 scMHC-I 细胞表面水平是至关重要的, 因为细胞系可能会失去转基因表达。在制备96孔板用于 t 细胞刺激时, 设置12个井板进行 cho 细胞染色, 如3.1.4 节所述。- 使用细胞刮刀将 cho 细胞从井底分离。这种方法比胰蛋白酶更可取, 因为它降低了由于蛋白溶解裂解而造成表位损伤的风险。
- 将含有 cho 细胞的1毫升培养基转移到流式细胞仪管中。在 300-400 x克的4°c 下旋转 5分钟, 在 fwb 稀释的100μl 抗 hla 抗体中重新悬浮。在4°c 的冰上孵化30分钟。
- 用抗 a2 抗体进行染色, 检测 a2 细胞表面总表达水平, 并与 e183 肽32复合物中的 a2 特异性 tcr 抗体检测激动剂 pMHC-I 细胞表面表达水平。
- 在每个 cho 样品中添加1毫升的 fwb, 在 300-400 x克、4°c、5分钟的温度下旋转, 然后在 fwb 0.3 毫升的情况下重新悬浮样品。进行流式细胞术分析。
结果
这里使用的 sc mhc i 类技术可以精确控制 mhc i 类的细胞表面表达与已知的、共价的相关肽, 从而诱导 t 细胞激活。我们已经生成了一个设计的异种 apc 系统 (图 1a-b. c), 允许在存在或不存在共激动剂 pmhc (图 1d·e) 的情况下呈现低水平的激动剂 pmhc。关键的是, 我们使用了一种针对 hla-a2 的 tcrs 样抗体, 该抗体呈现 e183 肽, 表明激动剂 sc e183-hla-a2 的表达不会因共同激动剂 gag-hla-a2 (图 1e) 的共同表达而改变。然而, 必须指出的是, e183-hla-a2 类特异性抗体显示出一定的与 hla-a2 的结合, 呈现 gag 肽 (图 1e)。类似的工程抗原呈现细胞系统可以使用不同的肽或 mhc 分子来研究不同特性的人 t 细胞中 tcr 和/或受体相互作用的分子要求。
我们使用这些工程 apc 来刺激 e183-hla-a2 特定的人类 cd8 + t 细胞克隆。使用了三个阴性对照: 仅 t 细胞, 未转染 t-rex cho 细胞, t-rex cho 细胞表达大量的共激动剂 sgag-hla-a2, 以测试在 t-rex cho 细胞 (未转染 t-rex cho 细胞) 上表达的任何分子的潜在 t 细胞活化细胞与 t 细胞相比), 并通过 sc-gag-hla-a2 (t-rex cho 细胞, 与未转染的 t-rex cho 细胞相比, 表达高水平的 sc-gag-hla-a2) 激活 t 细胞。未转染的 t-rex cho 细胞或表达 sc-gag-hla-a2 的 t-rex cho 细胞没有诱导 e183-hla-a2 特异性 cd8 + ctl 克隆的活化, 这是通过量化 ifn-γ的产生和脱粒标记 cd107a 的表达作为 t 细胞的测量结果确定的细胞毒性 (图 2a, b)。作为正控制的高水平激动剂 e183-hla-a2 的表达, 诱导非常有效的 ifn-γ生产和脱粒 (图 2a, b), 表明 sc hla-a2 结构可以通过特定的 tcr 识别来激活t 单元执行器功能。低浓度的 e183-hla-a2 的表达导致 ifn-γ的生产和脱粒水平较低, 而这是由共同激动剂 sgag-hla-a2 的存在 (图 2a, b) 增强的。必须指出的是, 即使是在抗原 pmhc (图 2b) 水平较低的情况下, cd107a+ t 细胞的比例也非常高, 这与此前关于诱导 t 细胞的激动剂 pmhc 数量要求相对较低的报告是一致的。细胞毒性33。cd107a mfi 指示单个单元的脱粒量, 提供了更好的动态范围 (图 2b)。所使用的 t 细胞活化分析允许同时量化两个主要的效应函数: 细胞因子的产生和细胞毒性, 并提供非常敏感的读数与良好的动态范围。
我们使用单链技术来测试是否需要 tcr 结合到共激动剂 pmhc 的聚酶 (pmhc) 相关激活增强。我们在 hla-a2 肽结合槽边缘的152号位置突变了 valine, 形成谷氨酸,产生 v152e 突变体, 因为据报道, 这种突变废除了 tcr 结合 hla-a2 34.然后, 我们测试 v152e 突变是否可以废除 tcr 结合 e183-hla-a2 ctl 克隆使用, 通过引入这种突变到激动剂 sc e183-hla-a2, 并表达突变激动剂 c 结构在 t-rex cho 细胞。野生类型, 但不是 v152e, sc e183-hla-a2 诱导激活 e183-hla-a2 特异性 ctl 克隆使用 (图 3 a)。必须注意的是, mhc i 类上的任何 tcr 结合突变都需要针对所使用的每个 tcr/t 细胞克隆分别进行测试, 因为突变的影响将取决于 tcr 和 pmhc 复合物之间的精确分子相互作用, 而这些突变在不同的 tcr。例如, 我们测试了8个突变, 或者之前报告的 tcr 结合突变或突变预测会破坏 tcr 结合而不会废除肽结合到 TCR-binding。其中, v152e 是唯一的突变, 废除激活 e183 特异性 t 细胞克隆使用 10.然后, 我们将 v152e 突变引入共济会 sgag-hla-a2, 并以较低的激动剂 e183-hla-a2 共同表达 wt 或 v152e sc gag-hla-a2。wt 和 v152e sc gag-hla-a2 增强了 ifn-γ的生产和脱粒 (图 3c, d), 这表明不需要 tcr 结合共致推进剂 pmhc 相关 cd8 + t 细胞的活化。本文介绍的单链 mhc i 类技术可用于修改 tcr 和/或受体结合 mhc i 类已知肽, 以研究 t 细胞抗原识别和活化的分子要求。

图 1: 用于研究人类 cd8+ t 细胞激活中的共激动剂的单链 hla-a2 结构.(a) schla-a2 结构示意图, 包括融合的人β2微球蛋白的共价信号序列、所选择的肽、柔性甘氨酸丝氨酸链接器 (ggggggggs gggs ggg)、人β2微球蛋白、柔性甘氨酸链接器和 hla-a2 重链。(b) 用于生成工程抗原呈现细胞的质粒示意图, 用于研究人 cd8 + t 细胞活化中的共反应性: 四环素抑制剂, 在四环素诱导启动子的控制下,非刺激共激动剂 gag-hla-a2 在本组织活性促进剂的控制下。(c) 用于研究共同反应的工程抗原呈现细胞示意图: t-rex cho 细胞 (无人 mhc 表达)、表达本构高水平 sc gag-hla-a2 (非刺激共激动剂 pmhc) 的 t-rex cho 细胞,t-rex cho 细胞在没有四环素 (低浓度激动剂肽) 的情况下, 表达低 "泄漏" 水平的 sc e183-hla-a2, t-rex cho 细胞在四环素 (高水平的激动剂肽)、t-rex cho 细胞的存在下表达高水平的 sc e183-hla-a2表达低水平的 e183-hla-a2 和高水平的 gag-hla-a2 (低浓度的激动剂肽和高水平的共同激动剂肽)。(d) 使用抗 hla-a2 抗体对工程抗原显示细胞系进行细胞表面染色。所示数字表示活细胞门中 mhc 染色的 mfi 值。5个独立实验 (e) 细胞表面染色的工程抗原呈现细胞系的数据代表使用 tcrl 样抗体特定的 hla-a2 呈现 e183 肽。所示数字表示活细胞门中 mhc 染色的 mfi 值。5个独立实验的数据代表。请点击这里查看此图的较大版本.

图 2: e183-hla-a2 特异性人类 cd8 + ctl 克隆的共用促的 pmhc 增强细胞因子的产生和脱粒.(a) hla-a2 特异性人类 cd8 + ctl 克隆的细胞内 ifn-γ染色, 用指定的工程抗原呈现细胞进行3h 刺激。所显示的数字表示 ifn-γ染色的阳性百分比。数据代表3个独立的实验, 每个实验都有技术三重奏。(b) hla-a2 特异性人 cd8 + ctl 克隆的细胞表面 cd107a 染色, 用指定的工程抗原呈现细胞进行3h 刺激。所显示的数字表示 cd107a 染色或 cd107a mfi 在 cd8 + t 细胞群中的阳性百分比。数据代表3个独立的实验, 每个实验都有技术三重奏。请点击这里查看此图的较大版本.
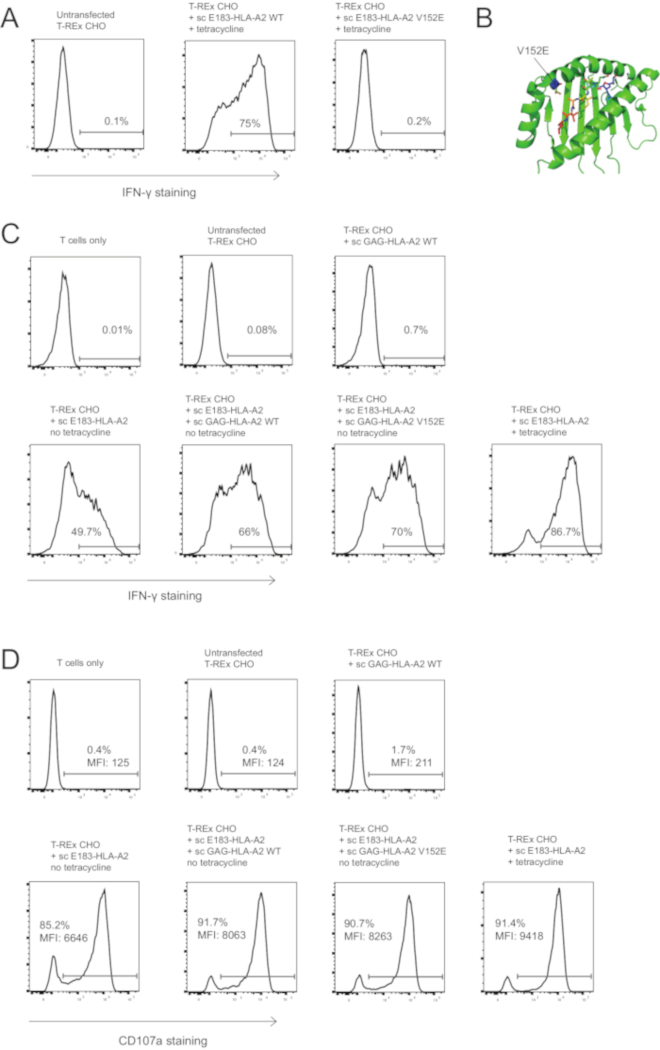
图 3: 共激动剂-介导的 t 细胞活化增强不需要 tcr 结合到共激动剂 pmhc 复合物.(a) sc e183-hla-a2 中的 v152e 突变消除了 e183-hla-a2 特异性人类 cd8 + ctl 克隆的激活。t-rex cho 细胞表达 wt 或 v152e 突变体 sc e183-hla-a2 水平较高 (四环素诱导), 用于刺激 e183-hla-a2 特异性人类 cd8 + ctl 克隆3小时。t 细胞活化是用细胞内 ifn-γ染色进行量化的。所显示的数字表示 ifn-γ染色的阳性百分比。数据代表3个独立的实验, 每个实验都有技术三重奏。(b) v152e 突变在 hla-a2 肽结合槽内的位置。(c) v152e 突变对 sc gag-hla-a2 共效剂 pmhc 复合物不废除同体激动剂依赖性活化增强。hla-a2 特异性人 cd8 + ctl 克隆在4h 刺激下, 用指定的工程抗原呈现细胞进行细胞内 ifn-γ染色。所显示的数字表示 ifn-γ染色的阳性百分比。数据代表3个独立的实验, 每个实验都有技术三重奏。(d) v152e 突变对 sc gag-hla-a2 共效剂 pmhc 复合物不废除同体激动剂依赖性活化增强。用指示的工程抗原呈现细胞3h 刺激 hla-a2 特异性人 cd8 + ctl 克隆后的细胞表面 cd107a 染色。所显示的数字表示 cd107a 染色或 cd107a mfi 在 cd8 + t 细胞群中的阳性百分比。数据代表3个独立的实验, 每个实验都有技术三重奏。请点击这里查看此图的较大版本.
讨论
该协议为研究人类 cd8+ t 细胞活化过程中的分子相互作用提供了一个可靠的工具。研究人 t 细胞活化过程中共激动的一个关键步骤是控制激动剂 pmhc 细胞表面表达, 以确保在有或不具有共激动剂 pmhc 表达的 apc 上的相同激动剂 pmhc 表达。在我们的实验系统中, 这是通过使用表达少量激动剂 pmhc 的单个细胞克隆来实现的, 然后是用共激动剂 pmhc 结构进行超输, 用 tcr 样抗体10进行激动剂 pmhc 定量,32. 由于激动剂 sc pmhc 表达会随着时间的推移而变化, 因此使用 tcr 样抗体量化每个实验中使用的 apc 上的激动剂 pmhc 表面表达至关重要。如果没有特定的 tcr 样抗体, 激动剂 scMHC-I 可以表示为荧光蛋白融合, 然后它的细胞表面表达可以用敏感的显微镜方法, 如总内部反射荧光显微镜进行量化35,36. 此外, 由于 cmv 启动子37的甲基依赖和独立沉默, 共激动剂 pmhc 的细胞表面表达会随着时间的推移而减少, 应使用抗体染色和流式细胞仪分析进行监测,在需要时重复进行 fas 排序。我们已经培养 cho 细胞长达 5周, sc pmhc 表达的损失相对有限。我们强烈建议在选择/分类后立即冻结 cho 细胞, 以确保已知的 sc mhc 表达的细胞的可靠库存。
所提出的协议的几个步骤可以修改, 这取决于设备的可用性, 也可以根据具体的研究目的进行修改。例如, 使用不需要伽玛 (或 x-) 辐照器的替代方法, 例如使用丝裂霉素 c38 治疗, 可以抑制 pbmc的增殖潜力 (步骤 3.2.1)。含有金属螯合剂39的非酶细胞分离缓冲液可以用来代替在3.3.1 的步骤中刮细胞。此外, 抗原呈现系统可以进行修改, 使其更适合表达不同 tcr 的人类 ctl 克隆. cho 细胞表达仓鼠 mhc i 类分子, 尽管这些与这里研究的 ctl 线无关 (图 2a和图 3a, 我们没有观察到 t 细胞对未转染的 cho 细胞的反应), 有可能是其他人类的 tcr 可能表现出一定的 x 反应性。在这种情况下, 仓鼠 mhc 一级表达可以通过敲出仓鼠β-2-微胶蛋白或 tap 使用 crispr/cas9 可以减少;或人类 apc 线可以使用后, crisprs9 介导β-微球蛋白或 tap 击倒。
这里介绍的实验系统可以精确控制 tcr 和 cd8 与 mhc 分子的相互作用, 这些分子呈现预定的肽。例如, 我们以前已经证明, 废除 cd8 结合 40到辅剂 pmhc 的突变消除了小鼠和人类 cd8 + t 细胞9,10的 coagonist 介导的激活增强, 而废除了 tcr与共激动剂 pmhc 的相互作用对共激动剂介导的激活增强10没有影响.然而, 使用单链 mhc 结构有几个限制。例如, 使用此实验系统测试多个共同激动剂肽序列是耗时和耗时的, 因为这涉及到产生具有不同肽的多个质粒编码 sc mhc, 以及随后的转染和细胞分选。以前, 我们使用小鼠 tap 缺乏细胞系 rma-s 来测试小鼠 t 细胞活化8,9中的多种共激动剂肽, 但这种方法在缺乏 tap 的人 t2 细胞系10中并不成功, 很有可能由于 tap 独立肽41的显示。我们实验系统的另一个局限性是, 不提供一个快速的方法来改变共激动剂 pmhc 分子的数量, 以确定触发 t 细胞活化所需的共激动剂 pmhc 的临界量。此外, 所使用的四环素诱导系统不允许通过改变四环素浓度在单个细胞水平上滴定激动剂 pmhc 量, 因为变化的四环素浓度改变了 hla-a2 阳性细胞的比例,而不是每个细胞的 hla-a2 水平。我们目前正在研究的另一种方法是使用支持脂质双层 42, 以前用于研究在小鼠 cd4+ t 细胞活化4或珠子提出固定数量的激动剂 pmhc存在不同数量的共激动剂 pmhc。当与 uv 裂解肽技术4,43一起使用时, 这些替代实验系统应允许快速测试多个共同激动剂肽序列以及不同数量的共同激动剂 pmhc.
mhc 技术也可用于研究人类或小鼠 cd4 t 细胞中的共激动性, 因为呈现预先确定肽的单链 mhc ii 类分子已在哺乳动物细胞表面44上成功表达。此外, sc mhc 技术的应用可以推广到 hla-e 等非经典 mhc 分子的研究。sc hla-e 已经被描述过, 其表达已被证明可以抑制人 t 细胞的激活45。另一个非经典的 mhc 分子感兴趣的是 cd1, 它呈现脂质而不是多肽46。由 cd1 重链和β2-微球蛋白组成的 sc 结构已被证明在细胞表面表达, 并结合相关的脂质 47。单链 mhc 技术作为研究 t 细胞和 nk 细胞活化过程中分子相互作用的研究工具具有巨大的潜力。
披露声明
提交人声明没有相互竞争的利益。
致谢
这项研究得到了新加坡卫生部国家医学研究委员会的支持, 该委员会的 cbrg额004年至 n. r. j. g., 由 create 在其 R571-002-012-592 到下午 a. m. 下, 国家研究基金会调查人员 r571-000-272-281 至下午晚些时候至下午晚些时候. 并由新加坡翻译研究调查员奖 (nmrc/star13 2012) 颁发给 a. b.。我们感谢 paul hutchinson 博士和 teo guo hui 先生, 他们来自 nus 免疫学项目流核心设施, 用于专家细胞分类。我们感谢陈伊利亚·尼以雅对手稿的批判性解读。
材料
| Name | Company | Catalog Number | Comments |
| Aim-V (serum free media) | Gibco | 12055091 | |
| Blasticidin | Gibco | R21001 | |
| Cytofix/Cytoperm (fixation/permealibisation kit) | BD | 554714 | |
| F12 | Gibco | 10565-018 | |
| Fetal bovine serum (FBS) | HyClone | SH3007103 | |
| Geneticin | Gibco | 10131035 | |
| GolgiPlug (Brefeldin A) | BD | 555029 | |
| Human serum | Sigma-Aldrich | H4522 | |
| Hygromycin | Gibco | 10687010 | |
| Lectin from Phaseolus vulgaris (PHA) | Sigma-Aldrich | L4144 | |
| Opti-MEM (low serum media) | Bibco | 31985070 | |
| 10x PBS | Vivantis | PB0344 – 1L | |
| Penicillin/Streptomycin | HyClone | SV30010 | |
| Polyethylenimine (PEI) | Sigma-Aldrich | 408727 | |
| Recombinant human IL2 | R&D Systems | 202-IL | |
| Recombinant human IL7 | R&D Systems | 207-IL | |
| Recombinant human IL15 | R&D Systems | 247-ILB | |
| Tetracycline | Sigma-Aldrich | T7660 | |
| T-REx CHO cell line | Thermo Fisher Scientific | R71807 | |
| 10 x Trypsin/EDTA | Gibco | 15400054 | |
| Antibodies | |||
| CD3 | BD | 347347 | Clone SK7, RRID:AB_400287 |
| CD8α | BD | 563795 | Clone RPA-T8, RRID:AB_2722501 |
| CD107a | BD | 566261 | Clone H4A3, RRID:AB_2739639 |
| HLA-A2 | eBioscience | 17-9876-41 | Clone BB7.2, RRID:AB_11151522 |
| IFN-γ | eBioscience | 12-7319-41 | Clone 4S.B3, RRID:AB_1311250 |
参考文献
- Gascoigne, N. R. Do T cells need endogenous peptides for activation?. Nature Reviews. Immunology. 8 (11), 895-900 (2008).
- Gascoigne, N. R., Zal, T., Yachi, P. P., Hoerter, J. A. Co-receptors and recognition of self at the immunological synapse. Current Topics in Microbiology and Immunology. 340, 171-189 (2010).
- Krogsgaard, M., Juang, J., Davis, M. M. A role for "self" in T-cell activation. Seminars in Immunology. 19 (4), 236-244 (2007).
- Krogsgaard, M., et al. Agonist/endogenous peptide-MHC heterodimers drive T cell activation and sensitivity. Nature. 434 (7030), 238-243 (2005).
- Ebert, P. J., Jiang, S., Xie, J., Li, Q. J., Davis, M. M. An endogenous positively selecting peptide enhances mature T cell responses and becomes an autoantigen in the absence of microRNA miR-181a. Nature Immunology. 10 (11), 1162-1169 (2009).
- Lo, W. L., et al. An endogenous peptide positively selects and augments the activation and survival of peripheral CD4+ T cells. Nature Immunology. 10 (11), 1155-1161 (2009).
- Yachi, P. P., Ampudia, J., Gascoigne, N. R., Zal, T. Nonstimulatory peptides contribute to antigen-induced CD8-T cell receptor interaction at the immunological synapse. Nature Immunology. 6 (8), 785-792 (2005).
- Yachi, P. P., Lotz, C., Ampudia, J., Gascoigne, N. R. T cell activation enhancement by endogenous pMHC acts for both weak and strong agonists but varies with differentiation state. The Journal of Experimental Medicine. 204 (11), 2747-2757 (2007).
- Hoerter, J. A., et al. Coreceptor affinity for MHC defines peptide specificity requirements for TCR interaction with coagonist peptide-MHC. The Journal of Experimental Medicine. 210 (9), 1807-1821 (2013).
- Zhao, X., et al. Nonstimulatory peptide-MHC enhances human T-cell antigen-specific responses by amplifying proximal TCR signaling. Nature Communications. 9 (1), 2716 (2018).
- Juang, J., et al. Peptide-MHC heterodimers show that thymic positive selection requires a more restricted set of self-peptides than negative selection. The Journal of Experimental Medicine. 207 (6), 1223-1234 (2010).
- Anikeeva, N., et al. Quantum dot/peptide-MHC biosensors reveal strong CD8-dependent cooperation between self and viral antigens that augment the T cell response. Proceedings of the National Academy of Sciences of the United States of America. 103 (45), 16846-16851 (2006).
- Anikeeva, N., Gakamsky, D., Scholler, J., Sykulev, Y. Evidence that the density of self peptide-MHC ligands regulates T-cell receptor signaling. PloS One. 7 (8), e41466 (2012).
- Schuren, A. B., Costa, A. I., Wiertz, E. J. Recent advances in viral evasion of the MHC Class I processing pathway. Current Opinion in Immunology. 40, 43-50 (2016).
- Bubenik, J. MHC class I down regulation, tumour escape from immune surveillance and design of therapeutic strategies. Folia Biologica. 51 (1), 1-2 (2005).
- Apps, R., et al. Influence of HLA-C expression level on HIV control. Science. 340 (6128), 87-91 (2013).
- Cebecauer, M., et al. CD8+ cytotoxic T lymphocyte activation by soluble major histocompatibility complex-peptide dimers. The Journal of Biological Chemistry. 280 (25), 23820-23828 (2005).
- Sporri, R., Reis e Sousa, C. Self peptide/MHC class I complexes have a negligible effect on the response of some CD8+ T cells to foreign antigen. European Journal of Immunology. 32 (11), 3161-3170 (2002).
- Ljunggren, H. G., et al. Empty MHC class I molecules come out in the cold. Nature. 346 (6283), 476-480 (1990).
- Kotsiou, E., Brzostek, J., Gould, K. G. Properties and applications of single-chain major histocompatibility complex class I molecules. Antioxidants & Redox Signaling. 15 (3), 645-655 (2011).
- Hansen, T. H., Connolly, J. M., Gould, K. G., Fremont, D. H. Basic and translational applications of engineered MHC class I proteins. Trends in Immunology. 31 (10), 363-369 (2010).
- Yu, Y. Y., Netuschil, N., Lybarger, L., Connolly, J. M., Hansen, T. H. Cutting edge: single-chain trimers of MHC class I molecules form stable structures that potently stimulate antigen-specific T cells and B cells. Journal of Immunology. 168 (7), 3145-3149 (2002).
- Mitaksov, V., et al. Structural engineering of pMHC reagents for T cell vaccines and diagnostics. Chemistry & Biology. 14 (8), 909-922 (2007).
- Truscott, S. M., et al. Disulfide bond engineering to trap peptides in the MHC class I binding groove. Journal of Immunology. 178 (10), 6280-6289 (2007).
- Truscott, S. M., et al. Human major histocompatibility complex (MHC) class I molecules with disulfide traps secure disease-related antigenic peptides and exclude competitor peptides. The Journal of Biological Chemistry. 283 (12), 7480-7490 (2008).
- Bertoletti, A., Ferrari, C. Innate and adaptive immune responses in chronic hepatitis B virus infections: towards restoration of immune control of viral infection. Postgraduate Medical Journal. 89 (1051), 294-304 (2013).
- Boni, C., et al. Characterization of hepatitis B virus (HBV)-specific T-cell dysfunction in chronic HBV infection. Journal of Virology. 81 (8), 4215-4225 (2007).
- Gehring, A. J., et al. Engineering virus-specific T cells that target HBV infected hepatocytes and hepatocellular carcinoma cell lines. Journal of Hepatology. 55 (1), 103-110 (2011).
- Gehring, A. J., et al. The level of viral antigen presented by hepatocytes influences CD8 T-cell function. Journal of Virology. 81 (6), 2940-2949 (2007).
- Bertoni, R., et al. Human histocompatibility leukocyte antigen-binding supermotifs predict broadly cross-reactive cytotoxic T lymphocyte responses in patients with acute hepatitis. The Journal of Clinical Investigation. 100 (3), 503-513 (1997).
- Goulder, P. J., et al. Patterns of immunodominance in HIV-1-specific cytotoxic T lymphocyte responses in two human histocompatibility leukocyte antigens (HLA)-identical siblings with HLA-A*0201 are influenced by epitope mutation. The Journal of Experimental Medicine. 185 (8), 1423-1433 (1997).
- Sastry, K. S., et al. Targeting hepatitis B virus-infected cells with a T-cell receptor-like antibody. Journal of Virology. 85 (5), 1935-1942 (2011).
- vanden Berg, H. A., et al. Cellular-level versus receptor-level response threshold hierarchies in T-cell activation. Frontiers in Immunology. 4, 250 (2013).
- Moots, R. J., Matsui, M., Pazmany, L., McMichael, A. J., Frelinger, J. A. A cluster of mutations in HLA-A2 alpha 2 helix abolishes peptide recognition by T cells. Immunogenetics. 34 (3), 141-148 (1991).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. Journal of Visualized Experiments. (61), (2012).
- Axmann, M., Schutz, G. J., Huppa, J. B. Single Molecule Fluorescence Microscopy on Planar Supported Bilayers. Journal of Visualized Experiments. (105), e53158 (2015).
- Mariati, E. Y., Koh, J. H., Yeo, S. C., Ho, Y., Yang, Toward stable gene expression in CHO cells. Bioengineered. 5 (5), 340-345 (2014).
- Matsushita, S., Tanaka, Y., Matsuoka, T., Nakashima, T. Clonal expansion of freshly isolated CD4T cells by randomized peptides and identification of peptide ligands using combinatorial peptide libraries. European Journal of Immunology. 31 (8), 2395-2402 (2001).
- Heng, B. C., Cowan, C. M., Basu, S. Comparison of enzymatic and non-enzymatic means of dissociating adherent monolayers of mesenchymal stem cells. Biological Procedures Online. 11, 161-169 (2009).
- Smith, K., et al. Sensory adaptation in naive peripheral CD4 T cells. The Journal of Experimental Medicine. 194 (9), 1253-1261 (2001).
- Wei, M. L., Cresswell, P. HLA-A2 molecules in an antigen-processing mutant cell contain signal sequence-derived peptides. Nature. 356 (6368), 443-446 (1992).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. Journal of Visualized Experiments. (19), (2008).
- Bakker, A. H., et al. Conditional MHC class I ligands and peptide exchange technology for the human MHC gene products HLA-A1, -A3, -A11, and -B7. Proceedings of the National Academy of Sciences of the United States of America. 105 (10), 3825-3830 (2008).
- Rhode, P. R., et al. Single-chain MHC class II molecules induce T cell activation and apoptosis. Journal of Immunology. 157 (11), 4885-4891 (1996).
- Crew, M. D., Cannon, M. J., Phanavanh, B., Garcia-Borges, C. N. An HLA-E single chain trimer inhibits human NK cell reactivity towards porcine cells. Molecular Immunology. 42 (10), 1205-1214 (2005).
- Van Kaer, L., Wu, L., Joyce, S. Mechanisms and Consequences of Antigen Presentation by CD1. Trends in Immunology. 37 (11), 738-754 (2016).
- Im, J. S., et al. Direct measurement of antigen binding properties of CD1 proteins using fluorescent lipid probes. The Journal of Biological Chemistry. 279 (1), 299-310 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。