Method Article
Spontanee ed evocate misure di dolore in modelli murini di dolore del ginocchio Monoarticular
In questo articolo
Riepilogo
Abbiamo sviluppato una misura evocata dolore di artrite e abbinato un metodo standardizzato per misurare il dolore spontaneo nei diversi modelli murini di artrite indotta chimicamente. Queste misure sono sensibili e riproducibili per diversi tipi di dolori articolari.
Abstract
Il dolore è la causa principale dell'inabilità dall'artrite. Attualmente esiste un bisogno insoddisfatto per i trattamenti adeguati per dolore di artrite. Modelli pre-clinici sono necessarie e utili per lo studio dei meccanismi del dolore e per valutare l'efficacia delle terapie di artrite. Misurazione del dolore in modelli animali di artrite è impegnativo. Abbiamo sviluppato metodi di misurazione del dolore spontaneo ed evocato in tre modelli di artrite murino. Abbiamo quantificare le risposte di dolore evocato di topi sottoposti a costante palpazione di un ginocchio doloroso. Valutiamo anche dolore spontaneo dalla proporzione di peso e la quantità di tempo collocati su ciascuno dei loro 4 membra dopo induzione di dolore di artrite in un ginocchio. Dolori articolari in questi modelli del mouse produce un aumento significativo nelle risposte di dolore evocato e un'alterazione nel cuscinetto di peso. Poiché i topi sono quadrupedi, alleggeriscono l'arto doloroso per l'arto controlaterale, per gli arti anteriori, o una certa combinazione. Questi metodi sono semplici, richiedono attrezzature minime e sono riproducibili e sensibili per la rilevazione del dolore. Essi sono utili per lo studio di analgesici nei topi e modificante la malattia trattamenti di artrite.
Introduzione
Il dolore è la principale causa di disabilità da artrite1,2. Attualmente gli analgesici disponibili sono spesso inefficaci, tossici e potenzialmente contribuiscono al livello nazionale narcotico problema3. Chirurgia non è sempre un'opzione per l'artrite di stadio finale, specialmente negli anziani, che possono avere più co-morbidità. Viscosupplementazione e steroidi intra-articolari può essere efficace nella malattia precoce ma in genere perdono la loro efficacia nella tarda fase malattia4. C'è un grande bisogno insoddisfatto per analgesici efficaci per il dolore di artrite che non può essere affrontata con trattamenti attualmente disponibili.
Modelli pre-clinici sono utili per la comprensione del meccanismo d'azione delle terapie del dolore e per predire le tossicità limitante, ma la misurazione del dolore negli animali è impegnativo5. Misure di dolore possono essere diretto e spontaneo (statico o dinamico cuscinetto di peso, piede postura, analisi del passo, movimento spontaneo e sensibilità meccanica o termica) o indiretta/evocato (prova di ritiro dell'arto, forza di compressione del ginocchio o formazione immagine del cervello) 6. per forme lievi di monoarthritis, analisi del passo è insensibile e manca di coerenza7. Cuscinetto di peso statico è utile per misurare il dolore nelle zampe posteriori del ratto, ma può essere difficile nei topi. Misure di sensibilità meccanica come il test di von Frey indirettamente rilevare sensibilizzazione del piede pad nella cornice di artrite del ginocchio, ma non misurano direttamente il dolore al ginocchio e sono difficili da eseguire. Forza di compressione del ginocchio come misurata con il dispositivo P.A.M. (misura di applicazione di pressione) può essere utilizzato nei ratti, ma il grande dispositivo è difficile da usare nei topi senza produrre comportamenti negativi che non riflettono necessariamente dolore8.
Abbiamo sviluppato metodi per la misurazione dolore spontaneo ed evocato in tre diversi modelli di artrite murino che sono sensibili e riproducibili per misurare la severità di dolore e gli effetti analgesici di terapie intra-articular9, 10. noi possiamo correlare anche sollievo dal dolore con altri marcatori istologici di dolore e schermo droghe d'investigazione che non sarebbero stato possibile negli esseri umani. Possiamo valutare sinergismo degli analgesici modestamente efficaci per identificare le terapie più efficaci di combinazione. Utilizzando metodi provati per dolore evocato sia spontaneo, evitiamo l'insidia di non riuscire a identificare il dolore che si riflette in un tipo di comportamento di dolore, ma non l'altro e più strettamente specchio misurazione del dolore in esseri umani11. Limitando la valutazione di dolore a due metodologie, minimizzare lo stress sugli animali, che possono influenzare il comportamento di dolore e massimizzare la produttività del laboratorio.
Protocollo
Tutti i protocolli e le procedure animale sono stati approvati dal comitato di uso e cura degli animali istituzionale di Minneapolis Veterans Affairs Health Care System (VAHCS) e conformati alla "Guida per la cura e l'uso degli animali da laboratorio" (la National Academic Press, USA) 12.
1. scelta degli animali
Nota: Topi C57Bl6 sono utilizzati per tutti i tre modelli di artrite.
- Utilizzare topi sia maschi o femminili, ma nota che la risposta al dolore di artrite può variare a seconda del genere e la patogenesi del modello in fase di test.
- Selezionare i topi che hanno raggiunto la maturità sessuale, non sono più in rapida crescita e non sono abbastanza vecchio per aver sviluppato artrite spontanea che poteva confondere misure di dolore.
Nota: Dodici settimane è un'età ideale per la misurazione del dolore in modelli descritti, ma questo dipende dal disegno dello studio. Età all'inizio dell'artrite dipende dalla durata di tempo che il modello necessario per sviluppare. Artrite infiammatoria acuta (modello carragenina) richiede 3 ore per sviluppare, quindi gli animali sono 12 settimane di età al momento della induzione. Artrite infiammatoria cronica (modello CFA) richiede 3 settimane per sviluppare, quindi gli animali sono 9 settimane di età al momento della induzione. Artrite degenerativa cronica (modello collagenosi) richiede 4 settimane per sviluppare, quindi gli animali sono 8 settimane al momento della induzione. Un modello più cronico di artrite degenerativa può essere utilizzato attraverso l'induzione di artrite a 6 settimane dell'età. Questo consente di 6 settimane di sviluppo del danno articolare. Tuttavia, l'artrite degenerativa cronica nei topi non produce dolore evocato significativo. - Ottenere gli animali da una fonte nazionale allevamento commerciale.
- Animali di casa in gruppi di fino a 8 animali in gabbie di policarbonato standard con ad libitum la dieta del roditore e acqua.
- Mantenere condizioni ambientali a 72 ° C ± 1 ° C e 33% ± 1% di umidità con cicli di luce/buio di 12 h.
2. intra-articular iniezioni nel ginocchio
- Creare un 30 G 2,5 mm sterile coprendo la lunghezza di un ago di 0,5 pollici con una guaina in polietilene tubolare con all'interno diametro di 0,38 mm e diametro esterno di 1,09 mm, lasciando solo 2,5 mm di ferro sporgente. Questo impedisce di inserimento dell'ago troppo profondamente e uscendo il giunto posteriormente.
- Scegliere un singolo ginocchio per iniettare, radere utilizzando qualsiasi commercialmente disponibili tagliacapelli elettrico facciale e sterilizzare con scrub providone-iodio.
- Anestetizzare il mouse con isoflurano 3% a 100% di O2 a 1 L/min per 3 min ± 1 min. mantenere l'anestesia utilizzando una punta conica durante la procedura. Confermare la profondità di anestesia di pizzico di punta. Prendersi cura di monitorare la condizione respiratoria e minimizzare l'esposizione di anestesia per mantenere adeguate respirazioni.
- Inserire il giunto al midline attraverso il tendine rotuleo appena inferiore al bordo inferiore della rotula utilizzando l'ago sterile con guaina, una volta che il mouse è completamente anestetizzato. Questo approccio di midline anteriore massimizza precisione per immettere il giunto e iniettare la sostanza di interesse.
- Utilizzare lo stesso approccio per l'iniezione di sostanze che inducono l'artrite sia sostanze analgesiche. Comandi finti sono prodotte inserendo l'ago come sopra ma senza iniettare qualsiasi sostanza.
3. produzione di artrite
- Anestetizzare l'animale come descritto al punto 2.3 sopra.
- Pesare la quantità appropriata (Vedi sotto) di carragenina, adiuvante completo di Freund e tipo IV collagenosi e diluire la concentrazione appropriata con normale soluzione salina in una cappa a flusso laminare per la sicurezza e sterilità.
- Iniettare 10 µ l di carragenina 2,5% diluito in soluzione salina sterile 0,9% nel ginocchio come sopra utilizzando una siringa Hamilton per produrre artrite infiammatoria acuta. L'artrite picchi 3 h dopo l'iniezione.
- Iniettare, 30 µ l (30 µ g) di Freund completo adiuvante (CFA) nel ginocchio per produrre artrite infiammatoria cronica. C'è una prima fase infiammatoria acuta che i picchi a 1 settimana quindi una fase cronica che i picchi a 3 settimane dopo l'iniezione.
- Iniettare 10 µ l contenente collagenasi di tipo IV 10 IU per produrre artrite degenerativa cronica. Picchi di dolore di artrite 4 settimane dopo l'iniezione.
4. misurazione del dolore articolare evocati
- Esaminare sempre il ginocchio normale comparatore in primo luogo per ridurre al minimo la risposta al dolore di incrocio (windup) dal ginocchio doloroso13.
- Addestrare l'esaminatore per applicare una pressione costante e ferma di 700 gf/cm2 = 10 psi utilizzando un livello di palpometro 4; il dispositivo emette 4 beep quando viene applicato questo livello di pressione. Questa quantità di pressione costantemente di suscitare una risposta di dolore maggiore da un giunto di artritico da un giunto normale.
Nota: Il dispositivo è calibrato in fabbrica per suscitare 4 beep quando viene applicato l'adeguato livello di pressione. Utilizzare il dispositivo per la formazione solo; non utilizzare su animali, ma quando si esaminano gli animali, applicare la quantità di pressione imparato attraverso la formazione. - Trattenere il mouse abbastanza saldamente per impedire il movimento casuale tenendo la collottola del collo con il dito indice e il pollice e utilizzando il 4th e 5th dita per trattenere la coda. Il mouse dovrebbe essere in grado di effettuare movimenti discreti, brevi con sforzo e quando stimolati, ma non dovrebbe essere in grado di muoversi liberamente o in modo continuativo.
- Amministrare ripetute palpazione di (palpometro livello 4) ferma contemporaneamente ai lati mediali e laterali di ogni ginocchio alle circa la linea comune con il pollice e il dito indice della mano libera una volta al secondo per un minuto mentre tratteneva il mouse. Non utilizzare il palpometro per l'esame del mouse; esso viene utilizzato solo per la formazione.
- Hanno un secondo osservatore a contare il numero di volte l'animale vocalizza e combatte per sfuggire il sistema di ritenuta durante questo periodo di tempo di un minuto. La somma di lotte e vocalizzazioni è il punteggio del dolore evocato.
- Sempre noi l'esaminatore stesso in tutto lo studio e confermare l'esaminatore e l'osservatore sono accecati per quanto riguarda condizione sperimentale.
5. misura di dolori articolari spontanei.
Nota: Il dispositivo di Advanced Dynamic peso cuscinetto (ADWB) calcola la percentuale di tempo totale che l'animale trascorre su ogni arto e la percentuale di peso totale a carico su ogni arto.
- Riempire un bicchiere in plastica con 2 L di acqua. Posizionare il tappetino in gomma e fibra di legno a media densità che sono inclusi con l'apparecchiatura con il becher riempito su scala di laboratorio e registrare il peso combinato.
- Aprire il programma ADWB e selezionare il tipo di sensore di topi .
- Calibrare il sistema prima di ogni esperimento:
- Selezionare calibrazione completa sotto il menu di calibrazione . Inserisci 0.00 come valore di Tara e il peso del rilievo di gomma piuma, fibra a media densità, bicchiere in plastica e acqua come il peso di calibrazione, quindi selezionare Avanti.
- Selezionare Tara prima di mettere qualcosa sul sensore. Prima di selezionare Anteprima di guadagno, coprire il sensore pad con il tappetino in gomma fornito, fibra a media densità e bicchiere in plastica riempito con 2 litri di acqua, in quell'ordine. Selezionare Anteprima di guadagno una volta che il peso di calibrazione è sul sensore.
- Regolare il peso di calibrazione, in modo che è uniformemente distribuito attraverso i singoli sensori e quando il valore dell' indicatore di calibrazione è superiore a 95, selezionare la definizione di guadagno. Questo processo produce una media normalizzata per i singoli sensori e conferma l'integrità dei singoli sensori. Infine, selezionare Avanti.
- Salvare il file di calibrazione nella cartella calibrazione.
- Selezionare nuovo e ove previsto immettere il nome del progetto e il nome di animale per il primo mouse per essere testato.
- Selezionare Sfoglia e aprire il file di calibrazione che è stato creato per il progetto. Selezionare successivo, assicurarsi di attivare l'acquisizione dei video sia selezionata, quindi selezionare OK.
- Pesare l'animale, selezionare catturae registra il peso nel software. Selezionare OK.
- Non acclimatare topi alla camera prima della raccolta dei dati, perché questo dispositivo misura comportamento spontaneo.
- Posizionare il mouse nella camera per un periodo di 5 minuti di test. Quando l'animale è nella camera di selezionare avvio. Il software sarà registrare attività dell'animale durante questo tempo, cattura un video e sincronizzare con i dati del sensore e automaticamente partizionare questo video in segmenti analizzabile e non analizzabile.
Nota: Il software considera segmenti analyzable quando viene rilevata almeno una zona stabile. Viene creata una zona stabile quando i sensori rilevano ≥ 2 g su un sensore con un minimo di un adiacente sensore rilevamento di ≥ 1 g e quando la distribuzione del peso di una zona è stabile per più di 0,38 s. - Prima la prima analisi in una serie selezionare segnando facile e che indipendente paws impostazione.
Nota: Segnando facile permette di convalida di iterazione dei segmenti dove non cambia la zona stabile basato sulla convalida della prima zona stabile di quel segmento. Zampe indipendente impostazione fornisce all'osservatore con accesso per le scorciatoie da tastiera che permettono l'identificazione individuale di ogni zampa. L'osservatore assegna le zone che soddisfano criteri minimi come posteriori destra, lasciato ribalta posteriore, destra, sinistra anteriore, entrambe le zampe anteriori, altra parte del corpo o ignorano zona utilizzando le scorciatoie da tastiera e tenendo il cursore sopra il segmento per la mappa dei video e in scala di attivano sensori. - Selezionare >> a spostare il primo segmento analizzabile. Se una zona stabile non hanno la corretta zampa identificata quindi posiziona il cursore su quella zona e premere la scelta rapida (destra hind, s; sinistra hind, un; diritto ribalta, w; sinistra anteriore, q; entrambi zampe anteriori, e; altra sezione del corpo, z, ignorare zona, x) che corrisponde con la parte del corpo corretto.
Nota: Un minimo di 1,5 min di tempo analyzable è necessaria per soddisfare le soglie di analisi. Analizzati segmenti vengono aggiunti e automaticamente in media per uscita a paw(s) dal software. - Il software ADWB calcola automaticamente la percentuale di tempo analizzato e percentuale di peso corporeo (g) posizionato su ciascuna delle opzioni quattro arto. Esportare questi valori in un nuovo foglio di calcolo selezionando risultati, esportare, selezionando Sì al prompt di domanda chiedendo se solo le prime cinque righe di riepilogo devono essere esportate, e la posizione dell'output.
- Eutanasia animali da inalazione di CO2 seguita dal thoracotomy alla fine del periodo di studio.
- Per ogni ulteriore animale nello stesso gruppo, scegliere nuovo e immettere un nome di animale univoco ma non modificare il nome del progetto. Selezionare successivo, assicurarsi di attivare l'acquisizione dei video sia selezionata, quindi selezionare OK. Procedura il 5.5 a 5.12, per quanto riguarda il primo animale.
Risultati
Dolore acuto e cronico infiammatorio e cronico degenerativo comune è stato prodotto da iniezione IA nel ginocchio di sinistra dei topi maschii e femminili di C57BL/6J prima valutazione del dolore utilizzando il protocollo di cui sopra. Dolori articolari è stata misurata come dolore evocato Spartiti (EPS) e comportamenti di dolore spontaneo misurata con un dispositivo di cuscinetto (ADWB) avanzate peso dinamico. Ai fini della presente relazione, singoli confronti sono stati fatti utilizzando il test t di Student. Per esperimenti cui sono confrontate dosi analgesiche, ANOVA può essere un confronto statistico più appropriato.
EPS (la somma di lotte conteggiate più vocalizzazioni) aumentato con tutti i tre tipi di dolori articolari (Figura 1). Misure ADWB del cuscinetto sulla sinistra dell'arto rispetto ai topi di ingenuo percentile di peso sono stati ridotti in dolori articolari infiammatorie acute e croniche. Le femmine, ma non maschi con cronica degenerativi articolare dolore (COL) ha mostrato riduzioni simili misure ADWB (Figura 2A). Maschi con dolori articolari infiammatori acuti trasferiti più peso le zampe anteriori che ingenuo animali. Cuscinetto su arti anteriori di peso aumentato nei topi della femmina rispetto a ingenuo ma non nei maschi con dolori articolari degenerative croniche (COL) (Figura 2B). Misure ADWB della percentuale di tempo sull'arto interessato di sinistra hind è diminuito rispetto al ingenuo in topi con dolori articolari infiammatorie acute e croniche, ma questo non era statisticamente significativa. Questi animali ha fatto spendere significativamente meno tempo per la sinistra dell'arto rispetto sulla destra dell'arto. Sia maschi che femmine con dolori articolari degenerative croniche, non c'era alcuna differenza nel tempo trascorso sugli arti posteriori sinistro rispetto a ingenuo. Femmine con dolori articolari degenerative croniche trascorso più tempo sul nonarthritic dell'arto destro rispetto al ingenuo (Figura 3A). Topi con acuta infiammatori dolori articolari e le femmine con dolori articolari degenerative croniche trascorso significativamente più tempo su quelle anteriori di animali naïve (Figura 3B).

Figura 1 . Evocato il dolore segna per gli arti posteriori di destra (colonna rossa) e sinistra (colonna blu). Arti posteriori destro servita come controlli interni e non ha subito alcun iniezioni di IA. Misurazioni sono state effettuate nelle seguenti condizioni: uninjected ingenuo (maschile e femminile), artrite infiammatoria acuta indotta da carragenina (auto), Complete di infiammatoria cronica artrite indotta da adiuvante di Freund (CFA) e cronica noninflammatory Artrite indotta da collagenosi (COL - maschio e femmina). Negli animali ingenuo l'EPS del ginocchio sinistro posteriore non era statisticamente differente da destra nei maschi e solo minimamente diverso nelle femmine (* *P = 0.038) probabilmente a causa di alcuni aumentata risposta al dolore nel ginocchio esaminato secondo (sinistra) a causa di dolore di crossover risposta. In tutti i gruppi artritici ginocchio artritico di sinistra EPS era significativamente maggiore di nonarthritic ginocchio controlaterale destro. Quando si confrontano l'EPS del ginocchio sinistro di gruppi di artrite per animali, tutti i gruppi di artrite avevano significativamente maggiori punteggi di EPS nel ginocchio artritico di sinistra rispetto al ginocchio sinistro ingenuo. Questo era vero sia maschi che femmine. P < 0,05 rispetto al maschio ingenuo, #P < 0,05 rispetto al femmina ingenuo. Tutte le barre di errore sono SEM in tutte le figure. Clicca qui per visualizzare una versione più grande di questa figura.
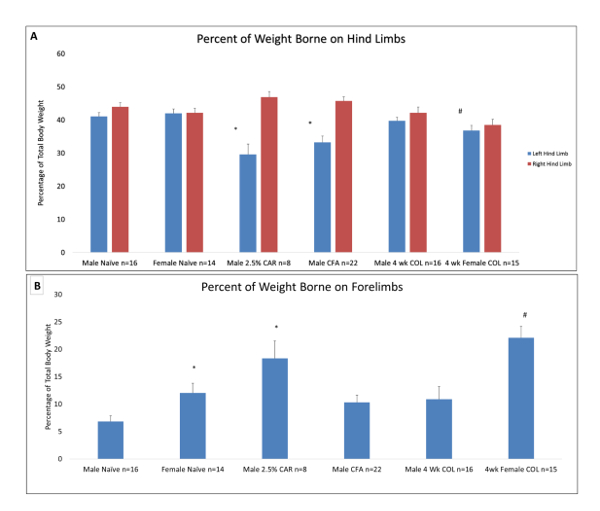
Figura 2 : Dolore spontaneo comportamento misurato in peso corporeo delle percentuali a carico degli arti. Comportamento di dolore spontaneo (A) misurato dal peso corporeo percentuale totale sulla sinistra (colonna blu) e gli arti posteriori di destra (colonna rossa). In entrambi gli animali maschii e femminili ingenuo, non c'era differenza significativa fra il peso percentuale carico sugli arti posteriori sinistro e destro. Topi maschi con auto e CFA indotto da dolori articolari e femmine con dolori articolari indotti COL foro significativamente meno peso sulla sinistra dell'arto rispetto all'ingenuo. P < 0,05 rispetto al maschio ingenuo, #P < 0,05 rispetto al femmina ingenuo. Comportamento di dolore spontaneo (B) misurato dal peso corporeo percentuale totale messo su quelle anteriori. Nei maschi con auto indotto da acuti dolori articolari e le femmine con dolori articolari cronici COL indotta, c'era un aumento significativo della quantità di peso sopportato su quelle anteriori. Questo non è stato visto nei maschi con CFA o COL indotto da dolori articolari. Ingenuo femmine tendevano a sopportare il peso di più sulle zampe anteriori dei maschi ingenuo (P = 0,02). Peso aggiuntivo può essere carico altre parti del corpo come la coda o scamone. Questi erano solitamente minimi e non ha contribuito significativamente alla comprensione della risposta dolore e pertanto non vengono visualizzati. P < 0,05 rispetto al maschio ingenuo, #P < 0,05 rispetto al ingenuo femmina e maschio 4 settimana COL nell'arto anteriore weightbearing. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: comportamento di dolore spontaneo misurato dalla percentuale di tempo trascorso sulle membra. Comportamento di dolore spontaneo (A) misurato dalla percentuale totale di tempo trascorso sulla sinistra (colonna blu) e gli arti posteriori di destra (colonna rossa). Non c'era differenza significativa tra destro e sinistro degli arti posteriori nei topi maschii e femminili ingenuo rispetto al tempo speso per l'arto. Topi maschi con auto e CFA ha indotto l'artrite è apparso per trascorrere meno tempo weightbearing con l'artritiche dell'arto sinistro rispetto a ingenuo, ma questo non era statisticamente significativa e probabile causa di aumentata variabilità in questa misura in questi topi. C'era una differenza significativa in questi animali confrontando destra a sinistra come la destra dell'arto trascorso più tempo totale weightbearing rispetto alla sinistra. Nelle femmine con COL ha indotto l'artrite, la destra dell'arto è stato weightbearing una maggior proporzione di tempo rispetto a ingenuo femmine. P < 0,05 confrontando destra a sinistra, n #P < 0,05 rispetto al ingenuo femmina e maschio 4 settimana COL tempo trascorso sulle zampe anteriori. (B) il comportamento spontaneo di dolore misurato dalla quantità totale di tempo speso per gli arti anteriori. Nei maschi con auto ha indotta l'artrite e le femmine con artrite indotta COL i topi trascorso significativamente più tempo weightbearing sugli arti anteriori che hanno fatto gli animali naïve. Topi femmina ingenuo trascorso più tempo sulle zampe anteriori del maschio ingenuo animali. P < 0,05 rispetto al maschio ingenuo, #P < 0,05 rispetto al femmina ingenuo. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Misurazione del dolore articolare in modelli preclinici di artrite infiammatoria e malattia degenerativa delle articolazioni è uno strumento sempre più prezioso per valutare nuovi trattamenti per l'artrite dolore e ripristinare la funzione articolare9,10. Misurare i comportamenti di dolore in topi con malattia cronica degenerativa delle articolazioni è impegnativo. Come quadrupedi, si può scaricare un arto doloroso a qualsiasi combinazione di altri tre arti o la coda. Funzione in diminuzione in un arto non può essere visualizzato come ovviamente come è negli esseri umani bipedi. Come cacciare animali, i topi hanno un beneficio di sopravvivenza per ridurre al minimo i comportamenti di dolore.
Questo rapporto dimostra che i dolori articolari da diversi meccanismi patologici possono essere misurata in topi con metodi semplici e relativamente poco costosi. Dolori articolari infiammatorie provoca grandi cambiamenti nel tempo e distribuzione del cuscinetto di peso e di conseguenza possono essere un modello più sensibile per la rilevazione dell'analgesia. Tuttavia, altri modelli di dolore articolare sarà importante durante la valutazione di nuovi potenziali analgesici poiché i meccanismi di iniziazione di dolore e di manutenzione sono probabili diversi con diverse patologie. Abbiamo trovato differenze nei modelli di scarico tra maschi e femmine e tra diversi modelli di dolore di artrite.
È importante riconoscere che non vi può essere sforzo così come differenze nel comportamento di dolore in topi14,15,16di genere. È anche noto che ci sono differenze di ceppo distinti in soglie di dolore. Abbiamo trovato che in topi C57/Bl6, le femmine hanno dimostrato significativamente più spontanei comportamenti di dolore (aumento di peso e tempo su arti anteriori) rispetto a topi maschi con dolori articolari cronici degenerativi (Figura 2 e Figura 3). Non abbiamo determinare la fase di estro per questi topi femminili, quindi non possiamo dire se questo ha avuto alcun effetto sui nostri risultati, ma altri hanno determinato quella fase di estro non ha spiegato le differenze del sesso osservati di topi C57/Bl617.
Comportamento di dolore evocato è sensibile a tutti i tipi di dolori articolari testato e ha buona riproducibilità. È fondamentale che l'esaminatore è addestrato per fornire pressione palpazione coerente, standardizzato e utilizzare metodi di ritenuta coerente che permette la gamma del comportamento di dolore per rilevare sia il dolore e l'analgesia. È importante esaminare sempre il ginocchio normale in primo luogo per minimizzare la risposta di dolore nel ginocchio normale a causa di un effetto dell'incrocio e massimizzare la differenza di risposta al dolore del ginocchio normale e doloroso. Utilizzando un secondo osservatore per calcolare le risposte di dolore che compongono l'EPS è necessario quindi che l'esaminatore si concentra sulla palpazione coerenza e affinché vocalizzazioni e lotte sono sempre conteggiate. Può essere necessario praticare il metodo di contenimento in particolare per garantire l'animale può reagire adeguatamente al dolore ma non reagisce troppo facilmente in modo da diluire la risposta al dolore. Un vantaggio della misurazione EPS è che è analoga alla misurazione congiunta tenerezza in pazienti umani.
Riteniamo che questi metodi sono superiori ai metodi esistenti in quanto misurano direttamente il dolore proveniente dalle articolazioni di ginocchio dei topi, sono utilizzabili in diversi modelli di monoarthritis dolore, essi includono entrambe le risposte di dolore spontaneo ed evocato e sono relativamente poco costoso, ma affidabile e riproducibile. Come si sviluppano le terapie per trattare più efficacemente l'artrite, questi metodi sarà utili per la conferma se i trattamenti sono realmente efficaci per l'esito più disabilitanti di artrite, dolore.
I nostri metodi presentano alcune limitazioni. Principalmente, la misura EPS è limitata dal requisito per un singolo esaminatore e l'osservatore e l'esigenza tecnica molto coerenza. Le misure di dolore evocati sono più automatizzate e non sono soggetti a differenze inter-osservatore. Ulteriore affinamento della misura EPS può includere metodi automatici per il conteggio dei vocalizzi in risposta alla palpazione, ad esempio utilizzando un rilevatore ad ultrasuoni pipistrello per contare le vocalizzazioni. Questo metodo avrebbe bisogno di essere paragonato al nostro attuale metodo per confermare la sensibilità e la specificità prima potrebbe essere ampiamente implementato.
In breve, descriviamo due misure di comportamento di dolore differenti per quantificare i dolori articolari in topi. Differenze di genere e ceppo devono essere considerate prima di scegliere un modello sperimentale. Misure di dolore evocato richiedono un'attenta formazione e attuazione coerente da parte dell'esaminatore. Entrambi i comportamenti di dolore spontaneo ed evocato sono raccomandati per valutare la severità di dolore e limitazione funzionale e dovrebbero essere utilizzati per valutare appieno gli effetti di nuovi potenziali analgesici.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Finanziato il Department of Veterans Affairs MERIT award 2 I01 RX000379-05.
Materiali
| Name | Company | Catalog Number | Comments |
| Advanced Dynamic Weightbearing Device | Bioseb In Vivo Research Instruments, Vitrolles, France | Model: BIO-DWB-M - For mice | |
| C57/Bl6 mice (male and female) | Jackson Labs, Bar Harbor ME | Stock No: 000664 | Black 6 | |
| Carrageenan | Sigma-Aldrich, St. Louis, MO, USA | 22049-5G-F | |
| Complete Freund's Adjuvant | Sigma-Aldrich, St. Louis, MO, USA | F5881 | |
| Palpometer | Palpometer Systems, Inc. Victoria, B.C | Not available - no longer in business | |
| Type IV Collagenase | Worthington Biomedical Corp, Lakeville, NJ | LS004210 |
Riferimenti
- Neggi, T. The epidemiology and impact of pain in osteoarthritis. Osteoarthritis and Cartilage. 21, 1145-1153 (2013).
- Center for Disease Control and Prevention. Prevalence of doctor-diagnosed arthritis and arthritis-attributable activity limitation - United States, 2007-2009. Morbidity and Mortality Weekly Report. 59, 1261-1265 (2010).
- Kaye, A., et al. Prescription Opioid Abuse in Chronic Pain: An Updated Review of Opioid Abuse Predictors and Strategies to Curb Opioid Abuse: Part 1. Pain Physician. 20, 93-109 (2017).
- Maheu, E., et al. Why we should definitely include intra-articular hyaluronic acid as a therapeutic option in the management of knee osteoarthritis: Results of an extensive critical literature review. Seminars in Arthritis and Rheumatism. , (2018).
- Malfait, A. -. M. Why we should study pain in animal models of rheumatic diseases. Clinical and Experimental Rheumatology. 35, 37-39 (2017).
- Piel, M. J., Kroin, J. S., van Wijnen, A. J., Kc, R., Im, H. -. J. Pain Assessment in Animal Models of Osteoarthritis. Gene. 537, 184-188 (2014).
- Dorman, C. W., Krug, H. E., Frizelle, S. P., Funkenbusch, S., Mahowald, M. L. A comparison of DigiGait™ and TreadScan™ imaging systems: assessment of pain using gait analysis in murine monoarthritis. Journal of Pain Research. 7, 25-35 (2013).
- Barton, N., et al. Pressure application measurement (PAM): A novel behavioural technique for measuring hypersensitivity in a rat model of joint pain. Journal of Neuroscience Methods. 163, 67-75 (2007).
- Bert, J., et al. The Effect of Treatment with Resiniferatoxin and Capsaicin on Dynamic Weight Bearing Measures and Evoked Pain Responses in a Chronic Inflammatory Arthritis Murine Model. Internal Medicine Review. 2016 (6), 89 (2016).
- Abdullah, M., et al. The effect of intra-articular vanilloid receptor agonists on pain behavior measures in a murine model of acute monoarthritis. Journal of Pain Research. 9, 563-570 (2016).
- Anke, T. T., Kuner, R. Studying ongoing and spontaneous pain in rodents - challenges and opportunities. European Journal of Neuroscience. 39, 1881-1890 (2014).
- National Research Council. . Guide for the Care and Use of Laboratory Animals. , (2011).
- Kuner, R. Central mechanisms of pathological pain. Nature Medicine. 16, 1258-1266 (2010).
- Banik, R., Woo, Y., Park, S., Brennan, T. Strain and Sex Influence on Pain Sensitivity after Plantar Incision in the Mouse. Anesthesiology. 105, 1246-1252 (2006).
- Mogil, J. S., Chesler, E., Wilson, S. G., Juraska, J. M., Sternberg, W. F. Sex differences in thermal nociception and morphine antinociception in rodents depend on genotype. Neuroscience & Biobehavioral Reviews. 24, 375-389 (2000).
- Mogil, J., et al. Heritability of nociception I: Responses of 11 inbred mouse strains on 12 measures of nociception. Pain Physician. 80, 67-82 (1999).
- Meziane, H., Ouagazzal, A. -. M., Aubert, L., Wietrzych, M., Krezel, W. Estrous cycle effects on behavior of C57BL/6J and BALB/cByJ female mice: implications for phenotyping strategies. Genes, Brain, and Behavior. 6, 192-200 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon