Method Article
Analisi metabolica ingabbiamento in topi alta Fed grasso e della composizione corporea
In questo articolo
Riepilogo
Questo protocollo descrive l'uso di un analizzatore di composizione corporea e sistema di monitoraggio degli animali metabolica per caratterizzare la composizione corporea e parametri metabolici nei topi. Un modello di obesità indotta alimentando grassi viene utilizzato come esempio per l'applicazione di queste tecniche.
Abstract
Alterazioni di composizione corporea (massa grassa o magra), parametri metabolici quali consumo di ossigeno del corpo intero, dispendio energetico e utilizzazione del substrato e comportamenti come l'ingestione di cibo e attività fisica in grado di fornire informazioni importanti per quanto riguarda i meccanismi di fondo di malattia. Data l'importanza della composizione corporea e il metabolismo allo sviluppo di obesità e le sue conseguenze successive, è necessario effettuare misure accurate di questi parametri in ambito di ricerca pre-clinica. I progressi della tecnologia nel corso degli ultimi decenni hanno reso possibile derivare queste misure nei modelli del roditore in modo non invasivo e longitudinale. Di conseguenza, queste misure metaboliche hanno dimostrato utile nel valutare la risposta di manipolazioni genetiche (ad esempio transgenici o knockout mice, virale knock-down o sovraespressione di geni), lo screening droga sperimentale/mescola e dietetici, interventi di attività fisiche o comportamentali. Qui, descriviamo i protocolli utilizzati per misurare la composizione corporea e parametri metabolici utilizzando un animale monitoraggio sistema nei topi di dieta-federazione grassi cibo-federazione e alti.
Introduzione
Metabolismo è alla base di molti aspetti della normale cellulare, organo e fisiologia del corpo intero. Di conseguenza, nella cornice di varie patologie, alterazioni al metabolismo possono contribuire direttamente allo stato di fondo o potrebbero essere negativamente influenzate come un effetto collaterale della patologia. Tradizionalmente, studi in equilibrio energetico e metabolico sono stati concentrati sul campo dell'obesità e patologie correlate come l'insulino-resistenza, pre-diabete, intolleranza al glucosio, malattia cardiovascolare ed il diabete. Questa ricerca è autorizzata data la crescente prevalenza di tali condizioni in tutto il mondo e dell'individuo, della società, e costi economici queste condizioni infliggono. Come tale, lo sviluppo di strategie di prevenzione e nuove terapie per l'obesità di destinazione è un obiettivo nei laboratori di ricerca del mondo e modelli preclinici del topo sono fortemente invocati per questi studi.
Mentre la pesatura topi fornisce una valutazione affidabile di aumento di peso o perdita, non fornisce una ripartizione delle diverse componenti che compongono la pagina di composizione del corpo intero (massa grassa, massa magra, acqua gratuita così come altri componenti quali pelliccia e artigli). La pesatura delle adiposità al completamento degli studi, una volta che il mouse è deceduto fornisca una misura precisa dei diversi depositi di grasso, ma può solo fornire dati per un unico punto di tempo. Di conseguenza, spesso è necessario iscriversi più coorti per studiare lo sviluppo dell'obesità nel tempo, significativamente crescente numero di animali, tempo e costi. L'uso del dual-energy x-ray absorptiometry (DEXA) fornisce un approccio per valutare il contenuto del corpo del tessuto grasso e magro e consente al ricercatore di ottenere dati in modo longitudinale. Tuttavia, la procedura richiede topi anestetizzati1e ripetuti attacchi di anestesia possono influenzare l'accumulo di tessuto adiposo o impatto altri aspetti della regolazione metabolica. EchoMRI utilizza la risonanza magnetica nucleare rilassometria per misurare la massa grassa e magra, acqua gratuita e contenuto d'acqua totale. Ciò è ottenibile grazie alla creazione di contrasto tra i componenti differenti del tessuto, con differenze nella durata, ampiezza e distribuzione spaziale delle radiofrequenze generati permettendo la delineazione e la quantificazione di ogni tipo di tessuto. Questa tecnica è vantaggiosa in quanto è semplice, rapido e non invasivo, non richiede alcuna anestesia o la radiazione e, soprattutto, è stato convalidato positivamente contro analisi chimica2.
Una considerazione chiave di ricerca correlata e l'obesità è l'equazione di equilibrio di energia. Accumulo di grasso è più complicato che puramente energetica (assunzione di cibo) contro energia fuori (dispendio energetico), ma sono fattori vitali per essere in grado di misurare. Dispendio energetico quotidiano è il totale di quattro diversi componenti: (1) dispendio energetico basale (tasso metabolico a riposo); (2) il dispendio energetico a causa dell'effetto termico del consumo alimentare; (3) l'energia necessaria per la termoregolazione; e (4) l'energia spesa sull'attività fisica. Come dispendio energetico genera calore, misurare la produzione di calore da un animale (conosciuto come calorimetria diretta) può essere utilizzato per valutare il dispendio energetico. In alternativa, misurazione di ispirato e scaduto concentrazioni di O2 e CO2, permettendo per la determinazione del corpo intero O2 consumo e produzione di CO2 , può essere utilizzata come un modo per misurare indirettamente (indiretta Calorimetria a) produzione di calore e di conseguenza calcolare il dispendio energetico. Un aumento nell'assunzione di cibo o una diminuzione nel dispendio energetico possa predisporre tali topi ad aumento di peso e osservazioni dei cambiamenti in questi parametri possono fornire utili informazioni di probabili meccanismi d'azione su particolari modelli di obesità. Un parametro metabolico correlato di interesse è il rapporto di cambio delle vie respiratorie (RER), un indicatore della percentuale di substrato/carburante (cioè, carboidrati o grassi) che è in fase di metabolismo e viene utilizzata per produrre energia. Misurazione dell'ingestione di cibo (energia consumata) combinato con livelli di attività fisica, consumo2 O, RER e dispendio energetico è pertanto in grado di garantire un'ampia comprensione del profilo metabolico dell'organismo. Un metodo per raccogliere tali dati consiste nell'utilizzare un animale di laboratorio completa sistema di monitoraggio (vongole), che si basa sul metodo calorimetria indiretta per misurare il dispendio energetico e ha la capacità aggiunte di determinazione dei livelli di attività fisica (fascio pause) e l'assunzione di cibo tramite scale incorporato nella camera di misura.
In questo protocollo forniamo una descrizione semplice dell'uso di un analizzatore di composizione corporea per valutare la composizione corporea nei topi e un sistema di monitoraggio metabolico animale per misurare aspetti del metabolismo. Considerazioni e limitazioni per queste tecniche saranno discusse così come suggeriti metodi di analisi, interpretazione e rappresentazione dei dati.
Protocollo
Tutti gli esperimenti descritti sono stati approvati da Alfred medica ricerca formazione Precinct animale comitato etico (AMREP AEC) e topi sono stati forniti assistenza umana in linea con il National Health and Medical Research Consiglio (NHMRC) delle linee guida Australia su Sperimentazione animale. Gli animali sono stati somministrati loro prescritto dieta e acqua ad libitum e ospitato in un ambiente a temperatura controllata (~ 21-22 ° C) con una luce di 12 h e 12 h-scuro ciclo. Sette settimane vecchio topo maschio (su uno sfondo di C57Bl/6J) sono stati alimentati la dieta cibo normale regolare (energia contenuto 14,3 MJ/kg, che consiste del 76% di kJ da carboidrati, 5% di grassi, proteine 19%; Vedi tabella materiali) o per il gruppo di alimentazione grasso elevato, un alto contenuto di grassi dieta (HFD) ( energia contenuto 19 MJ/kg, composta da 36% di kJ da carboidrati, grasso 43%, 21% di proteine, specialità feed) per 3 settimane. Peso corporeo e misure della composizione corporea tramite una macchina di EchoMRI sono state fatte settimanalmente durante l'analisi di monitoraggio metabolico ha avuto luogo in un vongole dopo 3 settimane della dieta.
1. corpo composizione Analyzer procedura
Nota: Per funzionare in modo ottimale, il EchoMRI 4-in-1 utilizzato in questo protocollo devono essere contenuti all'interno di una stanza dove la temperatura dell'aria è stabile e non fluttua. Idealmente questo dovrebbe essere costantemente monitorato. Lo spostamento della macchina e interruzioni di alimentazione dovrebbe anche essere evitato se possibile. Se l'alimentazione è stata interrotta e deve essere riavviato il sistema, consentire almeno 2-3 h per la macchina per riscaldarsi prima di utilizzarlo nuovamente. Prima di iniziare, assicurarsi che si sono indossando corretti dispositivi di protezione individuale.
- Prima di analizzare i topi, è possibile eseguire un test di sistema sul corpo macchina di analizzatore di composizione. Questo comporta l'uso di uno standard di calibrazione (denominato un campione di prova sistema olio canola (costi)) per testare la precisione dello strumento e garantire che c' non è stata nessuna deriva nella relativa esattezza.
- Aprire il software di sistema, quindi fare clic sul pulsante di barra degli strumenti di Test di sistema o premendo "Alt + Y" contemporaneamente.
- Prima di effettuata il test di sistema dal computer, attendere un promemoria verificare che i costi corretti (in questo caso i costi specifici del mouse) è stato inserito all'interno del portale del sistema ( Figura 1). Una volta confermato che questo è davvero il caso, accettare per procedere con la prova, che avrà pochi minuti per completare.
- Una volta ha superato il test di sistema, proseguire con la scansione.
- Se il test di sistema fallisce, ripetere il test di sistema.
- Se la macchina continua a essere fuori portata (che indica che una deviazione si è verificato), calibrazione può essere necessario rettificare la situazione. Completare questo seguendo le istruzioni o come descritto nel manuale dell'utente fornito al momento dell'acquisto. Se il problema persiste, controllare il manuale3 o segnalare il problema al team di supporto del produttore e cercare ulteriori istruzioni.
- Posizionare i topi in un piccolo animale portacampioni (lungo cilindro) per tenerli contenuti mentre si è in macchina. A tale scopo, posizionare orizzontalmente il titolare, sollevare il mouse e inserirlo in primo luogo l'apertura della testa del cilindro. Lentamente e con attenzione portare il titolare in posizione verticale in modo che il mouse si trova nella parte inferiore del cilindro e pronto per l'analisi.
- Una volta all'interno il titolare, è possibile inserire un delimitatore per limitare il movimento del mouse durante il periodo di misura. In alcune circostanze, con topi estremamente attivi, può essere necessario tenere il delimitatore in luogo con la punta delle dita.
Nota: Acquisire i topi con posizionamento in portacampioni prima della loro analisi iniziale per ridurre lo stress. L'uso di un portacampioni animali colorati rosso può anche ridurre la potenziale risposta allo stress, come i topi si sentono che sono nel buio. - All'interno del software, selezionare una cartella (cartella sulla barra degli strumenti) per salvare i dati e creare un nome di file.
- Se necessario, è possibile ridurre la quantità di rumore casuale nelle misurazioni grasse e magre aumentando il numero delle accumulazioni di primarie della scansione. Una volta avviato il software, le accumulazioni primarie è impostata su un valore predefinito consigliato per uso generale quotidiano; Se non c'è un motivo specifico per modificare questi parametri, le impostazioni predefinite verranno darà il necessario livello di precisione per gli utenti.
- Se non siete interessati nell'ottenere i dati per acqua libera e totale, spegnere la fase acqua selezionando la scheda per dire di no. In questo modo verrà ridurre significativamente la durata della scansione e migliorare la velocità effettiva.
- Avviare la scansione selezionando "start scan" o premendo F5 sulla tastiera. Inserire tutti i dati pertinenti circa l'animale (ad es., animal ID, massa corporea, ecc.) e premere "ok" o F5 per iniziare la scansione, che avrà circa 1 min.
- Dopo i dati sono stati ottenuti, rimuovere il supporto animale contenente il mouse dalla macchina e posto sul retro degli animali nella sua gabbia. Una volta che tutti gli animali sono stati analizzati, esportare i dati per ulteriori analisi e confronto.
- Prima e dopo l'uso, pulire accuratamente i possessori degli animali secondo le istruzioni del produttore. Come questi supporti sono costruiti da plastica acrilica, alcol isopropilico e alcool etilico dovrebbe essere evitati poichè possono causare screpolature dei titolari e/o rapido deterioramento del titolare, aumentando così la probabilità di rottura. Invece, utilizzare acqua calda per lavastoviglie soluzione oppure, se ulteriore disinfettante è necessario, utilizzare F10 (a una diluizione di 1: 125) o altri spray disinfettante o pulizia (Vedi Tabella materiali) e poi pulire.
2. metabolico animale monitoraggio Procedure di sistema
Nota: Il sistema richiede ~ 2 h per riscaldare e stabilizzare. Se la macchina è stata spenta, esso deve essere acceso per consentire la cella di ossido di zirconio essere riscaldata a 725 ° C. Inoltre abbiamo posto generalmente topi nell'analizzatore di composizione corporea un giorno prima di entrare l'animale sistema di monitoraggio per evitare eventuali problemi con lo sforzo del fermo.
- Verificare il computer collegato al sistema di monitoraggio degli animali è acceso e aprire il programma di controllo. Selezionare l'opzione "Oxymax Utility" dal menu dello strumento per avviare le pompe.
- Riempire bottiglie d'acqua con acqua appropriato, pesare e controllare la salute dei topi e organizzare il cibo. Se nel sistema di misura l'assunzione di cibo, considera spolverizzare il cibo. Riempire le tramogge di cibo premendo il cibo di piattaforma e punta a molla nella tramoggia. Assicurarsi che la tramoggia di cibo e una bottiglia d'acqua siano completamente pieno per garantire che non c'è abbastanza cibo e acqua per durare il tempo sperimentale assegnato.
- Controllare lo stato di drierite/essiccante; Se si utilizza un indicatore di colore, dovrebbe essere blu e quindi asciugare, ma se è rosa/viola, ha avuto la capacità di assorbimento dell'umidità significativo e dovrebbe essere sostituito o rabboccato.
- Controllare la condizione della trappola di ammoniaca e calce sodata e sostituire se necessario. Se la trappola di ammoniaca è collegata due alla volta, quando la seconda trappola Mostra segni di un cambiamento di colore, sostituire il primo. Un aumento nell'offset CO2 può anche significare la necessità di sostituire la calce sodata.
Nota: Essiccante può essere asciugato in forno e riutilizzato, tuttavia noi seguire le raccomandazioni del produttore del sistema per utilizzare fresco ogni volta. - Assemblare gli alloggiamenti. A tale scopo, posizionare la tramoggia di cibo sulla bilancia, quindi posizionare la camera in cima con la piattaforma perforata che diventa il pavimento della camera inserita. Attentamente posizionare il mouse nella camera e fissare il coperchio del sistema con la parte anteriore e clip di nuovo e fissare prima posizionando la bottiglia di acqua e di fissaggio. Come misura precauzionale, ricontrollare tutti i coperchi di camera, topi e acqua (Figura 2A-D).
Nota: A seconda delle dimensioni dei topi in esame, può essere necessario regolare l'altezza degli spazi sopra la tramoggia di cibo in modo che i topi hanno accesso al cibo, ma non abbastanza spazio che dormono direttamente sopra l'alimentatore. - Come è consigliabile che i sensori di gas essere calibrato prima di ogni esperimento, calibrare il sistema.
- Utilizzare un gas di composizione nota (0,5% CO2, 20,5% O2, equilibrio dell'azoto). Collegare il serbatoio del gas di calibrazione al sistema tramite un regolatore e tubo flessibile. Accendere e assicurare la pressione di uscita del serbatoio è la lettura di 5-10 psi.
Nota: Alcuni sistemi avrà un secondo serbatoio, tubo e regolatore per l'uso di azoto puro come un gas "offset". Il sistema che operiamo invece utilizza la calce sodata per generare aria libera di CO2 . - Seguire le procedure per calibrare sia O2 e sensori di CO2 . Selezionare "calibrazione" dal menu strumenti e calibrare in modo sequenziale CO2e O2 . Prima di calibrare garantire quel campione 1) e flussi di riferimento sono 0,400 LPM, 2) la temperatura del sensore2 O di Zirconia è 725 ° C (± 1 ° C), 3) il campione e riferimento più secca e pompe ad aria sono su, e 4) il gas di calibrazione è collegato e acceso.
- Se necessario, effettuare la calibrazione del sensore di O2 , regolare leggermente il controllo offset sulla parte anteriore del sensore ossigeno zirconio per ottenere un valore di rapporto di2 O di 1.0000 (± 0.0002). Questo è per assicurarsi che sia entro limiti accettabili (evidenziati in carattere verde sul display software sullo schermo del computer).
- Dopo il successo di O2 e calibrazione del sensore di CO2 , disattivare la bombola del gas di calibrazione e staccare il tubo dal regolatore. Dopo la calibrazione, O2 per aria di riferimento (atmosferica) dovrebbe leggere 20,92 (± 00.02). Se la calibrazione è fuori tolleranza, ripetere e fare riferimento alla risoluzione dei problemi guide dal produttore. In caso contrario, contattare il produttore per ulteriori istruzioni.
- Utilizzare un gas di composizione nota (0,5% CO2, 20,5% O2, equilibrio dell'azoto). Collegare il serbatoio del gas di calibrazione al sistema tramite un regolatore e tubo flessibile. Accendere e assicurare la pressione di uscita del serbatoio è la lettura di 5-10 psi.
- Procedere con set-up sperimentale. Selezionare "Apri file sperimentale" nel menu di esperimento. Selezionare il modello appropriato (ad esempio, il mouse). Sotto "setup" nel menu di esperimento definire i parametri dell'esperimento che deve essere registrato (per esempio, mouse ID, peso, gruppo, ecc.) de-selezionare qualsiasi chambers non è in uso e selezionare il percorso per l'esperimento deve essere salvato.
- Assicurare le scale hanno state tarate se misurando l'ingestione di cibo e avviare l'acquisizione dei dati selezionando l'opzione "Esegui" nel menu di esperimento. Dati vengono acquisiti per le durate differenti a seconda del fenotipo, le linee guida istituzionali su isolamento degli animali e l'utilizzo del sistema.
Nota: Nelle nostre mani, l'esperimento viene ordinariamente eseguito per 48 h, con le prime 24 ore utilizzata come acclimatazione per il nuovo ambiente e la seconda 24h utilizzato per l'analisi dei dati. Il periodo di raccolta di dati si basa su quanto tempo lo sperimentatore vuole mantenere loro topi singolarmente ospitato e dipende l'approvazione etica animale. In alternativa, qualora esistano disposizioni, topi possono essere acclimatati nelle camere prima di essere messi nel sistema e collegati. Ogni camera è misurato circa una volta ogni 13 min quando è in uso un sistema di 12 camera. - Controllare regolarmente e monitorare i risultati ottenuti mentre i topi sono nel sistema per garantire il benessere degli animali e che vengono raccolti dati appropriato. Qualsiasi problema può essere in grado di essere identificati in questa fase e rettificato. Verifica su ogni mouse ogni mattina e la sera quando sono nel sistema.
- Controllare la scheda metabolica nella parte superiore della pagina del file di dati per i dati raccolti in tempo reale per ogni mouse per quanto riguarda le spese di consumo, RER e l'energia di ossigeno. Nel frattempo, le interruzioni del fascio e dati sui consumi alimentari può essere individuati nelle schede attività e alimentazione, rispettivamente. Verificare che il "O2 In" sta leggendo intorno 20.90-20,94, la "CO2 In" è intorno a 0,040 - 0,050, la RER è compreso tra 0,7 e 1, e la portata è costante a 0,5 - 0,6 L/min.
- A intervalli regolari, verifica che i topi hanno accesso a cibo e acqua e che stanno consumando ciascuno. Assicurarsi che essi non stanno dimostrando tutti i segni di afflizione come scavare la pavimentazione forata. Inoltre, monitorare i risultati che vengono visualizzati.
- Al completamento del tempo allocato sperimentale, selezionare "stop" dal menu di esperimento ed esportare i risultati (come file CSV, File > Esporta > generare soggetto CSV) per l'analisi.
- Controllare la salute dei topi, pesare e quindi tornare alla loro casa gabbie.
- Topi può essere ostile verso a vicenda dopo la separazione, quindi monitorare una volta che essi sono alloggiati insieme nuovamente.
- Smontare le gabbie, togliere gli alimenti in eccesso dalle tramogge e suggerimento qualsiasi feci, urina e cibo dalle gabbie. Immergere le bottiglie e sippers in soluzione diluita di T-bac, immergere e pulire gli altri componenti nella soluzione di candeggina diluita. Risciacquare con acqua pulita e lasciare all'aria secca.
- Calcolare i parametri metabolici con il software. Il software utilizza un numero di equazioni per fornire i dati finali di uscita4.
Per il calcolo della produzione di consumo e l'anidride carbonica dell'ossigeno: consumo di ossigeno: VO2 (LPM)= VioO2i - VoO2o; Produzione di anidride carbonica: VCO2 (LPM)= VoCO2o-VhoCO2i
Dove: Vi = il tasso di ventilazione ingresso (LPM), Vo = il tasso di ventilazione di uscita (LPM), O2i = la concentrazione di2 O all'ingresso, O2o = la concentrazione di2 O uscita, CO2i = CO2 concentrazione in ingresso, CO2o = la concentrazione di CO2 all'uscita.
Per il calcolo della RER: RER = VCO2 / VO2. Si noti che non è stato misurato l'ossidazione della proteina e quindi la RER non era adeguato per questo.
Per il calcolo del dispendio energetico: dispendio energetico: CV = 3.815 + 1.232* RER
Calore (Kcal/h)) = CV * VO2. Dove: CV è il potere calorifico (il rapporto tra il calore e il volume del consumo di ossigeno). Questo è derivato da "The elementi della scienza della nutrizione" definita la tabella di Lusk, composta da Graham Lusk.
Risultati
Visto nella Figura 3 vengono visualizzati una tipica variazione parametri di composizione corporea all'alta alimentazione grassa, come misurato tramite EchoMRI. Al basale non c'era alcuna differenza in qualsiasi parametro misurato (Figura 3A-F). Tuttavia, dopo appena 1 settimana di alimentazione alto di grassi, c'era un aumento significativo del peso corporeo, massa grassa e massa grassa nel gruppo HFD (Figura 3A,B,D). La grandezza delle differenze tra i due gruppi per queste misure hanno continuato ad aumentare sopra l'intervento dietetico di 3 settimana. Massa magra, acqua gratuita e contenuto di acqua totale (Figura 3,E,F) non hanno differito fra i gruppi in qualsiasi momento. Può anche essere visto che il chow ha alimentato i topi hanno continuati a mettere su peso durante il periodo di studio (Figura 3A) e che questo era dovuto un aumento in massa magra (Figura 3) piuttosto che una massa grassa aumentare (Figura 3B).
Come si può vedere nella Figura 4, tre settimane di alta alimentazione grasso portato ad una serie di modifiche, come rilevato nell'animale metabolica sistema di monitoraggio. VO2 quando non regolato per peso corporeo era significativamente più alta nel grasso alto più pesante ha alimentato i topi (Figura 4A). In particolare, normalizzazione del VO2 tramite due diversi fattori hanno provocato due esiti differenti. Normalizzazione di peso dal corpo intero ha portato a nessuna differenza in VO2 tra il cibo standard nutriti e alto contenuto di grassi ha alimentato i topi, mentre normalizzazione alla massa magra ha prodotto una differenza significativa (Figura 4B,C). Questi risultati dimostrano la normalizzazione dei dati2 VO dividendo per variabili massa significativamente influenzato i risultati, che si consiglia cautela nell'interpretazione VO2 dati quando è espresso in tale maniera. Per una descrizione dettagliata di come esprimere VO2 dati e gli effetti di normalizzare i parametri differenti vedono la discussione eccellente in Tschop, et al. 5 nella loro guida all'analisi del metabolismo energetico del mouse, Tschop e colleghi suggeriscono l'uso dell'analisi di co-varianza (ANCOVA) per interrogare statisticamente gli effetti del peso corporeo o della composizione corporea il dispendio energetico e i dati dell'assunzione di cibo . In questo caso, eseguendo un ANCOVA sui dati riportati nella Figura 4A, utilizzando il peso corporeo come covariata, rivela che nessuna differenza statisticamente significativa esiste tra cibo normale e HFD, indicando così che una volta contabilità per peso corporeo, non c'è Nessuna differenza nel consumo di ossigeno fra i gruppi. Questo risultato può essere facilmente visualizzato durante la stampa VO2 contro peso corporeo come un scatterplot come mostrato in Figura 4. Tramando VO2 contro peso corporeo (Figura 4) dimostra che i dati di2 VO si trovano su una linea comune in relazione al peso corporeo, con gli animali più pesanti che consumano più ossigeno. Di nota, tramando VO2 contro massa magra dimostra che i dati di2 VO si trovano su due linee distinte in relazione alla massa magra (Figura 4E).
RER era significativamente più bassa nell'alto contenuto di grassi ha alimentato i topi, che indica l'utilizzo di grasso sopra l'utilizzo di carboidrati quando hanno alimentato la dieta grassa alta (Figura 5A). Dispendio di energia (calore) senza normalizzazione è stato aumentato negli animali più pesanti, probabilmente a causa degli animali avendo tessuto più metabolicamente attivo (figura 5B), con questa differenza sta perdendo una volta normalizzato al peso corporeo (Figura 5). Si noti inoltre l'aumenti della VO2, RER e l'energia spesa nel ciclo scuro rispetto al ciclo di luce quando i topi sono più attivi. Queste differenze rappresentano classiche giornaliere alterazioni del metabolismo che si verificano nei topi. Mentre in questo esempio, abbiamo diviso i dati in blocchi di 12 h, divisione dei dati ulteriormente in epoche di tempo più piccoli può anche essere utile. Livelli di attività fisica sono anche un fattore che contribuiscono al dispendio energetico. Questi non erano differenti fra i gruppi, suggerenti che una diminuzione in movimento non era il driver del fenotipo obeso nell'alto contenuto di grassi ha alimentato i topi (Figura 5).
L'altro lato dell'equazione di equilibrio dell'energia è la quantità di energia che viene consumata ed entra nel corpo. Per guardare questo aspetto del metabolismo abbiamo analizzato la quantità di cibo che i topi hanno consumati mentre nell'animale metabolica sistema di monitoraggio. Come si può osservare in Figura 6A, i topi mangiavano la stessa quantità di cibo come misurato dal peso o quando normalizzato al peso corporeo (Figura 6B). (ANCOVA nuovamente può essere utilizzato per valutare l'impatto del peso corporeo sull'ingestione di cibo). Normalizzazione dell'assunzione di cibo al peso corporeo può essere un passo importante per considerare se il dispendio energetico inoltre è stato normalizzato per il peso, mantenendo così ogni lato dell'equazione dell'energia in equilibrio. Mentre i topi hanno mangiato la stessa quantità di cibo, è importante per tenere conto della densità di energia di ciascuna delle diete utilizzate. Quando tenendo conto di questo fattore, osserviamo i topi su HFD consumando più energia (Figura 6) e da questi esperimenti è probabile che questo sta guidando l'espressione fenotipica. Che è, poiché i topi stanno prendendo in più energia, ma essi non sono proporzionalmente spendere più energia, loro obesità può essere attribuito ad accumulo di energia.
Statistiche
Tutti i dati in questo documento sono presentati come media ± errore standard della media (SEM). Significatività statistica è stata fissata a p < 0.05. * indica p < 0,05, * * indica p < 0.01, * * * indica p < 0,001 e n = 6 per gruppo, se non diversamente indicato. Gli investigatori erano in grado di essere accecato per l'intervento di gruppo dietetico a causa di una differenza di colore delle diete. I topi sono stati scelti in quanto a quale dieta sono stati dati.

Figura 1 : Corretto posizionamento del mouse costi e portacampioni animale piccolo contenente topi all'interno l'analizzatore di composizione corporea. Per eseguire un test di sistema utilizzando uno standard di calibrazione (costi) o per la scansione dei topi all'interno il piccolo animale portacampioni, posizionate ognuno all'interno del portale del sistema. Le frecce rosse indicano il cilindro in cui i topi saranno contenuti entrando il cavalletto della macchina.

Figura 2 : Assemblaggio di singole camere. A) inserire la tramoggia di cibo al centro dell'equilibrio. B) inserire la piattaforma in ogni camera camera e posto sopra la tramoggia. C) mettere topi nelle camere individualmente e fissare il coperchio. D) posizionare la bottiglia d'acqua e fissare.

Figura 3 : Analisi della composizione corporea oltre 3 settimane di una dieta grassa alta. A) del peso corporeo, B) massa, del grasso C) massa magra, D) percentuale in massa di grasso, E) libero contenuto d'acqua, e F) totale contenuto d'acqua. Cerchi rappresentano la dieta normale del cibo, piazze HFD. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : Parametri metabolici ottenuti dagli esperimenti sugli animali a sistema monitoraggio metabolico dopo 3 settimane delle rispettive diete. Topi sono stati alloggiati negli alloggiamenti per 48 h con le prime 24 ore in qualità di familiarizzazione. I dati ottenuti dalla seconda 24 h è stati analizzati e presentati in queste figure. A) 2 tassi di VO crudo, B) VO2 normalizzato al peso corporeo C) VO2 normalizzata alla massa magra, D) scatterplot per non rettificati VO2 (periodo totale 24 h) a corpo pesa, t e E) non rettificati VO2 a massa magra. A-C Barre bianche rappresentano la dieta normale del cibo, barre nere rappresentano dieta grassa alta. D-E Cerchi rappresentano la dieta normale del cibo, piazze HFD. Clicca qui per visualizzare una versione più grande di questa figura.
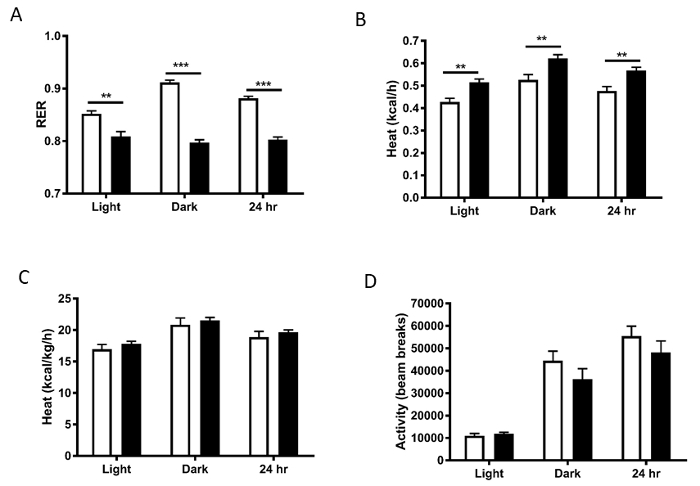
Figura 5 : A) rapporto di cambio respiratorio (RER), B) calore (dispendio energetico), e C) calore normalizzato al peso corporeo. D) livelli di attività calcolato come la somma del deambulatorio X e Y del fascio fascio interruzioni e Z. Barre bianche rappresentano la dieta normale del cibo; barre nere rappresentano HFD.

Figura 6 : I dati dell'assunzione di cibo ottenuto nel sistema per la 24h di finale. A) l'ingestione di cibo in grammi, B) l'ingestione di cibo normalizzato al peso corporeo e C) l'apporto energetico calcolato. n = 4-5 (3 topi erano escluso dovuto fare un grande pasticcio con il loro cibo). Barre bianche rappresentano la dieta normale del cibo; barre nere rappresentano HFD. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Fasi critiche
I protocolli descritti nel presente documento forniscono un esempio di modi in cui composizione corporea misura e vari parametri metabolici nei topi utilizzando un analizzatore di composizione corporea e un animale metabolico, sistema di monitoraggio. Per entrambe le tecniche, è criticamente importante garantire che le macchine stanno lavorando in modo ottimale, e per fare questo, è imperativo che il ricercatore esegue un test di sistema per l'analizzatore di composizione corporea e calibra una composizione di gas noto per il metabolico animale monitoraggio sistema prima dell'uso dell'apparecchiatura. Ciò garantirà una maggiore coerenza dei risultati e la possibilità di rilevare potenziali problemi con le macchine.
Il modo in cui i dati vengono normalizzati per gli esperimenti di monitoraggio animali metabolici è anche di vitale importanza per garantire la validità dei risultati ottenuti dalla tecnica. Come indicato nei nostri risultati rappresentativi (Figura 4A-E) VO2 possono essere segnalati in un certo numero di modi diversi: il tasso assoluto (L/min), riguardante la massa del corpo del mouse (mL/kg * min), o rispetto alla massa magra del corpo (mL/kgLBM * min) se i dati sono disponibili (ad esempio ottenuti da un analizzatore di composizione corporea). A seconda del fenotipo, può essere più appropriato normalizzare i valori di un particolare modo per escludere eventuali potenziali bias. Ad esempio, se un animale ha aumentato la massa del corpo, hanno più tessuto che è disponibile e in grado di consumare ossigeno e naturalmente il loro dispendio energetico è più alto. Normalizzando al corpo totale massa potrebbe non essere la migliore opzione come esso sarà pregiudizi verso l'osservazione di una diminuzione nel consumo di ossigeno per unità di massa, anche se il consumo di ossigeno dei tessuti non può essere diverso. Come alternativa alla normalizzazione al peso corporeo, uno può normalizzare la massa magra del corpo del mouse. Come magra massa è principalmente responsabile del consumo di ossigeno, e massa magra in genere rimangono invariate o solo modestamente differente fra i gruppi sperimentali, normalizzazione in questo modo può essere un modo più rappresentativo di esprimere dati2 VO. Dovrebbe essere notato che il vano di massa magro è composto di molti tessuti differenti, tutte con differenti tassi metabolici, e di conseguenza normalizzazione in questo modo può non essere appropriato o fornire qualsiasi intuizione quale componente di massa magra è che stimolano la cambiamento. Inoltre, esclude il contributo del componente di massa grasso sul metabolismo.
Dato questi problemi, un metodo alternativo basato su statisticamente è stato anche proposto5,6. Analisi della covarianza (ANCOVA) è un test statistico che permette il confronto di una variabile (ad esempio, il dispendio energetico) in più gruppi durante la correzione di altri fattori o variabili definite covariate. In questo modo fattori peso corporeo, massa grassa e massa magra possono essere incluse come variabili che influenzano il dispendio energetico, ma anche questo metodo ha una propria ipotesi specifiche6, incluso il fatto che l'utilizzo di più variabili in ANCOVA è probabile che invalidarla a meno che le variabili sono indipendenti uno da altro. Sembra che ci sia alcun modo singolo perfetto o universalmente concordato per normalizzare e VO2 o energia spesa dati attuali, può essere opportuno visualizzare e presentare i dati in un certo numero di modi per dare l'immagine più chiara del fenotipo al lettore. Livelli di attività fisica possono aumentare il consumo di ossigeno, e così negli animali che hanno fenotipi di attività (un aumento o diminuzione), può anche essere necessario di conto/normalizzare per modifiche in movimento per determinare se questo può spiegare parzialmente o completamente conto per qualsiasi cambiamento nella VO2.
Le modifiche e la risoluzione dei problemi
I risultati rappresentativi visualizzati in questo protocollo sono stati ottenuti da esperimenti condotti a una temperatura di 21-22 ° C. La zona di thermoneutral di un mouse è circa 30 ° C, quindi in una tradizionale casa di animale con la sua temperatura impostata su 20-22 ° C per il comfort umano, un mouse è messo sotto stress termico. Per contrastare ciò, non tremare termogenesi è attivata a queste temperature più fredde, risultante in un fino a un aumento di 2 volte nel dispendio energetico tra topi ospitato a 20 ° C rispetto a quelli alloggiati a 30 ° C7. La custodia ambientale dei topi è una considerazione importante per questi esperimenti, come è stato dimostrato che alloggiamento dei topi a thermoneutrality può potenziare lo sviluppo di alcune condizioni come aterosclerosi8 e alto contenuto di grassi indotta da dieta la steatosi epatica non alcolica (NAFLD) patogenesi9. Temperatura ambientale è quindi anche una considerazione importante quando conducendo esperimenti in un animale metabolico, sistema di monitoraggio come un fenotipo può essere presente a determinate temperature, ma non in altri, che potrebbe puntare a un potenziale meccanismo di azione. Un tale scenario potrebbe essere un fenotipo che coinvolge l'attivazione di grasso beige reclutato per cui una quantità maggiore di questo tessuto permette un maggiore incremento della termogenesi sotto raffreddamento condizioni10. Così, può essere necessario modificare l'ambiente set-up che è stato descritto in questi esperimenti attuali e per condurre esperimenti alle temperature ambientali multipli per ottenere una rappresentazione accurata dello stato metabolico vero del modello. Risoluzione dei problemi a causa di errori tecnici, potrebbe essere necessario contattare i produttore direttamente per istruzioni. Se ci sono problemi con questo tipo di analizzatore di composizione corporea, che si raccomanda di eseguire un test di ripetere scansioni, che corre 25 scansioni contro il costo. Queste informazioni vi serviranno l'azienda per la diagnostica. Allo stesso modo con il sistema di monitoraggio degli animali metabolico, se si verificano problemi, raccogliere i file di dati dall'ultima volta che il sistema funzionava bene e i file da quando i problemi hanno presentato affinché supporto può fare una diagnosi probabile.
Limitazioni
Mentre l'analizzatore di composizione corporea fornisce dati eccellenti in accumulo di grasso del corpo intero, non permette per la determinazione di depositi adiposi regionali. Questo è importante nel campo della ricerca dell'obesità, come non tutti i grassi sono lo stesso, con la posizione che ha accumulato il grasso e le sue proprietà funzionali essendo particolarmente importante. Infatti, gli effetti protettivi di depositi di grasso sottocutanei (o grasso metabolicamente sano) sono stati descritti11. Micro-tomografia (micro-CT) in grado di discriminare tra grasso sottocutaneo e viscerale12, come può la formazione immagine a risonanza magnetica (MRI) analisi13. Utilizzo di queste tecniche possa fornire ulteriori informazioni sul sito di accumulo adiposo. L'animale metabolica anche il sistema di monitoraggio ha i suoi limiti. Mentre il dispendio energetico giornaliero totale può essere misurata, il sistema non è in grado di discernere tra le diverse componenti che compongono il dispendio energetico. Un'ulteriore limitazione del sistema è che è possibile che l'obesità può svilupparsi senza una diminuzione misurabile nel dispendio energetico rilevato tramite questi tipi di sistemi, anche indipendentemente da alterazioni di assunzione di cibo/energia. Studi hanno dimostrato che piccole riduzioni nel dispendio energetico, che sono abbastanza sostanziale per causare peso significativo guadagno a lungo termine, non può essere rilevato robustamente in tali sistemi metabolici oltre il breve termine14,15, 16. Mentre abbiamo usato una n di 6 per gruppo nello studio corrente per dimostrare questa metodologia come uno studio di esempio, per rilevare piccole differenze nel dispendio energetico che potrebbe contribuire all'obesità probabile richiede molti più topi5. Avanzamenti nella risoluzione di rilevazione in questi sistemi e la possibilità di eseguire questi tipi di studi per un periodo più lungo saranno di aiuto in grado di rilevare queste piccole ma significative modifiche. Per quanto riguarda la misurazione dell'ingestione di cibo, in genere abbiamo osservato che l'ingestione di cibo 24h in topi ospitato all'interno dell'animale metabolica, sistema di monitoraggio è inferiore rispetto a quanto sarebbe essere osservato nella gabbia a casa, probabilmente dovuto i motivi discussi sopra. Pertanto, oltre a monitorare l'assunzione di cibo in questo sistema, valutiamo inoltre l'ingestione di cibo nelle gabbie casa dei topi. Mentre questo può essere fatto solo in una situazione dove i topi da particolari gruppi sperimentali sono alloggiati separatamente, ha il vantaggio di permettere vicino a valutazione giornaliera continua. L'investigatore semplicemente pesa la quantità di cibo nella tramoggia a una determinata ora del giorno, sempre pari al cibo sparso in tutta la gabbia e poi si divide la quantità totale di cibo consumato per il numero di topi presenti nella gabbia.
Applicazioni future
Mentre all'interno di questa recensione abbiamo usato l'obesità acquisita tramite grasso alta alimentazione come un esempio di uno stato di malattia dove la misurazione composizione corporea e parametri metabolici sono utili, che l'uso di questa apparecchiatura è lontano da limitata a questo campo di ricerca. L'utilizzo di queste tecniche è prezioso anche quando lo studio di malattie come il diabete, malattie cardiovascolari, sarcopenia relativo all'età, fragilità, cachessia neoplastica, distrofie muscolari e lipodistrofia. Mentre i costi iniziali di acquisto tale infrastruttura è notevole, la capacità di utilizzare l'apparecchio in più e diversi campi di ricerca medica mitiga questo costo iniziale. Inoltre, in corso reagenti e materiale di consumo costa è minime per queste macchine; Tuttavia, manutenzione preventiva e la manutenzione deve essere considerati e preventivati per.
Proprio come massa magra ottenuta tramite analisi della composizione corporea può essere un fattore di normalizzazione importante per derivata dall'animale metabolica sistema di monitoraggio del consumo di ossigeno, determinazione della massa magra utilizzabile anche per normalizzare i dosaggi test di droga. Per esempio, in studi metabolici, è all'ordine del giorno per eseguire un test di tolleranza al glucosio orale o intraperitoneale (GTT), o una prova di tolleranza di intraperitoneale dell'insulina (ITT). Questi test esaminano la possibilità di un mouse per smaltire un carico di glucosio o di rispondere all'insulina. Alterazioni nei livelli di glucosio nel sangue in risposta a questi test fornisce informazioni sul livello di glucosio del corpo intero e la tolleranza dell'insulina nel modello. Tradizionalmente, il bolo di glucosio e di insulina somministrato in questi test viene dosato secondo il peso del corpo del mouse. Tuttavia, come modelli di obesità accumulano massa grassa massa magra, dosaggio al peso corporeo potrebbe polarizzare il modello più pesante verso l'intolleranza al glucosio in una GTT come ricevono più glucosio. Questo è dovuto al fatto che i fegato, muscolo scheletrico e nel cervello, organi che smaltire la maggior parte del glucosio in stato post-prandial17, sono componenti di misura di massa magra e raramente o leggermente modificare nella maggior parte dei modelli. Al contrario, in un ITT quando dosato al peso corporeo, un modello più pesante che riceverebbe più insulina potrebbe essere più sensibile al glucosio abbassa gli effetti di insulina puramente perché ha ricevuto una quantità maggiore. Pertanto, se il ricercatore ha accesso ai dati di composizione del corpo, la massa magra può essere la misura più appropriata, in contrasto con la massa del corpo intero, per tale dosaggio calcoli18. Prendendo questo ulteriore, magri massa dati ottenuti dall'analisi della composizione corporea potrebbero anche essere utilizzati per dosare farmaci sperimentali, se l'esigenza è nata per tenere conto di massa magra tale esclusione della massa grassa. Un'altra applicazione dell'animale metabolica sistema di monitoraggio che non è stato discusso o dimostrato in questo manoscritto è associare che una pedana mobile motorizzata allegata al sistema affinché i parametri metabolici descritti nel presente documento può anche essere misurata durante esercizio.
Le procedure descritte in questa recensione possono essere utilizzate per caratterizzare la composizione corporea e vari parametri metabolici nei topi. Queste misure sono applicabili a una vasta gamma di campi di ricerca e possono fornire informazioni importanti per la caratterizzazione di un fenotipo. I dati derivati da questi metodi possono anche fornire prove verso meccanismi di fondo un particolare fenotipo metabolico di guida. Ulteriore sviluppo e perfezionamento di queste tecnologie consentirà ai ricercatori di avanzare le loro scoperte verso i risultati terapeutici.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Ringraziamo il personale dalla ricerca medica Alfred e team formazione Precinct Animal Services (AS AMREP) per la loro assistenza e cura i topi utilizzati in questo studio e per il sostegno del regime di supporto dell'infrastruttura operativa dello stato vittoriano Governo.
Materiali
| Name | Company | Catalog Number | Comments |
| 4 in 1 system | EchoMRI | 4 in 1 system | Whole body composition analyser |
| Canola oil test sample (COSTS) | EchoMRI | Mouse-specific (contact company for cat number) | |
| Animal specimen holder | EchoMRI | 103-E56100R | |
| Delimiter | EchoMRI | 600-E56100D | |
| 12 chamber system | Columbus Instruments | Custom built | Metabolic Caging System; includes control program |
| Drierite | Fisher Scientific | 238988 | CLAMS consumable |
| Calibration gas tank | Air Liquide | Mixed to order | Gas calibration (0.5% CO2, 20.5% O2, balance nitrogen). |
| Normal chow diet | Specialty Feeds | Irradiated mouse and rat diet | |
| High fat diet | Specialty Feeds | SF04-001 | |
| Balance | Mettler Toledo | PL202-S | Balance for weighing mice |
| TexQ Disinfectant spray | TexWipe | ||
| Hydrogen Peroxide cleaning solution | TexWipe | TX684 |
Riferimenti
- Chen, W., Wilson, J. L., Khaksari, M., Cowley, M. A., Enriori, P. J. Abdominal fat analyzed by DEXA scan reflects visceral body fat and improves the phenotype description and the assessment of metabolic risk in mice. Am J Physiol Endocrinol Metab. 303 (5), E635-E643 (2012).
- Kovner, I., Taicher, G. Z., Mitchell, A. D. Calibration and validation of EchoMRI whole body composition analysis based on chemical analysis of piglets, in comparison with the same for DXA. Int J Body Compos Res. 8 (1), 17-29 (2010).
- EchoMRI. Software User Manual: Whole body composition analyzer. , (2016).
- Columbus Instruments. Oxymax for Windows User Manual. , September (2014).
- Tschop, M. H., et al. A guide to analysis of mouse energy metabolism. Nat Methods. 9 (1), 57-63 (2011).
- Speakman, J. R. Measuring energy metabolism in the mouse - theoretical, practical, and analytical considerations. Front Physiol. 4, (2013).
- Swoap, S. J., et al. Vagal tone dominates autonomic control of mouse heart rate at thermoneutrality. Am J Physiol Heart Circ Physiol. 294 (4), H1581-H1588 (2008).
- Tian, X. Y., et al. Thermoneutral housing accelerates metabolic inflammation to potentiate atherosclerosis but not insulin resistance. Cell Metab. 23 (1), 165-178 (2016).
- Giles, D. A., et al. Thermoneutral housing exacerbates nonalcoholic fatty liver disease in mice and allows for sex-independent disease modeling. Nat Med. 23 (7), 829-838 (2017).
- Lee, M. W., et al. Activated type 2 innate lymphoid cells regulate beige fat biogenesis. Cell. 160 (1-2), 74-87 (2015).
- Kusminski, C. M., et al. MitoNEET-driven alterations in adipocyte mitochondrial activity reveal a crucial adaptive process that preserves insulin sensitivity in obesity. Nat Med. 18 (10), 1539-1549 (2012).
- Judex, S., et al. Quantification of adiposity in small rodents using micro-CT. Methods. 50 (1), 14-19 (2010).
- Chaurasia, B., et al. Adipocyte ceramides regulate subcutaneous adipose browning, inflammation, and metabolism. Cell Metab. 24 (6), 820-834 (2016).
- Matthews, V. B., et al. Interleukin-6-deficient mice develop hepatic inflammation and systemic insulin resistance. Diabetologia. 53 (11), 2431-2441 (2010).
- Tschop, M., Smiley, D. L., Heiman, M. L. Ghrelin induces adiposity in rodents. Nature. 407 (6806), 908-913 (2000).
- Garcia, M. C., et al. Mature-onset obesity in interleukin-1 receptor I knockout mice. Diabetes. 55 (5), 1205-1213 (2006).
- Kowalski, G. M., Bruce, C. R. The regulation of glucose metabolism: Implications and considerations for the assessment of glucose homeostasis in rodents. Am J Physiol Endocrinol Metab. 307 (10), E859-E871 (2014).
- McGuinness, O. P., Ayala, J. E., Laughlin, M. R., Wasserman, D. H. NIH experiment in centralized mouse phenotyping: the Vanderbilt experience and recommendations for evaluating glucose homeostasis in the mouse. Am J Physiol Endocrinol Metab. 297 (4), E849-E855 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon