Method Article
Composición corporal y análisis jaulas metabólico en ratones de reserva grasa alta
En este artículo
Resumen
Este protocolo describe el uso de un analizador de composición corporal y el sistema metabólico de control animal para caracterizar la composición corporal y parámetros metabólicos en ratones. Un modelo de obesidad inducido por la alimentación alta en grasas se utiliza como un ejemplo para la aplicación de estas técnicas.
Resumen
Alteraciones en la composición corporal (masa grasa o magra), parámetros metabólicos tales como consumo de oxígeno corporal total, gasto de energía y utilización de sustrato y conductas tales como el consumo de alimentos y actividad física pueden proporcionar información importante con respecto a los mecanismos subyacentes de la enfermedad. Dada la importancia de la composición corporal y metabolismo para el desarrollo de la obesidad y sus secuelas posteriores, es necesario hacer medidas precisas de estos parámetros en el marco de la investigación preclínica. Avances en la tecnología en las últimas décadas han hecho posible obtener estas medidas en modelos de roedores de una manera no invasiva y longitudinal. En consecuencia, estas medidas metabólicas han demostrado ser útiles al evaluar la respuesta de manipulaciones genéticas (ratones por ejemplo transgénicos o knockout, viral de la precipitación o la sobreexpresión de los genes), compuesto de drogas experimentales proyección y dietéticos, intervenciones de actividad física o conductuales. Adjunto, describimos a los protocolos utilizados para medir la composición corporal y parámetros metabólicos usando un animal control en ratones alimentados con dieta grasa, alimentados con chow y alta.
Introducción
Metabolismo es la base de muchos aspectos de celular normal, el órgano y la fisiología de todo el cuerpo. En consecuencia, en el marco de diversas patologías, alteraciones del metabolismo pueden contribuir directamente a la condición subyacente o pueden ser afectados negativamente como un efecto secundario de la patología. Tradicionalmente, investigación metabólica y estudios de balance de energía se han concentrado en el campo de la obesidad y condiciones relacionadas tales como resistencia a la insulina, prediabetes, diabetes, intolerancia a la glucosa y enfermedad cardiovascular. Esta investigación se justifica dada la prevalencia creciente de tales condiciones en todo el mundo y el individuo, sociedad, y costos económicos causan estas condiciones. Como tal, el desarrollo de estrategias de prevención y terapéutica nueva obesidad objetivo es una meta constante en laboratorios de investigación alrededor del mundo y modelos preclínicos murinos son confiar pesadamente en estos estudios.
Ratones de peso proporciona una evaluación confiable de la pérdida o ganancia de peso, no proporciona un desglose de los diferentes componentes que conforman la composición de todo el cuerpo (masa grasa, masa magra, agua libre así como otros componentes tales como piel y garras). El pesaje de los cojines gordos en la terminación de los estudios una vez que el ratón ha fallecido proporciona una medida exacta de diferentes depósitos de grasa pero sólo puede proporcionar datos para un momento único. Como consecuencia, a menudo es necesario inscribirse varias cohortes para investigar el desarrollo de la obesidad en el tiempo, significativamente mayor número de animales, tiempo y costos. El uso de absorciometría de rayos x de energía dual (DEXA) proporciona un enfoque para evaluar el contenido de tejido magro y grasa del cuerpo y permite al investigador obtener datos de forma longitudinal. Sin embargo, el procedimiento requiere ratones anestesiados1y repetidos episodios de anestesia pueden afectar la acumulación de tejido adiposo o afectar otros aspectos de la regulación metabólica. EchoMRI utiliza la relaxometría de resonancia magnética para medir la masa grasa y magra, agua libre y agua total contenido. Esto es factible debido a la creación de contraste entre los componentes de tejidos diferentes, con diferencias en la duración, amplitud y distribución espacial de radiofrecuencias generadas que permiten la delimitación y cuantificación de cada tipo de tejido. Esta técnica es ventajosa ya que es no invasivo, rápido, simple, no requiere anestesia ni radiación y, lo importante, ha sido validada positivamente contra análisis químico2.
Una consideración clave de la obesidad y la investigación relacionada es la ecuación de balance de energía. Mientras que la acumulación de grasa es más complicada que puramente energía (alimentación) versus energía hacia fuera (gasto de energía), son factores vitales para poder medir. Gasto energético diario es la suma de cuatro componentes: (1) gasto de energía basal (tarifa metabólica de reclinación); (2) el gasto de energía debido al efecto térmico de consumo de alimentos; (3) la energía requerida para la termorregulación; y (4) la energía se gasta en la actividad física. Como gasto de energía genera calor, midiendo la producción de calor por un animal (conocido como calorimetría directa) puede utilizarse para evaluar el gasto de energía. Alternativamente, la medición de inspirado y expirado las concentraciones de O2 y CO2, lo que para la determinación de consumo de todo el cuerpo O2 y CO2 producción, puede ser utilizada como una forma de medir indirectamente (indirecta Calorimetría) producción de calor y, en consecuencia, calcular el gasto de energía. Un incremento en la ingestión de alimentos o una disminución en el gasto de energía se predispone a ratones a aumento de peso y observaciones de los cambios en estos parámetros pueden proporcionar información útil de probables mecanismos de acción en modelos particulares de la obesidad. Un parámetro metabólico relacionado de interés es la relación de intercambio respiratorio (RER), un indicador de la proporción de sustrato/combustible (es decir, carbohidratos o grasa) que sufre metabolismo y se utiliza para producir energía. En consecuencia, medición del consumo de alimentos (energía consumida) combinado con niveles de actividad física, el consumo de2 O, RER y gasto de energía puede proporcionar una comprensión amplia del perfil metabólico de un organismo. Un método para reunir estos datos es utilizar un animal de laboratorio control (almejas), que se basa en el método de calorimetría indirecta para medir el gasto energético y tiene la capacidad añadida de determinación de los niveles de actividad física (viga se rompe) y la ingestión de alimentos mediante escalas incorporado en la cámara de medición.
En este protocolo nos proporcionan una descripción directa de la utilización de un analizador de composición corporal para evaluar composición corporal en ratones y un sistema de control animal metabólico para medir aspectos del metabolismo. Consideraciones y limitaciones de estas técnicas se discutirán y sugeridos métodos de análisis, interpretación y representación de datos.
Protocolo
Todos los experimentos descritos fueron aprobados por el Alfred médico investigación educación recinto Animal Comité de ética (AMREP AEC) y ratones recibieron atención humana en línea con la salud nacional y el Consejo de investigación médica (NHMRC) de Australia directrices sobre Experimentación con animales. Los animales fueron administrados su prescripción de dieta y agua ad libitum y ubicado en un entorno de temperatura controlada (~ 21-22 ° C) con una luz de 12 h y 12 h oscuridad ciclo. Semana siete ratones machos viejos (en un fondo de C57Bl/6J) fueron alimentados con cualquier dieta chow normal regular (14.3 MJ/kg de contenido de energía, compuesto por 76% de kJ de hidratos de carbono, grasa 5%, 19% de proteína; véase tabla de materiales) o para el grupo de alimentación grasa alto, un alto grado en grasas de la dieta () (HFD) energía contenido de 19 MJ/kg, que consta de 36% de kJ de hidratos de carbono, 43% de grasa, 21% de proteína, especialidad alimenta) durante 3 semanas. Peso corporal y las medidas de composición corporal utilizando una máquina de EchoMRI se realizaron semanalmente mientras que el análisis de control metabólico ocurrió en una almejas después de 3 semanas de la dieta.
1. procedimiento de analizador de composición corporal
Nota: Para funcionar de forma óptima, el EchoMRI 4-en-1 utilizado en este protocolo se debe contener dentro de una habitación donde la temperatura del aire es estable y no varía. Idealmente esto debe ser constantemente monitoreado. Movimiento de la máquina y las interrupciones para poder también debe ser evitado si es posible. Si se ha interrumpido el suministro de energía y el sistema debe ser reiniciado, permiten al menos 2-3 h para la máquina se caliente antes de usarlo otra vez. Antes de comenzar, asegúrese de que usted está usando equipo de protección personal correcto.
- Antes de la exploración de ratones, realizar una prueba del sistema en el equipo de analizador de composición corporal. Esto implica el uso de un estándar de calibración (que se refiere como una muestra de prueba de sistema de aceite canola (costes)) para probar la precisión del instrumento y asegurar que no ha habido deriva en su exactitud.
- Abra el software de sistema, luego haga clic en el botón de barra de herramientas de prueba del sistema o pulsando "Alt + Y" al mismo tiempo.
- Antes de la prueba del sistema se lleva a cabo por el equipo, espere un recordatorio verificar que los gastos correctos (en este caso los costos específicos de ratón) se ha colocado en el pórtico del sistema ( figura 1). Una vez confirmado que este es el caso, aceptar para proceder con la prueba, que tendrá unos minutos para completar.
- Una vez que ha pasado la prueba del sistema, seguir con la exploración.
- Si la prueba del sistema falla, repita la prueba de sistema.
- Si la máquina continúa fuera de rango (lo que indica que se ha producido una desviación), la calibración puede ser necesaria para rectificar la situación. Esto completa siguiendo las instrucciones o como se describe en el manual de usuario suministrado en el momento de la compra. Si el problema persiste, compruebe el manual3 o informar el problema al equipo de soporte del fabricante y buscar más instrucción.
- Coloque los ratones en un porta espécimen animal pequeño (cilindro largo) para evitar que mientras que en la máquina. Para ello, coloque el soporte horizontal, coger el ratón e introduzca en la abertura de la cabeza del cilindro primero. Lentamente y con cuidado llevar el soporte a la posición vertical para que el ratón está en la parte inferior del cilindro y listo para el análisis.
- Una vez dentro del sujetador, inserte un delimitador para limitar el movimiento del ratón durante el período de medición. En algunas circunstancias, con los ratones extremadamente activos, puede ser necesario sujetar el delimitador en el lugar con la punta del dedo.
Nota: Familiarizar a los ratones con la colocación de los soportes de la muestra antes de su análisis inicial para reducir el estrés. El uso de un soporte de espécimen de animal color rojo también puede reducir la respuesta de estrés potencial, como los ratones sienten que están en la oscuridad. - Dentro del software, seleccionar una carpeta (barra de herramientas de carpeta) para guardar los datos y crear un nombre de archivo.
- Si es necesario, reducir la cantidad de ruido en las mediciones de grasa y magras incrementando el número de acumulaciones primarios de la exploración. Una vez que se inicia el software, las acumulaciones de primarias se establece en un valor predeterminado recomendado para uso diario general; a menos que haya una razón específica para cambiar estos parámetros, la configuración predeterminada le dará el nivel necesario de precisión a los usuarios.
- Si no está interesado en la obtención de datos de agua libre y agua total, apague la etapa agua seleccionando la ficha para decir que no. Esto reducir significativamente la duración de la exploración y mejorar el rendimiento.
- Iniciar la exploración seleccionando "start scan" o pulsando F5 en el teclado. Ingrese todos los datos relevantes sobre el animal (por ejemplo, animal ID, masa del cuerpo, etcetera.) y pulse 'Aceptar' o F5 para iniciar la exploración, que tendrá aproximadamente 1 minuto.
- Después de que los datos han sido obtenidos, desmonte la sujeción del animal con el ratón de la máquina y colocar la espalda del animal en su jaula. Una vez que todos los animales han sido explorados, exportar los datos para su análisis posterior y la colación.
- Antes y después del uso, limpie bien los titulares de los animales según las instrucciones del fabricante. Como estos soportes están construidos de plástico acrílico, alcohol isopropílico y alcohol etílico deben evitarse ya que pueden causar agrietamiento de los titulares o rápido deterioro del soporte, lo que aumenta la probabilidad de rotura. En su lugar, use una solución de agua tibia para lavar platos o, si más desinfectante es necesario, utilizar F10 (en una dilución de 1:125) u otros aerosoles desinfectantes o de limpieza (véase Tabla de materiales) y luego limpie.
2. metabólico Animal procedimiento del sistema de monitoreo
Nota: El sistema requiere ~ 2 h para calentar y estabilizar. Si la máquina se ha apagado, se debe encender para permitir que la célula de Zirconia para calentarse a 725 º C. También ponemos generalmente ratones en el analizador de composición corporal un día antes de entrar en el animal, sistema de vigilancia para evitar problemas con la tensión de retención.
- Asegúrese de que el ordenador conectado al sistema de vigilancia animal esté encendido y abra el programa de control. Seleccione la opción "Oxymax utilidad" en el menú herramientas para iniciar las bombas.
- Botellas de agua se llenan de agua apropiado, pesar inspeccionar la salud de los ratones y organizar la comida. Si en el sistema de medición de la ingestión de alimentos, considere pulverización la comida. Llenar las tolvas de alimentación presionando el alimento de plataforma y punta con resorte en la tolva. Asegúrese de que la tolva de alimentos y la botella de agua son completamente llenos para asegurar que hay suficiente comida y agua para durar el tiempo experimental.
- Comprobar el estado del drierite/secante; Si se utiliza un indicador de color, debe ser azul y por lo tanto seco, pero si es rosa, tiene absorción de humedad importante y debe ser reemplazado o recargar.
- Comprobar el estado de la trampa de amoniaco y soda cal y cámbielo si es necesario. Si se conecta la trampa de amoniaco dos a la vez, cuando la segunda trampa muestra signos de un cambio de color, vuelva a colocar el primero de ellos. Un aumento en el desplazamiento de CO2 también puede significar la necesidad de reemplazar la cal de soda.
Nota: Desecante se puede secar en un horno y reutilizado, sin embargo seguimos las recomendaciones del fabricante del sistema para utilizar fresco cada vez. - Montar las cámaras. Para hacer esto, coloque la tolva de alimento en el equilibrio, luego coloque la cámara en la parte superior con la plataforma perforada que se convierte en el piso de la cámara que se inserta. Cuidadosamente colocar el ratón en la cámara y conecte la tapa del sistema con la parte delantera y clips de nuevo y asegure antes de sujeción y posicionamiento de la botella de agua. Como medida de precaución, vuelva a verificar todas las tapas de cámara, ratones y agua (figura 2A-D).
Nota: Dependiendo del tamaño de los ratones siendo examinado, puede ser necesario ajustar la altura de los espacios por encima de la tolva de alimentos para que los ratones tienen acceso a los alimentos pero no hay suficiente espacio en el que puede dormir directamente sobre el comedero. - Pues es recomendable calibrar los sensores de gas antes de cada experimento, calibrar el sistema.
- Utilice un gas de composición conocida (0,5% de CO2, 20,5% O2, balance de nitrógeno). Conecte el tanque de gas de calibración para el sistema a través de un regulador y manguera. Activar y asegurar la presión de salida del tanque es lectura 5-10 psi.
Nota: Algunos sistemas tendrán un segundo tanque, manguera y regulador para el uso de nitrógeno puro como gas "offset". El sistema que opera en lugar de otro utiliza cal sodada para generar aire libre de CO2 . - Siga los procedimientos para calibrar el O2 y CO2 sensores. Seleccione "calibración" en el menú herramientas y calibrar secuencialmente el O2 y CO2. Antes de calibrar Asegúrese que 1) de la muestra y los flujos de referencia son LPM 0,400, 2) la temperatura del sensor2 O Zirconia es 725 ° C (± 1 ° C), 3) la muestra y referencia secador y bombas de aire están en, y 4) el gas de calibración está conectado y encendido.
- Si es necesario, durante la calibración del sensor de O2 , ligeramente ajusta el offset en el frente del sensor de oxígeno de zirconia para alcanzar un valor O2 cociente de 1.0000 (± 0.0002). Esto es para asegurar que está dentro de límites aceptables (resaltados en verde font en la pantalla de software en la pantalla del ordenador).
- Después de éxito O2 y CO2 calibración del sensor, desconecte el cilindro de gas de calibración y desconecte la manguera del regulador. Después de la calibración, O2 para el aire de referencia (atmosférico) debe leer 20.92 (± 00.02). Si la calibración está fuera de tolerancia, repita y se refieren a la solución de problemas guia del fabricante. En caso contrario, póngase en contacto con el fabricante para obtener más instrucciones.
- Utilice un gas de composición conocida (0,5% de CO2, 20,5% O2, balance de nitrógeno). Conecte el tanque de gas de calibración para el sistema a través de un regulador y manguera. Activar y asegurar la presión de salida del tanque es lectura 5-10 psi.
- Proceda con el montaje experimental. Seleccione "Abrir archivo experimental" el experimento. Seleccione la plantilla adecuada (por ejemplo, ratón). Bajo "configuración" en el menú de experimento definir los parámetros del experimento que debe ser registrado (por ejemplo, ratón ID, peso, grupo, etc.) deseleccionar cualquier cámaras no esté en uso y seleccione la ubicación para el experimento para salvarse.
- Asegúrese de que las escalas han sido taradas si medir la ingestión de alimentos y comenzar la captura de datos seleccionando "ejecutar" en el menú de experimento. Datos se capturan durante diferentes periodos de tiempo dependiendo del fenotipo, las pautas de aislamiento de animales y uso del sistema.
Nota: En nuestras manos, el experimento es habitualmente ejecute durante 48 h, con las primeras 24 h utilizada como aclimatación al nuevo entorno y la segunda 24 h utilizado para análisis de datos. El periodo de recolección de datos se basa en cuánto el investigador desea mantener sus ratones solo vivienda y depende de la aprobación de la ética animal. Por otra parte, si existen disposiciones, ratones pueden aclimatados en las cámaras antes de ser colocado en el sistema y conectados. Cada cámara mide aproximadamente una vez cada 13 minutos cuando se utiliza un sistema de 12 cámaras. - Controlar regularmente y controlar los resultados que se obtienen mientras que los ratones están en el sistema para asegurar el bienestar de los animales y que se está recogiendo los datos pertinentes. Cualquier tema puede ser identificado en esta etapa y rectificado. Verificación de cada ratón cada mañana y tarde cuando están en el sistema.
- Compruebe la ficha metabólica en la parte superior de la página de archivo de datos para los datos recogidos en tiempo real para cada ratón en lo que respecta a los gastos de consumo, el RER y la energía del oxígeno. Mientras tanto, haz pausas y datos de consumo de alimentos pueden ser localizados en las fichas de actividad y alimentación, respectivamente. Compruebe que está leyendo "O2 en" alrededor de 20.90-20.94, "CO2 en" es de alrededor de 0.040 - 0.050, el RER está entre 0,7 y 1, y el caudal es constante en el 0.5 - 0.6 L/min.
- Periódicamente, comprobar que los ratones tengan acceso a alimentos y agua y que está consumiendo cada uno. Asegúrese de que no manifiestan signos de dificultad tales como cavar en el suelo perforado. Asimismo, supervisar los resultados que se muestran.
- Al finalizar el tiempo experimental asignado, seleccione "stop" en el menú de experimento y exportar los resultados (como archivos CSV, archivo > Exportar > generar tema CSV) para el análisis.
- Inspeccionar la salud de los ratones, pesarlos y luego regresar a sus jaulas hogar.
- Ratones pueden ser hostiles hacia los demás después de la separación, así monitorear una vez que se encuentran juntos otra vez.
- Desmontar las jaulas, quitar el exceso de comida de tolvas y punta cualquier heces, orina y alimento de las jaulas. Sumergir las botellas y sippers en solución diluida de T-bac, remojar y limpiar los otros componentes en solución de lejía diluida. Enjuague con agua limpia y déjelo al aire seco.
- Calcular parámetros metabólicos con el software. El software utiliza una serie de ecuaciones para proporcionar los datos finales de salida4.
Para el cálculo de consumo y dióxido de carbono la producción de oxígeno: consumo de oxígeno: VO2 (LPM)= VO2i - VoO2o; Producción de dióxido de carbono: VCO2 (LPM)= VoCO2o-VCO2i
Donde: V = la tasa de entrada de ventilación (LPM), Vo = la tasa de ventilación de salida (LPM), O2i = la concentración de O2 en la entrada, O2o = la concentración de O2 en salida, CO2i = CO2 concentración en entrada, CO2o = la concentración de CO2 en la salida.
Para el cálculo de RER: RER = VCO2 / VO2. Tenga en cuenta que no se midió la oxidación de proteínas y por lo tanto el RER no fue ajustado para esto.
Para el cálculo de gasto energético: gasto de energía: CV = 3.815 + 1.232* RER
Calor (Kcal/h)) = CV * VO2. Donde: CV es el poder calorífico (la relación entre el calor y el volumen de consumo de oxígeno). Esto se deriva de "Los elementos de la ciencia de nutrición" conocido como la tabla de Lusk, conformado por Graham Lusk.
Resultados
Los resultados observados en la figura 3 muestran un cambio típico en parámetros de composición corporal en alta alimentación grasa, medido a través de EchoMRI. Al inicio del estudio no hubo diferencias en cualquier parámetro medido (Figura 3A-F). Sin embargo, después de sólo una semana de alimentación alta en grasas, hubo un aumento significativo en el peso corporal, masa grasa y el porcentaje de masa grasa en el grupo HFD (Figura 3A,B,D). La magnitud de las diferencias entre los dos grupos para estas medidas siguió aumentando sobre la intervención de dieta de 3 semanas. Masa magra, agua libre y el contenido de agua total (figura 3,E,F) no difirió entre los grupos en cualquier momento. También se observa que el chow alimentó ratones continuó para poner el peso en el período de estudio (Figura 3A) y que esto era debido a un aumento en masa magra (figura 3) en lugar de una masa de grasa aumenta (figura 3B).
Como puede verse en la figura 4, tres semanas de alimentación grasa alta condujo a una serie de cambios según lo detectado en el metabolismo animal sistema de monitoreo. VO2 no ajustado para el peso corporal fue significativamente mayor en el más alto grado en grasas alimentada ratones (Figura 4A). En particular, normalización de VO2 a través de dos diferentes factores dio lugar a dos resultados diferentes. Normalización al peso total del cuerpo conducida a ninguna diferencia en VO2 entre el chow estándar alimentados y alto grado en grasas alimentó ratones, mientras que la normalización a masa magra produjo una diferencia significativa (Figura 4B,C). Estos resultados demuestran que la normalización de datos de2 VO dividiendo las variables masa significativamente afectadas por los resultados, y debe tener precaución al interpretar los datos de2 VO cuando se expresa de tal manera. Para una discusión detallada de cómo expresar el VO2 datos y los efectos de normalizar para distintos parámetros ven la excelente discusión en Tschop, et al. 5 en su guía para el análisis del metabolismo energético de ratón, Tschop y colegas sugieren el uso de análisis de la varianza (ANCOVA) para interrogar estadísticamente los efectos de peso o composición corporal sobre el gasto de energía y datos de consumo de alimentos . En este caso, realizar un ANCOVA en los datos mostrados en la Figura 4A, usando el peso corporal como la covariable, revela que ninguna diferencia estadísticamente significativa existe entre chow normal y HFD, lo que indica que una vez que contabilidad para peso corporal, hay ninguna diferencia en el consumo de oxígeno entre los grupos. Este resultado se puede visualizar fácilmente cuando ploteo VO2 contra peso corporal como un diagrama de dispersión como se muestra en la figura 4. Trazado de VO2 contra peso (figura 4) muestra que los datos de2 VO mienten en una línea común en lo referente a peso corporal, con los animales más pesados consumen más oxígeno. De nota, tramando VO2 contra masa magra muestra que los datos de VO2 se encuentran en dos líneas diferenciadas en relación con la masa magra (figura 4E).
RER fue significativamente menor en el alto grado en grasas alimentada ratones, indicando la utilización de grasa sobre la utilización de hidratos de carbono cuando alimentados con la dieta alta en grasas (figura 5A). Gasto de energía (calor) sin normalización fue aumentada de los animales más pesados, probablemente debido a los animales tener tejidos más metabólicamente activos (figura 5B), con esta diferencia se pierden una vez normalizado al peso corporal (figura 5). También tenga en cuenta los aumentos en el gasto de VO2, RER y la energía en el ciclo oscuro en comparación con el ciclo de luz cuando los ratones son más activos. Estas diferencias representan las alteraciones diarias clásicas en el metabolismo que se producen en ratones. Mientras que en este ejemplo, hemos dividido los datos en bloques de 12 h, División de los datos más en épocas de tiempo más pequeño también puede ser útil. Niveles de actividad física son también un factor que contribuyen al gasto de energía. Estos no fueron diferentes entre los grupos, lo que sugiere que una disminución en el movimiento no era el conductor del fenotipo obeso en el alto grado en grasas alimentada ratones (figura 5).
El otro lado de la ecuación de balance de energía es la cantidad de energía que se consume y entra en el cuerpo. Para examinar este aspecto del metabolismo se analizaron la cantidad de alimentos que consumen los ratones mientras que en el metabolismo animal sistema de monitoreo. Como puede observarse en la figura 6A, los ratones comían la misma cantidad de alimentos medido en peso o cuando normalizado al peso corporal (Figura 6B). (ANCOVA otra vez ser utilizado para evaluar el impacto del peso corporal sobre la ingesta de alimentos.) Normalización de la ingesta de alimento a peso corporal puede ser un paso importante a tener en cuenta si gasto de energía también ha sido normalizado peso, manteniendo así a cada lado de la ecuación de energía en equilibrio. Mientras los ratones comían la misma cantidad de alimentos, es importante para tener en cuenta la densidad energética de cada una de las dietas utilizadas. Teniendo este factor en cuenta, observamos los ratones en el HFD consumen más energía (figura 6) y de estos experimentos es probable que esto esta volviendo el fenotipo obeso. Es, ya que los ratones toman más energía, pero no gastan proporcionalmente más energía, su obesidad puede atribuirse al almacenamiento de energía.
Estadísticas
Todos los datos en este trabajo se presentan como media ± error estándar de la media (SEM). Significación estadística fue fijado en p < 0.05. * indica p < 0.05, ** indica p < 0.01, *** indica p < 0.001 y n = 6 por grupo indique. Los investigadores fueron cegados a la intervención dietética grupo debido a una diferencia en el color de las dietas. Los ratones fueron elegidos al azar en cuanto a que dieta les dieron.

Figura 1 : Colocación correcta de los costos de ratón y sostenedor del espécimen animal pequeño ratones en el analizador de composición corporal. Para realizar una prueba del sistema utilizando un estándar de calibración (costos) o para el análisis de ratones en el soporte de espécimen de animal pequeño, coloque cada una en el pórtico del sistema. Las flechas rojas indican el cilindro en el cual los ratones se se contienen en el pórtico de la máquina.

Figura 2 : Montaje de las cámaras. A) Coloque la tolva de alimentación en el centro del equilibrio. B) Inserte la plataforma de cada cámara cámara y lugar sobre la tolva. C) ratones en las cámaras individualmente y tapa. D) Coloque la botella de agua y apriete.

Figura 3 : Análisis de la composición del cuerpo más de 3 semanas de una dieta alta en grasas. A) peso corporal, B) grasa masa, C) magra masa, D) porcentaje de masa de grasa, E) libre contenido en agua, y F) contenido de agua total. Los círculos representan dieta chow normal, cuadrados representan HFD. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Parámetros metabólicos obtienen de metabólicas experimentos animales de sistema monitoreo después de 3 semanas de las dietas respectivas. Ratones fueron alojados en la cámara durante 48 h con las primeras 24 h actuando como familiarización. Los datos obtenidos en el segundo 24 h fue analizados y presentados en estas cifras. A) tasa de2 VO crudo, B) VO2 normalizado al peso corporal C) VO2 normalizado a la masa magra, D) pesar del diagrama de dispersión para VO2 (período de 24 h total) al cuerpo, t y E) VO2 a masa magra. A-C Barras blancas representan dieta chow normal, barras de color negro representan la dieta alta en grasas. D-E Los círculos representan dieta chow normal, cuadrados representan HFD. Haga clic aquí para ver una versión más grande de esta figura.
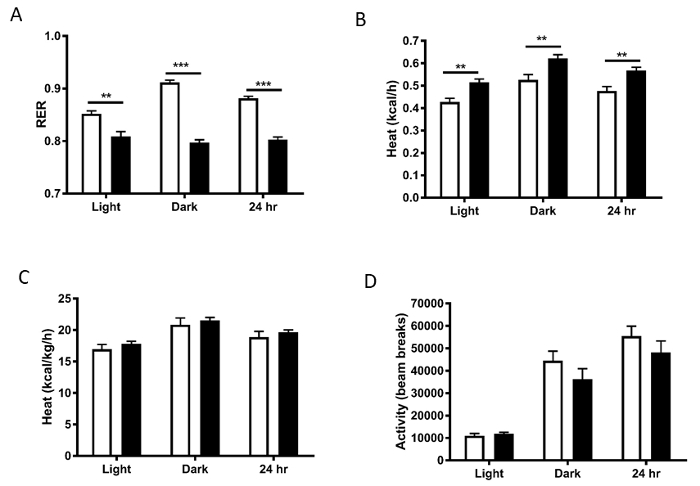
Figura 5 : A) cociente de intercambio respiratorio (RER), B) calor (gasto energético), y C) calor normalizado al peso corporal. D) niveles de actividad se calcularon como la suma de la girola X e Y de la viga se rompe y Z Haz descansos. Barras blancas representan dieta chow normal; barras de color negro representan HFD.

Figura 6 : Datos de consumo de alimentos obtienen en el sistema para el final 24 h. A) ingesta de alimentos en gramos, B) ingesta normalizado al peso corporal y C) del aporte calórico calculado. n = 4-5 (3 ratones fueron excluidos debido a hacer un lío grande con la comida). Barras blancas representan dieta chow normal; barras de color negro representan HFD. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Pasos críticos
Los protocolos descritos proporcionan un ejemplo de formas de composición del cuerpo medida y diferentes parámetros metabólicos en ratones usando un analizador de composición corporal y un metabolismo animal sistema de monitoreo. Para ambas técnicas, es críticamente importante asegurar que las máquinas están trabajando de forma óptima, y para ello, es imprescindible que el investigador realiza una prueba del sistema para el analizador de composición corporal y calibra a una composición conocida del gas para el metabolismo animal control sistema antes del uso de los equipos. Esto garantizará una mayor coherencia de los resultados y la posibilidad de detectar cualquier problema potencial con la maquinaria.
La manera en que datos se normalizaron para metabólicos experimentos controles animal también es de vital importancia para asegurar la validez de los resultados obtenidos de la técnica. Como se indica en nuestros resultados representativos (Figura 4A-E) VO2 puede ser divulgado en un número de diferentes maneras: su tasa absoluta (L/min), en relación con la masa del cuerpo del ratón (mL/kg * min), o en relación con la masa corporal magra (LBM mL/kg * min) si esa información está disponible (por ejemplo obtenidos de un analizador de composición corporal). Según el fenotipo, pueden ser más apropiada normalizar los valores de una manera particular para descartar cualquier sesgo potencial. Por ejemplo, si un animal ha aumentado la masa corporal, tienen más tejido que está disponible y capaz de consumir oxígeno y naturalmente su gasto energético es mayor. Normalizar a corporal total masa puede no ser la mejor opción como se sesgo hacia la observación de una disminución en el consumo de oxígeno por unidad de masa, a pesar de que el consumo de oxígeno de los tejidos no puede ser diferente. Como alternativa a la normalización de peso corporal, se puede normalizar a la masa magra del cuerpo del ratón. Como tejido magro, masa es principalmente responsable de consumo de oxígeno, y la masa magra es típicamente inalterada o sólo levemente diferente entre los grupos experimentales, normalización de esta manera puede ser una forma más representativa de expresar datos de VO2 . Cabe señalar que el compartimiento de masa magro se compone de muchos tejidos diferentes, con diferentes tasas metabólicas, y por consiguiente normalización de esta manera no puede ser apropiado o proporcionar cualquier información en el componente de masa magro está impulsando la cambio. Además, excluye la contribución del componente masa grasa sobre el metabolismo.
Teniendo en cuenta estas cuestiones, un método alternativo de base estadísticamente ha sido también propuesto5,6. Análisis de la covarianza ANCOVA ()) es una prueba estadística que permite la comparación de una variable (por ejemplo, gasto de energía) a través de varios grupos al mismo tiempo de corregir para otros factores o variables como covariables. En estos factores de forma como peso corporal, masa grasa y masa magra pueden ser incluidos como variables que influyen en gasto de energía, pero incluso este método tiene su propia hipótesis específica6, incluyendo el hecho de que el uso de múltiples variables en ANCOVA es probable que invalida a menos que las variables son independientes entre sí. Parece que no hay manera solo perfecta o universalmente acordada para normalizar y VO2 o energía gasto datos actuales, puede ser apropiado exhibir y presentar los datos en un número de maneras de dar la imagen más clara del fenotipo al lector. Niveles de actividad física pueden aumentar el consumo de oxígeno, y así en los animales que tienen fenotipos de actividad (un aumento o disminución), puede también ser necesario cuenta/normalizar cambios en movimiento para determinar si esto puede explicar total o parcialmente cuenta de cualquier cambio de VO2.
Modificaciones y la resolución de problemas
Los resultados representativos en este protocolo se obtuvieron de experimentos llevados a cabo a una temperatura ambiente de 21-22 ° C. La zona termoneutral de un ratón es aproximadamente 30 ° C, por lo que en una casa tradicional de animales con su temperatura regulada a 20-22 ° C para el confort humano, un ratón es sometido a estrés térmico. Para contrarrestar esto, se activa la termogénesis sin escalofríos en estas temperaturas más frías, dando por resultado un up a un aumento de 2 dobleces en gasto de energía entre ratones ubicado a 20 ° C en comparación con aquellos en 30 ° C7. La vivienda ambiental de ratones es una consideración importante para estos experimentos, como se ha demostrado que vivienda de ratones en termoneutralidad puede potenciar el desarrollo de ciertas condiciones tales como ateroesclerosis8 y alta grasa inducida por dieta patogenia de enfermedad del hígado graso no alcohólico (HGNA)9. Temperatura ambiente por lo tanto es también una consideración importante cuando se realizan experimentos en un animal metabólico control, como un fenotipo puede estar presente en ciertas temperaturas, pero no en otros, que podría señalar a un mecanismo potencial de acción. Un tal escenario podría ser un fenotipo que implica la activación de la grasa beige contratación por el que una mayor cantidad de este tejido permite un mayor aumento en la termogénesis bajo condiciones más frescas10. Por lo tanto, puede ser necesario modificar el medio ambiente estableció que fue descrita en estos experimentos actuales y llevar a cabo experimentos bajo temperaturas ambientales múltiples para conseguir una representación exacta de la verdadera estado metabólico del modelo. Para la solución de problemas debido a errores técnicos, puede ser necesario ponerse en contacto con los fabricantes directamente para la instrucción. Si hay problemas con este tipo de analizador de composición del cuerpo se recomienda realizar una prueba repetir exploraciones, que se extiende 25 exploraciones sobre el costo. La empresa necesitará esta información para el diagnóstico. Del mismo modo con el sistema metabólico de control animal, si surgen problemas, recopila los archivos de datos desde la última vez que el sistema funcionó bien y los archivos de cuando los problemas se presentaron por lo que apoyo puede hacer un diagnóstico probable.
Limitaciones
Mientras que el analizador de composición corporal proporciona datos excelentes sobre todo el cuerpo la acumulación de grasa, no permite para la determinación de depósitos de grasa regionales. Esto es importante en el campo de la investigación de la obesidad, como no toda la grasa es el mismo, con la ubicación que se ha acumulado la grasa y sus propiedades funcionales, siendo particularmente importante. De hecho, los efectos protectores de depósitos de grasa subcutáneos (o la grasa metabólicamente sano) han sido descritas11. Tomografía computada de micro (micro-CT) puede discriminar entre subcutánea y visceral fat12, como la proyección de imagen de resonancia magnética (MRI) análisis13. Uso de estas técnicas puede proporcionar más información en el sitio de la acumulación adiposa. El animal metabólico sistema de control también tiene sus limitaciones. Mientras que el gasto total de energía diaria se puede medir, el sistema no es capaz de discernir entre los diferentes componentes que conforman el gasto de energía. Otra limitación del sistema es que es posible que la obesidad puede desarrollarse sin una disminución mensurable en gasto de energía detectada por estos tipos de sistemas, incluso independientemente de alteraciones de la ingesta de alimentos y la energía. Los estudios han demostrado que pequeñas disminuciones en gastos energéticos, que son lo suficientemente sustanciales como para causar significativo peso ganancia a largo plazo, no pueden ser detectados robusta en tales sistemas metabólicos en el corto plazo14,15, 16. Si bien hemos utilizado una n de 6 por grupo en el estudio actual para demostrar esta metodología como el estudio de un ejemplo detectar pequeñas diferencias en el gasto de energía que podría contribuir a la obesidad probablemente requiere muchos más ratones5. Los avances en la resolución de la detección en estos sistemas y la capacidad para realizar este tipo de estudios durante un largo periodo de tiempo ayuda en la habilidad de detectar estos cambios pequeños pero significativos. Con respecto a la medición de la ingestión de alimentos, por lo general hemos observado que la toma de comida 24 h en ratones en el metabolismo animal sistema de monitoreo es más baja que se celebraría en la casa jaula, probablemente debido a las razones mencionadas. Por lo tanto, además de controlar la ingestión de alimentos en este sistema, además evaluar la ingesta de alimentos en el hogar jaulas de ratones. Mientras que esto puede hacerse sólo en una situación donde los ratones de determinados grupos experimentales se encuentran por separado, tiene la ventaja de permitir cerca de evaluación diaria continua. El investigador simplemente pesa la cantidad de alimentos en la tolva a una hora determinada del día, siempre representando comida esparcido a lo largo de la jaula y luego divide esta cantidad total de alimentos consumidos por el número de ratones presentes en la jaula.
Futuras aplicaciones
Mientras que dentro de esta revisión hemos utilizado la obesidad adquirida través de alto grado en grasas de alimentación como un ejemplo de un estado de enfermedad, donde la medición de composición corporal y parámetros metabólicos son útiles, que el uso de este equipo lejos de se limita a este campo de investigación. El uso de estas técnicas también es valioso estudiar enfermedades como la diabetes, enfermedad cardiovascular, sarcopenia relacionada con la edad, debilidad, caquexia por cáncer, distrofias musculares y lipodistrofia. Mientras que los costos iniciales de compra de tal infraestructura es considerable, la capacidad para utilizar el equipo en múltiples y diversos campos de la investigación médica mitiga este costo inicial. Además, reactivo de curso y los costos de consumibles son mínimos para estas máquinas; sin embargo, mantenimiento preventivo y servicio considerados y presupuestados.
Igual masa magra obtenida mediante análisis de la composición corporal puede ser un factor importante de normalización para el consumo de oxígeno derivado del metabolismo animal sistema de monitoreo, determinación de masa magra puede utilizarse para normalizar la dosis de prueba de la droga. Por ejemplo, en estudios metabólicos, es habitual realizar una prueba de tolerancia a glucosa oral o intraperitoneal (GTT), o una prueba de tolerancia a insulina intraperitoneal (ITT). Estas pruebas examinan la capacidad de un ratón para deshacerse de una carga de glucosa o responder a la insulina. Alteraciones en los niveles de glucosa en sangre en respuesta a estas pruebas proporciona información sobre el nivel de glucosa de todo el cuerpo y la tolerancia de la insulina en el modelo. Tradicionalmente, la glucosa y la insulina bolo administrado en estas pruebas se dosifica según el peso corporal del ratón. Sin embargo, modelos de obesidad acumula masa grasa por masa magra, dosificación por peso corporal podría sesgar el modelo más pesado hacia la intolerancia a la glucosa en un GTT como reciben más glucosa. Esto es debido a que el hígado, músculo esquelético y cerebro, los órganos que disponen de la mayoría de la glucosa en el estado post-prandial17, son componentes de la medición de la masa magra y raramente o cambiar ligeramente en la mayoría de los modelos. Por el contrario, en una ITT cuando dosificar al peso corporal, un modelo más pesado que recibiría más insulina puede aparecer más sensible a lo efectos de la insulina de hipoglucemiante puramente porque ha recibido una mayor cantidad. Por lo tanto, si el investigador tiene acceso a los datos de composición corporal, la masa magra puede ser la medida más adecuada, a diferencia de la masa de cuerpo entero, para estos cálculos de dosis18. Teniendo esto más, magros masa datos obtenidos de análisis de composición corporal podrían también utilizarse para dosificar medicamentos experimentales si la necesidad se presentó para tener en cuenta masa magra en la exclusión de la masa grasa. Otra aplicación del metabolismo animal sistema de vigilancia no se ha discutido o demostrado en este manuscrito es asociar una caminadora motorizada adjunto al sistema para que los parámetros metabólicos discutieron en este documento puede también medirse durante la ejercicio.
Los procedimientos descritos en esta revisión pueden utilizarse para caracterizar la composición corporal y diferentes parámetros metabólicos en ratones. Estas medidas son aplicables a una amplia gama de campos de investigación y pueden proporcionar información importante para la caracterización de un fenotipo. Datos derivados de estos métodos también pueden proporcionar evidencia hacia mecanismos subyacentes conduce un determinado fenotipo metabólico. Desarrollo y refinamiento de estas tecnologías permitirá a los investigadores avanzar en sus conclusiones a los resultados terapéuticos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos al personal de la investigación médica Alfred y el equipo de educación recinto Animal servicios (AMREP como) por su asistencia y cuidado de los ratones utilizados en este estudio y el apoyo del plan operacional de la ayuda de infraestructura del estado de Victorian Gobierno.
Materiales
| Name | Company | Catalog Number | Comments |
| 4 in 1 system | EchoMRI | 4 in 1 system | Whole body composition analyser |
| Canola oil test sample (COSTS) | EchoMRI | Mouse-specific (contact company for cat number) | |
| Animal specimen holder | EchoMRI | 103-E56100R | |
| Delimiter | EchoMRI | 600-E56100D | |
| 12 chamber system | Columbus Instruments | Custom built | Metabolic Caging System; includes control program |
| Drierite | Fisher Scientific | 238988 | CLAMS consumable |
| Calibration gas tank | Air Liquide | Mixed to order | Gas calibration (0.5% CO2, 20.5% O2, balance nitrogen). |
| Normal chow diet | Specialty Feeds | Irradiated mouse and rat diet | |
| High fat diet | Specialty Feeds | SF04-001 | |
| Balance | Mettler Toledo | PL202-S | Balance for weighing mice |
| TexQ Disinfectant spray | TexWipe | ||
| Hydrogen Peroxide cleaning solution | TexWipe | TX684 |
Referencias
- Chen, W., Wilson, J. L., Khaksari, M., Cowley, M. A., Enriori, P. J. Abdominal fat analyzed by DEXA scan reflects visceral body fat and improves the phenotype description and the assessment of metabolic risk in mice. Am J Physiol Endocrinol Metab. 303 (5), E635-E643 (2012).
- Kovner, I., Taicher, G. Z., Mitchell, A. D. Calibration and validation of EchoMRI whole body composition analysis based on chemical analysis of piglets, in comparison with the same for DXA. Int J Body Compos Res. 8 (1), 17-29 (2010).
- EchoMRI. Software User Manual: Whole body composition analyzer. , (2016).
- Columbus Instruments. Oxymax for Windows User Manual. , September (2014).
- Tschop, M. H., et al. A guide to analysis of mouse energy metabolism. Nat Methods. 9 (1), 57-63 (2011).
- Speakman, J. R. Measuring energy metabolism in the mouse - theoretical, practical, and analytical considerations. Front Physiol. 4, (2013).
- Swoap, S. J., et al. Vagal tone dominates autonomic control of mouse heart rate at thermoneutrality. Am J Physiol Heart Circ Physiol. 294 (4), H1581-H1588 (2008).
- Tian, X. Y., et al. Thermoneutral housing accelerates metabolic inflammation to potentiate atherosclerosis but not insulin resistance. Cell Metab. 23 (1), 165-178 (2016).
- Giles, D. A., et al. Thermoneutral housing exacerbates nonalcoholic fatty liver disease in mice and allows for sex-independent disease modeling. Nat Med. 23 (7), 829-838 (2017).
- Lee, M. W., et al. Activated type 2 innate lymphoid cells regulate beige fat biogenesis. Cell. 160 (1-2), 74-87 (2015).
- Kusminski, C. M., et al. MitoNEET-driven alterations in adipocyte mitochondrial activity reveal a crucial adaptive process that preserves insulin sensitivity in obesity. Nat Med. 18 (10), 1539-1549 (2012).
- Judex, S., et al. Quantification of adiposity in small rodents using micro-CT. Methods. 50 (1), 14-19 (2010).
- Chaurasia, B., et al. Adipocyte ceramides regulate subcutaneous adipose browning, inflammation, and metabolism. Cell Metab. 24 (6), 820-834 (2016).
- Matthews, V. B., et al. Interleukin-6-deficient mice develop hepatic inflammation and systemic insulin resistance. Diabetologia. 53 (11), 2431-2441 (2010).
- Tschop, M., Smiley, D. L., Heiman, M. L. Ghrelin induces adiposity in rodents. Nature. 407 (6806), 908-913 (2000).
- Garcia, M. C., et al. Mature-onset obesity in interleukin-1 receptor I knockout mice. Diabetes. 55 (5), 1205-1213 (2006).
- Kowalski, G. M., Bruce, C. R. The regulation of glucose metabolism: Implications and considerations for the assessment of glucose homeostasis in rodents. Am J Physiol Endocrinol Metab. 307 (10), E859-E871 (2014).
- McGuinness, O. P., Ayala, J. E., Laughlin, M. R., Wasserman, D. H. NIH experiment in centralized mouse phenotyping: the Vanderbilt experience and recommendations for evaluating glucose homeostasis in the mouse. Am J Physiol Endocrinol Metab. 297 (4), E849-E855 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados