Method Article
Micro-dissezione dell'organo dello smalto da incisivo dei ratti esposti a tossici ambientali
In questo articolo
Riepilogo
Comprensione dello smalto formazione e possibili alterazioni richiede lo studio di ameloblast attività. Qui, descriviamo un metodo affidabile e coerenza per micro-dissezionare organi di smalto contenente Adamantoblasti fase di secrezione e di maturazione che possono essere utilizzato per ulteriori quantitative e qualitative procedure sperimentali.
Abstract
Difetti dello smalto derivanti da condizioni ambientali e modi di vita sono le preoccupazioni di salute pubblica a causa della loro alta prevalenza. Questi difetti derivano da attività alterata delle cellule responsabili della sintesi di smalto denominato ameloblasts, che presentano in organo dello smalto. Durante l'Amelogenesi, ameloblasts seguire una sequenza specifica e precisa di eventi di proliferazione, differenziazione e morte. Un ratto incisivi in continua crescita è un adatto modello sperimentale per studiare ameloblast fasi di attività e differenziamento in condizioni fisiologiche e patologiche. Qui, descriviamo un metodo affidabile e coerenza per micro-sezionare organo dello smalto dei ratti esposti a tossici ambientali. Gli epiteli dentali micro-dissecato contengono Adamantoblasti fase di secrezione e di maturazione che possono essere utilizzati per esperimenti qualitativi, quali le analisi immunohistochemistry e ibridazione in situ , così come per analisi quantitative come RT-qPCR, RNA-seq e Western blotting.
Introduzione
Molti i difetti inerenti allo sviluppo dello smalto possono derivare dall'esposizione a tossici ambientali e/o stile di vita inadeguato1,2,3,4. Caratterizzazione di interrompere gli eventi e le molecole di amelogenesis utilizzando la procedura descritta attualmente promuoverà l'uso dei difetti dello smalto risultante come marker precoce di esposizione alle sostanze tossiche diverse e può aiutare a ricostituire la storia di salute della ogni paziente durante il periodo perinatale quando lo smalto è sintetizzato1,2. Sintesi dello smalto possono essere diviso in quattro fasi principali a seconda ameloblast attività5. Il primo passo raggruppa la proliferazione dei precursori delle cellule e pre-ameloblast. Durante il secondo passaggio, ameloblasts differenziato secernere proteine di matrice dello smalto (EMPs), principalmente amelogenina, enamelina e ameloblastin, che determinano lo spessore dello smalto finale. Così, qualsiasi interruzione della sintesi di EMP conduce ai difetti quantitativi dello smalto. Dopo la deposizione dello spessore dello smalto completo, inizia la fase di maturazione. Durante questa fase, crescita di cristalliti di apatite in larghezza e spessore permette lo smalto raggiungere il più alto rapporto di mineralizzazione, trovato in un tessuto biologico, fino al 96% in peso. Eventi endocrini che si verificano durante il lead di fase di maturazione a qualitativa dello smalto i difetti. Infine, ameloblasts entra in una fase di post-maturazione, anche chiamato pigmentazione nei roditori e apoptosi durante l'eruzione del dente rendendo i difetti dello smalto (se qualsiasi) irreparabile e irreversibile, quindi difetti forniscono potenziale registrazione retrospettiva di ameloblast sottolinea. Nei roditori, Amelogenesi segue una sequenza di eventi con la particolarità che loro incisivi crescono continuamente, che li rende un modello adatto per studiare il processo generale di amelogenesis simile. Così, qualsiasi interruzione di Amelogenesi provoca alterazioni della qualità dello smalto e/o quantità, a seconda l'intervallo di tempo dell'evento endocrini. In questo senso, l'esposizione alla diossina, piombo e sostanze chimiche endocrina (EDCs) come il bisfenolo A (BPA), genisteina e vinclozolin, hanno dimostrato di generare smalto hypomineralizations1,2,3 ,6,7,8. Asimmetriche macchie opache bianche sono stati identificati sugli incisivi dei ratti esposti a una dose BPA della basso-dose durante il periodo fetale e il primo mese dopo la nascita1. Questi difetti dello smalto in ratti ed in quelli di incisivo molare umano hypomineralization (MIH), condividono caratteristiche cliniche, strutturali e biochimiche simili. MIH è una patologia dello smalto dentale recentemente descritto, per cui l'eziologia rimane ancora poco chiara9,10 , nonostante molti fattori causali essendo stato supposto9,10,11 ,12.
Un altro importante smalto hypomineralization patologia a causa di fattori ambientali è fluorosi dentale (DF), che è la conseguenza di assorbimento eccessivo di fluoro (> 0,1 mg/kg/giorno)13,14. La principale fonte di fluoro è l'acqua potabile che viene completato o naturalmente arricchita con fluoro. Fluoruro è anche spesso prescritto per prevenire la carie dentale, ma la dose profilattica è solo il 50% inferiore rispetto il tossico uno (≤ 0.05 mg/kg/giorno). MIH e DF, due frequenti patologie derivanti dall'esposizione a fattori ambientali, possono presentare caratteristiche comuni che devono essere caratterizzato a causa il potenziamento degli effetti hypomineralizing di fluoro combinato con altre sostanze tossiche come interferenti endocrini2 o amoxicillin15.
Micro-dissezione dell'organo dello smalto del ratto contenenti Adamantoblasti a stadi diversi di differenziazione aiuterà a comprendere il meccanismo d'azione di molecole capaci di interferire con attività ameloblast e causare i difetti dello smalto essere diagnosticata dopo l'eruzione dei denti. In altre parole, la caratterizzazione dei cambiamenti di composizione di matrice smalto gene espressione e smalto a causa di tossici ambientali permette la ricostituzione della storia di esposizione a sostanze tossiche e facilita il controllo di sicurezza ambientale per pubblico salute.
Protocollo
Tutti gli animali utilizzati nel presente studio sono stati effettuati conformemente agli orientamenti per la cura e l'uso degli animali da laboratorio del Ministero francese dell'agricoltura (A-75-06-12).
1. animale esposizione alle sostanze tossiche
- Prima di eseguire questo protocollo, ottenere la necessaria approvazione istituzionale ed essere sicuri di rispettare tutte le linee guida di cura degli animali.
- Applicare la struttura del protocollo ricerca permettendo la costituzione di diversi gruppi sperimentali al fine di verificare l'impatto della molecola studiata su ameloblast secrezione fase e la fase di maturazione ameloblast. Qui, quattro gruppi di ratti maschii di Wistar sono stati costituiti a seconda della loro esposizione al fluoruro (NaF) in combinazione o non con BPA (Figura 1A)2. Tutti gli animali sono stati osservati e sezionati il giorno 65 (Figura 1B).
2. dissezione di Hemi-mandibole dai ratti adulti
- Eutanasia ratti da CO2 asfissia, facoltativamente seguita dalla decapitazione alla testa separata dal resto del corpo. Esporre i ratti di CO2 per 5 min in un box dedicato16.
- Rimuovere tutta la pelle dalle labbra inferiori usando un bisturi #11 al fine di ottenere un facile accesso agli incisivi inferiori.
- Con il bisturi stesso, fare un'incisione tra i due incisivi inferiori con una leggera pressione e la mandibola sarà diviso in due metà.
- Tagliare l'articolazione mandibolare temporale con un bisturi per staccare la mascella e tenere hemi-mandibola con pinzette bene.
- Tagliare i tessuti molli circostanti con un bisturi e rimuovere tutti i muscoli, tendini e legamenti con una spatola fino a quando l'osso è completamente pulito.
3. isolamento del incisivo17,18
- Radersi con attenzione l'osso inserendo la lama parallela all'asse longitudinale principali dell'incisivo. Partono dalla cresta ossuta vicino alle punte dell'incisivo (estremità prossimale) fino alla fine dell'incisivo Ansa cervicale. Il movimento di incisione procede da prossimale a distale direzione.
- Effettuare un primo taglio distalmente al ciclo cervicale con il bisturi per rimuovere il gonion di hemi-mandibola e permettere che toglie l'incisivo facilmente senza danneggiare il ciclo cervicale o la fase secretiva del Adamantoblasti (linea rossa in Figura 2).
- Fare un secondo taglio sotto il secondo molare e inserire il bisturi tra l'osso e la superficie mediale dell'incisivo. Quando tutto l'osso basale è sollevato, ruotare verso l'esterno l'incisivo e toglierlo con attenzione per evitare smalto tessuto dell'organo compromettere con pinzette bene.
4. micro-dissezione dell'organo dello smalto sotto lente binoculare
- Goccia 200 µ l di tampone fosfato salino (PBS 1X) sull'incisivo utilizzando una pipetta. Prendere l'incisivo con pinzette bene con la superficie labiale rivolto verso l'alto. Fare un bisturi segno tra l'incolore e le parti arancione del tessuto. Questo contrassegno corrisponde per la macchia bianca sottostante che è osservabile in seguito (Figura 2).
- Raschiare, con un escavatore o strumento equivalente, la superficie delle cellule dal marchio bisturi alla estremità apicale corrispondente da secrezione Adamantoblasti di fase (incolore) e il marchio di bisturi alla punta dell'incisivo per l'Adamantoblasti di fase (arancione) di maturazione.
- Rimuovere il tessuto di 2 mm corrispondono alla fase di transizione, come precedentemente descritto19. Non aprire l'incisivo durante la dissezione dell'organo dello smalto per evitare la contaminazione del mesenchima.
- Tagliare il ciclo cervicale situato immediatamente nella parte apicale dell'incisivo (Figura 2) come descritto in precedenza20.
- Raccoglierlo in soluzione al 10% formalina o lisi per ulteriori indagini (Vedi Tabella materiali).
5. raccolta dei tessuti dell'organo dello smalto separati per ulteriori indagini
- Goccia 200 µ l di tampone PBS 1 X sull'incisivo.
- Con una lama per bisturi #11, attentamente staccare le cellule epiteliali dentale gradualmente nel buffer, separatamente per ogni fase con l'aiuto del marchio bisturi fatto in precedenza.
- Per cella RNA e proteina estrazioni, mettere il tessuto in una soluzione di lisi che permette l'estrazione di proteine e di RNA (Vedi Tabella materiali).
Nota: Preparare alta qualità RNAs girando il tessuto-escavatore nel tubo e poi rettifica le cellule fino ad ottenere un impasto omogeneo. L'impasto è pronto per l'estrazione di RNA e proteine secondo la procedura del produttore, che era precedentemente descritti2,8,17. Di solito, circa 5-10 µ g totale RNAs e 150 µ g proteine totali sono stati ottenuti per ogni preparazione. - Per le analisi istologiche, immunohistochemistry (IHC) e l'ibridazione in situ (ISH), mettere lo strato delle cellule in formalina al 10% per 2 h, quindi conservare a 4 ° C in PBS 1X. Il tessuto può quindi essere incorporato in cera di paraffina o tessuto OCT per sezioni congelate.
- Per le estrazioni di EMP, prendere l'incisivo con pinzette bene. Dopo una breve esposizione all'aria (lieve disidratazione), una macchia bianca sarà visibile intorno alla parte centrale della superficie labial dell'incisivo, che rappresenta l'inizio della mineralizzazione dello smalto. Questa macchia bianca corrisponde alla transizione- / presto-fase di maturazione di ameloblasts, così utilizzarlo come un indicatore per l'estrazione di EMPs21.
Risultati
Molti smalto difetti, come fluorosi dentale12,13, possono derivare da condizioni ambientali a causa dell'assorbimento di fluoro eccessivo o smalto hypomineralization simili a MIH dovuto l'esposizione a qualche EDCs1, 7,22. Questi difetti inerenti allo sviluppo dello smalto possono essere riprodotta sperimentalmente su ratti (Figura 1)1,2,7,23,24. Il ratto hemi-mandibola contiene un singolo incisivo separato da tre molari da uno spacco, chiamato il diastema. La continua crescita dell'incisivo contiene due tessuti mineralizzati, prodotto da odontoblasti dentina e lo smalto prodotto da Adamantoblasti presenti nell'organo dello smalto con altre cellule epiteliali (Figura 2). L'incisivo roditore sembra essere un modello adatto per studiare l'Amelogenesi come, al contrario i molari, che contiene tutte le fasi di proliferazione e differenziazione di ameloblast per tutta la vita dell'animale.
Organo dello smalto di Micro-Sezionato dall'incisivo di ratto possa essere separato secondo ameloblast fase di differenziazione con l'aiuto di una macchia bianca che appare dopo una lieve disidratazione, e questo può essere usato come un indicatore della fase di transizione tra secrezione - e fasi di maturazione19,21,25. La qualità dello smalto micro-dissecato tessuti possono essere controllati da Masson tricromica di colorazione (Figura 3A). Osservazione al microscopio ha mostrato le cellule epiteliali dello smalto tipico e ameloblast palizzata. L'assenza di contaminazione mesenchymal è stata attestata dall'assenza di colorazione (Figura 3A) verde di collagene e di espressione (Figura 3B). Questi tessuti micro-dissecato possono essere utilizzati per qualitative analyses come IHC (Figura 3) e ISH e analisi quantitative quali RT-qPCR (Figura 3B), RNA-seq e Western blotting. Ad esempio, il recettore degli androgeni in particolare è stato localizzato nella fase di maturazione Adamantoblasti utilizzando un anticorpo specifico diretto contro questa proteina (Vedi Tabella materiali) (Figura 3)8. Le fasi di differenziazione principale ameloblast sono caratterizzate da specifico gene espressione modelli26 che possono essere identificati su organo dello smalto micro-sezionato. Ad esempio, secrezione-fase Adamantoblasti express enamelina2 e fase di maturazione Adamantoblasti express callicreina 4 (KLK4) (Figura 3B). Essi contengono alti livelli di ferritina che conferiscono la capacità di memorizzare quantità elevate di ferro, che è responsabile per il colore arancione delle smalto27.
Rottura di fluoruro di amelogenesis facilmente può essere seguita tramite l'osservazione dei lisati cellulari per le estrazioni RNA: controllare la fase di maturazione lisati erano arancioni, mentre quelli fluoruro-trattati erano luce gialla a incolore (Figura 4A). Analisi dei livelli di RNA estratto dalla fase di maturazione micro-dissecato organo dello smalto ha mostrato KLK4 giù-regolamento sul trattamento di fluoruro (Figura 4B), che inoltre è stato provato tramite un'analisi trascrittomica su larga scala ha riferito recentemente2. Specifiche proteine espresse sia da Adamantoblasti possono anche essere localizzate utilizzando micro-dissecato smalto organo28di fase di secrezione o maturazione. Ad esempio, il recettore degli androgeni è stata specificamente localizzato utilizzando micro-dissecato smalto organo8,28.
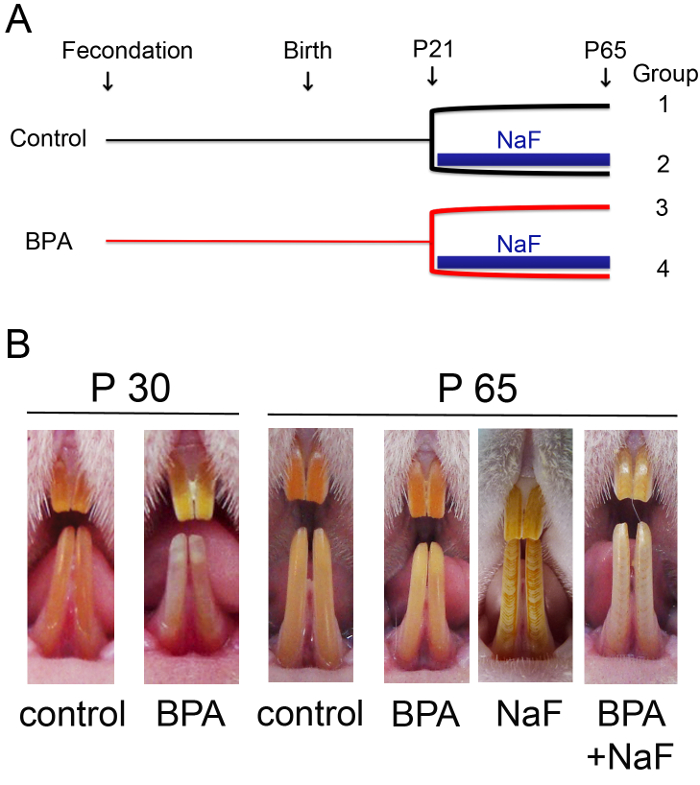
Figura 1: smalto difetti osservati in ratti esposti a fluoruro (NaF), in combinazione o non con bisfenolo A (BPA). (A) rappresentazione schematica dei quattro gruppi sperimentali di ratti Wistar costituiti per il presente studio, gruppi che dipendevano le diverse condizioni ambientali applicate ai ratti. Dal giorno gestazionale 1 (fecondazione) fino al giorno dello svezzamento 21 (P21), 5 µ g/kg BPA in 0,5 mL di olio di mais è stato amministrato oralmente mediante sonda gastrica giornalmente alle femmine in gravidanza ed allattamento, considerando che solo olio di mais è stato amministrato al gruppo di controllo. Dopo lo svezzamento, ogni diga è stato identificato e distribuita in modo casuale in uno dei due gruppi corrispondenti. I ratti maschii sono stati selezionati per questo studio ed esposti a 5 µ g/kg/die BPA da solo, 5 mM NaF da solo, o entrambi allo stesso dosaggio fino a 65 giorni dopo la nascita (P65). Gruppo di controllo è stato dato solo solvente. (B) a postnatale giorno 30 (P30), ratti cronicamente esposti a BPA della basso-dose mostravano macchie opache bianche e un fenotipo dentale non è più evidente è stato identificato per ratti adulti (P65). Alternanza di fasce bianche e arancioni di fluorosi dentale tipica (DF) sono stati osservati in ratti trattati con NaF. Un fenotipo più grave, caratterizzato da una decolorazione importante incisivo è stato identificato in ratti esposti ad entrambi gli agenti. Smalto incisale arancione omogenea caratterizzata ratti di controllo. Clicca qui per visualizzare una versione più grande di questa figura.
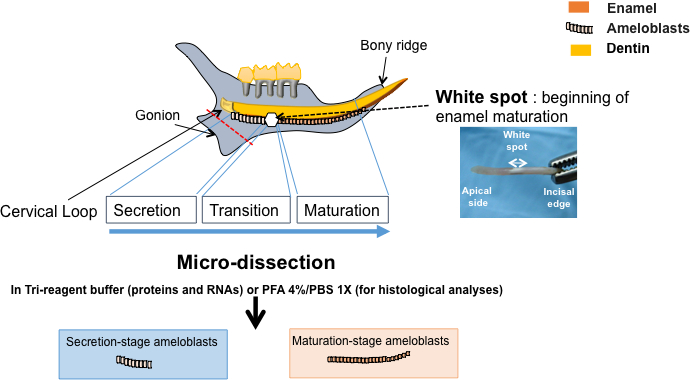
Figura 2: rappresentazione schematica della procedura. Isolamento di ameloblasts da secrezione e maturazione-fasi da organo dello smalto micro-dissecato. Il ratto hemi-mandibola contiene tre molari e un incisivo continuamente crescente con due tessuti mineralizzati, la dentina prodotta da odontoblasti (in giallo) e lo smalto prodotto da Adamantoblasti (in arancione). Quando l'incisivo è isolato e leggermente disidratato, una macchia bianca vicino alla parte apicale della superficie labial è osservabile. Aiuta a identificare ameloblast fase di differenziazione, dato che copre la fase di transizione tra la secrezione e fasi di maturazione. L'organo dello smalto è attentamente micro-sezionato, separati in 3 parti a seconda delle fasi di differenziazione ameloblast e usate per analisi (istologico) qualitativa o quantitativi approcci sperimentali (mRNA e proteina analisi di RT-qPCR e Western blotting, rispettivamente).

Figura 3: controllo di qualità del micro-dissecato secrezione - e maturazione-fasi dell'organo dello smalto. Organo dello smalto del ratto è diviso in 3 parti contenenti il ciclo cervicale, la secrezione-fase ameloblasts e Adamantoblasti di fase di maturazione. (A) tricromica di Masson macchiatura delle parti micro-dissecato ha mostrato le cellule epiteliali differenti e l'assenza di cellule mesenchimali. Barra della scala, 100 µm. (B) analisi dell'espressione genica mediante esperimenti di RT-qPCR di RNA estratto dalla fase di maturazione e di secrezione organo dello smalto. Un tipico pattern di espressione di KLK4 ed enamelina è stato osservato, così come l'assenza di collagene 1 previsto in cellule mesenchimali. Colorazione usato fluorescente di (C) un anticorpo (Vedi Tabella materiali) specificamente diretto contro il recettore degli androgeni espresso solo dalla fase di maturazione ameloblasts. Barra della scala, 20 µm. Clicca qui per visualizzare una versione più grande di questa figura.
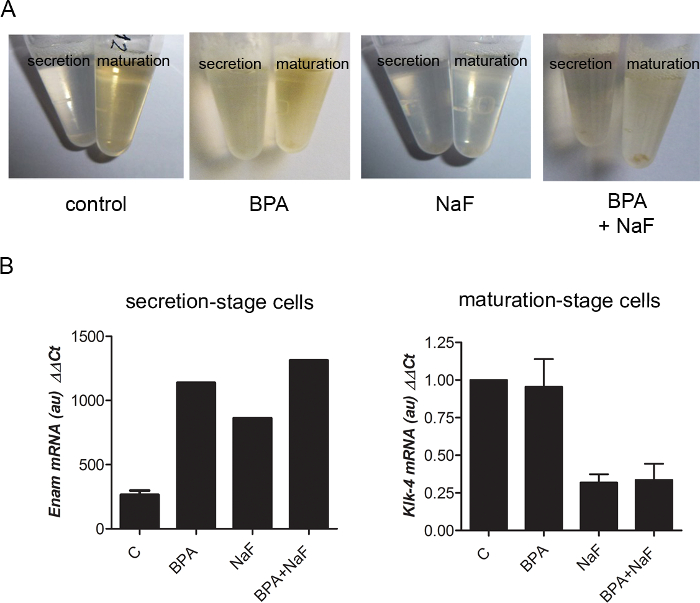
Figura 4: risultati rappresentativi ottengono con organo dello smalto ratto micro-dissecato. (A) quando le cellule sono state risospese in un tampone di lisi per l'estrazione di RNA (Vedi Tabella materiali), Stadio di maturazione tessuto contenente Adamantoblasti pigmentato è sembrato arancione in condizioni di controllo e BPA-trattati. La porzione di secrezione-fase è gialla non importa le condizioni. Nel trattamento di NaF, tutti i lisati erano luce gialla ad incolore. (B) esempio di RT-qPCR dati ottenuti con le preparazioni di RNA da organi dello smalto dei ratti sottoposti a varie condizioni ambientali. NaF down-regolato KLK4 in fase di maturazione, e BPA ha aumentato l'espressione enamelina in fase di secrezione. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Ameloblast alterata attività e/o interrotte ameloblast proliferazione, differenziazione e maturazione processi piombo per i difetti dello smalto irreversibile e, a sua volta, la caratterizzazione dei difetti dello smalto può aiutare a sviluppare la comprensione dell'alterata ameloblast attività durante amelogenesis. Così, gli studi su organo dello smalto isolato sono determinante per delucidare gli eventi patologici che conducono allo smalto difetti qualunque loro origine, ambientali o genetici.
Questa tecnica è stata descritta originariamente da Hiller et al. 17 e Robinson et al. 18e viene utilizzato per illustrare gli effetti specifici su ogni fase di differenziazione dell'organo dello smalto. Poi è stato adattato per EMP estrazioni19,24,25. Attualmente utilizziamo questa procedura per separare le parti principali dell'organo dello smalto e raccogliere i campioni biologici in differenti condizioni ambientali per l'analisi di RNA e proteine (possibilmente intra - ed extracellulari proteine) utilizzando quantitativi e qualitativi tecniche.
La precisione della micro-dissezione richiede notevole formazione prima della sua applicazione, per consentire la raccolta dell'organo dello smalto conservata e per evitare contaminazioni mesenchymal e qualsiasi forma di distruzione del tessuto. Inoltre, è abbastanza difficile riuscire con topi o ratti piccoli. Infatti, la parte più delicata della procedura è quello di preservare la morfologia del tessuto, l'istologia e l'orientamento in IHC e ISH, al contrario di tecniche classiche comunemente eseguite sugli incisivi per questi due approcci.
Uno dei principali vantaggi dell'utilizzo di micro-dissecato smalto rispetto alla demineralizzata intera hemi-mandibola è il mantenimento dello smalto RNA e proteine grazie alla mancanza di qualsiasi post-raccolta di trattamento. Organo dello smalto micro-sezionato è utilizzabile direttamente per tutte le tecniche di biologia molecolare e biochimica, senza selezione o la coltura delle cellule. Il vantaggio di questa procedura è la misurazione diretta dei livelli di RNA e proteine che riflette la loro quantità nello specifico ameloblasts in vivo in condizioni fisiologiche o patologiche. Inoltre, alcune sostanze tossiche agiscono sul palco una differenziazione in particolare, come è il caso con fluoruro, che agisce sulla fase di maturazione ameloblasts e non su quelli di secrezione-tappa23,24. Il micro-dissezione delle diverse regioni dell'organo dello smalto permette lo studio del meccanismo d'azione di alcune sostanze tossiche o di geni specifici cui effetti potrebbero essere non rilevabili sull'organo intero smalto o su cellule isolate. Infatti, ameloblasts, differenziato soprattutto quelli, sono difficili da raccogliere e coltura in vitro, che è attestata dalla mancanza di studi riportati sull'argomento. Le cellule epiteliali solo dentali che possono essere isolate sono pre-ameloblasts e cellule staminali dal ciclo cervicale20. Inoltre, le linee cellulari ameloblastic segnalati, principalmente ratto cappello-729, mouse LS830, ALC31e umano AM-132, spesso perdono le caratteristiche di differenziazione di ameloblasts in vivo : essi esprimono proteine della matrice extracellulare (EMPs) come ameloblastin similmente a secrezione-fase ameloblasts e anche KLK4 o SLC26A4/pendrin, come Stadio di maturazione Adamantoblasti8, ma sono più o meno incapaci di esprimere amelogenina e di mineralizzare la matrice per produrre lo smalto. L'isolamento di cellule staminali epiteliali dentale e Adamantoblasti embrionale può costituire un'opzione per studiare le prime fasi di differenziazione ameloblast, ma gli studi sul processo di mineralizzazione dello smalto terminale non possono essere effettuati in modo diverso rispetto a con modelli in vivo . Quest'ultima parte di amelogenesis è determinante per la qualità dello smalto. Considerando che i principali fattori coinvolti nello sviluppo del dente, come Bmp, Msx, Fgf, tacca, Shh, Wnt sono descritte bene33,34, coloro che sono strettamente coinvolti in qualità di smalto sono ancora poco conosciuti. La caratterizzazione dei fattori chiave in qualità di smalto è necessaria decifrare carie e scopri innovativo trattamento curativo o preventivo per carie dentaria, che costituiscono un problema importante di sanità pubblica come 92% di 20 a 64 anni adulti anziani nel mondo hanno o hanno avuto almeno una carie35,36,37.
Roditori esposti a tossici ambientali in grado di disgregare amelogenesi e alterare la qualità dello smalto possono costituire un buon modello per studi sui fattori ambientali. Procedure simili potrebbero essere utilizzate anche per gli studi funzionali sui geni di interesse direttamente o indirettamente coinvolti nell'amelogenesis. L'organo di micro-dissecato smalto è un materiale adatto per caratterizzare i meccanismi di azione delle sostanze tossiche e loro destinazione geni in vivo evitando qualsiasi polarizzazione sperimentale. Quando i difetti dello smalto dello sviluppo saranno caratterizzati, tale approccio poteva essere considerato un modello predittivo dei potenziali impatti patologico romanzo inquinanti.
Divulgazioni
Gli autori non hanno conflitti di interesse a divulgare.
Riconoscimenti
Questo lavoro è stato finanziato dall'Università Paris-Diderot, l'Istituto nazionale francese di salute e ricerca medica (INSERM) e l'Istituto francese per la ricerca odontoiatrici (IFRO).
Materiali
| Name | Company | Catalog Number | Comments |
| Bisphenol A | Sigma Aldrich, Saint Louis MO | 239658 | |
| formalin 10% | Sigma-Aldrich, Saint Louis, MO | HT5012 | |
| Tri-Reagent | Euromedex, France | TR118 | |
| RLT buffer | Qiagen, Les Ulis, France | 74126 | RNeasy Protect Mini Kit |
| Androgen receptor antibody | Santa Cruz Biotechnology, Santa Cruz, CA) | sc-816 | rabbit polyclonal antibody |
| PBS 10x | EUOMEDEX | ET330.A | |
| Sodium fluoride (NaF) | Sigma-Aldrich, Saint Louis, MO | S-1504 | |
| paraplast regular | Leica microsystems, Nanterre cedex, France | 39601006 | called was/parafin in the text |
| tissue OCT | VWR, Fontenay-sous-Bois, France | 411243 | |
| Extra Fine Bonn Scissors - Straight/8.5 cm | PHYMEP , Paris, France | 14084-08 | |
| Handle for Scalpel Blades - 12.5 cm | PHYMEP, Paris, France | 10035-12 | |
| Curved Scalpel Blade | PHYMEP , Paris, France | 10035-20 | |
| Dissecting Knife - Fine/Straight Tip | PHYMEP , Paris, France | 10055-12 | |
| Circle Knife | PHYMEP, Paris, France | 10059-15 | |
| scalpel blades n°11 Swann-Morton | VWR, Fontenay-sous-Bois, France | 233-0024 | |
| binocular lens | Leica biosystems, Nanterre cedex, France | MZFLIII |
Riferimenti
- Jedeon, K., et al. Enamel defects reflect perinatal exposure to bisphenol A. Am J Pathol. 183, 108-118 (2013).
- Jedeon, K., et al. Chronic Exposure to Bisphenol a Exacerbates Dental Fluorosis in Growing Rats. J Bone Miner Res. 31, 1955-1966 (2016).
- Alaluusua, S., et al. Developmental dental aberrations after the dioxin accident in Seveso. Environ Health Perspect. 112, 1313-1318 (2004).
- Chapple, I. L., et al. Interaction of lifestyle, behaviour or systemic diseases with dental caries and periodontal diseases: consensus report of group 2 of the joint EFP/ORCA workshop on the boundaries between caries and periodontal diseases. J Clin Periodontol. 44, S39-S51 (2017).
- Nanci, A. Enamel: Composition, Formation, and Structure. Ten Cate's Oral Histology Development, Structure, and Function. , 122-164 (2012).
- Leite, G. A., Sawan, R. M., Teofilo, J. M., Porto, I. M., Sousa, F. B., Gerlach, R. F. Exposure to lead exacerbates dental fluorosis. Arch Oral Biol. 56, 695-702 (2011).
- Jedeon, K., et al. Enamel hypomineralization due to endocrine disruptors. Connect Tiss Res. 55, 1-5 (2014).
- Jedeon, K., et al. Androgen receptor involvement in rat amelogenesis: an additional way for endocrine disrupting chemicals to affect enamel synthesis. Endocrinology. 157, 4287-4296 (2016).
- Weerheijm, K. L., Jalevik, B., Alaluusua, S. Molar-incisor hypomineralisation. Caries Res. 35, 390-391 (2001).
- Jälevik, B. Prevalence and Diagnosis of Molar-Incisor- Hypomineralisation (MIH): A systematic review. Eur Arch Paediatr Dent. 11, 59-64 (2010).
- Alaluusua, S. Aetiology of Molar-Incisor Hypomineralisation: A systematic review. Eur Arch Paediatr Dent. 11, 53-58 (2010).
- Jedeon, K., Berdal, A., Babajko, S., Gibert, Y. The tooth, target organ of Bisphenol A, could be used as a biomarker of exposure to this agent. Bisphenol A: Sources, Risks of Environmental Exposure and Human Health Effects. , 205-225 (2015).
- Fejerskov, O., Larsen, M. J., Richards, A., Baelum, V. Dental tissue effects of fluoride. Adv Dent Res. 8, 15-31 (1994).
- Robinson, C., Connell, S., Kirkham, J., Brookes, S. J., Shore, R. C., Smith, A. M. The effect of fluoride on the developing tooth. Caries Res. 38, 268-276 (2004).
- Sahlberg, C., Pavlic, A., Ess, A., Lukinmaa, P. L., Salmela, E., Alaluusua, S. Combined effect of amoxicillin and sodium fluoride on the structure of developing mouse enamel in vitro. Arch Oral Biol. 58, 1155-1164 (2013).
- Pritchett-Corning, K. R. Euthanasia of neonatal rats with carbon dioxide. J Am Assoc Lab Anim Sci. 48, 23-27 (2009).
- Hiller, C. R., Robinson, C., Weatherell, J. A. Variations in the composition of developing rat incisor enamel. Calcif Tissue Res. 18, 1-12 (1975).
- Robinson, C., Kirkham, J., Nutman, C. A. Relationship between enamel formation and eruption rate in rat mandibular incisors. Cell Tissue Res. 254, 655-658 (1988).
- Smith, C. E., Nanci, A. A method for sampling the stages of amelogenesis on mandibular rat incisors using the molars as a reference for dissection. Anat Rec. 225, 257-266 (1989).
- Chavez, M. G., et al. Isolation and culture of dental epithelial stem cells from the adult mouse incisor. J Vis Exp. (87), (2014).
- Brookes, S. J., Kingswell, N. J., Barron, M. J., Dixon, M. J., Kirkham, J. Is the 32-kDa fragment the functional enamelin unit in all species?. Eur J Oral Sci. 119, 345-350 (2011).
- Babajko, S., Jedeon, K., Houari, S., Loiodice, S., Berdal, A. Disruption of Steroid Axis, a New Paradigm for Molar Incisor Hypomineralization (MIH). Front Physiol. 8, 343 (2017).
- Houari, S., et al. Asporin and the mineralization process in fluoride-treated rats. J Bone Min Res. 29, 1446-1455 (2014).
- Denbesten, P., Li, W. Chronic fluoride toxicity: dental fluorosis. Monographs in oral science. 22, 81-96 (2011).
- Kirkham, J., Robinson, C., Phull, J. K., Shore, R. C., Moxham, B. J., Berkovitz, B. K. The effect of rate of eruption on periodontal ligament glycosylaminoglycan content and enamel formation in the rat incisor. Cell Tissue Res. 274, 413-419 (1993).
- Lacruz, R. S., et al. Identification of novel candidate genes involved in mineralization of dental enamel by genome-wide transcript profiling. J Cell Physiol. 227, 2264-2275 (2012).
- Wen, X., Paine, M. L. Iron deposition and ferritin heavy chain (Fth) localization in rodent teeth. BMC research notes. 6, 1 (2013).
- Houari, S., Loiodice, S., Jedeon, K., Berdal, A., Babajko, S. Expression of Steroid Receptors in Ameloblasts during Amelogenesis in Rat Incisors. Front Physiol. 7, 503 (2016).
- Kawano, S., et al. Establishment of dental epithelial cell line (HAT-7) and the cell differentiation dependent on Notch signaling pathway. Connect Tissue Res. 43, 409-412 (2002).
- Zhou, Y. L., Snead, M. L. Identification of CCAAT/enhancer-binding protein alpha as a transactivator of the mouse amelogenin gene. J Biol Chem. 275, 12273-12280 (2000).
- Nakata, A., et al. Establishment and characterization of a spontaneously immortalized mouse ameloblast-lineage cell line. Biochem Biophys Res Commun. 308, 834-839 (2003).
- Harada, H., et al. Establishment of ameloblastoma cell line, AM-1. Journal of oral pathology & medicine: official publication of the International Association of Oral Pathologists and the American Academy of Oral Pathology. 27, 207-212 (1998).
- Jussila, M., Thesleff, I. Signaling networks regulating tooth organogenesis and regeneration, and the specification of dental mesenchymal and epithelial cell lineages. Cold Spring Harb Perspect Biol. 4, a008425 (2012).
- Tucker, A., Sharpe, P. The cutting-edge of mammalian development; how the embryo makes teeth. Nat Rev Genet. 5, 499-508 (2004).
- Vos, T., et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380, 2163-2196 (2012).
- Marcenes, W., et al. Global burden of oral conditions in 1990-2010: a systematic analysis. J Dent Res. 92, 592-597 (2013).
- . Dental Caries (Tooth Decay) in Adults (Age 20 to 64) Available from: https://www.nidcr.nih.gov/DataStatistics/FindDataByTopic/DentalCaries/DentalCariesAdults20to64.htm (2017)
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon