Method Article
Un metodo per valutare le funzioni effettrici Fc-mediata indotte dagli anticorpi specifici di Hemagglutinin di riossidazione
In questo articolo
Riepilogo
Descriviamo un metodo per misurare l'attivazione di funzioni effettrici Fc-mediata dagli anticorpi che hanno come destinazione l'emagglutinina del virus dell'influenza. Questo dosaggio può essere adattato anche per valutare la capacità di anticorpi monoclonali o policlonali sieri altre glicoproteine di superficie virale di targeting di indurre immunità Fc.
Abstract
Gli anticorpi svolgono un ruolo cruciale nell'accoppiamento la risposta immunitaria innata e adattativa contro gli agenti patogeni virali attraverso i loro domini di legame dell'antigene e Fc-regioni. Qui, descriviamo come misurare l'attivazione di Fc funzioni effettrici dagli anticorpi monoclonali targeting l'emoagglutinina di virus dell'influenza con l'uso di una linea di cellule Jurkat geneticamente esprimendo un'attivazione digitare 1 Fc-FcγR. utilizzando questo metodo, la contributo delle specifiche interazioni Fc-FcγR conferito dalle immunoglobuline può essere determinata usando un'analisi in vitro .
Introduzione
Immunità prevista dal vaccino influenzale stagionale tradizionalmente è stata valutata dal emoagglutinazione inibizione (HI) analisi1, che misura la presenza di anticorpi che il sito di legame del recettore del hemagglutinin di destinazione. Questi anticorpi HI-attivo possono conferire immunità sterilizzante, ma sono generalmente stretti nella loro ampiezza di protezione, fornire l'immunità per solo un selezionare alcuni ceppi del virus dell'influenza. L'isolamento e la caratterizzazione di largamente reattivi anticorpi monoclonali che riconoscono l'emoagglutinina (HA) suggerire che lo sviluppo di un vaccino antinfluenzale universale è a portata di mano2,3,4, 5 , 6 , 7 , 8. uno degli obiettivi principali di un vaccino antinfluenzale universale è quello di indurre una risposta anticorpale forte verso le regioni conservate del virus influenzale9,10,11,12 , 13 , 14 , 15 , 16. in linea di massima gli anticorpi reattivi che riconoscono questi epitopi conservati, composto di neutralizzazione e non neutralizzando gli anticorpi17,18, hanno dimostrati di richiedono interazioni Fc-FcγR per ottimale protezione in vivo ed evidenziare il contributo di immunità Fc per la complessiva risposta immunitaria al virus influenzale19,20.
Componenti di protezione sono fondamentali per valutare l'immunità all'infezione. Questi indicatori consentono a scienziati e clinici valutare l'efficacia dei vaccini, il significato dei dati e il corso del trattamento. Il solo correlazione stabilito di protezione contro l'infezione da virus influenzale è l'analisi di inibizione di emagglutinazione. Un titolo di 01:40 è associato con una riduzione del 50% del rischio di malattia1,21 – e riflette la presenza di anticorpi che inibiscono agglutinazione prendendo di mira il recettore vincolante sito situato sulla testa globulare della HA. Tuttavia, dovrebbe anche essere notato che le risposte delle cellule T possono essere una componente migliore di protezione contro l'infezione da virus influenzale negli anziani. Interessante, un recente rapporto suggerisce che l'attività di inibizione della neuraminidasi può essere un migliore indicatore di immunità all'influenza22. Fortunatamente, tipico in vitro dosaggi come analisi di inibizione di neutralizzazione o neuraminidasi possono misurare anticorpi specifici del gambo o neuraminidasi HA. La maggior parte di questi saggi convenzionali in vitro , tuttavia, solo prendere in considerazione la funzione della regione di associazione dell'antigene dell'anticorpo e non misurano il ruolo della regione Fc. Inoltre, il contributo degli anticorpi non neutralizzanti che proteggere tramite Fc recettore fidanzamento in vivo non sono rilevati17,18. Al fine di misurare la protezione garantita dagli anticorpi che inducono immunità Fc quali citotossicità di anticorpo dipendente cellulo-mediata (ADCC), è necessaria un'analisi robusta in vitro .
Il metodo descritto di seguito valuta la capacità di anticorpi monoclonali murini di indurre funzioni Fc-mediata attraverso l'uso di una linea di cellule Jurkat geneticamente esprimendo un'attivazione murino digitare 1 FcR, FcγRIV. Impegno di anticorpo del FcγR trasduce quel fattore nucleare di trigger di attività luciferasica attivato T-cellule-mediata di segnalazione intracellulare. Il saggio ha diversi vantaggi rispetto alle tecniche tradizionali che richiedono isolamento e coltura di cellule effettrici primarie e l'uso di citometria a flusso per rilevare l'attivazione di funzioni effettrici Fc-mediata19,,23,24 ,25,26. In primo luogo, il protocollo descritto qui può essere facilmente adattato per incorporare diversi bersagli virali, FcγRs e anticorpi appartenenti a specie diverse (umane e murine). In secondo luogo, l'uso di una modifica per la cella di Jurkat linea esprimendo un FcγR con un gene reporter luciferasi sotto un fattore nucleare delle cellule T attivate (NFAT) consente per un saggio di grande formato che possa essere facilmente analizzato utilizzando un lettore di luminescenza di misura. Qui, l'attivazione tradizionale di cellule effettrici primario viene sostituito con l'induzione di NFAT-luciferasi all'impegno dell'anticorpo di un FcγR sulla superficie della cellula Jurkat. Questo test di formato piastra a 96 pozzetti consente la misurazione di fino a quattro diversi campioni in triplici copie con sette diluizioni – un numero di campioni che potrebbe essere ingombrante usando le tecniche tradizionali. Ci sono ulteriori punti da considerare con questo test che può influenzare la progettazione di esperimenti e l'interpretazione dei dati. Il bersaglio virale deve essere espresso sulla superficie delle cellule in ordine per riconoscimento anticorpale. Per ovviare a questo inconveniente, l'antigene bersaglio (ad es. una proteina virale interna) può essere rivestito direttamente sulla superficie di una piastra. Tuttavia, questo non è ancora stato rigorosamente testato. Inoltre, la modifica per la linea cellulare Jurkat esprime un solo tipo di attivazione FcγR e non esprime alcun FcγRs inibitorio, mentre linee cellulari primarie esprimono tutti i recettori in un contesto fisiologico.
Precedentemente abbiamo usato questo test per dimostrare che l'epitopo specificità in un contesto policlonale svolge un ruolo cruciale nella regolazione di funzioni effettrici Fc-mediata e che l'attivazione ottimale della risposta cellulo-mediata anticorpo-dipendente richiede due punti di Contattare27,28. Qui, descriviamo un metodo che valuta la capacità degli anticorpi monoclonali specifici del gambo per coinvolgere e attivare murino attivazione FcγRIV. Anche se ci sono eccezioni29,30, un gran numero di anticorpi reattivi largamente la regione gambo antigenicamente conservata del hemagglutinin di destinazione e quindi gioca un ruolo importante nello sviluppo di una influenza universale vaccino.
Protocollo
Gli esperimenti preformati in questo manoscritto sono stati fatti il codice istituzionale seguente Icahn School of Medicine di etica e regolamenti.
1. espressione di Influenza Virus Hemagglutinin tramite transfezione o infezione
Transfezione:
- Cellule embrionali umane del rene (HEK 293T) piastra ad una densità di 2 x 104 cellule/pozzetto in una cultura di tessuto bianca trattati piastra a 96 pozzetti e lasciate riposare per 4 h in un incubatore a 37 °C (con 5% CO2).
- Transfect cellule con 100 ng di DNA codificante per emoagglutinina virale e 0,2 μL di reagente di transfezione per pozzetto in un volume totale di 50 μL.
Nota: Entrambi plasmide e trasfettante reagente sono diluiti in 1 x Opti-minimo essenziale Media (MEM) ridotto del siero medio. - Dopo incubazione piastre in un incubatore a 37 °C con 5% CO2 per 18 h, rimuovere i supporti di transfezione.
2. infezione
- Cellule di rene canino piastra A549 o Madin Darby ad una densità di 2 x 104 cellule/pozzetto in una cultura di tessuto bianca trattati piastra a 96 pozzetti e crescono per almeno 18 h in incubatore a 37 °C con 5% CO2.
- Virus diluito in 1 x MEM e infettare le cellule ad una molteplicità di infezione di 0,33 per 1h in un incubatore a 37 °C con 5% di CO2, 1 o 3. Volume totale deve essere uguale a 100 μL.
Nota: x 10 MEM è diluito con acqua per fare un 1 x stock lavoro MEM diluizioni di virus citati sopra. - Dopo l'infezione, rimuovere l'inoculo e aggiungere 100 μL di 1 x MEM nella piastra in assenza di tripsina.
- Crescere le cellule infettate per 18-24 h in un incubatore a 37 °C con 5% CO2.
3. valutando l'attivazione FcRg/NFAT-mediata di attività luciferasica di anticorpi monoclonali o sieri
- In primo luogo, è possibile sostituire mezzi di sviluppo delle cellule trasfettate o infetti con 25 µ l di media di dosaggio (1 x RPMI 1640 supplementato con 4% (vol/vol) basso IgG fetale bovino sieri).
- In una piastra a 96 pozzetti separata, eseguire diluizioni quadruplo degli anticorpi di interesse a partire a 30 μg/mL utilizzando il supporto di analisi. Effettuare diluizioni in triplici copie ed un esempio di disposizione di piastra è illustrata in Figura 1A. Assicurati di includere un controllo che esclude anticorpo (nessun controllo dell'anticorpo) così come un controllo di sfondo (tampone del saggio da solo).
Nota: per entrambi il 'nessun anticorpo' e controlli di sfondo, aggiungere 25 µ l di tampone di dosaggio invece di anticorpo. - Trasferimento 25 μL di anticorpi diluiti in serie da passo 3.2 a rispettivi pozzetti su piatto di cellule trasfettate o cellule infettate.
- Incubare la piastra in un incubatore a 37 °C (con 5% CO2) per 15 min.
- Aggiungere 25 μL della cella appropriata dell'effettore modificate Jurkat esprimendo murino FcgRIV o FcgRIIIa umano (75.000 di cellule/pozzetto). Volume totale per ogni bene dovrebbe essere 75 µ l e la concentrazione iniziale e finale dell'anticorpo è a 10 µ g/mL (Figura 1B).
Nota: Per il controllo di sfondo, aggiungere 25 µ l di tampone di dosaggio invece di cellule effettrici. Per esaminare la fagocitosi cellulo-mediata anticorpo-dipendente, può essere utilizzato un cellulare Jurkat modificate esprimendo la FcgRIIa umana. - Incubare la piastra in un incubatore a 37 ° C con 5% CO2 per 6 h.
- Disgelo e tampone substrato caldo luciferasi in un'acqua di 37 °C per circa 1 h prima dell'uso.
Nota: Per rendere il tampone del substrato di luciferasi, ricostituire il liofilizzato luciferase assay substrato nel tampone fornito. Tampone substrato ricostituito può essere conservato a-30 °C a-10 °C fino a sei settimane. - Aggiungere 75 μL/pozzetto di tampone substrato luciferasi in tutti i pozzetti tranne per il controllo di sfondo.
- Continua a leggere un luminometro.
- Calcolare l'induzione di piega con la seguente equazione: piegare induzione = (valore di valore-sfondo indotto) / (nessun valore di valore-sfondo di mAb).
Risultati
Abbiamo dimostrato che un gambo specifiche mAb, 6F12, ma non testa testa-specifiche mAb, PY102, era in grado di attivare le cellule natural killer di primarie aumentando CD107a e interferone γ19. Per modellare la capacità di un anticorpo specifico del gambo di attivare le cellule NK umane primarie, ci mostrano che un mAb specifici del gambo, 6F12, robustamente può attivare la cella di Jurkat modificata esprimendo la murino FcγRIV da ~ 14-fold. D'altra parte, il mAb di testa-specifico, PY102 e il controllo IgG do non (Figura 2)28.
Per studiare se la molteplicità di infezione (MOI) possa influenzare l'induzione di cellule Jurkat esprimendo il FcγRIV murino, abbiamo infettato cellule MDCK con X31 (un ricombinato virus dell'influenza A esprimere l'emoagglutinina e neuraminidasi del eterologo Kong/1/68 (H3N2) virus con i segmenti interni del A/Puerto Rico/8/34 (H1N1)) con un MOI di 0,33, 1 o 3. Ventiquattro ore più tardi, cellule Jurkat esprimenti murini FcγRIV e mAb 9H 10 sono stati aggiunti a cellule MDCK infette. In Figura 3, indichiamo che le cellule infettate con un MOI di 3 possono indurre la luminescenza circa 3 volte superiore rispetto alle cellule MDCK infettate con un MOI di 0,33.

Figura 1 : Un disegno schematico di un esempio di layout di piastra e la composizione dei gruppi sperimentali. (A) la concentrazione iniziale per ogni campione di anticorpo è a 10 µ g/mL e diluito in serie su tutta la piastra (colonna 1 alla colonna 12) 4 volte. Ogni campione viene fatto in triplici copie. Fila G è riservata per il nessun controllo del mAb e riga H è sfondo. Il volume finale (B) per ogni gruppo sperimentale prima dell'aggiunta di tampone substrato luciferasi è 75 µ l. Di nota, il campione e 'nessun gruppo mAb' con 25 µ l di cellule effettrici aggiunto, mentre i gruppi di controllo sfondo hanno 75 µ l di media di dosaggio. Clicca qui per visualizzare una versione più grande di questa figura.
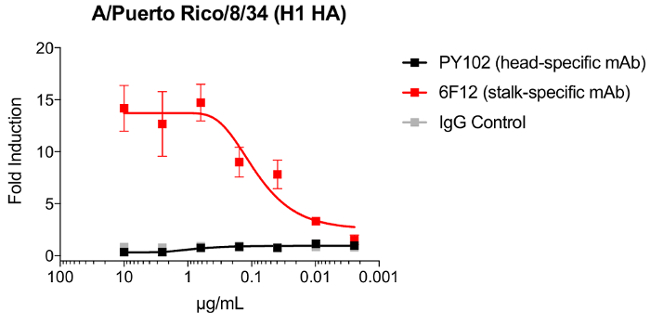
Figura 2 : Induzione di Jurkat modificate cellule esprimendo FcgR da un anticorpo monoclonale gambo. Le cellule A549 sono state infettate con A/Puerto Rico/8/34 (H1N1) con un MOI di 3. A 24 ore post infezione, murino Jurkat FcγRIV-esprimendo le cellule in combinazione con PY102, 6F12 o un controllo di IgG sono stati aggiunti. Induzione di cellule Jurkat sono stati valutati da segnale di luminescenza generata da luciferasi di lucciola sotto l'elemento di risposta NFAT. Barre di errore = deviazioni standard. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 : La molteplicità di infezione colpisce induzione di un anticorpo specifico del gambo. Le cellule MDCK sono state infettate con X31 (H3N2) con un MOI di 0,33, 1 o 3. A 24h post infezione, cellule Jurkat FcgR-esprimendo in combinazione con 9H 10 (diluizione iniziale di 10 µ g/mL) aggiunta. Induzione di cellule Jurkat sono stati valutati da segnale di luminescenza generata da luciferasi di lucciola sotto l'elemento di risposta NFAT. Barre di errore = deviazioni standard. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il metodo qui descritto consente di misurare la capacità di un anticorpo monoclonale specifico HA per coinvolgere il FcγRIV murino. L'antigene bersaglio, emoagglutinina di virus influenzale, è espresso sulla superficie delle cellule dopo l'infezione da virus o transfezione del DNA del plasmide. Il dosaggio ulteriormente è favorevole all'utilizzo di diverse proteine virali di superficie espressa in combinazione con altri FcγRs (esseri umani o murino). Inoltre, abbiamo utilizzato campioni di siero per valutare la capacità degli anticorpi in un contesto policlonale di indurre le funzioni effettrici Fc (dati non mostrati), che possono fornire informazioni più rilevanti quando lo studio della risposta immunitaria adattativa indotta tramite l'infezione o vaccinazione. Inoltre speculiamo che il dosaggio può essere modificato per misurare l'induzione di anticorpi che riconoscono proteine virali interne di rivestimento direttamente le piastre con proteina solubile. Tuttavia, questa metodologia non è stato rigorosamente testata.
Induzione delle funzioni effettrici anticorpo-dipendente può essere influenzata da diversi fattori tra cui, ma non limitato a realizzatore al rapporto di destinazione (numero di cellule effettrici aggiunto per pozzetto), la concentrazione dell'anticorpo utilizzato, il tempo d'incubazione tra le cellule effettrici e destinazione e la concentrazione di siero basso IgG utilizzato nel tampone.
Storicamente, il test standard per misurare l'attività di citotossicità cellulare dipendente dall'anticorpo di anticorpi o sieri policlonali coinvolge primarie cellule natural killer (NK) raccolte da donatori. Impegno di FcγR e l'attivazione del pathway intracellulari è in genere determinati dall'espressione di markers di attivazione CD107a e/o IFN-γ19,23,24,31. Anche se l'analisi classica utilizza cellule effettrici più rilevanti come essi non sono stati geneticamente ingegnerizzati, variazione di donatore a causa di differenze allelic nella FcγR può influire sull'attivazione delle cellule NK e provocare variazioni da lotto a lotto. Un test ELISA basati su dimero di FcγR o un rilascio di cromo uccidendo dosaggio25comprendono saggi alternativi utilizzati come surrogati per attività di ADCC. Anche se l'uso di un test ELISA basati su dimero di FcγR è a resa elevata, l'analisi non può essere fisiologicamente rilevante come questo dosaggio non fa uso di cellule effettrici32. Mentre le misure di analisi versione cromo diretta uccisione, non è elevato throughput e richiede cellule NK primarie che sono ancora donatore dipendente33. Un metodo recente descrivono l'uso di murini ibridome a cellula T che esprimono stabilmente chimerico FcγR-CD3ζ catena molecole e misure di attivazione attraverso la secrezione del-2. Il test descritto è simile al metodo descritto qui, che fa uso di una cellula T modificata come un surrogato per una cellula effector esprimendo un singolare attivazione FcγR34. In alternativa, una linea cellulare (NK92.05-CD16) esprimendo la FcγRIIIa può essere utilizzata come le cellule effettrici e upregulation dell'antigene degranulazione che CD107a viene utilizzato come un indicatore di attivazione. Tuttavia, l'uso di virioni e peptidi virali su piastre ELISA sul protocollo di quest'ultimo va notato come proteine coattati superfici idrofobiche non possono sempre ricapitolare la struttura fisiologica di antigeni35.
Il metodo qui descritto è un test formato da 96 pozzetti, fa uso di fisiologicamente rilevanti e nativamente espresso bersagli virali e possa essere modificati per gli anticorpi murini o umani. Le cellule Jurkat geneticamente modificate possono essere mantenute in cultura e crioconservati36. Anche se attualmente le cellule effettrici esprimono solo un FcγR d'attivazione, i numerosi vantaggi dell'utilizzo di questo protocollo descritto in questo studio devono tener conto quando si misura la funzione effector cellulo-mediata anticorpo-dipendente.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Questo progetto è stato finanziato in parte con fondi federali dal National Institute of Allergy e malattie infettive, National Institutes of Health, Department of Health and Human Services, sotto CEIRS contratto P01AI097092-04S1 (p.e.l.).
Materiali
| Name | Company | Catalog Number | Comments |
| A549 cells | ATCC | CCL-185 | Adenocarcinomic human alveolar basal epithelial cells |
| HEK 293T cells | ATCC | CRL-3216 | Human embryonic kidney cells |
| Lipofectamine 2000 | Life Technologies | 11668019 | Transfection reagent |
| 1X Opti-MEM Reduced Serum Medium | ThermoFisher Scientific | 51985-034 | |
| White tissue culture treated 96-well plate | Corning, Inc. | 3917 | Assay plates |
| 10X MEM | Gibco | 11430-030 | |
| Jurkat cell expressing murine FcgRIV | Promega | M1201 | Kit provides includes cells, Bio-Glo Luciferase assay system, 1X RPMI and low IgG serum |
| Jurkat cell expressing human FcgRIIIa | Promega | G7010 | Kit provides includes cells, Bio-Glo Luciferase assay system, 1X RPMI and low IgG serum |
| Jurkat cell expressing human FcgRIIa | Promega | G9901 | Kit provides includes cells, Bio-Glo Luciferase assay system, 1X RPMI and low IgG serum |
| Luminometer | BioTek | Synergy H1 Multi-Mode reader | Luminescence plate reader |
| Bio-Glo Luciferase Assay System | Promega | G7940 | Contains luciferase assay buffer and luciferase assay substrate |
| Madin Darby canine kidney cells | ATCC | CCL-34 | Canine kidney cells |
Riferimenti
- Hobson, D., Curry, R. L., Beare, A. S., Ward-Gardner, A. The role of serum haemagglutination-inhibiting antibody in protection against challenge infection with influenza A2 and B viruses. J Hygiene. 70 (04), 767-777 (1972).
- Throsby, M., et al. Heterosubtypic neutralizing monoclonal antibodies cross-protective against H5N1 and H1N1 recovered from human IgM+ memory B cells. PloS One. 3 (12), e3942 (2008).
- Ekiert, D. C., et al. Antibody recognition of a highly conserved influenza virus epitope. Science. 324 (5924), 246-251 (2009).
- Ekiert, D. C., et al. A Highly Conserved Neutralizing Epitope on Group 2 Influenza A Viruses. Science. 333 (6044), 843-850 (2011).
- Tan, G. S., et al. A pan-H1 anti-hemagglutinin monoclonal antibody with potent broad-spectrum efficacy in vivo. J Virol. 86 (11), 6179-6188 (2012).
- Tan, G. S., et al. Characterization of a Broadly Neutralizing Monoclonal Antibody That Targets the Fusion Domain of Group 2 Influenza A Virus Hemagglutinin. J Virol. 88 (23), 13580-13592 (2014).
- Friesen, R. H. E., et al. A common solution to group 2 influenza virus neutralization. PNAS. 111 (1), 445-450 (2014).
- Dreyfus, C., et al. Highly Conserved Protective Epitopes on Influenza B Viruses. Science. 337 (6100), 1343-1348 (2012).
- Krammer, F., Palese, P., Steel, J. Advances in Universal Influenza Virus Vaccine Design and Antibody Mediated Therapies Based on Conserved Regions of the Hemagglutinin. Curr Top Microb and Immunol. , (2014).
- Impagliazzo, A., et al. A stable trimeric influenza hemagglutinin stem as a broadly protective immunogen. Science. , (2015).
- Nachbagauer, R., Krammer, F. Clinical Microbiology and Infection. Clin Microb Infect. , 1-7 (2017).
- Krammer, F. Novel universal influenza virus vaccine approaches. Current opinion in virology. 17, 95 (2016).
- Steel, J., et al. Influenza virus vaccine based on the conserved hemagglutinin stalk domain. mBio. 1 (1), (2010).
- Krammer, F., Pica, N., Hai, R., Margine, I., Palese, P. Chimeric hemagglutinin influenza virus vaccine constructs elicit broadly protective stalk-specific antibodies. J Virol. 87 (12), 6542-6550 (2013).
- Krammer, F., Pica, N., Hai, R., Tan, G. S., Palese, P. Hemagglutinin Stalk-Reactive Antibodies Are Boosted following Sequential Infection with Seasonal and Pandemic H1N1 Influenza Virus in Mice. J Virol. 86 (19), 10302-10307 (2012).
- Hai, R., et al. Influenza viruses expressing chimeric hemagglutinins: globular head and stalk domains derived from different subtypes. J Virol. 86 (10), 5774-5781 (2012).
- Dunand, C. J. H., et al. Both Neutralizing and Non-Neutralizing Human H7N9 Influenza Vaccine-Induced Monoclonal Antibodies Confer Protection. Cell Host and Microbe. 19 (6), 800-813 (2016).
- Tan, G. S., et al. Broadly-Reactive Neutralizing and Non-neutralizing Antibodies Directed against the H7 Influenza Virus Hemagglutinin Reveal Divergent Mechanisms of Protection. PLoS Path. 12 (4), e1005578 (2016).
- DiLillo, D. J., Tan, G. S., Palese, P., Ravetch, J. V. Broadly neutralizing hemagglutinin stalk-specific antibodies require FcγR interactions for protection against influenza virus in vivo. Nat Med. 20 (2), 143-151 (2014).
- DiLillo, D. J., Palese, P., Wilson, P. C., Ravetch, J. V. Broadly neutralizing anti-influenza antibodies require Fc receptor engagement for in vivo protection. J Clin Invest. 126 (2), 605-610 (2016).
- Potter, C. W., Oxford, J. S. Determinants of immunity to influenza infection in man. Brit Med Bull. 35 (1), 69-75 (1979).
- Memoli, M. J., et al. Evaluation of Antihemagglutinin and Antineuraminidase Antibodies as Correlates of Protection in an Influenza A/H1N1 Virus Healthy Human Challenge Model. mBio. 7 (2), e00417 (2016).
- Jegaskanda, S., et al. Age-associated cross-reactive antibody-dependent cellular cytotoxicity toward 2009 pandemic influenza A virus subtype H1N1. J Infect Dis. 208 (7), 1051-1061 (2013).
- Jegaskanda, S., et al. Cross-Reactive Influenza-Specific Antibody-Dependent Cellular Cytotoxicity Antibodies in the Absence of Neutralizing Antibodies. J Immunol. 190 (4), 1837-1848 (2013).
- Jegaskanda, S., Wheatley, A. K., Kent, S. J. ScienceDirectAntibody-dependent cellular cytotoxicity and influenza virus. Curr Opin Virol. 22 (C), 89-96 (2017).
- Srivastava, V., et al. Identification of Dominant Antibody-Dependent Cell-Mediated Cytotoxicity Epitopes on the Hemagglutinin Antigen of Pandemic H1N1 Influenza Virus. J Virol. 87 (10), 5831-5840 (2013).
- He, W., et al. Epitope specificity plays a critical role in regulating antibody-dependent cell-mediated cytotoxicity against influenza A virus. PNAS. 113 (42), 11931-11936 (2016).
- Leon, P. E., et al. Optimal activation of Fc-mediated effector functions by influenza virus hemagglutinin antibodies requires two points of contact. PNAS. , 201613225 (2016).
- Benjamin, E., et al. A Broadly Neutralizing Human Monoclonal Antibody Directed against a Novel Conserved Epitope on the Influenza Virus H3 Hemagglutinin Globular Head. J Virol. 88 (12), 6743-6750 (2014).
- Ekiert, D. C., Kashyap, A. K., et al. Cross-neutralization of influenza A viruses mediated by a single antibody loop. Nature. 488 (7417), 526-532 (2013).
- He, W., et al. Broadly Neutralizing Anti-Influenza Virus Antibodies: Enhancement of Neutralizing Potency in Polyclonal Mixtures and IgA Backbones. J Virol. 89 (7), 3610 (2015).
- Kristensen, A. B., et al. Antibody Responses with Fc-Mediated Functions after Vaccination of HIV-Infected Subjects with Trivalent Influenza Vaccine. J Virol. 90 (12), 5724-5734 (2016).
- Greenberg, S. B., Criswell, B. S., Six, H. R., Couch, R. B. Lymphocyte cytotoxicity to influenza virus-infected cells. II. Requirement for antibody and non-T lymphocytes. J Immunol (Baltimore, Md. : 1950). 119 (6), 2100-2106 (1977).
- Corrales-Aguilar, E., Trilling, M., et al. A novel assay for detecting virus-specific antibodies triggering activation of Fcγ receptors. J Immunol Meth. 387 (1-2), 21-35 (2013).
- de Vries, R. D., et al. Influenza virus-specific antibody dependent cellular cytoxicity induced by vaccination or natural infection. Vaccine. 35 (2), 238-247 (2017).
- Cheng, Z., et al. Development of a robust reporter-based ADCC assay with frozen, thaw-and-use cells to measure Fc effector function of therapeutic antibodies. J Immunol Meth. 414 (1), 69-81 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon