Method Article
L'applicazione di geneticamente codificato fluorescente ossido nitrico (NO •) sonde, i geNOps, in tempo reale Imaging di NO • I segnali in singole cellule
In questo articolo
Riepilogo
This manuscript presents protocols for the application of novel genetically encoded nitric oxide (NO•) probes (geNOps) to monitor single cell NO• fluctuations in real-time using fluorescence microscopy. The Ca2+-triggered NO• formation on the level of individual endothelial cells was visualized by combining geNOps with a chemical Ca2+ sensor.
Abstract
L'ossido nitrico (NO •) è un piccolo radicale, che media più importanti funzioni cellulari nei mammiferi, batteri e piante. Nonostante l'esistenza di un gran numero di metodi per rilevare NO • in vivo e in vitro, il monitoraggio in tempo reale di NO • a livello di singola cellula è molto impegnativo. Gli effetti fisiologici o patologici di NO • sono determinati dalla concentrazione effettiva e tempi di questa radicale. Di conseguenza, i metodi che consentono la rilevazione cella singola di NO • sono altamente desiderabili. Recentemente, abbiamo ampliato il pallet di NO • Indicatori introducendo fluorescente a base di proteine geneticamente codificato ossido nitrico singolo sonde (NO •) (geNOps) che rispondono direttamente a cellulari NO • fluttuazioni e, di conseguenza, risponde a questa esigenza. Qui mostriamo l'utilizzo di geNOps per valutare intracellulari NO • segnali in risposta a due chimica diversa NO • molecole -liberating. I nostri risultati also confermare che preparata 3- (2-idrossi-1-metil-2-nitrosohydrazino) -N-metil-1-propanamine (NOC-7) ha un potenziale molto maggiore di evocare variazione intracellulari NO • livelli rispetto al inorganico NO • nitroprussiato donatore di sodio (SNP). Inoltre, live-cell imaging a due colori utilizzando le geNOps verdi (G-GENOP) e l'indicatore chimico Ca 2+ Fura-2 è stata eseguita per visualizzare la stretta regolamentazione di Ca 2+ -dipendente NO • formazione in singole cellule endoteliali. Questi esperimenti rappresentativi dimostrano che geNOps sono strumenti adatti per indagare la generazione in tempo reale e la degradazione di monocellulari NO • segnali in diversi apparati sperimentali.
Introduzione
Abbiamo recentemente sviluppato una nuova classe di geneticamente codificati fluorescenti NO • sonde, chiamato geNOps 1. Questi sensori sono costituiti da una semplice costruzione, batteri-derivati, NO • vincolante dominio 2, che è coniugato ad una proteina fluorescente distinta (FP) Variante 3 (ciano, verde o arancione FP). NO • legandosi al centro 4 ferro non-eme (II) entro i geNOps riduce istantaneamente l'intensità di fluorescenza 1. È importante sottolineare che il geNOps fluorescenza riprende rapidamente e completamente quando intracellulari NO • livelli declino 1. Di conseguenza, geNOps permettono imaging in tempo reale di (sotto) cellulari NO • fluttuazioni. Anche se il NO • rilevamento meccanismo della geNOps rimane poco chiaro fino ad ora, hanno dimostrato di essere ottimi NO • giornalisti, e quindi hanno la potenza di aprire una nuova era di policromo, quantitativa NO • bioimaging con alte risoluzioni spaziali e temporali 1, 5. Altri disponibili fluorescenti No • Le sonde sono basate su composti chimici di piccole dimensioni, che devono essere caricati nelle cellule, e sono irreversibilmente modificate da NO • 6. Ulteriori svantaggi di no • piccoli fluorofori sensibili sono il loro potenziale citotossicità e relativamente bassa specificità che rendono difficile usarli in modo affidabile, analitica e conclusiva 7, 8, 9. Anche se l'utilizzo efficace di sonde fluorescenti geneticamente codificate richiede tecniche di trasferimento genico efficienti, FP basati su sensori geneticamente codificate sono emersi come strumenti indispensabili che hanno rivoluzionato la nostra comprensione del funzionamento interno delle cellule 10, 11. Prima dello sviluppo dei singoli geNOps FP-base, un Förster trasferimento di energia di risonanza (FRET) a base di sensore NO •, indicato come NOA-1 12, è stato costruito. Sato et al. progettato questo sonda sofisticato che è costituito da due subunità del NO • -sensitive guanilato ciclasi solubile (SGC), entrambi coniugati sensori di agitarsi basati su segnalazione guanosina monofosfato ciclico (cGMP) livelli 12. Come questa sonda risponde alle cGMP, rileva solo indirettamente intracellulari NO • fluttuazioni 12. Sebbene NOA-1 risponde NO • aumenti nella gamma nano-molare, questo strumento non è stato frequentemente utilizzato finora, probabilmente a causa di limitazioni relative alla disponibilità e praticabilità di questo sensore bilaterale ingombrante.
Funzioni versatili di NO •, che hanno un impatto fondamentale processi biologici sono stati ben caratterizzati 13, 14. Molti studi hanno dimostrato che l'NO • concentration all'interno delle cellule e sottodomini determina il destino della cellula in materia di salute e le malattie 14, 15, 16. In mammiferi, NO • è principalmente generata enzimatica in vari tipi di cellule dalla famiglia 17 ben caratterizzato ossido nitrico sintasi (NOS). Finora, tre isoforme di NOS sono stati descritti 18, 19, 20; questi sono i Ca 2+ / calmodulina-dipendente endoteliale NOS (eNOS o NOS-3) 18 e neuronale NOS (nNOS o NOS-1) 19, e il Ca 2+ / calmodulina-indipendente costitutivamente attivo NOS inducibile (iNOS o NOS- 2) 20. Inoltre, l'esistenza di mitocondriale NOS (mtNOS) è stato anche suggerito 21. Tuttavia, mtNOS è considerato come una variante di splicing di nNOS, e non è quindi classificato separatamente come isoforma 21. Un'altra isoforma, oltre a quelli in cellule di mammifero, è il cosiddetto batterica NOS (bNOS), trova principalmente nei batteri gram-positivi 22. La produzione enzimatica di NO • è altamente controllato e dipende dalla disponibilità di alcuni cofattori come nicotinamide adenina dinucleotide fosfato (NADPH), flavina adenina dinucleotide (FAD), tetraidrobiopterina (BH4), ossigeno molecolare e L-arginina 17. Il cationico aminoacido L-arginina è il substrato che viene convertito in L-citrullina upon NO • produzione 17. Oltre al altamente regolata generazione enzimatica di NO •, è stato ipotizzato che il radicale può essere ridotto non enzimaticamente da pool di nitrito di mitocondri in condizioni di ipossia 23. Una volta NO • viene prodotto all'interno di una cella, può liberamente diffondere attraverso biomembrane 14,ref "> 15. Tuttavia, il molto breve emivita di questo radicale è determinata principalmente dalle condizioni ambientali, e vari percorsi e reazioni chimiche degradare efficientemente NO • livelli 24. Infine, la formazione, la diffusione, e la degradazione di NO • dipende su diversi parametri ambientali che determinano la concentrazione effettiva della molecola biologicamente attiva 24.
La tecnologia geNOps consente la rilevazione diretta di (sub) NO cellulare • fluttuazione 1 ed è quindi adatto a reinvestigate, e di recente scoperta dei meccanismi responsabili per l'accumulo e la decomposizione dei cellulari NO • segnali. Qui, mettiamo a disposizione i protocolli semplici e risultati rappresentativi per l'utilizzo di geNOps di visualizzare esogena evocato e endogeno generati profili NO •, a livello delle singole cellule. Inoltre, la tecnologia geNOps può essere adattato per applicatura in altri sistemi modello cellulare per studiare le complesse modelli di NO • formazione, la diffusione, e il degrado in risposta a diversi stimoli cellulari e sollecitazioni.
Protocollo
1. Preparazione di buffer chimici e soluzioni
- Preparare un buffer di memorizzazione contenente 135 mM NaCl, 5 mM KCl, 2 mM CaCl 2, 1 mM MgCl2, 10 mM HEPES, 2,6 mm NaHCO 3, 0,44 mM KH 2 PO 4, 0,34 mm Na 2 HPO 4, 10 mM D- glucosio, 2 mM L-glutammina, 1x MEM vitamine, acidi 1x MEM amminoacidi, 1% penna strep, e 1% amfotericina B. Sciogliere tutti i componenti in acqua distillata e mescolare il buffer per 20 minuti con un agitatore magnetico a temperatura ambiente. Regolare il pH a 7,44 con 1 M NaOH. Dopo l'aggiunta a gocce di NaOH, misurare il pH utilizzando un pHmetro mentre mescolando continuamente.
- Preparare una Ca 2+ -contenente tampone fisiologico che consiste di 140 mM NaCl, 5 mM KCl, 2 mM CaCl 2, 1 mM MgCl 2, 10 mM D-glucosio, e 10 mM HEPES. Regolare il pH a 7,4 con NaOH come descritto al punto 1.1.
- Preparare un buffer -free Ca 2+ che consiste degli stessi ingredienticome elencato nel passo 1.2. Utilizzare 1 mM EGTA invece di 2 mM.
- Solubilizzare Fura-02:00 in DMSO per ottenere una soluzione stock 1 mm. Aliquota della soluzione di riserva in fiale sigillate ermeticamente e conservare a -20 ° C per un massimo di un mese. Se congelato, consentire soluzione madre equilibrare a temperatura ambiente per almeno 1 ora al riparo dalla luce. Diluire la soluzione madre Fura-02:00 in 1 buffer di stoccaggio ml (punto 1.1) per ottenere una concentrazione finale di 3,3 micron.
- Preparare 1 ml di una soluzione 100 mM istamina magazzino in acqua distillata (pH 7,0). Diluire il 100 mM soluzione istamina magazzino in 100 ml Ca 2+ -contenente tampone fisiologica ad una concentrazione finale di 100 mM istamina.
- Solubilizzare Nω-Nitro-L-arginina (L-NNA) in 100 ml di tampone fisiologico contenente calcio per ottenere una concentrazione finale di 300 mM. Conservare le soluzioni a 37 ° C bagnomaria per almeno 1 ora fino a quando la L-NNA è completamente sciolto.
- Solubilizzare 10 mg NOC-7 in wa distillatater (pH 7,0) per ottenere una soluzione stock 10 mM. Aliquota della soluzione di riserva in piccole aliquote in fiale sigillate ermeticamente e conservare immediatamente a -70 ° C. Diluire la soluzione stock NOC-7 in tampone fisiologico per ottenere una concentrazione finale di 10 pM NOC-7.
NOTA: NOC-7 è un piccolo composto chimico che libera spontaneamente NO con una breve emivita. Sempre preparare i buffer di lavoro che consiste NOC-7 appena prima di ogni esperimento. - Fare una soluzione 1 mM di sodio nitroprussiato (SNP) in un buffer di calcio fisiologico e preparare una diluizione 10 micron.
NOTA: Sempre preparare piccole quantità (~ 10 ml) di soluzioni di NO-donatori a causa del tasso di degradazione rapida. - Preparare una soluzione tampone fosfato (PBS), composto da 137 mm NaCl, 2,7 mM KCl, 9,2 mm Na 2 HPO 4 e 1,5 mm KH 2 PO 4. Regolare il valore di pH a 7,44 con NaOH / HCl.
2. Preparazione delle cellule
NOTA: In order per ottenere uniformità nella prestazione di misurare ossido nitrico (NO •) in singole cellule utilizzando geNOps, le cellule devono essere pre-incubate con un ferro (II) / vitamina C contenente tampone prima esperimenti di imaging per ripristinare Fe 2+ all'interno del NO • -di legame dominio del NO • -probes. Nel caso di cellule HEK293 e EA.hy926, incubazione per 20 min con la soluzione ripetitore di ferro (II) conduce alla piena attivazione dei sensori NO •.
- Seed 5.5 x 10 5 EA.hy926 o HEK293 cellule per il giorno successivo o 3,5 x 10 5 cellule per il giorno dopo giorno dopo, il 30-mm vetrini da microscopio in un pozzo di un 6-pozzetti. Incubare le cellule a 37 ° C in ambiente umidificato con 5% di CO 2.
NOTA: Informazioni dettagliate sulla infezione da adenovirus di cellule di mammifero e la costruzione virus è stato descritto da Zhang et al. 25. Questo passaggio non si applica per le cellule HEK 293 che esprimono stabilmente G-GENOP. - Prendere siero fetale di vitello (FCS) e l'aquila mezzo modificato di Dulbecco (DMEM) senza antibiotici e aggiungere adeno-associato virus di tipo 5 (AAV5) vettore che trasporta il gene che codifica per il G-GENOP (MOI: 500 per le cellule EA.hy926 cedere quasi il 100 % di cellule positive; MOI: 1 è efficiente per le cellule HEK293).
NOTA: l'uso di vettori virali adeno-associati viene assegnato al gruppo di rischio 2. biosicurezza livello 2 di contenimento è generalmente richiesto per lavorare con questo vettore. Se necessario, infezione virale può essere eseguita anche in FCS contenenti terreno. In alternativa, le cellule possono essere transitoriamente trasfettate con vettori a base di lipidi 1. - Rimuovere il terreno di coltura e lavare le cellule con pre-riscaldato (37 ° C) PBS. Aggiungere 1 ml di terreno DMEM / AAV5 su ogni bene per 1 ora. Questo passaggio non si applica per le cellule HEK 293 che esprimono stabilmente G-GENOP.
- Aggiungere 1 ml di 20% FCS-DMEM contenente su ciascun pozzetto per una concentrazione finale di 10% FCS. Non rimuovere il supporto AAV5 contenenti dalle cellule. gentiluomoly Altalena la piastra di omogeneizzare il mezzo all'interno dei pozzetti. Incubare le cellule per 48 ore a 37 ° C in ambiente umidificato con 5% di CO 2. Questo passaggio non si applica alle cellule HEK 293 che esprimono stabilmente G-GENOP.
- Dopo 48 ore, lavare le cellule con PBS preriscaldata. Successivamente aggiungere 2 ml di buffer di stoccaggio pre-riscaldato (punto 1.1) in ogni pozzetto e incubare cellule presso la sala RT per almeno 1 ora al riparo dalla radiazione luminosa.
- Sostituire il buffer di storage con 1 ml / pozzetto del ferro (II) soluzione di richiamo a temperatura ambiente (RT). Incubare le cellule esattamente per 20 minuti al buio.
NOTA: Non superare o ridurre il tempo di incubazione ottimale come questo potrebbe influenzare la risposta dei NO • sonde. - Lavare le cellule una volta con tampone di conservazione e incubare ogni pozzetto con 2 ml di tampone di stoccaggio per almeno 2 ore a RT per permettere alle cellule di equilibrare.
- Sostituire il buffer di stoccaggio con 3.3 mM Fura-2:00 in tampone di stoccaggio 1 ml per 45 minuti a temperatura ambiente, protettadalla luce.
- Lavare le cellule due volte con tampone di conservazione e incubare, ancora una volta per almeno 30 min per permettere alle cellule di equilibrare.
3. cellulare Imaging in diretta di NO • e Ca 2+ Segnali in celle singole,
- Fissare un 30 millimetri vetrino rivestito con celle EAhy.926 o HEK293 (dal punto 2.1) in una camera metallica perfusione e posizionarlo sul microscopio. Collegare il tubo afflusso ai serbatoi tampone e l'efflusso ad una pompa a vuoto. Garantire un flusso costante e di evitare lo scarico del vetrino.
- Avviare la perfusione gravità-driven con tampone calcio fisiologica (dal punto 1.2) utilizzando un sistema di perfusione semiautomatico.
NOTA: Tale sistema è costituito da serbatoi tampone, rispettivi tubi, valvole magnetiche che sono controllate elettronicamente e una pompa a vuoto (vedere Figura 1B). La portata può variare da 1 a 3 ml / min, dipende dall'altezza dei serbatoi di perfusione. Per coerenti appli droga localizione, la portata di tutti i serbatoi utilizzati dovrebbe essere approssimativamente uguale. Questo dovrebbe essere testato prima di esperimenti di imaging. Si consideri che le cellule endoteliali rispondono a maggiore sforzo di taglio che può essere indotta da rigorosa perfusione. - Accendere il sistema di imaging e consentire riscaldamento di tutti i dispositivi per 30 min.
- Definire le impostazioni di imaging utilizzando rispettivo software. Selezionare eccitazione lunghezza d'onda di 340 nm e 380 nm per Fura-2 imaging e 480 nm per eccitante G-GENOP. Per ridurre al minimo la fluorescenza sbiancamento aumentare il binning fotocamera a 4 e ridurre l'intensità di eccitazione e tempi di esposizione. Vedere i passaggi anche 3,6-3,8.
NOTA: Le impostazioni di imaging e dei parametri dipendono dai dispositivi utilizzati, Fura-2 efficienza di carico e livelli di espressione G-GENOP. - Selezionare la regione di imaging spostando il xyz-tavolo del microscopio fino a diverse cellule fluorescenti sono nel fuoco. Quindi definire regioni di interesse (ROI) tramite il relativo software. Disegnare le regioni che coprono diversi intera singlcellule fluorescenti e per campo dell'imaging manualmente. Inoltre, definire una regione di dimensioni simili sfondo.
NOTA: una volta le immagini sono state acquisite e memorizzate ROI può anche essere definito di recente dopo il processo di imaging per ulteriori analisi utilizzando rispettivo software di analisi delle immagini (vedi Lista dei materiali). - Inizia la raccolta di dati su un microscopio a fluorescenza invertito e avanzato con una fase di campionamento motorizzata, e una sorgente di luce monocromatica. In alternativa eccitare a 340 nm e 380 nm per Fura-2 del mattino e 480 nm per G-GENOP, rispettivamente. Impostare rispettivi tempi di esposizione in modo che per tutti i canali, un segnale di fluorescenza chiaro è rilevabile nel tempo. Vedere anche il punto 3.4.
NOTA: Questo dipende dall'intensità della luce di eccitazione e il binning fotocamera. Ad esempio, utilizzare il 15% dell'intensità della luce di eccitazione, un binning telecamera 4 e 150 ms per 340 nm, 50 ms per 380 nm e 300 ms per 480 nm. Vedere anche il punto 3.4. - Raccogliere la luce emessa a 510 nm per Fura-2 / AM, 520 nm per G-genop utilizzando un dispositivo (CCD) fotocamera accoppiamento di carica con filtro corrispondente composto dell'eccitatore 500 nm, un dicroico 495 nm e un emettitore 510-520 nm. Registra un fotogramma totale ogni 3 secondi.
- Registrare i primi minuti (se necessario fino a 3 min) in fisiologica Ca 2+ tampone (1.2) per ottenere la linea di base di rispettivi segnali di fluorescenza nel tempo.
- Una volta che una linea di base stabile di fluorescenza si osserva, passare a 100 istamina mM o ATP (1 micron o 100 micron) contenente fisiologico Ca 2+ buffer per stimolare le cellule per 3 min.
NOTA: le cellule EA.hy926 che rispondono alle agonisti mostrano un forte aumento del rapporto di Fura-2 (fluorescenza eccitata a 340 nm divisa attraverso la fluorescenza eccitato a 380 nm) e una netta diminuzione del segnale di fluorescenza G-GENOP. - Passare indietro al Ca 2+ tampone fisiologico senza istamina o ATP e L-NNA per 5 minuti per rimuovere i composti dalle cellule. Questo passaggio potrebbe essere prolungata fino a quando le FLUORESmodifiche Cence vengono recuperati completamente.
- Amministrare 10 pM NOC-7 in fisiologica Ca 2+ buffer per 2 minuti utilizzando il sistema di perfusione. Il donatore non influisce fortemente G-GENOP fluorescenza che di solito diminuisce del> 20% in risposta a 10 micron NOC-7. Nelle cellule EA.hy926 l'effetto NOC-7 è di circa 3 volte più forte rispetto al agonisti indotta G-GENOP fluorescenza tempra.
- Lavare il NO • mescola rilasciante per circa 10 minuti con Ca 2+ fisiologica tampone e interrompere la registrazione, una volta fluorescenza basale è recuperato.
Analisi 4. I dati
- Export acquisito dati di intensità media di fluorescenza di singole cellule nel tempo, il software di analisi dei dati.
- Sottrarre rispettivi valori di fondo e calcolare il rapporto di 340 nm 380 nm dei rispettivi fura-2 segnali di ogni singola cellula nel tempo.
- Sottrarre i valori del canale G-GENOP sfondo avere la fl effettivauorescence intensità della sonda NO (F) nel tempo utilizzando qualsiasi software di calcolo.
- Dai valori di fluorescenza basale come F 0 (F 0 è la fluorescenza del probe NO nel tempo senza stimolazione). Vedere anche il punto 4.5 e Figura 1C.
- Calcolare una funzione nel tempo gli effetti di fluorescenza sbiancanti utilizzando la seguente equazione: F = 0 F inital • exp (-K • Time) + plateau F. F inital: viene avviato il massimo segnale di fluorescenza, una volta per immagini; K: costante di velocità della fluorescenza sbiancamento nel corso del tempo; F plateau: fluorescenza minimo raggiunto sbiancando nel corso del tempo; Vedere i passaggi anche 4.3- 4.4 e Figura 1C.
NOTA: Per l'approssimazione, possono essere utilizzati tutti i valori di fluorescenza nel tempo prima e dopo la stimolazione delle cellule. Ulteriori dettagli sono specificati da Bentley et al. 27. - Per normalizzare il segnale G-GENOP nel tempo, calcolare 1-F / F0 (passaggi 4.3-4.5). Vedere la figura 1C e 1D.
Risultati
Visualizzazione del singolo cellulare no • Profili in risposta a Transientemente Applied donatori di NO
Abbiamo utilizzato un clone di cellule HEK che esprime stabilmente G-GENOP (Figura 1A), per visualizzare NO • segnali sul singolo livello di cella in risposta a due differenti piccoli composti chimici NO-liberazione, NOC-7 e SNP. I NO • donatori sono stati consecutivamente applicati e rimossi dalle cellule durante l'imaging mediante un sistema di perfusione a gravità che assicurava flusso continuo (Figura 1B). Tutte le cellule esprimenti G-GENOP diverse intensità mostrato una netta riduzione della fluorescenza in risposta a NOC-7 e SNP (Figura 1C), indicando veloce NO • accumulo all'interno delle cellule dopo l'aggiunta dei NO • donatori. Segnali di fluorescenza normalizzati (1-F / F 0) hanno dimostrato che entrambi NO • donatori evocati cellula omogenear NO • elevazioni che completamente recuperato su dilavamento dei composti NO • rilasciante (Figura 1D). Tuttavia, 10 pM SNP indotta solo il 50% del NO cellulari • segnale (9,63 ± 1,05%, n = 3/38) che è stato raggiunto da 10 pM NOC-7 (18,10 ± 1,20%, n = 3/38, p < 0,0001). Per raggiungere pari livelli intracellulari NO • sia con NO • donatori, era necessaria una concentrazione di 1 mM di SNP (Figure 1C, 1D).
Successivamente, abbiamo testato la capacità di appena preparato contro scaduto NOC-7 per elevare intracellulari NO • livelli nelle cellule HEK. A questo scopo, abbiamo preparato quattro tamponi sperimentali contenenti 5 mM NOC-7. L'NO • donatore è stato aggiunto sia fresco appena prima della misurazione, o mantenuto entro serbatoi per 1 ora, 2 ore e 3 ore a temperatura ambiente prima della misurazione. I diversi tamponi sono stati consecutivamente applicati a ef rimossiROM le cellule che esprimono G-GENOP utilizzando un sistema di perfusione (Figura 2B). Questo approccio ha presentato la stabilità del acquose NOC-7 soluzioni che, come previsto, mostrava diminuita capacità nel corso del tempo per elevare i livelli intracellulari NO • (figure 2A, 2C). È interessante notare, NO • segnali recuperati significativamente più veloce sulla rimozione di buffer scaduti, rispetto al intracellulare NO • risposta che è stata evocata da fresco NOC-7 (Figura 2C), forse indicando adesione delle molecole intatte NO • -liberating a componenti cellulari .
Visualizzazione simultanea di Ca 2+ e NO • I segnali nelle cellule endoteliali singoli
Al fine di studiare Ca 2+ -triggered NO • formazione nelle cellule endoteliali, comunemente usato endoteliali immortalato cellule-surrogato, linea cellulare EA.hy926, era transiently trasfettate con G-GENOP e caricato con Fura-2 / AM (vedi protocollo 2.8). Trasfezione prodotto circa il 10% del G-GENOP cellule endoteliali positive (n = 6, Figura 3A), che è sufficiente a registrare Ca 2+ -evoked NO • produzione a livello di singole cellule endoteliali. Tuttavia, abbiamo raggiunto quasi il 100% di cellule EA.hy926 positivo G-GENOP utilizzando un vettore virale adeno-associato (n = 6; vedi protocollo 2.2). Prima di effettuare misurazioni multicanale, le cellule sono state incubate per 20 min a temperatura ambiente in tampone di conservazione composto L-NNA, un potente irreversibile NOS-inibitore 26. Le cellule di controllo sono stati mantenuti nello stesso buffer di storage senza L-NNA (vedi protocollo 1.1) (Figura 3B). Il trattamento di cellule di controllo con l'istamina, una inositolo potente 1,4,5-trifosfato (IP 3) -generating agonista, immediatamente elevato citosolico Ca 2+ livelli seguita da un graduale aumento di intracellulare NO • fino a quando l'agonista era removed (figure 3C, 3D). Le cellule pre-trattate con il NOS-inibitore hanno mostrato simili citosolico Ca 2+ segnali, mentre la intracellulare NO • il livello è rimasto pressoché inalterato in risposta all'istamina (Figura 3E). EA.hy926 cellule che esprimono G-GENOP sono stati trattati con 1 micron e 100 micron del IP 3 -generating agonista ATP, al fine di verificare se geNOps sono adatti per monitorare No • segnali in risposta a low fisiologico e sovra-fisiologiche concentrazioni di un agonista (Figura 3F). Nella linea cellulare endoteliale 1 mM ATP evocato una chiara citosolico NO • segnale, che è di circa la metà del segnale ottenuto da 100 ATP mM (Figura 3F).

Figura 1: Profili NO intracellulari in risposta a diversi NO-Liberati ng molecole. (A) le immagini dei campi larghi di cellule HEK che esprimono stabilmente citosolico G-GENOP. barra della scala = 20 micron. (B) illustrazione schematica di un sistema di perfusione a gravità basato semiautomatica per l'applicazione controllata e la rimozione di NOC-7 e SNP. (C) rappresentante (su 3 esperimenti indipendenti) non normalizzata intensità di fluorescenza cella singola traccia in unità arbitrarie in funzione del tempo di cellule HEK esprimenti stabilmente citosolico G-GENOP in risposta a 10 mM NOC-7, 10 pM SNP, e 1 mM SNP. Nero curva in grassetto rappresenta la curva media di 26 tracce unicellulari (le curve di colore grigio chiaro). Punteggiata curva nera rappresenta F 0, che è stato utilizzato per la normalizzazione. (D) le tracce singole normalizzate e invertite (1-F / F 0, le curve di colore grigio chiaro), e media della curva (nera curva grassetto) nel tempo in risposta a 10 micron NOC-7, 10 micron SNP, e 1 mm SNP estratto dal pannello C.es / ftp_upload / 55486 / 55486fig1large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
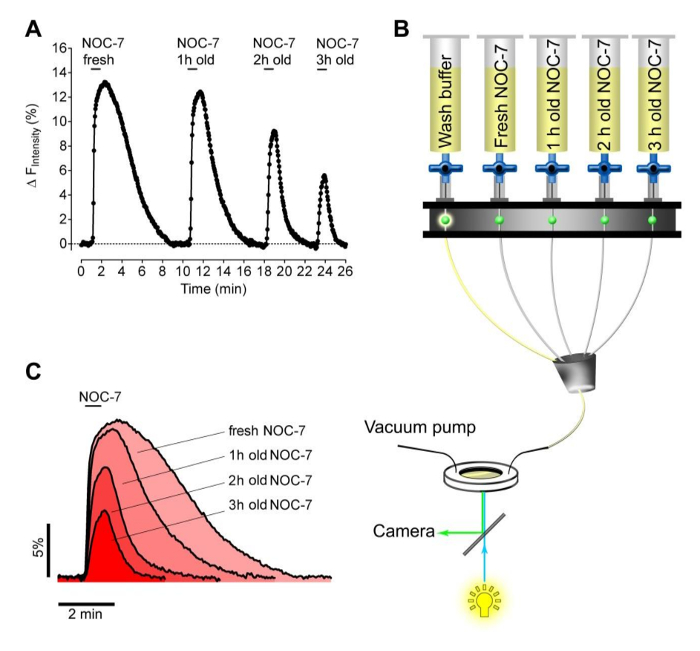
Figura 2: prova di stabilità del NOC-7 utilizzando cellule HEK stabilmente G-GENOP che esprimono. (A) Rappresentante NO • curva di concentrazione-risposta nel tempo di stabilmente G-GeNOps che esprimono cellule HEK su richiesta di soluzioni tampone fresche e vecchie NOC-7. Tutti i tamponi contenenti NOC-7 sono state preparate inizialmente con una concentrazione finale di 5 mM utilizzando la stessa soluzione madre (50 mM). Il tempo elapse delle rispettive soluzioni dopo la preparazione fino di imaging ammonta a 1 ora, 2 ore e 3 ore come indicato. (B) illustrazione schematica di un sistema di perfusione semiautomatico basato gravità consecutivamente aggiungere e rimuovere soluzioni NOC-7 contenente durante l'imaging. (C) correlazioni temporali dicellulari NO • segnali in risposta al preparato di fresco e vecchi NOC-7 tamponi. Clicca qui per vedere una versione più grande di questa figura.

Figura 3: l'imaging multicanale simultanea di NO • e Ca 2+ segnali nelle cellule singole EA.hy926. (A) a grande campo immagini di fluorescenza rappresentativi di cellule che esprimono EAhy.926 G-GENOP (pannello di sinistra) che vengono caricati con Fura-2 / AM (centrale e pannelli a destra). barra della scala = 20 micron. (B) illustrazione schematica del trattamento delle cellule EAhy.926 con 500 mM Nω-nitro-L-arginina (L-NNA) per 20 min all'interno di un piatto sei pozzetti prima della misura. (C) decorso Rappresentante di un record simultanea di Fura-2 (eccitazione: 340 nm / 380 nm emission: 510 nm) e segnali G-GENOP (eccitazione: 480 nm; emissione: 520 nm) in risposta a 100 pM istamina. Come indicato istamina è stato rimosso dopo 3 min utilizzando un sistema di perfusione. (Linea di Fura-2 segnali rapporto, F 340 / F 380 è grigio solido) (D) curve rappresentano le registrazioni simultanee di citosolico Ca 2+ e NO • (curva normalizzata e invertita, 1-F / F 0 è linea continua verde) segnali nel tempo di un singolo fura-2 / aM caricata cellule endoteliali che esprimono transitoriamente G-GENOP. Le cellule sono state stimolate con 100 mM di istamina per 3 minuti in un Ca 2+ (2 mM CaCl 2) contenente tampone (n = 8/3). (E) Rappresentante contemporaneamente registrato Ca 2+ (linea continua grigio) e NO • segnali (linea continua verde) nel tempo di una cellula EA.hy926 che è stato pretrattato con 500 mM Nω-nitro-L-arginina (L-NNA) prima la misura (n = 12/3). Le cellule sono state trattate con 100 mM istamina in presenza di 2 mMCa 2+. (F) curve medi rappresentano citosolici NO • segnali in risposta a 1 mM ATP seguita da una seconda stimolazione cellulare con 100 mM ATP. Barre rappresentano i valori medi ± SD di massimi segnali G-GENOP in risposta a 1 mM ATP (barra bianca) e 100 micron ATP (barra verde) di 4 esperimenti indipendenti; p <0,001 vs 1 mM ATP. P-value è stato calcolato utilizzando un test t spaiato. Clicca qui per vedere una versione più grande di questa figura.
Discussione
Dalla scoperta NO • come importante molecola di segnalazione in biologia 28, la misura in tempo reale specifica del radicale in singole cellule, tessuti e animali interi con alta risoluzione in modo fattibile e affidabile è stato aspirato. Qui riportiamo l'applicazione del recente sviluppo fluorescenti NO • sonde geneticamente codificati (geNOps) che consentono esatto live-cell imaging di NO • segnali con grande campo microscopia a fluorescenza 1.
Per aggirare le procedure di trasfezione elaborati e invasive clone di cellule HEK che esprime stabilmente verde fluorescente G-GENOP è stato utilizzato per quantificare esogeno generato monocellulari NO • Profili. Come cellule HEK normalmente non producono NO • endogenamente 29, questo tipo di cellule è adatto per la generazione di una linea cellulare sensore GENOP-based, che potrebbe essere utile per molte altre applicazioni in condizioni di co-colturacon NO • produzione di cellule primarie o anche negli animali 30 che vivono. Tuttavia, in questo studio abbiamo dimostrato la capacità di vari composti NO • -liberating, di diverse concentrazioni e le stabilità, per evocare intracellulari NO • segnali utilizzando il modello delle cellule HEK che esprimono G-GENOP. I nostri dati hanno rivelato che il NO • la concentrazione, la qualità -donor e il metodo di applicazione alla fine determinano i modelli di NO intracellulari • Profili. Tali informazioni sono indispensabili per la caratterizzazione in situ farmacocinetica di diversi NO • donatori, indicativi di diverse malattie. In particolare, geNOps hanno dimostrato di rispondere in modo stabile a molteplici applicazioni ripetitive di NO • -donor impulsi per un tempo molto lungo 1. Di conseguenza, gli esperimenti usando NO • -liberating composti qui presentati, consentono conclusioni semi-quantitative per quanto riguarda le varie ampiezze e cinetica della rispettiva NO cellulare226; segnali (figure 1 e 2).
Sebbene il esprimono stabilmente clone cellulare HEK deriva probabilmente da una singola cellula, un'ampia eterogeneità di G-geNOps livelli di espressione è stato osservato (Figura 1). Questa è una caratteristica comune di cloni cellulari stabili come la trascrizione del gene (genoma integrato) di interesse è sotto il controllo di diversi fattori quali diversi stress ambientali 31 che influenzano i tassi di crescita cellulare 32, e lo stato del ciclo cellulare 33. I singoli geNOps FP-based sono sonde non raziometriche e, quindi, l'NO • indotta perdita di intensità di fluorescenza aumenta con il livello di espressione GENOP 1. Di conseguenza, la normalizzazione dei segnali geNOps è essenziale per quantificare cellulari NO • segnali particolarmente in caso di un'analisi comparativa. Come indicato nel nostro studio recente, una stretta correlazione lineare Bra l'intensità di fluorescenza basale geNOps e la forza del quenching di fluorescenza NO • indotta in un ampio intervallo di intensità di fluorescenza è stato trovato 1. Questa è una caratteristica importante di geNOps per la quantificazione assoluta di cellulari NO • segnali. Come mostrato in Figura 1, la normalizzazione dei segnali G-geNOps in risposta al NOC-7 e SNP rivelato omogenei NO • segnali in diverse cellule HEK dallo stesso piatto, indicando che le cellule HEK non sono diverse per quanto riguarda la loro capacità di assumere e degradare NO • radicale che deriva dal NO • donatore. Al contrario, utilizzando geNOps in cellule HeLa hanno dimostrato chiari eterogeneità di cellulari NO • segnali tra cellule diverse in risposta a NOC-7. Queste differenze puntare a specifici del tipo NO • metabolismo e decomposizione tariffe cellulari, che potrebbe avere molteplici implicazioni nella fisiologia cellulare e la patologia, e può essere scoperto usando il GENOPLa tecnologia s.
Tuttavia, due importanti caratteristiche di geNOps devono essere considerati con attenzione per il corretto utilizzo dei sensori e delle interpretazioni dei dati: i) geNOps richiedono adeguata di ferro (II) per rispondere pienamente alle NO • 1 e ii) a seconda della variante di FP, geNOps può essere sensibile al pH 1. Qui si descrive un protocollo che è stato trovato per essere adatto per il ferro non tossico (II) la supplementazione di geNOps, che sono espressi in entrambi i HEK, HeLa o cellule EA.hy926 (vedi protocollo 2.6). Mentre è stato dimostrato che il trattamento delle cellule con il ferro (II) / vitamina C non ha influenzato la morfologia cellulare, la vitalità cellulare e l'attività metabolica delle cellule 1, potrebbe essere essenziale per ottimizzare questo importante passo per altri tipi di cellule e tessuti. Tuttavia, in alcune condizioni sperimentali, il requisito di ferro (II) loading potrebbe limitare l'applicabilità geNOps. In particolare, è stato dimostrato che l'ascorbato può ridurre NO • 35 e ascorbato-ferro (II) sono in grado di pulire NO • 36, 37. Inoltre, l'eccesso di ferro (II) e ascorbato possono indurre una risposta infiammatoria 39 e eNOS sganciamento di 41. Tali effetti devono essere considerati quando si utilizza la tecnologia geNOps. E 'stato dimostrato che in certe condizioni sperimentali, il pH intracellulare è influenzato significativamente 34, che ha il potenziale per influenzare il geNOps fluorescenza 1. In particolare, i ciano e verde geNOps varianti sono relativamente pH sensibile che mostra una diminuzione della fluorescenza su acidificazione 1. Quindi, i cambiamenti acuti di (sotto) pH cellulare potrebbero simulare falsi No • segnali quando si utilizzano i geNOps sensibili pH. Come suggerito nel nostro precedente lavoro, l'utilizzo parallelo di No • geNOps insensibili (geNOps mut) e Contro negativoLS si consiglia di sezionare vero cellulare NO • segnale dal pH cambia 1. Inoltre variazioni di pH cellulare possono essere ispezionati con sonde di pH, come Sypher 34.
Inoltre, abbiamo visualizzato il enzimatica endogena NO • formazione in risposta ad una fisiologica Ca 2+ -mobilizing agonista nella cellula endoteliale surrogata EA.hy926. La linea cellulare EA.hy926 è un sistema modello utilizzato di frequente che esprime costantemente eNOS 38. L'utilizzo di geNOps transitoriamente espressi in cellule EA.hy926, ha confermato che IP 3 mediata Ca 2+ segnali evocano profonda NO • formazione in questo tipo di cellule, che è stato quasi completamente bloccato da L-NNA. Al fine di correlare temporalmente Ca 2+ con No • segnali, le cellule G-GENOP che esprimono sono stati caricati con le sostanze chimiche Ca 2+ -indicatore Fura-2 / am UV-eccitabile. La separazione spettrale della Ca 2+ legato e non legato Fura-2 fluo rescence dal segnale G-GENOP può essere facilmente raggiunto con filtro commercialmente disponibili imposta 40. Imaging entrambe le sonde hanno svelato che il Ca 2+ -triggered enzimatica NO • formazione si verifica molto più lento rispetto al citosolico Ca 2+ aumento di questo tipo di cellule endoteliali. Cinetiche simili di monocellulari NO • segnali nelle cellule endoteliali da arteria polmonare bovina in seguito al trattamento delle cellule con la IP 3 -generating bradichinina agonista, così come sforzi di taglio sono stati segnalati con NOA-1, un sensore altamente NO • sensitive indiretta 12 . Pertanto, questi dati sottolineano che il Ca 2+ -evoked eNOS derivato NO • formazione richiede un certo tempo di avviamento fino al raggiungimento della piena attività enzimatica. Sebbene la cinetica di cellulare NO • formazione, diffusione e degradazione possono essere estratti da altri dati, ad esempio misure di tensione basato su NO • indotta rilassamento dei vasiss = "xref"> 26, il grande vantaggio di NO fluorescenti • sonde è che convertono direttamente cellulari NO • fluttuazioni in segnali visibili in tempo reale. Quindi, di imaging NO cellulare • segnali con geNOps offre alta risoluzione spaziale e temporale, e offre possibilità uniche a (ri) indagare la (sub) cellulare NO • omeostasi. Per esempio, immagini eNOS spola 42 in combinazione con la tecnologia geNOps in singole cellule endoteliali potrebbe essere adatto per correlare NO • formazione con la localizzazione subcellulare e traslocazione del NO • -produzione enzimatica o altre proteine rilevanti quali calmodulina e caveolin 43.
Qui si descrive l'applicazione possibile del G-GENOP che esprimono cellule HEK e EA.hy926 di visualizzare in modo esogeno ed endogeno generato cellulari NO • segnali a livello di singola cellula e in tempo reale su un ampio campo convenzionale fluorescenza microscope. I nostri dati implicano che geNOps sono adatti per monitorare specificamente (sotto) cellulari NO • dinamiche in varie condizioni sperimentali utilizzando tutti i tipi di tipi di cellule interessanti.
Divulgazioni
EE, MW, RM e WFG, membri del personale della Medical University di Graz, hanno depositato una domanda di brevetto del Regno Unito (numero domanda di brevetto WO2015EP74877 20.151.027, la priorità numero GB20140019073 20.141.027) che descrivono parti della ricerca in questo manoscritto. Le licenze relativi a questo brevetto sono forniti per Next Generation imaging di fluorescenza (NGFI) GmbH ( http://www.ngfi.eu/ ), una società spin-off dell'Università di Medicina di Graz.
Riconoscimenti
The authors acknowledge C.J. Edgell, Pathology Department, University of North Carolina at Chapel Hill, NC, USA for providing the EA.hy926 cells. Author E.E. is supported by Nikon Austria within the Nikon-Center of Excellence, Graz and is a fellow of the Ph.D. program in Molecular Medicine at the Medical University of Graz. The researchers are also supported by the Ph.D. program Metabolic and Cardiovascular Disease (DK-W1226) of the Medical University of Graz. This work was also funded by the FWF project P 28529-B27. Microscopic equipment is part of the Nikon-Center of Excellence, Graz that is supported by the Austrian infrastructure program 2013/2014, Nikon Austria Inc., and BioTechMed, Graz.
Materiali
| Name | Company | Catalog Number | Comments |
| NaCl | Carl Roth, Karlsruhe, Germany | 3957.20 | sodium chloride |
| KCl | Carl Roth, Karlsruhe, Germany | 6781.1 | potassium chloride |
| CaCl2·2H2O | Carl Roth, Karlsruhe, Germany | T885.1 | calcium chloride dihydrate |
| MgCl2·6H2O | Carl Roth, Karlsruhe, Germany | 2189.2 | magnesium chloride hexahydrate |
| HEPES | Carl Roth, Karlsruhe, Germany | 9105.3 | 4-(2-Hydroxyethyl)-1-piperazineethanesulfonic acid |
| NaHCO3 | Carl Roth, Karlsruhe, Germany | 8551.1 | sodium hydrogencarbonate |
| KH2PO4 | Merck, Darmstadt, Germany | 104873 | potassium dihydrogen phosphate |
| Na2HPO4·2H2O | Carl Roth, Karlsruhe, Germany | 4984.1 | sodium hydrogenphosphate dihydrate |
| D(+)-Glucose monohydrate | Carl Roth, Karlsruhe, Germany | 6780.1 | >99.5%; for cell culture, endotoxin free |
| EGTA | Carl Roth, Karlsruhe, Germany | 3054.2 | ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid; calcium chelating agent |
| NaOH | Carl Roth, Karlsruhe, Germany | 6771.1 | sodium hydroxide |
| HCl | Carl Roth, Karlsruhe, Germany | 4625.1 | hydrochloric acid, fuming, 37% (~10 N) |
| DMSO | Carl Roth, Karlsruhe, Germany | 4720.1 | dimethyl sulfoxide; highly polar, aprotic organic solvent |
| L-Glutamic acid hydrochloride | Sigma Aldrich, Vienna, Austria | G2128 | (S)-2-Aminoglutaric acid |
| DMEM, low glucose | Sigma Aldrich, Vienna, Austria | D5523 | Dulbecco’s Modified Eagle’s Medium - low glucose; with 1,000 mg/L glucose and L-glutamine, without sodium bicarbonate, powder, suitable for cell culture |
| MEM Vitamin solution (100x) | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 11120037 | 100x the vitamins found in the standard Minimum Essential Medium (MEM) |
| MEM Amino acids solution (50x) | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 11130036 | 50x the essential amino acids (except L-glutamine) found in the standard Minimum Essential Medium (MEM) |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 15140122.00 | antibiotics to prevent bacterial contamination of cell cultures |
| Amphotericin B | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 15290026.00 | Gibco Amphotericin B contains 250 µg of amphotericin B (Fungizone) and 205 µg of sodium deoxycholate; prevents the contamination of cell cultures by yeast and multicellular fungi |
| FCS | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 10270106 | Fetal Bovine Serum, qualified, E.U.-approved, South America origin |
| PBS, pH 7.4 | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 10010031.00 | phosphate-buffered saline |
| Fura-2 (AM) | Teflabs, Austin, TX, USA | 102 | fluorescent cytosolic calcium indicators |
| Histamine dihydrochlorid | Sigma Aldrich, Vienna, Austria | H7250 | 2-(4-Imidazolyl)ethylamine dihydrochloride; IP3-generating agonist |
| Nω-Nitro-L-arginine | Sigma Aldrich, Vienna, Austria | N5501 | N5-(Nitroamidino)-L-2,5-diaminopentanoic acid; L-NNA; inhibitor of nitric oxide synthase |
| NOC-7 | Calbiochem/Merck, Darmstadt, Germany | 487952 | 3-(2-Hydroxy-1-methyl-2-nitrosohydrazino)-N-methyl-1-propanamine; nitric oxide (NO) donor short half-life of NO release |
| Sodium nitroprusside dihydrate | Santa Cruz Biotechnology, Texas, USA | sc-203395A | sodium nitroferricyanide(III) dihydrate; nitric oxide releasing compound |
| 30 mm Cover slips | Karl Hecht, Sondheim v. d. Rhön, Germany | 41001130 | glass cover slips, HECHT "Assistent", size 1, round, 30 mm, (VE: 100 pcs.) |
| Iron(II) booster solution | Next generation fluorescent imaging (NGFI), Graz, Austria | n.a. | Iron(II) containing physiological buffer for non toxic iron(II) loading of cells; http://www.ngfi.eu/product/ironii-booster-solution/ |
| G-geNOp plasmid | Next generation fluorescent imaging (NGFI), Graz, Austria | n.a. | plasmid DNA encoding green NO sensitive probe (G-geNOp); http://www.ngfi.eu/product/g-genop/ |
| G-geNOp AAV5 | Next generation fluorescent imaging (NGFI), Graz, Austria | n.a. | adenovirus encoding green NO sensitive probe (G-geNOp); http://www.ngfi.eu/product-category/genops/viral-genops-vectors/g-genop-aav5/ |
| G-geNOp sensor cell line | Next generation fluorescent imaging (NGFI), Graz, Austria | n.a. | human embryonic kidney cell line (HEK293) stably expressing green NO sensitive probe (G-geNOp); http://www.ngfi.eu/product-category/genops/g-genop-sensor-cell-line/ |
| HEK293A cell line | Invitrogen/Thermo Fisher Scientific, Waltham, MA, USA | R70507 | subclone of human embryonic kidney cell line (HEK293) |
| EA.hy926 cell line | American Type Culture Collection (ATCC), Wesel, Germany | CRL-2922 | somatic cell hybrid clone of human umbilical vein cell line with a thioguanine-resistant clone of A549 |
| TILL iMIC | Till Photonics, Graefling, Germany | n.a. | digital microscope |
| Polychrome V monochromator | Till Photonics, Graefling, Germany | n.a. | ultra fast switching |
| AVT Stingray F145B | Allied Vision Technologies, Stadtroda, Germany | n.a. | Versatile CCD camera with Sony ICX285 EXview HAD sensor, IEEE 1394b |
| alpha Plan Fluar 40 | Zeiss, Göttingen, Germany | n.a. | 40X objective |
| dichroic filters | Chroma Technology Corp, Rockingham, Vermont, USA | n.a. | GFP emitter 514/3 nm (515dcxr) |
| ValveBank8 Controller | AutoMate Scientific, Inc., Berkeley, California, USA | 01-08 | programmable perfusion system control unit |
| BVC control | Vacuubrand, Wertheim, Germany | 727200 | Chemistry diaphragm pump ME 1C; vacuum pump for perfusion system |
| ImageJ software | NIH Image | Java image processing program inspired by NIH Image. http://imagej.net/Welcome |
Riferimenti
- Eroglu, E., et al. Development of novel FP-based probes for live-cell imaging of nitric oxide dynamics. Nat Commun. 7, 10623(2016).
- Bush, M., et al. The structural basis for enhancer-dependent assembly and activation of the AAA transcriptional activator NorR. Mo. Microbiol. 95 (1), 17-30 (2015).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nat. Methods. 13 (7), 557-562 (2016).
- D'Autréaux, B., Tucker, N., Spiro, S., Dixon, R. Characterization of the Nitric Oxide-Reactive Transcriptional Activator NorR. Globins and Other Nitric Oxide-Reactive Proteins, Part B. Poole, ed.P. oole,R. .K. .,(ed)., 437, 1st edition, Elsevier textbooks, s.l. 235-251 (2008).
- Strack, R. Sensors and probes: Yes to genetically encoded NO• sensors. Nat Methods. 13 (4), 288(2016).
- Auten, R. L. Response to 'The use of diaminofluorescein for nitric oxide detection: Conceptual and methodological distinction between NO and nitrosation. Free Radic. Biol. Med. 50 (12), 1812(2011).
- Sivaraman, G., Anand, T., Chellappa, D. A Fluorescence Switch for the Detection of Nitric Oxide and Histidine and Its Application in Live Cell Imaging. ChemPlusChem. 79 (12), 1761-1766 (2014).
- Ye, X., Rubakhin, S. S., Sweedler, J. V. Detection of nitric oxide in single cells. Analyst. 133 (4), 423-433 (2008).
- Thyagarajan, B., Malli, R., Schmidt, K., Graier, W. F., Groschner, K. Nitric oxide inhibits capacitative Ca2+ entry by suppression of mitochondrial Ca2+ handling. Br J Pharmacol. 137 (6), 821-830 (2002).
- Germond, A., Fujita, H., Ichimura, T., Watanabe, T. M. Design and development of genetically encoded fluorescent sensors to monitor intracellular chemical and physical parameters. Biophy. Rev. 8, 121-138 (2016).
- Malli, R., Eroglu, E., Waldeck-Weiermair, M., Graier, W. F. Filling a GAP-An Optimized Probe for ER Ca2+ Imaging In Vivo. Cell Chem Biol. 23 (6), 641-643 (2016).
- Sato, M., Hida, N., Umezawa, Y. Imaging the nanomolar range of nitric oxide with an amplifier-coupled fluorescent indicator in living cells. Proc Natl Acad Sci USA. 102 (41), 14515-14520 (2005).
- Weidinger, A., Kozlov, A. V. Biological Activities of Reactive Oxygen and Nitrogen Species: Oxidative Stress versus Signal Transduction. Biomolecules. 5 (2), 472-484 (2015).
- Paolo, S. Nitric Oxide in Human Health and Disease. Encyclopedia of life sciences. , Wiley. Chichester. (2005).
- Pacher, P., Beckman, J. S., Liaudet, L. Nitric oxide and peroxynitrite in health and disease. Physiol Rev. 87 (1), 315-424 (2007).
- Bonafe, F., Guarnieri, C., Muscari, C. Nitric oxide regulates multiple functions and fate of adult progenitor and stem cells. J Physiol Biochem. 71 (1), 141-153 (2015).
- Forstermann, U., Sessa, W. C. Nitric oxide synthases: regulation and function. Eur. Heart J. 33 (7), 829-837 (2012).
- Dudzinski, D. M., Igarashi, J., Greif, D., Michel, T. The regulation and pharmacology of endothelial nitric oxide synthase. Annu Rev Pharmacol Toxicol. 46, 235-276 (2006).
- Zhou, L., Zhu, D. -Y. Neuronal nitric oxide synthase: structure, subcellular localization, regulation, and clinical implications. Nitric Oxide. 20 (4), 223-230 (2009).
- Aktan, F. iNOS-mediated nitric oxide production and its regulation. Life Sci. 75 (6), 639-653 (2004).
- Ghafourifar, P., Cadenas, E. Mitochondrial nitric oxide synthase. Trends Pharmacol Sci. 26 (4), 190-195 (2005).
- Crane, B. R., Sudhamsu, J., Patel, B. A. Bacterial nitric oxide synthases. Annu Rev Biochem. 79, 445-470 (2010).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nat Rev Drug Discov. 7 (2), 156-167 (2008).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochim Biophys Acta. 1411 (2-3), 273-289 (1999).
- Zhang, Y., et al. Estrogen-related receptors stimulate pyruvate dehydrogenase kinase isoform 4 gene expression. J Biol Chem. 281 (52), 39897-39906 (2006).
- Holzmann, S., Kukovetz, W. R., Windischhofer, W., Paschke, E., Graier, W. F. Pharmacologic differentiation between endothelium-dependent relaxations sensitive and resistant to nitro-L-arginine in coronary arteries. J Cardiovasc Pharmacol. 23 (5), 747-756 (1994).
- Bentley, M., et al. Vesicular calcium regulates coat retention, fusogenicity, and size of pre-Golgi intermediates. Mol Biol Cell. 21 (6), 1033-1046 (2010).
- Ignarro, L. J. Nitric oxide: a unique endogenous signaling molecule in vascular biology. Biosci Rep. 19 (2), 51-71 (1999).
- Upreti, M., Kumar, S., Rath, P. C. Replacement of 198MQMDII203 of mouse IRF-1 by 197IPVEVV202 of human IRF-1 abrogates induction of IFN-β, iNOS, and COX-2 gene expression by IRF-1. Biochem Biophys Res Com. 314 (3), 737-744 (2004).
- Lacin, E., Muller, A., Fernando, M., Kleinfeld, D., Slesinger, P. A. Construction of Cell-based Neurotransmitter Fluorescent Engineered Reporters (CNiFERs) for Optical Detection of Neurotransmitters In Vivo. J Vis Exp. (111), (2016).
- de Nadal, E., Ammerer, G., Posas, F. Controlling gene expression in response to stress. Na. Rev Genet. 12 (12), 833-845 (2011).
- Latchman, D. S. Transcriptional Gene Regulation in Eukaryotes. Encyclopedia of life sciences. , Wiley. Chichester. (2005).
- Bertoli, C., Skotheim, J. M., de Bruin, R. A. M. Control of cell cycle transcription during G1 and S phases. Nat Rev Mol Cell Biol. 14 (8), 518-528 (2013).
- Poburko, D., Santo-Domingo, J., Demaurex, N. Dynamic regulation of the mitochondrial proton gradient during cytosolic calcium elevations. J Biol Chem. 286 (13), 11672-11684 (2011).
- Suarez, S. A., et al. Nitric oxide is reduced to HNO by proton-coupled nucleophilic attack by ascorbate, tyrosine, and other alcohols. A new route to HNO in biological media. J Am Chem Soc. 137 (14), 4720-4727 (2015).
- Kuropteva, Z. V., Kudryavtsev, M. E. Ferrous-ascorbate complexes as carriers of nitric oxide. Gen Physiol Biophys. 16 (1), 91-96 (1997).
- Vanin, A. F., Huisman, A., Stroes, E. S., Ruijter-Heijstek, F. C., Rabelink, T. J., van Faassen, E. E. Antioxidant capacity of mononitrosyl-iron-dithiocarbamate complexes: implications for NO trapping. Free Radic Biol Med. 30 (8), 813-824 (2001).
- Lindberg, R. A., Dewhirst, M. W., Buckley, B. J., Hughes, C. S., Whorton, A. R. Ca2+-dependent nitric oxide release in endothelial but not R3230Ac rat mammary adenocarcinoma cells. Am J Physiol. 271 (1), 332-337 (1996).
- Campo, G. M., et al. The SOD mimic MnTM-2-PyP(5+) reduces hyaluronan degradation-induced inflammation in mouse articular chondrocytes stimulated with Fe (II) plus ascorbate. Int J Biochem Cell Biol. 45 (8), 1610-1619 (2013).
- Waldeck-Weiermair, M., et al. Spatiotemporal correlations between cytosolic and mitochondrial Ca2+ signals using a novel red-shifted mitochondrial targeted cameleon. PLOS ONE. 7 (9), 45917(2012).
- Kuzkaya, N., Weissmann, N., Harrison, D. G., Dikalov, S. Interactions of peroxynitrite with uric acid in the presence of ascorbate and thiols: implications for uncoupling endothelial nitric oxide synthase. Biochem Pharmacol. 70 (3), 343-354 (2005).
- Liu, J., Hughes, T. E., Sessa, W. C. The first 35 amino acids and fatty acylation sites determine the molecular targeting of endothelial nitric oxide synthase into the Golgi region of cells: a green fluorescent protein study. J Cell Biol. 137 (7), 1525-1535 (1997).
- Feron, O. The Endothelial Nitric-oxide Synthase-Caveolin Regulatory Cycle. J Biol Chem. 273 (6), 3125-3128 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon