Method Article
Identificazione di un Epitopo Lineare B-cell monoclonale riconosciuto Peptide scansione-assistito
In questo articolo
Riepilogo
Here, the authors present a simple and efficient protocol to define a linear antigenic epitope using a purified monoclonal antibody and peptide scanning through dot-blot hybridization. The identified epitope can then be used in therapeutic and diagnostic applications.
Abstract
L'identificazione di un epitopo antigenico da parte del sistema immunitario permette la comprensione del meccanismo di protezione di anticorpi neutralizzanti che possono facilitare lo sviluppo di vaccini e farmaci peptidici. scansione Peptide è un metodo semplice ed efficace che mappa semplicemente l'epitopo lineare riconosciuto da un anticorpo monoclonale (mAb). Qui, gli autori presentano una metodologia di determinazione epitopi che coinvolge le proteine ricombinanti in serie tronche, design peptide sintetico, e dot-blot ibridazione per il riconoscimento antigenico di proteina di rivestimento del virus della necrosi nervoso utilizzando un anticorpo monoclonale neutralizzante. Questa tecnica si basa sulla ibridazione dot-blot di peptidi sintetici e mAbs su una membrana di fluoruro di polivinilidene (PVDF). La regione minima antigenica di una proteina di rivestimento virale riconosciuta dalla RG-M56 mAb può essere ridotto passo-passo guarniti mappatura peptide su un peptide epitopo 6-mer. Inoltre, la scansione alanina mutagenesi e residui subsostituzioni con può essere effettuata per caratterizzare il significato di legame di ogni residuo di amminoacido costituente l'epitopo. I residui che fiancheggiano il sito epitopi sono stati trovati a svolgere un ruolo critico nella regolazione del peptide conformazione. Il peptide epitopo identificata può essere usato per formare cristalli di epitopi complessi peptide-anticorpo per uno studio x-ray diffrazione e la concorrenza funzionali, o terapeutica.
Introduzione
Nel sistema immunitario, la ricombinazione di segmenti V, D, J e permette agli anticorpi di creare enormi variazioni di complementarietà determinazione regioni (CDR) per il legame ai vari antigeni per proteggere l'host da infezione patogena. La difesa di neutralizzazione degli anticorpi contro gli antigeni dipende dalla complementarità spaziale tra i CDR degli anticorpi e gli epitopi degli antigeni. Pertanto, la comprensione di questa interazione molecolare aiuterà disegno vaccino profilattico e terapeutico sviluppo peptide farmaci. Tuttavia, questa interazione neutralizzazione può essere influenzato sia dalla più domini antigenici da un singolo antigene e da più CDR di anticorpi, che di conseguenza rendono il processo determinazione epitopo più complesso. Fortunatamente, lo sviluppo della tecnologia degli ibridomi, che fonde singole cellule produttrici di anticorpi con cellule di mieloma, consente un lotto costantemente dividendo di cellule secrete un anticorpo specifico, noto come un anticorpo monoclonale (mAb) 1. cellule di ibridoma producono questi puri, ad alta affinità anticorpi monoclonali di legarsi a un singolo dominio antigenica di un antigene specifico. Con il rapporto di antigene-anticorpo stabilito, diversi approcci, tra cui la scansione peptide, può essere utilizzato per determinare l'epitopo di un antigene utilizzando il mAb corrispondente. I recenti sviluppi nella tecnologia peptide sintetico hanno reso la tecnica di scansione peptide più accessibile e più conveniente per effettuare. Brevemente, un insieme di sovrapposizione peptidi sintetici sono prodotti secondo una sequenza antigene bersaglio e sono associate ad una membrana solido supportato per mAb ibridazione. scansione Peptide non solo offre un modo semplice per mappare la regione di legame dell'anticorpo, ma facilita anche aminoacidi (aa) mutagenesi tramite scansione residuo o di sostituzione per valutare l'interazione vincolante tra ciascun residuo aa del peptide epitopo e REC dell'anticorpo.
Qui, il presente studio descrive un protocollo per l'identificazione efficiente della epitopo lineare della proteina di rivestimento giallo cernie virus della necrosi nervosa (YGNNV) utilizzando un neutralizzante mAb 2, 3, 4. Il protocollo include mAb la preparazione, la costruzione e l'espressione di proteine ricombinanti in serie tronche, sintetico disegno peptide sovrapposizione, dot-blot ibridazione, la scansione alanina, e la sostituzione mutagenesi. Considerando il costo elevato di sintesi peptidica, la fase di troncare serialmente le proteine ricombinanti di una proteina bersaglio desiderato è stato modificato, e la regione antigenica è stata ridotta a circa 100 a 200 residui aa prima dell'esecuzione del sintetico matrice peptide analisi dot-blot.
Protocollo
1. Preparazione di anticorpo monoclonale
- Cultura i monoclonali murini cellule di ibridoma RG-M56 2 in terreno privo di siero in fiaschi 175T a 37 ° C con 5% di CO 2 supplemento. Raccogliere il surnatante quando il colore del mezzo diventa giallo dopo cinque giorni di incubazione.
NOTA: cellule di ibridoma sono state coltivate in terreno privo di siero per evitare la contaminazione di anticorpi da siero bovino fetale. - Centrifugare il surnatante a 4.500 xg per 30 minuti a 4 ° C e scartare il pellet residui cellulari.
- Aggiungere 2 ml di agarosio proteina G (fornito come un impasto 50%) per una colonna di 5 ml ed equilibrare con 10 volumi di resina (10 ml) di PBS ghiacciato.
- Carico 200 mL del supernatante anticorpi (passo 1.2) sulla colonna e scartare il pass-through.
- Aggiungere 10 ml di PBS ghiacciato alla colonna di lavarlo. Ripetere due volte.
- Aggiungere 10 ml di 50 mM glicina, pH 2.7 alla colonna per eluire l'anticorpo proteina G-associata. Colnare 900 microlitri frazioni in una provetta contenente 100 ml di 10x tampone di neutralizzazione (1 M Tris, 1,5 M di NaCl, e 1 mM EDTA, pH 8,0).
- Conservare l'anticorpo purificato nel 50% glicerolo con 0,03% NaN 3 a -20 ° C.
2. Costruzione ed espressione di serie troncati proteine ricombinanti
- Preparare una miscela di reazione di PCR: 5 ml di 10x tampone Pfu, 0,2 mM di ogni dNTP, 0,2 micron primer forward 3, 0,2 micron inverso Primer 3, 2 mM MgSO 4, 1 ng di pET20b-1A59 DNA 3 plasmide, e 2,5 U ( unità) di polimerasi Pfu DNA; aggiungere DDH 2 O per un volume finale di 50 microlitri.
- campioni eseguito in un termociclatore automatica utilizzando i seguenti parametri: Ciclo 1 (94 ° C per 5 min); cicli di 2-36 (94 ° C per 30 s, 63 ° C per 30 s, e 72 ° C per 60 s); e il ciclo di 37 (72 ° C per 7 min).
- Estrarre la reazione a catena della polimerasi (PCR) prodotti utilizzando un kit di purificazione PCR 5 per facilitare la seguente digestione enzima di restrizione.
- Digerire i frammenti di DNA PCR-amplificato con Nde I e Xho I enzimi di restrizione e legare ciascuno di questi frammenti di DNA in Nde I e Xho I enzima-spaccati PET-20b (+) vettoriale. Trasformare i costrutti in cellule di Escherichia coli DH-5alfa-competente 6.
- Preparare la miscela di digestione in un tampone di digestione (20 mM Tris-acetato, 10 mM Mg (CH 3 COO) 2, 50 mm KCH 3 COO, e 1 mM DTT, pH 7.9) con 1 mg di DNA PCR-amplificato o PET-20b (+) DNA vettoriale e 2 U di Nde I e Xho I di restrizione enzimi in un volume finale di 20 microlitri.
- Mescolare la miscela di digestione delicatamente e far girare rapidamente verso il basso. Incubare a 37 ° C per 2 ore in un bagno asciutto per garantire il taglio completo della restrizione sedersies.
- Estrarre i frammenti di DNA con enzimi di restrizione digerito usando un kit di purificazione PCR 5 per facilitare la seguente costruzione plasmide.
- Preparare l'impasto legatura in tampone legatura (66 mM Tris, 5 mM MgCl 2, 1 mM ATP, e 5 mm DTT, pH 7,5) con 100 ng di predigerito, DNA PCR-amplificato, 10 ng di predigerito PET-20b (+) DNA vettore, e 5 U di T4 DNA ligasi in un volume finale di 10 microlitri.
- Mescolare il composto legatura delicatamente e girare rapidamente verso il basso. Incubare a 16 ° C per 18 ore in un bagno d'acqua.
- Mettere 10 ml di campioni legatura in 100 ml di cellule DH-5α-competenti e mescolare delicatamente prima di mettere la provetta in ghiaccio per 30 min. Mettere la provetta in un bagno asciutto a 42 ° C per 90 s per indurre shock termico 7. trasferire immediatamente il tubo sul ghiaccio per 2 minuti.
- Aggiungere 900 ml di Luria-Bertani (LB) brodo (1% Bacto triptone, 0,5% Bacto lievito estrat, e 0,5% NaCl, pH 7,0) al tubo. Incubare a 37 ° C con 150 rpm agitazione per 45 min. Agglomerare le cellule per centrifugazione a 4.000 x g per 10 minuti e scartare il surnatante.
- Risospendere il pellet con 50 ml di brodo LB e diffondere ogni trasformazione su piastre LB pre-riscaldato contenenti 100 mg ampicillina / mL. Incubare le piastre a 37 ° C per 16 h.
- Prendete una singola colonia utilizzando una punta di 200 microlitri e metterlo in 3 ml di brodo LB contenente 100 mg ampicillina / ml in un tubo 15 ml vagamente innevate. Incubare a 37 ° C con 150 rpm agitazione per 12 ore.
- Estrarre il DNA plasmide 8 da ogni cultura e la sequenza usando promotore T7 e primer terminator T7 per confermare la sequenza di 9.
- Dopo la conferma di sequenza, di trasformare 10 ng di DNA da questi PET-20b (+) plasmidi con diverse lunghezze del gene della proteina di rivestimento YGNNV nel ceppo BL-21 (DE3) di E. coli da noiing il metodo shock termico 7. Seguire i passaggi 2.3.6-2.3.8 per eseguire la trasformazione.
- Trasferire una singola colonia da ogni trasformata E. coli BL-21 cellule in 3 ml di brodo LB contenente 100 mg ampicillina / ml in un tubo 15 ml vagamente innevate. Incubare la cultura a 37 ° C con agitazione 150 rpm.
- Raffreddare la coltura a 25 ° C quando la OD 600 della coltura è di circa 0,6 e aggiungere IPTG ad una concentrazione finale di 0,4 mM di indurre l'espressione della proteina ricombinante. Incubare la cultura per un extra di 4 ore a 25 ° C con 200 giri al minuto agitazione.
- Trasferire 1 ml di coltura in una provetta. Agglomerare le cellule per centrifugazione a 12.000 xg per 1 min e scartare il surnatante.
- Risospendere il pellet cellulare in 100 ml di tampone di denaturazione (8 M urea, 20 mM sodio fosfato, e 0,5 M NaCl, pH 7,4) pipettando su e giù con una micropipetta. Mescolare nel vortex vigorosa.
NOTA: Il sol campioneutions dovrebbero ora essere semi-trasparente, un po 'appiccicoso, e pronto per il saggio di ibridazione dot-blot.
3. Progettazione e sintesi di peptidi sovrapposti
- Progettazione e sintesi di 3 seriali peptidi 20-mer che ogni sovrapposizione con il suo successore da 10 residui aa dalla regione 195-338 aa della proteina di rivestimento YGNNV per restringere la regione epitopo di RG-M56 mAb da dot blotting.
- Progettazione e sintetizzare peptidi 3 tre 8-Mer (195 VNVSVLCR 202, 197 VSVLCRWS 204, e 199 VLCRWSVR 206) con una sovrapposizione di 6 residui aa sul prossimo peptide sintetico per ridurre l'epitopo regione di 195-206 aa dal dot blotting.
- Progettazione e sintetizzare 3 7-mer (196 NVSVLCR 202 e 195 VNVSVLC 201), 6-mer (195 VNVSVL 200, 196 NVSVLC 201, e 197 VSVLCR 202), e 5-mer peptidi (195 VNVSV 199, 196 NVSVL 200, 197 VSVLC 201, e 198 SVLCR 202), con una sovrapposizione di 6, 5 e 4 residui aa rispettivamente, sui loro peptidi vicini per minimizzare la regione epitopo dal dot blotting.
4. Dot-blot ibridazione
- Sciogliere ciascun peptide sintetizzato in dimetilsolfossido (DMSO) ad una concentrazione finale di 10 mg / mL.
NOTA: Per superare varie solubilità di peptidi sintetici, tutti i peptidi sintetici deve essere sciolto in DMSO. DMSO è un buon solvente per sciogliere completamente peptidi idrofobi o idrofili. - Immergere la membrana di polivinilidene fluoruro (PVDF) con metanolo per 2 min.
NOTA: membrana PVDF è fino a resistente a DMSO 100%; altri possono non essere così. - Equilibrare la membrana PVDF con buffer modificato Towbin (25 mM Tris, 192 mM glicina, e 0,1% SDS, pH 8,3) per2 min.
NOTA: 10-20% (v / v) di metanolo può essere aggiunto al buffer Towbin modificato per migliorare i risultati di trasferimento. - Risciacquare un pezzo di carta cromatografica con tampone Towbin modificato. Posizionare la membrana PVDF sulla carta cromatografia. Attendere fino a quando il buffer Towbin modificato è scomparsa dalla superficie della membrana PVDF prima di procedere alla fase successiva.
- Aggiungere 2 ml di ogni campione peptide alla membrana con una punta di 10 microlitri. Far asciugare la membrana PVDF sulla carta cromatografia per 10 min. Aggiungere ciascun campione peptide lentamente e gradualmente sulla membrana per evitare troppa diffusione.
- Bloccare la membrana in tampone TBST (0,05% (v / v) Tween-20, 20 mM Tris, 150 mM NaCl, pH 7,4) con 5% di latte scremato per 30 minuti a temperatura ambiente agitando delicatamente.
- Aggiungere RG-M56 mAb a una diluizione finale di 1: 1.000 in tampone TBST con 5% di latte scremato alla membrana. Incubare la membrana a 37 ° C per 1 ora agitando delicatamente.
- Rimuovere l'anticorpo cosìluzione. Lavare la membrana in tampone TBST per 5 minuti agitando delicatamente. Ripetere due volte.
- Aggiungere l'anticorpo secondario (capra anti-IgG di topo, Fc, fosfatasi alcalina coniugata) a una diluizione finale di 1: 5.000 in tampone TBST con 5% di latte scremato alla membrana. Incubare la membrana a 37 ° C per 1 ora agitando delicatamente.
- Scartare la soluzione di anticorpi. Lavare la membrana in tampone TBST per 5 minuti agitando delicatamente. Ripetere la fase di lavaggio due volte.
- Sviluppare la membrana con soluzione di substrato BCIP / NBT a temperatura ambiente per 15 minuti al buio. Arrestare lo sviluppo lavando la membrana con DDH 2 O quando appare il segnale.
- Asciugare la membrana e catturare l'immagine dot-blot utilizzando un sistema di immagini.
- Misurare l'intensità di ogni macchia di punti utilizzando immagine software di analisi 3.
5. alanina scansione e Sostituzione
- Progettare e sintetizzare 3 alanina e methipeptidi sostituzione onine. Sostituire ogni residuo aa con alanina per la 8-mer peptide 195 VNVSVLCR 202 e sintetizzare peptidi 195 ANVSVLCR 202, 195 VAVSVLCR 202, 195 VNASVLCR 202, 195 VNVAVLCR 202, 195 VNVSALCR 202, 195 VNVSVACR 202, 195 VNVSVLAR 202, e 195 VNVSVLCA 202 . Sostituire leucina aa residuo 200 a metionina per creare la SJNNV genotipo epitopo peptide 195 VNVSVMCR 202.
- Seguire Sezione 4 per eseguire la scansione e alanina sostituzione mutagenesi puntino assorbente.
Risultati
L'obiettivo di questo esperimento è stato quello di identificare un epitopo attraverso dot assorbente con anticorpo monoclonale. Per restringere rapidamente ed efficientemente giù regione antigenica riconosciuto dal mAb, l'intera lunghezza e proteine di rivestimento ricombinante YGNNV serialmente troncati con un tag di fusione 6xHis al C-terminale sono stati espressi da un sistema di espressione di E. coli PET 10 (Figura 1A). Le proteine ricombinanti risultanti sono stati avvistati sulla membrana PVDF con RG-M56 mAb e anticorpo anti-6xHis per dot-blot ibridazione. Il blotting dot rivelato segnali positivi contro 1-338 aa (full-length), 51-338 aa, e 195-338 aa, ma non 1-100 AA o 1-200 aa proteine ricombinanti (Figura 1B). La matrice dot ibridato contro l'anticorpo anti-6xHis e confermato l'espressione di tutte le proteine ricombinanti. Questi dati indicano che l'epitopo del riconoscimento RG-M56 mAb è situato in una nea proteina ricombinante 144-aaR la C-terminale della proteina di rivestimento YGNNV (195-338 bis).
Successivamente, seriali peptidi 20-mer con 10 aa-residui a lungo sovrapposizioni sul loro prossimo sono stati progettati e sintetizzati dalla sequenza di 144-aa proteina ricombinante per la scansione del peptide per restringere la regione epitopo. Questi peptidi sintetici sono stati avvistati su una membrana PVDF e sottoposti a dot-blot ibridazione con RG-M56 mAb. Il risultato ha mostrato segnali positivi solo sul peptide 195-214 aa ed il controllo positivo, 195-338 aa proteina ricombinante (Figura 2A). Come l'epitopo si trova all'interno del peptide 195-214 aa regione, ma non la regione aa peptide 205-224, tre seriali peptidi 8-mer con residui 6-aa sovrapporsi da AA residui 195-206 (peptidi 195-202 bis, 197- 204 bis, e 199-206 aa) sono stati progettati e sintetizzati. Dot-Blot risultati di ibridazione hanno mostrato segnali positivi sul peptide 195-202 aa e il positivo controllo peptide 195-214 aa utilizzandoRG-M56 mAb (Figura 2B).
Scansione alanina e sostituzione mutagenesi sono stati eseguiti per valutare la specificità di ciascun residuo aa dell'epitopo 8-mer, 195 VNVSVLCR 202. Ogni residuo aa del peptide 8-mer stato sostituito individualmente con alanina. L'array mutazione peptide alanina è stato posto su una membrana PVDF utilizzando peptide 195-202 aa come controllo positivo. Analisi dot-blot ha indicato che le tre mutazioni che sostituiscono, V197A, V199A, e C201A, abolito l'affinità di legame di RG-M56 mAb (Figura 3A). Sebbene aa residuo 200 nel epitopo SJNNV genotipo è metionina, al contrario di un leucina nelle altre quattro epitopi genotipo Betanodavirus, la sequenza SJNNV genotipo, 195 VNVSVMCR 202, mostrato affinità di legame positivo contro RG-M56 mAb, come quella del controllo positivo (Figura 3A). Questo risultato indica che gli epitopi of tutti i genotipi Betanodavirus possono essere riconosciuti da RG-M56 mAb. L'affinità di legame di ciascun residuo aa partecipanti al sito epitopo è stato ulteriormente quantificato misurando l'intensità del dot blot di ciascuna sostituzione alanina utilizzando il software di analisi di immagine (Figura 3B) del segnale. Le intensità dei V197A, V199A, e sostituzioni C201A sono stati ridotti al 10,2%, 18,6% e 8,5%, rispettivamente, in confronto con quelli del controllo positivo (100%), mentre il V195A, S198A, L200A, R202A, e sostituzioni L200M mostrato intensità superiori o simili come quella del controllo positivo. Vale la pena notare che la forza che influenza della sostituzione N196A è ambiguo, con una riduzione del 37,4% nel controllo positivo. Questi risultati indicano che V197, V199 e C201 sono residui essenziali per il legame di RG-M56 mAb.
I risultati della scansione alanina mutagenesi rivelare che i residui aa V195, N196, e può R202essere sostituito con alanina, il che implica che la regione epitopo potrebbe essere ulteriormente ristretto ad entrambe termini. Pertanto, il passo-passo rifilato mappatura peptide attraverso 7-mer, 6-mer, e 5-mer sintetico peptidi passo è stato progettato per ridurre al minimo la regione antigenica. Il segnale positivo era presente sul peptide sintetico 6-mer 196 NVSVLC 201, ma non sulle 7-mer e 5-mer peptidi sintetici (Figura 4). Questi dati indicano che l'epitopo minimo di NNV proteina di rivestimento riconosciuto da RG-M56 mAb è il peptide 6-Mer, 196 NVSVLC 201.
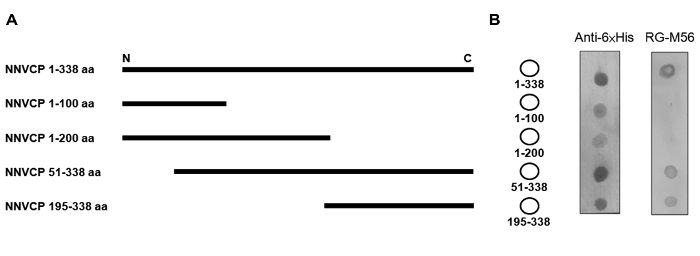
Figura 1: Riduzione della regione epitopo utilizzando proteine ricombinanti serialmente troncati ei anticorpo monoclonale. (A) Mappa NNVCPs ricombinanti in serie troncate. NNVCP 1-338 aa è la proteina di rivestimento full-length. (B) Dot-bloAnalisi t di NNVCPs ricombinanti. Sinistra: Mappa delle YGNNV proteine ricombinanti cappotto in serie troncate sulla membrana PVDF. Medio: L'analisi dot-blot è stata effettuata utilizzando un anticorpo anti-6xHis. A destra: L'analisi dot-blot è stata effettuata utilizzando RG-M56 mAb. NNVCP: proteina di rivestimento nervoso necrosis virus; aa: aminoacido; PVDF: fluoruro di polivinile; N: N-terminale; C: C-terminale; mAb: anticorpo monoclonale. Clicca qui per vedere una versione più grande di questa figura.

Figura 2: Fine mappatura della regione epitopo utilizzando peptidi sintetici. (A) A sinistra: sequenze di aminoacidi dei peptidi sintetici 20-mer sono state allineate per NNVCP 195-338 bis; ogni peptide precedente ha avuto un 10 aa-residui a lungo sovrapposizione con il seguente peptide. A destra: Mappa del speptidi ynthetic sulla membrana PVDF. Ricombinante NNVCP 195-338 aa è stato utilizzato come controllo positivo. L'analisi dot-blot è stata effettuata utilizzando RG-M56 mAb. (B) A sinistra: le sequenze di amminoacidi dei peptidi sintetici 8-mer, 195-202 aa, 197-204 aa, e 199-206 aa; ogni peptide precedente aveva un 6 aa-residui a lungo sovrapposizione con il seguente peptide. Sintetico peptide 195-214 aa è stato utilizzato come controllo positivo. A destra: L'analisi dot-blot è stata effettuata utilizzando RG-M56 mAb. Clicca qui per vedere una versione più grande di questa figura.

Figura 3: la scansione alanina e la sostituzione della mutagenesi 195 VNVSVLCR 202 epitopi. Sequenze (A) aminoacidi di sostituzione mutagenesi e analisi dot-Blot. Ogni aa Residue della regione epitopo, 195-202 aa, è stato sostituito individualmente con alanina. la sostituzione L200M è la sequenza genotipo SJNNV alla proteina di rivestimento regione epitopi Betanodavirus. Sintetico peptide 195-202 aa è stato utilizzato come controllo positivo. I residui aa sostituiti sono sottolineate. (B) Quantificazione del segnale di affinità di legame Dot Blot. L'intensità del controllo positivo (195-202 aa) il segnale è stato determinato come 100%. Clicca qui per vedere una versione più grande di questa figura.

Figura 4: determinazione minima epitopi. Il 7-mer (A), 6-mer (B), e 5-mer (C) peptidi sintetici 195-202 aa sono stati usati per identificare l'epitopo minimo riconosciuto da RG-M56 mAb. Pepti sinteticode 195-202 aa è stato utilizzato come controllo positivo. Clicca qui per vedere una versione più grande di questa figura.
Discussione
Questo protocollo offre una tecnica rapida e semplice per identificare un epitopo lineare MAB-riconosciuto. Prendendo in considerazione il costo di sintesi peptidica e l'efficienza di produzione di peptidi sintetizzare, la regione antigenica della proteina di rivestimento del virus è stata ridotta di esprimere proteine ricombinanti serialmente tronche prima dell'analisi scansione peptide. Come tale, il sistema affidabile ed efficiente espressione di E. coli pET stato usato per produrre queste proteine ricombinanti in serie tronche, le proteine ricombinanti con pesi molecolari tra 10 e 50 kDa possono essere facilmente espresse attraverso questo sistema. In questo modo, l'epitopo può essere facilmente ridotta a un più gestibile 100 a 200 regione aa. La PET-20b (+) vettore è stato appositamente scelto, in quanto contiene una sequenza che codifica per l'espressione di 6xHis-tag, permettendo alle proteine prodotte 6xHis-tag di fusione da immunodetected utilizzando un anticorpo anti-6xHis per confermare l'espressione della ricombinante proteins. Le proteine ricombinanti cappotto prodotte sono stati poi analizzati utilizzando RG-M56 mAb tramite un test di ibridazione dot-macchia. Un metodo alternativo di determinazione delle proteine epitopo ricombinante è purificare le proteine ricombinanti espresse tramite metallo immobilizzato ionico Cromatografia di affinità su 10, separare le proteine ricombinanti con elettroforesi su gel di SDS-poliacrilammide, ed eseguire analisi Western blot 3.
Per mappare ulteriormente e più finemente la posizione epitopo determinata dai risultati dell'analisi ibridazione dot-blot utilizzando proteine ricombinanti serialmente tronche, peptidi sintetici sovrapposti con dimensioni diverse sono stati progettati. Tra le diverse possibili lunghezze di peptide sintetico di sintetizzare, 20-mer con 10 aa-residui-lungo peptidi sovrapposti sono stati scelti prima della scansione peptide, sia per la loro elevata purezza sintesi (intorno al 90%) e loro lunghezza peptide, abbastanza per la ricerca del continuo epitope riconosciuto da anticorpi delle cellule B 11. Si noti che l'accuratezza e la purezza dei peptidi sintetizzati deteriorano come il peptide sintetizzato è più lungo. In questo modo, la regione epitopo è stato rapidamente ridotto a circa 10 residui aa lunghezza. Dopo seriali peptidi sovrapposti 8-mer sono state intervistate, la regione epitopo lineare è stato definito in modo da peptide 195-202 aa. Successivamente, scansione alanina di questo 8-mer epitopo peptide rivela la forza critica affinità di legame di ciascun residuo aa, consentendo la ricerca per l'epitopo minimo. I ruoli essenziali del V197, V199, e residui aa C201 implica che la regione epitopo lineare copre almeno 5 residui aa, da 197 a 201. Inoltre, aa residui V195, N196, e R202 possono essere sostituiti con alanina, senza perdere del tutto vincolante affinità, indicando che la regione epitopo può essere ridotto a 7, 6, o anche 5 residui aa lunghezza. sequenze piccolo peptide possono essere facilmente ed economicamente sintetizzati per la ricerca lineare (cocontinua che) epitopi. Tuttavia, questa tecnica di scansione peptide sintetico non è adatto per la determinazione di un epitopo discontinuo di un anticorpo, a meno che non sia combinato con epitopo escissione e spettrometria di massa analisi 12.
In questo protocollo, una tecnica di ibridazione dot-blot è stato utilizzato per cercare l'epitopo lineare di un anticorpo monoclonale. Dot-blot ibridazione è un metodo semplice ma efficace. All'inizio della ricerca, quando la regione epitopo è ristretto da un paesaggio larga scala, la preoccupazione principale è osservare sia un segnale positivo o negativo dopo l'ibridazione dell'anticorpo ad una proteina di membrana bersaglio, come la maggior parte mAbs legarsi solo ad uno specifico epitopo di una proteina antigenica (figure 1 e 2). Tuttavia, quando si utilizza dot-blot ibridazione per esplorare la disponibilità legame di ciascun residuo aa nella regione epitopo contro l'anticorpo, ad esempio mediante mutagenesi alanina sostituzione,l'intensità di ogni residuo aa sostituito determinato dal dot blotting segnale deve essere preso in considerazione in generale il significato di legame. Che intensità del segnale può essere quantificato facilmente utilizzando il software di analisi di immagine (Figura 3B) o un densitometro. In alternativa, un test immuno-assorbente enzimatico (ELISA) può essere effettuata per quantificare il grado di affinità di legame e la potenza del segnale risultante 3.
Nello studio precedente, l'unica proteina di rivestimento del non-busta virus della necrosi nervosa era immuno-riconosciuta da 10 anticorpi monoclonali con un alto valore dell'indice di neutralizzazione tra 6,5-4,5 (log 10 NI) 2. La capacità di riconoscimento altamente specifico degli anticorpi monoclonali sono stati successivamente utilizzate per lo sviluppo di un passo, rapida kit diagnostico immunocromatografico per la rilevazione di pesci NNV infettate 13. L'epitopo antigenica della proteina di rivestimento nervoso necrosis virus è stato riconosciuto dal RG-M18mAb come un peptide 8-Mer, 195 VNVSVLCR 202 3, attraverso il quale un nuovo recettore NNV è stato identificato (dati non pubblicati). Nel presente studio, l'epitopo di necrosi nervosa proteina di rivestimento del virus è stata ulteriormente ridotta a un peptide 6-Mer, 196 NVSVLC 201, dall'altro mAb, RG-M56.
E 'inaspettato che due peptidi 7-Mer (196 NVSVLCR 202 e 195 VNVSVLC 201) contenenti 6-mer peptide 196 NVSVLC 201 non sono riconosciuti da RG-M56 mAb (Figura 4A). Un'interpretazione ragionevole è che, anche se i residui circostanti V195 e R202 non possono contribuire direttamente alla interazione Legame tra l'epitopo e anticorpi, i residui che fiancheggiano influenzano la formazione della conformazione corretta peptide di riconoscimento anticorpale. La comparsa di V195 o R202 al loro capolinea accompagnamento da solo può contorcere il peptide sinteticoconformazione per il riconoscimento degli anticorpi e vincolante. La conformazione epitopo è guidato dalla forza di entrambi i termini, V195 e R202, che sono bilanciati uno contro l'altro nel peptide sintetico 8-Mer, 195 VNVSVLCR 202, e contrastato nel peptide sintetico 6-Mer, 196 NVSVLC 201. I residui aa, V195, N196, e R202, possono essere sostituiti singolarmente con alanina senza completamente perdere la capacità di legame e, quindi, i risultati della scansione alanina mutagenesi indicano che questi tre residui aa non possono giocare un ruolo significativo nel riconoscimento e vincolante di RG -M56 mAb. Tuttavia, dopo il taglio un altro residuo del peptide sintetico 6-mer, 196 NVSVLC 201, il peptide 5-mer, 197 VSVLC 201, senza la N196 nella regione N-terminale fiancheggiante, perde la capacità di essere riconosciuto e legato RG -M56 mAb (Figura 4C). Questo risultato suggerisce che il residuo N196 può anche pstabilire un ruolo importante nella regione fiancheggiante dell'epitopo per stabilizzare la conformazione corretta epitopo per facilitare il riconoscimento e legame di RG-M56 mAb. L'importanza di accompagnamento residui circondano la regione epitopo era stato esplorato anche da altri studi di legame antigene-anticorpo. L'importanza di affiancare residui aa che circondano la regione epitopo α-bungarotoxin per il legame degli anticorpi è stata studiata utilizzando diverse sostituzioni aa all'interno dello stesso sito secondario colinergica. Sono stati poi valutati come sia essenziale, influente, o meno influente 14. Si è inoltre constatato che la specificità di epitopo anticorpi riconosciuta di mucine epiteliali carcinoma-associato può essere ulteriormente influenzata dai residui aa fiancheggianti. Questi effetti possono presentare barriere conformazionali che possono impedire il legame di un anticorpo per un epitopo 15.
L'epitopo 6-Mer, 196 NVSVLC 201 </ Sub>, ha caratteristiche estremamente idrofobi, con quattro residui idrofobici, tra due valina (197 e 199), uno leucina (200), e una cisteina (201) (forma ridotta). Residui V197, V199 e C201 sono fondamentali per il riconoscimento RG-M56 mAb e vincolante, come determinato da alanina mutagenesi scansione. La regione epitopo era situato in uno degli otto anti-paralleli beta fili di dominio di shell (S-dominio) del NNV proteina di rivestimento 16. È interessante notare che l'epitopo non appare sul dominio protrusione all'esterno, ma nasconde nella struttura gelatina extra della S-dominio sotto gli altri beta-fili anti-parallele. L'epitopo, con la sua alta idrofobicità, può ottenere un microambiente più stabile in questa depressione. Inoltre, il 195 VNVSVLCR 202 3 peptide di questo epitopo è stato trovato per ostacolare la propagazione del gigante cernia virus della necrosi nervosa nelle cellule cerebrali cernia. Pertanto, questo epitopo peptide è stato suggerito essere un competitor coinvolti nel dominio recettoriale richiesto per l'ingresso del virus 3. Si è ipotizzato che gli inibitori di ingresso peptide comprendente residui idrofobici e / o anfipatiche possono alterare la conformazione fisica e chimica delle interfacce membrane cellulari e possono ostacolare la fusione delle membrane cellulari e virali 17. Inoltre, molti inibitori d'ingresso peptide sintetico hanno dimostrato forti proprietà di inibizione nei confronti di varie infezioni da virus 17, 18. Così, il peptide epitopo identificato con residui idrofobici e forte inibizione voce contro l'infezione NNV può facilitare lo sviluppo di farmaci peptidici terapeutici.
Divulgazioni
The authors have no conflicts of interest related to this report.
Riconoscimenti
The authors thank Miss Ching-Chun Lin and Miss Diana Lin of the Core Facility of the Institute of Cellular and Organismic Biology (ICOB) of Academia Sinica for offering their expertise on peptide synthesis and DNA sequencing, respectively. This study was supported by Academia Sinica.
Materiali
| Name | Company | Catalog Number | Comments |
| Hybrid-SFM medium | Gibco | 12045-076 | |
| Dulbeccos's Phophate-Buffered Saline (PBS) | Gibco | 21600-069 | |
| Pfu DNA Polymerase | Thermo Scientific | EP0502 | Including buffers |
| T4 DNA Ligase | Roche | 10799009001 | Including buffers |
| NdeI | New England Biolabs | R0111S | Including buffers |
| XhoI | New England Biolabs | R0146S | Including buffers |
| pET-20b(+) vector | Novagen, Merck Millipore | 69739 | |
| E.coli DH-5α competent cell | RBC Bioscience | RH617 | |
| E.coli BL-21(DE3) competent cell | RBC Bioscience | RH217 | |
| Ampicillin | Amresco | 0339-25G | |
| LB broth | Invitrongen | 12780-052 | |
| Isopropylthio-β-D-thiogalactoside (IPTG) | MDBio, Inc. | 101-367-93-1 | |
| Methanol | Merck Millipore | 106009 | |
| Polyoxyethylene 20 Sorbitan Monolaurate (Tween-20) | J.T.Baker | X251-07 | |
| Dimethyl sulfoxide (DMSO) | Sigma | D2650 | |
| Glycine | Amresco | 0167-5KG | |
| Tris | Affymetrix, USB | 75825 | |
| NaCl | Amresco | 0241-1KG | |
| EDTA | Amresco | 0105-1KG | |
| Glycerol | Amresco | 0854-1L | |
| NaN3 | Sigma | S2002-500G | |
| BCIP/NBT | PerkinElmer | NEL937001PK | |
| Goat Anti-Mouse IgG, Fc fragment antibody | Jackson ImmunoResearch | 115-055-008 | |
| Immobilon-P (Polyvinylidene fluoride, PVDF) | Merck Millipore | IPVH00010 | |
| Protein G Agarose Fast Flow | Merck Millipore | 16-266 | |
| QIAquick PCR Purification kit | Qiagen | 28106 | |
| UVP BioSpectrum 600 Image System | UVP | n/a | |
| VisionWorks LS Analysis Software Ver 6.8 | UVP | n/a | |
| MyCycler thermal cycler | BioRad | 1709713 |
Riferimenti
- Milstein, C., Kohler, G. Clonal variations of myelomatous cells (proceedings). Minerva Med. 68 (50), 3453 (1977).
- Lai, Y. S., et al. In vitro neutralization by monoclonal antibodies against yellow grouper nervous necrosis virus (YGNNV) and immunolocalization of virus infection in yellow grouper Epinephelus awoara (Temminck & Schlegel). J Fish Dis. 24 (4), 237-244 (2001).
- Chen, C. W., Wu, M. S., Huang, Y. J., Cheng, C. A., Chang, C. Y. Recognition of Linear B-Cell Epitope of Betanodavirus Coat Protein by RG-M18 Neutralizing mAB Inhibits Giant Grouper Nervous Necrosis Virus (GGNNV) Infection. PLoS One. 10 (5), 0126121 (2015).
- Lai, Y. -. S., et al. Propagation of yellow grouper nervous necrosis virus (YGNNV) in a new nodavirus-susceptible cell line from yellow grouper, Epinephelus awoara (Temminck & Schlegel), brain tissue. J Fish Dis. 24 (5), 299-309 (2001).
- Lougee, E., Morjaria, S., Shaw, O., Collins, R., Vaughan, R. A new approach to HLA typing designed for solid organ transplantation: epityping and its application to the HLA-A locus. Int J Immunogenet. 40 (6), 445-452 (2013).
- Radulovich, N., Leung, L., Tsao, M. S. Modified gateway system for double shRNA expression and Cre/lox based gene expression. BMC Biotechnol. 11, 24 (2011).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253 (2007).
- Pronobis, M. I., Deuitch, N., Peifer, M. The Miraprep: A Protocol that Uses a Miniprep Kit and Provides Maxiprep Yields. PLoS One. 11 (8), e0160509 (2016).
- Metzker, M. L. Emerging technologies in DNA sequencing. Genome Res. 15 (12), 1767-1776 (2005).
- Chiu, C. C., John, J. A., Hseu, T. H., Chang, C. Y. Expression of ayu (Plecoglossus altivelis) Pit-1 in Escherichia coli: its purification and immunohistochemical detection using monoclonal antibody. Protein Expr Purif. 24 (2), 292-301 (2002).
- Atassi, M. Z. Antigenic structures of proteins. Their determination has revealed important aspects of immune recognition and generated strategies for synthetic mimicking of protein binding sites. Eur J Biochem. 145 (1), 1-20 (1984).
- Opuni, K. F., et al. Mass spectrometric epitope mapping. Mass Spectrom Rev. , (2016).
- Chang, C. Y., Chiu, C. C., Christopher John, J. A., Liao, I. C., Leaño, E. M. . The Aquaculture of Groupers. , 207-224 (2008).
- Conti-Tronconi, B. M., et al. Alpha-bungarotoxin and the competing antibody WF6 interact with different amino acids within the same cholinergic subsite. Biochemistry. 30 (10), 2575-2584 (1991).
- Briggs, S., Price, M. R., Tendler, S. J. Fine specificity of antibody recognition of carcinoma-associated epithelial mucins: antibody binding to synthetic peptide epitopes. Eur J Cancer. 29 (2), 230-237 (1993).
- Chen, N. C., et al. Crystal Structures of a Piscine Betanodavirus: Mechanisms of Capsid Assembly and Viral Infection. PLoS Pathog. 11 (10), e1005203 (2015).
- Badani, H., Garry, R. F., Wimley, W. C. Peptide entry inhibitors of enveloped viruses: The importance of interfacial hydrophobicity. Biochim Biophys Acta. , (2014).
- Qureshi, N. M., Coy, D. H., Garry, R. F., Henderson, L. A. Characterization of a putative cellular receptor for HIV-1 transmembrane glycoprotein using synthetic peptides. AIDS. 4 (6), 553-558 (1990).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon