Method Article
Preparazione del cromosoma meiotico si diffonde da Mouse spermatociti
In questo articolo
Riepilogo
Meiosi sono il processo di sviluppo da cui i gameti sono formate attraverso un singolo ciclo di replicazione del DNA e due successivi turni di segregazione del cromosoma. Meiosi mammiferi possono essere esaminate utilizzando una tecnica per preparare cromosomici meiotica. Qui, noi dimostrare un metodo di preparazione di superficie-diffusione nuclei da spermatociti di mouse.
Abstract
Meiosi nei mammiferi sono un processo di sviluppo dinamico che si verifica nelle cellule germinali e possa essere studiato e caratterizzato. Utilizzando un metodo per diffondere i nuclei sulla superficie delle diapositive (piuttosto che farli cadere da un'altezza), dimostriamo una tecnica ottimizzata su spermatociti del mouse che è stato descritto nel 1997. Questo metodo è ampiamente usato nei laboratori per lo studio dei mammiferi meiosi perché produce una pletora di nuclei di alta qualità in fase di sottostadi della profase I. seminiferi tubuli si inserisce in una soluzione ipotonica a gonfiarsi spermatociti. Poi spermatociti vengono rilasciati in una soluzione di saccarosio per creare una sospensione cellulare e i nuclei sono sparsi su vetrini imbevuta di fissativo. A seguito di immunostaining, può essere esaminata una diversità delle proteine attinente a processi meiotici. Ad esempio, proteine del complesso synaptonemal, una struttura tripartita che collega i cromosoma assi e nuclei degli omologhi insieme possono essere facilmente visualizzate. Proteine di ricombinazione meiotic, che sono coinvolti nella riparazione di rotture a doppio filamento del DNA tramite la ricombinazione omologa, possono anche essere immunostained per valutare la progressione della Profase I. Qui descriviamo e dimostrare dettagliatamente una tecnica ampiamente utilizzata per lo studio dei mammiferi meiosi in spermatociti da topo maschio giovanile o adulta.
Introduzione
Topi sono utilizzati estesamente come organismo modello per lo studio di meiosi nei mammiferi. Possono essere valutati sia i normali processi di sviluppo e difetti che si verificano durante la meiosi. La linea temporale e la progressione delle caratteristiche salienti che si verificano durante la profase I e sottostadi, come pure una moltitudine di specifiche proteine coinvolte in processi cruciali per la regolazione della meiosi può essere caratterizzati in wild type e topi mutanti. Diversi processi specializzati che si verificano durante la meiosi che ho posso essere studiato in dettaglio (rivisto in Handel e Schimenti1). Questi includono la formazione di rotture a doppio filamento (DSB) del DNA e riparazione, ricombinazione, la formazione di Complesso Sinaptonemale e segregazione del cromosoma.
Un aspetto importante di studiare processi meiotici è la capacità di esaminare i nuclei contenenti cromosomi omologhi sono risolti, visivamente e otticamente, per meglio distinguono e identificano i sottostadi della profase I. profase è composto da 5 sottostadi che sono caratterizzati da specifiche caratteristiche tra cui la formazione del complesso synaptonemal (SC). Lo SC è un'impalcatura di proteina tripartita che consente l'accoppiamento e la riparazione di rotture a doppio filamento del DNA degli omologhi. Durante leptonema, omologhi allineare come gli elementi assiali di SC sono fissati. Quindi allegato di elementi centrali del complesso synaptonemal durante zygonema facilita la connessione fisica e accoppiamento (sinapsi) tra coppie di omologhi di. Durante pachynema, sinapsi degli omologhi diventa completo e crossover di DNA sono formate dalla riparazione di una popolazione di seleziona delle rotture del doppio filamento di DNA tramite ricombinazione omologa. La SC Disassembla durante diplonema, permettendo per omologhi di desynapse ma rimangono attaccati ai loro centromeri ed ai luoghi dei crossover di DNA. Infine durante diacinesi, omologhi ricondenseranno e si verifica la transizione alla metafase1.
Storicamente, superficie-diffusione della cromatina meiotica ha reso alcuni nuclei, particolarmente quelle dalle prime fasi della Profase I2. Di conseguenza, questi metodi sono stati modificati per migliorare la separazione delle cellule dai tessuti (cioè testicolo o dell'ovaio), la tecnica di diffusione della cromatina meiotica e la resa dei nuclei meiotic di alta qualità per valutazione2,3, 4. Inoltre, questo metodo si è rivelato utile nel preservare nucleare e cromatina associata proteine nei nuclei meiotici, come dimostrato da immunolocalizzazione pubblicati tecniche5,6,7. Di conseguenza, il metodo inizialmente descritto da Peters2 e dimostrato qui rese molti nuclei di spermatocita scoppio separata contenente gli omologhi che subiscono i sottostadi leptotene, zigotene, pachitene, diplotene e diacinesi della Profase I.
La tecnica della preparazione di superficie-diffusione nuclei (chiamati anche analisi di diffusione della cromatina) è ampiamente usata per lo studio di meiosi nei campi della biologia riproduttiva e cella. Diapositive che contengono i nuclei superficie-diffusione possono essere successivamente immunostained con gli anticorpi alle proteine di interesse o sottoposti a macchiatura d'argento e poi analizzati con microscopia. Il metodo è simile per i topi maschi e femminili, anche se le modifiche sono state descritte per topi femmina2. È fondamentale non overmince tubuli seminiferi. I nuclei devono anche essere ben distribuiti affinché seguendo immunostaining omologhi e proteine associate sono chiaramente visibili con la microscopia. Superficie-diffusione nuclei possono essere preparati in poche ore ed entrambi immunostained immediatamente o conservati a-80 ° C per un massimo di 3 settimane prima di scongelamento e immunostaining. Tuttavia, risultati ottimali si ottengono migliori per alcune proteine se immunostaining viene eseguita immediatamente o entro 2 settimane di preparazione di superficie-diffusione nuclei. I vetrini possono essere immunostained con un protocollo standard usando gli anticorpi alle proteine di interesse, seguita da incubazione con gli anticorpi secondari coniugati a fluorescente proteine o coloranti, allora imaged con microscopia di fluorescenza8. Al giorno postnatale 15-21 c'è tessuto sufficiente per ogni coppia di tipo selvaggio testicoli per produrre 6-10 diapositive e più vecchi topi (compresi gli adulti) produrrà più diapositive. Tuttavia, topi wild type 6 settimane di età ed oltre anche resa più post-meiotiche cellule (cioè spermatidi) sui vetrini seguendo immunostaining. Inoltre, tutti i sottostadi della profase io posso essere osservato in topi giovanili e adulti. Testicoli da maschi a giorni postnatali 10 a 15 produrrà molti più cellule leptotene e zigotene. Topi oltre postnatale giorno 14 a 15 anni di età produrrà più nuclei di pachitene e diplotene.
Qui descriviamo e dimostrare un metodo ampiamente usato della preparazione di superficie-diffusione nuclei da spermatociti di mouse.
Protocollo
Tutti i metodi che coinvolgono topi utilizzati alti standard etici e benessere e sono stati approvati dal comitato di uso al Drexel University College of Medicine e istituzionali Animal Care.
1. preparazione di soluzioni e strumenti necessari
- Preparare il tampone di estrazione ipotonico (EB) in 50 mL di acqua ultrapura laboratorio grado, pH 8,2-8,4 (tabella 1). Rendono la soluzione fresco ogni volta, tenere sul ghiaccio ed utilizzare entro 2 h di preparazione spread; Ciò è necessario per ottimizzare la riduzione e la proteasi inibendo attività di DTT e PMSF, rispettivamente. Utilizzare 10 mL di EB per ogni coppia di testicoli del topo.
- Preparare una soluzione di saccarosio di 100mm (fresco ogni volta) aggiungendo 0,342 g di saccarosio a 10 mL di laboratorio ultrapura acqua di grado. Aggiustare il pH a 8.2
- Preparare soluzione fissante (1% paraformaldeide (PFA), 0,15% Triton X-100, pH regolato a 9,2 con 1 N HCl o NaOH N 1) mensile fresco e store è a temperatura ambiente al riparo dalla luce. Diluire un 16% commercialmente PFA partenza stock disponibile al 4% in 1X PBS per uso come un magazzino di lavoro e quindi memorizzare 4% aliquote a-20 ° C.
- Per preparare la soluzione fissante, aggiungere 10 mL di soluzione al 4% PFA e 600 µ l di 10% Triton X-100 a 30 mL di 1X PBS, mescolare bene e regolare il pH a 9,2 con 1 N HCl o NaOH N 1. Conservare la soluzione fissativa in una provetta conica da 50 mL avvolta nella carta stagnola a temperatura ambiente (per non più di 4 settimane).
- Preparare soluzioni di lavaggio (mentre scivoli stanno asciugando gli ultimi 30 minuti) con 200 Photo-Flo: 0,4% Photo-Flo 200/PBS (320 µ l di Photo-Flo 200 in 80 mL di 1X PBS) e 0,4% Photo-Flo 200/dH2O (160 µ l di Photo-Flo 200 in 40 mL di acqua ultrapura laboratorio). Utilizzare una finestra di Coplin 50 mL riempita con 40 mL di soluzioni per lavare i vetrini 10 o meno in un momento.
- Preparare i seguenti strumenti: 1 paio di forbici chirurgiche (di incidere la pelle), 1 paio di forbici chirurgiche punta fine (di incidere il peritoneo), 2 paia di pinze a punta dritto fine (per sezionare ogni testicolo), 1 lama di rasoio regolo (di incidere ogni testicolo), 2 paia di punta forcipe (per immobilizzare ogni testicolo e spremere i tubuli seminiferi) curvo, barattoli di Coplin 50ml, Teflon stampato 3 anello scivoli, 1 bisturi con lama taglia 11, camera umidificata, 100 x 15 mm piastre Petri, pennarello a punta fine o una matita e un shaker a piattaforma rotante.
- Premium posto uncharged vetrino smerigliato fine diapositive di vetro in posizione verticale in una vaschetta di Coplin 50 mL riempita con soluzione fissante fino all'utilizzo.
Nota: La matita è comodo se diapositive verranno successivamente utilizzate nelle procedure che richiedono di etanolo, come l'ibridazione in situ di fluorescenza.
- Premium posto uncharged vetrino smerigliato fine diapositive di vetro in posizione verticale in una vaschetta di Coplin 50 mL riempita con soluzione fissante fino all'utilizzo.
2. i nuclei di spermatocita diffusione
- Eutanasia di un topo maschio secondo le linee guida istituzionali (ad es., dislocazione cervicale con o senza CO2 asfissia).
- Utilizzare P10 - P20 maschi per valutare meiotiche celle nella prima ondata della spermatogenesi; Utilizziamo abitualmente P15 - P17 maschi per ottenere cellule da tutti i sottostadi della Profase I. adulti testicoli fornirà cellule da Profase I troppo, ma anche essi produrranno più postmeiotiche cellule, quali spermatidi.
- Raccolto e pesare i testicoli (registrare i pesi associati); quindi inserirli in una piastra Petri contenente poche gocce di freddo HEB per tenerli umidi.
- Tenere testicolo contro il fondo del piatto con una pinza a punta ricurva e utilizzare una lama di rasoio regolo per fare un'incisione del midline verticale piccolo attraverso la capsula del testicolo. Mentre ancora in mano il testicolo contro il fondo del piatto con un forcipe, utilizzare un secondo set di pinze punta ricurva o lama di rasoio regolo per spremere delicatamente i tubuli seminiferi dal testicolo.
- Inserire i tubuli in una provetta conica da 15 mL contenente 10 mL di HEB freddo, avendo cura di evitare di mettere i pezzi della capsula nel tubo. Ripetere la procedura con il secondo testicolo.
- Incubare i tubuli seminiferi decapsulato nel tubo conico contenente HEB in ghiaccio per 30-60 min, a seconda delle dimensioni dei testicoli. Incubare i tubuli seminiferi da un paio di testicoli pesa 30 mg o meno per 30 min, tubuli da un paio di testicoli pesatura 31 a 50 mg per 30-45 minuti e testicoli più grandi per 60 minuti. Non alterare i tempi per un solo testicolo.
Nota: Il tempo di incubazione ottimali può variare a seconda dell'esperienza di sperimentatore, i reagenti utilizzati e i topi analizzati. - Mentre i tubuli seminiferous sono incubando in EB, è possibile utilizzare un pennarello o una matita per etichettare le estremità glassate di vetrino diapositive con mouse numero, data e numero della diapositiva. Quindi è possibile porre i vetrini pre-puliti in una vaschetta di Coplin contenente la soluzione fissante.
- A seguito di incubazione, versare tubuli ed EB in una capsula Petri pulita e tubuli separate in circa ciuffi di diametro di 3 mm. Ogni ciuffo produce 2 scivoli e il numero di diapositive ha reso dipende dalla dimensione dei testicoli.
Nota: Possiamo ottenere 8 scivoli da wild-type e 6 diapositive da subfertile Chtf18-null testicoli P16 (che sono più piccoli a causa di numeri in diminuzione delle cellule di germe meiotica e mitotica8). Un testicolo adulto pesa 100 mg o più dovrebbe produrre 16 vetrini. - Posto 23 µ l di soluzione di saccarosio di 100 mM in un anello di Teflon stampato, 3 anello scorrevole e aggiungere un ciuffo di tubuli seminiferi sul ring. Quindi usando curve suggerimento pinze per tenere il ciuffo, delicatamente tritare i tubuli con una lama di rasoio taglia 11 fino a quando la soluzione diventa torbida.
Nota: Non overmince come questo si tradurrà in cromosomi frammentati. Si noti che cromosomi frammentati potrebbero anche essere indicativi di un fenotipo mutante. - Rimuovere i detriti, aggiungere un altro 23 µ l di soluzione di saccarosio e utilizzare una micropipetta delicatamente dispensazione la miscela su e giù un paio di volte per aiutare a separare le cellule in sospensione.
- Rimuovere un vetrino ammollo nel Vaso Coplin contenente soluzione fissante e inclinare la diapositiva sopra il vaso, in modo che una gocciolina generosa raccoglie nell'angolo inferiore della diapositiva.
- Pipettare 20 µ l di sospensione cellulare saccarosio dall'anello della diapositiva stampata 3 anello Teflon in fissativa gocciolina su un premio glassato di vetrino e dispensare la sospensione su e giù per 2 - 3 volte.
Nota: La goccia fissativa deve essere abbastanza grande nel volume affinché aggiunta di 20 μL della sospensione delle cellule di saccarosio ad esso permette la copertura attraverso l'intera diapositiva quando la miscela è diffuso (Vedi 2.11 qui sotto).
- Pipettare 20 µ l di sospensione cellulare saccarosio dall'anello della diapositiva stampata 3 anello Teflon in fissativa gocciolina su un premio glassato di vetrino e dispensare la sospensione su e giù per 2 - 3 volte.
- Lentamente inclinare la diapositiva al lato opposto la goccia per diffondere la sospensione cellulare lungo la lunghezza della diapositiva. Poi lentamente inclinare la diapositiva torna a diffondere la sospensione cellulare lungo la larghezza della diapositiva per coprirlo completamente. Evitare di diffondere la sospensione sulla stessa area della diapositiva più di una volta altrimenti che le celle si sovrappongono tra loro.
- Immediatamente porre il vetrino in una camera umidificata e ripetere i passaggi da 2.8 a 2.11 fino a quando tutti i grumi di tubuli seminiferi sono stati utilizzati per rendere diapositive. È importante non spostare la camera umidificata durante il processo di essiccazione per evitare lo strappo e la sovrapposizione di cellule.
- Lasciare i vetrini Incubare in una camera umidificata coperta a temperatura ambiente per 2,5 h in modo che si asciugano lentamente e non completamente. Umidità elevata e lenta essiccazione in questo passaggio sono importanti per garantire un'adeguata diffusione della cromatina. Quindi rimuovere il coperchio dell'alloggiamento e vetrini asciugare completamente altri 30 min.
- Mettere i vetrini (retro o in un modello di zigzag) in una vaschetta di Coplin contenente 0,4% di soluzione di Photo-Flo 200/1 X PBS e lavare i vetrini due volte, 5 minuti ciascuno, agitando delicatamente la Coplin jar su una piattaforma rotante shaker. Utilizzare la soluzione fresca per ogni lavaggio e mantenere diapositive da diversi topi in vasi separati per ciascuno dei lavaggi.
- Lavare i vetrini in una vaschetta di Coplin contenenti 0,4% Photo-Flo 200/dH2O soluzione per 5 min una volta durante l'agitazione.
- Rimuovere diapositive dal Coplin jar (ultimo lavaggio), accuratamente pulire i bordi e le parti inferiori delle diapositive per eliminare il liquido in eccesso e mettere i vetrini in una posizione angolata, quasi-montante ad asciugare. Uno sperimentatore che è abile in questa tecnica può elaborare e preparare i nuclei superficie-diffusione dai topi di 4 o 5 in un giorno.
- Una volta asciutto (15-20 min), processo diapositive immediatamente per immunofluorescenza o conservare a-80 ° C in una scatola di diapositive ben chiuso al riparo dalla luce per un massimo di 3 settimane (a seconda delle proteine bersaglio valutandi; risultati ottimali possono essere ottenuti se macchiato lo stesso giorno o entro 2 settimane).
- Se conservati a-80 ° C, quindi lasciare vetrini a temperatura ambiente e lavare in una vaschetta di Coplin contenente 1 X PBS o blocco per 5 min prima della colorazione.
Nota: Molti protocolli di colorazione di immunofluorescenza diversi fornirà buoni risultati; per un protocollo di immunostaining8, fare riferimento a Berkowitz et al.
- Se conservati a-80 ° C, quindi lasciare vetrini a temperatura ambiente e lavare in una vaschetta di Coplin contenente 1 X PBS o blocco per 5 min prima della colorazione.
Risultati
La capacità di questo metodo per fornire un numero elevato di superficie sviluppa nuclei che contengono gli omologhi intatti dipende da tre fattori principali: 1) tempo di incubazione appropriato di tubuli seminiferi in buffer ipotonico (cioè EB) per ottenere adeguatamente si gonfiò spermatocita i nuclei che scoppiano ma non si disintegrano da prolungata incubazione in EB, 2) micropipetting le goccioline di saccarosio di cellule per ottenere una sospensione separata dei nuclei che non sono raggruppati insieme e 3) inclinazione ogni fissativo rivestito diapositiva in una sola direzione alla volta e non avanti e indietro. Una volta preparato, superficie diffusione nuclei possono essere immunostained con fluorescente identificati anticorpi alle proteine di interesse e quindi imaged con microscopia (rappresentante esempi sono mostrati in Figura 1 e Figura 2. La figura 1 Mostra esempi di nuclei di pachitene wild-type che sono ben distribuiti (A), i nuclei contenenti irregolarmente immunostained, comparenti brandelli omologhi a causa di incubazione in EB troppo a lungo, (B), scarsamente diffuse sovrapposti nuclei (C) e nuclei contenenti omologhi frammentati a causa di "overmincing" dei tubuli seminiferi (D). Quando la tecnica è effettuata bene, una pletora di nuclei che rappresentano i principale 5 sottostadi di profase io posso essere ottenuto. Nella figura 2 viene illustrato il leptotene, zigotene, pachitene, diplotene e diacinesi fasi della profase ho nei nuclei di spermatociti di tipo selvaggio da giovani maschi.

Figura 1: Superficie sviluppa nuclei di spermatociti di tipo selvaggio da topi giovani.
Pachitene spermatocita nuclei erano macchiati con anti-SYCP3 (verde), che colora i nuclei di elementi assiale e laterale del complesso synaptonemal (A) ben distribuiti. (B) i nuclei dai tubuli seminiferi incubati in EB troppo a lungo. (C) scarsamente diffuse nuclei sovrapposti. (D) omologhi frammentati a causa di "overmincing" dei tubuli seminiferi (punte di freccia indicano due frammenti di piccoli omologo). Barra della scala è di 5 μm. Clicca qui per visualizzare una versione più grande di questa figura.
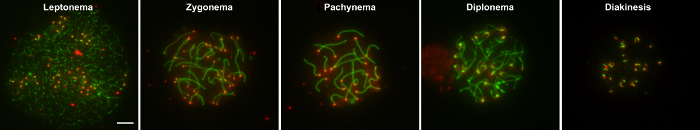
Figura 2: Esempi di nuclei da sottostadi della Profase I.
Spermatociti di tipo selvaggio da giovani maschi erano macchiati con siero CREST (rosso), che le macchie centromeri, e anti-SYCP3 (verde), che gli elementi di assiale e laterale del complesso synaptonemal di macchie. Le leptotene, zigotene, pachitene, diplotene e diacinesi fasi della Profase I, rispettivamente, è indicato. Barra della scala è di 5 μm. Clicca qui per visualizzare una versione più grande di questa figura.
| Reagente | Quantità | Concentrazione finale |
| 1 M Tris-Cl (pH 8.2) | 1,5 mL | 30 mM |
| Saccarosio | 0,85575 g | 50 mM |
| Citrato trisodico biidrato | 0,25 g | 17 mM |
| 0.5 EDTA M | 500 ΜL | 5 mM |
| Ditiotreitolo (DTT) | 0,00385 g | 0,5 mM |
| 0,2 M Phenymethylsulfonyl fluoruro (PMSF) | 25 ΜL | 0,1 mM |
Tabella 1: Ricetta per il tampone di estrazione ipotonico (EB).
Aggiungere i reagenti di laboratorio ultrapura 50 mL acqua di grado e regolare il pH 8,2-8,4 (se necessario, utilizzare 1 N NaOH soluzione o 1 N HCl). Preparare HEB fresco ogni volta, tenere il ghiaccio e utilizzare entro 2 h di preparazione.
Discussione
Per ottenere un numero elevato di nuclei spermatocita ben diffusa, di buona qualità, le fasi più critiche del presente protocollo includono il tempo di incubazione appropriato dei tubuli seminiferi in EB, appropriata macinazione dei tubuli seminiferi, e la tecnica impiegata per si sono diffuse la sospensione cellulare di saccarosio attraverso le diapositive rivestite con fissativa. Noi incubare tubuli seminiferi dai testicoli dei maschi di tipo selvaggio che vanno da postnatale giorno 15 all'età adulta in EB per 45 min, mentre i testicoli da in modo paragonabile invecchiato Chtf18-topi sono incubati per solo 30 min perché testicoli sono la metà e contengono significativamente meno cellule germinali8. Nella nostra esperienza, l'incubazione di Chtf18-null testicoli per più di 30 min compromette l'integrità delle cellule, con conseguente mal risolti omologhi. Tubuli seminiferi sono macinati solo per ottenere una sospensione di cellule di saccarosio nuvoloso, e ogni diapositiva deve contenere una gocciolina generosa di fissativo prima della diffusione (cfr. 2.10). Diapositive sono inclinate in una sola direzione alla volta e non avanti e indietro. Il metodo è ideale per lo studio di meiosi, ma è in gran parte limitato a sottostadi della Profase I. Tuttavia, i nuclei in fase S premeiotic, metafase I e II possono essere osservati e sono stati segnalati7,9.
Si tratta di un metodo semplice che richiede qualche pratica per acquisire competenza e ottenere i migliori risultati. Risultati non ottimali possono verificarsi per diversi motivi. I nuclei non possono essere ben distribuiti, conseguente in cluster o sovrapposizione di cellule. Ciò può verificarsi se la sospensione di eritrociti di saccarosio non è adeguatamente pipettata o non c'è abbastanza fissativo sulla diapositiva per diffondere i nuclei ben. Se scivoli non sono rivestiti con abbastanza fissativo residuo o la sospensione delle cellule non si sono diffuse attraverso il vetrino in una direzione liscia o diffondere ripetutamente avanti e indietro, le cellule si sovrappongono e aggregano assieme. Se i tubuli seminiferous sono "overminced" gli omologhi possono essere frammentati o appaiono un po' tagliuzzati. Perché mutante testicoli possono essere più piccoli, contengono meno spermatociti ed essere più suscettibili di "overmincing" o la frammentazione dei tubuli seminiferi, si consiglia di praticare un paio di volte su testicoli di controllo (ad esempio wild type) in primo luogo per ottimizzare la tecnica nella mani di un novizio.
Preparazione di nuclei di diffusione superficiale è una tecnica fondamentale utilizzata per esaminare i passaggi chiave di regolamentazione e la progressione della meiosi, come pure per caratterizzare fenotipi meiotici nei topi. Pertanto, utilizzare questo metodo estesamente e insegnare a tutti i nuovi membri di laboratorio come eseguirla. Una volta acquistato padronanza di questa tecnica, una miriade di altre tecniche può essere utilizzata successivamente e in concomitanza con esso. Ad esempio, diversi tipi di immunostaining e/o microscopia compreso widefield o confocale con epifluorescenza, o electron microscopia può essere eseguita. Oltre a studiare meiosi specifiche proteine come componenti del complesso synaptonemal, coloro che interagiscono con il SC, ad esempio cohesins, complessi multiproteici che mediano la coesione, può essere valutate (rivisto in 10,11 12). Regolamento di formazione di crossover, lavorazione e stagionatura del DNA possono essere e sono stati studiati anche con questa tecnica13. Inoltre, questa tecnica è stata eseguita seguendo l'uso dei metodi per ottenere specifiche popolazioni di mouse spermatociti: 1) a seguito di cultura di spermatociti in acido okadaico per indurre la progressione alla transizione G2/MI, producendo numeri aumentati di diplotene, diacinesi e si diffonde14,15 e 2 metafase) dopo i metodi usati per isolare una popolazione arricchita di pachitene spermatociti14.
La tecnica della preparazione di superficie-diffusione nuclei da spermatociti mouse descrisse e dimostrò che qui è una tecnica estremamente utile e semplice. È per eccellenza per ogni laboratorio che studia meiosi utilizzando topi come organismo modello, ma richiede qualche pratica e finezza per ottenere i migliori risultati.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori riconoscono l'assistenza tecnica di Abigail Harris. Essi riconoscono anche Paula Cohen e Kim Holloway per aiutare ad ottimizzare il protocollo di preparazione di superficie-diffusione nuclei da spermatociti di mouse. Gli autori hanno anche apprezzano la lettura critica del manoscritto da Karen Schindler.
Questo lavoro è stato supportato da NIH R01 GM106262 a K.M.B.
Materiali
| Name | Company | Catalog Number | Comments |
| Photo-Flo 200 | Kodak | 1464510 | |
| 16% Paraformaldehyde (formaldehyde aqueous solution) | Electron Microscopy Sciences | RT 15710 | Dilute 16% solution into 4% working stocks with 1X PBS and freeze aliquots at -20 °C |
| Teflon printed 3 ring slides | Electron Microscopy Sciences | 63418-11 | |
| Premium uncharged frosted end glass slides | Several commercial brands | Clean slides in ethyl or isopropyl alcohol and allow to drip dry prior to use; label slides on frosted end with a permanent marker or pencil depending on subsequent use of slides | |
| Surgical scissors (sharp and blunt tips) | Fine Science Tools | 14001-12 | Different brand of a similar type will work |
| Fine tip surgical scissors (sharp tips) | Fine Science Tools | 14058-11 | Different brand of a similar type will work |
| Straight fine tip forceps | Fine Science Tools | 11050-10 | Different brand of a similar type will work |
| Curved medium tip forceps | Fisher | 16100110 | Different brand of a similar type will work |
| Scalpel handle | Fine Science Tools | 10003-12 | Different brand of a similar type will work |
| Mouse anti-SYCP3 | Abcam | ab97672 | Use at 1:300 |
| Anti-centromere protein (derived from human CREST patient serum) | Antibodies Incorporated | 15-234-0001 | Use at 1:50 |
| Humidified chamber | We use Nunc square culture dishes 500 cm2/well with moistened paper towels | ||
| Widefield microscope with epifluorescence | Leica microsystems | Any standard model | |
| Coplin jars | Several commercial brands | 50 ml capacity; 40 mm (1.6 in.) diameter, holds 10 slides (back to back) | |
| Petri dishes | Several commercial brands | 100 x 15 mm diameter, polystyrene sterile untreated |
Riferimenti
- Handel, M. A., Schimenti, J. C. Genetics of mammalian meiosis: regulation, dynamics and impact on fertility. Nat Rev Genet. 11, 124-136 (2010).
- Peters, A. H., Plug, A. W., van Vugt, M. J., de Boer, P. A drying-down technique for the spreading of mammalian meiocytes from the male and female germline. Chromosome Res. 5, 66-68 (1997).
- Counce, S. J., Meyer, G. F. Differentiation of the synaptonemal complex and the kinetochore in Locusta spermatocytes studied by whole mount electron microscopy. Chromosoma. 44, 231-253 (1973).
- Speed, R. M. Meiosis in the foetal mouse ovary. I. An analysis at the light microscope level using surface-spreading. Chromosoma. 85, 427-437 (1982).
- Ashley, T., et al. Dynamic changes in Rad51 distribution on chromatin during meiosis in male and female vertebrates. Chromosoma. 104, 19-28 (1995).
- Baker, S. M., et al. Involvement of mouse mLh1 in DNA mismatch repair and meiotic crossing over. Nat Genet. 13, 336-342 (1996).
- Plug, A. W., Xu, J., Reddy, G., Golub, E. I., Ashley, T. Presynaptic association of Rad51 protein with selected sites in meiotic chromatin. Proc Natl Acad Sci U S A. 93, 5920-5924 (1996).
- Berkowitz, K. M., et al. Disruption of CHTF18 causes defective meiotic recombination in male mice. PLoS Genet. 8, e1002996 (2012).
- Gomez, R., et al. Sororin loads to the synaptonemal complex central region independently of meiotic cohesin complexes. EMBO Rep. 17, 695-707 (2016).
- Brooker, A. S., Berkowitz, K. M. The roles of cohesins in mitosis, meiosis, and human health and disease. Methods Mol Biol. 1170, 229-266 (2014).
- McNicoll, F., Stevense, M., Jessberger, R. Cohesin in gametogenesis. Curr Top Dev Biol. 102, 1-34 (2013).
- Rankin, S. Complex elaboration: making sense of meiotic cohesin dynamics. FEBS J. 282, 2426-2443 (2015).
- Holloway, J. K., Sun, X., Yokoo, R., Villeneuve, A. M., Cohen, P. E. Mammalian CNTD1 is critical for meiotic crossover maturation and deselection of excess precrossover sites. J Cell Biol. 205, 633-641 (2014).
- La Salle, S., Sun, F., Handel, M. A. Isolation and short-term culture of mouse spermatocytes for analysis of meiosis. Methods Mol Biol. 558, 279-297 (2009).
- Wiltshire, T., Park, C., Caldwell, K. A., Handel, M. A. Induced premature G2/M-phase transition in pachytene spermatocytes includes events unique to meiosis. Dev Biol. 169, 557-567 (1995).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon