Method Article
Preparación del cromosoma meiótico se extiende desde ratón espermatocitos
En este artículo
Resumen
La meiosis es el proceso de desarrollo por que los gametos se forman a través de una sola ronda de replicación del ADN y dos series sucesivas de segregación cromosómica. Meiosis mamífera pueden examinarse mediante la utilización de una técnica para preparar extensiones de cromosoma meiótico. Aquí, demostramos un método de preparación de superficie de extensión núcleos de espermatocitos de ratón.
Resumen
Meiosis mamífera es un proceso dinámico del desarrollo que ocurre en las células de germen y puede ser estudiado y caracterizado. Usando un método para extender los núcleos en la superficie del portaobjetos (en lugar de dejarlos caer desde una altura), se demuestra una técnica optimizada en espermatocitos de ratón que primero fue descrita en 1997. Este método es ampliamente utilizado en laboratorios para el estudio de meiosis mamífera porque produce una gran cantidad de núcleos de alta calidad sometidos a subetapas de la profase I. seminíferos túbulos primero se colocan en una solución hipotónica a hincharse espermatocitos. Espermatocitos se lanzan en una solución de sacarosa para crear una suspensión de células y núcleos se extienden sobre portaobjetos de vidrio empapado de fijador. Después de inmunotinción, se puede examinar una diversidad de proteínas relacionadas a los procesos de meiosis. Por ejemplo, las proteínas del Complejo Sinaptonémico, una estructura tripartita que une los ejes de cromosoma/corazones de homólogos pueden visualizarse fácilmente. Las proteínas de la recombinación meiótica, que están implicadas en la reparación de roturas de doble cadena de DNA por recombinación homóloga, pueden también ser immunostained para evaluar la progresión de la profase I. Aquí describimos y mostrar en detalle una técnica ampliamente utilizada para el estudio de meiosis mamífera en espermatocitos de ratones machos jóvenes o adultos.
Introducción
Ratones se utilizan extensivamente como un organismo modelo para el estudio de meiosis en mamíferos. Pueden evaluar los procesos de desarrollo normales y defectos que ocurren durante la meiosis. El cronograma y la progresión de las características salientes que ocurren durante la profase I y subetapas, así como una multitud de proteínas específicas implicadas en procesos cruciales para la regulación de la meiosis se caracteriza en el tipo salvaje y mutantes ratones. Varios procesos especializados que ocurren durante la meiosis que puedo estudiarse en detalle (revisado en Handel y Schimenti1). Estos incluyen formación de rotura de doble cadena (DSB) de DNA y reparación, recombinación, formación del Complejo Sinaptonémico y segregación cromosómica.
Un aspecto importante del estudio de procesos meióticas es la capacidad de examinar los núcleos que contienen cromosomas homólogos que son visualmente y ópticamente decidieron mejor distinguieran e identifican las subetapas de la profase I. profase se compone de 5 subestadios se caracterizan por rasgos específicos incluyendo la formación del Complejo Sinaptonémico (SC). El SC es un andamio de proteína tripartita que permite sincronización y reparación de rotura de doble cadena de ADN de homólogos. Durante leptonema, homólogos alinean elementos axiales de la SC están establecidas. Entonces fijación de elementos centrales del Complejo Sinaptonémico durante zygonema facilita la sincronización y física conexión (sinapsis) entre pares de homólogos. Durante pachynema, synapsis de homólogos se convierte completo y cruces de ADN están formadas por reparación de una población selecta de roturas de doble cadena de DNA mediante recombinación homóloga. La SC se desarma en diplonema, permitiendo homólogos desynapse pero permanecer unido en sus centrómeros y en sitios de cruces de ADN. Finalmente durante la diacinesis, homólogos recondensen y la transición a la metafase produce1.
Históricamente, superficie-que se separa de la cromatina meiótica rindió pocos núcleos, especialmente los de las primeras etapas de la profase I2. Como resultado, estos métodos fueron modificados para mejorar la separación de las células de los tejidos (ovario o testículo), la técnica de la que se separa la cromatina meiótica y la producción de núcleos meiótica de alta calidad para evaluación2,3, 4. Además, este método demostró para ser útil en la preservación de nuclear y la cromatina encuadernado proteínas en núcleos meióticas según lo demostrado por técnicas de inmunolocalización publicado5,6,7. Por lo tanto, el método inicialmente descrito por Peters2 y demostrado aquí rendimientos muchos núcleos de espermatocito ráfaga separadas con homólogos en el leptoteno, anfiteno, paquiteno, diploteno y diacinesis subetapas de la profase I.
La técnica de preparación de núcleos de extensión de superficie (también llamados análisis de propagación de la cromatina) es ampliamente utilizada para el estudio de meiosis en los campos de la biología reproductiva y de la célula. Diapositivas que contienen núcleos de extensión de la superficie pueden ser posteriormente immunostained con anticuerpos a las proteínas de interés o sometidos a tinción de plata y luego analizan con microscopia. El método es similar para los ratones masculinos y femeninos, aunque se han descrito modificaciones para ratones hembra2. Es crucial no overmince los túbulos seminíferos. Núcleos deben también bien transmitirse para que tras inmunotinción homólogos y las proteínas asociadas claramente se observan con microscopia. Núcleos de extensión de la superficie pueden ser preparados en tan sólo unas horas y ya sea immunostained inmediatamente o almacenados a-80 ° C durante un máximo de 3 semanas antes de la descongelación y el immunostaining. Sin embargo, obtener resultados óptimos se obtienen mejor para algunas proteínas si inmunotinción se realiza inmediatamente o dentro de 2 semanas de preparación de núcleos de extensión de la superficie. Diapositivas pueden ser immunostained con un protocolo estándar usando los anticuerpos a las proteínas de interés, seguido por la incubación con anticuerpos secundarios conjugados a fluorescente proteínas o tintes, luego imágenes con fluorescencia microscopía8. En el día postnatal 15-21 hay suficiente tejido por cada par de testículos de tipo salvaje para producir diapositivas 6 a 10, y ratones mayores (incluyendo a adultos) dan más diapositivas. Sin embargo, ratones de tipo salvaje 6 semanas de edad y mayores también producirá más post meiosis células (es decir, espermátidas) en las diapositivas siguientes immunostaining. Además, todos los subestadios de profase puedo observarse en ratones adultos y juveniles. Los testículos de machos en postnatales días 10 al 15, obtendrá muchas más células leptoteno y anfiteno. Mayores de día postnatal 14 a 15 ratones producirá más núcleos paquiteno y diploteno.
Aquí describimos y demostrar un método ampliamente utilizado de la preparación de superficie de extensión núcleos de espermatocitos de ratón.
Protocolo
Todos los métodos de ratones utilizaron alta ética y estándares de bienestar y fueron aprobados por el cuidado institucional de animales y uso en Drexel University College of Medicine.
1. preparación de soluciones y de instrumentos necesarios
- Preparación de Buffer de extracción hipotónica (HEB) en 50 mL de agua de laboratorio ultrapura grado, pH 8.2-8.4 (tabla 1). Hacer la solución fresca cada vez, mantener en hielo y usar dentro de 2 h de la preparación de extensiones; Esto es necesario para optimizar la reducción y la proteasa inhibidora actividades de TDT y PMSF, respectivamente. Utilizar 10 mL de HEB para cada par de testículos de ratón.
- Preparar una solución de sacarosa 100 mM (fresco cada vez) mediante la adición de 0,342 g de sacarosa por 10 mL de laboratorio ultrapura grado agua. Ajustar el pH a 8.2
- Preparar solución de fijación (1% paraformaldehido (PFA), 0.15% Tritón X-100, pH ajustado a 9.2 con 1 N HCl o NaOH N 1) mensuales frescos y almacenar a temperatura ambiente protegido de la luz. Diluir un stock inicial de comercialmente disponible 16% PFA al 4% de 1 X PBS para el uso como un trabajo y luego guardar alícuotas de 4% a-20 ° C.
- Para preparar la solución fijadora, añadir 10 mL de solución 4% de la PFA y 600 μl de 10% Tritón X-100 a 30 mL de 1 X PBS, mezclar bien y ajustar el pH a 9.2 con 1 N HCl o NaOH N 1. Almacenar la solución fijadora en un tubo cónico de 50 mL, envuelto en papel de aluminio a temperatura ambiente (de no más de 4 semanas).
- Preparar soluciones de lavado (mientras que las diapositivas están secando los últimos 30 minutos) con foto-Flo 200: 0,4% foto-Flo 200/PBS (320 μl de Photo-Flo 200 en 80 mL de 1 X PBS) y 0.4% foto-Flo 200/dH2O (160 μl de Photo-Flo 200 en 40 mL de agua de laboratorio ultrapura grado). Use una jarra de Coplin de 50 mL con 40 mL de soluciones para lavar 10 o menos diapositivas a la vez.
- Preparar los siguientes instrumentos: 1 par de tijeras quirúrgicas (que haga una incisión en la piel), 1 par de tijeras quirúrgicas de punta fina (al incidir el peritoneo), 2 pares de pinzas de punta fina recta (a diseccionar a cada testículo), 1 borde recto hoja de afeitar (para incidir cada testículo), curva de 2 pares de pinzas de punta (para inmovilizar cada testículo y exprimir hacia fuera de los túbulos seminíferos), 50 mL frascos Coplin, Teflon imprime diapositivas de anillo 3, 1 bisturí con hoja de tamaño 11, cámara humidificado, platos de Petri 100 x 15 mm, marcador permanente de punta fina o un lápiz y una agitador rotatorio de la plataforma.
- Premium de lugar sin cargar prefiltrado portaobjetos esmerilado final vertical en un frasco de Coplin 50 mL llenada con solución fijadora hasta su uso.
Nota: El lápiz es preferible si diapositivas se utilizará posteriormente en los procedimientos que requieren etanol, tales como hibridación en situ de la fluorescencia.
- Premium de lugar sin cargar prefiltrado portaobjetos esmerilado final vertical en un frasco de Coplin 50 mL llenada con solución fijadora hasta su uso.
2. núcleos de espermatocito separarse
- Eutanasia a un ratón macho según las pautas (por ejemplo, la dislocación cervical con o sin CO2 asfixia).
- Uso P10 - P20 machos para evaluar células meióticas en la primera onda de la espermatogénesis; rutinariamente utilizamos P15 - P17 los machos para obtener las células de los subestadios de profase I. proporcionarán los testículos adultos células de profase I demasiado, pero también producirá células más postmeiotic, como espermátides.
- Cosecha y pesan los testículos (registrar los pesos pares); luego colocarlos en una placa Petri que contenga unas gotas de frío HEB para mantenerlos húmedos.
- Sostenga el testículo contra el fondo del plato con unas pinzas de punta curva y utilizar una cuchilla de filo recto para hacer una incisión del midline vertical pequeño a través de la cápsula del testículo. Manteniendo todavía los testículos contra el fondo del plato con una pinzas, utilice un segundo conjunto de pinzas de punta curva o cuchilla de filo recto para apretar suavemente los túbulos seminíferos del testículo.
- Coloque los tubos en un tubo cónico de 15 mL que contiene 10 mL de HEB fría, teniendo cuidado con poner piezas de la cápsula en el tubo. Repita estos pasos con el segundo testículo.
- Incubar los túbulos seminíferos decapsulated en el tubo cónico que contenga HEB en hielo por 30-60 min, dependiendo del tamaño de los testículos. Incubar los tubos seminíferos de un par de testículos pesa 30 mg o menos por 30 min, los túbulos de un par de testículos, peso de 31 a 50 mg de 30-45 minutos y los testículos más grandes durante 60 minutos. No alteran los tiempos de un solo testículo.
Nota: El tiempo de incubación óptimo puede variar dependiendo de la experiencia del experimentador, los reactivos usados y los ratones se analiza. - Mientras que los túbulos seminíferos están incubando en HEB, utilice un lápiz o marcador para etiquetar los extremos helados de prefiltrado diapositivas con el ratón, número de diapositiva y fecha. Luego coloque las diapositivas previamente limpiadas en una jarra de Coplin conteniendo la solución fijadora.
- Tras incubación, vierta los túbulos y HEB en una caja de Petri limpia y túbulos separados en unos grupos de diámetro de 3 mm. Cada grupo da 2 toboganes, y el número de diapositivas dado depende del tamaño de los testículos.
Nota: Obtenemos 8 diapositivas de tipo salvaje y las 6 diapositivas de subfertilidad Chtf18-null P16 testículos (que son más pequeños debido a disminución de las células germinales meióticas y mitóticas8). Testículo adulto un peso de 100 mg o más se espera para producir 16 diapositivas. - Lugar 23 μl de solución de sacarosa 100 mM en un anillo de un Teflon impreso, 3 anillo de la diapositiva y agregar un grupo de túbulos seminíferos con el anillo. Entonces usando curva Punta pinzas para sujetar la masa, picar suavemente los túbulos con una cuchilla de afeitar 11 de tamaño hasta que la solución se vuelva turbia.
Nota: No overmince como resultado cromosomas fragmentados. Tenga en cuenta que los cromosomas fragmentados también podrían ser indicativos de un fenotipo mutante. - Eliminar los residuos, añadir otro 23 μl de solución de sacarosa y utilice una micropipeta para suavemente pipetear la mezcla hacia arriba y hacia abajo unas cuantas veces para ayudar a separar las células en la suspensión.
- Eliminar una diapositiva en la jarra de Coplin conteniendo solución de fijación e inclinar el portaobjetos sobre la jarra para una gota generosa se recoge en la parte inferior de la diapositiva.
- Pipetear 20 μl de la suspensión celular de sacarosa del anillo de la diapositiva de impresos 3 anillo de teflón a la gota fijadora en un premium mate portaobjetos de vidrio y pipetear la suspensión hacia arriba y abajo 2 - 3 veces.
Nota: Debe ser lo suficientemente grande en volumen la gota fijadora para que además de 20 μL de la suspensión de células de sacarosa permite cobertura en toda la diapositiva entera cuando la mezcla se extiende (ver 2.11 abajo).
- Pipetear 20 μl de la suspensión celular de sacarosa del anillo de la diapositiva de impresos 3 anillo de teflón a la gota fijadora en un premium mate portaobjetos de vidrio y pipetear la suspensión hacia arriba y abajo 2 - 3 veces.
- Lentamente incline la diapositiva al lado opuesto de la gota para extender la suspensión de células a lo largo de la longitud de la diapositiva. Luego lentamente incline la corredera atrás para extender la suspensión de células a lo largo de la anchura de la corredera para cubrirlo totalmente. Evitar la propagación de la suspensión sobre la misma área de la diapositiva más de una vez lo contrario, que las células se superpondrán entre sí.
- Inmediatamente Coloque el portaobjetos en una cámara humidificada y repetir pasos 2.8 a 2.11 hasta los grupos de los túbulos seminíferos se han utilizado para hacer diapositivas. Es importante no mover la cámara humidificada durante el proceso de secado para evitar desgarro y superposición de las células.
- Deje que los portaobjetos se incuban en una cámara humidificada cubierta a temperatura ambiente durante 2,5 h para que seque lentamente y no totalmente. Alta humedad y secado lento en este paso están importantes para asegurar la difusión adecuada de la cromatina. Luego retire la tapa de la cámara y permita que el portaobjetos se seque al aire completamente un adicional 30 minutos.
- Diapositivas (espalda con espalda o en forma de zigzag) en una jarra de Coplin que contenga 0,4% foto-Flo 200/1 X PBS solución y lave el portaobjetos dos veces, 5 minutos cada uno, por agitar suavemente el recipiente del tarro en una plataforma giratoria coctelera. Utilizar solución fresca para cada colada y diapositivas de diferentes ratones en frascos separados para cada uno de los lavados.
- Lave los portaobjetos en una jarra de Coplin conteniendo 0.4% foto-Flo 200/dH2O solución durante 5 minutos una vez cuando agitándola.
- Retirar los portaobjetos del Coplin jar (último lavado), con cuidado Limpie los bordes y fondos de las diapositivas a eliminar el exceso de líquido y coloque los portaobjetos en posición inclinada, casi vertical, para secar. Un experimentador que domina esta técnica puede procesar y preparar superficie propagación núcleos de 4 o 5 ratones en un día.
- Una vez seco (15-20 min), proceso de diapositivas inmediatamente para tinción de inmunofluorescencia o tienda a-80 ° C en una caja de diapositivas bien cerrados protegida de la luz para un máximo de 3 semanas (dependiendo de las proteínas blanco evaluadas; resultados óptimos se pueden obtener si mancharon el mismo día o dentro de 2 semanas).
- Si se almacenan a-80 ° C, luego deje que el portaobjetos se llegue a temperatura ambiente y lavado en un frasco de Coplin conteniendo 1 X PBS o bloque 5 min antes de la tinción.
Nota: Muchos protocolos de tinción de inmunofluorescencia diferentes proporcionará buenos resultados; Consulte a Berkowitz et al. de immunostaining protocolo8.
- Si se almacenan a-80 ° C, luego deje que el portaobjetos se llegue a temperatura ambiente y lavado en un frasco de Coplin conteniendo 1 X PBS o bloque 5 min antes de la tinción.
Resultados
La capacidad de este método para proporcionar grandes cantidades de superficie de extensión núcleos que contienen homólogos intactos depende de tres factores principales: 1) tiempo de incubación apropiados de los túbulos seminíferos en tampón hipotónico (es decir, HEB) para obtener adecuadamente hinchó espermatocito núcleos que explotaran pero no se desintegran de prolongada incubación en HEB, 2) micropipetting las gotas de sacarosa de las células para obtener una suspensión separada de los núcleos que no están agrupados y 3) inclinación cada fijador cubierto diapositivas en una sola dirección en un momento y no hacia adelante y hacia atrás. Una vez preparada, la superficie propagación núcleos pueden ser immunostained con etiquetados fluorescente anticuerpos a las proteínas de interés y luego fotografiada con microscopio (representante de ejemplos se muestran en la figura 1 y figura 2. La figura 1 muestra ejemplos de núcleos de paquiteno de tipo salvaje que se extienden bien (A), núcleos que contienen irregularmente immunostained, jirones homólogos que aparecen debido a la incubación en HEB demasiado largo (B), mal repartidas superpuestas núcleos (C) y que contiene los núcleos homólogos fragmentadas debido a la "overmincing" de los túbulos seminíferos (D). Cuando la técnica se realiza también, una gran cantidad de núcleos que representa las principal 5 subestadios de profase puedo obtener. Figura 2 muestra las etapas de profase leptoteno, anfiteno, paquiteno, diploteno y diacinesis en núcleos de espermatocitos tipo salvaje de machos juveniles.

Figura 1: Superficie transmite núcleos de espermatocitos tipo salvaje de ratones jóvenes.
Paquiteno espermatocito núcleos fueron manchados con anti-SYCP3 (verde), que tiñe los núcleos de elementos axial, lateral del Complejo Sinaptonémico (A) bien extendidos. (B) los núcleos de los túbulos seminíferos se incubaron en HEB demasiado largo. (C) mal extendido núcleos superpuestos. (D) homólogos fragmentadas debido a la "overmincing" de los túbulos seminíferos (puntas de flecha indican dos fragmentos pequeños de homólogo). Barra de escala es de 5 μm. Haga clic aquí para ver una versión más grande de esta figura.
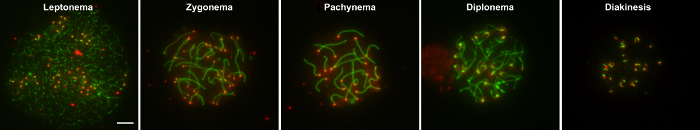
Figura 2: Ejemplos de núcleos de subestadios de la profase I.
Espermatocitos de tipo salvaje de machos juveniles fueron manchados con cresta suero (rojo), que tiñe los centrómeros, y anti-SYCP3 (verde), que tiñe los elementos axial, lateral del Complejo Sinaptonémico. El leptoteno, anfiteno, paquiteno, diploteno y diacinesis etapas de profase I, respectivamente, se muestran. Barra de escala es de 5 μm. Haga clic aquí para ver una versión más grande de esta figura.
| Reactivo de | Cantidad | Concentración final |
| 1 M Tris-Cl (pH 8.2) | 1.5 mL | 30 mM |
| Sacarosa | 0,85575 g | 50 mM |
| Citrato trisódico dihidrato | 0,25 g | 17 mM |
| 0, 5 EDTA M | 500 ΜL | 5 mM |
| Ditiotreitol (DTT) | g 0,00385 | 0,5 mM |
| 0.2 M Phenymethylsulfonyl fluoruro (PMSF) | 25 ΜL | 0,1 mM |
Tabla 1: Receta de tampón de extracción hipotónica (HEB).
Añadir reactivos para laboratorio ultrapura 50 mL grado agua y ajustan a pH 8.2-8.4 (si es necesario utiliza 1 N NaOH solución o 1 N HCl). Preparar HEB fresco cada hora, mantener en hielo y usar dentro de 2 h de preparación.
Discusión
Para obtener un número elevado de núcleos de espermatocito bien extendidas, buena calidad, los pasos más críticos de este protocolo incluyen el tiempo de incubación apropiados de los túbulos seminíferos en HEB, apropiado picado de túbulos seminíferos, y la técnica empleada para distribuyen la suspensión de células de sacarosa en el fijador diapositivas revestido. Incuban los túbulos seminíferos de los testículos de los machos de tipo salvaje desde día postnatal 15 a la edad adulta en HEB por 45 min, mientras que los testículos de comparable de Chtf18-ratones nulos se incuban durante sólo 30 minutos porque los testículos son mitad del tamaño y contienen significativamente menos células germinales8. En nuestra experiencia, incubación de Chtf18-null los testículos para más de 30 min compromete la integridad de las células, dando por resultado homólogos mal resueltos. Túbulos seminíferos son picados sólo para obtener una suspensión turbia de la sacarosa, y cada diapositiva debe contener una gota generosa de fijador antes de separarse (ver 2.10). Diapositivas están inclinadas en una dirección en un momento y no hacia adelante y hacia atrás. El método es ideal para el estudio de la meiosis I, pero es en gran parte limitada a subetapas de la profase I. Sin embargo, los núcleos en fase S de premeiotic de metafase I y II pueden observarse y han sido registrados7,9.
Este es un método sencillo que requiere algo de práctica para adquirir competencia y obtener los mejores resultados. Resultados subóptimos podrían ocurrir por varias razones. Núcleos pueden no ser bien extendidos, dando por resultado agrupado o superposición de las células. Esto puede ocurrir si la suspensión de células de sacarosa no se pipetea adecuadamente o no hay suficiente fijador en la diapositiva para difundir los núcleos bien. Si las diapositivas no están cubiertas con suficiente fijador residual o la suspensión de células no es difundir a través de la diapositiva en una dirección suave o difundir repetidamente hacia adelante y hacia atrás, entonces las células se superponen y agruparse. Si los túbulos seminíferos son "overminced" homólogos pueden ser fragmentados o aparecerán algo rallados. Como testículos mutantes pueden ser menor, contiene espermatocitos menos y ser más susceptibles a "overmincing" o fragmentación de los túbulos seminíferos, se recomienda practicar un par de veces en los testículos de control (por ejemplo, el tipo salvaje) para optimizar la técnica de la manos de un novato.
Preparación de núcleos de propagación superficial es una técnica fundamental para examinar medidas reguladoras y progresión de la meiosis, así como para caracterizar los fenotipos meióticas en ratones. Por lo tanto, utilizamos este método ampliamente y enseñar a todos los nuevos miembros de laboratorio a realizar. Una vez que se domina esta técnica, puede utilizarse un sinnúmero de otras técnicas, posteriormente y en relación con el mismo. Por ejemplo, varios tipos de immunostaining o microscopía incluyendo widefield o confocal con epifluorescencia o Electrón microscopia puede realizarse. Además de estudiar las proteínas específicas de la meiosis como componentes del Complejo Sinaptonémico, quienes interactúan con la SC, como cohesins, complejos de multiproteínas que median la cohesión, pueden ser evaluados (revisado en 10,11 12). Reglamento de formación de crossover, procesamiento y maduración de ADN puede ser y también han sido estudiados con esta técnica13. In addition, esta técnica se ha realizado tras el uso de métodos para obtener poblaciones específicas de ratón espermatocitos: 1) a raíz de la cultura de espermatocitos en ácido okadaico para inducir la progresión a la transición G2/MI, produciendo aumento en el número de diploteno, diacinesis y metafase se extiende de14,15 y 2) después de los métodos utilizados para aislar una población enriquecida de paquiteno espermatocitos14.
La técnica de preparación de superficie de extensión núcleos de espermatocitos de ratón descrito y demostrado que aquí es una técnica muy útil y sencilla. Es por excelencia a cada laboratorio que estudios usando ratones como un organismo modelo de meiosis, pero requiere práctica y habilidad para lograr los mejores resultados.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores reconocen la asistencia técnica de Abigail Harris. También reconoce Paula Cohen y Kim Holloway para ayudar a optimizar el protocolo de preparación de superficie de extensión núcleos de espermatocitos de ratón. Los autores también aprecian la lectura crítica del manuscrito por Karen Schindler.
Este trabajo fue financiado por los NIH R01 GM106262 a K.M.B.
Materiales
| Name | Company | Catalog Number | Comments |
| Photo-Flo 200 | Kodak | 1464510 | |
| 16% Paraformaldehyde (formaldehyde aqueous solution) | Electron Microscopy Sciences | RT 15710 | Dilute 16% solution into 4% working stocks with 1X PBS and freeze aliquots at -20 °C |
| Teflon printed 3 ring slides | Electron Microscopy Sciences | 63418-11 | |
| Premium uncharged frosted end glass slides | Several commercial brands | Clean slides in ethyl or isopropyl alcohol and allow to drip dry prior to use; label slides on frosted end with a permanent marker or pencil depending on subsequent use of slides | |
| Surgical scissors (sharp and blunt tips) | Fine Science Tools | 14001-12 | Different brand of a similar type will work |
| Fine tip surgical scissors (sharp tips) | Fine Science Tools | 14058-11 | Different brand of a similar type will work |
| Straight fine tip forceps | Fine Science Tools | 11050-10 | Different brand of a similar type will work |
| Curved medium tip forceps | Fisher | 16100110 | Different brand of a similar type will work |
| Scalpel handle | Fine Science Tools | 10003-12 | Different brand of a similar type will work |
| Mouse anti-SYCP3 | Abcam | ab97672 | Use at 1:300 |
| Anti-centromere protein (derived from human CREST patient serum) | Antibodies Incorporated | 15-234-0001 | Use at 1:50 |
| Humidified chamber | We use Nunc square culture dishes 500 cm2/well with moistened paper towels | ||
| Widefield microscope with epifluorescence | Leica microsystems | Any standard model | |
| Coplin jars | Several commercial brands | 50 ml capacity; 40 mm (1.6 in.) diameter, holds 10 slides (back to back) | |
| Petri dishes | Several commercial brands | 100 x 15 mm diameter, polystyrene sterile untreated |
Referencias
- Handel, M. A., Schimenti, J. C. Genetics of mammalian meiosis: regulation, dynamics and impact on fertility. Nat Rev Genet. 11, 124-136 (2010).
- Peters, A. H., Plug, A. W., van Vugt, M. J., de Boer, P. A drying-down technique for the spreading of mammalian meiocytes from the male and female germline. Chromosome Res. 5, 66-68 (1997).
- Counce, S. J., Meyer, G. F. Differentiation of the synaptonemal complex and the kinetochore in Locusta spermatocytes studied by whole mount electron microscopy. Chromosoma. 44, 231-253 (1973).
- Speed, R. M. Meiosis in the foetal mouse ovary. I. An analysis at the light microscope level using surface-spreading. Chromosoma. 85, 427-437 (1982).
- Ashley, T., et al. Dynamic changes in Rad51 distribution on chromatin during meiosis in male and female vertebrates. Chromosoma. 104, 19-28 (1995).
- Baker, S. M., et al. Involvement of mouse mLh1 in DNA mismatch repair and meiotic crossing over. Nat Genet. 13, 336-342 (1996).
- Plug, A. W., Xu, J., Reddy, G., Golub, E. I., Ashley, T. Presynaptic association of Rad51 protein with selected sites in meiotic chromatin. Proc Natl Acad Sci U S A. 93, 5920-5924 (1996).
- Berkowitz, K. M., et al. Disruption of CHTF18 causes defective meiotic recombination in male mice. PLoS Genet. 8, e1002996 (2012).
- Gomez, R., et al. Sororin loads to the synaptonemal complex central region independently of meiotic cohesin complexes. EMBO Rep. 17, 695-707 (2016).
- Brooker, A. S., Berkowitz, K. M. The roles of cohesins in mitosis, meiosis, and human health and disease. Methods Mol Biol. 1170, 229-266 (2014).
- McNicoll, F., Stevense, M., Jessberger, R. Cohesin in gametogenesis. Curr Top Dev Biol. 102, 1-34 (2013).
- Rankin, S. Complex elaboration: making sense of meiotic cohesin dynamics. FEBS J. 282, 2426-2443 (2015).
- Holloway, J. K., Sun, X., Yokoo, R., Villeneuve, A. M., Cohen, P. E. Mammalian CNTD1 is critical for meiotic crossover maturation and deselection of excess precrossover sites. J Cell Biol. 205, 633-641 (2014).
- La Salle, S., Sun, F., Handel, M. A. Isolation and short-term culture of mouse spermatocytes for analysis of meiosis. Methods Mol Biol. 558, 279-297 (2009).
- Wiltshire, T., Park, C., Caldwell, K. A., Handel, M. A. Induced premature G2/M-phase transition in pachytene spermatocytes includes events unique to meiosis. Dev Biol. 169, 557-567 (1995).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados