Method Article
Lesione aortica di crusca a murina: un efficace
In questo articolo
Riepilogo
La restenosi dopo procedure cardiovascolari (chirurgia bypass, angioplastica o stenting) è un problema significativo che riduce la durata di queste procedure. Una terapia ideale potrebbe inibire la proliferazione delle cellule muscolari lisce (VSMC), promuovendo la rigenerazione dell'endotelio. Descriviamo un modello per la valutazione simultanea della proliferazione VSMC e della funzione endoteliale in vivo.
Abstract
La ricostruzione arteriosa, sia in caso di angioplastica che di intervento di bypass, comporta traumi iatrogeni che provocano disturbi endoteliali e proliferazione delle cellule muscolari lisce vascolari (VSMC). I modelli murini comuni studiano piccole vasi come le arterie carotide e femorali. Qui descriviamo un sistema in vivo in cui sia la proliferazione VSMC che la funzione di barriera endoteliale possono essere valutate contemporaneamente in un grande recipiente. Abbiamo studiato la risposta aortica infrarenale alla lesione nei topi C57BL / 6. L'aorta è stato ferito dalla vena renale sinistra alla biforcazione aortica da 30 crush transmural di durata di 5 secondi con un applicatore a cotone. I cambiamenti morfologici sono stati valutati con l'istologia convenzionale. Lo spessore della parete aorta è stato misurato dalla superficie luminare all'adventitia. L'integrazione di EdU e la colorazione di contatori con DAPI e l'alpha-actina è stata utilizzata per dimostrare la proliferazione del VSMC. L'attivazione di ERK1 / 2, un moderatore noto della formazione di iperplasia intima, è stato scoraggiatoEstratti da Western Blot. L'effetto dell'infiammazione è stato determinato da immunohistochemistry per le cellule B, le cellule T e macrofagi . Le sezioni di endotelio sono state visualizzate con la microscopia elettronica a scansione (SEM). La funzione di barriera endoteliale è stata determinata con la colorazione Evans Blue. La lesione transmurale ha provocato l'ispessimento della parete aortica. Questa lesione ha causato la proliferazione del VSMC, soprattutto 3 giorni dopo la lesione e l'attivazione precoce di ERK1 / 2 e la diminuzione della espressione p27 kip1. La lesione non ha determinato l'aumento delle cellule B, delle cellule T o dell'infiltrazione dei macrofagi nella parete del vaso. La lesione ha causato denudazione parziale della cellula endoteliale e la perdita del contatto cellulare. La lesione ha causato una significativa perdita di funzione barriera endoteliale, che è tornata alla base dopo sette giorni. Il modello di lesioni aortiche blasfonde trasversali murine fornisce un sistema efficace per studiare contemporaneamente sia la proliferazione VSMC che la funzione di barriera endoteliale in un grande recipiente.
Introduzione
La restenosi Seguendo procedure cardiovascolari (chirurgia bypass, angioplastica o stenting) è un problema significativo riducendo la durata di queste procedure. Tutte le procedure di rivascolarizzazione sono afflitte da restenosi. Le strategie presenti per prevenire la restenosi (stent che eluiscono farmaci e palloni rivestiti di droga) inibiscono sia la cellula muscolare liscia vascolare (VSMC) che la proliferazione delle cellule endoteliali (EC). Di conseguenza, questi interventi prevengono la restenosi mediata dal VSMC, ma impediscono anche la rigenerazione dell'endotelio. Senza un endotelio intatto, i pazienti devono essere su potenti agenti antiagglomeranti per ridurre il rischio di trombosi in situ a rischio di complicazioni emorragiche. Una terapia ideale inibirà la proliferazione del VSMC, promuovendo la rigenerazione dell'endotelio. Pertanto, vi è la necessità di studiare simultaneamente la proliferazione VSMC e la funzione di barriera endoteliale i n vivo .
Attualmente, ci sono severModelli di topo restenosi 1 . Questi modelli includono lesioni carotide e lesioni del filo femorale 2 . I modelli aortici includono il posizionamento dello stent 3 , la lesione a palloncino 4 e l'allograft aortico 5 . Tutti i modelli presenti sono limitati. La legatura carotide genera una lesione neointimale mediata dal flusso e non ha lesioni endoteliali. Inoltre, le arterie carotide e femorali hanno molte pieghe meno strati cellulari rispetto ai vasi umani, limitando il loro valore traduzionale. L'aorta del topo, che è di circa 1,3 mm di diametro, è l'unica vaso che si avvicina ad un'arteria umana (coronaria) clinicamente rilevante (3).
Nonostante il potenziale di traslazione dei modelli murali aortici della malattia, i modelli correnti hanno limitazioni. Questi modelli richiedono abilità microchirurgiche avanzate e attrezzature specializzate come palloncini e stents per angioplastica. Qui, noi presentiamoUna nuova tecnica riproducibile per indurre contemporaneamente la proliferazione del VSMC e disturbare la funzione di barriera endoteliale.
Protocollo
Dichiarazione di etica: I protocolli per la manipolazione degli animali sono stati approvati dal Comitato istituzionale per la cura degli animali (IACUC) dell'Università del Maryland (protocollo numero 0416009) e condotto secondo gli standard internazionali AAALAC.
1. Procedura chirurgica
- Tecnica anestetica
- Sterilizzare tutti gli strumenti utilizzati per la chirurgia di sopravvivenza con sterilizzazione a vapore a 121 ° C per 30 min.
- Indurre l'anestesia attraverso un serbatoio di induzione con 100% O 2 e 2,5% isoflurano consegnato tramite vaporizzatore di precisione. Post-induzione, interrompere l'isoflurano e sciacquare la camera con O 2 . Mantenere l'anestesia con 1,5-2% di isoflurano tramite maschera e 1 L / min O 2 per inalazione.
- Attaccare sia la camera di induzione e la maschera facciale ad un detergente per carbone per l'assorbimento del gas di scarico per proteggere il personale. Garantire un adeguato livello anestetico da dimostrareChe non vi è risposta a stimoli nocivi (pizzicotto del piede).
- Creare un campo operativo costituito da un vassoio chirurgico con rilievo isotermico per fornire un supporto termico durante l'intervento chirurgico. Un ulteriore pad isotermico fornirà un supporto termico agli animali nella loro gabbia di recupero.
- Preparazione degli animali
- Eseguire la seguente inchiesta sui maschi C57BL / 6 maschi di 10-12 settimane.
- Rimuovere i peli sulla superficie addominale ventrale dell'animale dallo sterno fino alla regione inguinale con un agente depilatore o un tagliatore elettrico con una lama di 40.
- In caso di agente depilatorio, applicare questo composto alla zona chirurgica per 2-3 minuti e poi rimuoverlo con cotone. Utilizziamo un composto commercialmente disponibile di idrossido di calcio e idrossido di sodio.
- Preparare l'area sopra la spalla con alcol al 70% e iniettare sottocutanea carprofen (5 mg / kg) con un ago da 25 gauge o più piccolo. QuestoIl trattamento fornirà analgesia postoperatoria per l'animale.
- Trasferisci l'animale al campo chirurgico e posiziona nella ricostruzione dorsale.
- Preparare il sito chirurgico sciacquando 8-12% di providone-iodio con un applicatore di cotone pulito o garza di cotone. Quindi sciacquare la pelle due volte con alcool al 70%.
- Mettere il lubrificante oculare in entrambi gli occhi per ridurre l'incidenza della desquamazione corneale. Coprire il sito chirurgico con un drappo sterile.
- Tecnica operativa
- Effettuare un'incisione mediana di laparotomia addominale di circa 2-2,5 cm di lunghezza con un bisturi che inizia immediatamente caudale il processo xiphoid e si estende verso il bacino.
- Mobilizzare l'intestino e il duodeno e riflettere lateralmente a destra. Roll up una striscia di cotone sterile confezionato e imbevuto di salina sterile per l'iniezione per consentire l'imballaggio della viscera per migliorare l'esposizione.
- Con il piccolo intestino mobilitato al lato destro dellaL'addome esporre il retroperitoneo ed esporre l'aorta addominale dalla vena renale sinistra alla biforcazione aortica ( Figura 1 ).
- Con un applicatore sterile a cotone, consegnare 30 frantumazioni consecutive, ogni cinque secondi in durata.
- Rimuovere l'imballaggio e consentire al viscera di tornare alla propria posizione nativa.
- Chiudere la fascia con una sutura monofilamento assorbibile 4-0 (polidioxanone). La pelle è chiusa con una sutura monofilamento non in assorbimento 6-0 (nylon).
- Recupero e cura post-procedura
- Dopo la procedura, posizionare l'animale in una gabbia di recupero con biancheria pulita su un tampone isotermico per continuare il supporto termico finché l'animale non è in grado di ambulare normalmente. Non lasciare l'animale incustodito fino a dimostrare la capacità di mantenere la ricostruzione sternale.
- Monitorare l'animale ogni ora per i primi 4 h dopo l'intervento chirurgico. Una volta che l'animale sta ambulando normalmente ritornare i T alla camera di affiliazione assegnata. L'animale non sarà ospitato in compagnia di un altro animale fino a quando non sarà completamente recuperato.
- Monitorare l'animale due volte al giorno per i primi 72 h dopo l'intervento chirurgico e almeno 3 volte la settimana dopo. Il monitoraggio include la pesatura dell'animale tre volte alla settimana.
- Amministrare carpofen (5 mg / kg) sottocutanea due volte al giorno per i primi 72 h dopo l'intervento chirurgico.
2. Approvvigionamento di tessuti
- Metodo di eutanasia
- Eutanizzare gli animali in momenti prestabiliti.
- Indurre l'anestesia attraverso un serbatoio di induzione con 100% O 2 e 2,5% isoflurano consegnato tramite vaporizzatore di precisione.
- Per studiare l'integrità dell'endotelio, somministrare tintura blu all'animale.
NOTA: Evans Blue è un colorante azoto caricato negativamente con un'elevata affinità di legame per l'albumina e può solo macchiare i vasi sanguigni in assenza di un endotilo intattoS = "xref"> 6. - Per gli studi di integrità endoteliale, al momento dell'eutanasia, perfusione degli animali con 5 mL di 0.3% Evans Blue colorante seguita da 5 mL di PBS a pressione fisiologica per 5 minuti. L'animale viene mantenuto in un piano chirurgico di anestesia durante la procedura di perfusione.
- Per studiare l'integrità dell'endotelio, somministrare tintura blu all'animale.
- Dopo aver raggiunto un piano profondo anestetico, aprire il petto con una sternotomia. Fare una lacerazione nell'atrio destro per consentire il drenaggio del sangue dall'animale e accedere al ventricolo sinistro è accessibile con un ago da 21 G e iniettare la soluzione salina fosfatizzata (PBS) finché l'effluente dal atrio destro non è chiaro.
- Dopo la perfusione con PBS, entrare nell'addome attraverso un'incisione midline.
- Ancora una volta, mobilitare l'intestino sottile al lato destro dell'addome che esprima l'aorta infrarenale, seziona acutamente l'aorta dai tessuti adiacenti e lo accetta dalla vena renale sinistra alla biforcazione aortica.
- Conservare l'aorta esaurita in un paraformald del 4%Ehyde soluzione fino al processo di trasformazione del tessuto.
- Per gli studi di integrità endoteliale, aprire l'aorta longitudinalmente e fissarlo a un foglio di cera esponendo l'intera superficie della lumina 6 . Eseguire una valutazione qualitativa dell'integrità endoteliale per il grado di colorazione con il colorante Evans Blue 6 .
- Per altri esami istologici, tagliare l'aorta trasversalmente e inserirlo in composti ottimali di taglio (OCT) come dettato dal metodo istologico da utilizzare 7 .
Risultati
Le sezioni trasversali delle aorta incorporate in OCT sono state sezionate e macchiate con ematoxilina e eosina e poi contate con la macchia Verhoeff-Van Gieson (VVG) per identificare la lamina elastica interna ed esterna 7 . L'ispessimento della parete aortica indotta da lesioni a crisi è aumentato rispetto alle aorte degli animali trattati con una procedura sham (laparotomia e piccola mobilitazione intestinale). Lo spessore delle pareti, valutato dalla distanza da adventitia al lumen, è stato il più grande tre giorni dopo la lesione (42,2 ± 1,7 μm contro 22,1 ± 1,1 μm per la laparotomia da solo) ( Figura 2A-B ). Le lesioni hanno causato le cellule aventi un aspetto più arrotondato e un contorno irregolare della superficie lumina ( Figura 2C ).
L'aumento della diffusione della parete dell'arto ferito è almeno in parte mediato da una maggiore proliferazione della muscolatura vascolare medialeCelle. Per dimostrare che l'ispessimento della parete è dovuto ad una maggiore proliferazione in contrasto con l'ipertrofia cellulare, abbiamo utilizzato un saggio di proliferazione EdU. In questo saggio, l'analogo timidina 5-etinil-2'-deoxyuridine (EdU) viene somministrato per via endovenosa al mouse 24 h prima dell'eutanasia. EdU è incorporato nel DNA durante la sintesi. L'EDU è rilevato da una reazione a clic (catalizzatore di azide-alchino catalizzato con rame con colorante verde-fluorescente) 8 . I topi sham esposti solo alla laparotomia non avevano nessuna fluorescenza osservata in alcun strato dell'arto. Conversley, i topi sottoposti a lesioni aortiche hanno dimostrato la fluorescenza sia nei media che nell'intima dell'aorta ( Figura 3 ).
L'ispessimento della parete aortica dopo la lesione della crusca attiva i percorsi di segnalazione cellulare implicati nella restenosi negli esseri umani. La kinione della proteina attivata da mitogeni (MAP Kinase) ERK1 / 2 è uno dei principali mediatori della formazione di iperplasia intimaIn risposta alla stimolazione da un mitogeno, ERK1 / 2 è fosforilato e attivato 9 , 10 . I dati del nostro laboratorio hanno inoltre dimostrato che l'inibitore della chinina-dipendente chinasi p27 kip1 è diminuito in risposta a stimoli mitogeni nella parete del recipiente 12 . I topi sono stati eutanizzati a 1, 3, 7 giorni e 1 mese dopo la lesione aortica. L'aorta infrarenale è stata isolata e l'espressione proteica di ERK1 / 2, fosfo-ERK1 / 2 (la forma attivata di ERK1 / 2) e l'inibitore della chinina dipendente della ciclina p27 kip1 sono state determinate mediante analisi Western blot ( Figura 4A ). Non è stata osservata alcuna modifica nella totale espressione di proteine ERK1 / 2 nel tempo. Tuttavia, tre giorni dopo la lesione, l'espressione fosforo-ERK1 / 2 (Pi-ERK1 / 2) era superiore al 200% rispetto alla linea di base Pi-ERK1 / 2. L' espressione p27 kip1 è diminuita nei primi tempi e ha raggiunto un nadir di circa il 20% del basale 7 giorni afTer lesioni. Sia l' espressione Pi-ERK1 / 2 che p27 kip1 hanno approssimato i livelli di base di un mese dopo la lesione ( Figura 4B ). Così l'ispessimento osservato della parete aortica è almeno in parte dovuto all'aumento della proliferazione mediale.
Il modello di lesioni aortiche consente la valutazione simultanea della proliferazione muscolare liscia media e della funzione di barriera endoteliale. La microscopia elettronica a scansione (SEM) è stata utilizzata per caratterizzare l'effetto della ferita di schiacciamento sulla morfologia dell'endotelio. La superficie lumina dell'arto è fiancheggiata da un confluente endotelio che impedisce l'adesione di cellule emerse di sangue e di molecole ( Figura 5A , Barra di scala = 100 μm). Al contrario, i danni causati da schiacciamento provocano la rottura delle cellule endoteliali e la denudazione parziale dell'endotelio ( figura 5B , barra di scala = 100 μm). Come visto in caso di ingrandimento più elevato, la rottura dell'endotelio provoca l'adhesiSu particelle consistenti in dimensioni e forma con piastrine. L'adesione di queste particelle si verifica in tutta l'area di lesione e non si limita a zone di denudazione lorda osservate con ingrandimento inferiore ( figura 5C , barra di scala = 50 μm). La morfologia della particella aderente è meglio osservata con ingrandimento superiore. Queste particelle sono coerenti con le piastrine e la fibrina ( figura 5D , barra di scala = 10 μm).
Oltre alla morfologia endoteliale, la funzione barriera dell'endotelio può essere valutata con questo modello di lesioni vascolari. L'azoto colorante Evans Blue non può permeare il normale e intatto endotelio dell'arte murino. Il danno alla funzione barriera dell'endotelio consente la colorazione della membrana basale con Evans Blue. I topi trattati con una laparotomia da solo (sham) hanno mantenuto la funzione barriera dell'endotelio e queste aortiche erano bianche. La ferita di crush ha portato aPerdita diffusa della funzione di barriera endoteliale e queste aortiche colorate in blu scuro. L'intensità della colorazione con Evans Blue è stata diminuita tre giorni dopo la ferita di schiacciamento e la funzione completa della barriera è stata ripristinata la settimana dopo la lesione ( Figura 6A ). La funzione di barriera endoteliale può essere ulteriormente quantificata pesando i campioni e omogeneizzando in 10 volte il volume di soluzione al 50% di acido tricloroacetico. Diluizione del surnatante in etanolo a 4 volte permette di determinare l'intensità di fluorescenza (eccitazione 620 nm e emissione 680 nm) come descritto da Aoki et al . 11 . La quantità di Evans Blue eluita dall'arto infrarenale era più di tre volte superiore in aortiche subito dopo lesioni rispetto agli aortaggi soggetti a laparotomia (Lesioni - Giorno 0). L'aorta continua a macchiare con Evans Blue a un e tre giorni dopo il pregiudizio, ma meno intensamente che al momento della lesione, suggerendo un graduale recupero della funzione di barriera endoteliale. Una settimana a poppaL'infortunato ferito aveva una colorazione equivalente come aorta trattata con laparotomia da sola ( Figura 6B ).
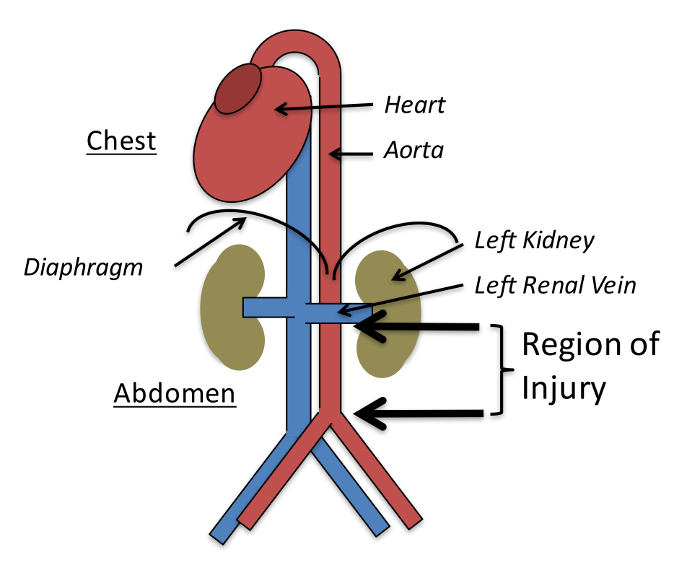
Figura 1: L'infortunio è creato da Bluntly Crushing l'aorta dalla vena renale sinistro alla biforcazione aortica. Figura adattata con l'autorizzazione di Yu et al ., PLoS One 2015 12 . Clicca qui per visualizzare una versione più grande di questa figura.
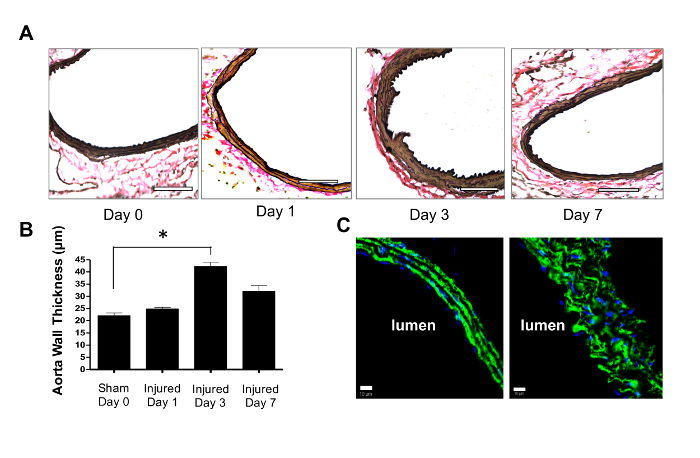
Figura 2: La ferita di schiacciamento induce spessore della parete aortica. ( A ) L'alterazione morfologica indotta dall'infezione da parte della crusca. Le sezioni trasversali rappresentative di 5 μm sono state macchiate con VVG a 0,1, 3 e 7 giorni dopo la lesione. Barre scala = 100 μm. ( B ) Lo spessore della parete era il più grande 3 giorni dopo la lesione, 42,2 ± 1,7 μm, ed era significativamente maggiore rispetto all'aorta di animali sbattuti esposti solo alla laparotomia, 22,1 ± 1,1 μm. La significatività statistica è stata determinata con il test t-test a due coda dello Studente. * Indica p <0,05, n = 3. ( C ) La lesione di crush ha indotto un'apparenza arrotondata di VSMC mediali (macchiati in verde per l'actina muscolare liscia α) e cambiando l'orientamento cellulare. I nuclei sono stati contratti con DAPI (blu). Barre di scala = 10 μm. I dati sono presentati come mezzi e deviazioni standard. Clicca qui per visualizzare una versione più grande di questa figura.
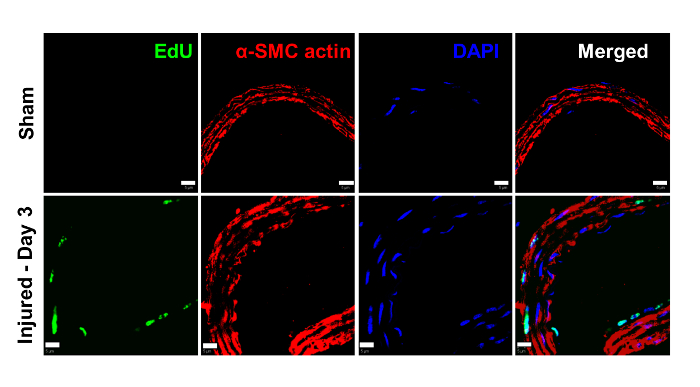
Figura 3: La ferita di crush induce Cell ProlifeNella parete aortica. I topi sono stati esposti a solo laparotomia da solo (sham) o laparotomia con lesioni aortiche di schiacciamento. L'analogica di timidina 5-etinil-2'-deossiuridina (EdU) è stata somministrata 24 ore prima dell'eutanasia. EdU è incorporato nel DNA durante la sintesi. EdU viene rilevato da una reazione a clic (catalizzatore di rame-azide-alchino a ciclo-carico con colorante verde-fluorescente). Non c'era alcun EdU rilevabile (verde) nella parete aortica degli animali da trucco. Negli animali sottoposti a lesioni di schiacciamento, l'EdU si è macchiata notevolmente nei mezzi dell'arte e, in misura minore, nell'intima. Le cellule muscolari lisce vascolari sono state identificate mediante colorazione con anticorpo actina muscolare liscio α (rosso). Questo risultato suggerisce che l'osservazione osservata della parete osservata in Figura 2 è dovuta ad un aumento della proliferazione cellulare. Barre di scala = 10 μm. Clicca qui per visualizzare una versione più grande di questa figurae.
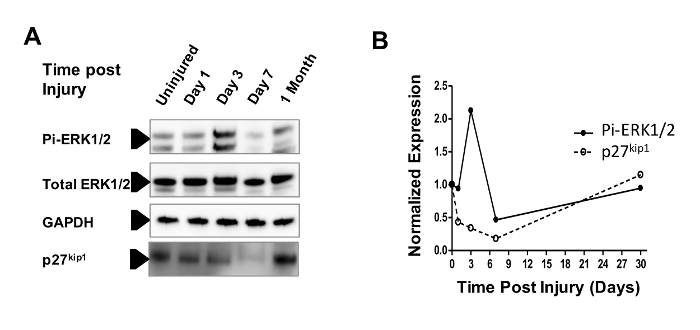
Figura 4: Il percorso attivato con Mitogen attivato dalla proteina-kinasi (MAP-Kinasi) viene attivato in risposta alla lesione da crush. ( A ) La MAP Kinase ERK1 / 2 è fosforilata quando attivata ed è associata con iperplasia intestinale e restenosi. I topi sono stati eutanizzati a 1, 3, 7 giorni e 1 mese dopo la lesione aortica. L'analisi di blot western è stata utilizzata per valutare l'espressione proteica del totale ERK1 / 2, fosfo-ERK1 / 2 e l'inibitore della chinina dipendente dalla ciclina p27 kip1 . L'espressione della proteina è stata normalizzata ad un animale di sham trattato con laparotomia da sola. ( B ) Non è stata osservata alcuna modifica nella totale espressione di proteine ERK1 / 2 nel tempo. Tuttavia, tre giorni dopo la lesione, l'espressione fosforo-ERK1 / 2 (Pi-ERK1 / 2) era superiore al 200% rispetto alla linea di base Pi-ERK1 / 2. L' espressione p27 kip1 è diminuita nei primi tempiD ha raggiunto un nadir di circa il 20% del basale sette giorni dopo il pregiudizio. L' espressione di Pi-ERK1 / 2 e p27 kip1 ha approssimato i livelli di base di un mese dopo la lesione. Clicca qui per visualizzare una versione più grande di questa figura.
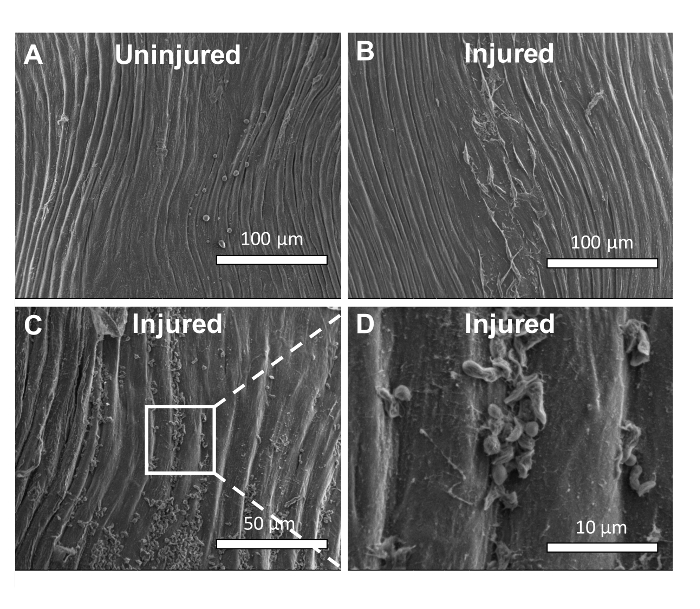
Figura 5. La ferita di crush distrugge le cellule endoteliali aortiche. ( A ) La microscopia elettronica di scansione (SEM) è stata utilizzata per caratterizzare l'effetto della ferita di schiacciamento sulla morfologia dell'endotelio. La superficie lumina dell'arte normale è fiancheggiata da un confluente endotelio che impedisce l'adesione di cellule e molecole nate dal sangue. ( B ) La lesione della crusca provoca la rottura delle cellule endoteliali e la denudazione parziale dell'endotelio. ( C ) Come si vede a magnifica più altaLa disfunzione dell'endotelio provoca l'adesione di particelle consistenti nella dimensione e nella forma con le piastrine. L'adesione di queste particelle si verifica per tutta la zona di lesioni e non è limitata a zone di denudazione lorda osservate con ingrandimento inferiore. ( D ) A maggiore ingrandimento, queste particelle sono coerenti con le piastrine e la fibrina. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: La lesione aortica sfalsata consente di quantificare la funzione di barriera endoteliale. ( A ) Il danneggiamento della funzione barriera dell'endotelio consente la colorazione della membrana basale con la tintura Evans Blue. I topi trattati con una laparotomia da solo (sham) hanno mantenuto la funzione barriera dell'endotelio e della thLe aorta erano bianche. La lesione della crusca ha causato una perdita diffusa della funzione di barriera endoteliale e queste aortiche sono macchiate di blu scuro. L'intensità della colorazione con Evans Blue è stata ridotta tre giorni dopo la ferita di schiacciamento e la funzione completa della barriera è stata ripristinata la settimana dopo il danno. ( B ) La legatura di Evans Blue all'aorta infrarenale è stata quantitata eluendo Evans Blue dal campione e quantificando per intensità di fluorescenza. I dati sono presentati come mezzi e deviazioni standard. Il più Evans Blue è stato eluso dall'aorta immediatamente dopo il danno di schiacciamento. Al momento dell'infortunio, l'aorta ha legato più volte tre volte più Evans Blue rispetto all'aorta soggetto a laparotomia da sola. Poiché l'aorta è stato permesso di recuperare, è stato meno vincolante a un e tre giorni dopo il pregiudizio. Una settimana dopo l'infortunio, l'aorta ha legato la stessa quantità di Evans Blue come le aortas soggette alla laparotomia da sola. La significatività statistica è stata determinata con il test t-test a due coda dello Studente. * DeNote p <0,05, n = 3, NS indica non significativo. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Abbiamo caratterizzato gli effetti di un modello di lesioni aortiche murine che provoca l'iperplasia mediale e la disfunzione della barriera endoteliale. Il distacco parziale CE lungo l'aorta intima ha accompagnato la perdita di contatto cellulare e miglioramento delle protuberanze delle cellule. Corrispondentemente, la funzione di barriera endoteliale è stata significativamente compromessa, che ha stimolato i percorsi di segnalazione sensibili al mitogeno, portando alla proliferazione di VSMC e ad ispessimento della parete del vaso. I punti di forza di questo modello sono che è tecnicamente più facile da imparare e eseguire rispetto ad altri modelli aortici di malattia e consente la valutazione simultanea della risposta proliferativa alla lesione e alla funzione endoteliale. Il passo critico in questo protocollo è l'infortunio effettivo di schiacciamento. La variabilità nella portata della ferita di schiacciamento potrebbe provocare vari gradi di lesioni e quindi variabile quantità proliferazione delle cellule muscolari lisce. Un passo che riduce questa variabilità nel nostro laboratorio è quello di avere uno sCientista, cieco al trattamento o condizione sperimentale, eseguire tutte le lesioni di schiacciamento.
Una limitazione di questo modello è la sua generalizzabilità a processi clinicamente rilevanti di malattie umane. Nonostante la prima robusta risposta proliferativa dei VSMC in questo modello, non modella gli eventi ritardati della restenosi, cioè non è stato sviluppato un neointima. Diminuiti mediatori infiammatori, come le citochine, potrebbero regolare questo processo. Questo risultato potrebbe essere dovuto al rapido recupero dell'endotelio da un lesione parziale. Simile a un modello di lesioni vascolari precedentemente riportato nei conigli 13 , l'infiltrazione delle cellule immunitarie era minore. Nella presente indagine abbiamo valutato il profilo delle citochine infiammatorie degli animali di sham e degli animali di lesioni aortiche con l'array di profiler. Tuttavia, non c'era alcuna differenza significativa nel profilo della citocina che spiegherebbe la differenza nella risposta proliferativa tra sham e animali feriti (datinon mostrato). La lesione descritta nella presente relazione è temporaneamente limitata. Mentre altri modelli di lesioni aortiche e iperplasia intima come il modello di angioplastica aortica completamente denudano l'endotelio, il modello presente solo parzialmente denudera l'aorta. La denudazione completa dell'endotelio richiede molto più tempo a recuperare e questi animali sperimentano gli effetti di lesioni per un lungo periodo di tempo.
Questo modello produce una risposta rapida di VSMC e EC a lesioni che consentono di quantificare i cambiamenti morfologici e biochimici in una settimana. È più efficiente di altri modelli che richiedono 14-28 giorni prima che l'effetto dell'intervento sia evidente. Questo modello utilizza l'aorta murina che è l'unico vascello murino che si avvicina a una nave umana clinicamente rilevante. Il significativo vantaggio di questa tecnica rispetto ad altri modelli aortici è che questo modello è relativamente facile da imparare e non richiede costoso o difficile ottenere eqUipment 2 , 3 , 4 , 5 . In conclusione, il modello di lesioni murali aortiche murine fornisce una piattaforma in vivo tecnicamente semplice, poco costosa ed efficiente per valutare contemporaneamente la risposta di VSMC e EC a lesioni vascolari.
Divulgazioni
Questo lavoro è stato finanziato dal Dipartimento per gli Affari dei Veterani per lo sviluppo della carriera (1IK2BX001553-01) (TSM) e la cure vascolari EJ Wylie Scholarship (TSM).
Riconoscimenti
Ringraziamo Ph.D. Hsia Ru-ching, presso l'Electron Microscopy Core Facility della University of Maryland School of Medicine per il suo supporto tecnico nel trattamento dei campioni di scansione microscopica elettronica.
Materiali
| Name | Company | Catalog Number | Comments |
| Ocular lubricant | Dechra | 17033-211-38 | Pharmaceutical agents |
| Isoflurane | VetOne | 502017 | Pharmaceutical agents |
| Carprofen | Zoetis | 26357 | Pharmaceutical agents |
| Precision vaporizer | Summit Medical | 10675 | Surgical supplies |
| Charcoal scavenger | Bickford Inc. | 80120 | Surgical supplies |
| Isothermal pad | Harvard Apparatus | 50-7053-R | Surgical supplies |
| Sterile cotton-tipped applicator | Fisher Scientific | 23-400-124 | Surgical supplies |
| 4-0 absorbable monofilament suture | Ethicon, Inc | J310 | Surgical supplies |
| 5-0 non-absorbable monofilament suture | Ethicon,Inc | 1666 | Surgical supplies |
| 21-gauge x 1 inch needle | BD Biosciences | 305165 | Surgical supplies |
| 25-gauge x 1 inch needle | BD Biosciences | 305125 | Surgical supplies |
| Dry sterilizer | Cellpoint | 7770 | Surgical supplies |
| Fine scissors | Fine Science Tools | 14058-09 | Surgical instruments |
| Adson forceps | Fine Science Tools | 11006-12 | Surgical instruments |
| Dumont #5 fine forceps | Fine Science Tools | 11254-20 | Surgical instruments |
| Vannas Spring Scissors 3 mm cutting edge | Fine Science Tools | 15000-00 | Surgical instruments |
| Needle driver | Fine Science Tools | 91201-13 | Surgical instruments |
| Scalpel handle #4 | Fine Science Tools | 10004-13 | Surgical instruments |
| Scalpel blades #10 | Fine Science Tools | 10010-00 | Surgical instruments |
| PBS | Lonza | 17-516F | Reagents for tissue processing |
| Evans Blue | Sigma-Aldrich | E2129 | Reagents for tissue processing |
| Paraformaldehyde | Sigma-Aldrich | P6148 | Reagents for tissue processing |
| Modeling wax | Bego | 40001 | Reagents for tissue processing |
| OCT compound | Tissue-Tek Sakura | 4583 | Reagents for tissue processing |
| Mayer's hematoxylin solution | Sigma-Aldrich | MHS16 | Reagents for immunohistological analysis |
| Eosin Y solution alcoholic | Sigma-Aldrich | HT110316 | Reagents for immunohistological analysis |
| Elastin stain kit | Sigma-Aldrich | HT25A | Reagents for immunohistological analysis |
| Click-it Edu Alexa-488 Imaging Kit | Invitrogen | C10337 | Reagents for immunohistological analysis |
| Anti-Erk1/2 antibody | Cell Signaling Technology | 4695 | Reagents for immunohistological analysis |
| Anti-phospho-Erk1/2 antibody | Cell Signaling Technology | 4370 | Reagents for immunohistological analysis |
| Anti-p27kip1 antibody | Cell Signaling Technology | 3698 | Reagents for immunohistological analysis |
| Trichloroacetic acid | Sigma-Aldrich | T9159 | Reagents for immunohistological analysis |
Riferimenti
- Carmeliet, P. Mechanisms of angiogenesis and arteriogenesis. Nat Med. 6 (4), 389-395 (2000).
- Carmeliet, P., Moons, L., Collen, D. Mouse models of angiogenesis, arterial stenosis, atherosclerosis and hemostasis. Cardiovasc Res. 39 (1), 8-33 (1998).
- Baker, A. B., et al. Heparanase Alters Arterial Structure, Mechanics, and Repair Following Endovascular Stenting in Mice. Circ Res. 104 (3), 380-387 (2009).
- Petrov, L., Laurila, H., Hayry, P., Vamvakopoulos, J. E. A mouse model of aortic angioplasty for genomic studies of neointimal hyperplasia. J Vasc Res. 42 (4), 292-300 (2005).
- Li, J., et al. Vascular smooth muscle cells of recipient origin mediate intimal expansion after aortic allotransplantation in mice. Am J Path. 158 (6), 1943-1947 (2001).
- Radu, M., Chernoff, J. An in vivo assay to test blood vessel permeability. J Vis Exp. (73), e50062 (2013).
- Turbett, G. R., Sellner, L. N. The use of optimal cutting temperature compound can inhibit amplification by polymerase chain reaction. Diagn Mol Pathol. 6 (5), 298-303 (1997).
- Puchtler, H., Waldrop, F. S. On the mechanism of Verhoeff's elastica stain: a convenient stain for myelin sheaths. Histochem. 62 (3), 233-247 (1979).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proc Natl Acad Sci U S A. 105 (7), 2415-2420 (2008).
- Nelson, P. R., Yamamura, S., Mureebe, L., Itoh, H., Kent, K. C. Smooth muscle cell migration and proliferation are mediated by distinct phases of activation of the intracellular messenger mitogen-activated protein kinase. J Vasc Surg. 27 (1), 117-125 (1998).
- Rzucidlo, E. M. Signaling pathways regulating vascular smooth muscle cell differentiation. Vascular. 17, S15-S20 (2009).
- Aoki, T., Sumii, T., Mori, T., Wang, X., Lo, E. H. Blood-brain barrier disruption and matrix metalloproteinase-9 expression during reperfusion injury: mechanical versus embolic focal ischemia in spontaneously hypertensive rats. Stroke. 33 (11), 2711-2717 (2002).
- Yu, D., et al. MARCKS Signaling Differentially Regulates Vascular Smooth Muscle and Endothelial Cell Proliferation through a KIS-, p27kip1- Dependent Mechanism. PLoS One. 10 (11), e0141397 (2015).
- Banai, S., et al. Rabbit ear model of injury-induced arterial smooth-muscle cell-proliferation - kinetics, reproducibility, and implications. Circ Res. 69 (3), 748-756 (1991).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon