Method Article
Il sistema olfattivo come modello per studiare gli schemi di crescita assonale e Morfologia
In questo articolo
Riepilogo
We describe a protocol for in vivo labeling of olfactory sensory neurons by electroporation and subsequent confocal laser-scanning or multiphoton microscopy to visualize neuronal morphology and its development over time.
Abstract
The olfactory system has the unusual capacity to generate new neurons throughout the lifetime of an organism. Olfactory stem cells in the basal portion of the olfactory epithelium continuously give rise to new sensory neurons that extend their axons into the olfactory bulb, where they face the challenge to integrate into existing circuitry. Because of this particular feature, the olfactory system represents a unique opportunity to monitor axonal wiring and guidance, and to investigate synapse formation. Here we describe a procedure for in vivo labeling of sensory neurons and subsequent visualization of axons in the olfactory system of larvae of the amphibian Xenopus laevis. To stain sensory neurons in the olfactory organ we adopt the electroporation technique. In vivo electroporation is an established technique for delivering fluorophore-coupled dextrans or other macromolecules into living cells. Stained sensory neurons and their axonal processes can then be monitored in the living animal either using confocal laser-scanning or multiphoton microscopy. By reducing the number of labeled cells to few or single cells per animal, single axons can be tracked into the olfactory bulb and their morphological changes can be monitored over weeks by conducting series of in vivo time lapse imaging experiments. While the described protocol exemplifies the labeling and monitoring of olfactory sensory neurons, it can also be adopted to other cell types within the olfactory and other systems.
Introduzione
The lifelong turnover of sensory neurons distinguishes the olfactory system from many other sensory and neuronal systems1,2. Newly formed sensory neurons are continuously generated in the basal portion of the olfactory epithelium3 and extend their axons into the olfactory bulb, the first relay station of the olfactory system4. However, the cellular and molecular mechanisms controlling the formation and maintenance of the olfactory map are far from being fully understood4,5.
Here, we describe a protocol for labeling sensory neurons of the olfactory organ of larval X. laevis by in vivo electroporation of fluorophore-coupled dextrans. The presented protocol allows visualization of axonal morphology and connectivity, track axonal development over time and study mechanisms regulating axonal wiring and guidance.
Electroporation is a well established method to introduce charged macromolecules, like dextran-coupled dyes and DNA, into cells6,7. The cell membrane is permeabilized by application of short voltage pulses and the molecules are electrophoretically delivered into the cytosol8. Spatially restricted electroporation using a micropipette permits selective labeling of cells including neurons and has been applied in various neuronal systems including the visual system of X. laevis9,10.
We show how the electroporated animals can be used to study axonal growth patterns and morphology in living animals using confocal laser-scanning or multiphoton microscopy. The described procedure allows identifying the coarse topology of axonal projections of sensory neurons of the main and accessory olfactory system11,12. Using in vivo time lapse imaging, it is also suitable to supervise the glomerular connections of single mature sensory neurons, and to monitor the evolution of the axonal projection patterns of immature sensory neurons12. The described protocol can be applied to investigate the structure and formation of olfactory circuits in the intact animal and can be adapted to other cell types within the olfactory and other neuronal systems.
Protocollo
NOTA: la movimentazione degli animali e gli esperimenti sono stati eseguiti, come approvato dal comitato dell'Università di Göttingen per l'Etica nella sperimentazione animale.
1. Preparazione degli strumenti e Pipettare Fabrication
- Assicurarsi che l'impostazione elettroporazione è costituito da uno stereomicroscopio con grande distanza di lavoro ed è dotato di illuminazione e di filtro fluorescenti set per il colorante utilizzato.
- Per elettroporazione utilizzare un elettroporatore singola cellula dedicato o un generatore di impulsi piazza generico collegato a un oscilloscopio. Collegare le uscite elettroporatore al titolare pipetta e un elettrodo bagno. Collegare il terminale positivo del generatore di impulsi al titolare micropipetta e il terminale negativo all'elettrodo vasca. Assicurarsi che sia il titolare pipetta e l'elettrodo vasca contengono fili d'argento rivestite con un sottile strato di cloruro di argento.
- Montare il supporto pipetta su un micromanipolatore per consentire il posizionamento esatto.
- Realizzare micropipette elettroporazione da capillari di vetro borosilicato con filamento interno.
- Utilizzare un estrattore micropipetta orizzontale e applicare un protocollo modificato per la fabbricazione di pipette per esperimenti di patch clamp come descritto da Bestman et al. 13.
- Adattare i parametri per la produzione di un gambo più lungo e un'apertura punta più piccola con un conseguente resistenza pipetta più elevato di circa il 15-20 MOhm per l'elettroporazione di singola cellula. La resistenza pipetta dovrebbe essere inferiore, per esempio, 3-4 MOhm, per l'etichettatura dei gruppi di cellule.
- Misurare la resistenza pipetta direttamente con elettroporatore unicellulare dedicato o calcolare con la legge di Ohm dopo la misurazione del flusso di corrente con un oscilloscopio dopo l'applicazione di un impulso di tensione definito.
2. Preparazione di elettroporazione Solution
- Sciogliere destrano fluoroforo-accoppiato a rana suoneria (98 mM NaCl, KCl 2 mM, 1 mM CaCl 2, 2 mgc mMl 2, glucosio 5 mM, 5 mM Na-piruvato, HEPES 10 mM, portato a pH 7,8, osmolarità era 230 mOsmol / l) ad una concentrazione di 3 mM. Le cellule non possono essere così intensamente etichettati se si ricorre alle concentrazioni più basse di tintura. Preparare un grande volume soluzione madre e dividerlo in piccole aliquote. Congelarli per lo stoccaggio (stabile per mesi).
NOTA: Destrani sono disponibili in diverse dimensioni e una serie di emissioni / spettri di eccitazione (ad esempio, Alexa 488-destrano 10kD, Alexa 546-destrano 10kD, Alexa 568-destrano 10kD, Alexa 594-destrano 10kD, TMR-destrano 3KD.). - Backfill la micropipetta con un puntale di forma allungata con un piccolo volume di soluzione di destrano (1-5 ml). Sfogliare con attenzione la micropipetta con il dito per rimuovere le bolle d'aria residue dalla punta della pipetta.
- Montare la micropipetta nel supporto pipetta. Assicurarsi che il filo d'argento all'interno della pipetta è in contatto con la soluzione colorante.
3. Selezione dei larvale X. laevis </ Em>
- Utilizzare larve albino di X. laevis per gli esperimenti. Animali wild type in possesso melanofori pigmento pieno che mostrano le emissioni autofluorescenza durante confocale / immagini multiphoton e non sono quindi adatti per gli esperimenti descritti.
- Fase girini premetamorphotic dopo Nieuwkoop e Faber 14. Selezionare girini di fasi 45-53 per gli esperimenti.
4. Elettroporazione di Destrani Fluoroforo accoppiati
- Mettere un piccolo pezzo di tessuto in una capsula di Petri e coprire con un piccolo volume di acqua contenente 0,02% tricaine (Etil methanesulfonate 3-amminobenzoato, portata a pH 7).
- Anestetizzare i girini in acqua contenente 0,02% tricaine. Dopo qualche minuto gli animali cessano movimento. Confermare l'anestesia adeguata toccando girini. Dovrebbero essere non risponde.
- Trasferire con cautela il girino dall'anestesia al tessuto ricoperto capsula di Petri.
- Assicurarsi che il elettr bagnoode chiude il circuito elettroporazione. Assicurarsi che l'elettrodo è in contatto con il tessuto bagnato; un contatto diretto con il girino non è necessario.
- Posizionare la punta della micropipetta vicino al organo olfattivo con il micromanipolatore.
- Penetrare la pelle che copre l'organo olfattivo con la punta della pipetta e con cautela far avanzare la punta nello strato di neuroni sensoriali in posizione centrale del principale epitelio olfattivo o vomeronasale epitelio.
- Innescare impulsi di tensione piazza positivi per trasferire tintura in neuroni sensoriali. Applicare un singolo impulso di tensione (ad es., 25 V, lunghezza dell'impulso 25 msec) o di un treno di impulsi multipli (ad es., 50 V, lunghezza dell'impulso di 300 msec, 400 msec durata treno a 200 Hz).
NOTA: Determinare i parametri ottimali per l'impulso di tensione desiderato estendere di etichettatura. Ridurre impulso di ampiezza di tensione, la durata e il numero di ripetizioni per ridurre il numero di cellule marcate. Applicare maggiore ampiezza dell'impulso di tensione, la durata e il numero di pulses per una etichettatura più diffusa. - Visualizza successo di estrusione tintura ed elettroporazione da impulsi innescati con illuminazione fluorescente dello stereomicroscopio. Il colorante si diffonde rapidamente nel corpo cellulare e dei dendriti dopo l'elettroporazione di successo.
- Ripetere i passaggi 4,5-4,9 per il secondo organo olfattivo del girino.
- Trasferire il girino in un bicchiere pieno d'acqua fresca per il recupero. Dopo ca. 5 min i girini svegliarsi dall'anestesia e iniziare i normali movimenti di nuoto.
- Dopo 24 ore il colorante elettroporate si diffonde nei neuroni sensoriali e, infine, raggiunge il bulbo olfattivo attraverso il trasporto assonale.
5. Gli animali di montaggio per In Vivo visualizzazione di celle e processi assonale
- Anestetizzare i girini in acqua contenente 0,02% tricaine.
- Trasferire accuratamente girini in una camera di imaging, ad esempio, un piccolo gomma siliconica rivestita capsula di Petri con un incavo girino dimensioni.
- Tagliare un piccolo rettangolo in una striscia di Parafilm. Coprire il girino con il Parafilm, lasciando il telencefalo anteriore a vista attraverso la finestra cut-out. Fissare il Parafilm con aghi sul piatto senza ferire il girino.
- Assicurarsi che il girino è immerso in acqua sufficiente contenente 0,02% tricaine.
- Montare la camera di imaging sul palco di un microscopio multiphoton in posizione verticale o microscopio confocale.
- Acquisire una pila tridimensionale di immagini del bulbo olfattivo. Assicurarsi che la procedura di imaging è il più breve possibile e non supera i 10-15 minuti.
- Ritorno il girino in acqua normale in un serbatoio separato ed evitare l'esposizione alla luce. Dopo 5 minuti, il girino si sveglia dall'anestesia.
- Ripetere i passaggi 5,1-5,7 dopo intervalli di tempo specificati, ad es., Tutti i giorni.
6. Gli animali di montaggio per Ex Vivo visualizzazione di celle e processi assonale
- In alternativa alla sezione 5del protocollo, usare un preparato cervello asportato per la visualizzazione dei neuroni sensoriali etichettati.
- Anestetizzare e uccidere il girino dalla resezione del cervello nella zona di transizione al midollo spinale. Accise un blocco di tessuto contenente gli organi olfattivi, i nervi olfattivi e telencefalo anteriore.
- Trasferire il blocco dei tessuti di soluzione di Ringer rana e rimuovere il tessuto connettivo con le forbici sottili per esporre il lato ventrale del cervello.
- Trasferire il blocco dei tessuti ad una camera di imaging e fissarlo con una cornice in platino corde con fili di nylon.
- Montare la camera di imaging sul palco di un microscopio confocale / multiphoton.
- Acquisire una pila tridimensionale di immagini del bulbo olfattivo.
7. Image Processing e Valutazione dei dati
- Ottimizzare e mezzi non-locali di filtraggio per migliorare la qualità dell'immagine e la visualizzazione di strutture neuronali come descritto da Coupé, P. et al. 15.
NOTA: I dati di esperimenti di imaging in strati più profondi del tessuto di esemplari vivi sono spesso rumorosi. - Creazione di proiezioni di massima intensità delle pile di immagine per una visione d'insieme.
- Per time-lapse esperimenti di imaging schermo set di dati per singoli assoni inequivocabilmente identificabili di neuroni sensoriali.
- Ricostruire morfologia cellulare via software assistita tracciabilità dei processi neuronali come descritto da Peng et al. 16.
Risultati
Il protocollo descritto può essere applicato con successo per elettroporazione in vivo di visualizzazione processi assonale di neuroni sensoriali del sistema olfattivo di X. anestetizzato laevis, utilizzando confocale a scansione laser o la microscopia multifotonica (Figura 1).
Elettroporazione consente destrani fluoroforo-accoppiato per entrare e per diffondere rapidamente all'interno delle cellule dell'organo olfattivo. E 'utile applicare l'illuminazione a fluorescenza per verificare l'etichettatura successo dopo l'attivazione di impulsi di tensione. In funzione dei parametri di elettroporazione, per es., La resistenza pipetta, gruppi di cellule (Figura 2A, B) o singole cellule (Figura 2C) dell'organo olfattivo sono etichettati. Gli assoni dei neuroni sensoriali etichettati possono essere visualizzati nel nervo olfattivo (Figura 2D) e processi assonali si possono osservare anche nel bulbo olfattivo, di solito 24 ore dopo l'elettroporazione di successo(Figura 3). Elettroporazione di gruppi di neuroni sensoriali permette la visualizzazione dei modelli di cablaggio grossolane nel bulbo olfattivo (Figura 3A). Elettroporazione singola cellula può essere applicato a esaminare singoli modelli di proiezione assonale, biforcazioni assonale e la connettività alle strutture glomerulari nel bulbo olfattivo (Figura 3C-E).
Trasparenti girini albini di X. permesso laevis in confocale in vivo o multifotonica immagini dei neuroni sensoriali marcati nel cervello intatto di girino anestetizzato. Lo sviluppo di modelli di crescita assonale può essere seguito per diversi giorni / settimane ripetuta nella visualizzazione in vivo dello stesso neurone sensoriale marcato (Figura 4). A seconda della scadenza del neurone sensoriale al punto temporale di elettroporazione pattern assone nel bulbo olfattivo può variare considerevolmente. Neuroni maturi già in possesso di elaborati rami assonali che dispongono di ciuffoaree ED collegati a glomeruli. Il modello di crescita assonale dei neuroni maturi è piuttosto stabile, ma l'allungamento dei rami degli assoni e dei parametri di ciuffi glomerulari sono osservabili (Figura 4A-E). Neuroni sensoriali si possono osservare in vivo per periodi di tempo prolungati, ad es., Più di tre settimane (Figura 4F-I). D'altra parte, assoni dei neuroni immaturi sono ancora in fase di crescita iniziale, non possiedono arborizzazioni tufted e non hanno ancora collegato alla loro obiettivi finali glomerulari. Il protocollo sperimentale permette di tracciare lo sviluppo di questi neuroni durante la maturazione, ad es., L'allungamento degli assoni, biforcazioni e la creazione di arborizzazioni tufted (Figura 4J-L). Per ulteriori esempi vedere anche Hassenklöver e Manzini 12.

Figura 1. Schema del protocollo sperimentale. (A) i neuroni sensoriali nelle principali epitelio olfattivo (MOE) o organo vomeronasale (VNO) dell'organo olfattivo del X. anestetizzato laevis larve sono etichettati mediante elettroporazione con una pipetta di vetro riempito con una soluzione di destrano fluorescente. Gli assoni dei neuroni marcati possono essere seguite attraverso il nervo olfattivo (ON) e, infine, raggiungono il bulbo olfattivo (OB). (B) Il girino è anestetizzato e le neuroni marcati sono ripetutamente studiati utilizzando un microscopio confocale o multiphoton in intervalli di tempo specifici. (C) Lo sviluppo incrementale di modelli di crescita assonale delle cellule marcate può essere seguita su intervalli di tempo di giorni o settimane.

Figura 2. Electroporation dei neuroni sensoriali in organo olfattivo. (A) elettroporazione con pipette a bassa resistenza porta alla etichettatura dei più celle in organo olfattivo. In questo esempio rappresentativo sono state colorate più neuroni recettori olfattivi (ORNS, punte di freccia pieni) e due cellule a forma colonnare di supporto (SC, asterischi). Le linee tratteggiate delimitano i confini epitelio olfattivo (OE). (B) affinamento dei parametri di elettroporazione, per es., Aumentando la resistenza pipetta, limita il numero di cellule marcate. In questo esempio, un singolo neurone sensoriale (frecce piene) e quello adiacente supporto cella (asterisco) erano macchiati dopo l'elettroporazione. Si noti il singolo assone lasciando l'epitelio olfattivo (punte di freccia aperte). (C) elettroporazione successo singola cellula porta alla etichettatura esclusiva di un singolo neurone sensoriale (freccia piena) e il suo assone collegato (punte di freccia aperte) nell'epitelio olfattivo. (D) Il singolo assone etichetta (punte di freccia aperte) può essere seguito attraverso il nervo olfattivo (ON) nel bulbo olfattivo.
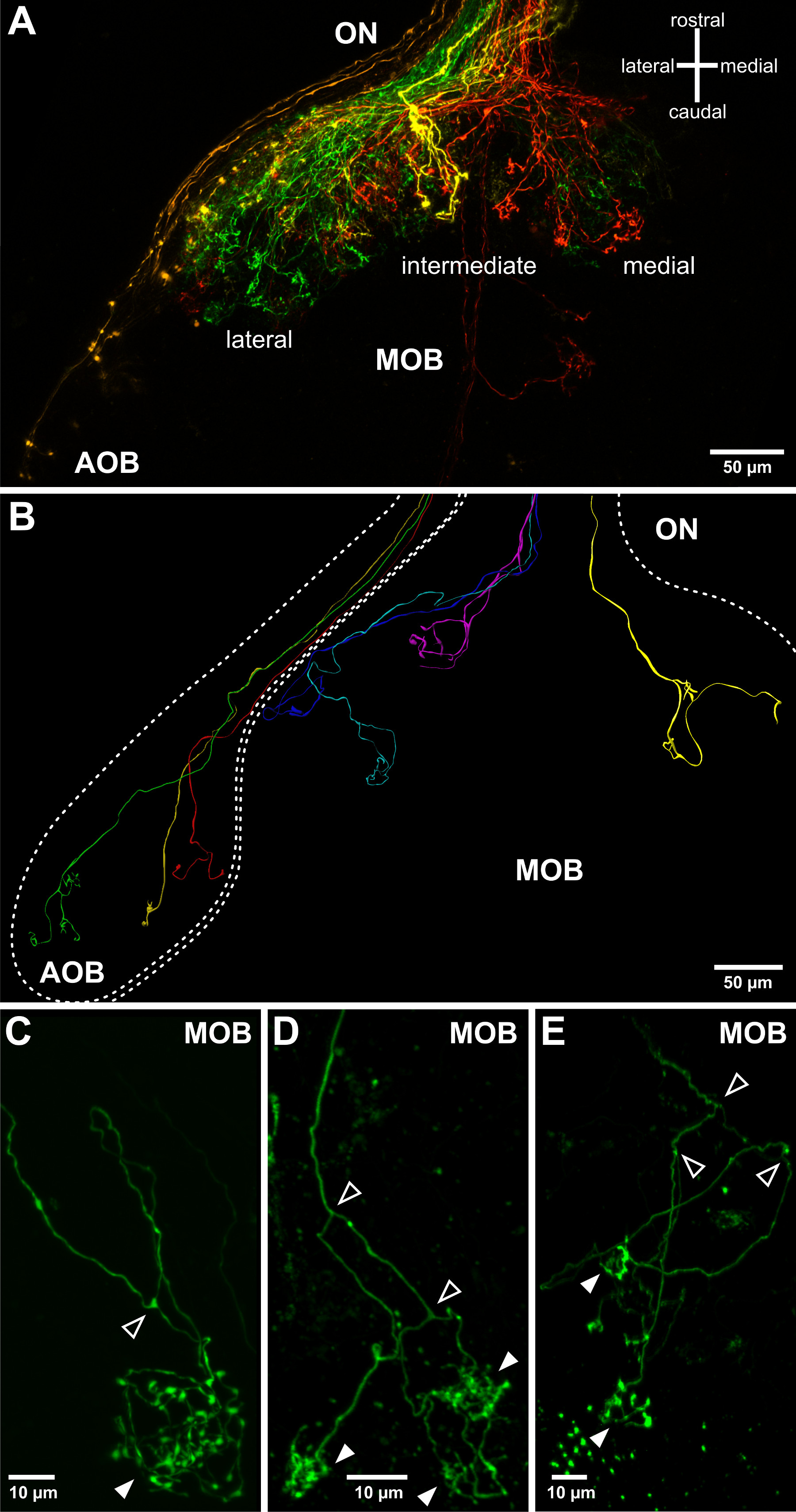
Figura 3. Visualizzazione proiezioni assoni olfattivi del bulbo olfattivo asportato. (A) La topologia grossolana delle proiezioni assonali dei neuroni sensoriali nel bulbo olfattivo può essere visualizzato utilizzando inferiori pipette elettroporazione di resistenza. Un emisfero bulbo olfattivo e il suo nervo olfattivo associato (ON) sono raffigurati. Quattro destrani accoppiati a diversi fluorofori sono stati elettroporate in quattro punti distanti del organo olfattivo: laterale (verde), intermedio (giallo), mediale MOE (rosso) e VNO (arancione). Questo permette di visualizzare il bulbo olfattivo accessorio (AOB) e tre campi di proiezione principali del bulbo olfattivo principale (MOB). (B) Differenti modelli di crescita assonale di singoli neuroni sensoriali olfattivi sovrapposti sulla struttura del bulbo olfattivo. Raffigurato sono combinati tre ricostruzioni tridimensionali di molteplici colorazioni cella singola derivate da diversi esemplari larvali. (CE) Esempi di assoni olfattivi singoli sporgenti nel bulbo olfattivo e formando tufted arborizzazioni / sinapsi in glomeruli sferici (punte di freccia piene). Si noti che in X. laevis assoni olfattivi biforcano regolarmente (punte di freccia aperta) prima di connettersi a uno, due o più glomeruli (punte di freccia pieni, vedi anche Hassenklöver e Manzini 12).
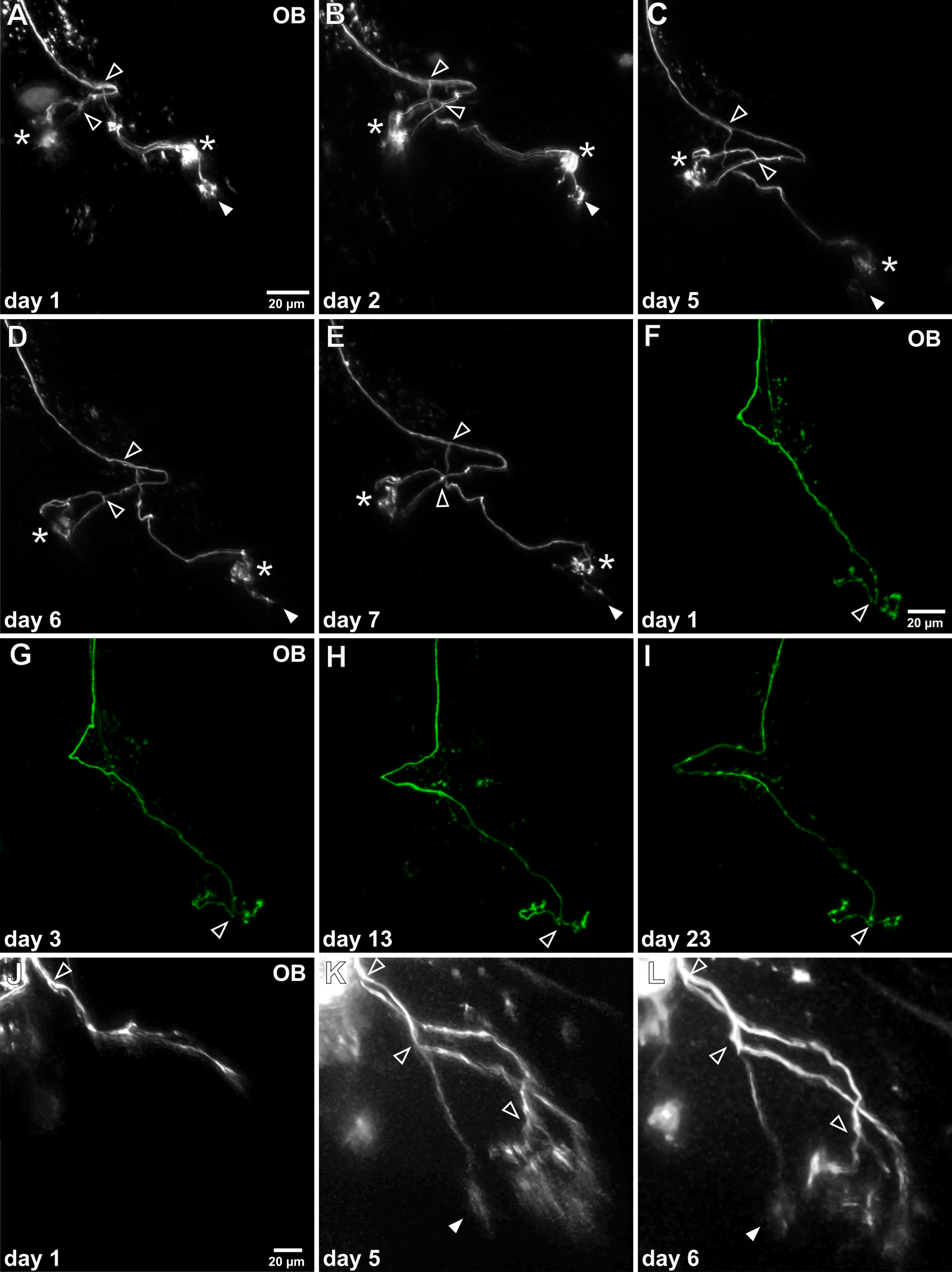
Figura 4. In vivo time-lapse imaging di singoli assoni dei neuroni olfattivi. (AE)Dopo il successo elettroporazione singola cella l'assone marcata può essere ripetutamente visualizzato nel bulbo olfattivo (OB). Questo esempio mostra un assone individuo che è stato indagato per una settimana. La morfologia generale non cambia notevolmente e due grandi punti di ramificazione può essere identificato (punte di freccia aperte). Si noti che nel corso del tempo, un ciuffo glomerulare subisce una riduzione di continuo (freccia piena), mentre gli altri due ciuffi glomerulare rimangono stabili (asterischi). (FI) Questo esempio rappresentativo che mostra la vitalità di osservazioni a lungo termine come questo assone specifico è stato studiato per più di tre settimane. Nessun cambiamento apparente del suo modello di crescita può essere rilevata. (JL) Un esempio di un assone sensoriale immaturo nel processo di crescita è raffigurato. Non si è ancora connesso a glomeruli e caratteristici ciuffi glomerulari sono mancanti. Dopo 5 giorni i rami assonali sono allungati, l'assone biforcata più volte e arborizzazioni fini sonostabilita.
Discussione
La procedura sperimentale qui descritta permette di etichettatura neuroni sensoriali del organo olfattivo di X. larvale laevis mediante elettroporazione di destrani fluoroforo ad accoppiamento e la successiva visualizzazione di crescita assonale sensoriale nell'animale vivente. Variando i parametri della elettroporazione in vivo è possibile controllare il numero di neuroni sensoriali etichettati. E 'quindi possibile etichettare grandi gruppi di neuroni di un epitelio sensoriale, molto pochi o addirittura singole cellule.
Per garantire la desiderata estendere dell'etichettatura neuronale è importante essere particolarmente prudenti sulle caratteristiche micropipetta e gli impulsi di elettroporazione. Più elevate resistenze pipetta e la riduzione di impulso di tensione di ampiezza, durata e numero di ripetizioni in grado di ridurre la quantità di cellule marcate, considerando che una riduzione resistenze pipetta e una maggiore ampiezza di impulso di tensione, la durata e il numero di impulsi può portare l'etichettatura indicante il più diffuso. The l'uso di destrani fluorescenti per l'elettroporazione fornisce un feedback visivo immediato se le impostazioni applicate sono adeguate. Fare attenzione che l'utilizzo di parametri di ampiezza, durata e numero di impulsi che superano i valori previsti dal protocollo può potenzialmente portare a danni delle cellule o anche morte cellulare 17. Suggerimenti intasati o rotti di micropipette possono anche ostacolare l'elettroporazione di successo.
In elettroporazione in vivo nell'organo olfattivo di X. laevis è limitato a stadi larvali poiché la pelle di rane postmetamorphotic è più duro e non può essere facilmente penetrato con una micropipetta. La visualizzazione in vivo dei processi neuronali può essere ostacolata dalla dispersione della luce di eccitazione / emissione in aree cerebrali profonde o da vasi sanguigni. Questo problema diventa particolarmente evidente nelle fasi larvali più elevati a causa di un cervello più grande e può portare a segnali rumorosi rendendo la chiara identificazione dei processi assonali fini più difficile.
jove_content permessi protocollo presentato per visualizzare i neuroni sensoriali nel sistema olfattivo intatto, senza sezionare l'animale, danneggiare le cellule durante l'etichettatura, la preparazione di fette di tessuto o il fissaggio del tessuto necessario per i metodi alternativi, come l'etichettatura in zona whole-cell esperimenti -clamp 18. Quando si combinano l'etichettatura di alcuni o di singoli neuroni sensoriali con in vivo lasso di tempo di imaging, è possibile visualizzare le connessioni glomerulari di singoli neuroni sensoriali maturi su intervalli di tempo lunghi. In questo modo è possibile monitorare lo sviluppo dei modelli di proiezione assonale dei neuroni sensoriali immaturi per diverse settimane. Quest'ultima possibilità è particolarmente interessante in quanto consente il monitoraggio dei modelli di crescita di singoli assoni nell'animale vivente. Questo apre la possibilità di indagare i meccanismi cellulari e molecolari che controllano la guida degli assoni e pathfinding. Diversi fattori, tra cui l'espressione del recettore odorizzante, vari axon molecole di orientamento e di odorizzante indotta / attività spontanea dei neuroni sensoriali hanno dimostrato di regolare la constatazione bersaglio degli assoni dei neuroni sensoriali 4,5.L'applicazione del protocollo non è limitata ai neuroni sensoriali olfattivi, ma può essere applicato anche per studiare altri tipi di cellule, ad es., Cellule staminali / progenitrici delle zone neurogenici del cervello sviluppo o cellule mitrali del bulbo olfattivo. Inoltre la tecnica dimostrata può essere utilizzato anche in combinazione con destrani sensibili calcio o iniettata coloranti calcio membrana permeabile per ottenere informazioni funzionali sul neurone etichettati e / o la circuiteria collegata 7,19. La disponibilità di una vasta gamma di fluorofori accoppiati a destrani consente etichettatura dei molteplici singole cellule o di popolazioni con colori diversi. Inoltre plasmide soluzione di DNA, per esempio codifica per proteine fluorescenti, è adatto per elettroporazione e può migliorare ulteriormente l'versatiliTy e l'utilità della tecnica 6. Il protocollo può essere ulteriormente migliorato per consentire l'elettroporazione combinato di destrani e del DNA o Morpholinos a carico manipolare l'espressione genica 13,17.
Il metodo descritto rappresenta certamente un nuovo strumento per indagare il complesso e processi ancora pienamente compreso che regolano la guida assonale nel sistema olfattivo dei vertebrati.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was supported by DFG Schwerpunktprogramm 1392 (project MA 4113/2-2), cluster of Excellence and DFG Research Center Nanoscale Microscopy and Molecular Physiology of the Brain (project B1-9), and the German Ministry of Research and Education (BMBF; project 1364480).
Materiali
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| SZX16 | Olympus | stereomicroscope with fluorescent illumination | |
| Axon Axoporator 800A | Molecular Devices | single cell electroporator | |
| ELP-01D | npi electronic | electroporator | |
| MMJ | Märzhäuser Wetzlar | manual micromanipulator | |
| P-1000 | Sutter | Horizontal micropipette puller | |
| G150F-4 | Warner Instruments | glass capillaries for electroporation pipette fabrication; internal filament makes backfilling easier | |
| Alexa 488-dextran 10kD | Life Technologies | D22910 | |
| Alexa 546-dextran 10kD | Life Technologies | D22911 | |
| Alexa 568-dextran 10kD | Life Technologies | D22912 | |
| Alexa 594-dextran 10kD | Life Technologies | D22913 | |
| TMR-dextran 3kD (micro-Ruby) | Life Technologies | D7162 | |
| microloader pipette tips | eppendorf | 930001007 | |
| tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10521 | anesthetic; use gloves |
| A1-MP | Nikon | multiphoton microscope | |
| LSM 780 | Zeiss | confocal microscope | |
| Imaris | Bitplane | alternative software for neuronal tracing |
Riferimenti
- Huard, J. M., Youngentob, S. L., Goldstein, B. J., Luskin, M. B., Schwob, J. E. Adult olfactory epithelium contains multipotent progenitors that give rise to neurons and non-neural cells. J. Comp. Neurol. 400 (4), 486-4810 (1998).
- Schwob, J. E. Neural regeneration and the peripheral olfactory system. Anat. Rec. 269 (1), 33-49 (2002).
- Leung, C. T., Coulombe, P. A., Reed, R. R. Contribution of olfactory neural stem cells to tissue maintenance and regeneration. Nat. Neurosci. 10 (6), 72-726 (2007).
- Lodovichi, C., Belluscio, L. Odorant receptors in the formation of the olfactory bulb circuitry. Physiology (Bethesda. 27 (4), 212-2110 (2012).
- Mori, K., Sakano, H. How is the olfactory map formed and interpreted in the mammalian brain). Annu. Rev. Neurosci. 34, 467-499 (2011).
- De Vry, J., et al. In vivo electroporation of the central nervous system: a non-viral approach for targeted gene delivery. Prog. Neurobiol. 92 (3), 227-244 (2010).
- Hovis, K. R., Padmanabhan, K., Urban, N. N. A simple method of in vitro electroporation allows visualization, recording, and calcium imaging of local neuronal circuits. J. Neurosci. Methods. 191 (1), 1-10 (2010).
- Chen, C., Smye, S. W., Robinson, M. P., Evans, J. A. Membrane electroporation theories: a review. Med. Biol. Eng. Comput. 44 (1-2), 5-14 (2006).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70 (4-5), 148-154 (2002).
- Hewapathirane, D. S., Haas, K. Single cell electroporation in vivo within the intact developing brain. J. Vis. Exp. (17), (2008).
- Gliem, S., et al. Bimodal processing of olfactory information in an amphibian nose: odor responses segregate into a medial and a lateral stream. Cell. Mol. Life Sci. 70 (11), 1965-1984 (2013).
- Hassenklöver, T., Manzini, I. Olfactory wiring logic in amphibians challenges the basic assumptions of the unbranched axon concept. J. Neurosci. 33 (44), 17252-1710 (2013).
- Bestman, J. E., Ewald, R. C., Chiu, S. -. L., Cline, H. T. In vivo single-cell electroporation for transfer of DNA and macromolecules. Nat. Protoc. 1 (3), 1272-1210 (2006).
- Nieuwkoop, P. D., Faber, J., Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis. , (1994).
- Coupé, P., Munz, M., Manjón, J. V., Ruthazer, E. S., Collins, D. L. A CANDLE for a deeper in vivo insight. Med. Image Anal. 16 (4), 849-864 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nat. Biotechnol. 28 (4), 348-353 (2010).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7 (107), (2007).
- Nezlin, L. P., Schild, D. Individual olfactory sensory neurons project into more than one glomerulus in Xenopus laevis tadpole olfactory bulb. J. Comp. Neurol. 481 (3), 233-239 (2005).
- Nagayama, S., et al. In vivo simultaneous tracing and Ca2+ imaging of local neuronal circuits. Neuron. 53 (6), 789-803 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon