Method Article
מערכת חוש הריח כמודל לחקר דפוסי axonal צמיחה ומורפולוגיה
In This Article
Summary
We describe a protocol for in vivo labeling of olfactory sensory neurons by electroporation and subsequent confocal laser-scanning or multiphoton microscopy to visualize neuronal morphology and its development over time.
Abstract
The olfactory system has the unusual capacity to generate new neurons throughout the lifetime of an organism. Olfactory stem cells in the basal portion of the olfactory epithelium continuously give rise to new sensory neurons that extend their axons into the olfactory bulb, where they face the challenge to integrate into existing circuitry. Because of this particular feature, the olfactory system represents a unique opportunity to monitor axonal wiring and guidance, and to investigate synapse formation. Here we describe a procedure for in vivo labeling of sensory neurons and subsequent visualization of axons in the olfactory system of larvae of the amphibian Xenopus laevis. To stain sensory neurons in the olfactory organ we adopt the electroporation technique. In vivo electroporation is an established technique for delivering fluorophore-coupled dextrans or other macromolecules into living cells. Stained sensory neurons and their axonal processes can then be monitored in the living animal either using confocal laser-scanning or multiphoton microscopy. By reducing the number of labeled cells to few or single cells per animal, single axons can be tracked into the olfactory bulb and their morphological changes can be monitored over weeks by conducting series of in vivo time lapse imaging experiments. While the described protocol exemplifies the labeling and monitoring of olfactory sensory neurons, it can also be adopted to other cell types within the olfactory and other systems.
Introduction
The lifelong turnover of sensory neurons distinguishes the olfactory system from many other sensory and neuronal systems1,2. Newly formed sensory neurons are continuously generated in the basal portion of the olfactory epithelium3 and extend their axons into the olfactory bulb, the first relay station of the olfactory system4. However, the cellular and molecular mechanisms controlling the formation and maintenance of the olfactory map are far from being fully understood4,5.
Here, we describe a protocol for labeling sensory neurons of the olfactory organ of larval X. laevis by in vivo electroporation of fluorophore-coupled dextrans. The presented protocol allows visualization of axonal morphology and connectivity, track axonal development over time and study mechanisms regulating axonal wiring and guidance.
Electroporation is a well established method to introduce charged macromolecules, like dextran-coupled dyes and DNA, into cells6,7. The cell membrane is permeabilized by application of short voltage pulses and the molecules are electrophoretically delivered into the cytosol8. Spatially restricted electroporation using a micropipette permits selective labeling of cells including neurons and has been applied in various neuronal systems including the visual system of X. laevis9,10.
We show how the electroporated animals can be used to study axonal growth patterns and morphology in living animals using confocal laser-scanning or multiphoton microscopy. The described procedure allows identifying the coarse topology of axonal projections of sensory neurons of the main and accessory olfactory system11,12. Using in vivo time lapse imaging, it is also suitable to supervise the glomerular connections of single mature sensory neurons, and to monitor the evolution of the axonal projection patterns of immature sensory neurons12. The described protocol can be applied to investigate the structure and formation of olfactory circuits in the intact animal and can be adapted to other cell types within the olfactory and other neuronal systems.
Protocol
הערה: טיפול בבעלי חיים וניסויים בוצעו כפי שאושרו על ידי ועדת אוניברסיטת גטינגן לאתיקה בניסויים בבעלי חיים.
1. הכנת ייצור מכשירים ופיפטה
- ודא שהתקנת electroporation מורכבת מסטראו עם מרחק עבודה גדול ומצוידת במערכות תאורה ומסנן ניאון לצבע המשמש.
- לelectroporation להשתמש גם electroporator אחד ייעודי תא או מחולל פעימות כיכר הגנרית המצורף לאוסצילוסקופ. חבר את יציאות electroporator לבעל טפטפת ואלקטרודה אמבטיה. חבר את הקוטב החיובי של מחולל הפעימות לבעל micropipette והקוטב השלילי על האלקטרודה האמבטיה. להבטיח הן את בעל טפטפת ואלקטרודה האמבטיה מכילות חוטי כסף מצופים בשכבה דקה של כלוריד כסף.
- הר בעל פיפטה על micromanipulator כדי לאפשר מיקום מדויק.
- לפברק micropipettes electroporation מנימי זכוכית בורוסיליקט עם נימה פנימית.
- השתמש בחולץ micropipette אופקי וליישם פרוטוקול שונה עבור הייצור של טפטפות לניסויי מהדק תיקון כפי שתואר על ידי Bestman et al. 13.
- להתאים פרמטרים לייצר Shank ופתיחת טיפ קטן יותר וכתוצאה מכך התנגדות פיפטה גבוהה יותר של כ 15-20 mOhm לelectroporation תא בודד יותר. התנגדות פיפטה צריכה להיות נמוכה יותר, למשל, 3-4 mOhm, לתיוג של קבוצות של תאים.
- מדוד את התנגדות פיפטה באופן ישיר עם electroporator תא בודד ייעודי או לחשב אותו עם חוק אוהם לאחר מדידת זרימה נוכחית עם אוסצילוסקופ לאחר היישום של דופק מתח מוגדר.
2. הכנת Electroporation הפתרון
- לפזר dextran מצמידים fluorophore בצלצול צפרדע (98 מ"מ NaCl, 2 מ"מ KCl, 1 מ"מ CaCl 2, 2 מ"מ MGCl 2, 5 גלוקוז מ"מ, 5 מ"מ Na-פירובט, 10 HEPES מ"מ, מותאם pH 7.8, osmolarity הייתה 230 mOsmol / l) בריכוז של 3 מ"מ. התאים לא יכולים להיות כל כך שכותרתו במאור פנים, אם ריכוזי צבע נמוכים יותר משמשים. הכן פתרון מניות נפח גדול ולחלק אותו לaliquots קטנים. להקפיא אותם לאחסון (יציב במשך חודשים).
הערה: dextrans זמין בגדלים שונים ומגוון רחב של פליטה / ספקטרום עירור (למשל, 10kD Alexa 488-dextran, Alexa 10kD 546-dextran, Alexa 10kD 568-dextran, 10kD 594-dextran אלקסה, 3kD TMR-dextran.). - למילוי micropipette עם קצה פיפטה מוארך עם נפח קטן של פתרון dextran (1-5 μl). קפיצי בזהירות את micropipette עם האצבע כדי להסיר בועות אוויר שנותרו בקצה פיפטה.
- הר micropipette בבעל פיפטה. ודא שחוט הכסף בתוך פיפטה הוא במגע עם פתרון הצבע.
3. בחירה של הזחל X. laevis </ Em>
- השתמש זחלים לבקן של X. laevis לניסויים. בעלי חיים מסוג ברי רשות melanophores מלא פיגמנט המציג פליטת autofluorescence במהלך confocal / ההדמיה multiphoton ולכן אינו מתאימים לניסויים שתוארו.
- שלב ראשני premetamorphotic לאחר Nieuwkoop ו -14 פאבר. בחר ראשנים של שלבים 45-53 לניסויים.
4. Electroporation של dextrans מצמיד Fluorophore
- מניחים פיסה קטנה של רקמה בצלחת פטרי ולכסות אותו עם נפח קטן של מים המכילים 0.02 tricaine% (methanesulfonate 3-aminobenzoate אתיל, מותאם pH 7).
- להרדים את הראשנים במים המכילים tricaine 0.02%. אחרי כמה דקות החיות יפסיקו לנוע. לאשר הרדמה תקינה על ידי נגיעה ראשנים. הם צריכים להיות ללא תגובה.
- להעביר בזהירות את הראשן מההרדמה לצלחת פטרי רקמות מכוסות.
- ודא אלקטרונ האמבטיהשיר הלל סוגר את מעגל electroporation. ודא כי האלקטרודה היא במגע עם הרקמות הרטובות; מקשר ישיר לראשן אין צורך.
- מקם את הקצה הקרוב micropipette לאיבר חוש הריח באמצעות micromanipulator.
- לחדור את העור המכסה את איבר חוש הריח עם קצה פיפטה ובזהירות לקדם את הקצה לתוך שכבת תא עצב חושי במיקום המרכזי של אפיתל הריח העיקרי או אפיתל יעקובסון.
- תגרום להבזקי מתח מרובע חיוביים להעברת צבע לתוך תאי עצב תחושתיים. החל דופק מתח יחיד (לדוגמא., 25 V, אורך הפולס 25 אלפיות שני) או רכבות של פולסים מרובים (לדוגמא., 50 V, אורך הפולס 300 μsec, 400 משך רכבת msec ב 200 הרץ).
הערה: קביעת פרמטרים דופק מתח אופטימליים עבור רצוי להאריך של תיוג. להפחית משרעת מתח דופק, משך ומספר החזרות להפחית את מספרם של תאים שכותרתו. החל גבוה משרעת דופק מתח, משך ומספר pulses לתיוג נרחב יותר. - דמיין שחול מוצלח צבע וelectroporation על ידי פולסים מופעלים באמצעות תאורת ניאון של סטראו. הצבע מתפשט במהירות לתוך גוף תא ודנדריט לאחר electroporation המוצלח.
- חזור על שלבים 4.5-4.9 לאיבר ההרחה השני של הראשן.
- העבר את הראשן לתוך כוס מלאה במים שפירים להתאוששות. אחרי בערך 5 דקות הראשנים מתעוררים מהרדמה ולהתחיל תנועות שחייה רגילות.
- לאחר 24 שעות לצבוע electroporated מתפשט בעצב סנסורי וסופו של דבר מגיע לנורת חוש הריח באמצעות תחבורת axonal.
5. בעלי חיים הרכבה להדמיה in vivo של תאים ותהליכי axonal
- להרדים את הראשנים במים המכילים tricaine 0.02%.
- בזהירות להעביר ראשנים לחדר הדמיה, למשל, גומי סיליקון קטן מכוסה צלחת פטרי עם הפסקת ראשן בגודל.
- לחתוך מלבן קטן בפס של Parafilm. מכסה את הראשן עם Parafilm, עוזב את telencephalon הקדמית חשופה מבעד לחלון לחתוך החוצה. תקן את Parafilm עם מחטים על הצלחת מבלי לפגוע בראשן.
- ודא הראשן הוא שקוע במים מספיקים מכילים tricaine 0.02%.
- הר חדר ההדמיה על הבמה של מיקרוסקופ multiphoton זקוף או מיקרוסקופ confocal.
- לרכוש שלוש ערימה ממדית של תמונות של הנורה חוש הריח. ודא שהליך ההדמיה הוא קצר ככל האפשר ולא יעלה על 10-15 דקות.
- להחזיר את הראשן למים רגילים במכל נפרד ולמנוע חשיפה לאור. לאחר 5 דקות, הראשן מתעורר מהרדמה.
- חזור על שלבים 5.1-5.7 לאחר מרווחי זמן שצוינו, לדוגמא., בכל יום.
6. בעלי חיים הרכבה להדמיה Ex Vivo של תאים ותהליכי axonal
- לחלופין לסעיף 5של הפרוטוקול, להשתמש הכנת מוח נכרתה לדמיין את עצב סנסורי שכותרתו.
- הרדימי ולהרוג את הראשן על ידי חיתוך רוחב של המוח במעבר לחוט השדרה. בלו בלוק של רקמה המכיל את איברי חוש הריח, עצבי חוש הריח וtelencephalon הקדמית.
- מעביר את גוש הרקמה לפתרון צלצול צפרדע ולהסיר רקמת חיבור עם מספריים עדינים כדי לחשוף את הצד הגחוני של המוח.
- מעביר את גוש הרקמה לחדר הדמיה ולתקן את זה עם מסגרת פלטינה חוטים עם חוטי ניילון.
- הר חדר ההדמיה על הבמה של מיקרוסקופ confocal / multiphoton.
- לרכוש שלוש ערימה ממדית של תמונות של הנורה חוש הריח.
7. עיבוד תמונה והערכת נתונים
- לייעל וליישם אמצעים לא-מקומיים של סינון לשיפור איכות תמונה והדמיה של מבנים עצביים כפי שתואר על ידי קופה, פ et al. 15.
הערה: נתוני ניסויי הדמיה בשכבות רקמה עמוקות יותר של דגימות חיות הם לעתים קרובות רועשים. - צור תחזיות בעוצמה מקסימלית של ערימות תמונה לסקירה.
- לזמן לשגות ניסויי הדמיה מסך ערכות נתונים עבור אקסונים באופן חד משמעי לזיהוי יחידים של עצב סנסורי.
- לשחזר מורפולוגיה תאית באמצעות סיוע תוכנת מעקב של תהליכים עצביים כפי שתואר על ידי אל פנג et. 16.
תוצאות
הפרוטוקול המתואר יכול להיות מיושם בהצלחה עבור electroporation ובהדמית vivo של תהליכי axonal של נוירונים חושיים של מערכת ההרחה של X. בהרדמה laevis, באמצעות confocal לייזר סריקה או במיקרוסקופ multiphoton (איור 1).
Electroporation מאפשרת dextrans מצמידים fluorophore להיכנס ולהתפשט במהירות בתוך תאים של איבר חוש הריח. זה מועיל ליישם תאורת ניאון כדי לוודא תיוג מוצלח לאחר מפעילה פולסים מתח. בהתאם לפרמטרי electroporation, למשל., התנגדות פיפטה, קבוצות של תאים (איור 2 א, ב) או תאים בודדים (איור 2C) של איבר חוש הריח מסומנות. האקסונים של תאי עצב תחושתיים שכותרתו ניתן דמיינו בעצב ההרחה (איור 2 ד) וניתן לצפות תהליכי axonal גם בנורת חוש הריח, בדרך כלל 24 שעות לאחר electroporation המוצלח(איור 3). Electroporation של קבוצות של תאי עצב תחושתיים מאפשר לדמיין את דפוסי חיווט הגסים בנורת חוש הריח (איור 3 א). electroporation תא הבודד יכול להיות מיושם על לחקור דפוסים בודדים axonal הקרנה, בהסתעפויות axonal וקישוריות למבני גלומרולריות בנורת חוש הריח (איור 3 ג-ה).
ראשנים לבקן שקופים של X. היתר laevis בconfocal vivo או ההדמיה multiphoton של עצב סנסורי שכותרתו במוח שלם של ראשן בהרדמה. פיתוח דפוסי צמיחת axonal ניתן לעקוב במשך כמה ימים / שבועות על ידי חוזר ונשנה בהדמית vivo של אותו תא העצב החושי שכותרתו (איור 4). בהתאם לפדיון של נוירון החושי בנקודת הזמן של electroporation דפוס האקסון בנורת חוש הריח יכול להשתנות במידה ניכרת. נוירונים בוגרים כבר יש סניפי axonal משוכללים שכוללים ציצהאזורי ed מחוברים לglomeruli. דפוס צמיחת axonal של נוירונים בוגרים הוא יציב למדי, אבל התארכות של ענפי האקסון וחידודים של ציצות גלומרולריות ניתנת לצפייה (איור 4 א-ה). ניתן לצפות עצב סנסורי in vivo לתקופות זמן ממושך, למשל., יותר משלושה שבועות (איור 4F-I). מצד השני, האקסונים של תאי עצב לא בוגרים עדיין בתהליך של צמיחה ראשונית, אין לי arborizations המצויץ ועדיין אינו מחוברים למטרות גלומרולריות הסופיות שלהם. פרוטוקול הניסוי מאפשר מעקב ההתפתחות של תאי העצב האלה במהלך הבשלה, לדוגמא., התארכות האקסון, בהסתעפויות והקמת arborizations המצויץ (איור 4J-L). לדוגמאות נוספות ראה גם Hassenklöver ו -12 מנציני.

איור 1. סקירה סכמטי של פרוטוקול הניסוי. () נוירונים חושיים באפיתל ההרחה הראשי (משרד החינוך) או איבר יעקובסון (VNO) של איבר חוש הריח של X. בהרדמה זחלי laevis מסומנים דרך electroporation באמצעות פיפטה מזכוכית מלאה בפתרון dextran ניאון. יכולים להיות אחרי האקסונים של תאי עצב שכותרתו דרך עצב ההרחה (ON) וסופו של דבר להגיע לנורת חוש הריח (OB). (ב) הראשן הוא מורדם ונוירונים שכותרתו נחקרים שוב ושוב באמצעות מיקרוסקופ confocal או multiphoton בזמנים הקצובים. הפיתוח ההדרגתי של דפוסי צמיחת axonal של תאים שכותרתו (C) ניתן בעקבות לאורך פרקי זמן של ימים עד שבועות.

איור 2. Electroporation של עצב סנסורי באיבר חוש הריח. Electroporation () עם טפטפות התנגדות הנמוכה מובילה לתיוג של מספר תאים באיבר חוש הריח. בדוגמא זו נציג נוירונים קולטני ריח מרובים (ORNs, ראשי חץ מלאים) ושני תאים תומכים בצורת עמודים (SCS, כוכביות) הוכתמו. קווים מקווקווים לסמן את גבולותיה של אפיתל הריח (OE). (ב) זיקוק הפרמטרים electroporation, למשל., הגדלת התנגדות פיפטה, מגביל את מספר התאים שכותרתו. בדוגמא זו, תא עצב אחד חושי (ראשי חץ מלאים) ותא אחד (כוכבית) תמיכה בסמוכה הוכתמו לאחר electroporation. הערה האקסון היחיד שעזב את אפיתל ההרחה (ראשי החץ פתוחים). (ג) electroporation תא הבודד מוצלח מוביל לתיוג בלעדי של נוירון בודד חושי (ראש חץ מלא) והאקסון שלו המחובר (ראשי החץ פתוחים) באפיתל ההרחה. האקסון שהכותרת אחת (ראשי החץ פתוחים) (ד) דרך עצב ההרחה (ON) לנורת חוש הריח.
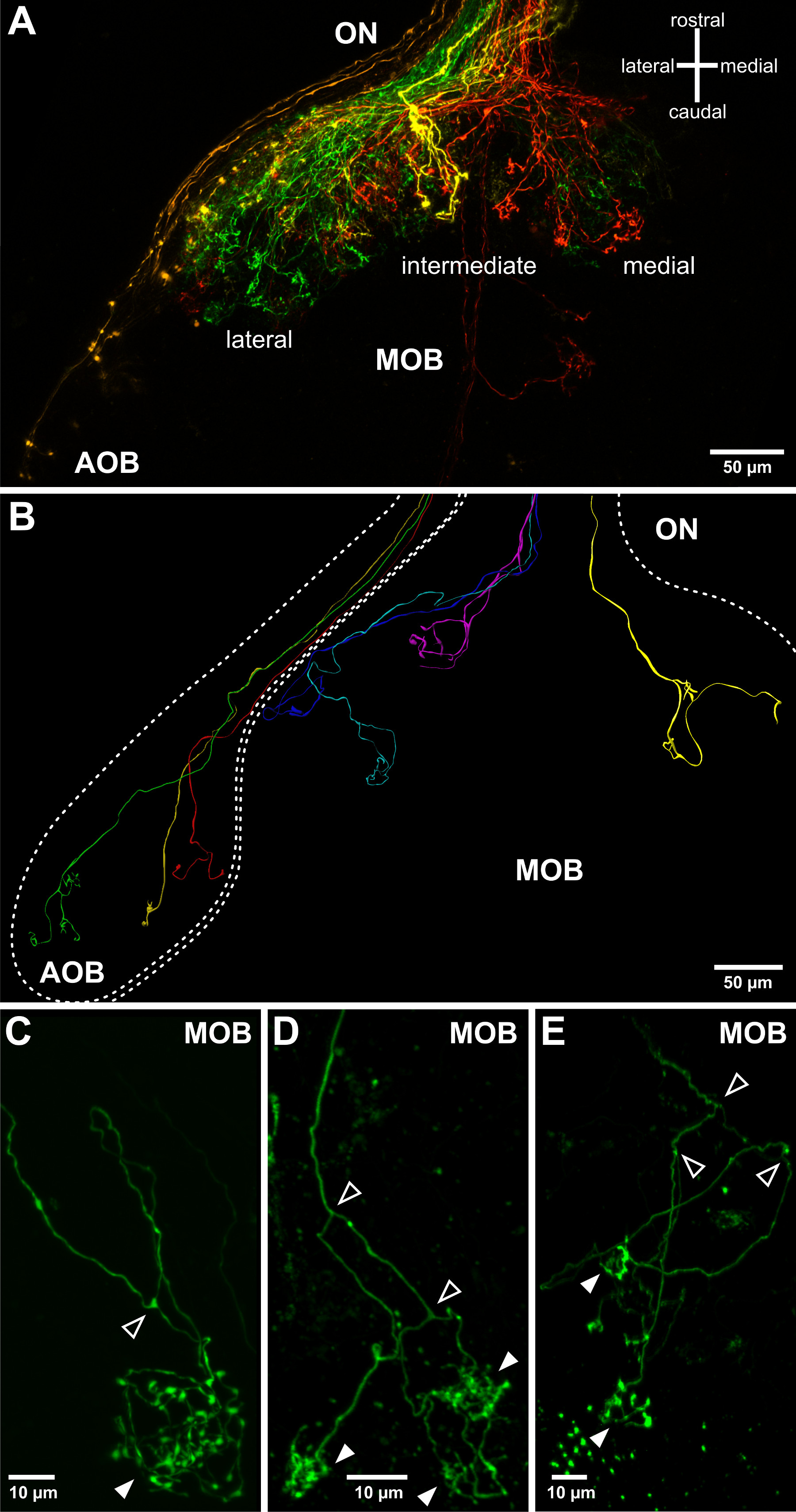
איור 3. לדמיין תחזיות האקסון חוש הריח בנורת חוש הריח נכרתה. () טופולוגיה הגסה של תחזיות axonal של עצב סנסורי בנורת חוש הריח יכול להיות דמיין באמצעות טפטפות electroporation התנגדות נמוכות יותר. חצי הכדור אחד חוש הריח נורה ועצב ההרחה הקשורים אליו (ON) מתוארים. ארבעה dextrans מצמידים את fluorophores שונה electroporated בארבעה מקומות מרוחקים של איבר חוש הריח: לרוחב (ירוק), בינוני (צהובה), מדיאלי משרד החינוך (אדום) וVNO (כתום). זה מאפשר לדמיין את הנורה אבזר חוש הריח (AOB) ושלושה שדות ההשלכה העיקריים של הנורה העיקרית חוש הריח (MOB). (ב) דפוסי צמיחת axonal שונים של עצב סנסורי חוש הריח חד על גבי המבנה של הנורה חוש הריח. המוצגים בשילוב שלושה שחזורים ממדיים של stainings תא הבודד מרובה נובע מדגימות זחל שונות. דוגמאות (CE) של אקסונים חוש הריח חד מקרינים לתוך הנורה חוש הריח ויוצרים arborizations / סינפסות מצויצות בglomeruli הכדורית (ראשי חץ מלאים). שים לב כי בX. laevis האקסונים חוש הריח להתפצל באופן קבוע (ראשי חץ פתוחים) לפני ההתחברות לglomeruli אחד, שתיים או מרובה (ראשי חץ מולא באופן, גם לראות Hassenklöver ו -12 Manzini).
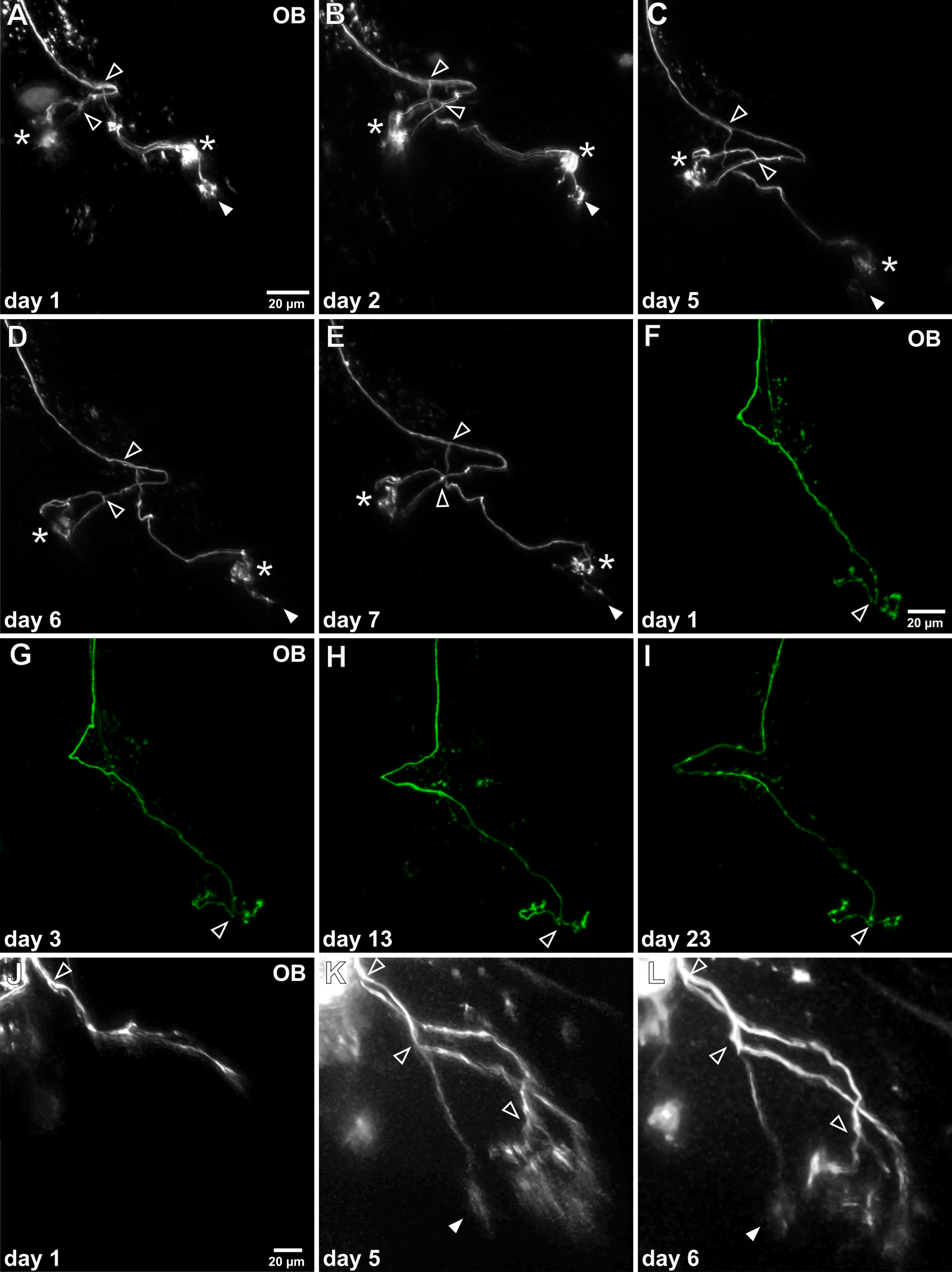
איור 4. בזמן לשגות הדמיה vivo של אקסונים נוירון חוש הריח חד. (AE)לאחר electroporation תא בודד המוצלח האקסון שכותרתו יכול להיות דמיין שוב ושוב בנורת חוש הריח (OB). דוגמא זו מראה האקסון בודד שנחקר במשך שבוע אחד. המורפולוגיה הכוללת אינה משתנה במידה ניכרת וניתן לזהות שתי נקודות הסתעפות גדולות (ראשי חץ פתוחים). שים לב כי במהלך הזמן, ציצה אחד גלומרולריות עוברת הפחתה מתמשכת (חץ מלא), ואילו בשתי קווצות גלומרולריות האחרות תישאר יציבים (כוכביות). (FI) דוגמא מייצגת זו מציגה את הכדאיות של תצפיות ארוכת טווח, כמו אקסון הספציפי זה נחקר במשך יותר משלושה שבועות. אין שינוי לכאורה של דפוס הגדילה שלו יכול להיות מזוהה. (JL) דוגמא של האקסון חושי בשלה בתהליך של צמיחה מתוארת. היא עדיין לא מחוברת לglomeruli וציצות גלומרולריות אופייניות חסרות. לאחר 5 ימים סניפי axonal מוארכים, האקסון מפוצל מספר פעמים וarborizations קנס הןהוקם.
Discussion
הליך הניסוי המתואר כאן מאפשר עצב סנסורי תיוג של איבר חוש הריח של X. הזחל laevis על ידי electroporation של dextrans מצמידים fluorophore וההדמיה הבאה של צמיחת האקסון חושית בחי. על ידי שינוי הפרמטרים של electroporation in vivo ניתן לשלוט על מספר תאי העצב התחושתי שכותרתו. זה ובכך ניתן לתייג קבוצות גדולות של תאי עצב של האפיתל חושית, כמה או אפילו תאים בודדים מאוד.
כדי להבטיח הרצוי להאריך תיוג עצבי חשוב להיות זהיר במיוחד על מאפייני micropipette וקטניות electroporation. התנגדויות פיפטה גבוהות יותר והפחתה של דופק מתח משרעת, משך ומספר החזרות יכולות להפחית את כמות התאים שכותרתו, ואילו הפחתת התנגדויות פיפטה ומשרעת דופק מתח גבוה יותר, משך זמן ומספר הפעימות יכול להוביל לתיוג נרחב יותר. השימוש בדואר של dextrans ניאון עבור electroporation מספק משוב חזותי מיידי אם ההגדרות להחיל מתאימות. היזהר שבאמצעות פרמטרים למשרעת, משך ומספר הפעימות שתעלינה על הערכים שנקבעו בפרוטוקול עלול לגרום לנזק לתאים או אפילו מוות של תאי 17. טיפים סתומים או שבורים של micropipettes יכולים גם לעכב electroporation המוצלח.
בelectroporation vivo באיבר חוש הריח של X. laevis מוגבל לשלבי זחל מאז העור של צפרדעי postmetamorphotic הוא קשה ולא ניתן לחדור בקלות עם micropipette. ההדמיה in vivo של תהליכים עצביים יכולה להתעכב על ידי הפיזור של עירור / פליטת אור באזורים במוח עמוק יותר או על ידי כלי דם. בעיה זו הופכת להיות בולטת במיוחד בשלבי זחל גבוהים יותר בשל מוח גדול יותר ויכולה להוביל לאותות רועשים שהופכים את זיהוי ברור של תהליכי axonal בסדר קשה יותר.
היתרי הפרוטוקול המובא "jove_content" לדמיין עצב סנסורי במערכת ההרחה שלמה בלי לנתח את החיה, לפגוע בתאים במהלך תיוג, הכנת חתכי רקמה או תיקון הרקמות כפי שיידרש לשיטות חלופיות, כמו תיוג בתיקון כל התא ניסויי -clamp 18. כאשר משלב את התיוג של כמה או בודדים נוירונים חושיים עם in vivo הדמיה הזמן לשגות, אפשר לדמיין את קשרי גלומרולריות של עצב סנסורי הבוגר יחיד על מרווחי זמן ארוכים. בדרך זו אפשר גם לעקוב אחר ההתפתחות של דפוסי הקרנת axonal של עצב סנסורי לא בשלה במשך מספר שבועות. אפשרות השנייה זו היא מעניינת במיוחד שכן היא מאפשרת ניטור דפוסי הצמיחה של אקסונים יחידים בחי. זה מפותח את האפשרות לחקור מנגנונים תאיים ומולקולריים השולטים האקסון הדרכה וpathfinding. מספר גורמים, כולל ביטוי קולטן odorant, axo השוניםמולקולות ההנחיה n ופעילות מושרה odorant / ספונטנית של תאי עצב תחושתיים הוכחו להסדיר את ממצא היעד של אקסונים נוירון החושיים 4,5.היישום של הפרוטוקול אינו מוגבל לעצב סנסורי חוש הריח, אבל יכול להיות מיושם גם ללמוד סוגי תאים אחרים, למשל., תאי גזע / אב של האזורים העצביים של המוח המתפתח או תאי צניפי של הנורה חוש הריח. בנוסף טכניקה הפגינה יכולה לשמש גם בשילוב עם dextrans רגיש סידן או בזריקת צבעי סידן קרום חדיר כדי לקבל מידע לגבי תפקוד תא העצב שכותרתו ו / או המעגלים המחוברים 7,19. הזמינות של מגוון רחב של fluorophores מצמידים את dextrans מאפשרת תיוג של תאים בודדים מרובים או אוכלוסיות עם צבעים שונים. גם פלסמיד פתרון ה- DNA, למשל קידוד לחלבוני ניאון, מתאים לelectroporation ועוד יכול לשפר את versatiliטאי ותועלת של הטכניקה 6. הפרוטוקול נוסף ניתן לשפר כדי לאפשר electroporation המשולב של dextrans וDNA או morpholinos הטעון לתפעל ביטוי גנים 13,17.
השיטה המתוארת בהחלט מייצגת כלי חדש כדי לחקור המורכב ותהליכים עדיין לא הבינו באופן מלא המסדירים הדרכת axonal במערכת חוש הריח החוליות.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by DFG Schwerpunktprogramm 1392 (project MA 4113/2-2), cluster of Excellence and DFG Research Center Nanoscale Microscopy and Molecular Physiology of the Brain (project B1-9), and the German Ministry of Research and Education (BMBF; project 1364480).
Materials
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| SZX16 | Olympus | stereomicroscope with fluorescent illumination | |
| Axon Axoporator 800A | Molecular Devices | single cell electroporator | |
| ELP-01D | npi electronic | electroporator | |
| MMJ | Märzhäuser Wetzlar | manual micromanipulator | |
| P-1000 | Sutter | Horizontal micropipette puller | |
| G150F-4 | Warner Instruments | glass capillaries for electroporation pipette fabrication; internal filament makes backfilling easier | |
| Alexa 488-dextran 10kD | Life Technologies | D22910 | |
| Alexa 546-dextran 10kD | Life Technologies | D22911 | |
| Alexa 568-dextran 10kD | Life Technologies | D22912 | |
| Alexa 594-dextran 10kD | Life Technologies | D22913 | |
| TMR-dextran 3kD (micro-Ruby) | Life Technologies | D7162 | |
| microloader pipette tips | eppendorf | 930001007 | |
| tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10521 | anesthetic; use gloves |
| A1-MP | Nikon | multiphoton microscope | |
| LSM 780 | Zeiss | confocal microscope | |
| Imaris | Bitplane | alternative software for neuronal tracing |
References
- Huard, J. M., Youngentob, S. L., Goldstein, B. J., Luskin, M. B., Schwob, J. E. Adult olfactory epithelium contains multipotent progenitors that give rise to neurons and non-neural cells. J. Comp. Neurol. 400 (4), 486-4810 (1998).
- Schwob, J. E. Neural regeneration and the peripheral olfactory system. Anat. Rec. 269 (1), 33-49 (2002).
- Leung, C. T., Coulombe, P. A., Reed, R. R. Contribution of olfactory neural stem cells to tissue maintenance and regeneration. Nat. Neurosci. 10 (6), 72-726 (2007).
- Lodovichi, C., Belluscio, L. Odorant receptors in the formation of the olfactory bulb circuitry. Physiology (Bethesda. 27 (4), 212-2110 (2012).
- Mori, K., Sakano, H. How is the olfactory map formed and interpreted in the mammalian brain). Annu. Rev. Neurosci. 34, 467-499 (2011).
- De Vry, J., et al. In vivo electroporation of the central nervous system: a non-viral approach for targeted gene delivery. Prog. Neurobiol. 92 (3), 227-244 (2010).
- Hovis, K. R., Padmanabhan, K., Urban, N. N. A simple method of in vitro electroporation allows visualization, recording, and calcium imaging of local neuronal circuits. J. Neurosci. Methods. 191 (1), 1-10 (2010).
- Chen, C., Smye, S. W., Robinson, M. P., Evans, J. A. Membrane electroporation theories: a review. Med. Biol. Eng. Comput. 44 (1-2), 5-14 (2006).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70 (4-5), 148-154 (2002).
- Hewapathirane, D. S., Haas, K. Single cell electroporation in vivo within the intact developing brain. J. Vis. Exp. (17), (2008).
- Gliem, S., et al. Bimodal processing of olfactory information in an amphibian nose: odor responses segregate into a medial and a lateral stream. Cell. Mol. Life Sci. 70 (11), 1965-1984 (2013).
- Hassenklöver, T., Manzini, I. Olfactory wiring logic in amphibians challenges the basic assumptions of the unbranched axon concept. J. Neurosci. 33 (44), 17252-1710 (2013).
- Bestman, J. E., Ewald, R. C., Chiu, S. -. L., Cline, H. T. In vivo single-cell electroporation for transfer of DNA and macromolecules. Nat. Protoc. 1 (3), 1272-1210 (2006).
- Nieuwkoop, P. D., Faber, J., Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis. , (1994).
- Coupé, P., Munz, M., Manjón, J. V., Ruthazer, E. S., Collins, D. L. A CANDLE for a deeper in vivo insight. Med. Image Anal. 16 (4), 849-864 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nat. Biotechnol. 28 (4), 348-353 (2010).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7 (107), (2007).
- Nezlin, L. P., Schild, D. Individual olfactory sensory neurons project into more than one glomerulus in Xenopus laevis tadpole olfactory bulb. J. Comp. Neurol. 481 (3), 233-239 (2005).
- Nagayama, S., et al. In vivo simultaneous tracing and Ca2+ imaging of local neuronal circuits. Neuron. 53 (6), 789-803 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved