Method Article
Isolamento e preparazione delle pareti cellulari batteriche per l'analisi compositia mediante cromatografia liquida ad alte prestazioni
In questo articolo
Riepilogo
La parete cellulare batterica è composta da peptidoglycan, una rete macromolecolare di fili di zucchero reticolati da peptidi. La cromatografia liquida ad alte prestazioni fornisce alta risoluzione e produttività per nuove scoperte della composizione peptidoglycan. Presentiamo una procedura per l'isolamento delle pareti cellulari (sacculi) e la loro successiva preparazione per l'analisi tramite UPLC.
Abstract
La parete cellulare batterica è fondamentale per la determinazione della forma cellulare durante la crescita e la divisione e mantiene l'integrità meccanica delle cellule di fronte alle pressioni del turgore diverse atmosfere di grandezza. Attraverso le diverse forme e dimensioni del regno batterico, la parete cellulare è composta da peptidoglycan, una rete macromolecolare di fili di zucchero reticolati da brevi peptidi. L'importanza centrale del peptidoglicano per la fisiologia batterica è alla base del suo uso come bersaglio antibiotico e ha motivato studi genetici, strutturali e biologici cellulari su come viene assemblato solidamente durante la crescita e la divisione. Tuttavia, sono ancora necessarie indagini approfondite per caratterizzare pienamente le principali attività enzimatiche nella sintesi del peptidoglycan e nella composizione chimica delle pareti cellulari batteriche. La cromatografia liquida ad alte prestazioni (HPLC) è un potente metodo analitico per quantificare le differenze nella composizione chimica delle pareti dei batteri coltivati in una varietà di condizioni ambientali e genetiche, ma la sua produttività è spesso limitata. Qui, presentiamo una procedura semplice per l'isolamento e la preparazione delle pareti cellulari batteriche per analisi biologiche del peptidoglycan tramite HPLC e Ultra Performance Liquid Chromatography (UPLC), un'estensione di HPLC che utilizza pompe per fornire pressioni ultra-elevate fino a 15.000 psi, rispetto ai 6.000 psi per HPLC. In combinazione con la preparazione delle pareti cellulari batteriche qui presentate, gli iniettori di campioni a basso volume, i rivelatori con alti tassi di campionamento, volumi di campioni più piccoli e tempi di esecuzione più brevi di UPLC consentiranno un'alta risoluzione e produttività per nuove scoperte della composizione peptidoglycan e della biologia delle cellule batteriche fondamentali nella maggior parte dei laboratori biologici con accesso a un ultracentrifugo e UPLC.
Introduzione
L'obiettivo del metodo descritto nel presente documento è quello di isolare le pareti cellulari batteriche intatte (sacculi) e di digerire il peptidoglycan (PG) in modo tale che la cromatografia liquida ultra-performance (UPLC) possa essere utilizzata per fornire informazioni come l'identità dei componenti muropeptidi e le loro concentrazioni, la lunghezza media dei filamenti di glicano e la frazione di materiale coinvolto nei collegamenti incrociati tra i trefoli. Per una discussione dettagliata della biochimica PG e delle specie di muropeptidi, ci sono diverse eccellenti recensioni che descrivono la struttura PG e il suo ruolo in infezione, resistenza, morfogenesi e crescita1-6. La cromatografia liquida ad alte prestazioni (HPLC) per l'analisi PG è stata inizialmente sviluppata da Glauner e Schwarz negli anni '80, e più recentemente è stata migliorata e applicata ampiamente nei laboratori di Miguel de Pedro e Waldemar Vollmer. I metodi precedenti utilizzavano l'analisi degli amminoacidi o la cromatografia su carta, tecniche dispendiose in termini di tempo e noiose che non producono valutazioni accurate o complete dei componenti della parete cellulare.
L'analisi UPLC può essere facilmente implementata in qualsiasi laboratorio di ricerca di base che abbia accesso a un ultracentrifugo e UPLC. Il metodo UPLC che presentiamo di seguito isola i sacculi completi, fornendo così informazioni complete e quantitative su tutte le specie chimiche in esso contenute. Questo metodo produce una quantificazione precisa di tutti i muropeptidi in una popolazione di batteri, il tutto entro una corsa UPLC di 20 minuti. L'implementazione di questo metodo comporta solo competenze di laboratorio di base, senza significativi investimenti finanziari nei materiali. Per eseguire i passaggi di questo metodo, i ricercatori devono solo essere esperti nella pipettazione, nella preparazione di tamponi ed enzimi e nella regolazione del pH, rendendolo accessibile a una vasta gamma di discipline scientifiche. La scelta degli enzimi utilizzati in questo protocollo dipende dalle specie di batterio analizzate; il protocollo qui descritto è utile per Escherichia coli, ed è stato generalmente trovato adeguato per isolare i sacculi da altri organismi Gram-negativi. La consultazione con la letteratura è raccomandata quando si applica questo metodo ai batteri Gram-positivi; in queste specie, la purificazione del sacculo è stata tradizionalmente più difficile. In particolare, questo metodo potrebbe essere necessario alterare in termini di scelta enzimatica e lunghezza dei tempi di digestione per adattarsi alle pareti più spesse e ai polimeri accessori come gli acidi teichoici dei batteri Gram-positivi. Il primo enzima in questo protocollo scide la lipoproteina della membrana esterna (come la lipoproteina di Braun, o Lpp) attacca al peptidogicano, rilasciando così tutto tranne il peptide C-terminale di- (o tri-) del Lpp dalla parete cellulare. Questo passaggio è necessario quando si esaminano enterobatteri, ma molti altri batteri Gram-negativi non hanno equivalenti Lpp, e quindi questo passaggio può essere saltato. Un secondo enzima si stacca specificamente dopo il componente dell'acido muramico del peptidoglycan, solubilizzando la subunità disaccaride che forma la specie muropeptide. Per fornire una valutazione accurata dell'architettura del PG, è necessario prestare attenzione a digerire i sacculi per evitare la scissione delle passerelle o di qualsiasi altra parte del gambo peptidico.
Sebbene le composizioni chimiche di peptidoglycan di oltre 100 ceppi di ~40 specie batteriche siano state analizzate dall'HPLC, non sono state eseguite analisi con la tecnologia UPLC. Inoltre, il lavoro precedente ha caratterizzato il peptidoglycan solo da una piccola frazione del dominio batterico, in parte limitato dalla produttività dell'HPLC. Pertanto, la diffusione di questo metodo al maggior numero possibile di ricercatori e l'implementazione su piattaforme UPLC saranno fondamentali per guidare studi fisiologici della grande frazione di specie batteriche il cui peptidoglycan deve ancora essere classificato.
Protocollo
1. Coltivare colture batteriche in 2,5 ml di media durante la notte
Diluire le colture 1:100 in 250 ml di mezzi freschi e crescere fino a600 OD di 0,7-0,8. Preparare una soluzione di dodecil solfato di sodio al 6% (SDS) in acqua.
ATTENZIONE: la polvere SDS è pericolosa - evitare di inalare polvere di SDS; indossare una maschera sul naso e sulla bocca.
2. Giorno 1 - Le colture batteriche di lysing vengono eseguite nel corso di un giorno e durante la notte
- Mentre le colture diluite crescono, impostare un bagno d'acqua bollente su una piastra calda in un becher da 1 L. Una volta che l'acqua è bollente, aliquota 6 ml di SDS 6% in tubi in polipropilene da 50 ml, aggiungere una piccola barra di agitazione a ciascun tubo, fissare i coperchi del tubo a tenuta di dita, posizionare i tubi nel bagnomaria e accendere mescolando a 500 giri/min sulla piastra calda.
- Raccogliere le colture da 250 ml a 5.000 × g per 10 minuti a temperatura ambiente e rimossare pellet in 3 ml di mezzi o 1 soluzione salina tamponata con fosfato. Le sospensioni a celle a pipetta lenta si trasformano in tubi da 50 ml con SDS bollente al 6% per liscire le cellule (concentrazione finale 4% SDS) mentre i tubi sono immersi nel bagno d'acqua bollente e richiudere i coperchi a tenuta di dita. Le sospensioni cellulari devono essere trasferite rapidamente in SDS bollente una volta rimontesi. Dovrebbero essere evitati bruschi cambiamenti ambientali, in quanto ciò potrebbe causare un'alterazione errata della struttura della parete cellulare.
- Coprire il bagno d'acqua bollente e lasciare bollire le cellule per 3 ore, controllando periodicamente il livello dell'acqua e riempiendo il bagnomaria quando necessario. Dopo 3 ore, spegnere l'elemento riscaldante della piastra calda e continuare a mescolare durante la notte a 500 giri/min.
3. Giorno 2 - Le digestione enzimatica vengono eseguite nel corso di un giorno
- Se sds è precipitato nei tubi da 50 ml durante la notte, impostare il bagnomaria a bollire per ulteriori 1-2 ore. Accendere un blocco termico a 60 °C. Preparare uno stock di 1 mg/ml di Pronasi E in Tris-HCl da 10 mM (pH 7,2) + 0,06% con NaCl e attivare la Pronasi E a 60 °C per almeno 30 min.
- Utilizzare un set di ultracentrifugo a 400.000 × g per far girare campioni per 20 minuti a temperatura ambiente al fine di pellettizzare i grandi polimeri PG e quindi purificarli da altri componenti cellulari. Rimuovere con cura il supernatante, quindi rimescolare ogni pellet in acqua ultrapura a temperatura ambiente. NOTA: Il volume di resuspensione dipende dal volume dei tubi ultracentrifugo utilizzati; utilizzare un volume che riempia i tubi almeno a metà strada ma non superi il volume massimo dei tubi. Ripetere la centrifugazione/lavaggio fino a quando l'acqua non forma bolle durante la resuspensione, indicando che l'SDS è stato completamente rimosso (in genere tre lavaggi). Interrompere il lavaggio del pellet se si forma un precipitato bianco, in quanto ciò indica che i sacculi si stanno raggruppando insieme. Il raggruppamento non è catastrofico, ma i grumi si legano molto fortemente alla plastica e alla vetreria causando una grande perdita di campioni. In questo caso, procedere con il protocollo utilizzando il campione di sacculi raggruppato.
- Nell'ultima fase di centrifugazione/lavaggio, rimescolare i campioni in 900 μl di 10 mM Tris-HCl (pH 7.2) + 0,06% con NaCl e trasferire a 2 ml tubi precedentemente infilati con fori nelle cime con un piccolo ago. Aggiungere 100 μl di 1 mg/ml di Pronasi E attivata (concentrazione finale di 100 μg/ml) a ciascun campione e incubare a 60 °C per 2 ore. Impostare un blocco di calore diverso su 100 °C.
- Interrompere la digestione della Pronasi E aggiungendo 200 μl di 6% di SDS a ciascun campione e far bollire i campioni nel blocco termico di 100 °C per 30 minuti. Impostare un blocco termico diverso a 37 °C e fare uno stock di muramidasi (mutanolisina) da 1 mg/ml in tampone fosfato da 50 mM (pH 4.9).
- Come nel passaggio 3.2, utilizzare un set di ultracentrifugo a 400.000 × g per far girare campioni per 20 minuti a temperatura ambiente e lavare con acqua ultrapura a temperatura ambiente fino a quando L'SDS non viene completamente rimosso (in genere tre lavaggi). Il volume di resuspensione dipende dal volume dei tubi ultracentrifugo utilizzati; utilizzare un volume che riempia i tubi almeno a metà strada ma non superi il volume massimo dei tubi.
- Nell'ultima fase di centrifugazione/lavaggio, resuspend campioni in 200 μl di tampone di fosfato di sodio da 50 mM (pH 4.9). Questo volume può essere regolato in base alla quantità di peptidoglycan nel campione e può essere dipendente dalle specie. Se in precedenza sono pubblicati rapporti di analisi HPLC per le specie di interesse, questo volume può essere stimato sulla base di queste quantificazioni (una compilazione di studi HPLC PG può essere trovata nelle informazioni supplementari di riferimento7). Per altre specie, la preparazione sacculus può essere eseguita fino a questo passaggio e quindi è possibile aggiungere diverse quantità di volumi di resuspensione per replicare i campioni al fine di determinare il volume minimo che consente al PG di rimanere in soluzione (vedi Discussione per ulteriori stime). Se il campione contiene più peptidoglycan, aumentare il volume di resuspensione; se il campione ha poco peptidoglycan, ridurre il volume di resuspensione ad un minimo di 50 μl.
- Trasferire campioni in tubi da 1,5 ml e aggiungere 1 mg/ml di muramidasi per ottenere una concentrazione finale di 40 μg/ml. Incubare 6-8 ore o durante la notte a 37 °C.
4. Giorno 3 - La preparazione dei campioni per UPLC viene eseguita l'ultimo giorno
- Accendere un blocco termico a 100 °C. Far bollire i campioni senza SDS per 5 minuti per fermare la digestione della muramisasi. Centrifugare i campioni per 10 min a 16.000 × g a temperatura ambiente, quindi trasferire il supernatante (i muropeptidi sono ora solubili) a tubi di vetro da 13 mm x 100 mm. Cerca di recuperare il più supernatante possibile, avvicinandoti molto al pellet senza disturbarlo.
- Regolare il pH aggiungendo 500 mM di tampone di borato (pH 9) al campione per una concentrazione finale di tampone di borato da 100 mM. Il tampone di borato è compatibile con l'agente riducente boroidro di sodio. Aggiungere 1-2 granelli di boroidro di sodio per ridurre ogni campione e lasciare che la reazione proceda per almeno 30 minuti a temperatura ambiente. ATTENZIONE: Il boroidro di sodio è altamente reattivo e pericoloso da maneggiare - evitare il contatto con la pelle (indossare guanti) ed evitare il contatto con gli occhi (indossare occhiali di sicurezza).
- Regolare i campioni in pH 3-4 (il punto isoelettrico muropeptide è ~3,5) con acido ortofosforico 50% v/v utilizzando incrementi di 20 μl fino a pH 6, come misurato con carta indicatore di pH, quindi utilizzando incrementi di 2 μl. ATTENZIONE: L'acido ortofosforico è corrosivo e pericoloso da maneggiare - evitare il contatto con la pelle (indossare guanti) ed evitare il contatto con gli occhi (indossare occhiali di sicurezza). Il campione deve bollicine in risposta all'aggiunta di acido ortofosforico; quando il campione smette di gorgogliare, questo indica in genere che è stato raggiunto un pH di 6. Se nel campione non si verifica alcun gorgogliamento, ciò può indicare che la quantità di boroidro di sodio aggiunta era troppo piccola. In questo caso, interrompere l'abbassamento del pH, aggiungere con cura uno o due granelli di boroidro di sodio, lasciare reagire per 5-10 minuti, quindi riprendere la regolazione del pH.
- Filtrare il campione attraverso un filtro siringa da 0,22 μm direttamente in un flaconcino UPLC. Se si è formato un precipitato, riscaldare il tubo con più passaggi attraverso una fiamma prima di filtrare. Se il campione non verrà iniettato nello strumento UPLC entro il giorno, congelare a -20 °C durante la notte. I campioni possono essere conservati fino a un anno a -80 °C. Il campione può essere scongelato passando attraverso una fiamma più volte.
- Iniettare 10 μl di ogni campione su uno strumento UPLC dotato di una colonna in fase invertita C18 da 1,7 μm e di un rilevatore di assorbanza impostato per monitorare 202-208 nm. Gli esempi vengono inseriti in sequenza, ma le funzionalità di campionamento automatico consentono di elaborare fino a 96 campioni in batch. Utilizzare 50 mM di fosfato di sodio (pH 4,35) + 0,4% v/v azide di sodio per il solvente A e 75 mM fosfato di sodio (pH 4,95) + 15% v/v metanolo per solvente B. NOTA: L'azide di sodio viene aggiunto per compensare l'assorbimento di metanolo di 205 nm per evitare la deriva di base. Impostare il flusso su 0,25 ml/min e utilizzare un gradiente lineare superiore a 25 min per ottenere il 100% di solvente B e l'eluizione sequenziale dei muropeptidi entro 30 min. Se la spettrometria di massa verrà utilizzata per caratterizzare i muropeptidi dopo UPLC, raccogliere frazioni del picco di interesse in un raccoglitore di frazioni e asciugare le frazioni utilizzando un evaporatore centrifugo.
Risultati
Utilizzando la procedura descritta nella figura 1, il campione finale deve essere costituito da almeno 200 μl di soluzione chiara che è stata filtrata direttamente in un flaconcino UPLC (passaggio 4.4). La separazione UPLC dei vari muropeptidi in un campione batterico si basa sulla loro relativa solubilità tra la fase mobile liquida e la fase stazionaria della colonna. Le colonne C18 in fase inversa forniscono una matrice fortemente idrofobica per separare le specie di muropeptidi in base all'idrofobicità e alle dimensioni8; i monomeri polari a basso peso molecolare elute per primi e gli oligomeri apolari a peso molecolare più elevati eluitano dopo (Figura 2). Un tipico risultato UPLC è mostrato nella Figura 2, con rilevamento tramite assorbanza UV a 202-208 nm in funzione del tempo che stabilisce il tempo di ritenzione di un particolare muropeptide. Questo risultato rappresentativo mostra una chiara risoluzione tra la maggior parte delle specie di muropeptide e una forte potenza del segnale in tutto lo spettro, che consente l'analisi e la lunghezza media del filamento di glico.
Il passaggio finale delineato nella figura 1 prevede la regolazione del pH e il filtraggio di eventuali particelle fini che possono ostruire le piccole dimensioni dei tubi utilizzati nell'UPLC. Se un campione è superconcentrato, ad esempio riutilizzando in 100 μl di tampone di fosfato di sodio nella fase 3.5 anziché 200 μl, il campione può diventare torbido, indicando che è stata raggiunta una concentrazione critica e che i muropeptidi sono precipitati. Questa perdita di solubilità comporterà l'intasamento del filtro siringa utilizzato nel passaggio 4.4, impedendo la deposizione di muropeptidi nel flaconcino UPLC e /o intasamento dei condotti e della colonna della macchina UPLC, che sono articoli costosi da sostituire. Un cromatogramma di esempio che riflette questa elaborazione aberrante del campione è illustrato nella figura 3; nessun picco eluitato, con conseguente assenza di dati sulla composizione PG. L'errata rettifica del pH ben al di sotto del punto isoelettrico dei muropeptidi(ad esempio ad un pH di 2) può anche comportare la precipitazione di muropeptidi e quindi l'assenza di picchi percepibili dall'analisi UPLC.
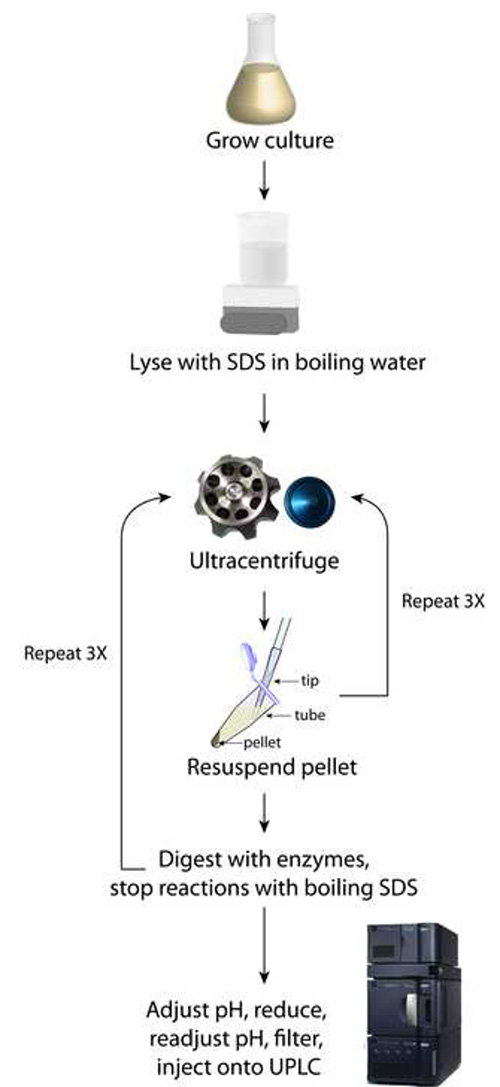
Figura 1. Schema di preparazione sacculi. Questo metodo si basa su cicli iterativi di ultracentrifugazione per purificare l'SDS lontano dai sacculi pellettati.

Figura 2. Esempio di cromatogramma UPLC di PG da sacculi digeriti da cellule E. coli MG1655. Si noti che la risoluzione comparabile di tutti i muropeptidi si ottiene nel 10% del tempo di una tipica corsa HPLC. Etichette muropeptide - M = monomero, D = dimero, T = trimer; (2,3,4,5) indicano il numero di peptidi staminali amminoacidiche; modifiche - G = glicina che sostituisce L-alanina, L = due amminoacidi aggiuntivi dalla scissione della Pronasi E, D = acido 3,3-diaminopimelico (DAP)-DAP, N = terminazione dell'anidro-muropeptide. Ad esempio, D33DL è un dimero con peptidi a gambo 3-aa, collegato attraverso un ponte trasversale DAP-DAP, contenente altri due amminoacidi della scissione pronasi E.

Figura 3. Analisi UPLC non riuscita di sacculi digeriti dalle cellule E. coli MG1655. L'assenza di picchi, che indica che non c'erano muropeptidi presenti nel campione, è dovuta al fatto che i muropeptidi si sono schiantati fuori soluzione prima dell'estrazione in una fiala UPLC (fase 4.4). Questa precipitazione potrebbe essere dovuta a una concentrazione eccessiva dei muropeptidi o al fatto che il pH è troppo basso.
Discussione
Un passaggio critico di questa procedura è il passaggio 3.1 del secondo giorno di preparazione del campione. Se l'SDS è precipitato durante la notte o se i campioni sono stati conservati in SDS al 4% per diverse settimane a temperatura ambiente, i campioni devono essere riboiled per almeno 1 ora per riassolvere l'SDS. Una causa comune per la precipitazione dell'SDS è l'uso di mezzi con sali di potassio, quindi il potassio dovrebbe essere evitato nei mezzi se possibile. Come accennato nella sezione Risultati rappresentativi, è anche fondamentale regolare il pH all'interno del punto isoelettrico dei muropeptidi (~3.5), ma non troppo inferiore al pH 3, o il materiale può precipitare. Infine, la resuspensione del campione deve avvenire nel volume appropriato di tampone di fosfato di sodio (fase 3.5), che deve essere giudicato dal ricercatore. Quando si sceglie il volume di resopensione del tampone di fosfato di sodio, è importante considerare quanto materiale muropeptide può essere generato da una particolare coltura batterica. Ad esempio, se il volume finale della coltura è di 250 ml, come indicato in precedenza, il campione deve essere rimorsipenso in almeno 200 μl di tampone di fosfato di sodio. Se il ricercatore modifica il metodo a colture da 50 ml, i campioni possono essere rimorsi in 100 μl di tampone di fosfato di sodio o meno. Anche la considerazione delle quantità previste di peptidoglycan in una specie è importante; ad esempio, gli sferoplasti E. coli contengono sostanzialmente meno peptidoglycan (circa il 7% della quantità nelle cellule E. coli di tipo selvatico 10), e quindi è appropriata la resuspensione in 100 μl o meno di tampone di fosfato di sodio. Se è difficile coltivare una certa specie batterica o sforzarsi a grandi quantità (250 ml), il volume finale della coltura può essere ridotto e/o la diluizione della coltura notturna può essere ridotta. Infine, l'iniezione su un sistema HPLC richiede un volume minimo di 200 μl, mentre 10 μl è sufficiente per un sistema UPLC.
La purificazione dei componenti PG in diversi organismi o per diverse applicazioni può essere sintonizzata variando il tipo di fase mobile, colonna e gradiente sullo strumento UPLC. Le fasi mobili a base di solventi, come l'acetonitrile, possono essere utilizzate per desalt campioni prima della spettrometria di massa. Possono anche essere necessarie diverse chimiche delle colonne per desalt accuratamente campioni per analisi successive. La figura 2 mostra il profilo di eluizione comune dei muropeptidi per il batterio gram-negativo a forma di asta E. coli MG1655; l'analisi del PG da batteri Gram-positivi e/o specie con altre forme può richiedere una messa a punto del gradiente delineato nel passaggio 4.5. Sebbene gli spettri UPLC come quello mostrato nella figura 2 generino molte classi di informazioni riguardanti il peptidoglycan, come l'identità muropeptide, la percentuale di reticoli e la lunghezza del filamento di glicano, il metodo ha diverse limitazioni, tra cui l'incapacità di mappare la distribuzione spaziale delle caratteristiche strutturali tra i sacculi. Ad esempio, né le posizioni di crossbridging lungo una catena glica né le posizioni delle lipoproteine legate possono essere individuate tramite HPLC o UPLC.
I vantaggi dell'analisi della composizione chimica del PG con HPLC includono una risoluzione più elevata, tempi di analisi più brevi e una quantificazione accurata11 rispetto a tecniche tradizionali come l'analisi degli amminoacidi12-14 o la cromatografia sucarta 15,16. UPLC offre una velocità e una sensibilità più elevate rispetto all'HPLC a causa di pressioni più elevate che consentono flussi più rapidi e quindi tempi di esecuzione più brevi. La risoluzione non viene sacrificata con UPLC, poiché le colonne di dimensione delle particelle inferiori a 2 μm, i rivelatori ad alta frequenza di campionamento e gli iniettori a basso volume sono in grado di resistere a pressioni molto elevate e quindi funzionare conprecisione ad alte velocità 17,18. Ciò si traduce nella capacità di analizzare i volumi del campione dell'ordine di 1 μl in decine di minuti, rispetto a 200 μl e ore per HPLC.
Le tecniche complementari all'UPLC includono l'analisi di massa muropeptide mediante spettrometria di massa. L'UPLC non è una tecnica distruttiva; l'eluito dalla colonna può essere raccolto dopo il rilevamento UV e asciugato utilizzando un evaporatore centrifugo comunemente disponibile nella maggior parte dei laboratori. Sebbene il campione possa essere dissale per prepararlo alla spettrometria di massa (fase 4.5), il desorbimento/ionizzazione laser assistito da matrice - Spettrometria di massa del tempo di volo consente l'analisi senza molta sensibilità alla concentrazione di sale19e fornisce dati di massa in grado di identificare in modo definitivo i muropeptidi. Il costo della preparazione di un campione di parete cellulare per UPLC è di circa $ 6-7, inclusi i costi di enzimi, sostanze chimiche e forniture utilizzate. Dati i suoi costi di gestione economici, l'accessibilità e l'utilità dimostrata per gli studi sulla parete cellulare batterica, UPLC dovrebbe diventare il metodo di scelta per una quantificazione accurata ad alta risoluzione, ad alta produttività e accurata della composizione peptidoglycan in tutto il regno batterico.
Divulgazioni
I costi di produzione per questo articolo sono stati sponsorizzati da Waters Corporation.
Riconoscimenti
Questo lavoro è stato supportato dal New Innovator Award DP2OD006466 (a K.C.H.). Gli autori ringraziano Russell Monds per una dimostrazione pratica del metodo e per le discussioni scientifiche.
Materiali
| Name | Company | Catalog Number | Comments |
| Pronase E | Amresco | E629 | |
| Mutanolysin from Streptomyces | Sigma-Aldrich | M9901 | |
| Sodium borohydride (NaBH4) | Sigma-Aldrich | 452882 | Sodium borohydride is highly reactive and dangerous to handle |
| Orthophosphoric acid | Sigma-Aldrich | 79607 | Orthophosphoric acid is corrosive and dangerous to handle |
| Boric acid | Sigma-Aldrich | 31146 | |
| Sodium azide | Sigma-Aldrich | S2002 | Sodium azide is a poison |
| Sodium tetraborate | Sigma-Aldrich | 221732 | |
| Millex 0.22 μm syringe filters | Fisher | SLGVR04NL | |
| pH strips (pH range 0-6) | Fisher | M95863 | |
| 50 ml polypropylene Falcon tubes | VWR | 21008-951 | |
| 13 mm x 100 mm glass tubes | Kimble Chase | 60CM13 | |
| 12 mm x 32 mm screw neck glass recovery vial | Waters | 186000327C | |
| Sodium Dodecyl Sulfate | Ambion | AM9820 | SDS powder is hazardous |
| Instrumentation | |||
| Waters Acquity UPLC H-Class system, including: | |||
| Acquity UPLC H-Class Sample Manager FTN | |||
| Acquity UPLC H-Class Quaternary Solvent Manager | |||
| Acquity UPLC BEH C18 1.7 µm column | |||
| Acquity UPLC PDA Detector | |||
| Waters Fraction Collector III | |||
| Acquity UPLC 30 cm Column Heater/Cooler |
Riferimenti
- den Blaauwen, T., de Pedro, M. A., Nguyen-Disteche, M., Ayala, J. A. Morphogenesis of rod-shaped sacculi. FEMS Microbiol. Rev. 32, 321-344 (2008).
- Holtje, J. V. Growth of the stress-bearing and shape-maintaining murein sacculus of Escherichia coli. Microbiol. Mol. Biol. Rev. 62, 181-203 (1998).
- Typas, A., Banzhaf, M., Gross, C. A., Vollmer, W. From the regulation of peptidoglycan synthesis to bacterial growth and morphology. Nat. Rev. Microbiol. 10, 123-136 (2011).
- Vollmer, W., Blanot, D., de Pedro, M. A. Peptidoglycan structure and architecture. FEMS Microbiol. Rev. 32, 149-167 (2008).
- Davis, K. M., Weiser, J. N. Modifications to the peptidoglycan backbone help bacteria to establish infection. Infect. Immun. 79, 562-570 (2011).
- Healy, V. L., Lessard, I. A., Roper, D. I., Knox, J. R., Walsh, C. T. Vancomycin resistance in enterococci: reprogramming of the D-ala-D-Ala ligases in bacterial peptidoglycan biosynthesis. Chem. Biol. 7, 109-119 (2000).
- Desmarais, S. M., De Pedro, M. A., Cava, F., Huang, K. C. Peptidoglycan at its peaks: how chromatographic analyses can reveal bacterial cell wall structure and assembly. Mol. Microbiol. 89, 1-13 (2013).
- Glauner, B., Holtje, J., Schwarz, U. The Composition of the murein of Escherichia coli. J. Biol. Chem. 263, 10088-10095 (1988).
- Glauner, B. Separation and quantification of muropeptides with high-performance liquid chromatography. Anal. Biochem. 172 (2), 451-464 (1988).
- Joseleau-Petit, D., Liebart, J. C., Ayala, J. A., D'Ari, R. Unstable Escherichia coli L forms revisited: growth requires peptidoglycan synthesis. J. Bacteriol. 189, 6512-6520 (2007).
- Hakenbeck, R., Holtje, J. V., Labischinski, H. . The target of penicillin: the murein sacculus of bacterial cell walls architecture and growth. , (1983).
- Boylen, C. W., Ensign, J. C. Ratio of teichoic acid and peptidoglycan in cell walls of Bacillus subtilis following spire germination and during vegetative growth. J. Bacteriol. 96, 421-427 (1968).
- Sutow, A. B., Welker, N. E. Chemical composition of the cell walls of Bacillus stearothermophilus. J. Bacteriol. 93, 1452-1457 (1967).
- Wang, W. S., Lundgren, D. G. Peptidoglycan of a chemolithotrophic bacterium, Ferrobacillus ferrooxidans. J. Bacteriol. 95, 1851-1856 (1968).
- de la Rosa, E. J., de Pedro, M. A., Vazquez, D. Penicillin binding proteins: role in initiation of murein synthesis in Escherichia coli. Proc. Natl. Acad. Sci. U.S.A. 82, 5632-5635 (1985).
- Kandler, O., Schleifer, K. H., Dandl, R. Differentiation of Streptococcus faecalis Andrewes and Horder and Streptococcus faecium Orla-Jensen based on the amino acid composition of their murein. J. Bacteriol. 96, 1935-1939 (1968).
- Kumar, A., Saini, G., Nair, A., Sharma, R. UPLC: a preeminent technique in pharmaceutical analysis. Acta Poloniae Pharmaceutica. 69, 371-380 (2012).
- Wilson, I. D., et al. High resolution "ultra performance" liquid chromatography coupled to oa-TOF mass spectrometry as a tool for differential metabolic pathway profiling in functional genomic studies. J. Proteome Res. 4, 591-598 (2005).
- Wieser, A., Schneider, L., Jung, J., Schubert, S. MALDI-TOF MS in microbiological diagnostics-identification of microorganisms and beyond (mini review). Appl. Microbiol. Biotechnol. 93, 965-974 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon