Method Article
I saggi di redditività per le cellule in coltura
In questo articolo
Riepilogo
Composti terapeutici sono spesso prima esaminate in vitro con saggi di vitalità. Conta delle cellule cieche da un osservatore umano può essere molto sensibile alle piccole variazioni di numero di cellulare, ma non valutare la funzione. Test di vitalità computerizzati, come qui descritto, in grado di valutare sia la struttura e la funzione in modo obiettivo.
Abstract
Conta delle cellule manuali su un microscopio sono un mezzo sensibile per valutare la vitalità cellulare, ma sono in termini di tempo e quindi costoso. Test di vitalità computerizzati sono costose in termini di attrezzature, ma può essere più veloce e più obiettivo di conta delle cellule manuali. La presente relazione descrive l'uso di tre di questi test di vitalità. Due di questi saggi sono infrarossi e uno è luminescente. Entrambi i saggi infrarossi si basano su un Imager Odyssey 16 bit. Un saggio infrarossi utilizza la macchia DRAQ5 per nuclei combinati con la macchia zaffiro per citosol e viene visualizzato nel canale 700 nm. L'altra analisi a raggi infrarossi, un In-Cell occidentale, utilizza anticorpi contro le proteine del citoscheletro (α-tubulina o microtubuli proteina associata 2) e le etichette nel canale 800 nm. Il terzo saggio vitalità è un saggio luminescente comunemente usato per ATP, ma usiamo un quarto del volume consigliato di risparmiare sui costi. Queste misurazioni sono affatto lineare e correlazione con il numero di ceLLS placcato, ma variano in sensibilità. Tutti e tre saggi eludere microscopio che richiede tempo e assaggiare l'intero bene, riducendo errore di campionamento. Infine, tutti i saggi possono facilmente essere completata entro un giorno della fine dell'esperimento, consentendo un maggior numero di esperimenti da eseguire entro brevi tempi. Tuttavia, tutti si basano sul presupposto che il numero di cellule rimangono in proporzione alla potenza del segnale dopo il trattamento, un presupposto che a volte non viene soddisfatta, soprattutto per ATP cellulare. Inoltre, se le cellule aumentano o diminuiscono in dimensioni dopo il trattamento, questo potrebbe influenzare la potenza del segnale senza compromettere numero di cellulare. Concludiamo che tutti i saggi di redditività, inclusi i conteggi manuali, risentono di una serie di avvertimenti, ma che i test di vitalità informatici sono ben merita l'investimento iniziale. Utilizzando tutti e tre saggi insieme produce una visione completa della struttura e della funzione cellulare.
Introduzione
Il saggio vitalità più comune nelle scienze biologiche comporta la conta delle cellule. Ciò è dimostrato da un'analisi delle superiori (più recenti) 200 pubblicazioni apparse in PubMed sia con le parole chiave "in vitro" o "cultura" a 2013/04/29 e 2013/04/30. Di queste pubblicazioni, il 23,5% utilizzati saggi di conta delle cellule, compresi i manuali numero di cellulare conteggi, numero di cellulare automatizzata conta con il software di imaging, e Trypan esclusione blu. Il / dosaggio Morto Live è stato usato in 1% di queste pubblicazioni. Il numero di pubblicazioni che utilizzano il MTT (3 - (4,5-dimethylthiazol-2-yl) -2,5-diphenyltetrazolium bromuro) test per la vitalità metabolica era l'11%. Questa rassegna della letteratura mostra anche che il numero di pubblicazioni usando saggi come MTT in combinazione con saggi conteggio cellulare era solo 3,5%. Nonostante la tendenza ad utilizzare un dosaggio vitalità di per sé, la valutazione della funzione cellulare in associazione con il numero di cellule sembra la scelta migliore per valutare i cellularintegrity. Conta delle cellule da soli non sono sufficienti perché le cellule rimanenti non possono essere funzionali o sani anche se sono presenti nel pozzo 1,2. Viceversa, misure funzionali quali ATP possono aumentare o diminuire in assenza di variazioni parallele nel numero di cellule. Il disaccoppiamento di letture metaboliche da numero di cellulare suggerisce che ATP e MTT test non dovrebbero mai essere utilizzati come unico saggio di redditività. Nella presente relazione, tre saggi di vitalità che il sondaggio sia le strutture cellulari e funzione metabolica sono descritti, per una visione più completa della integrità cellulare di qualsiasi test di per sé può permettersi.
Due dei nostri saggi richiedono un Termovisore che misura la fluorescenza nei canali 700 e 800 nm. Il rumore è basso nelle lunghezze d'onda infrarosse, portando a maggiori rapporti 3 segnale-rumore. L'imager Odissea che usiamo ha una gamma dinamica 4,5 log e un po 'profondità di 16, Translating di 2 16 o 65.536 tonalità di infrarossi. Questo può essere contrapposta a immagini a colori a 8 bit, che offre solo 2 8 o 256 tonalità di colore per ogni lunghezza d'onda. Così, a 16 bit di imaging ha una risoluzione più fine. Va notato che le immagini infrarosse originali vengono pseudocolored verde (800 nm) e rosso (700 nm) in rapporti pubblicati per la presentazione. Imager Odyssey sono comunemente utilizzati sia per Western blotting e In-Cell western 4-7. In-Cell western sulle cellule formaldeide-fisso utilizzano anticorpi primari contro qualsiasi proteina di interesse ed etichettarli in giro con anticorpi secondari fluorescenti a raggi infrarossi. Questa tecnica è nota per essere particolarmente utile per gli endpoint fosforilazione 6. Nella nostra In-Cell western, abbiamo macchiare cellule fissate per le proteine del citoscheletro α-tubulina o microtubuli neuronali proteina associata 2 (MAP2) nel canale 800 nm. Queste proteine sono abbastanza abbondanti per produrre elevati rapporti segnale-rumore. Abbiamo anche macchiare i nostri piatti in 700canale nm per nuclei con la macchia DRAQ5 e per il citoplasma con la macchia zaffiro. Entrambe le proteine del citoscheletro e le DRAQ5 + macchie Sapphire riflettono quindi le strutture cellulari.
Il terzo saggio di redditività misura la funzione metabolica e si chiama "Cell Titer Glo." In questo saggio basato luciferasi-, valori di luminescenza sono direttamente proporzionali ai livelli di ATP. Saggi ATP sono comunemente usati per quantificare cellule vitali 8-12. Tuttavia, compresa la parola "titolo" nel nome del saggio è un termine improprio perché ATP uscita per cella può cambiare in funzione di trattamenti tossina e quindi non è sempre proporzionale al numero di cellule 8. Livelli di ATP possono anche essere influenzati da ritmi circadiani 13 e 14 la divisione cellulare e la differenziazione cellulare 15. Tuttavia, il saggio ATP mostrato qui è semplice da eseguire e utile perché ATP è una misura robusta metabolicaredditività 16-21, se non cellulare il numero di per sé. Usando questo test per completare l'infrarosso In-Cell western cede quindi un quadro più completo della integrità cellulare di qualsiasi saggio da solo.
Protocollo
Uno schema dei protocolli è illustrato in Figura 1.
1. Cella di placcatura
Cellule piastra in piastre da 96 pozzetti a diverse densità di placcatura (Figura 2). Per i controlli di linearità sulla linea cellulare di neuroblastoma N2a, piatto 2.5k, 5k, 10k e 15k cellule per pozzetto in 3 o 6 pozzetti / gruppo. Per i controlli di linearità di ratto neuroni corticali primarie, piatto 25k, 50k, 100k, 200k e cellule per pozzetto in 3 o 6 pozzetti / gruppo. Se le linee cellulari o cellule primarie di interesse aspetto sano a diverse densità di placcatura, piastra in e intorno alla densità cellulare ottimale per tale tipo di cellula.
Nota: In questo studio, le cellule N2a sono state placcate in 100 microlitri mezzi e neuroni corticali primarie in 200 microlitri media su piatti che sono progettati per minori evaporazione. Per informazioni dettagliate sulla manipolazione delle cellule, dei media, sieri, antibiotici e trattamenti di tossina, consultare Unnithan et al. per N2a cells 8 e Posimo et al. per le culture corteccia primaria 22.
- Ripetere la placcatura su una seconda piastra a 96 pozzetti. Una piastra sarà saggiato per ATP (Figura 2A) e l'altro con i dosaggi infrarossi (Figura 2B). Non si può usare lo stesso piatto per l'ATP e saggi infrarossi perché le cellule devono essere lisate aperto per le misure di ATP intracellulari.
- Assicurati di piastra almeno 3 pozzi aggiuntivi per sottrazione del fondo nei saggi infrarossi alla densità di placcatura ottimale (colonna 2; Figura 2B).
- Aggiungere supporti senza cellule o, più economico i, acqua sterile per i pozzi esterni nelle righe A e H e nelle colonne 1 e 12. Evitare di fare affidamento su dati provenienti da pozzi lungo i bordi, in quanto la redditività è spesso inferiore qui dagli effetti di evaporazione media e gradienti di temperatura. Tali problemi con micropiastre sono comunemente chiamati effetti di bordo 23,24. Non tenere questi pozzi vuotiperché poi righe B e G e colonne 2 e 11 soffrono dell'effetto bordo.
Effetti di bordo possono essere ridotti incubando una piastra appena seminati a temperatura ambiente in condizioni ambientali prima del trasferimento in CO 2 incubatore 24. Inoltre, un recente studio Carralot descrive un metodo di correzione matematica per micropiastre utilizzando una singola colonna di controllo 23. Oliver e colleghi hanno usato un forzato microtitolazione aria piastra incubatore appositamente progettati per ridurre i gradienti termici 25. Se l'effetto di bordo è particolarmente preoccupanti, camere stabilità micropiastra (ad esempio, BT & C Incorporated) possono essere acquistati per creare un microambiente omogeneo con elevata umidità e perfino gradienti di temperatura. - Se sono necessari più pozzi rispetto mostrato in Figura 1 perché diluizioni dei reagenti supplementari o più densità di placcatura saranno testati, utilizzare i pozzi bordi per sottrazione del fondo.
- Aspettate la notte per l'attaccodi cellule e test la mattina successiva come descritto di seguito.
2. Luminescenti ATP Assay
- Seguire le raccomandazioni del cellulare Titer Glo quelle del per la ricostituzione del substrato con tampone e per i tempi di incubazione.
- Togliere 50 o 150 microlitri supporti da 100 o 200 ml di mezzi di placcatura, rispettivamente. Poco meno di 50 microlitri rimarranno dietro nel pozzo. Aggiungere 25 ml di reagenti (substrato con soluzione tampone) alle colonne 2-6 (Figura 2A) in una diluizione 1:2.
Nota: Variando volumi di supporti lasciati alle spalle dopo la rimozione potrebbe diluire o concentrare i reagenti del dosaggio ATP differenziale di tutti i pozzetti. Fate attenzione a garantire che il livello del liquido in tutti i puntali delle pipette multicanale è equivalente. Misurare il liquido restante nel selezionare pozzetti attraverso la piastra con una pipetta immediatamente prima di aggiungere i reagenti del test ATP per assicurare la precisione. Se l'alta variabilità esiste da differenziali di media evaporzione attraverso la superficie della piastra, rimuovere tutti i vecchi media e aggiungere lo stesso volume di mezzi freschi o tampone fosfato salino (PBS) a tutti i pozzetti immediatamente prima aggiunta di reagenti di saggio ATP. Se le piastre soffrono di livelli variabili di evaporazione, provare a passare alle piastre di evaporazione bassi da Corning Costar. In questi ultimi piastre, i 60 pozzi interni illustrati nella Figura 2 soffrono solo da una media di 0,995% ± 0,41 supporti evaporazione durante la notte. Vi è quindi trascurabile variabilità nel volume del supporto al momento del dosaggio. - Nelle colonne da 7 a 11, le righe B a D, rimuovere il supporto in 50 microlitri lasciare alle spalle, come descritto sopra, e aggiungere 50 ml di reagenti in una diluizione 1:1.
- Nelle colonne da 7 a 11, le righe E a G, lasciare le cellule in 100 microlitri di media e aggiungere 100 ml di reagenti, di nuovo in una diluizione 1:1. La società raccomanda che 100 ml di reagenti devono essere diluiti 1:1 in 100 ml di media.
Nota: Al fine diper risparmiare sui costi, è possibile tagliare queste raccomandazioni sia in volume che in diluizione. Tuttavia, prima di fare questo, assicurarsi che non riduca la linearità e sensibilità del saggio. - Una volta che un volume specifico e fattore di diluizione dei reagenti si trovano ad essere soddisfacenti, bastone con loro in tutti gli esperimenti successivi. I criteri di dati soddisfacenti sono descritti nella sezione dei risultati.
- Reagenti ricostituiti non utilizzati possono essere ricongelati e utilizzati in un secondo momento per risparmiare sui costi. Secondo il costruttore, reagenti ricostituiti possono essere conservati a -20 ° C per 21 settimane con perdita ~ 3% dell'attività.
- Togliere 50 o 150 microlitri supporti da 100 o 200 ml di mezzi di placcatura, rispettivamente. Poco meno di 50 microlitri rimarranno dietro nel pozzo. Aggiungere 25 ml di reagenti (substrato con soluzione tampone) alle colonne 2-6 (Figura 2A) in una diluizione 1:2.
- Posizionare la piastra su un agitatore orbitale per 2 minuti o un agitatore oscillante per 10 min. Se una parte della piastra viene saggiato per una misura diversa e non può essere scosso, agitare il supporto con semplice pipettaggio-up e down solo nei pozzetti di interesse. Tuttavia, bolle eccessivi generati durante questa fase interferiscano con lumiUscita nescent.
- 10 min dopo l'aggiunta dei reagenti, trasferire 60 ml di contenuto e in piastre da 96 pozzetti bianchi. I valori di luminescenza sono più alti in bianco piatti che in lastre trasparenti o neri perché riflettono la luce verso l'alto verso il rivelatore.
Nota: Nella nostra esperienza, le cellule sopravvivono meglio sulla bassa evaporazione, piastre Costar chiare rispetto ad altri piatti. Queste piastre specifici non sono venduti con pareti bianche. In secondo luogo, le lastre opache con pareti chiare e fondo sono più costosi rispetto alle piastre completamente chiari. Se si trasferisce il liquido luminescente a targhe bianche, le piastre bianche possono essere lavati e riutilizzati, risparmiando sul costo delle nuove utilizzando piastre bianche per ogni esperimento. Trasferimento di liquido è quindi la soluzione meno costosa nel lungo periodo. - Pop eventuali bolle d'aria prima della lettura della piastra con un ago o, preferibilmente, con aria forzata da un bulbo trasferimento pipetta di plastica. Leggere la piastra su un luminometro con un tempo di integrazione 1 sec (la società recommends 0,25-1 sec tempo di integrazione sufficiente). Leggere la piastra 10-12 minuti dopo l'aggiunta di reagenti del dosaggio ATP. Il tempismo è fondamentale per il confronto tra diversi piatti, perché il segnale luminescente è transitoria con un tasso di decadimento veloce, come dimostrato da Gilbert e colleghi 26.
- 10 min dopo l'aggiunta dei reagenti, trasferire 60 ml di contenuto e in piastre da 96 pozzetti bianchi. I valori di luminescenza sono più alti in bianco piatti che in lastre trasparenti o neri perché riflettono la luce verso l'alto verso il rivelatore.
- La media dei valori luminescenti dai 3 o 6 pozzetti in ciascun gruppo e trama in funzione del numero di cellule in un grafico a dispersione (vedi Figura 3). Prima di sottrarre la media dei valori di fondo di luminescenza dei pozzi vuoti appropriate (pozzi 2B - 2G, pozzi 11B - 11D, e pozzi 11E - 11G) da ciascun punto dati corrispondente. Ci saranno tre diversi gruppi per ogni densità di placcatura in questo esperimento iniziale (Figura 2A). Livelli di ATP possono essere linearmente correlati con densità cellulari in uno o tutti questi gruppi. Procedere con la più alta diluizione dei reagenti che dà ancora risultati soddisfacenti per risparmiare sui costi. Criteri di risultati soddisfacenti sono descritti in sezione dei risultati.
Nota: Con i supporti utilizzati nel presente studio, i valori di fondo con questo test non sono elevati ed è possibile saltare i pozzetti del bianco. Tuttavia, il produttore Promega riporta le differenze di luminescenza con i media cultura diversa. Il presente studio utilizza Hyclone fetale Clone III, una versione sintetica di siero fetale bovino per le cellule N2a e siero di vitello bovini per colture corticali primarie. Secondo il costruttore, siero di vitello diminuisce valori di luminescenza ma non diminuisce la sensibilità del saggio. Tuttavia, se questo è di rilevante interesse, diluire ATP reagenti di saggio in PBS anziché media al momento del test.- Se le cellule sembrano svilupparsi in modo non uniforme tra le colonne durante la notte, prova a saggiare entro 6 ore di placcatura. Tuttavia, tenere a mente che la densità al solito orario di dosaggio (ad esempio, 24 ore dopo il trattamento) è la densità a cui linearità deve essere raggiunto.
3. Infrared Saggi
- La mattina dopo placcatura, fissare le cellule nella seconda piastra a temperatura ambiente in una cappa aspirante. Assicuratevi di indossare i guanti per questo passaggio e smaltire il fissativo come rifiuto chimico, perché la formaldeide è cancerogena. Aggiungere formaldeide al 4% e il 4% di saccarosio in tampone fosfato 0,1 M ai media esistente in una diluizione 1:1. Il supporto può anche essere lavato con PBS prima di fissare in fissativo piena forza. In entrambi i casi la tecnica funziona bene.
- Incubare in fissativo per 20 minuti e poi rimuovere il fissativo e lavare 3 volte in 200 microlitri di PBS.
- Conservare la piastra in PBS con 0,2% di sodio azide a 4 ° C se il test non avrà luogo lo stesso giorno. Altrimenti, procedere con il test e inserire le cellule in soluzione bloccante per minimizzare il legame non specifico degli anticorpi.
- Diluire il pesce siero Odyssey blocco 1:1 in PBS e aggiungere 0,3% Triton X-100 come permeabilizer cella. Fai la soluzione di saturazione abbastanza così come Antibo primaria e secondariaLe soluzioni dy modo che 35 ml possono essere pipettati in ogni pozzetto. Tuttavia, se un sacco di bolle osservati durante pipettaggio, rendere> 50 microlitri per ogni pozzetto, altrimenti le bolle raggiungono giù nelle cellule e gli anticorpi blocco dal legame. Bolle di sapone eccessive apparirà come un luogo senza macchia circolare al centro del pozzo. Provare a regolare il pipettaggio se questo si verifica.
- Incubare in questa soluzione bloccante per 30-60 min a temperatura ambiente.
Nota: 5% di albumina sierica bovina o sieri normali dalla stessa specie come anticorpo secondario possono essere utilizzati anche come blocco soluzioni per risparmiare sul costo del blocco siero pesce. Blocco soluzioni in grado di influire sulle prestazioni degli anticorpi. Pertanto, il blocco ottimale per ciascun anticorpo è meglio determinato empiricamente.
Nota: alcuni ricercatori collocano In-Cell piatti occidentali sul agitatori durante l'incubazione. Tuttavia, questo non è necessario.
- Rendere gli anticorpi primari: 1:10.000 diluizione per l'anti-α-tubulina(Monoclonale di topo, Tabella 1) e 1:2.000 diluizione per anti-MAP2 (monoclonale di topo, tabella 1). Questi anticorpi sono specifici per le proteine di interesse in questi modelli cellulari; specificità è essenziale per qualsiasi macchia immunocitochimica.
Nota: MAP2 è un marcatore per i neuroni ed è adatto per colture neuronali / gliali miste. Le culture postnatali qui riportati contengono anche alcune glia (~ 25%) perché astrociti sembrano primo giorno embrionale 18, con i loro numeri picco nei primi anni del periodo neonatale 27,28. Non si può distinguere tra astrociti e neuroni nel ATP e DRAQ5 + Sapphire saggi. Per misurare neuroni e astrociti separatamente, utilizzare MAP2 simultanea e GFAP colorazione nei canali 800 e 700 nm, come descritto da Mullett e colleghi 4,29, tralasciando DRAQ5 + zaffiro. Tuttavia, se tutte le cellule nella coltura desiderano essere valutata, utilizzare un marcatore pan-cellulare come α-tubulina, β-actina, o GAPDH.
Nota: Queste diluizioni sono stati ottimizzati per il N2a e cellule corticali primarie e non possono generalizzare ad ogni modello. Pertanto, provare almeno due diluizioni principali anticorpi, una sulla metà sinistra del piatto e uno nella metà destra (vedi Figura 2B). In alternativa, provate 3-4 diluizioni di anticorpi primari su 3 pozzetti ciascuno. Ad esempio, la diluizione raccomandata sul foglio inserto anticorpo può essere accompagnata da cambiamenti duplici. In altre parole, se la diluizione raccomandata per immunocitochimica è 1:500, 1:250 e provare anche 1/1.000 fattori di diluizione.- Diluire gli anticorpi 1:1 blocco Odyssey: PBS e aggiungere 0,3% Triton-X. Per risparmiare sui costi, rendere gli anticorpi nella soluzione bloccante che è stato applicato alle celle nel passo 3.2.1 rimuovendo questa soluzione al termine dell'incubazione. Mantenere le cellule in PBS mentre si fa questo, non devono asciugare.
- Incubare in anticorpi primari o 1-2 ore a temperatura ambiente o per una notte a 4 ° C. Per debolmente binding anticorpi e proteine che non sono abbondanti, incubazioni overnight possono contribuire ad aumentare il segnale.
Nota: Lasciare almeno 3 pozzi nel bloccare soluzione per la sottrazione del fondo per ogni concentrazione anticorpo secondario (pozzi 2B-2D e pozzi 2E-2G in Figura 2B). Non esporre questi pozzi a qualsiasi anticorpo primario di sorta. Essi rivelano il grado di legame non specifico per l'anticorpo secondario e sono utili per i calcoli di rapporti segnale-rumore. Se c'è una preoccupazione che gli anticorpi secondari porterà ad alti livelli di legame non specifico, comprendere anche pozzetti di controllo che non sono esposte all'anticorpo primario o secondario ma ricevono lo stesso numero di lavaggi. La differenza tra questi pozzetti e le "secondario solo" pozzi rivelerà il grado di legame non specifico causato dal anticorpo secondario solo. Nel nostro test su cellule di topo N2a, intensità del segnale con l'anticorpo secondario anti-topo alone era 0,557 ± 0,032, il segnale con anti-conigliosolo anticorpo secondario era 0,533 ± 0,041, segnale senza anticorpo secondario è stato 0,357 ± 0,003, e il segnale con anticorpi primari e secondari era 11,867 ± 0,911. Non abbiamo così constatato alti livelli di legame non specifico anche quando si utilizza anticorpi secondari anti-topo su cellule di topo. Ci sono diversi produttori di anticorpi secondari infrarossi; si consiglia di acquistare solo quelli altamente cross-adsorbite. Si noti che la concentrazione di anticorpi secondari IgG può variare a seconda della fonte.
- Lavare anticorpi primari con 3 lavaggi di 200 microlitri di PBS per pozzetto, 10 min ciascuno. Gli anticorpi primari possono essere salvati a 4 ° C per un paio di settimane nello 0,2% di sodio azide e riutilizzati fino a minuscoli granelli di detriti diventano evidenti quando le soluzioni sono tenuti fino alla luce. Questo viene fatto solo per risparmiare sui costi. Se il costo non è un problema, gli anticorpi freschi per ogni uso.
- Diluire l'anticorpo secondario da 1:1.000 o 1:2.000 1:1 blocco Odyssey: PBS con 0,3% Triton-X (Figura 2B). Aggiungere la diluizione 1:1000 per la metà superiore della piastra e 1:2.000 per la metà inferiore della piastra. Tali concentrazioni potrebbero essere ulteriormente ridotti per risparmiare sui costi, ma verificare la linearità prima di impegnarsi in questo.
Nota: Assicurarsi di aggiungere la soluzione di anticorpo secondario appropriato sfondo pozzetti di sottrazione (colonna 2 nella Figura 2B).- Se una seconda proteina verrà saggiata in luogo di DRAQ5 + zaffiro, cellule etichetta per α-tubulina o MAP2 con 700 nm di capra anti-IgG di topo e la seconda proteina nel canale 800 nm con anticorpi primari da una specie diversa mouse. Il canale nm 800 ha meno di fondo rispetto al canale 700 nm e dovrebbe essere riservato per la proteina più critico di interesse.
- Incubare in anticorpi secondari per 1 ora a temperatura ambiente in un cassetto al riparo dalla luce.
- Lavare anticorpi secondari con 3 lavaggi di 200 microlitri di PBS per pozzetto, 10 minuti ciascuno.
- Effettuare le soluzioni DRAQ5 + Sapphire. Per la metà sinistra del piatto, diluire DRAQ5 1:10.000 (0,5 micron concentrazione finale) e Sapphire 1:1000 in PBS con 0,3% Triton-X (colonne 3-6, Figura 2B). Per la metà destra del piatto, diluire DRAQ5 1:20.000 (0,25 micron) e Sapphire 1:2000 (colonne 7-10; Figura 2b).
Nota: DRAQ5 utilizzato per essere venduto ad un archivio di 1 mm invece di uno stock di 5 mm. Alcuni rapporti pubblicati in precedenza utilizzati, pertanto 1:4,000 o 1:2.000 diluizioni di DRAQ5 8.- Per risparmiare sui costi, se due piastre vengono dosati contemporaneamente, le stesse soluzioni zaffiro DRAQ5 + possono essere utilizzati sulle due piastre in sequenza, pipettando fuori la prima piastra e aggiungendolo al secondo. Se vengono utilizzati due volte le stesse soluzioni in questo modo, usarli entro un giorno. Le soluzioni DRAQ5 diluito + Sapphire non possono essere salvate a 4 ° C o congelati per un uso successivo.
- Incubare in queste soluzioni per 30 minuti a temperatura ambiente lontano fluce rom. Se il tempo è breve e le DRAQ5 + soluzioni Sapphire non viene riutilizzato in altre lastre con differenti secondari, aggiungere queste macchie alle soluzioni anticorpo secondario nel passaggio 3.5 e incubare per 1 ora.
Nota: Non aggiungere DRAQ5 soluzione + Sapphire a sfondo pozzetti di sottrazione (colonna 2 nella figura 2B), come questi pozzi non devono essere colorati nel canale 700 nm.
- Lavare le piastre 3x con 200 microlitri di PBS per pozzetto per 10 minuti ciascuno. Mettere 0,2% di sodio azide nel lavaggio finale PBS se il piatto sta per essere colorate con altri anticorpi secondari visibile raggio dopo l'imaging a raggi infrarossi è completa.
- Scansione la piastra su un Odyssey Imager. Iniziare la scansione le piastre a intensità 5 e 169 mm risoluzione. O "qualità media" o impostazioni "bassa qualità" sono sufficienti. La società non rilascia informazioni sul filtro di eccitazione / emissione dettagliata. Tuttavia, i filtri di emissione sono larghi circa 20 nm e sono centrati intorno a 720 e 820 nm, secondo il produttore.
Nota: È possibile eseguire la scansione di lastre mentre ancora bagnato, gli investigatori potrebbero voler continuare a macchiare con altri marcatori. Tuttavia, l'azienda suggerisce nel suo protocollo online che lastre secche producono meno spread segnale ben-to-bene. Se li si esegue la scansione sia bagnato e poi asciutto per confrontare i dati, assicurarsi di rimuovere tutta la PBS dal bene perché rimanenti sali dopo l'evaporazione può portare a sfondo alta fluorescenza lungo i bordi.- L'Odissea Imager scansiona e attraverso il fondo della piastra. Piastre di produttori diversi possono richiedere diversi offset fuoco perché il fondo dei pozzetti può variare nel loro spessore e profondità nella piastra. Prova di scansione a diversi offset di messa a fuoco e vedere dove il più alto rapporto segnale-rumore e nitidissime (più a fuoco) segnale viene raggiunto: 2,5 millimetri, 3,0 millimetri, 3,5 millimetri, 4,0 millimetri. Prova anche per misurare la profondità del pozzo dal fondo di un piatto con un righello per confermare la Findings sulla Odyssey. Si ricordi che la plastica nel fondo del pozzo può aggiungere altezza supplementare alle misure del righello. Le piastre Costar utilizzati nel presente studio richiedono uno spostamento di 4,0 mm Messa.
- Utilizzare la funzione Occidentale In-Cell nel software per posizionare la griglia di giuste dimensioni sull'immagine della piastra ed esportare i dati in Microsoft Excel. Esaminare i valori "integrati intensità" degli stessi pozzi attraverso diversi spostamenti di messa a fuoco per trovare i valori di fluorescenza più alti. Il focus di offset che produce il più alto rapporto segnale-rumore (segnale in pozzi immunostained contro "non primari di controllo negativo" pozzi) è quello di scegliere in futuro.
- Una volta compensare una messa a fuoco è decisa, eseguire nuovamente la scansione con incrementi più piccoli. Ad esempio, se il segnale luminoso era a 3,5 e 4,0 millimetri, provare a scansione a 3.6, 3.7, 3.8 e 3,9 millimetri e vedere se c'è qualche ulteriore miglioramento della potenza del segnale. Se l'offset attenzione è sbagliato, intensità di segnale attraverso le 12 colonne su un pl vuotomangiato (quando tutte le colonne devono avere parità di segnale) apparirà come una curva a forma di U invece di una linea piatta. Se questo continua ad essere un problema con piatti di plastica, provare a lastre di fondo di vetro.
- Sottrarre la media delle intensità integrate nei precedenti sottrazione pozzetti (Figura 2B; pozzi 2B - 2D o pozzi 2E - 2G) da ogni punto dati corrispondente nei canali 700 e 800 nm. Poi la media delle intensità di segnale integrati per ogni gruppo di pozzi. Tracciare i dati come una dispersione contro densità cellulare (vedi Figura 3).
- Confrontare i risultati dei due differenti diluizioni di anticorpi primari e secondari e dei risultati delle due diverse diluizioni di DRAQ5 + zaffiro di stabilirsi su una diluizione ciascuno per esperimenti successivi. Se la linearità non è raggiunto, provare la scansione a una diversa intensità. Ripetete la scansione con intensità di 3 e 7 invece di 5 e rianalizzare i dati. Se i dati migliorano in uno di quei intensità manon sono ancora soddisfacenti, ripetere la scansione con incrementi intorno a tale intensità.
- Fare attenzione a non analizzare le immagini in cui il software mostra macchie bianche nei pozzetti; quei punti significano segnale satura di fuori della gamma della termocamera. Scansione ad una minore intensità se questo si verifica.
- Se la linearità non è raggiunto, anche cercare di fissare le cellule entro 6 ore di placcatura perché potrebbero crescere o morire in modo non uniforme nelle diverse colonne durante la notte. Prova anche a diverse densità di placcatura, diverse intensità di scansione, ulteriori ottimizzazioni dei fattori di diluizione dei reagenti, lastre fondo di vetro, DRAQ5 da solo come una macchia unico nucleo-, o diversi anticorpi diversi da quelli anti-α-tubulina o anti-MAP2.
Risultati
Il fattore limitante in questi esperimenti è la colorazione infrarossi, come il saggio ATP è relativamente breve durata. Per i saggi infrarossi, anticipiamo che otto piastre da 96 pozzetti possono essere colorati e scansione entro un giorno incredibile cifra di due lotti di quattro piastre ciascuno (vedi Figura 1). Questa stima assume 20 min di fissazione, 30 min di lavaggio, 30 min di blocco, 2 ore di incubazione anticorpo primario seguita da 30 minuti di lavaggi, 1 ora di incubazione anticorpo secondario seguito da 30 minuti di lavaggi, 30 min DRAQ5 + Sapphire seguita da 30 min di lavaggi, e 34 min di tempo di scansione per 4 piatti. Quindici minuti supplementari sono presi in Figura 1 per lavaggi al fine di spiegare la pipettaggio scaglionato in quattro piatti individuali. Tempo per l'analisi dei dati non è incluso in questa stima. Se si verificano ATP misurazioni saggio in parallelo per ogni piastra infrarossi, dodici piastre possono essere dosati in un giorno - sei per la macchia infrarossis e sei per livelli di ATP.
Criteri di dati soddisfacenti nelle analisi di regressione (Figura 3), come indicato nella sezione protocollo, includono una significativa correlazione tra la densità di placcatura e la potenza del segnale (a due code p ≤ 0,05). La dimensione delle variazioni di luminescenza o segnale infrarosso dovrebbe anche essere in proporzione alle variazioni di numero di cellule. Idealmente, le cellule 5k dovrebbero avere circa la metà della luminescenza o livelli di ATP di cellule 10k, 15k e le cellule devono avere valori di circa il 50% superiori a 10k cellule, ecc. Questo proporzionalità riflette la sensibilità del test ed è distinto dal valore R 2 o coefficiente di determinazione. R 2 solo misure quanto bene la retta di regressione approssima i punti dati veri. Anche se i dati sono lineari, le relative variazioni di intensità del segnale non possono essere in proporzione alla grandezza dei cambiamenti nel numero di cellule. Ciò può accadere wgallina la linea di regressione ha un elevato R 2 ma una bassa pendenza, suggerendo che il test non è molto sensibile. Pertanto, i criteri di correlazione significativa e proporzionalità dei dati devono essere entrambi soddisfatti. Infine, le variazioni di intensità del segnale intorno alla densità ottimale placcatura dovrebbero rientrare nel range dinamico dello strumento e il saggio. La gamma dinamica è il rapporto tra i valori massimo e minimo possibili. L'imager Odyssey ha una gamma dinamica 4,5 log e segnale saturato presenta come un colore bianco brillante al posto del solito colore rosso o verde per allertare il ricercatore che i risultati non sono quantificabili. L'intervallo dinamico durante il saggio stesso è ristretta a causa di problemi quali la massima e minima densità di placcatura per un dato tipo di cellula. Se uno piastre a crescente densità delle cellule, la curva di saturazione per questi test rivelerà la densità di placcatura di sopra del quale ulteriori differenze possono essere risolti, o perché sono fuorigamma della termocamera o perché le cellule non sopravvivono l'affollamento durante la notte. Allo stesso modo, se uno piastre diminuire la densità delle celle, si può misurare la densità minime cellulari di sotto del quale non ci sono ulteriori cambiamenti nel segnale. Il range dinamico del dosaggio comprende solo le densità di placcatura tra il minimo e massimo numero di cellule / pozzetto che può essere risolto. Non abbiamo misurato la gamma dinamica di questi saggi particolari perché le nostre cellule non sopravvivono bene a densità di là di quelli che sono segnalati.
Dopo l'ottimizzazione, ora colorare le cellule di neuroblastoma di topo N2a anti-α-tubulina a una diluizione 1:10.000, con anti-topo IgG a una diluizione 1:2000, e con le soluzioni DRAQ5 + Sapphire a 1:20.000 e 1:2.000, rispettivamente. Usiamo anche 25 microlitri di reagenti del dosaggio ATP in 50 microlitri mezzi di comunicazione. I risultati in queste condizioni sono illustrate nelle figure 3A, B, e C e sono stati pubblicati before 8. Potenza del segnale in tutti e tre i test era significativamente correlata con il numero di cellule per pozzetto. Sebbene tutte e tre saggi erano altamente lineare, non erano equivalenti in sensibilità. Per esempio, le cellule per pozzetto 5k non hanno esattamente la metà della quantità di colorazione infrarossi 10k cellule per pozzetto. In contrasto con i saggi infrarossi, il saggio ATP era più sensibile alle variazioni di densità di placcatura. In altre parole, luminescenza è sceso di circa la metà da 10k a 5k e da 5k a 2.5k cellule per bene. Nonostante questi risultati sulla più alta sensibilità del test ATP, si consiglia di eseguire tutti e tre i saggi di redditività per avere un quadro più ampio della salute cellulare.
Ora macchia colture primarie neuronali di ratto con anti-MAP2 a una diluizione 1:2.000, con IgG anti-topo a una diluizione 1:1000, e con le soluzioni DRAQ5 + Sapphire a 1:10.000 e 1:1.000, rispettivamente, e utilizziamo 25 microlitri di reagenti del dosaggio ATP in 50 microlitri mezzi (figure3D, E, e F). Potenza del segnale in DRAQ5 + saggio zaffiro era il meno lineare di tutti e tre i saggi perché c'era poca differenza tra 100k e 200k cellule per pozzetto nel canale 700 nm. Tuttavia, la potenza del segnale a 700 nm era ben in proporzione al numero di cellulare al di sotto 100k cellule per bene e abbiamo sempre piastra colture neuronali a 100k cellule per bene comunque. Tuttavia, abbiamo anche osservato che il DRAQ5 + test Sapphire non è così sensibile ai trattamenti di tossina come gli altri due saggi (vedi sotto). In contrasto DRAQ5 + zaffiro, potenza del segnale era migliore proporzione con densità di placcatura sia per il MAP2 e saggi ATP. Va notato che un maggior volume dei reagenti del dosaggio ATP può migliorare i risultati a 200k cellule per pozzetto. In altre parole, l'uscita luminescente può essere sollevato esattamente 200% dei valori in 100k cellule per pozzetto perché c'è più reattivo. Tuttavia, non abbiamo mai piastra colture corticali in quella ad alta densità di placcatura per experimenti. Abbiamo anche scoperto che i livelli MAP2 e ATP sono sensibili al 20% cambiamenti nella neocorticale densità di placcatura neuronale, che vanno da 20k cellule per bene a 120k cellule per ben 22. Tuttavia, altri ricercatori dovrebbero provare questi test nel proprio laboratorio, piuttosto che in base alle condizioni ottimali dai nostri esperimenti a causa della variabilità inter-laboratorio nel tessuto e la manipolazione delle cellule.
Al fine di illustrare l'utilità di questi saggi seguenti trattamenti con tossine, mostriamo curve dose-risposta di cellule N2a trattate con MG132, un inibitore del proteasoma (Figura 4). MG132 è stato applicato in presenza o assenza del glutatione precursore N-acetil cisteina. Questi dati possono anche essere trovati nel nostro recente pubblicazione sugli effetti protettivi di N-acetil cisteina 30. Le cellule sono stati analizzati 48 ore seguenti trattamenti MG132. MG132 diminuzione dose-dipendente segnale DRAQ5 + zaffiro (Figure 4A, D) e segnale α-tubulina ( Figure 4B, E). Condotta un'analisi di regressione lineare per estrarre valori di IC 50 in assenza o in presenza di N-acetil cisteina. L'equazione utilizzata era Y = 100 / (1 + 10 ^ ((logica 50-X) * versante))). Il valore IC 50 per DRAQ5 + Sapphire era 1,64 micron MG132 (logica 50 = 0,22 ± 0,03, R 2 = 0,9477, Hill pendenza = -1,26) e per i livelli di α-tubulina è stato 1.96 micron MG132 (logica 50 = 0,29 ± 0,04, R 2 = 0,9296, Hill pendenza = -1,349). N-acetil cisteina spostato le curve a destra, suggerendo che più MG132 era necessaria per uccidere le cellule in presenza di questo composto protettivo. In presenza di N-acetil cisteina, il valore IC50 per DRAQ5 + zaffiro era 4,64 pM MG132 (logica 50 = 0,67 ± 0,05, R 2 = 0,8732, Hill pendenza = -1.06) e α-tubulina era 6,35 pM MG132 ( Logic 50 = 0,80 ± 0,04, R 2 = 0,8802, Hill pendenza = -10,382). Uno studio delle cellule N2a da Madeira e colleghi ha riportato la perdita di circa il 50% della redditività a 10 micron MG132, come misurato dal test MTT 31. Fioriti riferito perdita del 60% di vitalità 4 ore dopo il trattamento con 50 mM MG132, di nuovo con il saggio MTT 32. Infine, Zhang e colleghi hanno riportato la perdita del 60% della redditività a 10 micron MG132, utilizzando conti di nuclei Hoechst-macchiati 33. Questi IC 50 valori sono superiori ai nostri. Tuttavia, abbiamo saggio per la vitalità 48 ore dopo l'inizio del trattamento, a differenza di questi studi precedenti.
Secondo Cell Titer Glo dosaggio, i livelli di ATP sono stati sollevati a basse concentrazioni di MG132 (Figura 4C), dimostrando che i livelli di ATP non sono necessariamente in proporzione al titolo cellulare dopo trattamento. I dati ATP sono comunque utili in quanto mostrano che N-acetil cisteina protegge anche la funzione metabolica quando le cellule N2a sono trattate con MG132. Ciò è evidenziato in tsi sposta nel valore IC50 di MG132 con N-acetil cisteina. Il valore di IC50 per l'ATP era 3.05 micron MG132 (logica 50 = 0.48 ± 0.07, R 2 = 0,8616, Hill pendenza = -1.0) con veicoli e 9.12 micron MG132 con N-acetil cisteina (logica 50 = 0,96 ± 0,04, R 2 = 0,9261, Hill pendenza = -1.0). Si noti che le concentrazioni che hanno portato alla rialzi ATP sono stati esclusi in questa analisi. Compresi tutti i valori nell'analisi abbassato il coefficiente di determinazione e l'aumento dei valori di IC 50 a 4.03 micron MG132 (logica 50 = 0,61 ± 0,09, R 2 = 0,7224, Hill Pendenza = -1.4) in presenza di veicolo e di 9.24 micron MG132 (logica 50 = 0,96 ± 0,07, R 2 = 0,6607, Hill Slope = -2.1) in presenza di N-acetil cisteina (contrasto con la Figura 4C).
Un secondo esempio di questi tre saggi è illustrato per colture primarie Figure 5. Tessuto è stato in paraffina da ratto neocorteccia e allocortex, dissociato, placcato a 100k cellule per pozzetto, e trattate in parallelo con H 2 O 2. Abbiamo testato l'ipotesi che queste due regioni cerebrali sarebbero differiscono nella loro manipolazione dello stress ossidativo come sono differenzialmente vulnerabili alle malattie neurodegenerative 34-39. Alcuni di questi dati sono stati pubblicati prima e i risultati sono discussi ulteriormente in questo studio 22. I valori di IC 50 per DRAQ5 + Sapphire erano 22,84 mM H 2 O 2 a neocorteccia (logica 50 = 1.36 ± 0.07, R 2 = 0,7552, Hill pendenza = -0.95) e 24.63 mM H 2 O 2 a allocortex (logica 50 = 1.39 ± 0,03, R 2 = 0,9379, Hill pendenza = -1,74). I valori di IC 50 per MAP2 erano 11.66 mM H 2 O 2 nella neocorteccia (logica 50 = 1,07 ± 0,04, R 2 = 0,9332, Hill pendenza = -2,13) e 29,76 mM H 2 O 2 a allocortex (logica 50 = 1,47 ± 0,04, R 2 = 0,8934, Hill pendenza = -4.45). I valori di IC 50 per l'ATP erano 23,82 mM H 2 O 2 a neocorteccia (logica 50 = 1.38 ± 0.03, R 2 = 0,8907, Hill pendenza = -2,56) e 44,5 mM H 2 O 2 a allocortex (logica 50 = 1.65 ± 0.03 , R 2 = 0,9204, Hill pendenza = -2,71). Allocortex era significativamente più resistenti allo stress ossidativo che neocorteccia a concentrazioni di H 2 O 2 al di sotto 50 pm, ma il DRAQ5 + saggio zaffiro è il meno sensibile illustrare questa differenza. Ciò può riflettere che quest'ultimo test non può distinguere glia dai neuroni, a differenza MAP2. Come accennato in precedenza, le nostre culture contengono alcuni glia, in quanto vengono raccolte dal cervello postnatale 22. Sorprendentemente, ad alte concentrazioni di H 2 O 2 (75 mM e sopra), quando tutti MAP2 + Neuroni sembrava essere morto, il DRAQ5 + test Sapphire ha rivelato che allocortex era meno resistente neocorteccia. Sulla base dei nostri risultati preliminari che GFAP + astrociti in queste culture sono più resistenti alla H 2 O 2 rispetto MAP2 + neuroni (non mostrato), ipotizziamo che gli astrociti corticali sono meno vulnerabili al danno ossidativo di astrociti allocortical. Questo modello può essere riflessa nel DRAQ5 + test Sapphire, ma non il dosaggio ATP perché gli astrociti ossidativamente danneggiate non sono metabolicamente vitali. Qualunque sia la ragione di questi modelli sorprendenti, questi dati colture primarie sono illustrati qui solo per rivelare che i saggi non sono sempre d'accordo.
Infine, al fine di illustrare la variabilità interplacca con tutte e tre saggi, abbiamo tracciato punti di dati grezzi, secondo e terzo Wells dalle curve dose-risposta succitate figure 6A-C e 6G-I >. Allo stesso modo, al fine di illustrare la variabilità interplate, abbiamo tracciato la media di punti di dati grezzi (la media dei pozzetti in triplicato) da due piastre in Figure 6D-F e 6J-L. Potenza del segnale in pozzi replicare e di tutti esperimenti indipendenti esposto correlazioni significative per ogni misura. C'era una certa variabilità nei valori grezzi attraverso esperimenti indipendenti in colture neuronali primarie, forse perché noi riutilizziamo anticorpi vecchi e soluzioni DRAQ5 + Sapphire e ricongelare test ATP inutilizzata dei reagenti un paio di volte. Un'altra ragione per la variabilità interplate superiore in colture primarie può essere la qualità della cultura stessa. Diversi intervalli post-mortem e la manipolazione dei tessuti attraverso diversi giorni sperimentali possono contribuire alla varianza.
jpg "/>
Figura 1. Illustrazione schematica di tutti e tre i test di vitalità (A) e calendario dei test a raggi infrarossi (B). Mostrato sono le procedure raccomandate per le cellule N2a. Se le soluzioni DRAQ5 + Sapphire non stanno per essere riutilizzati su altri piatti che si sono macchiati con anticorpi secondari diversi, che possono essere combinati con la soluzione di anticorpo secondario anti-mouse per un finale di 1 ora di incubazione, riducendo la procedura di un passo. Clicca qui per vedere l'immagine ingrandita.
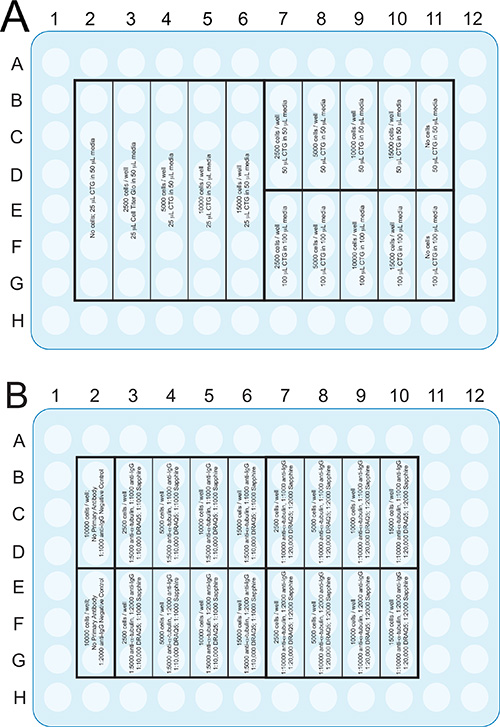
Figura 2. Formato piastra del saggio ATP (A) e saggi infrarossi (B) descritti nella sezione Procedure. SebbenePiastra a 96 pozzetti è illustrato, questi test possono essere adattati in altri formati, come ad esempio 384 pozzetti, per risparmiare sui reagenti e cellule. Clicca qui per vedere l'immagine ingrandita.
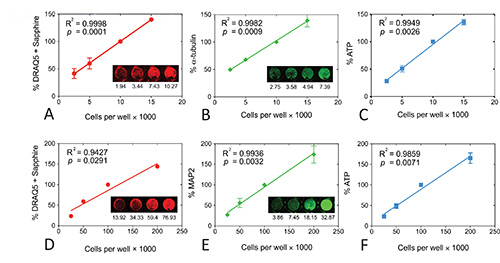
Figura 3. Regressioni lineari per tutti e tre i test di vitalità nelle cellule di neuroblastoma di topo N2a (A, B, C) o postnatali primari di ratto neuroni corticali (D, E, F). Potenza del segnale per ogni test è tracciata in funzione della densità di placcatura. Riquadri mostrano immagini rappresentative infrarossi del DRAQ5 + zaffiro (A, D), α-tubulina (B), o MAP2 (E) macchia. Valori di intensità prime sono elencate sotto ogni immagine. Si noti che i valori grezzi inun ben individuo può essere differente dalla media di 3 pozzi per l'esperimento e dalla media di 3-4 esperimenti indipendenti. Le immagini a infrarossi originali sono stati pseudocolored rosso (700 nm) o verde (800 nm). Ogni esperimento è stato condotto in pozzetti in triplicato e 3x ripetuto per DRAQ5 + Sapphire in entrambe le cellule N2a e neuroni primari, 3x per α-tubulina, 4x per MAP2, 3x di ATP nelle cellule N2a, e 4x per ATP nei neuroni. I dati dai pozzetti in triplicato sono stati mediati per un valore finale per ciascuna di 3-4 esperimenti. La media e la SEM di questi valori 3-4 finale è mostrato nel grafico. Si noti che i valori DRAQ5 + Sapphire presentano deviazioni standard bassi in modo che SEM barre non sono visibili. Il coefficiente R 2 di determinazione e di due valori p code valutare l'importanza della correlazione sono anche illustrato per ogni misura. I dati sono stati analizzati in GraphPad Prism (versione 5.0). Ristampato da Neurochimica internazionale, 61, da Unnithun et al: "Salvataggio da due hit modello high-throughput di neurodegenerazione con N-acetil cisteina," p 356-368, con il permesso di Elsevier. Clicca qui per vedere l'immagine ingrandita.

Figura 4. Protezione delle cellule N2a contro la tossicità MG132. N2a cellule sono state trattate con concentrazioni indicate di MG132 inibitore del proteasoma in presenza o assenza del antiossidante N-acetil cisteina (NAC, 3 mM). Tutti e tre i test di vitalità sono stati eseguiti 48 ore più tardi. Nota l'aumento dei livelli di ATP a basse concentrazioni di MG132 (C). Nessun aumento parallelo colorazione DRAQ5 + Sapphire (A) or α-tubulina (B) era evidente. Immagini a infrarossi rappresentativi della DRAQ5 + Zaffiro e macchie α-tubulina sono stati pseudocolored rosso e verde in D ed E, rispettivamente. Ogni esperimento è stato condotto in pozzetti in triplicato e 4x ripetuto per DRAQ5 + Sapphire, 4x per α-tubulina, e 3x per ATP. I dati dai pozzetti in triplicato sono stati mediati per un valore finale per ciascuna di 3-4 esperimenti. Di seguito riportiamo la media e SEM di questi 3-4 valori finali. * P ≤ 0,05 per il confronto di N-acetil cisteina contro l'acqua, correzione di Bonferroni seguente ANOVA a due vie. I dati sono stati analizzati in GraphPad Prism (versione 5.0). Ristampato da Neuroscience, 255, da Jiang et al: "N-acetil cisteina ottunde proteotoxicity in un calore di shock proteina-dipendente modo," p 19-32, con il permesso di Elsevier. Cleccare qui per vedere l'immagine ingrandita.
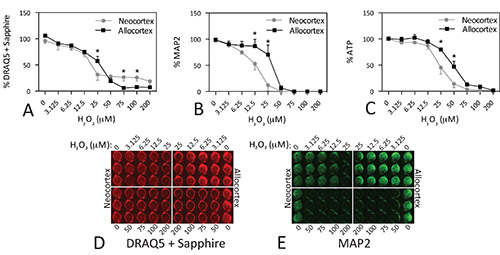
Figura 5. Vulnerabilità differenziale di culture neocorticali e allocortical alla tossicità perossido di idrogeno. Microdissections di motoria primaria postnatale e neocorteccia sensoriale e di allocortex entorinale e piriforme erano dissociate e piastrate a 100k cellule per bene. Il giorno in vitro 2, le cellule sono state trattate con concentrazioni di H 2 O 2 indicati. Le piastre sono stati analizzati 48 ore più tardi. Si noti che allocortex sopravvive queste condizioni di coltura meglio di neocorteccia ed ha il numero di cellule più elevati al basale. Ogni esperimento è stato condotto in pozzetti in triplicato e 4x ripetuto per DRAQ5 + Sapphire, 3x per MAP2, e 6x per ATP. I dati dai pozzetti in triplicato sono stati mediatiper un valore finale per ciascuno di 3-6 esperimenti. Di seguito riportiamo la media e SEM di questi 3-6 valori finali. * P ≤ 0,05 per il confronto di neo-versus allocortex, correzione di Bonferroni seguente ANOVA a due vie. I dati sono stati analizzati in GraphPad Prism (versione 5.0). Clicca qui per vedere l'immagine ingrandita.

Figura 6. Correlazioni intraplacca e Interplate per MG132 e H 2 O curve di risposta 2 dosi in cellule N2a e neuroni corticali. Tutti i singoli esperimenti sono stati eseguiti in pozzetti in triplicato. I dati grezzi provenienti dai secondi due pozzetti all'interno di ciascun gruppo sono stati tracciati come replica 1 e 2 per misurare riproducibilità entro le piastre (A, B e C per le cellule N2a e G, H e I per la corteccia). Dati dagli stessi gruppi di due esperimenti indipendenti (la media dei pozzetti in triplicato) sono stati rappresentati come piastra 1 e piastra 2 per misurare la riproducibilità tra piastre (D, E, e F per le cellule N2a e J, K, L per la corteccia). Il coefficiente R 2 di determinazione e di due valori p code valutare l'importanza della correlazione sono anche illustrato per ogni misura. I dati sono stati analizzati in GraphPad Prism (versione 5.0). Clicca qui per vedere l'immagine ingrandita.
Discussione
Abbiamo scoperto che la potenza del segnale in tutte e tre saggi di vitalità è lineare e correlazione con la densità di placcatura. Tuttavia, non tutti i saggi sono ugualmente sensibili a 2 volte o cambiamenti di 1,5 volte in densità di placcatura. Per le cellule N2a, i saggi infrarossi sono meno sensibili di dosaggio ATP, particolarmente a basse densità di placcatura. Sebbene i saggi infrarossi sono meno sensibili di ATP, i DRAQ5 + zaffiro saggi e saggi α-tubulina sono in buon accordo in che rivelano l'impatto altamente protettivo di N-acetil cisteina. C'era perdita dose-reattività del segnale infrarosso con entrambi i saggi e le tre curve di redditività è stata spostata a destra con N-acetil cisteina. Questa sovrapposizione non è sempre osservata per tutti i tipi di trattamenti di cellule N2a, come le α-tubulina e ATP saggi sembrano essere più sensibili ai composti come il cloruro di ammonio del DRAQ5 + saggio zaffiro (vedere Figura 4 in Unnithan et al. 8 ). Così, la vitalità phenotypes non sono sempre ugualmente rappresentati da tutti e tre saggi. Sebbene il dosaggio ATP era meglio proporzione al numero di cellule N2a placcato quello α-tubulina e DRAQ5 + saggi zaffiro, supponendo che la forza del segnale riflette il numero di cellule non è stato sempre rispettato dopo trattamento tossina. Livelli di ATP sono aumentato a concentrazioni di tossina che non ha provocato un aumento simile in segnale nei saggi infrarossi. Questi dati rivelano cambiamenti metabolici compensative nelle cellule N2a in risposta ad inibizione del proteasoma e sono utili nel loro diritto. L'ATP curva dose-risposta a forma di U è caratteristico del fenomeno chiamato ormesi. Ormesi è definito come reazioni biologiche favorevoli alle esposizioni di basso livello di tossine e di altri fattori di stress 40-42.
Per i neuroni, il DRAQ5 + macchia Sapphire era meno sensibile al MAP2 e saggi ATP ad alta densità di placcatura. Tuttavia, il DRAQ5 + zaffiro, MAP2, e saggi ATP erano ben in proporzione cell numero di neuroni corticali primari pari o inferiore a 100k cellule per bene. Abbiamo piastra neuroni a 100k cellule per bene. Neuroni dalla corteccia non sono noti a replicare, quindi, eravamo più preoccupati linearità a 100k o inferiore densità di placcatura. Il DRAQ5 + saggio zaffiro è meno sensibile alle differenze tra neocorteccia e allocortex rispetto sia MAP2 o ATP a concentrazioni inferiori a 50 mM H 2 O 2. Inoltre, i livelli di ATP non è caduta in modo drammatico su H 2 O 2 come trattamento di segnali infrarossi negli altri due saggi, forse suggerendo ancora aumenti compensativi della produzione di ATP. Le discrepanze tra i tre saggi in cellule N2a e neuroni primari possono riflettere sul fatto che le funzioni cellulari possono cambiare prima le strutture anatomiche lorde sono colpiti, e che le strutture cellulari, tra cui proteine del citoscheletro, possono essere colpiti molto tempo prima che le cellule sono si perdono. I dati recenti sui test di vitalità multiplex di Gilbert e colleghi convincenteche illustrano diverse misure di redditività come Hoechst colorazione nucleare e misurazioni ATP producono informazioni sulle caratteristiche cellulari specifiche che solo parzialmente e indirettamente riflettono la redditività nel suo complesso 26. Si consiglia pertanto di eseguire tutti e tre i test contemporaneamente e non basandosi su un unico test per la vitalità metabolica come molte pubblicazioni fanno. Per ulteriori informazioni su uno qualsiasi di queste misure, si consiglia di contare le singole cellule e quindi di valutare l'espressione della proteina del citoscheletro e livelli di ATP in funzione del numero di cellule.
Anche se ci sono altri saggi di redditività metabolica, quali MTT, il vantaggio del test ATP sta nella sua sensibilità e gamma dinamica. Il saggio MTT può sovrastimare il numero di cellule vitali in confronto alle misurazioni ATP e presenta un IC 50 che è due volte superiore 43. Inoltre, Petty e colleghi hanno riferito che il test ATP potrebberilevare il limite inferiore 1563 cellule per pozzetto mentre il saggio MTT non poteva rilevare meno di 25k cellule / pozzetto 12. Il rapporto segnale-rumore (segnale da pozzetti con cellule vive rispetto pozzetti privi di celle) è solo il 7 per MTT, ma 230 per l'ATP 44. Un altro vantaggio di luminescenti saggi ATP oltre MTT è che il tempo di incubazione è molto più breve. Inoltre, il saggio MTT da Promega costa 0,28 cent per bene considerando che il cellulare Titer Glo saggio dello stesso produttore al costo di 0,09 cent per bene alle nostre diluizioni consigliate. Tuttavia, vi sono limitazioni per tutti i dosaggi metabolici; attività metabolica può essere disaccoppiato dal sopravvivenza, specialmente durante necrosi. Se questo è un problema, i saggi della presente relazione possono essere combinati con le misure di rilascio lattato deidrogenasi accertare perdita di integrità della membrana. Questo non comporterebbe alcuna piastre supplementari, come misurazioni lattato deidrogenasi sono realizzati semplicemente nel mezzo extracellulare.
Anche se noi presentiamo questi saggi come alternative alla conteggi manuali sul microscopio, quest'ultimo può essere un mezzo altamente sensibili e accurate di numero di cellule di campionamento se condotto correttamente. Infatti, ci aspettiamo che conta di nuclei Hoechst-macchiati sarebbero più sensibili alle piccole variazioni di numero di cellule N2a rispetto alla DRAQ5 + test Sapphire. Quando tutti i test falliscono il test di linearità, conteggi manuali sono essenziali. Un buon esempio di questo è il nostro modello colta astrociti primario, su cui eseguiamo il manuale più faticoso conta 45. Tuttavia, i pregiudizi insiti dei conteggi manuali devono essere tenuti in considerazione quando si interpretano i dati di conteggio delle cellule, così come i difetti intrinseci del test computerizzati non devono essere ignorati. Un certo numero di punti di forza e di debolezza dei test di vitalità sono quindi descritte di seguito.
In primo luogo, se le macchie DAPI o Hoechst sono impiegati, nuclei rattrappiti e condensati sono spesso designati comeapoptotico 1. Tuttavia, le dimensioni delle cellule e la condensazione dei nuclei si trovano lungo un continuum liscia. Al contrario, la vita e la morte sono, fenomeni binari si escludono a vicenda. A meno che non si osservano due gruppi ben distinti di cellule vive o morenti, sembra meglio contare tutte le celle sottostanti diametro nucleare soglia apoptotica con software di imaging come MetaMorph o ImageJ piuttosto che ad occhio. Naturalmente, la scelta per un diametro soglia è arbitraria, perché non sappiamo a che punto è iniziata una cascata apoptotica irreversibile. Inoltre, per definizione, anche le cellule con caspasi attivate 3 non sono necessariamente in rotta verso la morte e dovrebbe forse essere considerati come ancora in vita al momento della fissazione 46. I nostri saggi infrarossi evitare tali preoccupazioni per il trattamento di tutte le cellule che sono attaccati alla piastra, al momento della fissazione come vivono ancora. Solo le cellule che hanno galleggiato via sono contati come morti. Questo pone le cellule in una delle due categorie distinte ed evita le insidie di utilizzare un complex, funzione continua come diametro nucleare.
In secondo luogo, conteggi manuali tipicamente campionare una piccola frazione dell'intero bene. Questo può portare a pregiudizi campionamento e, in alcune occasioni, alti errori standard della media. Con i nostri test di vitalità, l'intero bene sia sottoposto ATP e vicino all'intera bene viene campionato con i dosaggi infrarossi. Questo modello di campionamento aumenta la dimensione del campione ed evita la decisione talvolta arbitraria di dove nel pozzo per scattare una fotografia per conteggi manuali. Se le foto sono prese dal centro del pozzo, va tenuto presente che questa regione è dove si verifica l'off-lavare più di cellule, inducono potenziali sovrastima di tossicità. Al contrario, i saggi infrarossi gettano una griglia sull'immagine della piastra a 96 pozzetti che esclude solo angoli estremi dei pozzetti. Se lo si desidera, gli angoli dei pozzetti possono essere incluse aumentando il diametro dei cerchi nella griglia.
In terzo luogo, il fotografo e il contatore delle cellule devono essere entrambi accecati durante conteggi manuali. Tuttavia, una volta che le cellule vengono trattate con le tossine, che spesso assumono i cambiamenti morfologici che sono abbastanza evidente anche ad un occhio non allenato. Questo rende molto più difficile rimanere imparziale. La cecità non è un requisito per i nostri test.
Quarto, conteggi manuali sono che richiede tempo e costano il ricercatore principale più di stipendio. Gli stipendi sono uno dei più alti costi di conduzione della ricerca. Il tempo di scansione per un piatto sul Odyssey è a soli 8 minuti a lungo sulla "qualità media" impostazione e può essere abbassato ulteriormente l'impostazione "bassa qualità". Va notato che l'Odissea Imager è costoso, anche quando si compra una versione demo utilizzato, ma è un costo fisso di una volta. D'altra parte, bisogna anche investire in microscopi epifluorescenza relativamente costosi per la conta delle cellule manuali di DAPI-o Hnuclei oechst macchiato. Nonostante il costo iniziale, l'Odissea Imager è una macchina polivalente che misura anche immunoblots occidentali in maniera quantitativa 47,48. Abbiamo adattato uso della Odyssey per quantificazioni di immunoistochimica in strutture cerebrali macroscopiche come il ratto o topo striato e la corteccia telencefalica. Questo approccio è stato utilizzato anche da altri 49. Una debolezza della Odyssey Imager per l'imaging dei tessuti è che la risoluzione più alta è solo 21 micron. Pertanto non può contare singole cellule e non è destinato per visualizzarne i dettagli anatomici più fine.
Infine, i saggi infrarossi potrebbero non essere sensibile a piccole variazioni nel numero di cellule in conteggi manuali. I valori di IC 50, pertanto non possono essere considerati come mostra la concentrazione che provoca perdita precisamente il 50% del numero di cellule, ma solo come la concentrazione che provoca la perdita del 50% del segnale infrarosso. Questo avvertimento vale probabilmentetutti i test di vitalità che eludono la conta delle cellule individuali al microscopio e il campione l'intero bene in una sola volta. L'imprecisione associata a tali dosaggi può essere una funzione di ipertrofia, atrofia, o altri cambiamenti di aspetto che influenzano la potenza del segnale. Ad esempio, con alcune tossine, α-tubulina immunoreattività in ciascuna cella può aumentare in funzione della tossicità. Abbiamo osservato questo fenomeno in cellule N2a trattate con concentrazioni molto elevate di MG132 8. Se questo è preoccupante, altre proteine marker del citoscheletro, come β-actina o GAPDH possono essere usati. Inoltre, hanno sottolineato le cellule N2a tendono a formare processi bipolari 8,50,51. Con i cambiamenti nella dimensione della cella, uscita segnale fluorescente per cella anche differire tra i gruppi di trattamento. Raccomandiamo che le cellule trattate con tossina essere esaminati al microscopio livello ad alta risoluzione a seguito immunocitochimica per gli stessi marcatori utilizzati nella In-Cell occidentale. Se il citoplasma cambia notevolmente di dimensioni previo trattamento ma l'nucleo non si consiglia di utilizzare la macchia DRAQ5, senza Sapphire quantificare solo nuclei. Studi futuri con diversi coloranti e con altre proteine del citoscheletro abbondanti o altri sono garantiti per superare questi ostacoli.
Concludiamo che tutti i saggi soffrono di caveat e hanno sollevato preoccupazioni circa la sensibilità, linearità, errore di campionamento, rapporto segnale-rumore, distorsione umana o soggettività, il tempo e il costo. Inoltre, tutti i saggi si basano su ipotesi che non sono sempre rispettati. Pertanto, si consiglia che almeno due saggi essere utilizzati per descrivere gli effetti del trattamento su colture cellulari, uno che misura la salute metabolica e uno che si basa sulla vitalità anatomica. In questo modo, si può più efficacemente accertare se composti terapeutici proteggono sia struttura e funzione.
Divulgazioni
Nessuno degli autori ha conflitti da dichiarare.
Riconoscimenti
Riconosciamo Juliann Jaumotte per l'idea di risparmiare sui volumi di reagenti nel saggio ATP. Siamo profondamente grati per l'eccellente supporto amministrativo di Maria Caruso, Deb Willson, e Jackie Farrer e alla Scuola di Farmacia Mylan per fornire un sostegno finanziario per questi studi. Un ringraziamento anche a causa delle malattie Hunkele temuto Fondazione e il Parkinson e Disordini del Movimento Fondazione per il sostegno finanziario degli studi primarie neuronali.
Materiali
| Name | Company | Catalog Number | Comments |
| Cell Titer Glo | Promega | G7572 | Buy in 100 ml quantities and aliquot, instead of purchasing the more expensive 10 ml quantity. Reconstituted, unused reagents can be refrozen at -20 °C for at least 21 weeks |
| 18% Formalin | Thermo-Shandon | 9990244 | Buying this fixative avoids the weighing out of formaldehyde powders and boiling of the solution; exposure to vapors is thereby minimized |
| Sucrose | Sigma-Aldrich | S0389 | It is not essential to add this to formaldehyde solutions but it improves the appearance of the fixed cells |
| Odyssey Block | LI-COR | 927-40003 | This fish serum can be bought in bulk and frozen at -20 °C for long term use |
| Triton-X 100 | Sigma-Aldrich | 21568 | We store a stock solution of 10% Triton-X 100 in sterile water at 4 °C |
| Sodium Phosphate Monobasic | Fisher | S468 | One can also buy PBS tablets or 10x PBS solutions, but they are more expensive |
| Sodium Phosphate Dibasic | Fisher | S373 | See above |
| Sodium Azide (250x) | Ricca Chemical Company | 7144.8-16 | Do not buy the powder because sodium azide is very toxic. We store all our used antibodies in 1x sodium azide at 4 °C until they become contaminated with debris |
| Mouse anti-α-tubulin | Sigma-Aldrich | T5168 | This antibody is expensive but can be greatly diluted and is highly specific |
| Mouse anti-MAP2 | Sigma-Aldrich | M9942 | This antibody is expensive but is highly specific (a prerequisite for In-Cell Westerns) |
| 800 nm Goat anti-mouse IgG | LI-COR | 926-32210 | Other companies also sell infrared secondary antibodies. Be sure to purchase the highly cross-adsorbed antibodies and note that concentrations of IgGs may vary with the source |
| DRAQ5 | Biostatus | DR50200 | This compound used to be sold by LI-COR at 1 mM |
| Sapphire | LI-COR | 928-40022 | |
| Luminometer | PerkinElmer | VICTOR3 1420 multilabel counter | |
| Odyssey Imager | LI-COR | 9201-01 | |
| Shaker/Mixer | Research Products International | 248555 |
Riferimenti
- Leak, R. K., Liou, A. K., Zigmond, M. J. Effect of sublethal 6-hydroxydopamine on the response to subsequent oxidative stress in dopaminergic cells: evidence for preconditioning. J Neurochem. 99, 1151-1163 (2006).
- Ugarte, S. D., Lin, E., Klann, E., Zigmond, M. J., Perez, R. G. Effects of GDNF on 6-OHDA-induced death in a dopaminergic cell line: modulation by inhibitors of PI3 kinase. J. Neurosci. 73, 105-112 (2003).
- Patonay, G., Antoine, M. Near-infrared fluorogenic labels: new approach to an old problem. Anal. Chem. 63, (1991).
- Mullett, S. J., Hinkle, D. A. DJ-1 deficiency in astrocytes selectively enhances mitochondrial Complex I inhibitor-induced neurotoxicity. J. Neurochem. 117, 375-387 (2011).
- Egorina, E. M., Sovershaev, M. A., Osterud, B. In-cell Western assay: a new approach to visualize tissue factor in human monocytes. J. Thromb. Haemost. 4, 614-620 (2006).
- Aguilar, H. N., Zielnik, B., Tracey, C. N., Mitchell, B. F. Quantification of rapid Myosin regulatory light chain phosphorylation using high-throughput in-cell Western assays: comparison to Western immunoblots. PLoS One. 5, (2010).
- Jinwal, U. K., Dickey, C. A. Cell-based assays for regulators of tau biology. Methods Mol. Biol. 670, 93-108 (2011).
- Unnithan, A. S., Choi, H. J., Titler, A. M., Posimo, J. M., Leak, R. K. Rescue from a two hit, high-throughput model of neurodegeneration with N-acetyl cysteine. Neurochem. Int. 61, 356-368 (2012).
- Hoskins, C., Wang, L., Cheng, W. P., Cuschieri, A. Dilemmas in the reliable estimation of the in-vitro cell viability in magnetic nanoparticle engineering: which tests and what protocols? . Nanoscale Res. Lett.. 7, 10-1186 (2012).
- Essner, M. D., Javed, A., Eleazer, P. D. Effect of sodium hypochlorite on human pulp cells: an in vitro study. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 112, 662-666 (2011).
- Sims, J. T., Plattner, R. MTT assays cannot be utilized to study the effects of STI571/Gleevec on the viability of solid tumor cell lines. Cancer Chemother. Pharmacol. 64, 629-633 (2009).
- Petty, R. D., Sutherland, L. A., Hunter, E. M., Cree, I. A. Comparison of MTT and ATP-based assays for the measurement of viable cell. J. Biolumin. Chemilumin. 10, 29-34 (1995).
- Womac, A. D., Burkeen, J. F., Neuendorff, N., Earnest, D. J., Zoran, M. J. Circadian rhythms of extracellular ATP accumulation in suprachiasmatic nucleus cells and cultured astrocytes. Eur. J. Neurosci. 30, 869-876 (2009).
- Ataullakhanov, F. I., Vitvitsky, V. M. What determines the intracellular ATP concentration. Biosci. Rep. 22, 501-511 (2002).
- Iglehart, J. D., Silver, D. P. Synthetic lethality--a new direction in cancer-drug development. New Engl. J. Med. 361, 189-191 (2009).
- Crouch, S. P., Kozlowski, R., Slater, K. J., Fletcher, J. The use of ATP bioluminescence as a measure of cell proliferation and cytotoxicity. J. Immunol. Methods. 160, 81-88 (1993).
- Kangas, L., Gronroos, M., Nieminen, A. L. Bioluminescence of cellular ATP: a new method for evaluating cytotoxic agents in vitro. Med. Biol. 62, 338-343 (1984).
- Lundin, A., Hasenson, M., Persson, J., Pousette, A. Estimation of biomass in growing cell lines by adenosine triphosphate assay. Methods Enzymol. 133, 27-42 (1986).
- Sevin, B. U., et al. Application of an ATP-bioluminescence assay in human tumor chemosensitivity testing. Gynecol. Oncol. 31, 191-204 (1988).
- Maehara, Y., Anai, H., Tamada, R., Sugimachi, K. The ATP assay is more sensitive than the succinate dehydrogenase inhibition test for predicting cell viability. Eur. J. Cancer Clin. Oncol. 23, 273-276 (1987).
- Andreotti, P. E., et al. Chemosensitivity testing of human tumors using a microplate adenosine triphosphate luminescence assay: clinical correlation for cisplatin resistance of ovarian carcinoma. Cancer Res. 55, 5276-5282 (1995).
- Posimo, J. M., Titler, A. M., Choi, H. J., Unnithan, A. S., Leak, R. K. Neocortex and allocortex respond differentially to cellular stress in vitro and aging in vivo. PLoS One. 8, (2013).
- Carralot, J. P., et al. A novel specific edge effect correction method for RNA interference screenings. Bioinformatics. 28, 261-268 (2012).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. J. Biomol. Screen. 8, 566-570 (2003).
- Oliver, D. G., Sanders, A. H., Hogg, R. D., Hellman, J. W. Thermal gradients in microtitration plates. Effects on enzyme-linked immunoassay. J. Immunol. Methods. 42, 195-201 (1981).
- Gilbert, D. F., et al. A novel multiplex cell viability assay for high-throughput RNAi screening.. PLoS One. 6, (2011).
- Bayer, S. A., Altman, J. . Neocortical Development. , (1991).
- Miller, F. D., Gauthier, A. S. Timing is everything: making neurons versus glia in the developing cortex. Neuron. 54, 357-369 (2007).
- Mullett, S. J., Hinkle, D. A. DJ-1 knock-down in astrocytes impairs astrocyte-mediated neuroprotection against rotenone. Neurobiol. Dis. 33, 28-36 (2009).
- Jiang, Y., et al. N-Acetyl cysteine blunts proteotoxicity in a heat shock protein-dependent manner. Neuroscience. 255, 19-32 (1016).
- Madeira, A., et al. Caveolin-1 interacts with alpha-synuclein and mediates toxic actions of cellular alpha-synuclein overexpression. Neurochem. Int. 59, 280-289 (2011).
- Fioriti, L., et al. Cytosolic prion protein (PrP) is not toxic in N2a cells and primary neurons expressing pathogenic PrP mutations. J. Biol. Chem. 280, 11320-11328 (2005).
- Zhang, L., et al. Proteasome inhibition modulates kinase activation in neural cells: relevance to ubiquitination, ribosomes, and survival. J. Neurosci. Res. 87, 3231-3238 (2009).
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiol. Aging. 24, 197-211 (2003).
- Stranahan, A. M., Mattson, M. P. Selective Vulnerability of Neurons in Layer II of the Entorhinal Cortex during Aging and Alzheimer's Disease.. Neural Plast. 2010, (2010).
- Duyckaerts, C., Delatour, B., Potier, M. C. Classification and basic pathology of Alzheimer disease. Acta Neuropathol. 118, 5-36 (2009).
- Chu, C. C., Tranel, D., Damasio, A. R., Van Hoesen, G. W. The autonomic-related cortex: pathology in Alzheimer's disease. Cereb. Cortex. 7, 86-95 (1997).
- Braak, H., Del Tredici, K., Bohl, J., Bratzke, H., Braak, E. Pathological changes in the parahippocampal region in select non-Alzheimer's dementias. Ann. N.Y. Acad. Sci. 911, 221-239 (2000).
- Braak, H., Rub, U., Schultz, C., Del Tredici, K. Vulnerability of cortical neurons to Alzheimer's and Parkinson's diseases. J. Alzheimers Dis. 9, 35-44 (2006).
- Calabrese, E. J. Hormesis is central to toxicology, pharmacology and risk assessment. Hum. Exp. Toxicol. 29, 249-261 (2010).
- Giordano, J., Ives, J. A., Jonas, W. B. Hormetic responses in neural systems: consideration, contexts, and caveats. Crit. Rev. Toxicol. 38, 623-627 (2008).
- Mattson, M. P. Hormesis defined. . Ageing Res. Rev.. 7, 1-7 (2008).
- Wang, P., Henning, S. M., Heber, D. Limitations of MTT and MTS-based assays for measurement of antiproliferative activity of green tea polyphenols. PLoS One. 5, (2010).
- Riss, T. L., Moravec, R. A. Use of multiple assay endpoints to investigate the effects of incubation time, dose of toxin, and plating density in cell-based cytotoxicity assays. . Assay Drug Dev. Technol. 2, 51-62 (2004).
- Titler, A. M., Posimo, J. M., Leak, R. K. Astrocyte plasticity revealed by adaptations to severe proteotoxic stress. Cell Tissue Res. , (2013).
- McLaughlin, B., et al. Caspase 3 activation is essential for neuroprotection in preconditioning. Proc. Natl. Acad. Sci. U.S.A. 100, 715-720 (2003).
- Mathews, S. T., Plaisance, E. P., Kim, T. Imaging systems for westerns: chemiluminescence vs. infrared detection. Methods Mol. Biol. 536, 499-513 (2009).
- Picariello, L., et al. A comparison of methods for the analysis of low abundance proteins in desmoid tumor cells. Anal. Biochem. 354, 205-212 (2006).
- Tapias, V., Cannon, J. R., Greenamyre, J. T. Melatonin treatment potentiates neurodegeneration in a rat rotenone Parkinson's disease model. J. Neurosci. Res. 88, 420-427 (2010).
- Fenteany, G., Schreiber, S. L. Specific inhibition of the chymotrypsin-like activity of the proteasome induces a bipolar morphology in neuroblastoma cells. Chem. Biol. 3, 905-912 (1996).
- Omura, S., et al. Lactacystin, a novel microbial metabolite, induces neuritogenesis of neuroblastoma cells. J. Antibiot. 44, 113-116 (1991).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon