Method Article
Una piattaforma espressione conveniente e generale per la produzione di proteine secrete da cellule umane
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Nel periodo post-genomica umana, la disponibilità di proteine ricombinanti in conformazione nativa è cruciale per la ricerca strutturali, funzionali e terapeutico e lo sviluppo. Qui viene descritto un test e larga scala sistema di espressione proteica in cellule renali embrionali umane 293T che possono essere utilizzati per produrre una varietà di proteine ricombinanti.
Abstract
Ricombinante espressione della proteina in batteri, tipicamente E. coli, è stato la strategia più efficace per l'espressione quantità milligrammo di proteine. Tuttavia, ospiti procariotici spesso non sono appropriati per l'espressione di proteine virali umani, o eucariotica a causa della tossicità della macromolecola estera, le differenze nei macchinari ripiegamento proteico, oppure a causa della mancanza di particolari modifiche co-o post-traduzionale di batteri. Sistemi di espressione basati sul lievito (P. pastoris o S. cerevisiae) 1,2, baculovirus-insetto infetto (S. frugiperda o T. ni) 3 celle, e privo di cellule in vitro sistemi di traduzione 2,4 sono stati utilizzati con successo per produrre proteine di mammifero. Intuitivamente, la corrispondenza migliore è quella di utilizzare un ospite mammifero a garantire la produzione di proteine ricombinanti che contengono gli opportuni modifiche post-traslazionali. Un certo numero di linee cellulari di mammifero (embrionale umano Kidney (HEK) 293, C V-1 in cellule O rigine trasportano il S V40 larget T-antigene (COS), ovariche di criceto cinese (CHO), e altri) sono stati utilizzati con successo per sovraesprimere quantità milligrammi di un certo numero di proteine umane 5-9. Tuttavia, i vantaggi di utilizzare cellule di mammifero sono spesso contrastate da maggiori costi, necessità di apparecchiature di laboratorio specializzato, rese inferiori, proteine e tempi lunghi per sviluppare linee cellulari stabili di espressione. Aumentare la resa e la produzione di proteine più veloci, mantenendo bassi i costi, sono fattori importanti per molti laboratori accademici e commerciali.
Qui, noi descriviamo un tempo e costi contenuti, in due parti procedura per l'espressione di proteine umane secrete da cellule HEK aderenti 293T. Questo sistema è in grado di produrre quantitativi microgrammi per milligrammo di proteina funzionale per studi strutturali, biofisico e biochimiche. La prima parte, costrutti multiple del gene di interesse sono produrred in parallelo e transitoriamente trasfettate in cellule HEK aderenti 293T in piccola scala. La rilevazione e l'analisi di proteina ricombinante secreto nel mezzo di coltura cellulare viene effettuata mediante analisi western blot utilizzando anticorpi disponibili commercialmente diretti contro un vettore codificato tag proteina purificazione. Successivamente, costrutti adatti per produzione su larga scala di proteine vengono trasfettate transitoriamente usando polietilenimmina (PEI) in 10-strato fabbriche di cellule. Le proteine secrete in litro di volumi di terreno condizionato sono concentrate in quantità gestibili mediante filtrazione a flusso tangenziale, seguita da purificazione da anti-HA cromatografia di affinità. L'utilità di questa piattaforma è provato dalla sua capacità di esprimere quantità di milligrammi di citochine, recettori delle citochine, recettori della superficie cellulare, i fattori intrinseci, di restrizione e glicoproteine virali. Questo metodo è stato utilizzato con successo nella determinazione strutturale dei 5,10 trimeriche glicoproteina ebolavirus.
2, è richiesto. Questa procedura può essere rapidamente esteso a sistemi di maggiore complessità, come co-espressione di complessi proteici, antigeni e anticorpi, la produzione di particelle simili a virus di vaccini, o produzione di adenovirus o lentivirus per la trasduzione di linee cellulari difficili.
Protocollo
1. Preparazione al lavoro - Costruisce e colture cellulari
Prima di iniziare il protocollo, il gene di interesse dovrebbero essere codone-ottimizzata per l'espressione in cellule di mammifero, e clonato in un vettore di espressione appropriato usando tecniche standard di biologia molecolare. Al fine di garantire la massima possibilità di espressione riuscita, varianti multiple del gene di interesse deve essere generata. Molti vettori di espressione di mammifero sono disponibili in commercio e hanno i tag di depurazione diversi (poliistidina, emoagglutinina, streptavidina, HALO-Tag, glutatione S-transferasi, tra gli altri). Noi preferiamo utilizzare il vettore pDISPLAY, che codifica per un promotore forte citomegalovirus umano, uno κ segnale di secrezione Ig, purificazione emoagglutinina tag, e ha un C-terminale di ancoraggio transmembrana per indirizzare la proteina attraverso la via secretoria per la visualizzazione sulla membrana plasmatica. Di solito inserire un codone di stop di fronte al transmembrana ancho vettore codificator per consentire la proteina di essere secreto nel terreno condizionato.
Embrionali umane di rene (HEK), le cellule 293T sono ampiamente disponibili e facilmente coltivate e transfettate. HEK 293T sono abitualmente utilizzati per l'espressione di proteine provenienti da mammiferi, ma sono considerati a rischio biologico e devono essere gestiti a livello di biosicurezza 2. Si prega di indossare indumenti di protezione individuale; lavoro deve essere eseguita in un armadio di sicurezza biologica approvato con tecnica asettica. Tutti i rifiuti e le superfici devono essere disinfettati secondo le linee guida istituzionali e governative. Si raccomanda che le cellule da testare per la contaminazione da micoplasma prima dell'uso. Le cellule possono essere trattati con ciprofloxacina (10 pg / ml) per dieci giorni a eliminare qualsiasi fonte di Mycoplasma spp. contaminazione. Protocolli generali per propagare le cellule HEK 293T sono presentati separatamente (Box 1).
Considerazioni aggiuntive per test-e su larga scala l'espressione della proteina sono reviewed in 11-15.
2. Piccola prova Expression
Una volta costrutti sono stati progettati e generati su piccola scala trasfezioni di prova può essere eseguita usando HEK 293T, schematicamente il processo di sintesi è presentato di seguito (Fig. 1).
- Utilizzare T75 cm 2 o cm T225 2 flaconi di coltura cellulare (a seconda del numero di espressioni di prova da eseguire) per far crescere le cellule HEK 293T e dividere le celle ogni 2-3 giorni quando le cellule sono al 100% confluenti (Box 1).
- Seme 2,5 x 10 5 cellule HEK 293T cellule per pozzetto in una piastra da 6 pozzetti e si aggiungono 2 ml di DMEM con 1X pen / strep e il 10% (v / v) FBS, turbinio delicatamente la piastra di assicurare anche la dispersione delle cellule in ciascun pozzetto, e incubare durante la notte a 37 ° C in 5% CO 2 camera umidificata.
- Quando le cellule HEK 293T raggiungere il 40% di confluenza, eliminare i mezzi di comunicazione fresca ed aggiungere 2 ml di DMEM con la penna 1X / strep e il 10% (v / v) FBS ai pozzetti. Eseguiresaggi di trasfezione.
- Aliquotare 90 microlitri DMEM privo di siero in una provetta sterile 1,5 ml microcentrifuga. Pipettare 3 GeneJuice microlitri in DMEM privo di siero e mescolare delicatamente il tubo (vortice finger). Incubare per 5 minuti a temperatura ambiente.
- Aggiungere 1 pg di DNA plasmidico purificato Miniprep (DNA fotografia = 100 ng / ml) nel DMEM-GeneJuice miscela, vortice dito, e incubare per 15 minuti a temperatura ambiente.
- Pipettare goccia a goccia la miscela di trasfezione su cellule HEK 293T, e agitare la piastra da 6 pozzetti delicatamente per consentire una distribuzione uniforme della miscela di trasfezione. Incubare la piastra da 6 pozzetti a 37 ° C in 5% CO 2 camera umidificata.
- Aggiungere 1 ml di DMEM fresco con 1X pen / strep e il 10% (v / v) FBS ad ogni pozzetto 24 ore dopo la transfezione e incubare per altre 48 ore (totale di 72 ore).
- Harvest 1 ml di surnatante da ciascun pozzetto a tre giorni dopo la trasfezione e microcentrifuga i campioni a 16.000 g per 10 minuti a temperatura ambiente. Effettuare western blot come indicato nel riquadro 2. I campioni possono essere conservati a 4 ° C. La lunghezza di conservazione a 4 ° C è dipendente proteina.
3. Grande espressione di test e di purificazione
Una volta che un costrutto è stato identificato l'espressione quantità milligrammo di proteina ricombinante è ottenuta mediante trasfezione di PEI aderenti cellule HEK 293T utilizzando 10-strato fabbriche di cellule (Fig. 2; 6360 centimetri 2 di superficie). Per gli studi più esplorativi, fabbriche di cellule più piccole o T-palloni (tabella 1) può essere utilizzato.
- Purificare 1 mg di DNA per trasfezione con un plasmide kit di purificazione MaxiPrep. Una coltura durante la notte 500 ml di XL-1 Blu cellule dovrebbe produrre almeno 1 mg di DNA puro. Controllare purezza di DNA misurando 260 A / A 280 rapporto; deve essere superiore a 1,8.
- Scalabilità fino cellule HEK 293T a 2,0 x 10 8 celle. Ogni centimetro T225 2 pallone cresciuto al 100% co confluenzantains e la media di ~ 2.25 x 10 7 cellule.
- Aggiungere 1,2 L DMEM con 5% (v / v) FBS ad un 10-strato di fabbrica della cellula. Aggiungere 2,0 x 10 8 cellule HEK 293T alla fabbrica cella e distribuire uniformemente le celle a tutti gli strati della nave. È molto difficile visualizzare la confluenza delle cellule in fabbrica cella. In alternativa, impostare un pallone da 2 centimetri T75 con un numero appropriato di cellule, utilizzando lo stesso numero di cellule rapporto superficie come eseguita con il 10-strato vaso. Monitorare questo fiasco tassi di crescita. Guarda il video associato per le istruzioni sulla gestione della fabbrica della cellula. Incubare per una notte a 37 ° C con 5% di CO 2 per consentire attaccamento cellulare e la crescita.
- Eseguire su larga scala di transfezione quando aderenti cellule HEK 293T sono il 70% confluenti. Preparare il PEI-DNA miscela di trasfezione (3:1 w / w PEI al rapporto di DNA) in un armadio di biosicurezza con un T75 sterile cm 2 pallone. Mescolare 0,84 mg di DNA con 84 ml di PBS 1X sterile, quindi aggiungere 2,5 ml di PEI (2.5 mg totale PEI). Incubare a temperatura ambiente per 15 minuti. Soluzione dovrebbe diventare nuvoloso.
- Versare il PEI-DNA miscela di trasfezione lentamente nella fabbrica cella e accuratamente distribuire su tutti gli strati della nave. Optional: per le rese di espressione aumento, aggiungere l'acido valproico (4 concentrazione mM finale). Incubare a 37 ° C con 5% CO 2 per quattro giorni.
- Harvest surnatante quattro giorni dopo la trasfezione. Centrifugare i mezzi condizionati a 6000 g per 30 minuti a 4 ° C. Ulteriori filtrare il supernatante utilizzando un apparato per il vuoto 0,22 um filtro Stericup. Il 10-strato di fabbrica della cellula può essere riutilizzato, si veda il riquadro 3 per le istruzioni di pulizia. E 'fondamentale che la pulizia è iniziata subito dopo la raccolta surnatante, non lasciare che le pile a secco sulla superficie del vaso.
- Concentrare il surnatante a 75 ml con il sistema di filtrazione tangenziale Centramate flusso.
- Aggiungere 500 ml di PBS e ri-concentrato a 75 ml. Ripetere tre Additvolte ional per tamponare completamente sostituire il campione.
- Equilibrare una ml 1 anti-HA colonna di affinità con 1X PBS e applicare il campione concentrato di flusso per gravità ad una velocità <1 ml / min.
- Lavare la colonna con 30 ml di 1X PBS-Tween 20.
- Sciogliere peptide HA in 1X PBS (1,0 mg / ml) e incubare a 37 ° C.
- Applicare 1 ml del peptide HA al anti-HA colonna e consentire il peptide di fluire nella resina. Raccogliere il flusso attraverso. Arrestare il flusso quando la soluzione peptide raggiunge l'altezza del letto.
- Incubare l'intera anti-HA colonna a 37 ° C per 15 minuti.
- Ripetere il passaggio 12 altre due volte.
- Applicare 1 ml di 1X PBS al anti-HA colonna e il flusso nella resina fino a raggiungere l'altezza del letto. Raccogliere il flusso attraverso.
- Rigenerare l'anti-HA colonna con 10 ml 0,1 M glicina pH 2.2. Lavare con 10 ml di PBS e colonna di affinità conservare a 4 ° C in PBS con 0,02% (w / v) NaN 3.
- Eseguire analisi SDS-PAGE e la piscina del fractions conseguenza. Nota: Il peptide HA possa interferire con le misure di concentrazione di proteine da A 280 o Bradford. Per stimare la quantità di proteina, carico 5, 10, 15, 25 pg di BSA sul gel SDS-PAGE come standard e confrontare le intensità banda.
9-17 passi possono essere ripetuti per acquisire ulteriori proteine dal mezzo condizionato.
4. Risultati rappresentativi
In questo articolo descriviamo e dimostrare una comoda piattaforma di espressione per milligrammo-quantitativa della produzione di proteine umane che possono essere successivamente utilizzati per studi strutturali e funzionali. La proiezione della proteina umana costrutti utilizzando cellule HEK 293T in piastre da 6 pozzetti sia efficiente ed efficace nell'individuare costrutti riconducibili alla produzione di larga scala. Vettori di espressione commerciali possono essere trasfettate efficientemente in cellule 293T HEK utilizzando una varietà di reagenti di trasfezione, come GeneJuice, Fugene o PE HD I. Si consiglia l'uso di un reagente di trasfezione commerciale, come GeneJuice o Fugene HD, per le espressioni di prova, in quanto tali reagenti sono più efficaci per i più poveri che esprimono le proteine (Fig. 3). Costrutti selezionati per l'espressione più vasta scala dovrebbe essere caratterizzata da un unico, band di forte intensità, corrispondente al peso molecolare corretto il Western Blot (Fig. 3). Glicoproteine possono migrare come band più ampio a causa della eterogeneità di glicosilazione. Abbiamo mostrato che una varietà di macromolecole, che vanno da glicoproteine virali, citochine, recettori di citochine, e proteine di superficie, può essere espressa e purificata per dare millgram quantità di proteina usando questa piattaforma espressione generale (Fig. 4).

Figura 1. Schema del flusso di lavoro di piccole dimensioni trasfezioni.tp_upload/4041/4041fig1large.jpg "target =" _blank "> Clicca qui per ingrandire la figura.

Figura 2. Corning 10-layer CellSTACK per la più grande espressione della proteina scala. Ogni livello contiene 636 centimetri 2 di superficie per l'attacco delle cellule. Uno standard di laboratorio incubatore CO 2 (6.0 cu. Ft) sarà tenere comodamente quattro 10-strato fabbriche di cellule.
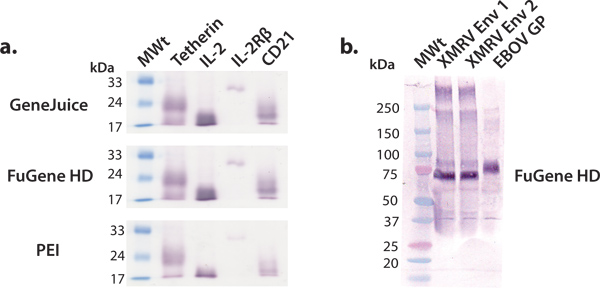
.. Figura 3 su piccola scala espressione di varie proteine secrete Abbiamo eseguito una serie di piccole espressioni di test che utilizzano reagenti di trasfezione comuni:. GeneJuice, Fugene HD e PEI (a) proiezione di una selezione di Western blot proteine umane cellulari (tetherin), i recettori (IL-2R subunità β) e citochine (IL-2). Tetherin è una glicoproteina di membrana umana che limita il rilascio dinascenti da HIV-1 virioni 16. Il dominio extracellulare di tetherin esiste come glicosilata, disolfuro-linked dimero di ~ 36 kDa. In condizioni riducenti, come mostrato qui, tetherin migra come un monomero con un peso molecolare apparente di circa 22 kDa. L'interleuchina-2 (IL-2) è una citochina (circa 17 kDa) coinvolta nella proliferazione dei linfociti 17. Esso interagisce con la IL-2 complesso recettore di IL-2R che βsubunit (~ 26 kDa) è un componente 18. CD21 è una proteina di membrana coinvolta nella attivazione e maturazione cellule B del sistema del complemento, ed è anche un recettore per il virus Epstein-Barr. Il dominio extracellulare di glicosilata CD21 migra come un monomero con un peso molecolare apparente di circa 20 kDa. (B) lo screening Western blot di glicoproteine di superficie selezionati virali (XMRV Env e ebolavirus GP). XMRV e glicoproteine transmembrana ebolavirus (ancora cancellata) esistono a livello della membrana virale come picchi trimeriche e sono coinvolti in attacco della cellula ospitee la fusione. Il ectodomain dell'XMRV Env e EBOV GP sono pesantemente decorate con N-linked glicani e migrare in apparenti peso molecolare di 70 kDa e 75 kDa, rispettivamente.

Figura 4. Umana purificata proteine cellulari da grandi culture HEK 293T. Tutte le proteine sono state espresse utilizzando uno strato 10-fabbrica della cellula, e concentrato e purificato mediante cromatografia anti-HA. Come mostrato da Coomassie-tinto analisi SDS-PAGE, i domini extracellulari del recettore dell'interleuchina-2 (IL-2R) α e γ subunità migrare peso molecolare di 40 kDa e 46 kDa, rispettivamente. Il dominio extracellulare di tetherin migra come dimero, sotto condizioni non riducenti, con un peso molecolare apparente di 36 kDa. Si noti che vi è una certa contaminazione BSA che appare ad un peso molecolare apparente di 60 kDa. Inoltre, l'eterogeneità dei N-glicani legati presenti tetherin,IL-2R α e IL-2R γ banda cause ampliare sul gel SDS-PAGE. Questi complessi di tipo N-linked glicani può essere rimosso utilizzando peptide: N-glicosidasi F.
| Nave | Superficie |
| 6-pozzetti | 9,5 centimetri 2 (ogni pozzetto) |
| Dischi da 100 mm | 55 centimetri 2 |
| 245 piatti mm | 500 cm 2 |
| T75 cm 2 pallone | 75 centimetri 2 |
| T175 cm 2 pallone | 175 centimetri 2 |
| T225 cm 2 pallone | 225 centimetri 2 |
| Roller bottiglia regolare | 850 centimetri 2 |
| Roller bottiglia espanso superficie | 1700 centimetri 2 |
| 1-strato CellSTACK | 636 centimetri 2 |
| 2 strati CellSTACK | 1272 centimetri 2 |
| 5-strato CellSTACK | 3180 centimetri 2 |
| 10-strato CellSTACK | 6360 centimetri 2 |
| 40-strato CellSTACK | 25440 centimetri 2 |
Tabella 1. Confronto di recipienti di coltura di cellule utilizzate per l'espressione proteica.
Elenco delle ricette reagente
100X Ciprofloxacina per 10 ml di soluzione, aggiungere 10 ml di acqua deionizzata a 10 mg di ciprofloxacina. Aggiungere 10 microlitri 6N HCl per sciogliere tutta la ciprofloxacina.
PEI (1 mg / ml) Ad una soluzione di 100 ml, sciogliere 100 mg di 25 kDa lineare PEI in acqua deionizzata e calore a 80 ° C. Soluzione raffreddare a temperatura ambiente, regolare il pH a 7,2, 0,22 micron filtro sterilizzare, aliquotare e congelare a -20 ° C per long-termine.
1X PBS per 1 soluzione acquosa L: 8,0 g di NaCl, KCl 0,2 g, 1,4 g di Na 2 HPO 4 (anidro), 0,24 g di KH 2 PO 4. Regolare il pH della soluzione a 7.4 e riempire a 1,0 L.
1X PBS-Tween-20 Per 1 soluzione acquosa L: 8,0 g di NaCl, KCl 0,2 g, 1,4 g di Na 2 HPO 4 (anidro), 0,24 g di KH 2 PO 4, 1 ml di Tween-20. Regolare il pH della soluzione a 7.4 e riempire a 1,0 L.
1X tampone di trasferimento Per 1 soluzione acquosa L: 3,0 g di Tris base, 14,4 g di glicina, 150 ml di metanolo.
SDS-PAGE 1X tampone di corsa da 1 soluzione acquosa L: 3,0 g Tris base, 14,4 g di glicina, 1,0 g SDS.
SDS-PAGE ridurre tampone campione per 10 ml di soluzione: 0,6 g SDS, 3 ml di glicerolo, 1,8 ml 1,0 Tris-HCl pH 6,8, 1 mg di blu di bromofenolo, 5% (v / v) 2-mercaptoetanolo.
Box 1. Protocolli generali per la propagazione delle cellule- Grow cellule HEK 293T in media Dulbeccòs Modified Eagle (DMEM) supplementato con 10% (v / v) di siero fetale bovino (FBS), 1X pen / strep a 37 ° C in 5% CO 2-atmosfera umidificata.
- Osservare cellule sotto un microscopio invertito. Quando le cellule sono al 100% di confluenza, rimuovere ed eliminare terreno di coltura.
- Lavare le cellule con 5 ml di PBS 1X sterile per rimuovere le tracce di siero. Eliminare il lavaggio PBS.
- Aggiungere 2 ml di 0,05% (w / v) tripsina-EDTA soluzione di un centimetro T225 pallone da 2 (o 1 ml di 0,05% (w / v) tripsina-EDTA per T75 pallone cm 2) e incubare a temperatura ambiente fino cellule staccare dalla superficie. È anche possibile utilizzare sterile 1X PBS-EDTA per staccare cellule HEK 293T.
- Aggiungere 13 ml di DMEM con 10% (v / v) FBS a un centimetro T225 pallone da 2 (o 9 ml di DMEM con 10% (v / v) FBS per T75 cm 2 pallone) per inibire la reazione tripsina.
- Split cells 1:5. Per un pallone da 2 centimetri T225, aggiungere 3 ml di sospensione cellulare a 27 ml di DMEM fresco con 1X pen / strep e il 10% (v / v) FBS in un recipiente di coltura nuova. Per un centimetro T75 pallone da 2, aggiungere 2 ml di sospensione cellulare a 8 ml di terreno di coltura fresco. Incubare colture a 37 ° C in 5% CO 2-atmosfera umidificata. Le cellule dovrebbe crescere al 100% di confluenza entro due giorni.
Box 2. Analisi Western blot
- Aggiungere 10 microlitri SDS-PAGE tampone campione riducendo a 30 microlitri di coltura cellulare surnatante. Caricare i campioni e prestained marcatori di peso molecolare su gel di poliacrilammide e mediante elettroforesi SDS-PAGE 1X tampone di corsa a 175 V per 1 ora o fino a marcatori di peso molecolare sono ben risolti.
- Bagnare il Immobilon-P membrana PVDF in metanolo 100% per 1 minuto per attivare.
- Montare apparato Western Blot. Assicurarsi che la membrana PVDF affronta l'elettrodo positivo e mantenere tutti i componenti bagnati con 1X tampone di trasferimento. Avoid bolle tra il gel di poliacrilammide e la membrana.
- Riempire la camera di elettroforesi con 1X tampone di trasferimento e trasferimento per 1 ora a 100 V.
- Bloccare la membrana con 5% (w / v) di latte scremato in 1X PBS-Tween 20 per 1 ora a temperatura ambiente, o per una notte a 4 ° C.
- Incubare con anticorpo monoclonale primario (cioè 1:1000 diluizione mAb anti-HA o altro appropriato anticorpo) dissolto in 5% (w / v) di latte scremato in 1X PBS-Tween 20 per 1 ora a temperatura ambiente o per una notte a 4 ° C.
- Lavare le membrane in 1X PBS-Tween 20 per 10 minuti. Ripetere due tempi supplementari.
- Incubare con un anticorpo monoclonale secondario coniugato con fosfatasi alcalina (1:1000 diluizione in 5% (w / v) di latte scremato in 1X PBS-Tween 20) per 1 ora a temperatura ambiente, o per una notte a 4 ° C.
- Lavare le membrane in 1X PBS-Tween 20 per 10 minuti. Ripetere due tempi supplementari.
- Posizionare la membrana in un piccolo contenitore, aggiungere 5 ml fosfatasi alcalina substratiTE (BCIP / NBT) soluzione. Sviluppo del colore deve avvenire entro 1-5 minuti. Una volta che l'intensità banda desiderata viene raggiunta, lavare con acqua deionizzata e asciugare all'aria. Colore può sbiadire nel tempo; elettronicamente la scansione delle membrane, una volta asciutti.
Box 3. La pulizia e il riciclaggio delle navi colture cellulari
Mentre fabbriche cellulari sono progettati per essere monouso, questi vasi può essere riciclato per ulteriori larga scala trasfezioni utilizzando il seguente protocollo di pulizia:
- Subito dopo decantazione il supernatante dal 10-strato fabbrica cellule, aggiungere 20% (v / v) candeggina e agitare vigorosamente per staccare le cellule. Incubare a temperatura ambiente per tre ore.
- Svuotare il recipiente e aggiungere fresco 20% (v / v) candeggina e incubare a temperatura ambiente per una notte.
- Svuotare il vaso e lavare con 1,5 L di acqua deionizzata. Ripetete tre volte.
- Svuotare il 10-strato di fabbrica della cellula e aggiungere 0,5 L di sterile 1X PBS supplementato con 10X soluzione antibiotica / antimicotica. Conservare il recipiente a temperatura ambiente e sostituire i tappi di sfiato per il riempimento di porte (standard 33 mm tappi a vite) prima dell'uso successivo. Nota: tutti i livelli devono essere completamente chiaro dopo la pulizia, se non, non utilizzare e smaltire la fabbrica delle cellule secondo le linee guida istituzionali.
Discussione
Il 10-strato fabbriche di cellule sono una nave efficace per la produzione di quantità di milligrammi di proteina. Uno dei principali vantaggi di utilizzare la fabbrica della cellula rispetto ad altre imbarcazioni tradizionali, quali bottiglie, flaconi a rulli scuotere o filatore boccette, è che non richiedono l'acquisto di eventuali attrezzature di laboratorio supplementare. Uno standard di CO 2 incubatore (circa 6.0 cu. Ft) sarà comodamente ospitare quattro 10-layer fabbriche di cellule (Fig. 2). Inoltre, questi vasi richiedono meno spazio di lavoro e piatti, flaconi o bottiglie rulli per produrre cellule e proteine; uno strato 10-fabbrica cella è equivalente al consumo di 7,5 bottiglie rotanti normali (Tabella 1). Ancora più importante, le cellule 293T HEK adattano bene nei vasi e sono altamente suscettibili di trasfezione transiente con PEI, fornendo così una soluzione a basso costo ed efficace per reagenti di trasfezione commerciali. Mentre fabbriche cellulari sono progettati per essere monouso Plasticware coltura cellulare, abbiamo been in grado di pulire efficacemente e riutilizzare queste navi più volte senza problemi di contaminazione, riducendo in modo significativo il costo per l'uso. Espressione della proteina Transient utilizzando un 10-strato fabbrica cellula è in grado di produrre ~ 1-10 mg di proteina purificata (Fig. 4), a seconda della proteina e le sue modificazioni. È possibile passare dalla espressione e clonazione piccola scala al completamento della grande espressione e purificazione in circa 3-4 settimane. In sintesi, questo è un rapido, piattaforma generale che è estremamente utile nella produzione di proteine secrete superficie umani o virale. Inoltre, questa piattaforma può anche essere usato per esprimere anticorpi, virus come particelle, e adenovirus e lentivirus per il trasferimento genico.
Abbiamo elencato qui di seguito i problemi comuni e possibili soluzioni. Per una guida alla risoluzione più dettagliata, vedere 14.
- No o l'espressione di proteine molto basso:
- Poor hSALUTE delle cellule-Macchia delle cellule utilizzando trypan blu per la vitalità e il test per la contaminazione da micoplasma. Se le cellule hanno un numero elevato passaggio (> 25 passaggi) e stanno crescendo lentamente, ricominciare da capo con nuove cellule HEK 293T. Efficienza di trasfezione e la produzione di proteine sono influenzati dalla età delle cellule in coltura.
- Poveri trasfezione transitoria di cellule transfettate dovrebbe essere ad un livello di confluenza di 40%. I rapporti di DNA di reagente di trasfezione deve essere ottimizzata.
- La proteina è instabile o non piegato-Controllare il pellet cellulare per la proteina insolubile. Verificare l'espressione di altri costrutti o proteina omologa.
- Nessuna proteina viene eluita dalla colonna:
- Proteina trattenuti sulla colonna-Eluire la proteina di interesse con 0,1 M glicina pH 2,2 e analizzare mediante western blot. Se la proteina viene mantenuto, utilizzare una maggiore concentrazione di peptide HA sintetico per eluizione o incubare la colonna a 37 ° C per periodi più lunghi.
- anti-HA column è danneggiato-Mentre la colonna, se pulito e conservato correttamente, possono essere riutilizzati più volte, l'efficienza della colonna diminuisce nel tempo. Utilizzare un nuovo anti-HA colonna.
- Protein-degrado Aggiungi inibitori della proteasi e mantenere proteine su ghiaccio durante l'intero processo di purificazione.
- Protein è precipitata o aggregate nella colonna-Se la proteina è instabile, prova diversi costrutti o le condizioni di buffer (es. pH, sali, additivi, ecc) per migliorare la stabilità della proteina.
- Protein non è riuscito a legare alla colonna-The HA-tag può essere sepolto o inaccessibili. Verificare che la proteina non è in flusso attraverso o lavare.
- Siero albumina contaminazione:
Albumina sierica bovina (BSA) tende a legarsi non specificamente anti-HA resina e può contaminare i eluizioni peptide HA. In Fig. 4, BSA migra come un gruppo compatto in un peso molecolare apparente di ~ 60-65 kDa. In questo caso, aumentare la concentrazione di Tween-20 nel P 1XBS-lavaggio Tween 20 allo 0,2% (v / v) e aumentare il volume del lavaggio. In alternativa, la contaminazione BSA può essere rimosso con l'esclusione dimensione o la cromatografia a scambio ionico.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Questo lavoro è stato supportato da un trattamento di HIV Ontario sovvenzione di funzionamento Research Network (ROG-G645) e la Canadian Institutes of Research Investigator Award Salute New (MSH-113554) per JEL, borse di studio e Università di Toronto per HA, FCA, e JDC. Gli autori desiderano ringraziare Marnie Fusco, Dafna Abelson e il Dott. Erica Ollmann Saphire at The Scripps Research Institute (La Jolla, CA) per le cellule che forniscono, le ebolavirus vettore di espressione GP e consigli generali.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome di reagente | Azienda | Numero di catalogo | Comments |
| Fosfatasi alcalina (BCIP / NBT) soluzione di substrato liquido | Sigma | B6404 | |
| Antibiotica / antimicotica, 100X | Invitrogen | 15240062 | |
| Anti-HA affinità matrice, clone 3F10 | Roche | 1815016 | |
| Anti-HA mAb murino, clone 16B12 | Covance | MMS-101P | |
| Pallone cultura cellulare, T75 2 cm coltura tessuto trattato | Corning | 430641 | |
| Pallone cultura cellulare, T225 2 cm coltura tessuto trattato | Corning | 431082 | |
| Piastre di coltura cellulare ,6-cultura e tessuto trattato | Corning | 3516 | |
| Fabbrica della cellula, 10-layer CellSTACK | Corning | 3312 | |
| Centramate Omega 5K Cassette | Coltre | OS005C12 | |
| Centramate Omega 30K Cassette | Coltre | OS030C12 | |
| Cromatografia su colonna in vetro, cm 1.0x10 | Kontes | 4204001010 | |
| Ciprofloxacina | Sigma | 17850 | |
| CO 2 | |||
| Eagle modificato da Dulbecco di supporto (DMEM) | Sigma | D5796 | |
| Siero bovino fetale (FBS), inattivato a caldo | Invitrogen | 12484-028 | |
| Fugene HD reagenti di trasfezione | Promega | 4709691001 | |
| GeneJuice reagenti di trasfezione | EMD / Merck | 70967-6 | |
| Glycine | Sigma | G8898 | |
| Capra anti-topo IgG F (ab ') 2 alcalina | Thermo Scientific | 31324 | |
| fosfatasi-coniugato anticorpo | |||
| Emoagglutinina (HA) peptide, 100 mg | GenScript | sintesi personalizzata | |
| (Sequenza: YPYDVPDYA, il 95% di purezza) | |||
| HEK 293T | ATCC | CRL-11268 | |
| Household candeggina (4% w / v di ipoclorito di sodio) | Sono disponibili varie marche | ||
| Immobilon-P membrana PVDF | Millipore | IPVH07850 | |
| Miniprep Kit purificazione plasmide, PureLink rapida | Invitrogen | K2100-11 | |
| MaxiPrep kit di purificazione plasmide, PureLink HiPure | Invitrogen | K2100-07 | |
| NaN 3 | Sigma | S8032 | |
| pDISPLAY vettore di espressione | Invitrogen | V660-20 | |
| Penicillina / streptomicina (pen / strep), 100X | Invitrogen | 15140-122 | |
| Tampone fosfato salino (PBS), sterile 1X | Sigma | D8537 | |
| Polietilenimmina (PEI), lineari 25 kDa | Polyscience | 23966 | |
| Il latte scremato in polvere secca | Garofano | ||
| Stericup-GP PES vuoto unità di filtrazione, | Millipore | SCGPU05RE | |
| 0,22 micron, 500 ml | |||
| Trypan blu | Invitrogen | 15250061 | |
| Tripsina-EDTA, 0,05% (w / v) | Invitrogen | 25300-054 | |
| Tween-20 | Sigma | P7949 | |
| L'acido valproico | Sigma | P4543 | |
| Centramate sistema a flusso tangenziale | Coltre | ||
| CO 2 incubatore umidificato, standard 6.0 cu. ft | Sono disponibili varie marche | ||
| Elettroforesi e trasferimento unità | Sono disponibili varie marche | ||
| Incubatore, 37 ° C | Sono disponibili varie marche |
Riferimenti
- Celik, E., Calik, P. Production of recombinant proteins by yeast cells. Biotechnol. Adv. , (2011).
- Yokoyama, S. Protein expression systems for structural genomics and proteomics. Curr. Opin. Chem. Biol. 7, 39-43 (2003).
- Nettleship, J. E., Assenberg, R., Diprose, J. M., Rahman-Huq, N., Owens, R. J. Recent advances in the production of proteins in insect and mammalian cells for structural biology. J. Struct. Biol. 172, 55-65 (2010).
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: Applications come of age. Biotechnol. Adv. , (2011).
- Lee, J. E. Structure of the Ebola virus glycoprotein bound to an antibody from a human survivor. Nature. 454, 177-182 (2008).
- Bowden, T. A. Structural basis of Nipah and Hendra virus attachment to their cell-surface receptor ephrin-B2. Nat. Struct. Mol. Biol. 15, 567-572 (2008).
- Evans, M. J., Hartman, S. L., Wolff, D. W., Rollins, S. A., Squinto, S. P. Rapid expression of an anti-human C5 chimeric Fab utilizing a vector that replicates in COS and 293 cells. J. Immunol. Methods. 184, 123-138 (1995).
- Ye, J. High-level protein expression in scalable CHO transient transfection. Biotechnol. Bioeng. 103, 542-551 (2009).
- Wurm, F. M. Production of recombinant protein therapeutics in cultivated mammalian cells. Nat Biotechnol. 22, 1393-1398 (2004).
- Lee, J. E., Fusco, M. H., Hessell, A. J., Burton, D. R., Saphire, E. O. Techniques and tactics used in determining the structure of trimeric, prefusion Ebola virus GP. Acta Cryst. 65, 1162-1180 (2009).
- Aricescu, A. R. Eukaryotic expression: developments for structural proteomics. Acta. Crystallogr. D Biol. Crystallogr. 62, 1114-1124 (2006).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta. Crystallogr. D Biol. Crystallogr. D62, 1243-1250 (2006).
- Chang, V. T. Glycoprotein structural genomics: solving the glycosylation problem. Structure. 15, 267-273 (2007).
- Lee, J. E., Fusco, M. H., Saphire, E. O. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nature Protocols. 4, 592-604 (2009).
- Nettleship, J. E., Rahman-Huq, N., Owens, R. J. The production of glycoproteins by transient expression in Mammalian cells. Methods Mol. Biol. 498, 245-263 (2009).
- Neil, S. J., Zang, T., Bieniasz, P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. Nature. 451, 425-430 (2008).
- Nakamura, Y. Heterodimerization of the IL-2 receptor beta- and gamma-chain cytoplasmic domains is required for signalling. Nature. 369, 330-333 (1994).
- Wang, X., Rickert, M., Garcia, K. C. Structure of the quaternary complex of interleukin-2 with its alpha, beta, and gammac receptors. Science. 310, 1159-1163 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon