Method Article
Eine bequeme und allgemein Expression Plattform für die Produktion von sekretierten Proteinen aus menschlichen Zellen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In der Post-Genom-Ära menschlicher, ist die Verfügbarkeit von rekombinanten Proteinen in nativer Konformation darauf an, strukturelle, funktionelle und therapeutische Forschung und Entwicklung. Hier beschreiben wir ein Test-und Proteomik-Expressionssystem in humanen embryonalen Nierenzellen 293T-Zellen, die verwendet werden, um eine Vielzahl von rekombinanten Proteinen hergestellt werden können.
Zusammenfassung
Rekombinante Proteinexpression in Bakterien, typischerweise E. coli, war die erfolgreichste Strategie zur Milligramm Menge Expression von Proteinen. Jedoch sind prokaryotische Wirte oft keine Bedeutung für die Expression von Mensch, viralen oder eukaryotischen Proteinen aufgrund der Toxizität der ausländischen Makromolekül, Unterschiede in der Proteinfaltung Maschinen oder aufgrund des Fehlens bestimmter Co-oder post-translationale Modifikationen in Bakterien. Expressionssysteme auf Hefe (P. pastoris oder S. cerevisiae) 1,2, Baculovirus-infizierten Insektenzellen (S. frugiperda oder T. ni) Zellen 3 und zellfreien in vitro-Translation-Systeme basieren 2,4 wurden erfolgreich eingesetzt, um Säugetier-Proteine herzustellen. Intuitiv ist die beste Übereinstimmung mit einem Säugetier-Wirt verwenden, um die Produktion von rekombinanten Proteinen, die die entsprechenden post-translationale Modifikationen beinhalten gewährleisten. Eine Reihe von Säugetier-Zelllinien (Human Embryonic KidNey (HEK) 293, haben C V-1 Zellen in O Rigin tragenden S V40 larget T-Antigen (COS), Ovarialzellen des chinesischen Hamsters (CHO), und andere) erfolgreich verwendet, um Milligramm-Mengen einer Reihe von humanen Proteine überexprimieren 5-9. Allerdings sind die Vorteile der Verwendung von Säugerzellen oft durch höhere Kosten, Erfordernis von speziellen Laborgeräten, niedriger Protein-Ausbeuten und lange Zeiten auf stabile Expression-Zelllinien zu entwickeln begegnet. Höherer Ertrag und Produktion von Proteinen schneller, während die Kosten niedrig hält, sind die Hauptfaktoren für viele akademische und kommerzielle Labors.
Hier beschreiben wir eine zeit-und kosteneffiziente, zweiteiliges Verfahren zur Expression von sezernierten humanen Proteinen aus adhärenten HEK 293T-Zellen. Dieses System ist in der Lage Mikrogramm bis Milligramm-Mengen an funktionellem Protein aus strukturellen, biophysikalischen und biochemischen Studien. Der erste Teil, mehrere Konstrukte des Gens von Interesse zu erzeugend parallel und transient in HEK 293T-Zellen adhärent in kleinem Maßstab transfiziert. Die Detektion und Analyse von rekombinantem Protein in das Zellkulturmedium sekretiert wird durch Western-Blot-Analyse unter Verwendung kommerziell erhältlicher Antikörper gegen ein Vektor-kodierte Proteinreinigung Tag gerichteten durchgeführt. Anschließend werden geeignete Konstrukte für die großtechnische Produktion Protein transient transfiziert mit Polyethylenimin (PEI) im 10-Schicht Zellfabriken. Proteine in Liter-Volumen von konditioniertem Medium sezerniert werden in handhabbare Mengen unter Verwendung Tangentialflussfiltration, gefolgt von Reinigung durch Anti-HA-Affinitätschromatographie eingeengt. Der Nutzen dieser Plattform wird durch seine Fähigkeit, Milligramm-Mengen von Cytokinen, Cytokinrezeptoren, Zelloberflächenrezeptoren, intrinsische Restriktionsfaktoren und viralen Glykoproteine exprimieren erwiesen. Diese Methode wurde auch erfolgreich bei der Strukturaufklärung der trimeren Ebolavirus Glykoprotein 5,10 verwendet.
2-Inkubator, erforderlich. Dieses Verfahren kann schneller auf Systeme mit höherer Komplexität, wie Co-Expression von Protein-Komplexe, Antigenen und Antikörpern, die Produktion von Virus-ähnlichen Partikeln für Impfstoffe oder Herstellung von Adenoviren oder Lentiviren zur Transduktion von schwierigen Zelllinien erweitert werden.
Protokoll
1. Vorbereitung der Arbeit - Konstrukte und Zellkulturen
Bevor das Protokoll, sollte das Gen von Interesse für die Expression in Säugerzellen Codon-optimiert und kloniert in einen geeigneten Expressionsvektor unter Verwendung herkömmlicher molekularbiologischer Techniken umfaßt. Um die höchste Wahrscheinlichkeit für eine erfolgreiche Expression zu gewährleisten, sollten mehrere Varianten des Gens von Interesse erzeugt werden. Viele Säugetier-Expressionsvektoren sind im Handel erhältlich und haben verschiedene Reinigungs-Tags (Polyhistidin, Hämagglutinin, Streptavidin, Halo-Tag, Glutathion S-Transferase, ua). Wir bevorzugen die pDisplay Vektor, der für eine starke humanen Cytomegalovirus-Promotor, ein Ig-κ-Sekretionssignal, Hämagglutinin Reinigung Tag codiert verwenden und hat einen C-terminalen Transmembran Anker, um das Protein durch den sekretorischen Weg für die Anzeige auf der Plasmamembran Ziel. Wir legen Regel ein Stop-Codon vor dem Vektor-kodierte Transmembran anchor, damit das Protein in das konditionierte Medium sekretiert werden.
Humane embryonale Nierenzellen (HEK) 293T-Zellen sind überall erhältlich und leicht kultiviert und transfiziert. HEK 293T werden routinemäßig für die Expression von aus Säugetieren gewonnenen Proteinen verwendet, die jedoch nicht als biologisch gefährlich und sollte auf Biosafety Level 2 behandelt werden. Bitte tragen Sie angemessene persönliche Schutzkleidung, die Arbeit sollte in einem zugelassenen Biosicherheitswerkbank unter aseptischen Bedingungen durchgeführt werden. Alle Abfälle und Oberflächen sollten nach institutionellen und staatlichen Richtlinien desinfiziert werden. Es wird empfohlen, dass die Zellen für Mykoplasmen-Kontaminationen vor Gebrauch getestet werden. Die Zellen können mit Ciprofloxacin (10 pg / ml) für 10 Tage, jede Quelle von Mycoplasma spp auszurotten behandelt werden. Kontamination. Allgemeine Protokolle zu HEK 293T Zellen vermehren werden separat (Box 1) vorgestellt.
Weitere Überlegungen für Test-und großflächige Protein-Expression sind reviewed in 11-15.
2. Tests im kleinen Massstab Expression
Sobald Konstrukte wurden entwickelt und erzeugt, Tests im kleinen Massstab Transfektionen kann unter Verwendung von HEK 293T-Zellen werden; eine schematische Zusammenfassung der Prozess wird unten (Abb. 1) vorgestellt.
- Verwendung T75 cm 2 oder T225 cm 2 Zellkulturflaschen (abhängig von der Anzahl der Testausdrücke durchgeführt werden), um die HEK 293T-Zellen wachsen und teilen die Zellen alle 2-3 Tage, wenn die Zellen 100% konfluent (Kasten 1) sind.
- Seed 2,5 x 10 5 HEK 293T Zellen pro Well in einer 6-Well-Platte und 2 ml DMEM mit 1X Penicillin / Streptomycin und 10% (v / v) FBS, wirbeln die Platte vorsichtig, um sicherzustellen, sogar in jeder Zelle Zerstreuung gut, und Inkubation über Nacht bei 37 ° C in einem 5% CO 2 befeuchteten Kammer.
- Wenn HEK 293T-Zellen 40% Konfluenz erreichen, werfen die Medien und frisches 2 ml DMEM mit 1X Penicillin / Streptomycin und 10% (v / v) FBS in die Vertiefungen. AusführenTransfektionstests.
- Aliquotieren 90 ul serumfreiem DMEM in ein steriles 1.5 ml Zentrifugenröhrchen. Pipette 3 ul GeneJuice in den Serum-freiem DMEM vorsichtig mischen und das Rohr (Finger Vortex). Für 5 Minuten bei Raumtemperatur.
- Fügen Sie 1 pg MiniPrep gereinigte Plasmid-DNA (DNA-Lager = 100 ng / ul) in DMEM-GeneJuice Mischung, Finger Wirbel, und inkubieren Sie für 15 Minuten bei Raumtemperatur.
- Pipettieren Sie die Transfektion Mischung tropfenweise auf HEK 293T-Zellen, und schwenken Sie die 6-Well-Platte vorsichtig, um eine gleichmäßige Verteilung der Transfektion Mischung zu ermöglichen. Inkubieren der 6-Well-Platte bei 37 ° C in einem 5% CO 2 befeuchteten Kammer.
- 1 ml frisches DMEM mit 1X Penicillin / Streptomycin und 10% (v / v) FBS, um jeweils gut 24 Stunden nach der Transfektion und Inkubation für weitere 48 Stunden (insgesamt 72 Stunden).
- Ernte 1 ml Überstand aus jeder Vertiefung auf drei Tage nach der Transfektion und Mikrozentrifugenröhrchen der Proben bei 16.000 g für 10 Minuten bei Raumtemperatur. Führen Sie Western-Blot-Analyse, wie in Kasten 2. Die Proben können bei 4 ° C gelagert werden Die Länge der Lagerung bei 4 ° C Proteins abhängig.
3. Großversuch Expression und Reinigung
Wenn ein Konstrukt identifiziert wurde Milligramm Menge Expression von rekombinantem Protein wird durch PEI Transfektion von adhärenten HEK 293T-Zellen unter Verwendung von 10-Schicht Zellfabriken (; 6360 cm 2 Oberfläche Abb. 2) erreicht. Für weitere Sondierungsstudien, können kleinere Zelle Fabriken oder T-Flaschen (Tabelle 1) verwendet werden.
- Reinigen 1 mg DNA für die Transfektion unter Verwendung eines Maxiprep Plasmid Purification Kit. Ein 500 ml Übernachtkultur von XL-1 Blue-Zellen produzieren sollte mindestens 1 mg reines DNA. Überprüfen Reinheit der DNA durch die Messung einer 260 / A 280-Verhältnis; sollte über 1,8 liegen.
- Scale-up HEK 293T-Zellen zu 2,0 × 10 8 Zellen. Jeder T225 cm 2 Flasche zu 100% Konfluenz gewachsen Zusammenarbeitntains und der Durchschnitt der ~ 2,25 x 10 7 Zellen.
- Mit 1,2 L DMEM mit 5% (v / v) FBS zu einem 10-Schicht Zellfabrik. In 2,0 x 10 8 HEK 293T-Zellen in die Zelle Fabrik und zu verteilen Zellen gleichmäßig auf alle Schichten des Schiffes. Es ist sehr schwierig, die Konfluenz der Zellen in der Zellfabrik visualisieren. Als Alternative, die Einrichtung eines T75 cm 2-Kolben mit einer entsprechenden Anzahl von Zellen, unter Verwendung des gleichen Zellzahl auf Flächenverhältnis wie bei der 10-Schicht Gefäß durchgeführt. Überwachen Sie diesen Kolben für Wachstumsraten. Das entsprechende Video für den Unterricht zum Umgang mit dem Zell-Fabrik. Inkubieren über Nacht bei 37 ° C mit 5% CO 2 für die Zellanheftung und Wachstum zu ermöglichen.
- Führen Sie umfangreiche Transfektion wenn adhärenten HEK 293T-Zellen 70% konfluent sind. Bereiten Sie die PEI-DNA-Transfektion Mischung (3:1 w / w PEI zu DNA-Verhältnis) in einer biologischen Sicherheitswerkbank mit einer sterilen T75 cm 2 Flasche. Mix 0,84 mg DNA mit 84 ml steriler 1X PBS, dann fügen Sie 2,5 ml PEI (2.5 mg insgesamt PEI). Inkubieren bei Raumtemperatur für 15 Minuten. Lösung sollte trübe.
- Gießen Sie die PEI-DNA-Transfektion Mischung langsam in die Zelle Fabrik und gründlich verteilen über alle Ebenen des Schiffes. Optional: für eine erhöhte Expression ergibt, fügen Valproinsäure (4 mM Endkonzentration). Bei 37 ° C mit 5% CO 2 für vier Tage.
- Ernte-Überstand 4 Tage nach der Transfektion. Zentrifugation der konditionierten Medien bei 6000 × g für 30 Minuten bei 4 ° C Weitere Filter der Überstand mit einem 0,22 um Stericup Vakuum Filtergerät. Der 10-Schicht Zellfabrik wiederverwendet werden können, siehe Kasten 3 für die Reinigung von Anweisungen. Es ist entscheidend, dass die Reinigung unmittelbar nach dem Überstand Ernte begonnen; lassen Sie sich nicht die Zellen trocken auf das Schiff Oberfläche.
- Konzentrat des Überstands auf 75 ml mit dem Centramate Tangentialströmungs-Filtersystem.
- In 500 ml PBS auf 75 ml neu zu konzentrieren. Wiederholen Sie drei additionalen mal komplett Pufferaustausch die Probe.
- Äquilibrieren einer 1-ml Anti-HA-Affinitätssäule mit 1 × PBS und anzuwenden konzentrierte Probe durch Schwerkraft mit einer Geschwindigkeit <1 ml / min.
- Die Säule wird mit 30 ml 1X PBS-Tween20.
- Man löst HA-Peptid in 1 × PBS (1,0 mg / ml) und Inkubation bei 37 ° C
- Es wird 1 ml der HA-Peptid an den Anti-HA-Säule und ermöglichen das Peptid in das Harz fließen kann. Sammeln Sie die Durchströmung. Stoppen Sie den Fluss, wenn das Peptid-Lösung die Betthöhe erreicht.
- Inkubieren Sie die gesamte Anti-HA-Säule bei 37 ° C für 15 Minuten.
- Wiederholen Sie Schritt 12 zwei weitere Male.
- Es wird 1 ml 1X PBS an den Anti-HA-Säule und fließen in das Harz, bis sie das Bett Höhe erreicht. Sammeln Sie die Durchströmung.
- Generieren Sie die Anti-HA-Säule mit 10 ml 0,1 M Glycin pH 2,2. Waschen mit 10 ml PBS und speichern Affinitätssäule bei 4 ° C in PBS mit 0,02% (w / v) NaN 3.
- Durchführen der SDS-PAGE-Analyse und die Pool-fractions entsprechend. Hinweis: Der HA-Peptid wird mit Proteinkonzentration Messungen von einem 280 oder Bradford stören. Um die Menge des vorhandenen Proteins, Last 5, 10, 15, 25 ug BSA auf die SDS-PAGE Gel schätzen als Standard und vergleichen Sie die Bandenintensitäten.
Schritte 9-17 wiederholt werden, um zusätzliches Protein aus dem konditionierten Medium zu erfassen.
4. Repräsentative Ergebnisse
In diesem Artikel beschreiben wir, und zeigen eine günstige Plattform für Ausdruck Milligramm-Mengen-Produktion humaner Proteine, die anschließend für strukturelle und funktionelle Studien genutzt werden können. Das Screening von humanem Protein-Konstrukte mit HEK 293T-Zellen in 6-Well-Platten ist effizient und effektiv bei der Ermittlung Konstrukte zugänglich größeren Maßstab. Kommerzielle Expressionsvektoren können effizient in HEK 293T-Zellen unter Verwendung einer Vielzahl von Transfektions-Reagenzien, wie GeneJuice, FuGene HD oder PE transfiziert werden I. Wir empfehlen die Verwendung eines kommerziellen Transfektionsreagenz wie GeneJuice oder FuGene HD, für Test-Ausdrücke, wie diese Reagenzien effektiver für ärmere Expression von Proteinen (Abb. 3) sind. Konstrukte für die Expression ausgewählt größeren Maßstab sollte durch ein einheitliches, starke Bande gekennzeichnet werden, entsprechend den entsprechenden Molekulargewicht in der Western-Blot (Abb. 3). Glykoproteine können als breiteres Band aufgrund von Heterogenität in der Glykosylierung zu migrieren. Wir haben gezeigt, dass eine Vielzahl von Makromolekülen, die von viralen Glycoproteinen, Cytokinen, Cytokinrezeptoren und andere Oberflächenproteine, exprimiert und gereinigt werden, um millgram Mengen an Protein mit diesen allgemeinen Ausdruck Plattform (4) zu ergeben.

Abbildung 1. Workflow-Schema der kleinräumigen Transfektionen.tp_upload/4041/4041fig1large.jpg "target =" _blank "> Klicken Sie hier für eine größere Abbildung zu sehen.

Abbildung 2. Corning 10-Schicht CellSTACK für größere Protein-Expression. Jede Schicht enthält 636 cm 2-Oberfläche für die Zellanheftung. Ein Standard-Labor-CO 2-Inkubator (6,0 cu. Ft.) wird bequem halten vier 10-Schicht Zellfabriken.
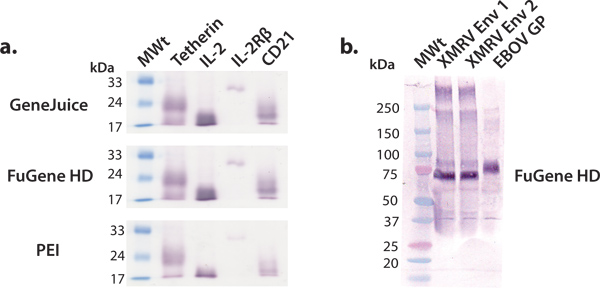
.. Abbildung 3 Small-scale Expression von verschiedenen sezernierten Proteinen Wir führten eine Reihe von Tests im kleinen Massstab Ausdrücke mit gemeinsamen Transfektionsreagenzien:. GeneJuice, FuGene HD und PEI (a) Western-Blot-Screening von ausgewählten humanen zellulären Proteinen (Tetherin), Rezeptoren (IL-2R β-Untereinheit) und Zytokine (IL-2). Tetherin ein Mensch ist Membranglykoprotein, die die Freisetzung beschränktentstehenden HIV-1 Virionen 16. Die extrazelluläre Domäne von Tetherin existiert glycosyliert, Disulfid-verknüpftes Dimer von ~ 36 kDa. Unter reduzierenden Bedingungen, wie hier dargestellt, wandert Tetherin als Monomer mit einem scheinbaren Molekulargewicht von ~ 22 kDa. Interleukin-2 (IL-2) ist ein Zytokin (~ 17 kDa) in Lymphozytenproliferation 17 beteiligt. Er interagiert mit dem IL-2 Rezeptor-Komplexes, von denen IL-2R βsubunit (~ 26 kDa) eine Komponente 18 ist. CD21 ist ein Membranprotein in der Aktivierung und Reifung B-Zellen durch das Komplementsystem beteiligt und ist auch ein Rezeptor für das Epstein-Barr-Virus. Die glykosylierten extrazellulären Domäne von CD21 wandert als Monomer mit einem scheinbaren Molekulargewicht von ~ 20 kDa. (B) Western-Blot-Screening von ausgewählten Oberfläche viralen Glykoproteine (XMRV Env und Ebolavirus GP). XMRV und Ebolavirus Glykoproteine (Transmembrananker gelöscht) sind im viralen Membran als trimere Komplexe und sind in Anhang Wirtszelle beteiligtund Fusion. Die Ektodomäne von Env XMRV und EBOV GP sind stark mit N-Glycane dekoriert und wandern an scheinbaren Molekulargewichten von 70 kDa und 75 kDa.

Abbildung 4. Gereinigte humane zelluläre Proteine aus großen HEK 293T Kulturen. Alle Proteine wurden exprimiert unter Verwendung eines 10-Schicht Zellfabrik und eingeengt und durch Anti-HA-Chromatographie. Wie durch Coomassie-gefärbten SDS-PAGE-Analyse gezeigt, sind die extrazellulären Domänen von Interleukin-2-Rezeptor (IL-2R) α und γ-Untereinheiten mit Molekulargewichten von 40 kDa und 46 kDa zu migrieren, jeweils. Die extrazelluläre Domäne von Tetherin wandert als Dimer, unter nicht-reduzierenden Bedingungen mit einem scheinbaren Molekulargewicht von 36 kDa. Beachten Sie, dass es eine BSA Verunreinigungen, die in einem scheinbaren Molekulargewicht von 60 kDa erscheint. Darüber hinaus präsentieren die Heterogenität der N-gebundenen Glykane auf Tetherin,IL-2R α und IL-2R γ Ursachen Bandenverbreiterung auf dem SDS-PAGE-Gel. Diese komplexe N-Glycane entfernen Sie mit Peptid werden: N-Glycosidase F.
| Schiff | Oberfläche |
| 6-Well-Platte | 9,5 cm 2 (jeweils gut) |
| 100 mm-Schalen | 55 cm 2 |
| 245 mm Teller | 500 cm 2 |
| T75 cm 2 Flasche | 75 cm 2 |
| T175 cm 2 Flasche | 175 cm 2 |
| T225 cm 2 Flasche | 225 cm 2 |
| Roller-Flasche regelmäßigen | 850 cm 2 |
| Roller-Flasche erweiterten Oberfläche | 1700 cm 2 |
| 1-Schicht CellSTACK | 636 cm 2 |
| 2-Schicht-CellSTACK | 1272 cm 2 |
| 5-Schicht-CellSTACK | 3180 cm 2 |
| 10-Schicht CellSTACK | 6360 cm 2 |
| 40-Schicht CellSTACK | 25.440 cm 2 |
Tabelle 1. Vergleich von Zellkulturgefäße für die Proteinexpression eingesetzt.
Liste der Reagenz-Rezepte
100X Ciprofloxacin für 10 ml Lösung, 10 ml destilliertem Wasser auf 10 mg Ciprofloxacin. Fügen Sie 10 ul 6N HCl zur vollständigen Auflösung des Ciprofloxacin.
PEI (1 mg / ml) für eine 100 ml Lösung, werden 100 mg von 25 kDa lineares PEI in entionisiertem Wasser und auf 80 ° C Coole Lösung auf Raumtemperatur, pH-Wert auf 7,2, 0,22 um Filter zu sterilisieren, aliquotieren und bei -20 ° C für LONg längerfristige Lagerung.
1X PBS für 1 l wässrigen Lösung: 8,0 g NaCl, 0,2 g KCl, 1,4 g Na 2 HPO 4 (wasserfrei), 0,24 g KH 2 PO 4. Der pH-Wert der Lösung auf 7,4 bis 1,0 und füllen L.
1X PBS-Tween-20 für 1 l wässrigen Lösung: 8,0 g NaCl, 0,2 g KCl, 1,4 g Na 2 HPO 4 (wasserfrei), 0,24 g KH 2 PO 4, 1 ml Tween-20. Der pH-Wert der Lösung auf 7,4 bis 1,0 und füllen L.
1X Transferpuffer für 1 l wässriger Lösung: 3,0 g Tris-Base, 14,4 g Glycin, 150 ml Methanol.
1X SDS-PAGE-Laufpuffer für 1 l wässriger Lösung: 3,0 g Tris-Base, 14,4 g Glycin, 1,0 g SDS.
SDS-PAGE reduzierendem Probenpuffer für 10 ml Lösung: 0,6 g SDS, 3 ml Glycerin, 1,8 ml 1,0 Tris-HCl pH 6,8, 1 mg Bromphenolblau, 5% (v / v) 2-Mercaptoethanol.
Box 1. Allgemeine Protokolle zur Zellvermehrung- Wachsen HEK 293T Zellen in Dulbecco modifiziertem Eagle-Medium (DMEM) mit 10% (v / v) fötales Rinderserum (FBS), 1 × Penicillin / Streptomycin bei 37 ° C ergänzt in einer 5% CO 2-befeuchteten Atmosphäre.
- Beachten Zellen unter einem inversen Mikroskop. Wenn die Zellen bei 100% Konfluenz sind, entfernen und entsorgen Kulturmedium.
- Spülen Zellen mit 5 ml sterilem PBS 1X, um Spuren von Serum zu entfernen. Entsorgen Sie den PBS-Waschung.
- 2 ml 0,05% (w / v) Trypsin-EDTA-Lösung zu einer T225 cm 2-Kolben (oder 1 ml von 0,05% (w / v) Trypsin-EDTA T75 cm 2-Kolben) und Inkubation bei Raumtemperatur, bis die Zellen zu lösen Entfernung von der Oberfläche. Es ist auch möglich, eine sterile 1X PBS-EDTA zu verwenden, um HEK 293T-Zellen zu lösen.
- In 13 ml DMEM mit 10% (v / v) FBS zu einem T225 cm 2-Kolben (oder 9 ml DMEM mit 10% (v / v) FBS T75 cm 2-Kolben), um das Trypsin Reaktion hemmen.
- Split cEllen 1:5. Für eine T225 cm 2 Flasche, 3 ml der Zellsuspension auf 27 ml frisches DMEM mit 1X Penicillin / Streptomycin und 10% (v / v) FBS in einem neuen Kulturgefäß. Für einen T75 cm 2 Flasche, 2 ml Zellsuspension bis 8 ml frischem Nährmedium. Inkubieren Kulturen bei 37 ° C in einem 5% CO 2-befeuchteten Atmosphäre. Die Zellen sind zu 100% Konfluenz innerhalb von zwei Tagen zu wachsen.
Kasten 2. Western Blot-Analyse
- In 10 pl SDS-PAGE-Probenpuffer Reduzierung auf 30 ul Zellkulturüberstand. Tragen Sie die Proben und vorgefärbten Molekulargewichtsmarker auf Polyacrylamidgele und Elektrophorese mit 1X SDS-PAGE-Laufpuffer bei 175 V für 1 Stunde oder bis Molekulargewichtsmarker sind gut aufgelöst.
- Einweichen Immobilon-P PVDF-Membran in 100% Methanol für 1 Minute bis zu aktivieren.
- Montieren Western-Blot-Apparatur. Stellen Sie sicher, die PVDF-Membran steht vor der positiven Elektrode und halten alle Komponenten nass mit 1X Transferpuffer. AvoID Blasen zwischen dem Polyacrylamid-Gel und der Membran.
- Füllen Sie den Elektrophoresekammer mit 1x Transfer-Puffer und Transfer für 1 Stunde bei 100 V.
- Sperren der Membran mit 5% (w / v) Magermilch in 1X PBS-Tween 20 für 1 Stunde bei Raumtemperatur oder über Nacht bei 4 ° C
- Inkubation mit monoklonalen primären Antikörper (dh einer Verdünnung von 1:1000 Anti-HA-mAb oder ein anderes geeignetes Antikörper), in 5% (w / v) gelöst Magermilch in 1X PBS-Tween 20 für 1 Stunde bei Raumtemperatur oder über Nacht bei 4 ° C
- Waschen der Membranen in 1X PBS-Tween 20 für 10 Minuten. Wiederholen Sie die beiden zusätzlichen Zeiten.
- Inkubieren mit einem monoklonalen sekundären Antikörper, konjugiert mit alkalischer Phosphatase (1:1000-Verdünnung in 5% (w / v) Magermilch in 1X PBS-Tween 20) für 1 Stunde bei Raumtemperatur oder über Nacht bei 4 ° C
- Waschen der Membranen in 1X PBS-Tween 20 für 10 Minuten. Wiederholen Sie die beiden zusätzlichen Zeiten.
- Legen Sie die Membran in einen kleinen Behälter, 5 ml alkalische Phosphatase Substrate (BCIP / NBT)-Lösung. Farbe Entwicklung sollte innerhalb von 1-5 Minuten auftreten. Sobald das gewünschte Band Intensität erreicht ist, mit VE-Wasser und der Luft trocknen zu waschen. Farbe im Laufe der Zeit verblassen; elektronisch scannen die Membranen einmal trocken.
Box 3. Reinigung und Recycling von Zellkulturgefäße
Während Zellfabriken entworfen, um den einmaligen Gebrauch sein, können diese Schiffe für weitere groß angelegte Transfektionen mit dem folgenden Protokoll Reinigung wiederverwendet werden:
- Unmittelbar nach dem Dekantieren des Überstandes aus dem 10-Schicht Zellfabrik, fügen Sie 20% (v / v) Bleichmittel und kräftig schütteln, um Zellen zu lösen. Inkubieren bei Raumtemperatur für drei Stunden.
- Entleeren Sie den Behälter und fügen frische 20% (v / v) Bleichmittel und inkubieren Sie bei Raumtemperatur über Nacht.
- Entleeren Sie den Behälter und waschen mit 1,5 l deionisiertem Wasser. Dreimal wiederholen.
- Leeren Sie den 10-Schicht Zellfabrik und 0,5 L von sterilen 1X PBS, ergänzt mit 10X Antibiotikum / Antimykotikum-Lösung. Lagern Sie das Gefäß bei Raumtemperatur und Belüftung ersetzen Kappen zum Füllen Ports (Standard 33 mm Gewindekappen) vor der nächsten Benutzung. Hinweis: Alle Schichten sollten ganz klar nach der Reinigung, wenn nicht, verwenden Sie nicht und entsorgen Sie die Zelle Werk nach den Richtlinien des Instituts.
Diskussion
Die 10-Schicht Zellfabriken sind eine effektive Behälter für die Herstellung von Milligramm-Mengen des Proteins. Ein wesentlicher Vorteil der Verwendung der Zellfabrik gegenüber anderen traditionellen Schiffe, wie z. B. Rollerflaschen, Schüttelkolben oder Spinnerflaschen, ist, dass sie bedürfen nicht der Kauf eines zusätzlichen Laborgeräte. Ein Standard-CO 2-Inkubator (~ 6,0 cu. Ft.) wird leicht Platz für vier 10-Schicht Zellfabriken (Abb. 2). Darüber hinaus erfordern diese Gefäße weniger arbeitsintensiv und Platz als Geschirr, Flaschen oder Rollerflaschen, um Zellen und Proteine zu produzieren, ein 10-Schicht Zellfabrik entspricht der Verwendung von 7,5 regelmäßigen Rollflaschen (Tabelle 1). Noch wichtiger ist, passen sich die HEK 293T-Zellen auch in den Gefäßen und sind gut geeignet für die transiente Transfektion von PEI, wodurch eine kostengünstige und effektive Möglichkeit zur kommerziellen Transfektionsreagenzien. Während Zellfabriken ausgelegt sind, Einweg-Zellkultur Plastikwaren sein, haben wir bEEN in der Lage, effizient zu reinigen und wieder verwenden diese Schiffe mehrere Male ohne Probleme Verunreinigung und reduziert dabei deutlich die Kosten pro Einsatz. Die transiente Proteinexpression unter Verwendung eines 10-Schicht Zellfabrik kann zur Herstellung ~ 1-10 mg gereinigtem Protein (4), abhängig von dem Protein und seine Modifikationen. Es ist möglich, aus der Klonierung und Expression kleinen bis zur Fertigstellung von großen Expression und Reinigung in etwa 3-4 Wochen dauern. Zusammenfassend ist eine schnelle, allgemeine Plattform, die sehr nützlich bei der Erzeugung von sezernierten menschlichen oder virale Oberflächenproteine ist. Darüber hinaus kann diese Plattform auch Antikörper, Virus-ähnlichen Partikeln und Adenoviren und Lentiviren für den Gentransfer zu exprimieren.
Wir haben unter gemeinsamer Probleme und mögliche Lösungen aufgelistet. Für eine detaillierte Anleitung zur Fehlerbehebung finden Sie 14.
- Keine oder sehr geringe Proteinexpression:
- Schlechte health der Zellen-Stain den Zellen unter Verwendung von Trypanblau auf Lebensfähigkeit und Test für Mykoplasmen-Kontaminationen. Wenn Zellen einen hohen Durchgang Nummer (> 25 Passagen) haben und wachsen langsam, starten Sie frisch mit neuen HEK 293T-Zellen. Die Transfektionseffizienz und Proteinproduktion nach dem Alter der Zellen in Kultur beeinflusst.
- Schlechte transienten Transfektion-Cells sollte bei einer Konfluenz von 40% transfiziert werden. Die Verhältnisse von DNA zu Transfektionsreagenz sollen optimiert werden.
- Protein instabil ist oder nicht gefaltet-Check des Zellpellets für unlösliche Proteinablagerungen. Testen Sie den Ausdruck des anderen Konstrukten oder homologen Proteins.
- Nr. Protein aus der Säule eluiert:
- Protein auf der Säule zurückgehalten-Eluieren des Proteins von Interesse mit 0,1 M Glycin, pH 2.2 und Analyse durch Western-Blot. Wenn Protein bleibt erhalten, verwenden Sie eine höhere Konzentration von synthetischen HA-Peptid für die Elution oder inkubieren Sie die Spalte bei 37 ° C für längere Zeiträume.
- Anti-HA-column beschädigt-Während die Säule, wenn richtig gereinigt und gelagert, mehrfach wiederverwendet werden können, wird die Leistungsfähigkeit der Säule mit der Zeit ab. Verwenden Sie eine neue Anti-HA-Säule.
- Proteinabbau-Add-Protease-Inhibitoren und halten Protein auf Eis während des gesamten Reinigungsprozesses.
- Protein ausgefällt oder auf aggregierte Spalte-Ist das Protein instabil ist, probieren Sie verschiedene Konstrukte oder Puffer-Bedingungen (zB pH, Salze, Zusatzstoffe, etc.), um die Stabilität von Proteinen zu verbessern.
- Protein nicht in die Spalte-Der HA-Tag darf beerdigt werden oder unzugänglich zu binden. Überprüfen Sie, dass das Protein nicht in der Strömung durch oder waschen.
- Serumalbumin Kontamination:
Rinderserumalbumin (BSA) neigt dazu, nicht spezifisch an den Anti-HA-Harz und kann die HA-Peptid Elutionen verunreinigen. In Abb. 4, wandert BSA als kompakte Bande bei einem scheinbaren Molekulargewicht von ~ 60-65 kDa. In diesem Fall erhöhen die Tween-20-Konzentration in der 1X PBS-Tween20 Wäsche auf 0,2% (v / v) und erhöhen das Volumen der Wäsche. Alternativ kann BSA Verunreinigungen entfernt unter Verwendung von Größenausschlusschromatographie oder Ionenaustauschchromatographie werden.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von einer HIV-Behandlung Ontario Network Research Operating Grant (ROG-G645) und der kanadischen Institutes of Health Research New Investigator Award (MSH-113554) zur JEL, und University of Toronto-Stipendien an HA, FCA, und das JDC unterstützt. Die Autoren bedanken sich Marnie Fusco, Dafna Abelson und Dr. Erica Ollmann Saphire am Scripps Research Institute (La Jolla, CA) danken für die Bereitstellung von Zellen, Ebolavirus GP Expressionsvektor und allgemeine Beratung.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz | Firma | Katalog-Nummer | Kommentare |
| Die alkalische Phosphatase (BCIP / NBT) flüssiges Substrat-Lösung | Sigma | B6404 | |
| Antibiotikum / Antimykotikum, 100X | Invitrogen | 15240062 | |
| Anti-HA Affinitätsmatrix, Klon 3F10 | Roche | 1815016 | |
| Anti-HA murinen mAk, Klon 16B12 | Covance | MMS-101P | |
| Zellkulturflasche, behandelt T75 cm 2 Gewebekultur | Corning | 430641 | |
| Zellkulturflasche, behandelt T225 cm 2 Gewebekultur | Corning | 431082 | |
| Zellkulturplatten ,6-Well-Gewebekulturplatten behandelt | Corning | 3516 | |
| Zellfabrik, 10-Schicht CellSTACK | Corning | 3312 | |
| Centramate Omega 5K Cassette | Leichentuch | OS005C12 | |
| Centramate Omega 30K Cassette | Leichentuch | OS030C12 | |
| Chromatographie-Glassäule, 1.0x10 cm | Kontes | 4204001010 | |
| Ciprofloxacin | Sigma | 17850 | |
| CO 2 | |||
| Dulbeccos modifiziertem Eagle-Medium (DMEM) | Sigma | D5796 | |
| Fötales Rinderserum (FBS), hitze-inaktiviert | Invitrogen | 12484-028 | |
| FuGENE HD Transfektionsreagenz | Promega | 4709691001 | |
| GeneJuice Transfektionsreagenz | EMD / Merck | 70967-6 | |
| Glycine | Sigma | G8898 | |
| Ziege anti-Maus-IgG F (ab ') 2 alkalischen | Thermo Scientific | 31324 | |
| Phosphatase-konjugierten Antikörper | |||
| Hämagglutinin (HA)-Peptid, 100 mg | Genscript | Custom Synthesis | |
| (Sequenz: YPYDVPDYA, 95% Reinheit) | |||
| HEK 293T-Zellen | ATCC | CRL-11268 | |
| Household Bleichmittel (4% w / v Natriumhypochlorit) | verschiedenen Marken stehen zur Verfügung | ||
| Immobilon-P PVDF-Membran | Millipore | IPVH07850 | |
| MiniPrep Plasmid Purification Kit, PureLink Schnellsuche | Invitrogen | K2100-11 | |
| Maxiprep Plasmid Purification Kit, PureLink HiPure | Invitrogen | K2100-07 | |
| NaN 3 | Sigma | S8032 | |
| pDisplay Expressionsvektor | Invitrogen | V660-20 | |
| Penicillin / Streptomycin (Pen / Strep), 100X | Invitrogen | 15140-122 | |
| Phosphat-gepufferte Salzlösung (PBS), sterile 1X | Sigma | D8537 | |
| Polyethylenimin (PEI), lineares 25 kDa | Polyscience | 23966 | |
| Magermilch trockenes Pulver | Nelke | ||
| Stericup-GP PES Vakuumfiltrationsgerät, | Millipore | SCGPU05RE | |
| 0,22 um, 500 ml Fassungsvermögen | |||
| Trypanblau | Invitrogen | 15250061 | |
| Trypsin-EDTA, 0,05% (w / v) | Invitrogen | 25300-054 | |
| Tween-20 | Sigma | P7949 | |
| Valproinsäure | Sigma | P4543 | |
| Centramate Tangentialströmung System | Leichentuch | ||
| CO 2 befeuchteten Inkubator, Standard 6,0 cu. ft. | verschiedenen Marken stehen zur Verfügung | ||
| Elektrophorese und Transfer-Einheit | verschiedenen Marken stehen zur Verfügung | ||
| Inkubator, 37 ° C | verschiedenen Marken stehen zur Verfügung |
Referenzen
- Celik, E., Calik, P. Production of recombinant proteins by yeast cells. Biotechnol. Adv. , (2011).
- Yokoyama, S. Protein expression systems for structural genomics and proteomics. Curr. Opin. Chem. Biol. 7, 39-43 (2003).
- Nettleship, J. E., Assenberg, R., Diprose, J. M., Rahman-Huq, N., Owens, R. J. Recent advances in the production of proteins in insect and mammalian cells for structural biology. J. Struct. Biol. 172, 55-65 (2010).
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: Applications come of age. Biotechnol. Adv. , (2011).
- Lee, J. E. Structure of the Ebola virus glycoprotein bound to an antibody from a human survivor. Nature. 454, 177-182 (2008).
- Bowden, T. A. Structural basis of Nipah and Hendra virus attachment to their cell-surface receptor ephrin-B2. Nat. Struct. Mol. Biol. 15, 567-572 (2008).
- Evans, M. J., Hartman, S. L., Wolff, D. W., Rollins, S. A., Squinto, S. P. Rapid expression of an anti-human C5 chimeric Fab utilizing a vector that replicates in COS and 293 cells. J. Immunol. Methods. 184, 123-138 (1995).
- Ye, J. High-level protein expression in scalable CHO transient transfection. Biotechnol. Bioeng. 103, 542-551 (2009).
- Wurm, F. M. Production of recombinant protein therapeutics in cultivated mammalian cells. Nat Biotechnol. 22, 1393-1398 (2004).
- Lee, J. E., Fusco, M. H., Hessell, A. J., Burton, D. R., Saphire, E. O. Techniques and tactics used in determining the structure of trimeric, prefusion Ebola virus GP. Acta Cryst. 65, 1162-1180 (2009).
- Aricescu, A. R. Eukaryotic expression: developments for structural proteomics. Acta. Crystallogr. D Biol. Crystallogr. 62, 1114-1124 (2006).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta. Crystallogr. D Biol. Crystallogr. D62, 1243-1250 (2006).
- Chang, V. T. Glycoprotein structural genomics: solving the glycosylation problem. Structure. 15, 267-273 (2007).
- Lee, J. E., Fusco, M. H., Saphire, E. O. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nature Protocols. 4, 592-604 (2009).
- Nettleship, J. E., Rahman-Huq, N., Owens, R. J. The production of glycoproteins by transient expression in Mammalian cells. Methods Mol. Biol. 498, 245-263 (2009).
- Neil, S. J., Zang, T., Bieniasz, P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. Nature. 451, 425-430 (2008).
- Nakamura, Y. Heterodimerization of the IL-2 receptor beta- and gamma-chain cytoplasmic domains is required for signalling. Nature. 369, 330-333 (1994).
- Wang, X., Rickert, M., Garcia, K. C. Structure of the quaternary complex of interleukin-2 with its alpha, beta, and gammac receptors. Science. 310, 1159-1163 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten