Method Article
Imaging ad alta risoluzione dal vivo del comportamento delle cellule in via di sviluppo neuroepitelio
In questo articolo
Riepilogo
Imaging del tessuto embrionale in real-time è una sfida per lunghi periodi di tempo. Qui vi presentiamo un test per monitorare i cambiamenti cellulari e sub-cellulare del midollo spinale pulcino per lunghi periodi con elevata risoluzione spaziale e temporale. Questa tecnica può essere adattato ad altre regioni del sistema nervoso e sviluppo embrionale.
Abstract
Il midollo spinale embrionale consiste di bicicletta cellule progenitrici neurali che danno luogo ad una grande percentuale delle cellule neuronali e gliali del sistema nervoso centrale (CNS). Anche se si sa molto sui meccanismi molecolari che motivo il midollo spinale e provocano la differenziazione neuronale 1, 2, ci manca una profonda conoscenza di questi eventi precoci a livello di comportamento cellulare. E 'quindi fondamentale per studiare il comportamento dei progenitori neurali in tempo reale in quanto sottoposti a neurogenesi.
In passato, imaging in tempo reale del primo tessuto embrionale è stato limitato da cellule / tessuti vitalità nella cultura nonché gli effetti fototossici di imaging fluorescente. Qui presentare un nuovo metodo di analisi per immagini come tessuto per lunghi periodi di tempo, utilizzando un romanzo ex vivo protocollo fetta cultura e ampio campo di microscopia a fluorescenza (Fig. 1). Questo approccio realizza lungo termine time-lapse monitoraggio della chick embrionale sPinal cellule progenitrici del midollo con elevata risoluzione spaziale e temporale.
Il test può essere modificato per l'immagine di una vasta gamma di tessuti embrionali 3, 4 Oltre all'osservazione dei comportamenti cellulari e sub-cellulare, lo sviluppo del romanzo e giornalisti molto sensibili per l'attività dei geni (ad esempio, di segnalazione Notch 5) rende questo test un potente strumento con il quale per capire come segnalazione regola il comportamento delle cellule durante lo sviluppo embrionale.
Protocollo
1. Dish Preparazione
- I piatti utilizzati per la cultura slice sono il fondo di vetro (con un coprioggetto come base) (piatti WillCo). Questi sono posizionati sul tessuto lente in un piatto tessuto 6 centimetri cultura per mantenere il fondo di vetro pulito.
- Il giorno prima dell'esperimento, si aggiungono 2 ml 0,1% di poli-L-lisina soluzione al fondo piatto di vetro e incubare per 5 min a temperatura ambiente per permettere la poli-L-lisina per rivestire il fondo di vetro.
- Rimuovere poli-L-lisina soluzione e sciacquare tre volte in acqua deionizzata, e poi una volta in 70% etanolo.
- Lasciare asciugare per una notte. I piatti possono anche essere asciugati con blando riscaldamento in un forno a microonde a bassa potenza per 30-45 secondi.
2. Embryo Elettroporazione
- Incubare le uova a 37 ° C a Hamburger-Hamilton (HH) stage 10 (circa 36 ore) (o altro livello a scelta).
- Prima di iniziare la preparazione aghi di vetro (usiamo un Flaming / modello di Brown p87 puller microcapillare) e rompere la punta del needle utilizzando una pinza sottile sotto un microscopio da dissezione. La fine dell'ago dovrebbe essere abbastanza sottili da perforare l'embrione, pur non essendo così stretta che impedisce l'iniezione della soluzione di DNA.
- Uova finestra ed elettrodi (5mm posto a parte) su entrambi i lati dell'embrione
- Iniettare DNA (~ 0,025-0,5 pg / pl in acqua deionizzata colorato con una piccola quantità di verde veloce) nel tubo neurale.
- Applicare corrente - 12-17 V tre volte, lunghezza di impulso 50ms con 950 ms tra gli impulsi.
- Usiamo basse concentrazioni di DNA e delle tensioni di elettroporazione basse per ottenere l'espressione del mosaico in modo da poter seguire le singole celle.
- Coprire finestra nel guscio con cellotape e assicurarsi che sia sigillato.
- Lasciare embrioni di recuperare per 3-4 ore o durante la notte a 37 ° C.
3. Il collagene e Cultura Preparazione Slice Media
- Preparare mix collagene e terreno di coltura fetta circa un'ora prima di affettarlo.
- A 300 t plipo 1 collagene aggiungere 100 microlitri soluzione 0,1% di acido acetico e 100 pl 5 x L15 mezzo. Vortex accuratamente dopo ogni aggiunta. La soluzione dovrebbe diventare gialla.
- Ora aggiungere bicarbonato di 15-20 microlitri di sodio 7,5% e completamente vortice. La soluzione dovrebbe diventare leggermente rosa, e il volume di bicarbonato di sodio richiesti per questo può variare. Tenere su ghiaccio e portare fresca ogni volta.
- Per aggiungere 10 ml di terreno neurobasal B-27 e integratore Glutamax, ad una concentrazione finale di 1 x soluzione di Gentamicina e 10 pl.
- Luogo in media a 37 ° C incubatore tamponata con il 5% di CO 2. Lasciare la parte superiore del contenitore allentata per consentire equilibrare con la CO 2.
4. Slice Cultura
- Rimuovere gli embrioni da uovo e lavare in media L15.
- In un piatto di coltura tissutale con uno strato di Sylgard sul fondo e perno fuori attraverso i circostanti extra-embrionali membrane in modo che siano ben teso.
- Utilizzo di un microfonoroknife, embrione fetta più diritta possibile attraverso la regione di interesse. Per il midollo spinale, fette dovrebbe essere compreso tra 1-2 somiti spessore. Lasciare collegati a fette embrione mentre si affettare altri embrioni in modo da non perderli.
- Preparare una punta di 200 microlitri micropipetta tagliando ~ 1 mm della punta e allegando ad un p2 o p10. Questa punta verrà utilizzato per trasferire le fette midollo spinale al fondo piatto di vetro. A 10 microlitri punta non è sufficientemente ampio per raccogliere fette.
- Rivestire l'interno della punta con il collagene pipettando 1 mix ul collagene preparato in precedenza. Lasciare agire per 1-2 minuti e poi risciacquare con L15 media. Ciò impedirà il tessuto si attacchi all'interno della punta.
- Staccare fetta dall'embrione utilizzando una microknife e togliere dal piatto con un p2 p10 o munito di una punta 200 pl e impostare a 1 microlitri. Prova di prendere come mezzo meno possibile.
- Il collagene mix e goccia Vortex 5-8 pl di questa al poli-L-lisina piatto rivestito.
- Immediatamente messo fetta embrione in collagene e la posizione in posizione con un paio di pinze sottili. Fette devono essere posizionati in modo che il lato di essere ripreso è a filo con il coprioggetto. Il tessuto deve aderire al poli-L-lisina rivestimento sul vetrino.
- Ripetere questa operazione finché non avrete fette più sul vetrino. Di solito possiamo mettere 6-9 fette su un piatto.
- Una volta che tutte le fette sono in posizione, coprire il piatto e permettono di impostare il collagene per 20 minuti. Alcuni dei primi collagene posto potrebbe essere già iniziato ad asciugarsi. Per evitare questo aggiungere una piccola quantità di L15 a questi prima copertura.
- Una volta impostata, aggiungere cautamente 2ml terreno di coltura fetta che è stata equilibrata in 5% CO 2 a 37 ° C per almeno un'ora. Bisogna fare attenzione a non staccare il collagene dal vetrino.
- Posto a 37 ° / 5% CO 2 incubatore e consentire fette di recuperare per almeno 3 ore prima di imaging. Se non c'è, piatto di umidità posto in uno spirito box perspexha bit di carta velina umida in un angolo.
5. Imaging embrioni Slices
- Usiamo un Core DeltaVision ampio campo ottico dotato di una camera Weatherstation ambientale fette di immagine. La camera è mantenuta costantemente a 37 ° C, con CO 2 apparato perfusione di mantenere la fase microscopio al 5% CO 2/95% aria.
- Imaging viene normalmente eseguita con un 40 x / NA 1,30 Olio per lenti ad immersione e le immagini vengono catturate con un HQ2 CoolSnap raffreddato camera CCD.
- Z sezioni vengono catturati ogni 1,5 um a 45 um tessuto. Il tempo di esposizione deve essere mantenuto il più basso possibile. Di solito esporre per 5-50 ms per ogni Z-sezione. Le immagini vengono catturate ogni 7 minuti e fino a 9 sezioni può essere visitata utilizzando il punto preciso del sistema DeltaVision di visita funzione.
6. Risultati rappresentativi
Un time-lapse sequenza di esempio di una cellula progenitrice midollo spinale èmostrato nella fig. 2a e Movie corrispondente 1. Imaging è stato avviato su una fetta del midollo spinale da una due-giorni di età (HH stage 12) dell'embrione. Questa cella è stata transfettata con un costrutto che esprime GFP-αTubulin. Durante questa prima fase, le cellule progenitrici neurali subiscono prevalentemente progenitrice progenitrici divisioni-mode durante il quale le cellule si dividono per generare due cellule progenitrici ulteriori ciclismo. Fig. Film 2b e corrispondente 2 mostra una cellula trasfettata con GFP-GPI (ancorata a GPI GFP), segna la membrana cellulare. Questa cellula subisce una divisione durante il quale il processo basale si divide in due ed è ugualmente ereditato dalle cellule figlie.
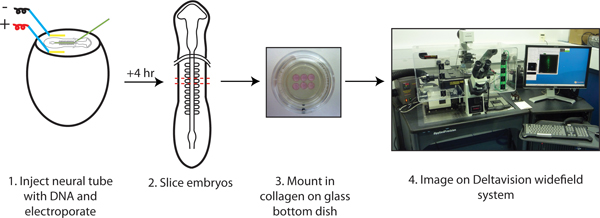
Figura 1. Slice protocollo di cultura per time-lapse imaging.

Figura 2. Cellule Behavior durante il normale sviluppo del midollo spinale. (a) i fotogrammi selezionati da Movie 1. Cellulari esprimenti GFP-tubulina divide con un piano di clivaggio che è perpendicolare alla superficie apicale (2 h 20 min), generando due cellule figlie che dividono ancora una volta (24 h 23 min e 25 h 54 min). (B) i fotogrammi selezionati da Movie 2. Cellule trasfettate con GFP-GPI subisce divisione cellulare in cui è suddiviso il processo basale (frecce bianche) e ugualmente ereditato dalle cellule figlie.
Movie 1. Clicca qui per vedere il film .
Movie 2. Clicca qui per vedere il film .
Discussione
Vi presentiamo qui un nuovo time-lapse test di imaging per monitorare il comportamento delle cellule in coltura fetta di pollo embrionale. Questo test permette l'imaging ad alta risoluzione di tessuti viventi per un massimo di 70 ore, anche se le scadenze tra 24-48 ore sono più facili da catturare. L'uso di un olio ad alta obiettivo NA e intervalli relativamente brevi tra i punti temporali consente l'acquisizione di immagini ad alta risoluzione, oltre a permettere di monitorare il comportamento cellulare che si verifica spesso rapidamente, e può essere facilmente perso durante convenzionale time-lapse imaging mediante confocale microscopia.
Il vantaggio principale di questo saggio è la capacità di celle di immagine per lunghi periodi di tempo. L'uso di ampio campo 6 invece di scansione laser confocale 7 microscopia è critico per questo. Microscopia confocale ha tradizionalmente offerto numerosi vantaggi rispetto ad ampio campo di microscopia, compresa la capacità di prendere sezioni ottiche ed eliminare di informazioni messa a fuoco direttamente 7, ma l'uso di un foro porta ad una perdita di luce al rivelatore 8, escludendo una quantità significativa di informazioni, e che richiede tempi di esposizione più lunghi. Wide-microscopia a campo, invece, utilizza illuminazione pieno campo e tutta la luce che passa attraverso l'obiettivo viene inviato al rivelatore. Questa accoppiata con uno ad alta efficienza quantica raffreddato Coupled Device (CCD) telecamera garantisce immagini con un elevato rapporto segnale-rumore rispetto alla microscopia confocale 9, con tempi di esposizione molto veloci. Nella nostra applicazione, dobbiamo immagine per lunghi periodi, record stack 3D e in ultima analisi, risolvere piccoli-vicino-diffrazione di strutture limitate. Sebbene microscopia confocale impedisce fuori-fuoco luce raggiunga il rivelatore e quindi riduce significativamente fondo in spessore, densamente-etichettati campioni 7, 8, si realizza solo utilizzabile segnale-rumore di ingresso luce molto più grande di ampio microscopia a campo 10. Per sparsel molto sensibile alla lucecampioni y-etichettati come i nostri fette elettroporate del midollo spinale, quindi, ampio microscopia a campo si comporta meglio di microscopia confocale. In combinazione con il ripristino dell'immagine deconvoluzione, che rimuove le informazioni fuoco e migliora il contrasto, a grande campo è quindi particolarmente indicato per il rilevamento di oggetti piccoli, dim 11. Anche se non è appropriato per ogni esperimento imaging dei tessuti, questo approccio è stato molto efficace per la nostra applicazione dal vivo imaging cellulare.
La scelta della proteina fluorescente è un importante fattore che può influenzare la sopravvivenza cellulare. Abbiamo trovato che i migliori risultati sono ottenuti dai costrutti che utilizzano la proteina fluorescente verde (GFP) 12 come marcatore. Stiamo valutando una serie di rossi proteine fluorescenti che possono essere efficacemente impiegati in combinazione con GFP per doppio canale time-decade. Ci sono una varietà di tali proteine disponibile 13. Sebbene molte proteine sono stabili come fusioni con una proteina fluorescente, Alcune proteine possono essere reso instabile per fusione, con conseguente riduzione della vitalità cellulare. In tali casi, l'uso di costrutti contenenti un sito interno di entrata del ribosoma (IRES) è utile per separare la proteina di interesse dalla proteina fluorescente.
Quando le fette di imaging del midollo spinale, la cura deve essere adottate per minimizzare l'esposizione alla luce fluorescente. Gli oculari del microscopio deve essere utilizzato solo a luce trasmessa (campo chiaro) per individuare e posizionare le fette. Immagini fluorescenti devono sempre essere acquisito utilizzando il software microscopio usando tempi di esposizione minimi. Questi dovrebbero essere mantenuto nella gamma di 5-50 ms e l'uso di filtri di densità neutri deve essere sperimentato. Anche se i tempi di esposizione più lunghi può inizialmente produrre immagini più nitide, gli effetti fototossiche di esposizione alla luce fluorescente può portare alla morte cellulare. I primi 5-10 um di tessuto che è più vicino al vetrino non deve essere immaginato come questa regione contiene tessuto che potrebbero essere danneggiati duranteaffettare.
Sebbene gli esempi presentati qui sono di embrioni in stadio elettroporata HH 10 e ripreso 6-7 ore dopo, questo metodo può essere usato per embrioni fino a SS stadio 18. Nelle fasi successive, il tessuto del midollo spinale è molto più grande ed è così difficile da tagliare a mano. In questi casi, gli embrioni incorporamento in agarosio a basso punto di fusione e sezionamento con un vibratomo possono ottenere risultati migliori. Anche se presentiamo questo test come metodo di imaging per le cellule del midollo spinale di sviluppo, questo approccio è stato modificato ad altri tessuti embrionali di immagini, compreso il sensoriale placodes 3.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente | Azienda | Numero di catalogo | Comments |
| WillCo Dish | WillCo Wells | GWst-3522 | |
| poli-L-lisina | Sigma | P8970 | 0,1% in Tris |
| Vetro borosilicato capillari | Harvard Instruments | GC100-10 | 1,0 millimetri di diametro esterno, 0,58 millimetri di diametro interno |
| Elettrodi (Genetrodes, in ovo, a forma di L | BTX | 10-001850-01 | 5 millimetri placcato in oro |
| ECM 830 quadrato generatore di impulsi | BTX | 45-0002 | per l'ovo in electroopration |
| Fast Green | Sigma | F7258 | |
| Collagene di tipo I ratti | Sigma | C3857 | |
| L-15 (polvere) | Sigma | 2,76 g / L in acqua distillata per soluzione 5x | |
| Bicarbonato di sodio | Sigma | S8761 | 7,5% soluzione |
| Media Neurobasal | Invitrogen | 12348-017 | senza rosso fenolo |
| Glutamax | Invitrogen | A1286001 | Soluzione 100x |
| B-27 supplemento | Invitrogen | 17504-044 | |
| Gentamicina | Invitrogen | 15710049 | 10 mg / ml |
| L15 media (liquido 1x) | Invitrogen | 11415-049 | |
| Microknife | Altomed | A10102 | 15 gradi di pendenza |
| Perni in acciaio inox senza testa | Watkins e Doncaster | E6871 | Formato A1 |
| Sylgard 184 elastomero | VWR | 634165S | |
| DeltaVision cuore del sistema microscopio | Applied Precision | ||
| Coolsnap HQ2 telecamera CCD | Fotometrici |
Riferimenti
- Ulloa, F., Briscoe, J. Morphogens and the Control of Cell Proliferation and Patterning in the Spinal Cord. Cell Cycle. 6, 2640-2649 (2007).
- Briscoe, J., Novitch, B. G. Regulatory pathways linking progenitor patterning, cell fates and neurogenesis in the ventral neural tube. Philosophical Transactions of the Royal Society B: Biological Sciences. 363, 57-70 (2008).
- Shiau, C., Das, R., Storey, K. An effective assay for high cellular resolution time-lapse imaging of sensory placode formation and morphogenesis. BMC Neuroscience. 12, 37 (2011).
- Wilcock, A. C., Swedlow, J. R., Storey, K. G. Mitotic spindle orientation distinguishes stem cell and terminal modes of neuron production in the early spinal cord. Development. 134, 1943-1954 (2007).
- Vilas-Boas, F., Fior, R., Swedlow, J. R., Storey, K. G., Henrique, D. A novel reporter of notch signalling indicates regulated and random notch activation during Vertebrate neurogenesis. BMC Biology. 9, 58 (2011).
- Herman, B. Fluorescence microscopy. Bios Scientific Publishers. , (1998).
- Conchello, J. -. A., Lichtman, J. W. Optical sectioning microscopy. Nat. Meth. 2, 920-931 (2005).
- Pawley, J. B., Pawley, J. B. . Fundamental Limits in Confocal Microscopy Handbook Of Biological Confocal. , (2006).
- Swedlow, J. R., Hu, K., Andrews, P. D., Roos, D. S., Murray, J. M. Measuring tubulin content in Toxoplasma gondii: A comparison of laser-scanning confocal and wide-field fluorescence microscopy. Proceedings of the National Academy of Sciences. 99, 2014-2019 (2002).
- Murray, J. M., Appleton, P. L., Swedlow, J. R., Waters, J. C. Evaluating performance in three-dimensional fluorescence microscopy. Journal of Microscopy. 228, 390-405 (2007).
- Biggs, D. S. C. 3D Deconvolution Microscopy. Current Protocols in Cytometry. , (2001).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W., Prasher, D. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Wiedenmann, J., Oswald, F., Nienhaus, G. U. Fluorescent proteins for live cell imaging: Opportunities, limitations, and challenges. IUBMB Life. 61, 1029-1042 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon