Method Article
La radioterapia combinata in un modello di tumore ortotopico cervello di topo
In questo articolo
Riepilogo
Lo scopo di questo articolo è quello di descrivere l'utilizzo di un modello di glioblastoma ortotopico per gli studi di chemio-radioterapia. Questo articolo passare attraverso l'elaborazione delle cellule, l'impianto, e la radioterapia del mouse utilizzando un modello intracranica.
Abstract
Glioblastoma multiforme (GBM) sono le più comuni e aggressivi tumori cerebrali primari adulti 1. Negli ultimi anni sono stati compiuti progressi sostanziali nella comprensione dei meccanismi di invasione tumorale, e diretta inoculazione intracerebrale del tumore offre l'opportunità di osservare il processo invasivo in un ambiente fisiologicamente appropriato 2. Per quanto riguarda i tumori del cervello umano sono interessati, i modelli ortotopici attualmente disponibili sono stabiliti mediante iniezione stereotassica di sospensioni cellulari o impianto di un pezzo solido di tumore mediante una procedura complicata craniotomia 3. Nella nostra tecnica si raccogliere cellule da coltura tissutale per creare una sospensione di cellule utilizzata per impiantare direttamente nel cervello. La durata dell'intervento è di circa 30 minuti, e come il mouse deve essere in un piano costante chirurgico, un anestetico iniettabile viene utilizzato. Il mouse viene posizionato in un telaio stereotassico fatta da Stoetling (figura 1). A poppaer la zona chirurgica viene pulito e preparato, si pratica un'incisione, e il bregma si trova per determinare la posizione del craniotomia. La posizione del craniotomia è di 2 mm verso destra e 1 mm anteriore del bregma. La profondità di 3 mm dalla superficie del cranio, e le cellule vengono iniettate ad una velocità di 2 microlitri ogni 2 minuti. La pelle viene suturata con 5-0 PDS, e il mouse è autorizzato a svegliarsi su una piastra elettrica. Dalla nostra esperienza, a seconda della linea cellulare, il trattamento può avvenire da 7-10 giorni dopo l'intervento. Somministrazione di farmaci dipende dalla composizione di farmaco. Per la radioterapia i topi vengono anestetizzati, e metterlo in una maschera su misura. Piombo copre il corpo del topo e espone solo il cervello del mouse. Lo studio della tumorigenesi e la valutazione di nuove terapie per GBM richiedono accurati e riproducibili cerebrali modelli animali tumorali. Così usare questo modello ortotopico cervello per studiare l'interazione del microambiente del cervello e il tumore, per testare il EFFICACIAess di diversi agenti terapeutici con e senza radiazioni.
Protocollo
I. Preparazione cellulare
- Le cellule vengono coltivate a confluenza in DMEM con 10% FBS circa un 80% confluenti 225 centimetri pallone da 3 per ogni 5 topi per essere impiantate.
- Aspirare mezzi fuori delle cellule, lavare con 10 ml di PBS senza calcio o magnesio. Aspirato PBS le cellule.
- Tripsinizzare le cellule con 3 ml di tripsina, attendere 10-15 min, e neutralizzare la tripsina con 15 ml di mezzo.
- Pipettare tutte le cellule ei media in una ml 50 conica. Due flaconi grandi inserirsi in uno da 50 ml.
- Spin celle a 1600 rpm per 7 minuti a 4 ° C. Completamente Aspirare il surnatante. Risospendere le cellule in 10 ml di PBS freddo, e risciacquare cellule delicatamente pipettando su e giù. Assicurarsi che il pellet di cellule è mescolato uniformemente con la PBS. La sospensione deve essere torbida.
- In questo momento un conteggio delle cellule avviene tramite un contatore Coulter. Le cellule vengono centrifugate nuovamente a 1600 rpm per 7 minuti a 4 ° C.
- Dopo la centrifugazione 2 ° delle cellule, comepirata tutti PBS e risospendere in 1 ml di PBS.
- Le cellule vengono filate in 1 ml di PBS a 3000 rpm per 10 min a 4 ° C. Il PBS viene aspirata, e PBS viene aggiunto per regolare la concentrazione finale di 1x10 6 per 5 microlitri di cellule U87, altre linee cellulari possono richiedere un numero diverso e concentrazione di cellule per la crescita tumorale ottimale.
- Dopo che il volume finale e concentrazione si ottiene le cellule sono tenuti in ghiaccio in una provetta Eppendorf.
II. Xenotrapianto
- Preparazione del topo
- I topi vengono anestetizzati mediante iniezione di un mix ketamina / Xylazina / Saline. La miscela è 120 mg / kg di Ketamina, 16 mg / kg di Rompun e Saline. I topi vengono pesati singolarmente e dato 0,1 ml ogni 10 g in base al loro peso. L'anestesia viene praticata con ago 26G collegato al 1 IP ml siringa. Ci vorranno circa 15 min per i topi di raggiungere una fase di sonno per non risposta al dolore. È possibile controllare la risposta al dolore dellatopi di pizzicare la loro zampa.
- Dopo il mouse è completamente anestetizzato, unguento oculare viene somministrato ai loro occhi per evitare che si secchi.
- Il mouse è posizionato sul letto del stereotassica con i denti anteriori superiori della tacca sulla barra di bocca. Il letto viene poi inserito nel stereotassico.
- La guardia naso è posta sopra il naso del mouse per impedire il movimento della testa, e le barre di auricolari sono gentilmente inserire nei canali dell'orecchio dei topi. Fare attenzione a non fare né il posizionamento della barra naso o barre di auricolari troppo stretti, come il cranio possono fratturarsi e / o impedire il mouse di respirare.
- Assicurarsi che la testa del mouse è il livello utilizzando le tacche sul stereotassica è utile durante questo processo.
- Per la preparazione iodio topo, alcol e providine viene applicato liberamente sulla testa del mouse alternata per un totale di 3 applicazione delle applicazioni alcool e 3 di iodio. Una applicazione finale di un tampone di alcool con il 70% viene applicatala testa.
- Procedura chirurgica
- Tutti gli strumenti della procedura devono essere sterilizzati in autoclave o sia immergendo gli strumenti in etanolo al 70% prima di iniziare la procedura.
- L'incisione viene fatta sulla sommità del cranio dietro l'occhio destro in diagonale indietro alla posteriore sinistra del cranio. L'incisione dovrebbe essere circa 10 mm a 15 mm.
- Usando un Q-tip, lentamente separare l'incisione per esporre il cranio e spazzare via la membrana che è tra il cranio e la pelle. Utilizzare un Q-tip a cancellare il sangue e guardare per sanguinamento eccessivo.
- Esporre la parte superiore del cranio per visualizzare il bregma. Utilizzando il punto di siringa Hamilton, posizionarlo sopra il bregma. La corretta posizione del foro da praticare nel cranio è 2 destra mm e 1 mm anteriore del bregma (figura 2). Un chirurgo punta di feltro o marcatore, che viene acquistato sterile, è usato per indicare la posizione del foro da forare. Si noti che il foro si trova vicino alla unosulla linea di sutura terior.
- Quindi praticare un piccolo foro nel cranio nella posizione indicata usando la punta di un ago 22G in un vaso PIN o alimentato attraverso un ago 18G.
- Caricare il 10 pl vetro Hamilton siringa con 5 microlitri di cellule. La siringa Hamilton è 10 microlitri con una 30G a 33G blunt ago fisso collegato ad esso. Assicurarsi di mescolare le cellule prima di caricarli, sia pipettando loro o utilizzando una siringa da 1 ml con un ago 25G attaccato. Dopo la siringa Hamilton è stato caricato, porla di nuovo in braccio per allinearla con il foro nel cranio.
- Abbassare l'estremità smorzata dell'ago alla superficie del cranio, una volta che l'ago è a livello del cranio, abbassare l'ago fino a che si trova alla profondità di 3 mm sotto la superficie del cranio.
- Dopo che l'ago è abbassato, esso rimane per 2 minuti per evitare qualsiasi trauma grave dall'ago che colpiscono il cervello. Impianto delle cellule è ad una velocità di 1 pl al minuto per un totale di 6-8 minuti, attenzione di qualsiasi backflow. Dopo l'ultima delle cellule sono stati impiantati, lasciare l'ago in posizione per altri 2 minuti, per permettere a tutte le cellule di sedimentare dentro
- Togliere l'ago dal cervello, e pulire il foro con un Q-tip. Procedere alla pulizia della ago e siringa con 50% acetone, 100% EtOH, e PBS, 3x in ciascuna soluzione e in questo ordine.
- La pelle del cranio è pronto per essere suturato in questo punto. Utilizzando 5-0 PBS chiudere l'incisione con circa 3 punti di sutura.
- Lasciare il mouse per svegliarsi su un blocco di calore, e riapplicare unguento oculare, se necessario. Il mouse può essere restituito alla gabbia dopo che mostra il movimento da solo (cioè Sollevando la testa o spostando le spalle).
III. Il trattamento dell'impianto IC By Radiation and Drug
- Radioterapia
- A seconda della linea cellulare, il trattamento dei topi può avvenire 5 a 7 giorni dopo l'impianto. Il nostro reparto utilizza una unità di radioterapia per il trattamento orthovoltage radiazionimento.
- Imaging come BLI (Imaging bioluminescenza), RM o TC può essere usato per visualizzare il tumore prima della randomizzazione (figura 3A).
- I topi sono anestetizzati con il cocktail di ketamina / Xylazina / soluzione salina come prima, e pomate oftalmiche viene applicata ai loro occhi.
- I topi sono posizionati in una dima personalizzato radiazione fatto che è configurata come una ruota torta, in cui le teste dei topi puntare verso il centro. I corpi dei topi sono schermati dalla radiazione con il piombo.
- Il trattamento farmacologico può essere somministrato prima o radiazione attraverso percorsi di consegna diversi, ad esempio SQ, di IP e IV.
IV. Risultati
Il mouse deve svegliarsi dalla procedura entro 45-60 minuti dopo l'iniezione anestesia. Se il mouse è difficilmente risveglio dopo la procedura e il tempo ha superato 1 ½ ora dopo la procedura, il mouse non può recuperare e l'eutanasia può essere un'alternativa efficace. Se there è il sanguinamento eccessivo o il teschio diventa incrinato in qualsiasi momento durante la procedura di eutanasia è consigliato. Se tutto va bene e, a seconda della linea cellulare, un tumore dovrebbe iniziare a formare entro 2-4 settimane dopo l'intervento ha luogo. Quando si utilizzano modelli di xenotrapianto intracraniche, l'efficacia terapeutica è di solito misurato come la sopravvivenza post-impianto 5. Tuttavia, poiché questo è un modello IC segni ed i sintomi si verificano prima della morte. Alcuni dei segni fisici del mouse si può presentare una postura ricurva, perdita di peso corporeo, e l'inattività. Alcuni dei segni neurologici possono essere convulsioni, inclinazione testa, e la perdita di equilibrio. Figura 3B mostra un HE macchia di un tumore alla mortalità. A Kaplan-Meier è utilizzato per valutare i dati (figura 4). Il numero di giorni di sopravvivenza al 50% e vengono calcolati rispetto al controllo. Se il gruppo di combinazione vissuto più a lungo l'aggiunta della radiazione singolo farmaco e braccia la combinazione è avuto successo.

Figura 1. L'apparecchiatura Stoelting stereotassica.
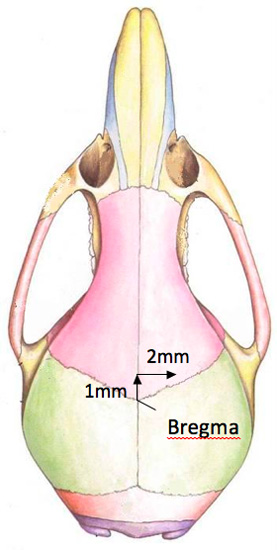
Figura 2. Un diagramma della posizione del foro nel cranio topo.
Figura 3A. BLI immagini dopo l'impianto GBM.

Figura 3B. H e E di tumore con una mortalità per GBM.

Figura 4. Risultati U87 IC impianti iniettati con inibitore di PARP 7 giorni dopo l'intervento chirurgico.
Discussione
Gliomi maligni, quali glioblastoma multiforme, rappresentano i più comuni tumori cerebrali primari e hanno una prognosi infausta 4. La sopravvivenza dei pazienti affetti da GBM è rimasto praticamente invariato negli ultimi dieci anni (cioè, 9-12 mesi post-diagnosi), nonostante i progressi nella chirurgia, radioterapia e chemioterapia 5. Le caratteristiche di un modello appropriato per lo studio del trattamento glioma dovrebbe includere una posizione riproducibile tumore e la crescita delle cellule come un tumore relativamente discreto, le cellule dovrebbe assomigliare quanto più possibile le caratteristiche istologiche di gliomi umani, dovrebbe esserci una crescita prevedibile velocità del tumore, la capacità di crescere il tumore in coltura tissutale e il modello dovrebbe essere in un piccolo animale per ridurre l'onere 6. Trattamenti efficaci dipendono da modelli sperimentali che ricordano da vicino le caratteristiche GBM umani per testare una nuova terapia e fornendo un'accurata comprensione delle basi molecolari di widespread glioma invasione 7. Indagini sulla biologia dei tumori cerebrali hanno utilizzato di routine linee cellulari coltivate o mantenute in vitro per ottenere informazioni 8. L'inibizione di invasione del tumore e l'angiogenesi è uno dei principali obiettivi nello sviluppo di nuove strategie terapeutiche contro i gliomi maligni 9. Le opzioni limitate trattamenti per glioblastoma hanno guidato una ricerca intensiva sulle alterazioni genetiche alla base di questo cancro mortale, con l'obiettivo lo sviluppo di terapie più razionali e più efficaci 10.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Questa ricerca è sostenuta da un finanziamento del programma intramurale del NIH.
Materiali
| Name | Company | Catalog Number | Comments |
| Lab standard stereotassico Instrutment | Stoelting mouse e adattatore Rat | ||
| Betadine | 100% EtOH | ||
| 70% EtOH | 50% Acetone | ||
| 6 "Q-tips | Tamponi imbevuti di alcol | ||
| Hamilton siringa 80008 | Ethicon 5-0 PD | ||
| 1701 SN 31-33G / 1 "/ PT3 ago | 1 ml siringhe | ||
| Aghi 25G | Riscaldamento pad | ||
| Artificial Tears Pomata | Molto raffinato marcatore permanente a punta |
Riferimenti
- Bleau, A. M., Holland, E. Trapping the mouse genome to hunt human alternations. Proc. Nat. Acad. Sci. U.S.A. 104, 7737-7738 (2007).
- McGrady, B. J., McCormick, D. A murine model of intracranial invasion: morphological observations on central nervous system invasion by melanoma cells. Clin. Exp. Metastasis. 10, 387-393 (1992).
- Fei, X., Zhang, Q., Dong, J., Diao, y., Wang, Z., Li, R., Wu, Z., Wang, A., Lan, Q., Zhang, S., Huang, Q. Development of clinically relevant orthotopic xenograft mouse model of metastatic lung cancer and glioblastoma through surgical tumor tissues injection with trocar. Journal of Experimental & Clinical Cancer Research. 29, 84-84 (2010).
- Fujita, M., Zhu, X., Sasaki, K., Ueda, R., Low, K., Pollack, I., Okada, H. Inhibition of STAT3 Promotes the Efficacy of Adoptive Transfer Therapy Using Type-1 CTLs by Modulation of the Immunological Microenvironment in a Murine Intracranial Glioma. J. Immunol. 180, 2089-2098 (2008).
- Candolfi, M., Curtin, J. F., Nichols, W. S., Muhammad, A. K. M. .. . G., King, G., Pluhar, G. D., McNiel, G. E., Ohlfest, E. A., Freese, J. R., Moore, P. F. Intracranial glioblastoma models in preclinical neuro-oncology: neuropathlogical characterization and tumor progression. J. Neurooncol. 85, 133-148 (2007).
- Kaye, A., Morstyn, G., Gardner, I., Pyke, K. Development of a xenograft glioma model in mouse brain. Cancer Research. 46, 1367-1373 (1986).
- Zhao, Y., Xiao, A., diPierro, C., Carpenter, J., Abdel-Fattah, R., Redpath, G., Lopez, M., Hussaini, I. An Extensive Invasive Intracranial Human Glioblastoma Xenograft Model. American Journal of Pathology. 176, 3032-3049 (2010).
- Learn, C., Grossi, P., Schmittling, R., Xie, W., Mitchell, D., Karikari, I., Wei, Z., Dressman, H., Sampson, J. Genetic Analysis of Intracranial Tumors in a Murine Model of Glioma Demonstrate a Shift in Gene Expression in Response to Host Immunity. J. Neuroimmunol. 182, 63-72 (2007).
- Martens, T., Laabs, Y., Günther, H., Kemming, D., Zhu, Z., Witte, L., Hagel, C., Westphal, M., Lamszus, K. Inhibition of Glioblastoma Growth in a Highly Invasive Nude Mouse Model Can Be Achieved by Targeting Epidermal Growth Factor Receptor but not Vascular Endothelial Growth Factor Receptor-2. Clin. Cancer Res. 14, 5447-5458 (2008).
- Purow, B., Schiff, D. Advances in the genetics of glioblastoma: are we reaching critical mass. Nat. Rev. Neurol. 5, 419-426 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon