Method Article
Combinación de radioterapia en un modelo ortotópico de tumor cerebral del ratón
En este artículo
Resumen
El propósito de este artículo es describir el uso de un modelo ortotópico de glioblastoma para los estudios de quimiorradioterapia. En este artículo se irá si el procesamiento de células, la implantación, y la radioterapia del ratón usando un modelo intracraneal.
Resumen
El glioblastoma multiforme (GBM) son los más comunes y agresivos tumores cerebrales en adultos de primaria 1. En los últimos años ha habido un progreso sustancial en la comprensión de los mecanismos de invasión tumoral y la inoculación directa de un tumor intracerebral ofrece la oportunidad de observar el proceso invasivo en un entorno fisiológico de 2. En cuanto a los tumores del cerebro humano se refiere, los modelos disponibles en la actualidad ortotópico se establecen, ya sea por inyección estereotáxica de suspensiones celulares o el implante de una pieza sólida de tumor a través de un procedimiento de craneotomía complicada 3. En nuestra técnica se cosechan las células de cultivo de tejidos para crear una suspensión celular utilizada para implantar directamente en el cerebro. La duración de la cirugía es de aproximadamente 30 minutos, y como el ratón tiene que estar en un plano quirúrgico constante, un anestésico inyectable que se usa. El ratón se coloca en una plantilla estereotáxica hecha por Stoetling (figura 1). En popaer el área quirúrgica se limpia y se prepara, se hace una incisión; y el bregma está localizado para determinar la ubicación de la craneotomía. La localización de la craneotomía es de 2 mm a la derecha y 1 mm rostral al bregma. La profundidad es de 3 mm de la superficie del cráneo, y las células se inyectan a un ritmo de 2 l cada 2 minutos. La piel se sutura con 5-0 PDS, y el ratón se le permite despertar en una almohadilla térmica. Desde nuestra experiencia, en función de la línea celular, el tratamiento puede llevarse a cabo de 7-10 días después de la cirugía. Entrega fármaco depende de la composición del fármaco. Para el tratamiento de radiación que los ratones se anestesiaron, y poner en una plantilla de encargo. El plomo cubre el cuerpo del ratón y expone sólo el cerebro del ratón. El estudio de la tumorigénesis y la evaluación de nuevas terapias para MBG requieren exactos y reproducibles cerebrales modelos animales de tumores. Así que utilizamos este modelo ortotópico del cerebro para estudiar la interacción del microambiente del cerebro y el tumor, para comprobar la EFICACIAceso de diferentes agentes terapéuticos con o sin radiación.
Protocolo
I. Preparación de la célula
- Las células se crecieron hasta confluencia en DMEM con FBS al 10% sobre un 80% confluente 225 cm 3 matraz por cada 5 ratones para ser implantados.
- Aspirar medios fuera de las células; lavar con 10 ml de PBS sin calcio o magnesio. Aspirar PBS fuera de las células.
- Trypsinize células con 3 ml de tripsina, esperar 10-15 min, y neutralizar la tripsina con 15 ml de medio.
- Pipetee todas las células y los medios en un cónico de 50 ml. Dos matraces grandes encajar en un cónico de 50 ml.
- Girar las células a 1600 rpm durante 7 min a 4 ° C. Totalmente aspirar sobrenadante. Resuspender las células en 10 ml de PBS frío, y enjuague células pipeteando suavemente hacia arriba y hacia abajo. Hacer que el sedimento celular se mezcla uniformemente con el PBS. La suspensión debe ser turbia.
- En este momento un recuento de células se realiza mediante un contador Coulter. Las células se centrifugan de nuevo a 1600 rpm durante 7 min a 4 ° C.
- Después de la centrifugación 2 ª de las células, comopirata todo PBS y resuspender en 1 ml de PBS.
- Las células se hacen girar en la 1 ml de PBS a 3000 rpm durante 10 min a 4 ° C. El PBS es aspirado, y PBS se añade para ajustar la concentración final de 1x10 6 por 5 l para U87 células, otras líneas de células pueden requerir un número diferente y la concentración de células para el crecimiento del tumor óptima.
- Después de que el volumen final y la concentración se obtiene las células se mantuvieron en hielo en un tubo eppendorf.
II. Xenoinjerto
- Preparación del ratón
- Los ratones son anestesiados utilizando una mezcla de la inyección de ketamina / xilazina / solución salina. La mezcla es de 120 mg / kg de ketamina, 16 mg / kg de Rompun y solución salina. Los ratones se pesaron individualmente y dado 0,1 ml por 10 g en base a su peso. El anestésico se administra con una aguja 26G unida a una jeringuilla de IP. Tomará aproximadamente 15 minutos para los ratones para llegar a una fase de sueño sin respuesta al dolor. Usted puede comprobar la respuesta al dolor de laratones por pellizcar a su pata.
- Después de que el ratón está totalmente anestesiado, pomada para los ojos se administra a los ojos, para evitar que se sequen.
- El ratón se coloca sobre la cama de la estereotáxica con los dientes delanteros superiores en la muesca de la barra de la boca. El lecho se coloca entonces en el estereotáxico.
- El protector de la nariz se coloca sobre la nariz del ratón para evitar el movimiento de la cabeza, y las barras del oído se coloque suavemente en los canales auditivos de los ratones. Tenga cuidado de no hacer bien la colocación de la barra de la nariz o los oídos barras demasiado apretados, ya que el cráneo se puede fracturar y / o evitar que el ratón de la respiración.
- Asegúrese de que la cabeza del ratón es el nivel de uso de las marcas de graduación en el estereotáxica es de gran ayuda durante este proceso.
- Para preparar el yodo ratón, el alcohol y providine se aplica abundantemente en la cabeza del ratón alterna para un total de 3 aplicación de aplicaciones de alcohol y 3 de yodo. Una aplicación final de una almohadilla de alcohol con 70% se aplica ala cabeza.
- El procedimiento quirúrgico
- Todos los instrumentos en el procedimiento debe ser esterilizado en autoclave o bien remojo instrumentos en etanol al 70% antes de comenzar el procedimiento.
- Se hace una incisión en la parte superior del cráneo, detrás del ojo derecho en diagonal atrás a la parte posterior izquierda del cráneo. La incisión debe ser de aproximadamente 10 mm a 15 mm de largo.
- El uso de un Q-tip, lentamente separar la incisión para exponer el cráneo y limpie la membrana que hay entre el cráneo y la piel. Use un Q-tip para borrar toda la sangre y ver a un sangrado excesivo.
- Exponer la parte superior del cráneo para visualizar el bregma. Utilizando el punto de jeringa Hamilton, colóquelo sobre el bregma. La posición correcta del agujero a perforar en el cráneo es 2 a la derecha mm y 1 mm anterior del bregma (figura 2). Un cirujano rotulador, que se compra estéril, se utiliza para marcar la ubicación del orificio a taladrar. Por favor, tenga en cuenta que el agujero se encuentra cerca de la unalínea de sutura terior.
- A continuación, perfore un pequeño agujero en el cráneo en la posición marcada con la punta de una aguja 22G en un florero de alfiler o alimentado a través de una aguja 18G.
- Cargue el 10 l de vidrio Hamilton jeringa con 5 ml de las células. La jeringa de Hamilton es de 10 ml con una aguja 30G 33G contundente de fijo se le atribuye. Asegúrese de mezclar las células antes de cargarlos, ya sea con la pipeta o usando una jeringa de 1 ml con una aguja 25G adjunto. Después de la jeringa Hamilton se carga, volver a meterla en el brazo para alinearse con el agujero en el cráneo.
- Baje el extremo de la aguja toque a la superficie del cráneo, una vez que la aguja esté a nivel con el cráneo; bajar la aguja hasta que esté en la profundidad de 3 mm por debajo de la superficie del cráneo.
- Después de la aguja es bajada, deberá permanecer allí durante 2 minutos para evitar cualquier trauma importante de la aguja que afecta al cerebro. Implantación de las células es a una velocidad de 1 l por minuto para un total de 6-8 minutos, tener cuidado de cualquier backflow. Después de la última de las células se han implantado, deje la aguja en su lugar durante otros 2 minutos, para permitir que todas las células para resolver pulg
- Retire la aguja en el cerebro, y limpiar el orificio con un Q-tip. Proceder a limpiar la aguja y una jeringa con acetona al 50%, 100% de EtOH, y PBS, 3x en cada solución y en ese orden.
- La piel sobre el cráneo está listo para ser suturado en este punto. Uso de 5-0 PBS cerrará la incisión con cerca de 3 puntos.
- Deje que el ratón para despertar en una almohadilla de calor, y volver a aplicar pomada para los ojos si es necesario. El ratón puede ser devuelto a la jaula después de que muestra el movimiento por sí mismo (es decir, de elevación hasta la cabeza o mover los hombros).
III. El tratamiento del implante IC por la radiación y Drogas
- Tratamiento de radiación
- Dependiendo de la línea celular, el tratamiento de los ratones puede tener lugar de 5 a 7 días después del implante. Nuestro departamento utiliza una unidad de radioterapia para el tratamiento de radiación ortovoltajeambiente.
- Imágenes como BLI (imágenes de bioluminiscencia), resonancia magnética o tomografía computarizada se puede utilizar para visualizar el tumor antes de la aleatorización (figura 3A).
- Los ratones se anestesiaron con el cóctel de ketamina / xilazina / solución salina como antes, y ungüento para los ojos se aplica a sus ojos.
- Los ratones se colocan en una plantilla de radiación por encargo que se configura como una rueda circular, en el que las cabezas de los ratones apuntan hacia el centro. Los cuerpos de los ratones están protegidos de la radiación con el plomo.
- El tratamiento farmacológico se puede dar antes o radiación a través de las rutas de distribución diferentes, es decir, SQ, IP y IV.
IV. Resultados
El ratón debe despertar del procedimiento dentro de 45-60 minutos después de la inyección de anestesia. Si el ratón ha difícilmente despertarse después del procedimiento y el tiempo ha superado una media hora después del procedimiento, el ratón no se recupere y la eutanasia puede ser una alternativa eficaz. Si ªantes que es el sangrado excesivo o se convierte en el cráneo roto en cualquier momento durante el procedimiento de la eutanasia se aconseja. Si todo va bien y en función de la línea celular, un tumor debe empezar a formar dentro de 2-4 semanas después del procedimiento tiene lugar. Cuando se utilizan modelos de xenoinjerto intracraneales, la eficacia terapéutica se mide generalmente como la supervivencia después de la implantación 5. Sin embargo, ya que este es un modelo de signos y síntomas de IC se producirá antes de la muerte. Algunos de los signos físicos del ratón se pueden presentar una postura encorvada, pérdida de peso corporal y la inactividad. Algunos de los signos neurológicos pueden ser convulsiones, inclinación de la cabeza y pérdida del equilibrio. La Figura 3B muestra una coloración de HE de un tumor en la mortalidad. Un gráfico de Kaplan-Meier se utilizó para evaluar los datos (Figura 4). El número de días de supervivencia del 50% se calculan y se compararon con el control. Si el grupo de combinación vivieron más que la adición de la radiación individual y brazos de drogas la combinación se tuvo éxito.

Figura 1. El equipo Stoelting estereotáxica.
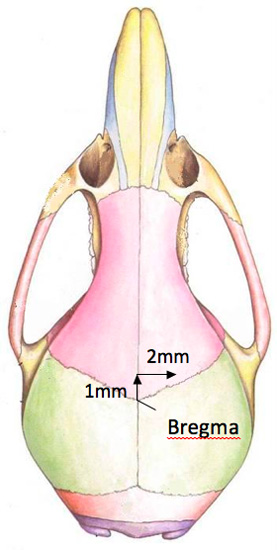
Figura 2. Un diagrama de la ubicación del orificio en el cráneo del ratón.
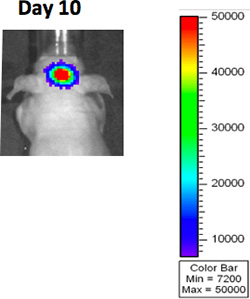
Figura 3. BLI imagen después de la implantación de GBM.

Figura 3B. H y E de tumor GBM en la mortalidad.

Figura 4. Resultados de los implantes U87 IC inyectados con inhibidor de la PARP 7 días después de la cirugía.
Discusión
Los gliomas malignos, tales como el glioblastoma multiforme, representan los tumores cerebrales primarios más comunes y tienen un pronóstico sombrío 4. La supervivencia de los pacientes afectados por el GBM se ha mantenido prácticamente sin cambios durante la última década (es decir, 9-12 meses después del diagnóstico) a pesar de los avances en la cirugía, la radioterapia y la quimioterapia 5. Las características de un modelo apropiado para el estudio del tratamiento del glioma debe incluir una localización del tumor reproducible y el crecimiento de las células en un tumor relativamente discreta, las células deben asemejarse lo más posible las características histológicas de los gliomas humanos, debería haber un crecimiento previsible tasa del tumor, la capacidad de crecer el tumor en cultivo de tejidos y el modelo debe estar en un animal pequeño para reducir el gasto 6. Los tratamientos efectivos dependen de modelos experimentales que se asemejan a las características humanas de GBM para probar nuevas terapias y la disponibilidad para una comprensión exacta de la base molecular de widespread glioma invasión 7. Las investigaciones sobre la biología de los tumores cerebrales también se utilizan habitualmente las líneas celulares cultivadas o mantenidas in vitro para obtener información 8. La inhibición de la invasión tumoral y la angiogénesis es un objetivo importante en el desarrollo de nuevas estrategias terapéuticas contra el glioma maligno 9. Las opciones de tratamiento limitadas para el glioblastoma han impulsado una intensa búsqueda en las lesiones genéticas que subyacen a este tipo de cáncer mortal, con el objetivo el desarrollo de terapias más racionales y más eficaces 10.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Esta investigación está financiada por el programa Intramural del NIH.
Materiales
| Name | Company | Catalog Number | Comments |
| Estándar de laboratorio estereotáxica Instrutment | Stoelting mouse y el adaptador de rata | ||
| Betadine | 100% de EtOH | ||
| 70% de EtOH | 50% de acetona | ||
| 6 "Q-tips | Torundas con alcohol | ||
| Hamilton jeringa de 80008 | Ethicon 5-0 PD | ||
| 1701 SN 31-33G / 1 "/ aguja PT3 | 1 ml jeringas | ||
| Agujas 25G | Almohadilla eléctrica | ||
| Las lágrimas artificiales Ungüento | Muy buen marcador permanente de punta |
Referencias
- Bleau, A. M., Holland, E. Trapping the mouse genome to hunt human alternations. Proc. Nat. Acad. Sci. U.S.A. 104, 7737-7738 (2007).
- McGrady, B. J., McCormick, D. A murine model of intracranial invasion: morphological observations on central nervous system invasion by melanoma cells. Clin. Exp. Metastasis. 10, 387-393 (1992).
- Fei, X., Zhang, Q., Dong, J., Diao, y., Wang, Z., Li, R., Wu, Z., Wang, A., Lan, Q., Zhang, S., Huang, Q. Development of clinically relevant orthotopic xenograft mouse model of metastatic lung cancer and glioblastoma through surgical tumor tissues injection with trocar. Journal of Experimental & Clinical Cancer Research. 29, 84-84 (2010).
- Fujita, M., Zhu, X., Sasaki, K., Ueda, R., Low, K., Pollack, I., Okada, H. Inhibition of STAT3 Promotes the Efficacy of Adoptive Transfer Therapy Using Type-1 CTLs by Modulation of the Immunological Microenvironment in a Murine Intracranial Glioma. J. Immunol. 180, 2089-2098 (2008).
- Candolfi, M., Curtin, J. F., Nichols, W. S., Muhammad, A. K. M. .. . G., King, G., Pluhar, G. D., McNiel, G. E., Ohlfest, E. A., Freese, J. R., Moore, P. F. Intracranial glioblastoma models in preclinical neuro-oncology: neuropathlogical characterization and tumor progression. J. Neurooncol. 85, 133-148 (2007).
- Kaye, A., Morstyn, G., Gardner, I., Pyke, K. Development of a xenograft glioma model in mouse brain. Cancer Research. 46, 1367-1373 (1986).
- Zhao, Y., Xiao, A., diPierro, C., Carpenter, J., Abdel-Fattah, R., Redpath, G., Lopez, M., Hussaini, I. An Extensive Invasive Intracranial Human Glioblastoma Xenograft Model. American Journal of Pathology. 176, 3032-3049 (2010).
- Learn, C., Grossi, P., Schmittling, R., Xie, W., Mitchell, D., Karikari, I., Wei, Z., Dressman, H., Sampson, J. Genetic Analysis of Intracranial Tumors in a Murine Model of Glioma Demonstrate a Shift in Gene Expression in Response to Host Immunity. J. Neuroimmunol. 182, 63-72 (2007).
- Martens, T., Laabs, Y., Günther, H., Kemming, D., Zhu, Z., Witte, L., Hagel, C., Westphal, M., Lamszus, K. Inhibition of Glioblastoma Growth in a Highly Invasive Nude Mouse Model Can Be Achieved by Targeting Epidermal Growth Factor Receptor but not Vascular Endothelial Growth Factor Receptor-2. Clin. Cancer Res. 14, 5447-5458 (2008).
- Purow, B., Schiff, D. Advances in the genetics of glioblastoma: are we reaching critical mass. Nat. Rev. Neurol. 5, 419-426 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados