Method Article
Sensation operante in Cerco il mouse
In questo articolo
Riepilogo
In questo protocollo si descrive un metodo di apprendimento operante mediante stimoli sensoriali come rinforzo nel topo. Non richiede alcuna formazione precedente o restrizione alimentare, e permette lo studio del comportamento motivato, senza l'utilizzo di un rinforzo farmacologiche o naturali come il cibo.
Abstract
Operant methods are powerful behavioral tools for the study of motivated behavior. These 'self-administration' methods have been used extensively in drug addiction research due to their high construct validity. Operant studies provide researchers a tool for preclinical investigation of several aspects of the addiction process. For example, mechanisms of acute reinforcement (both drug and non-drug) can be tested using pharmacological or genetic tools to determine the ability of a molecular target to influence self-administration behavior1-6. Additionally, drug or food seeking behaviors can be studied in the absence of the primary reinforcer, and the ability of pharmacological compounds to disrupt this process is a preclinical model for discovery of molecular targets and compounds that may be useful for the treatment of addiction3,7-9. One problem with performing intravenous drug self-administration studies in the mouse is the technical difficulty of maintaining catheter patency. Attrition rates in these experiments are high and can reach 40% or higher10-15. Another general problem with drug self-administration is discerning which pharmacologically-induced effects of the reinforcer produce specific behaviors. For example, measurement of the reinforcing and neurological effects of psychostimulants can be confounded by their psychomotor effects. Operant methods using food reinforcement can avoid these pitfalls, although their utility in studying drug addiction is limited by the fact that some manipulations that alter drug self-administration have a minimal impact on food self-administration. For example, mesolimbic dopamine lesion or knockout of the D1 dopamine receptor reduce cocaine self-administration without having a significant impact on food self-administration 12,16.
Sensory stimuli have been described for their ability to support operant responding as primary reinforcers (i.e. not conditioned reinforcers)17-22. Auditory and visual stimuli are self-administered by several species18,21,23, although surprisingly little is known about the neural mechanisms underlying this reinforcement. The operant sensation seeking (OSS) model is a robust model for obtaining sensory self-administration in the mouse, allowing the study of neural mechanisms important in sensory reinforcement24. An additional advantage of OSS is the ability to screen mutant mice for differences in operant behavior that may be relevant to addiction. We have reported that dopamine D1 receptor knockout mice, previously shown to be deficient in psychostimulant self-administration, also fail to acquire OSS24. This is a unique finding in that these mice are capable of learning an operant task when food is used as a reinforcer. While operant studies using food reinforcement can be useful in the study of general motivated behavior and the mechanisms underlying food reinforcement, as mentioned above, these studies are limited in their application to studying molecular mechanisms of drug addiction. Thus, there may be similar neural substrates mediating sensory and psychostimulant reinforcement that are distinct from food reinforcement, which would make OSS a particularly attractive model for the study of drug addiction processes. The degree of overlap between other molecular targets of OSS and drug reinforcers is unclear, but is a topic that we are currently pursuing. While some aspects of addiction such as resistance to extinction may be observed with OSS, we have found that escalation 25 is not observed in this model24. Interestingly, escalation of intake and some other aspects of addiction are observed with self-administration of sucrose26. Thus, when non-drug operant procedures are desired to study addiction-related processes, food or sensory reinforcers can be chosen to best fit the particular question being asked.
In conclusion, both food self-administration and OSS in the mouse have the advantage of not requiring an intravenous catheter, which allows a higher throughput means to study the effects of pharmacological or genetic manipulation of neural targets involved in motivation. While operant testing using food as a reinforcer is particularly useful in the study of the regulation of food intake, OSS is particularly apt for studying reinforcement mechanisms of sensory stimuli and may have broad applicability to novelty seeking and addiction.
Protocollo
1. Scrivi programma da eseguire sessioni di test operante con vari stimoli visivi e uditivi come rinforzo
- Per il rapporto fisso (FR) sessioni: rendere le sessioni di un'ora in lunghezza con luce casa e ventilatore acceso durante la sessione. Per le sessioni rapporto progressivo, rendono le sessioni di due ore di lunghezza. Hanno entrambe le leve prorogato per la durata della sessione e contrappeso che è designato leva "attiva" contro "inattivi" tra animali (assegnazione leva mai per ogni animale modifiche).
- Codice del programma in modo tale che ogni rinforzo varia in base ai seguenti parametri:
- ogni rinforzo ha una delle seguenti durate scelti a caso: 2, 4, 6 o 8 sec.
- ogni rinforzo ha uno dei tassi di stimolo seguenti lampada flash scelto a caso: 0,625, 1,25, 2,5 o 5 Hz, ognuno con un duty cycle del 50%.
- ogni stimolo lampada flash in modo casuale a sinistra oa destra della camera.
- fornire uno stimolo uditivo per tutta la durata del rinforzo; nel nostro laboratorio, abbiamo innescare una pompa per infusione, che garantisce un suono di circa 3 dB il rumore di fondo nella camera.
- Codice del programma per visualizzare i seguenti valori in tempo reale: 1. Numero di pressioni della leva attivo, 2. Numero di pressioni della leva inattivi, 3. Numero di rinforzi, 4. Tempo (in incrementi di 0,1 secondi).
2. Trattare gli animali (3 procedura di giorno)
- Dopo acclimatazione alla struttura animale, iniziare occupano degli animali. Questo abituare gli animali ad essere raccolto e trasportato.
- Inizio mettendo le mani guantate nella gabbia e lasciandoli riposare per 90 sec. Se ogni mouse non ha indagato le mani in quel momento, muovere le mani verso il mouse e attendere ciascuno di annusare e / o contattare le mani prima di procedere.
- Con attenzione raccogliere ogni mouse uno per uno dalla base della coda e metterla sulla vostra mano, alzando rapidamente e riportarla verso il basso per consentire il mouse per camminare fuori della tua mano nella gabbia.
- Ripetere per ogni momento del mouse 5-10, a seconda del comportamento del mouse. Il tempo finale è fatto questo, tenere alto il mouse (con in piedi sulla vostra mano) per un periodo di tempo, a seconda del giorno. Giorno 1: 5 sec, 2 ° giorno: 10 sec, 3 ° giorno: 15 sec. Garantire che ogni mouse soddisfa questo criterio per la giornata. Il giorno 1, cambiare i guanti tra gabbie.
- A partire dal 2 ° giorno, il colpo dorso dell'animale, mentre il mouse è sulla vostra mano. Anche il 2 ° giorno, cominciare peso gli animali ogni giorno. Segna coda ogni animale con un pennarello per indicare il numero soggetto.
- Se iniezioni sarà dato durante l'esperimento, i topi cominciano abituare alle iniezioni nel Day 2. Questo dovrebbe essere fatto dopo che tutti i topi in gabbia sono state manipolate e soddisfaceva il criterio per la giornata.
3. Pulire e verificare attrezzature
- Lavare tegame fondo con acqua calda.
- Pulire le pareti della camera operante e pavimenti con il 30% di etanolo.
- Eseguire un programma di test che si accende la luce casa, ventilatore, e le luci stimolo, si estende leve, e registra presse a leva.
- Assicurarsi che tutte le luci e ventilatori funzionino correttamente e testare il programma per garantire che tutte le macchine a leva sono registrati.
- Leve pulito con il 30% di etanolo.
4. Eseguire sessione operante (sessioni dovrebbero essere 5-6 giorni / settimana alla stessa ora del giorno)
- Pesare ogni mouse.
- Caricare il programma in ogni camera e annotare l'esperimento in modo appropriato. La leva attivo dovrebbe essere controbilanciato tra animali (ad esempio, la leva attivo è assegnato alla levetta sinistra per la metà dei topi, la leva destra è attivo per l'altra metà), ma il lato leva attivo non cambia mai una volta che il mouse di un mouse è stato assegnato.
- Trasporto ogni mouse alla sua sezione designata, chiudere la camera, e avviare la sessione.
- Dopo la sessione termina, rimuovere immediatamente il mouse e ri-segnare la coda.
- Camere pulite come descritto nella Sezione 3.
- Analizzare i dati per numero di presse a leva attivi e inattivi. Numero di rinforzi e / o l'accuratezza leva (presse a leva% attivo) può anche essere segnalato. Se i topi stanno per essere testati per l'effetto di un trattamento su OSS, in modo che tutti i topi da testare hanno incontrato i criteri di acquisizione (ad esempio,> 20 presse a leva attiva e> 65% presse a leva attiva per ultime tre sessioni di FR-1 ) prima dell'inizio del trattamento.
- Dopo l'acquisizione della FR-1 risponde, il programma di rinforzo può essere modificato (per esempio, un più alto rapporto fisso, rapporto progressivo, rapporto casuale, ecc.)
5. Rappresentante Risultati
Un esempio di acquisizione da parte di sesso maschile OSS topi C57BL/6J è illustrato nella figura 1 (riprodotto da 23). Topi di controllo sottoposti a condizioni identiche, tranne che preme la leva su entrambi leva non ha avuto conseguenzesequenza. Un'altra coorte di topi è mostrato nella Figura 2. In questo esperimento, un gruppo di topi hanno ricevuto rinforzi OSS, mentre un altro gruppo ha ricevuto rinforzi cibo. Abbiamo scoperto che in condizioni di accesso ad libitum a cibo, sia rapporto fisso e progressivo rispondere sono simili tra OSS e la risposta per il 10% Assicurare (Figura 2, A e B). Questo permette un confronto efficace di una manipolazione su due diversi tipi di rinforzo (sensoriale e alimentare) che evita confonde potenziale risultante dallo stato di fame o le differenze nel tasso di risposta.

Figura 1:. Presse a leva da topi OSS e OSS controlli topi hanno ricevuto vari stimoli visivi e uditivi successivo attiva la leva stampa (FR-1 programma di rinforzo), mentre preme la leva inattivo avuto alcuna conseguenza. Topi di controllo ha subito le stesse condizioni ma non ci fu alcuna conseguenza o di premere la leva (leve sono denotate 1 e 2 e si contrappongono tra gli animali nello stesso modo che le leve attivi ed inattivi sono controbilanciati per i topi OSS). Leva attiva premendo dai topi OSS è stata aumentata rispetto alla leva inattivo premendo (* p <0,05, ** p <0,01) e non armato leva premendo da controlli (n = 7 8, $ p <0,05, $ $ p <0,01 ). Figura riprodotto da 23.
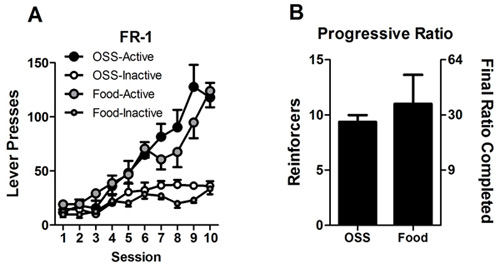
Figura 2:. Presse a leva da topi OSS e topi rispondere per il cibo A.) I topi hanno risposto su una FR-1 programma di rinforzo per stimoli OSS o rinforzo alimentare (10% Assicurare). Tutti i topi avevano accesso ad libidum al cibo per tutta la durata degli esperimenti. B.) Dopo FR-1 sessioni, i topi sono stati avanzati a un rapporto progressivo (PR) programma di rinforzo per cinque giorni. Dati rappresentano il mezzo di valori da quattro giorni e cinque per ogni animale. Il rapporto finale completa è riportata sulla destra asse Y e si riferisce al numero di risposte necessarie per ottenere il rinforzo corrispondente (cioè 30 risposte devono ottenere il rinforzo 10 ° dopo la precedente guadagnare nove rinforzi).
Discussione
Sensazione operante ricerca è una valida alternativa alla droga per via endovenosa di auto-somministrazione quando il mouse è l'animale di scelta. Il fatto che né interventi chirurgici né manutenzione catetere è necessario è vantaggioso, in quanto questi sono significativi ostacoli tecnici nel topo. OSS è anche interessante perché si può misurare aspetti di rinforzo distinto da altri rinforzi naturali come il cibo.
E 'utile notare che le misure comportamentali nel topo può essere molto variabile tra le diverse condizioni ambientali 24. Questo problema è sorto nel nostro laboratorio con OSS. Quando la procedura per la prima volta caratterizzato, gli animali sono stati alloggiati in una struttura che era ad alto traffico e un gran numero di persone che lavorano in essa tutta la giornata. Durante questo tempo, i topi sono stati alloggiati in un ciclo "normale" luce (luci accese: 0600-1800 h; esperimenti condotti ~ 0800-1400). Dopo essersi trasferito in una struttura dedicata alloggiamento all'interno del Laboratorio Vanderbilt neurocomportamentali, abbiamo scoperto che rapporto progressivo di OSS era molto più basso di quello che avevamo osservato in precedenza, rispondendo declinato in cinque giorni invece di rimanere stabile. Questa funzione è molto meno traffico e il personale sono addestrati a lavorare in silenzio ed essere consapevoli della delicatezza degli esperimenti eseguiti nella struttura. Da allora abbiamo regolato i topi ad un ciclo di luce che promuove lo stato di veglia durante il periodo della sperimentazione (luci accese: 1500-0300 h; esperimenti condotti ~ 0800-1400 h) e le prestazioni OSS è tornato a ciò che abbiamo osservato in precedenza.
Quello che segue è una descrizione delle nostre condizioni standard per gli esperimenti di OSS. Maschio topi C57BL/6J sono ordinati a 3 settimane di età dai Laboratori Jackson (Bar Harbor, ME) e ospitato nel ciclo di luce modificato per almeno una settimana prima di esperimenti. Gli animali sono sistemati in gruppi di 2-5, in camera di mais Cobb integrato con una piccola quantità di cellulosa (Cura Fresco). Gli esperimenti vengono eseguiti 5-6 giorni a settimana e le modifiche gabbia vengono eseguite solo prima di un giorno senza esperimenti. Mentre queste sono le nostre condizioni standard, abbiamo scoperto che topi di sesso femminile di età (fino a 20 settimane) sono anche in grado di acquisire OSS. Attualmente stiamo esaminando altre variabili che possono influire sulle prestazioni OSS. Mentre è noto che statico stimoli visivi sono in grado di servire come rinforzo nei topi 17, non si sa se l'approccio di migliorare la dinamica degli stimoli che noi e gli altri hanno impiegato 20,22,23 portare ad un aumento di rinforzo nelle attuali condizioni . Un'altra variabile che può influire OSS è ceppo di topi. Differenze di ceppi sono stati descritti nei topi per una serie di misure comportamentali e neurologici 25-29, e la performance differenziale su OSS e operante rispondere per alimentare può fornire una panoramica basi genetiche di questo comportamento.
Divulgazioni
Riconoscimenti
Questo progetto è stato sostenuto da NIH concede DA19112 (DGW) e DA026994 (OCM). Illustrazione è stato fornito da Katherine Louderback. Gli esperimenti sono stati eseguiti nel laboratorio Murine Vanderbilt neurocomportamentali.
Materiali
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Drug self-administration test package for mouse: extra-wide chamber and retractable levers | Med Associates, Inc | MED-307W-CT-D1 | Levers are ultra-sensitive (require ~2 grams force) and are mounted 2.2 cm above the floor. Yellow stimulus lamps are mounted 2 cm above each lever. | |
| Interface and software package | Med Associates, Inc | MED-SYST-16 | This is the package for up to 16 chambers. |
Riferimenti
- Thomsen, M., Caine, S. B. Intravenous drug self-administration in mice: practical considerations. Behav Genet. 37, 101-118 (2006).
- Koob, G. F. Animal models of motivation for drinking in rodents with a focus on opioid receptor neuropharmacology. Recent Dev Alcohol. 16, 263-281 (2003).
- Koob, G. F., Kenneth Lloyd, G., Mason, B. J. Development of pharmacotherapies for drug addiction: a Rosetta stone approach. Nat Rev Drug Discov. 8, 500-515 (2009).
- Arnold, J. M., Roberts, D. C. A critique of fixed and progressive ratio schedules used to examine the neural substrates of drug reinforcement. Pharmacol Biochem Behav. 57, 441-447 (1997).
- O'Brien, C. P., Gardner, E. L. Critical assessment of how to study addiction and its treatment: human and non-human animal models. Pharmacology & Therapeutics. 108, 18-58 (2005).
- Olsen, C. M., Duvauchelle, C. L. Prefrontal cortex D1 modulation of the reinforcing properties of cocaine. Brain Research. 1075, 229-235 (2006).
- Epstein, D. H., Preston, K. L., Stewart, J., Shaham, Y. Toward a model of drug relapse: an assessment of the validity of the reinstatement procedure. Psychopharmacology (Berl). 189, 1-16 (2006).
- Kalivas, P. W., McFarland, K. Brain circuitry and the reinstatement of cocaine-seeking behavior. Psychopharmacology (Berl). 168, 44-56 (2003).
- Stewart, J. Pathways to relapse: the neurobiology of drug- and stress-induced relapse to drug-taking. J Psychiatry Neurosci. 25, 125-136 (2000).
- Olsen, C. M., Winder, D. G. A method for single-session cocaine self-administration in the mouse. Psychopharmacology (Berl). 187, 13-21 (2006).
- Rocha, B. A. Differential responsiveness to cocaine in C57BL/6J and DBA/2J mice. Psychopharmacology (Berl). 138, 82-88 (1998).
- Caine, S. B., Negus, S. S., Mello, N. K. Method for training operant responding and evaluating cocaine self-administration behavior in mutant mice. Psychopharmacology (Berl). 147, 22-24 (1999).
- Colby, C. R., Whisler, K., Steffen, C., Nestler, E. J., Self, D. W. Striatal cell type-specific overexpression of DeltaFosB enhances incentive for cocaine. J Neurosci. 23, 2488-2493 (2003).
- Schramm-Sapyta, N. L., Olsen, C. M., Winder, D. G. Cocaine self-administration reduces excitatory responses in the mouse nucleus accumbens shell. Neuropsychopharmacology. 31, 1444-1451 (2006).
- Steiner, R. C., Hsiung, H. M., Picciotto, M. R. Cocaine self-administration and locomotor sensitization are not altered in CART knockout mice. Behav Brain Res. 171, 56-62 (2006).
- Marx, M. H., Henderson, R. L., Roberts, C. L. Positive reinforcement of the bar-pressing response by a light stimulus following dark operant pretests with no after effect. J Comp Physiol Psychol. 48, 73-76 (1955).
- Baron, A., Kish, G. B. Low-intensity auditory and visual stimuli as reinforcers for the mouse. J Comp Physiol Psychol. 55, 1011-1013 (1962).
- Stewart, J. Reinforcing effects of light as a function of intensity and reinforcement schedule. Journal of comparative and physiological psychology. 53, 187-193 (1960).
- Caggiula, A. R. Cue dependency of nicotine self-administration and smoking. Pharmacol Biochem Behav. 70, 515-530 (2001).
- Cain, M. E., Green, T. A., Bardo, M. T. Environmental enrichment decreases responding for visual novelty. Behavioural Processes. 73, 360-366 (2006).
- Thompson, T. I. Visual Reinforcement in Siamese Fighting Fish. Science. 141, 55-57 (1963).
- Blatter, K., Schultz, W. Rewarding properties of visual stimuli. Exp Brain Res. 168, 541-546 (2006).
- Olsen, C. M., Winder, D. G. Operant sensation seeking engages similar neural substrates to operant drug seeking in C57 mice. Neuropsychopharmacology. 34, 1685-1694 (2009).
- Crabbe, J. C., Wahlsten, D., Dudek, B. C. Genetics of mouse behavior: interactions with laboratory environment. Science. 284, 1670-1672 (1999).
- Crawley, J. N. Behavioral phenotypes of inbred mouse strains: implications and recommendations for molecular studies. Psychopharmacology (Berl). 132, 107-124 (1997).
- Belknap, J. K., Metten, P., Beckley, E. H., Crabbe, J. C. Multivariate analyses reveal common and drug-specific genetic influences on responses to four drugs of abuse. Trends Pharmacol Sci. 29, 537-543 (2008).
- Mozhui, K. Strain differences in stress responsivity are associated with divergent amygdala gene expression and glutamate-mediated neuronal excitability. J Neurosci. 30, 5357-5367 (2010).
- Hefner, K. Impaired fear extinction learning and cortico-amygdala circuit abnormalities in a common genetic mouse strain. J Neurosci. 28, 8074-8085 (2008).
- Elmer, G. I., Pieper, J. O., Hamilton, L. R., Wise, R. A. Qualitative differences between C57BL/6J and DBA/2J mice in morphine potentiation of brain stimulation reward and intravenous self-administration. Psychopharmacology (Berl). 208, 309-321 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon