Method Article
Sensation opérant dans la recherche de souris
Dans cet article
Résumé
Dans ce protocole, nous décrivons une méthode d'apprentissage opérant en utilisant des stimuli sensoriels comme un renforçateur chez la souris. Il ne nécessite aucune formation préalable ou de la restriction alimentaire, et il permet l'étude du comportement motivé sans l'utilisation d'un renforçateur pharmacologique ou naturels tels que la nourriture.
Résumé
Operant methods are powerful behavioral tools for the study of motivated behavior. These 'self-administration' methods have been used extensively in drug addiction research due to their high construct validity. Operant studies provide researchers a tool for preclinical investigation of several aspects of the addiction process. For example, mechanisms of acute reinforcement (both drug and non-drug) can be tested using pharmacological or genetic tools to determine the ability of a molecular target to influence self-administration behavior1-6. Additionally, drug or food seeking behaviors can be studied in the absence of the primary reinforcer, and the ability of pharmacological compounds to disrupt this process is a preclinical model for discovery of molecular targets and compounds that may be useful for the treatment of addiction3,7-9. One problem with performing intravenous drug self-administration studies in the mouse is the technical difficulty of maintaining catheter patency. Attrition rates in these experiments are high and can reach 40% or higher10-15. Another general problem with drug self-administration is discerning which pharmacologically-induced effects of the reinforcer produce specific behaviors. For example, measurement of the reinforcing and neurological effects of psychostimulants can be confounded by their psychomotor effects. Operant methods using food reinforcement can avoid these pitfalls, although their utility in studying drug addiction is limited by the fact that some manipulations that alter drug self-administration have a minimal impact on food self-administration. For example, mesolimbic dopamine lesion or knockout of the D1 dopamine receptor reduce cocaine self-administration without having a significant impact on food self-administration 12,16.
Sensory stimuli have been described for their ability to support operant responding as primary reinforcers (i.e. not conditioned reinforcers)17-22. Auditory and visual stimuli are self-administered by several species18,21,23, although surprisingly little is known about the neural mechanisms underlying this reinforcement. The operant sensation seeking (OSS) model is a robust model for obtaining sensory self-administration in the mouse, allowing the study of neural mechanisms important in sensory reinforcement24. An additional advantage of OSS is the ability to screen mutant mice for differences in operant behavior that may be relevant to addiction. We have reported that dopamine D1 receptor knockout mice, previously shown to be deficient in psychostimulant self-administration, also fail to acquire OSS24. This is a unique finding in that these mice are capable of learning an operant task when food is used as a reinforcer. While operant studies using food reinforcement can be useful in the study of general motivated behavior and the mechanisms underlying food reinforcement, as mentioned above, these studies are limited in their application to studying molecular mechanisms of drug addiction. Thus, there may be similar neural substrates mediating sensory and psychostimulant reinforcement that are distinct from food reinforcement, which would make OSS a particularly attractive model for the study of drug addiction processes. The degree of overlap between other molecular targets of OSS and drug reinforcers is unclear, but is a topic that we are currently pursuing. While some aspects of addiction such as resistance to extinction may be observed with OSS, we have found that escalation 25 is not observed in this model24. Interestingly, escalation of intake and some other aspects of addiction are observed with self-administration of sucrose26. Thus, when non-drug operant procedures are desired to study addiction-related processes, food or sensory reinforcers can be chosen to best fit the particular question being asked.
In conclusion, both food self-administration and OSS in the mouse have the advantage of not requiring an intravenous catheter, which allows a higher throughput means to study the effects of pharmacological or genetic manipulation of neural targets involved in motivation. While operant testing using food as a reinforcer is particularly useful in the study of the regulation of food intake, OSS is particularly apt for studying reinforcement mechanisms of sensory stimuli and may have broad applicability to novelty seeking and addiction.
Protocole
1. Ecrire le programme à exécuter séances d'essais opérant à l'aide variée des stimuli visuels et auditifs comme un renforçateur
- Pour fixes ratio (FR) séances: faire des séances d'une heure dans la longueur avec la lumière interne et d'un ventilateur en marche lors de la session. Pour les sessions de taux progressifs, faire des séances de deux heures la durée. Avez-deux leviers prolongée pour la durée de la session et contrebalancer laquelle le levier est désigné «active» vs «inactif» à travers les animaux (affectation de levier pour chaque animal ne change jamais).
- Le code du programme de telle manière que chaque renforçateur est variable selon les paramètres suivants:
- Chaque renfort a l'une des durées suivantes choisie au hasard: 2, 4, 6 ou 8 sec.
- Chaque renfort a un des taux suivants relance lampe flash choisie au hasard: 0,625, 1,25, 2,5, ou 5 Hz, chacun avec un rapport cyclique de 50%.
- chaque lampe flash est de relance au hasard sur la gauche ou la droite de la chambre.
- fournir un stimulus auditif pour la durée du renforçateur; dans notre laboratoire, nous déclenchons une pompe à perfusion, qui fournit un son d'environ 3 dB au-dessus du bruit de fond dans la chambre.
- Le code du programme pour afficher les valeurs suivantes en temps réel: 1. Nombre de presses à levier actif, 2. Nombre de presses à levier inactif, 3. Nombre de renforçateurs, 4. Temps (en incréments de 0,1 seconde).
2. Manipuler les animaux (3 jours la procédure)
- Après une acclimatation à l'animalerie, commencer la manipulation des animaux. Ce sera habituer les animaux à être ramassés et transportés.
- Commencez par placer les mains gantées dans la cage et les laisser reposer pendant 90 sec. Si chaque souris n'a pas enquêté sur vos mains en ce moment, déplacez doucement la main vers les souris et attendre pour chacun de renifler et / ou le contact entre vos mains avant de procéder.
- Soigneusement ramasser chaque souris, un par un par la base de la queue et le placer sur votre main, rapidement le lever et de le ramener vers le bas pour permettre à la souris pour marcher hors de votre main dans la cage.
- Répéter pour chaque fois la souris 5-10, selon le comportement de la souris. La dernière fois cela fait, tenir le haut de la souris (avec elle debout sur votre main) pour une période de temps, selon les jours. Jour 1: 5 sec, Jour 2: 10 sec, Jour 3: 15 sec. Assurez-vous que chaque souris répond à ce critère pour la journée. Le Jour 1, changer de gants entre les cages.
- À compter du Jour 2, accident vasculaire cérébral de l'animal est de retour alors que la souris est sur votre main. Aussi le jour 2, commencera peser les animaux par jour. Marquer la queue de chaque animal avec un Sharpie pour désigner le numéro de l'objet.
- Si les injections seront donnés lors de l'expérience, les souris commencent habituer à des injections sur le Jour 2. Cela devrait être fait après toutes les souris dans la cage ont été manipulés et ont satisfait au critère de la journée.
3. Nettoyer le matériel et le test
- Lavez pan fond avec de l'eau chaude.
- Nettoyez les parois et les planchers de chambre opérant avec de l'éthanol à 30%.
- Exécuter un programme test qui tourne sur la lumière interne, ventilateur, et les lumières de relance, étend les leviers et les dossiers presses à levier.
- S'assurer que toutes les lumières et les ventilateurs fonctionnent correctement et tester le programme afin de s'assurer que toutes les presses à levier sont enregistrés.
- Nettoyez-le avec les leviers 30% d'éthanol.
4. Effectuer la session opérant (sessions devraient être 5-6 jours / semaine à la même heure du jour)
- Peser chaque souris.
- Chargez le programme dans chaque chambre et d'annoter l'expérience appropriée. Le levier actif devrait être contrebalancé entre les animaux (par exemple, le levier actif est attribué au levier gauche pour la moitié de la souris, le levier de droite est active pour l'autre moitié), mais le côté levier actif ne change jamais une fois la souris une souris a été assignées.
- Transports chaque souris à sa chambre désignée, près de la chambre, et démarrer la session.
- Après la session se termine, retirez rapidement la souris et le re-marquer la queue.
- Nettoyer les chambres comme décrit dans la section 3.
- Analyser les données pour le nombre de presses à levier actif et inactif. Nombre de renforcements et / ou de l'exactitude de levier (presses% levier actif) peut aussi être déclaré. Si les souris vont être testés pour l'effet d'un traitement sur l'OSS, s'assurer que toutes les souris pour être testés ont répondu aux critères d'acquisition (par exemple,> 20 presses à levier actif et> 65% des presses levier actif pour les trois derniers FR-1 séances ) avant le début du traitement.
- Après l'acquisition de FR-1 répond plus, le calendrier de l'armature peut être changé (par exemple, un ratio supérieur fixe, taux progressifs, le ratio de hasard, etc.)
5. Les résultats représentatifs
Un exemple de l'acquisition par l'OSS souris C57BL/6J mâles est montré dans la figure 1 (reproduit à partir de 23). Les souris témoins ont subi des conditions identiques, sauf que presses à levier sur le levier de soit n'avait pas conquence. Une autre cohorte de souris est montré dans la figure 2. Dans cette expérience, un groupe de souris a reçu renfort OSS, tandis qu'un autre groupe a reçu le renforcement alimentaire. Nous avons constaté que dans des conditions d'accès ad libitum à la nourriture, les deux taux fixes et progressifs répondre sont similaires entre l'OSS et de répondre pour 10% Assurez (figure 2, A et B). Cela permet des comparaisons efficaces d'une manipulation sur deux types différents de renfort (sensorielles et alimentaires) qui évite confond potentielle résultant de l'état la faim ou de différences dans le taux de réponse.

Figure 1:. Presses à levier par des souris et des commandes OSS OSS souris ont reçu variée des stimuli visuels et auditifs après chaque activité sur le levier (FR-1 calendrier de renforcement), tandis que les presses levier inactif n'avait aucune conséquence. Les souris témoins ont subi les mêmes conditions, mais il n'y avait aucune raison d'appuyer sur le levier soit (leviers sont notés 1 et 2 et sont contrebalancés travers les animaux de la même manière que les leviers actifs et inactifs sont contrebalancés par des souris OSS). Appuyant sur le levier actif par les souris OSS a été augmenté par rapport à levier inactif appuyant sur (* p <0,05, ** p <0,01) et à la non-renforcées levier de pression par des contrôles (n = 7, 8, $ p <0,05, $ $ p <0,01 ). Figure reproduite à partir du 23.
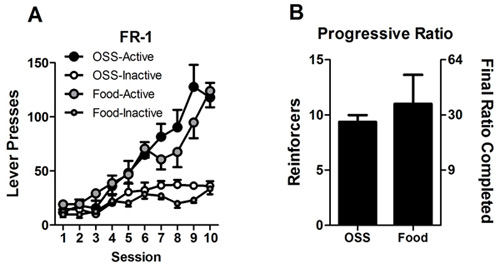
Figure 2:. Presses à levier par des souris et des souris répond OSS pour la nourriture A.) Souris répondu sur un calendrier de FR-1 du renfort pour des stimuli OSS ou renforçateur alimentaire (10% Assurer). Toutes les souris ont eu accès ad libidum à la nourriture pour la durée de l'expérimentation. B.) Après FR-1 séances, les souris ont été avancées pour un ratio progressif (PR) le calendrier de renfort pendant cinq jours. Les données représentent le moyen de valeurs de quatre et cinq jours pour chaque animal. Le rapport final complété est rapporté sur la droite de l'axe Y et se réfère au nombre de réponses requises pour obtenir le renforçateur correspondante (soit 30 réponses sont nécessaires pour obtenir le renforçateur 10 ème après avoir préalablement gagner neuf renforçateurs).
Discussion
Sensation opérant cherchant une alternative utile à la drogue auto-administration intraveineuse lorsque la souris est l'animal de choix. Le fait que ni la chirurgie ni entretien du cathéter est nécessaire est avantageuse, car ce sont d'importants obstacles techniques à la souris. OSS est également intéressante, car elle peut être de mesurer certains aspects de l'armature distincte des autres renforcements naturels tels que la nourriture.
Il est utile de noter que les mesures comportementales chez la souris peut être très variable dans différentes conditions environnementales 24. Cette question a été soulevée dans notre propre laboratoire avec l'OSS. Lorsque la procédure a été caractérisée, les animaux ont été logés dans un établissement qui avait fort trafic et un grand nombre de personnes qui y travaillent toute la journée. Pendant ce temps, les souris ont été logées sur un cycle de lumière "normale" (lumières: 0600-1800 h; expériences menées ~ 0800-1400). Après avoir déménagé à un centre d'hébergement dédié au sein du Laboratoire de Vanderbilt neurocomportementales, nous avons constaté que rapport qualité progressive de l'OSS a été beaucoup plus bas que nous avions précédemment observé; répondre diminué au cours de cinq jours au lieu de rester stable. Cette installation a beaucoup moins de trafic et le personnel sont formés pour travailler tranquillement et être conscient de la nature sensible des expériences réalisées dans l'établissement. Depuis, nous avons ajusté la souris à un cycle de lumière qui favorise l'éveil pendant la période d'expérimentation (lumières: 1500-0300 h; expériences menées ~ 0800-1400 h) et la performance OSS est de retour à ce que nous avons mentionné précédemment.
Ce qui suit est une description de nos conditions standards pour les expériences de l'OSS. Des souris mâles C57BL/6J sont commandés à 3 semaines d'âge de Jackson Laboratories (Bar Harbor, ME) et logé dans le cycle de lumière modifiée pour au moins une semaine avant les expériences. Les animaux sont logés en groupes de 2-5 dans le maïs Cobb literie complétée par une petite quantité de cellulose (Soins Fresh). Des expériences sont effectuées 5-6 jours par semaine et les modifications sont effectuées uniquement en cage avant d'un jour sans expériences. Alors que ce sont nos conditions standard, nous avons constaté que les souris femelles et les plus âgés (jusqu'à 20 semaines) sont également capable d'acquérir des logiciels libres. Nous sommes en train d'examiner d'autres variables qui peuvent affecter les performances OSS. Alors qu'il est connu que les stimuli visuels statiques sont capables de servir comme renforçateurs chez la souris 17, on ignore si l'approche de l'amélioration de la dynamique des stimuli que nous et d'autres ont employé 20,22,23 conduire à renfort augmenté dans les conditions actuelles . Une autre variable qui peut affecter l'OSS est la souche de souris. Différences entre les souches ont été décrites chez la souris pour une variété de mesures comportementales et neurologiques 25-29, et la performance différentiel sur l'OSS et opérant de répondre pour l'alimentation peut fournir un aperçu des fondements génétiques de ce comportement.
Déclarations de divulgation
Remerciements
Ce projet a été soutenu par des subventions des NIH DA19112 (DGW) et DA026994 (OCM). Illustration a été fournie par Katherine Louderback. Des expériences ont été effectuées dans le laboratoire de Vanderbilt neurocomportementales murin.
matériels
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Drug self-administration test package for mouse: extra-wide chamber and retractable levers | Med Associates, Inc | MED-307W-CT-D1 | Levers are ultra-sensitive (require ~2 grams force) and are mounted 2.2 cm above the floor. Yellow stimulus lamps are mounted 2 cm above each lever. | |
| Interface and software package | Med Associates, Inc | MED-SYST-16 | This is the package for up to 16 chambers. |
Références
- Thomsen, M., Caine, S. B. Intravenous drug self-administration in mice: practical considerations. Behav Genet. 37, 101-118 (2006).
- Koob, G. F. Animal models of motivation for drinking in rodents with a focus on opioid receptor neuropharmacology. Recent Dev Alcohol. 16, 263-281 (2003).
- Koob, G. F., Kenneth Lloyd, G., Mason, B. J. Development of pharmacotherapies for drug addiction: a Rosetta stone approach. Nat Rev Drug Discov. 8, 500-515 (2009).
- Arnold, J. M., Roberts, D. C. A critique of fixed and progressive ratio schedules used to examine the neural substrates of drug reinforcement. Pharmacol Biochem Behav. 57, 441-447 (1997).
- O'Brien, C. P., Gardner, E. L. Critical assessment of how to study addiction and its treatment: human and non-human animal models. Pharmacology & Therapeutics. 108, 18-58 (2005).
- Olsen, C. M., Duvauchelle, C. L. Prefrontal cortex D1 modulation of the reinforcing properties of cocaine. Brain Research. 1075, 229-235 (2006).
- Epstein, D. H., Preston, K. L., Stewart, J., Shaham, Y. Toward a model of drug relapse: an assessment of the validity of the reinstatement procedure. Psychopharmacology (Berl). 189, 1-16 (2006).
- Kalivas, P. W., McFarland, K. Brain circuitry and the reinstatement of cocaine-seeking behavior. Psychopharmacology (Berl). 168, 44-56 (2003).
- Stewart, J. Pathways to relapse: the neurobiology of drug- and stress-induced relapse to drug-taking. J Psychiatry Neurosci. 25, 125-136 (2000).
- Olsen, C. M., Winder, D. G. A method for single-session cocaine self-administration in the mouse. Psychopharmacology (Berl). 187, 13-21 (2006).
- Rocha, B. A. Differential responsiveness to cocaine in C57BL/6J and DBA/2J mice. Psychopharmacology (Berl). 138, 82-88 (1998).
- Caine, S. B., Negus, S. S., Mello, N. K. Method for training operant responding and evaluating cocaine self-administration behavior in mutant mice. Psychopharmacology (Berl). 147, 22-24 (1999).
- Colby, C. R., Whisler, K., Steffen, C., Nestler, E. J., Self, D. W. Striatal cell type-specific overexpression of DeltaFosB enhances incentive for cocaine. J Neurosci. 23, 2488-2493 (2003).
- Schramm-Sapyta, N. L., Olsen, C. M., Winder, D. G. Cocaine self-administration reduces excitatory responses in the mouse nucleus accumbens shell. Neuropsychopharmacology. 31, 1444-1451 (2006).
- Steiner, R. C., Hsiung, H. M., Picciotto, M. R. Cocaine self-administration and locomotor sensitization are not altered in CART knockout mice. Behav Brain Res. 171, 56-62 (2006).
- Marx, M. H., Henderson, R. L., Roberts, C. L. Positive reinforcement of the bar-pressing response by a light stimulus following dark operant pretests with no after effect. J Comp Physiol Psychol. 48, 73-76 (1955).
- Baron, A., Kish, G. B. Low-intensity auditory and visual stimuli as reinforcers for the mouse. J Comp Physiol Psychol. 55, 1011-1013 (1962).
- Stewart, J. Reinforcing effects of light as a function of intensity and reinforcement schedule. Journal of comparative and physiological psychology. 53, 187-193 (1960).
- Caggiula, A. R. Cue dependency of nicotine self-administration and smoking. Pharmacol Biochem Behav. 70, 515-530 (2001).
- Cain, M. E., Green, T. A., Bardo, M. T. Environmental enrichment decreases responding for visual novelty. Behavioural Processes. 73, 360-366 (2006).
- Thompson, T. I. Visual Reinforcement in Siamese Fighting Fish. Science. 141, 55-57 (1963).
- Blatter, K., Schultz, W. Rewarding properties of visual stimuli. Exp Brain Res. 168, 541-546 (2006).
- Olsen, C. M., Winder, D. G. Operant sensation seeking engages similar neural substrates to operant drug seeking in C57 mice. Neuropsychopharmacology. 34, 1685-1694 (2009).
- Crabbe, J. C., Wahlsten, D., Dudek, B. C. Genetics of mouse behavior: interactions with laboratory environment. Science. 284, 1670-1672 (1999).
- Crawley, J. N. Behavioral phenotypes of inbred mouse strains: implications and recommendations for molecular studies. Psychopharmacology (Berl). 132, 107-124 (1997).
- Belknap, J. K., Metten, P., Beckley, E. H., Crabbe, J. C. Multivariate analyses reveal common and drug-specific genetic influences on responses to four drugs of abuse. Trends Pharmacol Sci. 29, 537-543 (2008).
- Mozhui, K. Strain differences in stress responsivity are associated with divergent amygdala gene expression and glutamate-mediated neuronal excitability. J Neurosci. 30, 5357-5367 (2010).
- Hefner, K. Impaired fear extinction learning and cortico-amygdala circuit abnormalities in a common genetic mouse strain. J Neurosci. 28, 8074-8085 (2008).
- Elmer, G. I., Pieper, J. O., Hamilton, L. R., Wise, R. A. Qualitative differences between C57BL/6J and DBA/2J mice in morphine potentiation of brain stimulation reward and intravenous self-administration. Psychopharmacology (Berl). 208, 309-321 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon