Method Article
Analisi di Schwann-astrociti Interazioni utilizzo In Vitro Saggi
In questo articolo
Riepilogo
Questo articolo si propone di descrivere in modo graduale comunemente usato In vitro I test eseguiti nello studio delle cellule di Schwann-asrtocyte interazioni.
Abstract
Cellule di Schwann sono una delle celle utilizzate nelle strategie di riparazione dopo le lesioni del midollo spinale. Cellule di Schwann sono in grado di supportare la rigenerazione assonale e germinazione da 1,2 secernono fattori di crescita e fornendo la promozione della crescita molecole di adesione 3 e molecole della matrice extracellulare 4. Inoltre essi mielinizzare gli assoni demielinizzati nel sito di lesione 5.
Tuttavia dopo il trapianto, le cellule di Schwann non migrano dal sito di impianto e non si mescolano con il astrociti ospite 6,7. Ciò si traduce nella formazione di un confine netto tra le cellule di Schwann e gli astrociti, creando un ostacolo per gli assoni in crescita cercando di uscire dal retro innesto nel tessuto ospite prossimale e distale. Astrociti in contatto con le cellule di Schwann anche subire l'ipertrofia e up-regolazione delle molecole inibitori 8-13.
Test in vitro sono stati utilizzati per modellare cellule di Schwann-astrociti interazioni e sono stati importanti per capire il meccanismo alla base del comportamento cellulare.
Questi test in vitro includono test di confine, dove viene effettuata una co-coltura con due cellule diverse con ogni tipo di cellula che occupa diversi territori con solo un piccolo spazio che separa i due fronti della cella. Come le cellule si dividono e migrano, i due fronti cellulare avvicinarsi gli uni agli altri e, infine, si scontrano. Questo consente il comportamento delle due popolazioni cellulari da analizzare al confine. Un'altra variante della stessa tecnica è quello di mescolare le due popolazioni cellulari in coltura e nel corso del tempo i due tipi di cellule segregare con le cellule di Schwann insieme a blocchi come isole in mezzo astrociti insieme creazione di più di Schwann-astrociti confini.
Secondo test utilizzato per studiare l'interazione di due tipi di cellule è il test di migrazione in cui il movimento cellulari possono essere rintracciati sulla superficie del tipo di cellula monostrato 14,15. Questo test è comunemente noto come test coprioggetto invertita. Cellule di Schwann sono coltivati su piccoli frammenti di vetro e sono invertiti a faccia in giù sulla superficie dei monostrati astrociti e la migrazione viene valutata dal bordo del vetrino.
Entrambi i saggi sono stati strumentali per lo studio dei meccanismi connessi alla esclusione cellulare e la formazione di confine. Alcune delle molecole identificate utilizzando queste tecniche includono N-caderine 15, proteoglicani Condroitin Solfato (CSPGs) 16,17, FGF / eparina 18, Ef / efrine 19.
Questo articolo si propone di descrivere test confine e il dosaggio della migrazione in modo graduale e chiarire gli eventuali problemi tecnici che potrebbero verificarsi.
Protocollo
1. Contorno di analisi:
- Preparazione di base: le diapositive Camera sono rivestiti con poli-D-lisina vetrini durante la notte e sterile vengono preparati prima di iniziare l'esperimento. Terreno è preparato utilizzando Media Dulbecco Modified Eagle (DMEM), integrato con il 10% di siero fetale bovino (FCS), e 1% di penicillina-streptomicina-Fungizon (FPF). Anche una bottiglia di calcio / magnesio soluzione salina bilanciata libero Hanks (HBSS) è preparato.
- Primarie di cellule di Schwann ratto coltivate in matraccio trypsinized per 3 minuti con 0,1% tripsina. Primaria cultura astrociti di ratto è trypsinized per 5 minuti con 0,1% tripsina.
Tripsina è inactived aggiungendo DMEM supplementato con 10% FCS e 1% FPF. - Trypsinized cellule di Schwann e gli astrociti vengono trasferiti a separare i tubi falcon da 15 ml e centrifugato a 300G per 5 minuti.
- Cellule di Schwann e gli astrociti sono risospese alla densità di 2 x 10 6 (vedere la sezione dei risultati rappresentativi delle variazioni di densità delle cellule).
- 50 goccia l di sospensione delle cellule di Schwann è posta ad una estremità di pozzi camera PDL rivestiti di diapositive. Una striscia di vetro è stato utilizzato per spalmare la caduta verso il centro della camera per generare un bordo dritto. (Utilizzando un tagliatore di vetro, un coprioggetto di vetro rettangolare vengono tagliate longitudinalmente in modo che fosse in base alla larghezza della camera di diapositive utilizzate per le analisi di confine)
- Una seconda goccia di 50 ml di sospensione astrociti è stato posto dalla parte opposta del pozzo stesso e spalmato verso il centro per creare un bordo dritto parallelo alla prima goccia striscio con un piccolo spacco 0,2 millimetri tra di loro.
- La camera di diapositive contenenti le gocce sono posti in incubatore a 37 ° C per 2 ore.
- Dopo 2 ore, le culture sono stati lavati con DMEM per rimuovere non iscritti detriti cellulari e mezzo fresco contenente DMEM / 10% FCS / 1% PSF aggiunto.
Nota: DMEM / 10% FCS / 1% PSF può essere completato con forskolina (2μM) ed estratto di ipofisi bovina (BPE) (10μg / mL) a stimolare la proliferazione delle cellule di Schwann. BPE fornirà i fattori di crescita necessari per consentire a lungo termine cultura delle cellule di Schwann e forskolina aumenta i livelli di adenosina monofosfato ciclico all'interno delle cellule di Schwann di indurre la proliferazione - Le cellule sono coltivate per circa 8-10 giorni a 37 ° C, 7% di CO 2 incubatore. Il mezzo deve essere cambiata ogni 3 giorni. I due fronti cellula alla fine raggiungere l'altro e un confine netto si forma tra i due tipi di cellule. In questa fase gli esperimenti possono essere effettuate analisi di fattori coinvolti nella formazione di confine.
- Co-coltura può essere fissato con 4% di formaldeide e le cellule di Schwann può essere immunoistochimica con anticorpi anti-P75 e astrociti con anticorpi anti-GFAP per identificare le cellule in co-coltura. P75 anticorpo riconosce a bassa affinità dei recettori NGF su cellule di Schwann che gli astrociti mancanza. Anti-GFAP anticorpo riconosce proteina acida gliale firbrillary che localizza al citoplasma astrociti. (Si veda la Figura 1A per contorno rappresentante)
2. Migrazione di analisi:
- 4 piastre bene (15mm pozzi) sono coperti per una notte PDL e preparato per la creazione di monostrati astrociti.
- Primaria cultura astrociti è trypsinized per 5 minuti con 0,1% tripsina. Tripsina viene inattivato con l'aggiunta di DMEM supplementato con 10% FCS e 1% PSF e cellulari centrifugati a 300G per 5 minuti. (Vedi figura 2)
- Astrociti vengono nuovamente sospesi a 1x10 5 cellule / ml. 1 ml di questa soluzione è aggiunto ad ogni rivestito PDL bene in 4 piatti bene. Astrociti sono in coltura per 24-48 ore fino a quando il monostrato è completamente confluenti.
- Per valutare la migrazione delle cellule di Schwann su monostrati astrociti, parallelamente alla creazione di monostrati astrociti, circolare PDL rivestite coprioggetto di vetro sono posti in una provetta da 50 ml e schiacciato con una pipetta di plastica per creare piccoli frammenti di vetro.
- Frammenti di vetro vengono trasferiti in un pozzo in 6 piatto piatto bene e usando pinze adatte frammenti imprese sono scelti e collocati in altri pozzi. 5 frammenti di vetro vengono inseriti in ciascun pozzetto in 6 piastre.
- Primarie di cellule di Schwann coltivate in matraccio trypsinized per 3 minuti con 0,1% tripsina. Trypsinized cellule di Schwann sono trasferiti a separare tubo falcon da 15 ml e centrifugato a 300 g per 5 minuti. Cellule di Schwann sono risospese a 2x 10 6 cellule / ml in DMEM/10% FCS / 1% FPF.
- 20 gocce l di sospensione delle cellule di Schwann si aggiunge oltre ogni 5 frammenti coprioggetto posti in 6 piastre e le cellule vengono incubate a 37 ° C CO, 7% 2 per 2 ore.
- Dopo 2 ore, le cellule di Schwann sono collegati ai frammenti coprioggetto e DMEM/10% FCS / 1% PSF (Integrato con 2μM di forskolina e 10μg / mL di BPE è aggiunto a ciascun bene in modo che i frammenti sono completamente coperti di media) .
- I 6 piastre contenenti i frammenti vengono poi messi in incubatrice per 24-48 ore fino a quando i frammenti di vetro sono completamente confluente con cellule di Schwann.
- Una volta che i frammenti sono confluenti con le cellule di Schwann, ogni frammento viene raccolto con cura utilizzando pinze taglienti e immersa in HBSS per rimuovere le cellule distaccati e poi faccia rovesciata verso il basso a monostrato astrociti.
- Ogni bene è poi coperto con 1 ml di DMEM/10% sono consentiti FCS / 1% di cellule di Schwann PSF e di migrare dalle 24 alle 48 periodo. Durante questo periodo reagenti sperimentali come fattori di crescita possono essere aggiunti per valutare il loro effetto sul numero e la distanza di migrazione delle cellule di Schwann.
- Dopo il periodo di migrazione, i frammenti di vetro sono fissati al fondo di ciascun pozzetto con l'aggiunta del 4% paraformaldeide (PFA) per 30 minuti. A seguito di fissazione, immunostain le cellule di Schwann di p75 (riconoscimento del recettore a bassa affinità NGF) poi li macchia con ABC strepavidin kit-diaminobenzidina (DAB), per consentire la visualizzazione delle cellule di Schwann sotto microscopio ottico.
3. Rappresentante dei risultati:
A seguito di 8-10 giorni di Schwann-co-culture astrociti mostrano un confine netto tra i due tipi di cellule. Questo confine è più marcato se forskolina e BPE è usato nella cultura, come la proliferazione delle cellule di Schwann è migliorata.
Se nessun confine è osservata durante il periodo di 10 giorni, il tempo della cultura può essere aumentata ulteriormente fino a quando i confini sono stabiliti. Modifica del rapporto di densità delle cellule è un modo alternativo per aumentare la formazione di confine. Un rapporto di 3:1 di Schwann: la densità delle cellule astrociti possono essere utilizzati per la preparazione sospensioni cellulari 8,18.
A seguito di immunostaining per identificare le cellule di Schwann e gli astrociti, cellule mescolanza di valutare una linea possono essere tratte dove il confine è stabilito ed il numero di cellule di Schwann migrazione nel territorio astrociti possono essere contate al microscopio a fluorescenza.
Di seguito sono riportati due esempi di immagini ottenute confini, uno con ben formato segregazione delle cellule di Schwann e gli astrociti (Figura 1A) e uno in cui le cellule non hanno segregato e in diversi territori a causa della scarsa tecnica (Figura 1B).

. Figura 1 test Boundary: Schwann-astrociti interazione. A) Un giorno 10 co-coltura saggio in presenza di forskolin e BPE per stimolare la proliferazione delle cellule di Schwann dimostra un confine netto tra i due tipi di cellule (rosso = P75, verde = GFAP). B) Un giorno 10 co-coltura saggio in cui il confine non è formato e le due fronti cella mista. Ciò era dovuto alla miscelazione dei due gocce pur ponendo gocce astrociti e cellule di Schwann uno accanto all'altro durante la preparazione del confine (rosso = P75, verde = GFAP).
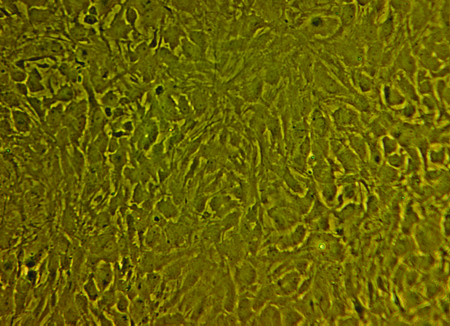
Figura 2. Un'immagine rappresentativa della confluenti monostrato astrociti
Saggi di migrazione valutare il movimento di un tipo di cellule sulla superficie di un altro tipo di cellula e quindi valutare un fenomeno diverso da quello della formazione di confine.
La pratica è necessaria per garantire invertendo i coprioggetti su monostrati non porta a danni alla cellule di Schwann-coperto frammenti di vetro e monostrati astrociti dal pinze taglienti. Per valutare la migrazione delle cellule di Schwann, la distanza massima della migrazione e del numero di cellule migrano dal bordo del vetrino può essere misurato con microscopio ottico.
Di seguito l'immagine di cellule di Schwann colorate con anticorpi P75 con colorazione DAB sulla superficie del monostrato astrociti (Figura 3).

Figura 3. Test di migrazione utilizzando test invertita coprioggetto. A) cellule di Schwann (marrone, immunoistochimica con anticorpi p75) migrare lontano dal bordo del vetrino. La freccia indica la direzione della migrazione delle cellule dal vetrino.
Discussione
I saggi di cui sopra sono stati utilizzati in diversi studi che dimostrano il ruolo dei molteplici fattori coinvolti nella formazione di confine tra il Schwann-astrociti e limitato la migrazione delle cellule di Schwann in ambiente astrocitaria.
Comprendere la meccanismi alla base di queste manifestazioni è essenziale in quanto consentirebbe lo sviluppo di strategie per ottimizzare e migliorare l'integrazione di innesti cell Schwann dopo il trapianto e in tal modo di facilitare l'uscita degli assoni rigeneranti dal retro innesto nel tessuto ospite permettendo la formazione di connessioni con il tessuto ospite.
Divulgazioni
Riconoscimenti
Vorremmo ringraziare Philippa Warren per il suo gentile aiuto.
Materiali
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 41966-029 | |
| HBSS | Invitrogen | 14170-088 | |
| FCS | Invitrogen | 10091-148 | |
| PSF | Invitrogen | 15240-062 | |
| BPE | Invitrogen | 13028-014 | |
| Forskolin | Calbiochem | 344273 | |
| Coverlips | VWR international | 631-0149 | |
| Coverlips(rectangle) | Menzel-Glaser | BB022050A1 | |
| Chamber slides | Nalge Nunc international | 177380 | |
| 4 well plates, 6 well plates | Nalge Nunc international | 4 well plates6 well plates | |
| rat p75 antibody | EMD Millipore | MAB365 | |
| GFAP antibody | Dako | Z0334 | |
| Secondary antibodies (Alexa-conjugated) | Invitrogen | A-11004 A-11034 | Goat anti mouse 568Goat anti Rabbit 488 |
| Secondary biotinylated | Vector Laboratories | Goat anti mouse | |
| DAB tablets | Sigma-Aldrich | D4418 | |
| ABC elite kit | Vector Laboratories | PK-6100 | |
| Fine Forceps | Fine Science Tools | 11295-10 | |
| Paraformaldehyde | Sigma-Aldrich | P6168 | |
| Fluorosave | Calbiochem | 345789 |
Riferimenti
- Assouline, J. G. Rat astrocytes and Schwann cells in culture synthesize nerve growth factor-like neurite-promoting factors. Brain Res. 428, 103-118 (1987).
- Taylor, J. S., Bampton, E. T. Factors secreted by Schwann cells stimulate the regeneration of neonatal retinal ganglion cells. J Anat. 204, 25-31 (2004).
- Reichardt, L. F. Integrins and cell adhesion molecules: neuronal receptors that regulate axon growth on extracellular matrices and cell surfaces. Dev Neurosci. 11, 332-347 (1989).
- Chiu, A. Y., Monteros, ., Espinosa de los, A., Cole, R. A., Loera, S., de Vellis, J. Laminin and s-laminin are produced and released by astrocytes, Schwann cells, and schwannomas in culture. Glia. 4, 11-24 (1991).
- Blakemore, W. F. Remyelination of CNS axons by Schwann cells transplanted from the sciatic nerve. Nature. 266, 68-69 (1977).
- Andrews, M. R., Stelzner, D. J. Evaluation of olfactory ensheathing and schwann cells after implantation into a dorsal injury of adult rat spinal cord. J Neurotrauma. 24, 1773-1792 (2007).
- Iwashita, Y., Fawcett, J. W., Crang, A. J., Franklin, R. J., Blakemore, W. F. Schwann cells transplanted into normal and X-irradiated adult white matter do not migrate extensively and show poor long-term survival. Exp Neurol. 164, 292-302 (2000).
- Lakatos, A., Franklin, R. J., Barnett, S. C. Olfactory ensheathing cells and Schwann cells differ in their in vitro interactions with astrocytes. Glia. 32, 214-225 (2000).
- Lakatos, A., Barnett, S. C., Franklin, R. J. Olfactory ensheathing cells induce less host astrocyte response and chondroitin sulphate proteoglycan expression than Schwann cells following transplantation into adult CNS white matter. Exp Neurol. 184, 237-246 (2003).
- Ghirnikar, R. S., Eng, L. F. Astrocyte-Schwann cell interactions in culture. Glia. 11, 367-377 (1994).
- Ghirnikar, R. S., Eng, L. F. Chondroitin sulfate proteoglycan staining in astrocyte-Schwann cell co-cultures. Glia. 14, 145-152 (1995).
- Plant, G. W., Bates, M. L., Bunge, M. B. Inhibitory proteoglycan immunoreactivity is higher at the caudal than the rostral Schwann cell graft-transected spinal cord interface. Mol Cell Neurosci. 17, 471-487 (2001).
- Fishman, P. S., Nilaver, G., Kelly, J. P. Astrogliosis limits the integration of peripheral nerve grafts into the spinal cord. Brain Res. 277, 175-180 (1983).
- Fok-Seang, J., Mathews, G. A., ffrench-Constant, C., Trotter, J., Fawcett, J. W. Migration of oligodendrocyte precursors on astrocytes and meningeal cells. Dev Biol. 171, 1-15 (1995).
- Wilby, M. J. N-Cadherin inhibits Schwann cell migration on astrocytes. Mol Cell Neurosci. 14, 66-84 (1999).
- Grimpe, B. The role of proteoglycans in Schwann cell/astrocyte interactions and in regeneration failure at PNS/CNS interfaces. Mol Cell Neurosci. 28, 18-29 (2005).
- Afshari, F. T., Kwok, J. C., White, L., Fawcett, J. W. Schwann cell migration is integrin-dependent and inhibited by astrocyte-produced. Glia. , (2010).
- Santos-Silva, A. FGF/heparin differentially regulates Schwann cell and olfactory ensheathing cell interactions with astrocytes: a role in astrocytosis. J Neurosci. 27, 7154-7167 (2007).
- Afshari, F. T., Kwok, J. C., Fawcett, J. W. Astrocyte-produced ephrins inhibit schwann cell migration via VAV2 signaling. J Neurosci. 30, 4246-4255 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon