Method Article
Analyse de Schwann-astrocytes interactions à l'aide In Vitro Tests
Dans cet article
Résumé
Cet article vise à décrire de manière progressive l'couramment utilisés In vitro Essais utilisés dans l'étude de cellules de Schwann-asrtocyte interactions.
Résumé
Les cellules de Schwann sont l'une des cellules couramment utilisés dans les stratégies de réparation suite à des blessures de la moelle épinière. Les cellules de Schwann sont capables de supporter la régénération axonale et la germination par les facteurs de croissance et en fournissant 1,2 sécrétant de promotion de croissance trois molécules d'adhésion et des molécules de la matrice extracellulaire 4. En outre, ils myéliniser les axones démyélinisées au site de la lésion 5.
Toutefois, suite à la transplantation, les cellules de Schwann ne migrent pas à partir du site de l'implant et ne se mêlent avec les astrocytes hôte 6,7. Il en résulte la formation d'une frontière nette entre les cellules de Schwann et les astrocytes, créant un obstacle pour les axones en croissance essayant de quitter l'arrière du greffon dans le tissu hôte proximale et distale. Les astrocytes en contact avec les cellules de Schwann subissent également une hypertrophie et jusqu'à réguler les molécules inhibitrices 8-13.
Dans des essais in vitro ont été utilisées pour modéliser la cellule de Schwann-astrocytes interactions et ont été importantes dans la compréhension du mécanisme qui sous-tendent le comportement cellulaire.
Ces tests in vitro comprennent test frontière, où une co-culture est faite en utilisant deux cellules différentes à chaque type de cellule d'occupation des territoires différents avec seulement un petit écart qui sépare les deux fronts cellule. Comme les cellules se divisent et migrent, les deux fronts cellulaires se rapprocher les uns aux autres et finalement en collision. Cela permet au comportement des deux populations cellulaires à analyser à la frontière. Une autre variante de la même technique est de mélanger les deux populations cellulaires dans la culture et au fil du temps les deux types cellulaires séparer avec des cellules de Schwann groupées comme des îles dans entre les astrocytes ainsi que la création de plusieurs Schwann-astrocytes limites.
Le second test utilisé dans l'étude de l'interaction des deux types cellulaires est le dosage de la migration cellulaires où le mouvement peut être suivi sur la surface de l'autre type cellulaire monocouche 14,15. Ce dosage est communément appelé test lamelle inversé. Les cellules de Schwann sont cultivées sur des petits fragments de verre et ils sont inversés face cachée sur la surface de monocouches d'astrocytes et de la migration est évaluée à partir du bord de la lamelle.
Les deux dosages ont joué un rôle dans l'étude des mécanismes sous-jacents impliqués dans l'exclusion cellulaires et la formation de frontière. Certaines des molécules identifiées en utilisant ces techniques incluent le N-cadhérines 15, chondroïtine sulfate protéoglycanes (CSPG) 16,17, le FGF / Héparine 18, Eph / éphrines 19.
Cet article vise à décrire de dosage et le dosage limite de migration en mode pas à pas et d'élucider les éventuels problèmes techniques qui pourraient survenir.
Protocole
1. Assay limites:
- Préparation de base: diapositives Chambre sont recouvertes de poly-D-Lysine lames de verre la nuit et stériles sont préparés avant de commencer l'expérience. Milieu est préparé en utilisant un milieu Eagle modifié par Dulbecco (DMEM), supplémenté avec 10% sérum de veau foetal (FCS), et 1% de pénicilline-streptomycine-Fungizon (FSP). Aussi une bouteille de calcium / magnésium libre solution saline équilibrée de Hanks (HBSS) est préparé.
- Primaire des cellules de Schwann de rat en culture dans le flacon sont trypsinisées pendant 3 minutes en utilisant 0,1% de trypsine. Primaire de la culture des astrocytes rat est trypsinisées pendant 5 minutes en utilisant 0,1% de trypsine.
La trypsine est inactivé par l'ajout de DMEM supplémenté avec 10% de SVF et 1% PSF. - Trypsinisées cellules de Schwann et les astrocytes sont transférés à séparer 15 ml tubes Falcon et centrifugés à 300G pendant 5 minutes.
- Les cellules de Schwann et les astrocytes sont remis en suspension à la densité de 2 x 10 6 (voir la section des résultats représentatifs des variations de densité cellulaire).
- 50 déposer uL de suspension de cellules de Schwann est placé à une extrémité du PDL puits recouverts de glisser chambre. Une bande de verre a été utilisé pour salir la chute vers le centre de la chambre de générer un bord droit. (Utilisation d'un coupe-verre, un des lamelles de verre rectangulaires sont coupées longitudinalement afin qu'il s'adapte à la largeur de la chambre de diapositives utilisées pour des essais de la frontière)
- Une deuxième baisse de 50 pi de la suspension des astrocytes a été placé à l'extrémité opposée du même puits et barbouillé vers le centre pour créer une arête droite parallèle à la première goutte frottis avec un petit écart de 0,2 mm entre eux.
- La chambre de diapositives contenant les gouttes sont placées dans l'incubateur à 37 ° C pendant 2 heures.
- Après 2 heures, les cultures ont été lavées avec du DMEM pour enlever non-inscrits débris cellulaires et du milieu frais contenant du DMEM / FCS à 10% / 1% PSF ajouté.
Remarque: DMEM / FCS à 10% / 1% PSF peut être complétée par la forskoline (2 pm) et extrait pituitaire bovin (BPE) (10 pg / mL) stimulent la prolifération de cellules de Schwann. BPE fournir les facteurs de croissance nécessaires pour permettre à long terme de culture de cellules de Schwann et la forskoline augmente le taux adénosine monophosphate cyclique dans les cellules de Schwann à induire la prolifération - Les cellules sont cultivées pendant environ 8-10 jours à 37 ° C, 7% de CO 2 incubateur. Le milieu nécessite d'être changée tous les 3 jours. Les deux fronts de cellule finira par atteindre l'autre et d'une limite nette se forme entre les deux types cellulaires. A ce stade, les expériences peuvent être réalisées analyser les facteurs impliqués dans la formation de frontière.
- Co-culture peut être fixé à l'aide de formaldéhyde 4% et les cellules de Schwann peuvent être immunocolorés avec des anti-P75 anticorps et les astrocytes avec des anticorps anti-GFAP pour identifier les cellules de co-culture. P75 anticorps reconnaît peu d'affinité sur des récepteurs du NGF cellules de Schwann qui astrocytes manque. Anti-GFAP anticorps reconnaît gliales firbrillary protéine acide qui localise au cytoplasme d'astrocytes. (S'il vous plaît voir la Figure 1A pour la limite de son représentant)
2. Essai de migration:
- 4 assiettes bien (15mm puits) sont PDL couché la nuit et préparées pour la création de monocouches d'astrocytes.
- Primaire de la culture des astrocytes sont trypsinisées pendant 5 minutes en utilisant 0,1% de trypsine. La trypsine est inactivée par l'ajout de DMEM supplémenté avec 10% de SVF et 1% de cellules PSF et centrifugés à 300G pendant 5 minutes. (Voir Figure 2)
- Les astrocytes sont re-suspendue à 1x10 5 cellules / ml. 1 ml de cette solution est ajoutée à chaque revêtement PDL bien dans 4 assiettes bien. Les astrocytes sont cultivés pendant 24-48 heures jusqu'à ce que la monocouche est complètement confluentes.
- Afin d'évaluer la migration des cellules de Schwann sur des monocouches d'astrocytes, parallèlement à la création de monocouches d'astrocytes, circulaire lamelles de verre enduit de PDL sont placés dans un tube de 50 ml et écrasés à l'aide d'une pipette en plastique pour créer de petits fragments de verre.
- Des fragments de verre sont transférés dans un puits dans 6 assiette à bien et l'aide de pinces appropriées fragments de taille sont choisis et placés dans d'autres puits. 5 fragments de verre sont placés dans chaque puits de plaque de 6 puits.
- Primaire des cellules de Schwann cultivées en flacon sont trypsinisées pendant 3 minutes en utilisant 0,1% de trypsine. Trypsinisées cellules de Schwann sont transférés à séparer le tube Falcon de 15 ml et centrifugées à 300 g pendant 5 minutes. Les cellules de Schwann sont remis en suspension à 2x 10 6 cellules / ml dans DMEM/10% SVF / 1% PSF.
- 20 ul de gouttelettes cellules de Schwann suspension est ajoutée sur chaque lamelle 5 fragments placés dans 6 assiettes bien et les cellules sont incubées à 37 ° C CO, 7% 2 pendant 2 heures.
- Après 2 heures, les cellules de Schwann sont attachés à la lamelle et fragments DMEM/10% SVF / 1% PSF (Complété avec 2 pm de la forskoline et de 10 pg / mL de BPE est ajouté à chaque puits afin que les fragments sont complètement couverts de moyenne) .
- La plaque de 6 puits contenant les fragments sont ensuite placés dans l'incubateur pendant 24-48 heures jusqu'à ce que les fragments de verre sont complètement concouramment avec des cellules de Schwann.
- Une fois les fragments sont confluentes avec des cellules de Schwann, chaque fragment est ramassé avec soin en utilisant une pince forte et trempée dans du HBSS pour enlever les cellules seules et ensuite le visage inversé vers le bas sur monocouche d'astrocytes.
- Chaque puits est ensuite recouvert avec 1 ml d'DMEM/10% SVF / 1% de cellules de Schwann PSF et sont autorisés à migrer pendant 24 à 48 période. Durant cette période réactifs expérimentales telles que les facteurs de croissance peuvent être ajoutés afin d'évaluer leur effet sur le nombre et la distance de migration des cellules de Schwann.
- Après la période de migration, les fragments de verre sont fixés au fond de chaque puits en ajoutant 4% de paraformaldéhyde (PFA) pour 30 minutes. Après fixation, les cellules de Schwann immunocoloration pour la p75 (reconnaissant des récepteurs de faible affinité du NGF), puis les colorer à l'aide ABC strepavidine kit-diaminobenzidine (DAB), pour permettre la visualisation des cellules de Schwann au microscope optique.
3. Les résultats représentatifs:
Après 8-10 jours de Schwann-astrocytes co-cultures montrent une frontière nette entre les deux types cellulaires. Cette limite est plus prononcé si la forskoline et BPE est utilisé dans la culture comme la prolifération des cellules de Schwann est renforcée.
Si aucune limite n'est constatée pendant la période de 10 jours, le temps de la culture peut être encore augmenté jusqu'à la frontières sont établies. Changer le rapport de la densité cellulaire est une autre façon d'augmenter la formation de frontière. Un ratio de 3:1 de Schwann: la densité des cellules astrocytaires peuvent être utilisés lors de la préparation des suspensions cellulaires 8,18.
Après immunomarquage pour identifier les cellules de Schwann et les astrocytes, des cellules d'évaluer entremêlement une ligne peut être établi où la limite est établie et le nombre de cellules de Schwann migrant sur le territoire des astrocytes peuvent être comptés sous microscope à fluorescence.
Voici deux exemples d'images obtenues frontières, l'un avec le bien-formé la ségrégation des cellules de Schwann et les astrocytes (figure 1A) et une où les cellules ne sont pas séparés et dans des territoires différents en raison de mauvaise technique (figure 1B).

Test Boundary. Figure 1: Schwann-astrocytes interaction. A) Une journée 10 co-culture de dosage, en présence de forskoline et BPE à stimuler la prolifération de cellules de Schwann démontre une frontière nette entre les deux types de cellules (rouge = P75, vert = GFAP). B) Une journée 10 co-culture où la limite de dosage n'est pas formé et les deux fronts de cellules mixtes. Cela est dû au mélange des deux gouttelettes tout en plaçant les gouttelettes de cellules de Schwann et des astrocytes côté de l'autre lors de la préparation de la frontière (rouge = P75, vert = GFAP).
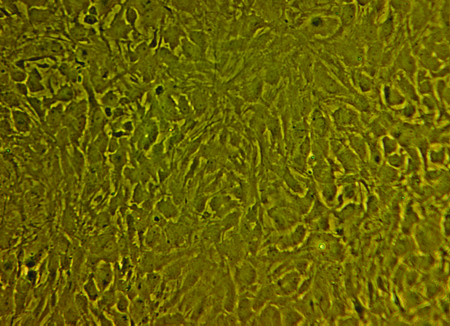
Figure 2. Image représentative de monocouche d'astrocytes confluents
Migration des dosages d'évaluer le mouvement d'un seul type de cellules sur la surface d'un autre type de cellule et donc d'évaluer un phénomène différent de celui de la formation de frontière.
La pratique est nécessaire pour assurer inversant les lamelles sur des monocouches ne conduit pas à des dommages à l'cellule de Schwann couvert de fragments de verre et des monocouches d'astrocytes par la pince forte. Afin d'évaluer la migration des cellules de Schwann, la distance maximale de migration et le nombre de cellules qui migrent depuis le bord de la lamelle peut être mesurée au microscope optique.
Ci-dessous est à l'image de cellules de Schwann colorés avec des anticorps P75 utilisant une coloration DAB sur la surface des monocouches d'astrocytes (figure 3).

Test de migration figure 3. Utilisant test lamelle inversé. A) Les cellules de Schwann (brun, immunocolorées avec p75 anticorps) migrer loin du bord de la lamelle. La flèche indique la direction de la migration cellulaire loin de la lamelle.
Discussion
Les tests décrits ci-dessus ont été utilisés dans différentes études démontrant le rôle de multiples facteurs impliqués dans la formation frontière entre les astrocytes et Schwann limitées de migration de cellules de Schwann dans l'environnement astrocytaire.
Comprendre les mécanismes sous-jacents de ces événements est essentielle car elle permettrait le développement de stratégies visant à optimiser et améliorer l'intégration des greffes de cellules de Schwann suivant la transplantation et, ce faisant faciliter la sortie des axones régénérant à l'arrière du greffon dans le tissu hôte permettant la formation de connexions avec le tissu hôte.
Déclarations de divulgation
Remerciements
Nous tenons à remercier Philippe Warren pour son aide genre.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 41966-029 | |
| HBSS | Invitrogen | 14170-088 | |
| FCS | Invitrogen | 10091-148 | |
| PSF | Invitrogen | 15240-062 | |
| BPE | Invitrogen | 13028-014 | |
| Forskolin | Calbiochem | 344273 | |
| Coverlips | VWR international | 631-0149 | |
| Coverlips(rectangle) | Menzel-Glaser | BB022050A1 | |
| Chamber slides | Nalge Nunc international | 177380 | |
| 4 well plates, 6 well plates | Nalge Nunc international | 4 well plates6 well plates | |
| rat p75 antibody | EMD Millipore | MAB365 | |
| GFAP antibody | Dako | Z0334 | |
| Secondary antibodies (Alexa-conjugated) | Invitrogen | A-11004 A-11034 | Goat anti mouse 568Goat anti Rabbit 488 |
| Secondary biotinylated | Vector Laboratories | Goat anti mouse | |
| DAB tablets | Sigma-Aldrich | D4418 | |
| ABC elite kit | Vector Laboratories | PK-6100 | |
| Fine Forceps | Fine Science Tools | 11295-10 | |
| Paraformaldehyde | Sigma-Aldrich | P6168 | |
| Fluorosave | Calbiochem | 345789 |
Références
- Assouline, J. G. Rat astrocytes and Schwann cells in culture synthesize nerve growth factor-like neurite-promoting factors. Brain Res. 428, 103-118 (1987).
- Taylor, J. S., Bampton, E. T. Factors secreted by Schwann cells stimulate the regeneration of neonatal retinal ganglion cells. J Anat. 204, 25-31 (2004).
- Reichardt, L. F. Integrins and cell adhesion molecules: neuronal receptors that regulate axon growth on extracellular matrices and cell surfaces. Dev Neurosci. 11, 332-347 (1989).
- Chiu, A. Y., Monteros,, Espinosa de los, A., Cole, R. A., Loera, S., de Vellis, J. Laminin and s-laminin are produced and released by astrocytes, Schwann cells, and schwannomas in culture. Glia. 4, 11-24 (1991).
- Blakemore, W. F. Remyelination of CNS axons by Schwann cells transplanted from the sciatic nerve. Nature. 266, 68-69 (1977).
- Andrews, M. R., Stelzner, D. J. Evaluation of olfactory ensheathing and schwann cells after implantation into a dorsal injury of adult rat spinal cord. J Neurotrauma. 24, 1773-1792 (2007).
- Iwashita, Y., Fawcett, J. W., Crang, A. J., Franklin, R. J., Blakemore, W. F. Schwann cells transplanted into normal and X-irradiated adult white matter do not migrate extensively and show poor long-term survival. Exp Neurol. 164, 292-302 (2000).
- Lakatos, A., Franklin, R. J., Barnett, S. C. Olfactory ensheathing cells and Schwann cells differ in their in vitro interactions with astrocytes. Glia. 32, 214-225 (2000).
- Lakatos, A., Barnett, S. C., Franklin, R. J. Olfactory ensheathing cells induce less host astrocyte response and chondroitin sulphate proteoglycan expression than Schwann cells following transplantation into adult CNS white matter. Exp Neurol. 184, 237-246 (2003).
- Ghirnikar, R. S., Eng, L. F. Astrocyte-Schwann cell interactions in culture. Glia. 11, 367-377 (1994).
- Ghirnikar, R. S., Eng, L. F. Chondroitin sulfate proteoglycan staining in astrocyte-Schwann cell co-cultures. Glia. 14, 145-152 (1995).
- Plant, G. W., Bates, M. L., Bunge, M. B. Inhibitory proteoglycan immunoreactivity is higher at the caudal than the rostral Schwann cell graft-transected spinal cord interface. Mol Cell Neurosci. 17, 471-487 (2001).
- Fishman, P. S., Nilaver, G., Kelly, J. P. Astrogliosis limits the integration of peripheral nerve grafts into the spinal cord. Brain Res. 277, 175-180 (1983).
- Fok-Seang, J., Mathews, G. A., ffrench-Constant, C., Trotter, J., Fawcett, J. W. Migration of oligodendrocyte precursors on astrocytes and meningeal cells. Dev Biol. 171, 1-15 (1995).
- Wilby, M. J. N-Cadherin inhibits Schwann cell migration on astrocytes. Mol Cell Neurosci. 14, 66-84 (1999).
- Grimpe, B. The role of proteoglycans in Schwann cell/astrocyte interactions and in regeneration failure at PNS/CNS interfaces. Mol Cell Neurosci. 28, 18-29 (2005).
- Afshari, F. T., Kwok, J. C., White, L., Fawcett, J. W. Schwann cell migration is integrin-dependent and inhibited by astrocyte-produced. Glia. , (2010).
- Santos-Silva, A. FGF/heparin differentially regulates Schwann cell and olfactory ensheathing cell interactions with astrocytes: a role in astrocytosis. J Neurosci. 27, 7154-7167 (2007).
- Afshari, F. T., Kwok, J. C., Fawcett, J. W. Astrocyte-produced ephrins inhibit schwann cell migration via VAV2 signaling. J Neurosci. 30, 4246-4255 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon