Method Article
Espressione, solubilizzazione detergente, e purificazione di un trasportatore di membrana, la proteina multiresistente MexB Resistenza
In questo articolo
Riepilogo
In questo protocollo dimostriamo l'espressione, solubilizzazione e la purificazione di una proteina di membrana ricombinanti espresse, MexB, come un complesso proteina solubile detergente. MexB è un trasportatore di membrana multifarmaco resistenza da parte degli agenti patogeni opportunistici batterici Pseudomonas aeruginosa.
Abstract
Multiresistenza ai farmaci (MDR), la capacità di una cellula tumorale o patogeno per resistere ad una vasta gamma di strutturalmente e funzionalmente correlati farmaci anti-cancro o antibiotici, è un grave problema attuale della salute pubblica. Questa resistenza ai farmaci è in gran parte a causa di pompe per la somministrazione di energia-dipendente efflusso. Le pompe espellere farmaci anti-cancro o antibiotici nel mezzo esterno, riducendo la loro concentrazione intracellulare di sotto di una soglia di tossicità. Stiamo studiando la resistenza ai farmaci in Pseudomonas aeruginosa, un patogeno opportunistico che provoca infezioni batteriche nei pazienti con molti tipi di lesioni o malattie, per esempio, ustioni o fibrosi cistica, e anche in immuno-cancro, dialisi, trapianto e pazienti. Le principali pompe di efflusso MDR in P. aeruginosa sono complessi tripartita composta da una membrana interna protone-droga antiporter (RND), un canale di membrana esterna (OMF), e una proteina linker periplasmatico (MFP) 1-8. Le proteine RND e OMF sono proteine transmembrana. Proteine transmembrana rappresentano oltre il 30% di tutte le proteine e il 65% dei bersagli farmacologici in corso. I domini transmembrana idrofobici produrre le proteine solubili in tampone acquoso. Prima di una proteina transmembrana può essere purificato, è necessario trovare le condizioni tampone contenente un detergente delicato che consentono la proteina di essere solubilizzati come un complesso detergente proteico (PDC) 9-11. In questo esempio, usiamo un RND proteine, il P. aeruginosa transmembrana trasportatore MexB, per dimostrare come esprimere una forma ricombinante di una proteina transmembrana, solubilizzare usando detersivi, e poi purificare i complessi proteici detergente. Questo metodo generale può essere applicato l'espressione, la purificazione, e la solubilizzazione di molte altre proteine di membrana ricombinanti espresse. I complessi proteici detergente può essere utilizzato successivamente per la caratterizzazione biochimica e biofisica tra cui X-ray determinazione della struttura cristallina o studi di reticolazione.
Protocollo
1. 1 ° giorno:
MexB da Pseudomonas aeruginosa è codificato da pFB101. Il gene è stato amplificato da MexB P. aeruginosa DNA genomico e inserite nel NdeI e siti di restrizione XhoI del + pET30b vettore. Il costrutto contiene un C-terminale tag hexahistidine.
- Il plasmide viene utilizzato per trasformare E. coli ceppo C43 (DE3) 12, e il trasformanti sono placcati su agar LB contenente 30 ug / ml kanamicina.
2. 2 ° giorno: Pernottamento Culture:
- In serata, 4 X 3 culture LB ml contenente 30 ug / ml kanamicina sono inoculate dalle colonie trasformante fresca. In alternativa, le culture possono essere inoculato da una permanente congelato.
Queste culture piccoli sono coltivate su un rullo a 37 ° C durante la notte.
3. 3 ° giorno: Growing 6 litri Culture:
- Al mattino, utilizzare le culture durante la notte per inoculare LB 150 ml contenente 30 ug / ml kanamicina. Far crescere la coltura a 37 ° C su un agitatore.
- Nel pomeriggio, usare la cultura piccolo per inoculare 6 x 1L 2XYT supporti contenenti 30 ug / ml kanamicina in fiaschi Fernbach. (Usa 25 mL per la cultura per una diluizione 1:40). Crescono le culture a 37 ° C fino a quando non raggiungono un diametro esterno 600 del 0,4-0,6, circa 1,5 ore
- Quando le culture raggiungere la giusta densità, indurre l'espressione delle proteine con l'aggiunta di IPTG 1M 0,5 ml. Mettere tutti i palloni indietro nello shaker e continuano a crescere loro a 30 ° C durante la notte.
4. Giorno 4: Raccolta Cellule e Purificare la proteina:
- Aggiungi inibitori della proteasi, DNAsi, e lisozima per le soluzioni tampone come segue: a 50 ml di tampone risospensione delle cellule, aggiungere DNaseI 10 mg (0,1 mg / ml concentrazione finale), 1 Completa EDTA senza tavoletta inibitore della proteasi, e un pizzico di lisozima . A 60 mL di tampone membrana risospensione, aggiungere 1 compressa inibitore della proteasi. Per un altro da 50 ml di tampone membrana risospensione, aggiungere 1 compressa inibitore della proteasi. Tenere tutte e tre le soluzioni in ghiaccio.
- Centrifugare le culture 30 min 5.000 giri in su larga scala centrifuga per raccogliere le cellule.
- Risospendere le cellule in 100 ml di tampone risospensione delle cellule (50 NaP mM, pH 7,0, 300 mM NaCl, 2 mM MgCl 2, 1 Completa EDTA senza tavoletta inibitore della proteasi, 0,1 mg / ml di DNAsi I, un pizzico di lisozima)
- Far passare la soluzione di cellule due volte attraverso una cella di pressione francese a 12.000 psi (762 pressione manometrica). Raccolgono il lisato cellulare in una bottiglia mantenuto freddo sul ghiaccio.
- Trasferire il lisato cellulare di SS34 provette da centrifuga e centrifugare per rimuovere i detriti cellulari per 30 min a 10.000 rpm a 4 ° C in un rotore-34 SS.
- Rimuovere con attenzione il sopranatante in Ti647.5 tubi ultracentrifuga. Centrifuga da 50 min a 40.000 rpm a 4C. Scartare il surnatante.
- Risospendere il pellet, che contiene le membrane delle cellule, a ca. 25 mL di tampone risospensione membrana (50 NaP mM, pH 7,0, 300 mM NaCl, 5% glicerolo, 1 Completa EDTA senza tavoletta inibitore della proteasi).
- Trasferire la sospensione membrana ad una provetta pulita e centrifugare a 40.000 rpm in un rotore Ti647.5 per 50 minuti a 4 ° C.
- Eliminare il supernatante e risospendere il pellet lavato membrana in 25 mL di tampone risospensione membrana (50 NaP mM, pH 7,0, 300 mM NaCl, 5% glicerolo, 1 Completa EDTA senza tavoletta inibitore della proteasi).
5. TM Proteine Solublization:
- Per le membrane risospeso (circa 25 ml), aggiungere 6 mL DDM 10% (concentrazione finale detergente DDM = 2%) Rock la miscela a 4 ° C per 2 ore.
- Centrifugare la miscela a 40.000 rpm per 40 minuti a 4 ° C nel rotore Ti647.5 per separare il detergente solubile complessi proteici da proteine insolubili. Salvare il surnatante, che contiene il detergente MexB complessi proteici.
6. IMAC:
- Mescolare il surnatante ottenuto dalla rotazione ad alta velocità con le perline di metallo affinità talon equilibrata nel buffer di risospensione. Incubare per 1 ora su un rullo a 4 ° C.
- Versare l'impasto in un corpo colonna a gravità ed eliminare il flusso attraverso.
- Lavare la colonna con 20 ml (10 volumi di colonna) di IMAC Binding Buffer e Wash (50 NaP mM, pH 7, 300 mM NaCl, 5% glicerolo, 0,2% DDM)
- Eluire la proteina con tampone di eluizione IMAC (50 NaP mM, pH 7,0, 300 mM NaCl, 5% glicerolo, 250 mM imidazolo, DDM 0,2%).
- Prendere 15 campioni microlitri della frazioni di eluizione, mescolare ognuno con 15 microlitri di buffer 2X SDS campione per l'analisi mediante elettroforesi su gel di poliacrilamide. Spin 30sec in una microcentrifuga. Analizzare i campioni su un 10% di poliacrilammide SDS gel per stimare la quantità e la purezza di MexB in ogni frazione.
- In comune le frazioni contenenti i complessi proteici detergente MexB e concentrarle in un concentratore di rotazione a 4 ° C. Fare attenzione che la proteina non precipitare in questa step.
7. Gel filtrazione Colonna:
- Pre-equilibrare uno Superose 12 HL 30/10 colonna con 24 mL di tampone di corsa (50 NaP mM, pH 7,0, 300 mM NaCl, 5% glicerolo, 0,2% beta-octylglucoside), e attendere una linea di base piatta.
- Sciacquare il sistema a ciclo Akta carico con tampone di corsa.
- Filtrare la soluzione proteica utilizzando un filtro siringa prima di applicarlo alla colonna.
- Di carico fino a 240 microlitri della soluzione proteica sulla colonna, con una concentrazione di proteine fino a 5 mg / ml.
- Esegui 1,5 volumi di colonna (36 ml) di tampone, raccogliere frazioni 0,25 ml. I complessi proteici detergente MexB deve eluire come un picco intorno ai 10 - 15 ml di volume di eluizione.
- Prendere 5 campioni microlitri della frazioni di picco. Mescolare ogni campione 1:1 con tampone 2X campione SDS. Analizzare i campioni su un gel di poliacrilamide al 10% per stimare la quantità e la purezza di MexB in ogni frazione
- Pool di frazioni contenenti MexB puro.
8. Rappresentante dei risultati:
Figura 1 include un gel di poliacrilamide con le frazioni colonna raccolti dalla colonna IMAC e le frazioni singoli dalla colonna gel filtrazione. Dopo la colonna di gel filtrazione la proteina sembra puro gel di poliacrilammide Coomassie macchiati. Figura 2 include una traccia dalla colonna gel filtrazione mostra la vetta principale del complesso eluizione di detergente proteico dalla colonna. Il rendimento medio di proteine MexB è di circa 2 mg per 6 litri di cultura 2XYT.
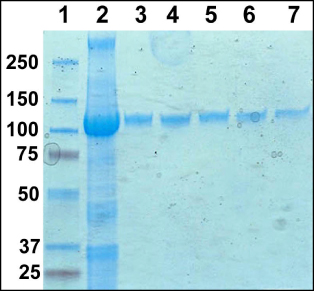
Figura 1. SDS-PAGE gel di purificazione del PDC MexB. Corsia 1, marcatori di peso molecolare. 2, pool frazioni IMAC. 3-7, gel filtrazione colonna frazioni.
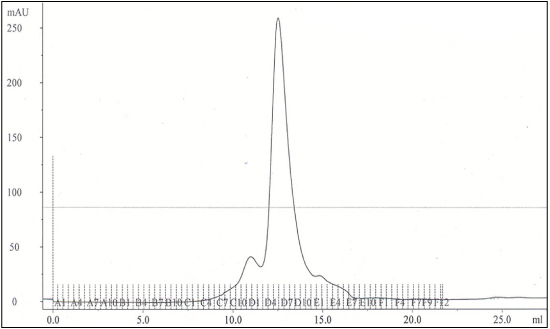
Figura 2. Esempio di risultati Gel filtrazione per complessi proteici detergente MexB (PDC).
Discussione
Oltre alla resistenza multidrug, molte attività vitali cellulari, compreso il trasporto di ioni, comunicazione cellula-cellula, il trasporto delle vescicole, il mantenimento della struttura cellulare, e interazioni ospite-patogeno, coinvolgono le proteine che sono incorporati nella membrana cellulare. Proteine transmembrana costituiscono oltre il 30% di proteine note e sono gli obiettivi per la maggior parte dei farmaci oggi in uso. Il pieghevole improprio o attività delle proteine transmembrana portare a importanti malattie genetiche, fra cui la fibrosi cistica e il diabete. Nonostante la grande importanza delle proteine transmembrana, c'è molto meno conosciuto circa le loro strutture e dei meccanismi molecolari che per le proteine solubili. La presenza di sequenze idrofobiche può rendere difficile esprimere e isolare grandi quantità di queste proteine e li rende refrattario a molti metodi biochimici e strutturali.
Questo protocollo ha dimostrato l', solubilizzazione detergente espressione e la purificazione di una proteina di membrana MDR come un complesso proteina solubile detergente. Questi metodi possono essere utilizzati con alcune modifiche per molte proteine transmembrana ricombinante espresso. La risultante purificata complessi detergente proteine sono solubili e possono essere utilizzati per le prove di cristallizzazione di raggi X determinazione struttura cristallografica e per altri caratterizzazione biofisica e biochimica, compresa la ricostituzione in liposomi o studi di reticolazione.
Durante le procedure di purificazione, è importante fare attenzione che i complessi proteici detergente non precipitare durante le fasi di concentramento lo spin. Diversi metodi possono anche essere utilizzati per aiutare concentrare il PDC prima o dopo la fase di gel filtrazione, come ad esempio ripetendo il passo IMAC con una colonna molto piccolo e il volume di eluizione di piccole dimensioni.
Divulgazioni
Riconoscimenti
Questo progetto è stato sostenuto dalle concessioni per CJJ dalla National Science Foundation e la Società per Scienze Biomolecolari.
Materiali
| Name | Company | Catalog Number | Comments |
| SDS sample buffer | Bio-Rad | 161-0737 | |
| C43(DE3) E. coli strain | Lucigen | 60345-1 | |
| kanamycin sulfate | Sigma-Aldrich | K4378 | |
| 2XYT media | Fisher Scientific | BP2466-2 | |
| LB media | Fisher Scientific | AC61189-5000 | |
| IPTG | Sigma-Aldrich | I6758 | |
| DNaseI | Fisher Scientific | BP3226-1 | |
| Lysozyme | Sigma-Aldrich | L7651 | |
| Complete EDTA-free protease inhibitor tablets | Roche Group | 11 873 580 001 | |
| NaP monobasic | Sigma-Aldrich | S6566 | |
| NaP dibasic | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S6191 | |
| MgCl2 | Sigma-Aldrich | M1028 | |
| Glycerol | Fisher Scientific | BP229-1 | |
| n-dodecyl-β-D-maltopyranoside | Anatrace | D310 | |
| 15ml tubes | Corning | 430052 | |
| See-Saw Rocker | Fisher Scientific | SSL 4 | |
| Talon metal affinity resin | Clontech Laboratories | 635503 | |
| imidazole | Sigma-Aldrich | I5513 | |
| 10% polyacrylamide SDS PAGE gels | Bio-Rad | 161-1454 | |
| Tris/glycine/SDS PAGE running buffer | Bio-Rad | 161-0732 | |
| Kaleidascope prestained molecular weight markers | Bio-Rad | 161-0324 | |
| Superose 12 30/10 column | GE Healthcare | 12 10/300 GL | |
| Amicon centrifugal concentrator | EMD Millipore | UFC801024 | |
| Syringe filter | Fisher Scientific | SLFG R04 NL | |
| Fernbach flasks | Fisher Scientific | 09-552-39 | |
| Shaker to hold Fernbach flasks | Fisher Scientific | ||
| Akta system | GE Healthcare | ||
| J6 Large scale centrifuge with JLA-8.1000 rotor | Beckman Coulter Inc. | ||
| 1 l centrifuge bottles | Beckman Coulter Inc. | 969329 | |
| RC-5 centrifuge | Thermo Fisher Scientific, Inc. | ||
| SS34 fixed-angle rotor and tubes | Thermo Fisher Scientific, Inc. | ||
| Sorvall floor model Ultracentrifuge | Thermo Fisher Scientific, Inc. | ||
| T647.5 rotor and tubes with caps | Thermo Fisher Scientific, Inc. | 08322 | |
| French Pressure Cell | Thermo Fisher Scientific, Inc. | FA-032 |
Riferimenti
- Eda, S., Maseda, H., Nakae, T. An elegant means of self-protection in gram-negative bacteria by recognizing and extruding xenobiotics from the periplasmic space. J. Biol. Chem. 278, 2085-2088 (2003).
- Li, X. Z., Ma, D., Livermore, D. M., Nikaido, H. Role of efflux pump(s) in intrinsic resistance of Pseudomonas aeruginosa: active efflux as a contributing factor to beta-lactam resistance. Antimicrob. Agents Chemother. 38, 1742-1752 (1994).
- Li, X. Z., Nikaido, H., Poole, K. Role of MexA-MexB-OprM in antibiotic efflux in Pseudomonas aeruginosa. Antimicrob. Agents Chemother. 39, 1948-1953 (1995).
- Masuda, N., Sakagawa, E., Ohya, S., Gotoh, N., Tsujimoto, H., Nishino, T. Substrate specificities of MexAB-OprM, MexCD-OprJ, and MexXY-oprM efflux pumps in Pseudomonas aeruginosa. Antimicrob. Agents Chemother. 44, 3322-3327 (2000).
- Okusu, H., Ma, D., Nikaido, H. AcrAB efflux pump plays a major role in the antibiotic resistance phenotype of Escherichia coli multiple-antibiotic-resistance (Mar) mutants. J. Bacteriol. 178, 306-308 (1996).
- Srikumar, R., Kon, T., Gotoh, N., Poole, K. Expression of Pseudomonas aeruginosa multidrug efflux pumps MexA-MexB-OprM and MexC-MexD-OprJ in a multidrug-sensitive Escherichia coli strain. Antimicrob. Agents Chemother. 42, 65-71 (1998).
- Tikhonova, E. B., Zgurskaya, H. I. AcrA, AcrB, and TolC of Escherichia coli Form a Stable Intermembrane Multidrug Efflux. Complex. J. Biol. Chem. 279, 32116-3224 (2004).
- Yoneyama, H., Ocakatan, A., Tsuda, M., Nakae, T. The role of mex-gene products in antibiotic extrusion in Pseudomonas aeruginosa. Biochem. Biophys. Res. Commun. 233, 611-618 (1997).
- Berger, B. W., Gendron, C. M., Robinson, C. R., Kaler, E. W., Lenhoff, A. M. The role of protein and surfactant interactions in membrane-protein crystallization. Acta. Crystallogr. D Biol. Crystallogr. 61, 724-730 (2005).
- Jones, M. Surfactants in membrane solubilisation. Int. J. Pharm. 177, 137-159 (1999).
- Maire, M. le, Champeil, P., Moller, J. V. Interaction of membrane proteins and lipids with solubilizing detergents. Biochim. Biophys. Acta. 1508, 86-111 (2000).
- Miroux, B., Walker, J. E. Over-production of proteins in Escherichia coli: mutant hosts that allow synthesis of some membrane proteins and globular proteins at high levels. J. Mol. Biol. 260, 289-298 (1996).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.