מיקרוסקופיה וכתמים: גרם, כמוסה וכתמים אנדוספור
Overview
מקור: ריאנון מ. לה-ווק1, נטליה מרטין1, אנדרו ג'יי ואן אלסט1, וויקטור ג'יי דיריטה1
1 המחלקה למיקרוביולוגיה וגנטיקה מולקולרית, אוניברסיטת מדינת מישיגן, מזרח לנסינג, מישיגן, ארצות הברית
חיידקים הם מיקרואורגניזמים מגוונים שנמצאים כמעט בכל מקום על פני כדור הארץ. מאפיינים רבים מסייעים להבחין ביניהם, כולל אך לא רק לסוג, צורה וסידור של גראם, ייצור כמוסה ויצירת נבגים. כדי לבחון מאפיינים אלה, ניתן להשתמש במיקרוסקופיה קלה; עם זאת, כמה מאפיינים חיידקיים (למשל גודל, חוסר צבע, תכונות שבירה) מקשה להבחין חיידקים אך ורק עם מיקרוסקופ אור (1, 2). הכתמת חיידקים נחוצה בעת הבחנה בין סוגי חיידקים עם מיקרוסקופיה קלה. שני הסוגים העיקריים של מיקרוסקופים אור הם פשוטים מורכבים. ההבדל העיקרי ביניהם הוא מספר העדשות המשמשות להעצמת האובייקט. למיקרוסקופים פשוטים (לדוגמה זכוכית מגדלת) יש רק עדשה אחת להגדלת אובייקט, בעוד שלמיקרוסקופים מורכבים יש מספר עדשות לשיפור ההגדלה (איור 1). למיקרוסקופים מורכבים יש עדשה אובייקטיבית קרובה לעצם שאוסף אור כדי ליצור תמונה של האובייקט. לאחר מכן זה מוגדל על ידי העין (עדשת העין) אשר מגדיל את התמונה. שילוב העדשה האובייקטיבית והעין מאפשר הגדלה גבוהה יותר מאשר שימוש בעדשה אחת בלבד. בדרך כלל, מיקרוסקופים מורכבים יש עדשות אובייקטיביות מרובות של כוחות שונים כדי לאפשר הגדלה שונה (1, 2). כאן, נדון בהדמיית חיידקים עם כתמי גרם, כתמי כמוסה וכתמי אנדוספור.

איור 1: מיקרוסקופ מורכב טיפוסי. החלקים החשובים ביותר של המיקרוסקופ מסומנים.
כתם גרם, שפותח בשנת 1884 על ידי הבקטריולוג הנס כריסטיאן גרם הדני (1), מבדיל חיידקים על סמך הרכב דופן התא (1, 2, 3, 4). בקצרה, כתם חיידקי ממוקם על שקופית מיקרוסקופ ולאחר מכן חום קבוע כדי לדבוק בתאים לשקופית ולהפוך אותם בקלות רבה יותר של כתמים (1). המדגם הקבוע בחום מוכתם בקריסטל ויולט, והופך את התאים לסגולים. השקופית היא סמוקה עם פתרון יוד, אשר מתקן את קריסטל סגול לקיר התא, ואחריו decolorizer (אלכוהול) לשטוף את כל קריסטל סגול לא קבוע. בשלב האחרון, כתם נגדי, ספרנין, מתווסף לתאי צבע אדומים (איור 2). כתם חיידקים חיובי גרם סגול בשל שכבת פפטידוגליקן עבה אשר לא חדירה בקלות על ידי decolorizer; חיידקים גרם שליליים, עם שכבת הפפטידוגיקאן הדקה יותר שלהם ותכולת שומנים גבוהה יותר, מתפרקים עם המנקה ומוכתמים באדום עם הוספת ספרנין (איור 3). כתמי גרם משמשים להבחנה בין תאים לשני סוגים (גראם-חיובי וסבתא שלילית) והוא שימושי גם כדי להבחין בצורת התא (ספירות או קוצ'י, מוטות, מוטות מעוקלים וספירלות) וסידור (תאים בודדים, זוגות, שרשראות, קבוצות ואשכולות) (1, 3).
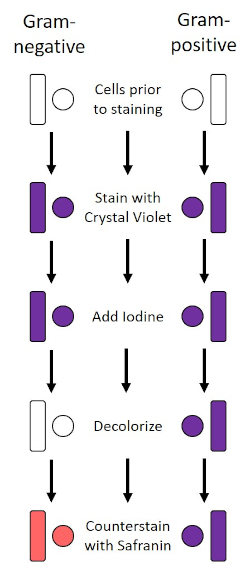
איור 2: שרטוט פרוטוקול הכתמת גרם. העמודה השמאלית מראה כיצד חיידקים גרם שלילי מגיבים בכל שלב של הפרוטוקול. העמודה הימנית מראה כיצד חיידקים חיוביים גרם מגיבים. כמו כן, מוצגות שתי צורות תאי חיידקים טיפוסיות: הבסילי (או המוטות) והקוס (או הכדורים).

איור 3: תוצאות כתמי גרם. כתם גרם של תערובת של סטפילוקוקוס אאורוס (קוצ'י סגול חיובי גרם) ו Escherichia coli (מוטות אדומים גרם שלילי).
חיידקים מסוימים מייצרים שכבה חיצונית צמיגית חוץ-תאית הנקראת כמוסה (3, 5). כמוסות הן מבני מגן עם פונקציות שונות, כולל אך לא מוגבל לדבקות במשטחים וחיידקים אחרים, הגנה מפני ייבוש, והגנה מפני פאגוציטוזיס. כמוסות מורכבות בדרך כלל פוליסכרידים המכילים יותר מ 95% מים, אבל כמה עשוי להכיל polyalcohols ופולימינים (5). בשל הרכבם הלא יוני בעיקר ונטייתם להדוף כתמים, שיטות הכתמה פשוטות אינן פועלות עם כמוסה; במקום זאת, כתמי כמוסה משתמשים בטכניקת הכתמים שלילית שמכתימה את התאים והרקע, ומשאירה את הקפסולה כהילה ברורה סביב התאים (1, 3) (איור 4). כתמי כמוסה כרוכים בהמרצת דגימה חיידקית לכתם חומצי על שקופית מיקרוסקופ. שלא כמו כתמי גרם, כתם החיידק אינו קבוע בחום במהלך כתם כמוסה. תיקון חום יכול לשבש או לייבש את הקפסולה, מה שמוביל לתשלילים כוזבים (5). יתר על כן, תיקון חום יכול לכווץ תאים וכתוצאה מכך סליקה סביב התא אשר יכול להיות בטעות כמוסה, המוביל חיובי שווא (3). הכתם החומצי צובע את רקע השקופית; תוך כדי מעקב עם כתם בסיסי, קריסטל ויולט, צובע את התאים החיידקיים עצמם, משאיר את הקפסולה לא מוכתמת ומופיעה כהילה ברורה בין התאים לרקע השקופית (איור 5). באופן מסורתי, דיו הודו שימש כתם חומצי כי חלקיקים אלה לא יכולים לחדור את הקפסולה. לכן, לא הקפסולה ולא התא מוכתמים בדיו הודו; במקום זאת, הרקע מוכתם. קונגו אדום, ניגרוסין או אאוזין ניתן להשתמש במקום דיו הודו. כתמי כמוסה יכולים לעזור לרופאים לאבחן זיהומים חיידקיים כאשר מסתכלים על תרביות מדגימות המטופלים ומנחים טיפול מתאים למטופל. מחלות נפוצות הנגרמות על ידי חיידקים אנקפסולציה כוללות דלקת ריאות, דלקת קרום המוח, סלמונלוזיס.
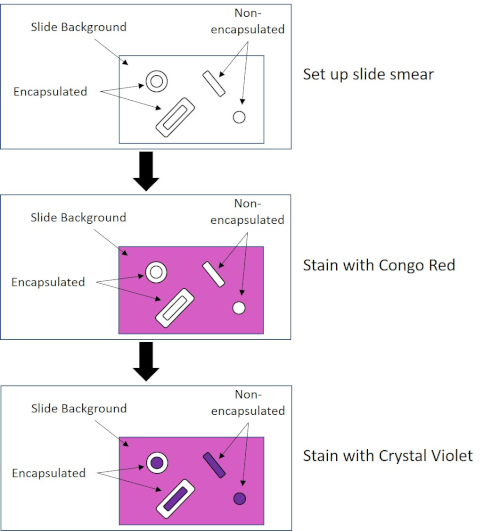
איור 4: שרטוט פרוטוקול הכתמת הקפסולה. החלונית העליונה מציגה את מריחת השקופית לפני כל יישום כתמים. החלונית האמצעית מראה כיצד השקופית והחיידקים נראים אחרי הכתם העיקרי, קונגו אדום. הלוח האחרון מראה כיצד השקופית והחיידקים דואגים לנגד, קריסטל ויולט.
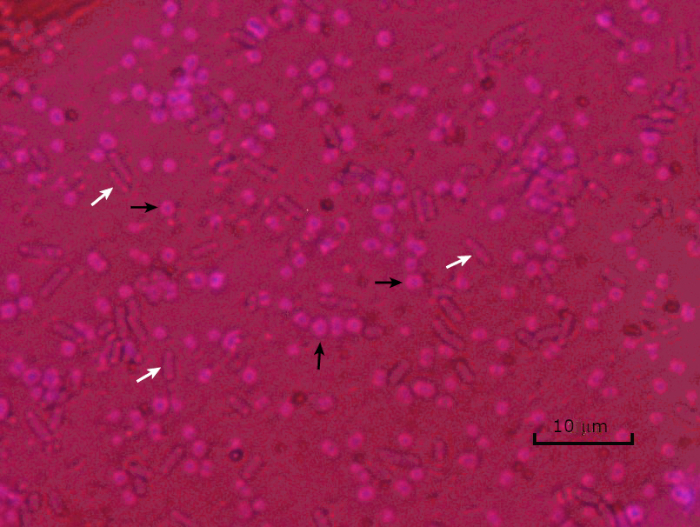
איור 5: תוצאות כתמי כמוסה. כתמי כמוסה של אצינטובקטר באומן (מסומן עם חצים שחורים) ו Escherichia coli ללא אנקפסולציה (מסומן עם חצים לבנים). שימו לב שהרקע כהה ותאי א. באומאני מוכתמים בסגול. הקפסולה סביב תאי A. baumannii ניכרת כהילה, בעוד E. coli אין הילה.
בתנאים שליליים (לדוגמה, הגבלה תזונתית, טמפרטורות קיצוניות או התייבשות), חיידקים מסוימים מייצרים אנדוספורים, מבנים לא פעילים מטבולית העמידים בפני נזק פיזי וכימי (1, 2, 8, 9). אנדוספורים מאפשרים לחיידק לשרוד תנאים קשים על ידי הגנה על החומר הגנטי של התאים; ברגע שהתנאים נוחים לצמיחה, הנבגים נבטים, וצמיחת החיידקים נמשכת. אנדוספורים קשים להכתים עם טכניקות הכתמה סטנדרטיות כי הם בלתי חדיר צבעים המשמשים בדרך כלל להכתמה (1, 9). הטכניקה המשמשת באופן שגרתי להכתמת אנדוספורס היא שיטת שייפר-פולטון (איור 6),המשתמשת בכתם הראשי של מלחיט גרין, כתם מסיס במים שנקשר חלש יחסית לחומר התאי, ולחום, כדי לאפשר לכתם לפרוץ את קליפת המוח של הנבג (איור 7). שלבים אלה צובעים את התאים הגדלים (המכונים תאים וגטטיביים בהקשר של ביולוגיה אנדוספורית), כמו גם אנדוספורים וכל נבגים חופשיים (אלה שכבר אינם נמצאים במעטפת התא לשעבר). תאים וגטטיביים נשטפים במים כדי להסיר את ירוק מלאכית; אנדוספורים שומרים על הכתם עקב חימום ירוק מלאכיט בתוך הנבג. לבסוף, התאים הצמחיים מוכתמים נגד ספרנין כדי לדמיין (איור 8). כתמים עבור אנדוספורים מסייעים להבדיל חיידקים לתוך לשעבר נבג ועבר שאינו נבג, כמו גם קובע אם נבגים נמצאים במדגם אשר, אם קיים, יכול להוביל לזיהום חיידקי על נביטה.
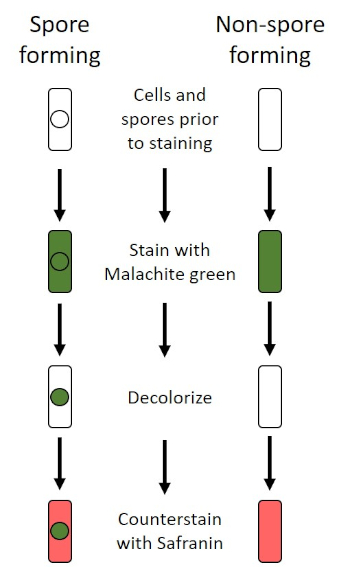
איור 6: שרטוט פרוטוקול הכתמת אנדוספור. העמודה השמאלית מראה כיצד חיידקים היוצרים נבג מגיבים בכל שלב של הפרוטוקול. העמודה הימנית מראה כיצד חיידקים שאינם נבגים מגיבים.

איור 7: דיאגרמה של מבנה אנדוספור. תא חיידקי המכיל אנדוספור עם מבני הנבג השונים המסומנים.
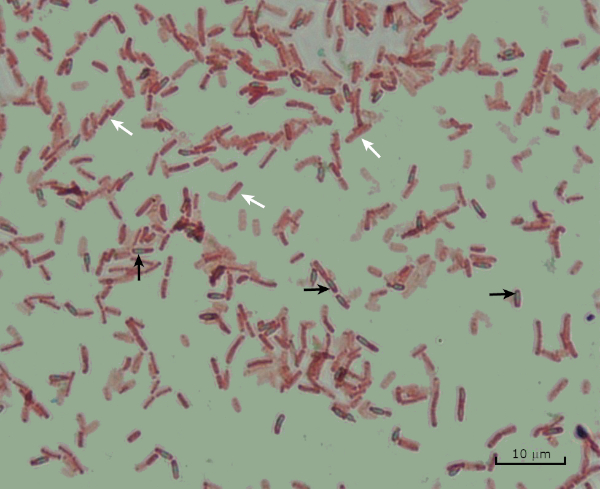
איור 8: תוצאות כתמי אנדוספור. כתם טיפוסי של אנדוספורים של בצילוס subtilis. התאים הצמחיים (המסומנים בחצים הלבנים) מוכתמים באדום, ואילו האנוספורים (המסומנים בחצים השחורים) מוכתמים בירוק.
Procedure
1. כתמי גרם
-
הגדרת
- ללבוש כפפות וחלוק מעבדה לא דליק, כמו צבעים יהיה להכתים ידיים ובגדים.
- מבער בונזן משמש לחימום תיקון החיידקים. השתמש בזהירות בעת עבודה עם להבה; לקשור שיער ארוך.
- ריאגנטים כתם גרם זמין מסחרית ישמשו.
- ניקוי שקופיות מיקרוסקופ עם מגבוני מעבדה.
-
פרוטוקול
- Pipet 10 μL פוספט אגום מלוח או מרק תרבות על שקופית.
- למרוח מושבה חיידקית לתוך הנוזל כדי לייצר שכבה אחידה דקה.
הערה: אין להשתמש בתרביות שגילן עולה על 24 שעות, שכן חיידקים זקנים מדי עשויים להיות שינויים בדופן התא שלהם אשר ישפיעו על תוצאות כתם גרם (1, 4). - מגלשה יבשה לחלוטין.
- לאחר הייבוש, חום לתקן חיידקים על ידי העברת להחליק דרך הלהבה (חיידקים בצד למעלה) 4-5 פעמים.
הערה: אין להחזיק את השקופית בלהבה זמן רב מדי או שאתה יכול לעוות את התאים החיידקיים (1). - עבודה מעל הכיור, להחזיק את רמת השקופית ולהחיל קריסטל סגול של גרם כדי לכסות לחלוטין את החיידקים קבועים בחום, לאפשר לעמוד 45 שניות.
- לשטוף עודף קריסטל ויולט על ידי החזקת השקופית בזווית התזה זרם עדין, עקיף של מים על המגלשה ולתת לו לדרוס את החיידקים המוכתמים. אין להשפריץ מים ישירות על החיידקים.
- מחזיק את רמת השקופית שוב, להחיל פתרון יוד של גרם כדי לכסות לחלוטין את החיידקים מוכתמים, לאפשר לעמוד 45 שניות.
- יש לשטוף עודף יוד כמו בשלב 1.2.6 לעיל.
- תוך החזקת השקופית בזווית, להוסיף כמה טיפות של Decolorizer על השקופית, לתת לו לטפטף למטה על החיידקים המוכתמים רק עד הריצה ברורה; בדרך כלל, כ-5 שניות. יש לשטוף מיד במים כמו בשלב 1.2.6 לעיל.
הערה: זהו צעד קריטי בפרוטוקול. מתן אפשרות לדקולור לטפטף זמן רב מדי או לא מספיק זמן תגרום להכתמת גרם כוזבת (4). - מחזיק את רמת השקופית שוב, להחיל ספרנין של גרם כדי לכסות לחלוטין את החיידקים, לאפשר לעמוד 45 שניות.
- יש לשטוף עודף ספרנין כמו בשלב 1.2.6 לעיל.
- כתם, לא לשפשף, עודף מים מן השקופית באמצעות מגבות נייר.
- בדוק שקופית על המיקרוסקופ באמצעות טבילת שמן עם מטרה 100X.
-
תוצאות וניתוח נתונים
- חיידקים חיוביים לגרם יכתימו סגול.
- חיידקים גרם שלילי יכתימו אדום.
- צורה (קוצ'י, בסילי, מוטות מעוקלים, ספירלות) של חיידקים תהיה גלויה.
- סידור של תאים חיידקיים (תאים בודדים, תאים משויכים, שרשראות של תאים, אשכולות, קיבוצים) יהיה גלוי.
2. כתמי כמוסה
-
הגדרת
- ללבוש כפפות וחלוק מעבדה כמו צבעים מכתימים ידיים ובגדים.
- להכנת 1% תמיסת קריסטל ויולט, יש לערבב 0.25 גרם קריסטל ויולט עם 25 מ"ל מים מזוקקים עד להמסה.
- כדי להכין 1% פתרון אדום קונגו, לערבב 0.25 גרם קונגו אדום עם 25 מ"ל מים מזוקקים עד מומס.
- נקה שקופיות עם מגבוני מעבדה.
-
פרוטוקול
- מקם 10 μL קונגו אדום על שקופית.
- בעזרת קצה צינור, למרוח מושבה חיידקית לתוך הצבע כדי לייצר שכבה אחידה דקה.
- מגלשה יבשה לחלוטין עם תערובת צבע/תא, 5-7 דקות.
הערה: אין לחמם תיקון כמו חימום יכול להתייבש או לעוות את הקפסולה. - להציף את הכתם עם 1% קריסטל ויולט במשך דקה אחת.
- שטפו כתם עודף על ידי החזקת המגלשה בזווית והתזה של זרם מים עדין ועקיף על המגלשה ונתנו לו לדרוס את החיידקים המוכתמים. אין להשפריץ מים ישירות על החיידקים.
- החזק את המגלשה בזווית של 45 מעלות עד לייבוש אוויר מוחלט.
- בחן מריחה על המיקרוסקופ תחת טבילת שמן עם מטרה של פי 100.
-
תוצאות וניתוח נתונים
- תאים חיידקיים יכתימו סגול.
- רקע השקופית יכתים כהה.
- כמוסות יהיו הילה ברורה סביב תאים על רקע כהה.
3. כתמי אנדוספור (שיטת שפר-פולטון)
-
הגדרת
- ללבוש כפפות וחלוק מעבדה לא דליק כדי להגן על הידיים והבגדים מפני צבעים ולהבה.
- מבער בונזן משמש לחימום תיקון החיידקים. השתמש בזהירות בעת עבודה עם להבה; לקשור שיער ארוך.
- להכנת 0.5% תמיסת מלחית ירוקה, מערבבים 0.125 גרם מלחית ירוק עם 25 מ"ל מים מזוקקים עד להמסה.
- השתמש בפתרון ריאגנט ספרנין זמין מסחרית של גראם.
- נקה שקופיות עם מגבוני מעבדה.
-
פרוטוקול
- Pipet 10 μl פוספט אגירה מלוחה (PBS) או מרק תרבות על שקופית.
- באמצעות טכניקה אספטית, למרוח מושבה חיידקית לתוך הנוזל כדי לייצר שכבה אחידה דקה.
הערה: אנדוספורים בדרך כלל לא נוצרים בתאים צעירים, ולכן התרבות מומלץ להיות בין 18 ל 36 שעות (9). - מגלשה יבשה לחלוטין.
- תיקון חום על ידי העברת שקופית (חיידקים בצד למעלה) דרך להבה 4-5 פעמים.
- כדי לעזור להכיל את הצבע, מניחים פיסת נייר עדשה (לחתוך כדי להתאים את מריחת החיידקים) על החום קבוע מריחה.
- נייר עדשה רווי עם תמיסת מלכיט ירוקה.
- מניחים להחליק על מים רותחים על צלחת חמה, ומחליקים אדים במשך 5 דקות, שמירה על נייר העדשה לח על ידי הוספת עוד צבע טיפה בכל פעם לפי הצורך.
הערה: הימנעו מהתחממות יתר וייבוש של תמיסת הצבע. - הסר שקופית מהכוס, הסר והשלך נייר עדשות, אפשר לגלישה להתקרר 2 דקות.
- מחזיקים שקופית בזווית, שוטפים היטב על ידי התזת זרם מים עדין ועקיף על מגלשה, ומאפשרים לו להתנקז מעל מריחה.
- החזקת רמת שקופית, מריחת שיטפון עם ספרנין, לאפשר לעמוד דקה אחת.
- יש לשטוף עודף ספרנין כמו בשלב 3.2.9 לעיל.
- אפשר לייבש אוויר.
- בדוק שקופית על מיקרוסקופ תחת טבילת שמן עם מטרה 100X.
-
תוצאות וניתוח נתונים
- נבגים יכתימו ירוקים.
- תאים צמחיים יכתימו באדום.
- תאים צמחיים מסוימים יכילו נבגים; התאים יכתימו באדום, בעוד האנוספורים יכתימו בירוק.
Application and Summary
לחיידקים מאפיינים ייחודיים שיכולים לסייע בזיהוי שלהם. חלק ממאפיינים אלה ניתן לראות על ידי כתמים ומיקרוסקופיה קלה. שלוש טכניקות הכתמה שימושיות לצפייה במאפיינים אלה הן כתמי גרם, כתמי כמוסה וכתמים אנדוספור. כל טכניקה מזהה מאפיינים שונים של חיידקים וניתן להשתמש בה כדי לסייע לרופאים להמליץ על טיפולים לחולים, לזהות מזהמים פוטנציאליים בדגימות או במוצרי מזון, ולאמת סטריליות דגימה.
References
- Black, J. G. Microbiology Principles and Explorations, 4th edition. Prentice-Hall, Inc., Upper Saddle River, New Jersey. (1999)
- Madigan, M. T. and J. M. Martinko. Brock Biology of Microorganisms, 11th edition. Pearson Prentice Hall, Upper Saddle River, New Jersey. (2006).
- Leboffe, M. J., and B. E. Pierce. A Photographic Atlas for the Microbiology Laboratory, 2nd ed. Morton Publishing Company, Englewood, Colorado. (1996).
- Smith, A. C. and M. A. Hussey. Gram stain protocols. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.2886. (2005).
- Hughes, R. B. and A. C. Smith. Capsule Stain Protocols Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3041. (2007).
- Anthony, E. E. Jr. A note on capsule staining. Science 73(1890):319-320 (1931).
- Finegold, S. M., W. J. Martin, and E. G. Scott. Bailey and Scott's Diagnostic Microbiology, 5th edition. The C. V. Mosby Company, St. Louis, Missouri. (1978).
- Gerhardt, P., R. G. E. Murray, W. A. Wood, and N. R. Krieg. Methods for general and molecular bacteriology. ASM Press, Washington, DC. (1994).
- Hussey, M. A. and A. Zayaitz. Endospore Stain Protocol. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3112. (2007).
Tags
Skip to...
Videos from this collection:

Now Playing
מיקרוסקופיה וכתמים: גרם, כמוסה וכתמים אנדוספור
Microbiology
362.5K Views

יצירת טור וינוגרדסקי: שיטה להעשרת המינים המיקרוביאליים בדוגמת משקעים
Microbiology
128.2K Views

דילול סדרתי ו ציפוי: ספירה מיקרוביאלית
Microbiology
314.0K Views

תרביות העשרה: מיקרואורובים אירוביים ואנאירוביים פולחניים על מדיות סלקטיביות ודיפרנציאליות
Microbiology
131.7K Views

תרביות טהורות ו ציפוי פסים: בידוד מושבות חיידקיות בודדות מדגם מעורב
Microbiology
165.7K Views

ריצוף rRNA 16S: טכניקה מבוססת PCR לזיהוי מינים חיידקיים
Microbiology
188.0K Views

עקומות צמיחה: יצירת עקומות צמיחה באמצעות יחידות יוצרות מושבה ומדידות צפיפות אופטית
Microbiology
293.1K Views

בדיקת רגישות אנטיביוטית: בדיקות אפסילומטר לקביעת ערכי המיקרופון של שתי אנטיביוטיקות והערכה של סינרגיה אנטיביוטית
Microbiology
93.4K Views

פלאק אסאי: שיטה לקביעת טיטר ויראלי כיחידות יוצרות פלאק (PFU)
Microbiology
185.7K Views

טרנספורמציה של תאי E. coli באמצעות הליך סידן כלוריד מותאם
Microbiology
86.3K Views

הטיות: שיטה להעברת עמידות אמפיצ'ין מתורם לנמען E. coli
Microbiology
38.1K Views

טרנסדוקציה של פאג': שיטה להעברת עמידות לאמפיצ'ילין מתורם לנמען E. coli
Microbiology
28.9K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved