טכניקות מבוססות אימונופרציפיטציה: טיהור חלבונים אנדוגניים באמצעות חרוזי אגרוז
Overview
מקור: סוזנה סי. שיסלר1, טוניה ג'יי ווב1
המחלקה למיקרוביולוגיה ואימפונולוגיה, אוניברסיטת מרילנד, בולטימור, MD 21201
אימונופרציפיטציה (IP, הידועה גם בשם "משיכה למטה" היא טכניקה נפוצה שיש לה יישומים במגוון תחומים. הוא נוצר לראשונה בשנת 1984, והוא שופר בשנת 1988 (1, 2). המטרה הבסיסית של IP היא טיהור ובידוד של חלבון מסוים באמצעות נוגדן נגד חלבון זה. המילה "אימונו" מתייחסת לשימוש בנוגדן בעוד המילה "משקעים" מתייחסת למשיכת חומר מסוים מפתרון. חלבון המטרה עשוי להיות אנדוגני או רקומביננטי. רוב החלבונים רקומביננטיים יש תג epitope (כלומר myc או דגל) מחובר אליהם כדי לפשט את הטיהור הבא. בדרך כלל, קל יותר לייעל IP חלבון רקומביננטי כי הנוגדנים נגד תגי אפיטופ רקומביננטי הם חזקים מאוד ויעילים. נוגדנים נגד חלבונים אנדוגניים יש יעילות משתנה מאוד - מה שהופך את זה הרבה יותר קשה לייעל IPs אלה. צעד הכרחי לאחר אימונופרציפיטציה הוא אימות של טיהור. החלבון המבודד נפתר באמצעות SDS-PAGE ולאחר מכן נבדק לטוהר על ידי כתמים מערביים (איור 1). שליטה חשובה היא שימוש בנוגדן אחר במהלך כתם המערב כדי לאמת משיכה של החלבון הנכון. השילוב של IP עם טכניקות עוקבות הוא כלי ניתוח רב עוצמה. המטרה לאחר הטיהור עשויה להיות אפיון החלבון עצמו על ידי NMR, ספקטרומטריית מסה ובוחן, או ניתוח של השותפים לאינטראקציה של החלבון (כלומר חלבון, DNA, RNA) (3, 4, 5).
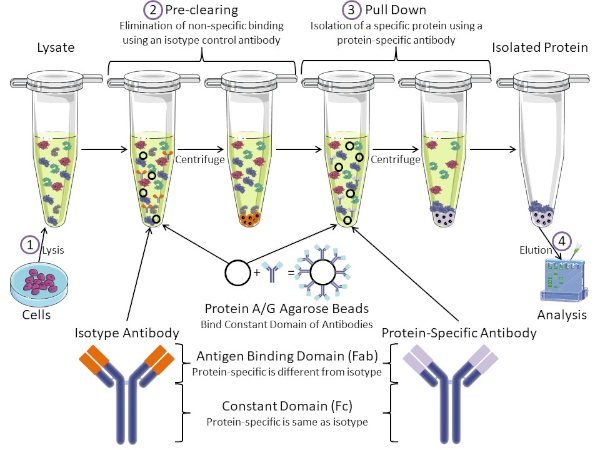
איור 1: סקירה כללית של הליך האימונופרנציה. אימונופרציפיטציה היא בידוד של חלבון מסוים באמצעות נוגדן. לאחר ייצור של ליסאט מהתאים, ישנם שני שלבים עיקריים- ניקוי מראש ומשיכה למטה. במהלך שלב טרום ניקוי, תאי-lysates מנוקים מראש של חלבונים שנקשרים נוגדנים שאינם במיוחד באמצעות נוגדן בקרת איזוטיפ. בצעד למטה, חלבון היעד נמשך למטה באמצעות נוגדן ספציפי לחלבון. לאחר מכן מנתחים את החלבון המבודד על ידי כתם מערבי. נוגדני איזוטיפ ונוגדנים ספציפיים לחלבון הם בעלי אותו תחום קבוע, אך תחומים שונים של כריכת אנטיגן. מרכיב מרכזי בפרוטוקול זה הוא חרוזי אגרוז חלבון A/G הקושרים את התחום הקבוע של נוגדנים - ומאפשרים אימונופרציפיטציה של חלבון היעד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
נוגדנים הם המרכיב העיקרי של אימונופרציפיטציה המבדילה אותו מצורות אחרות של טיהור חלבונים (כלומר טיהור עמודת זיקה לניקל). נוגדנים הם מולקולות המיוצרות על ידי תאי B שיכולות לזהות אפיטופים ספציפיים של חלבון. לנוגדנים יש שני תחומים: קבוע (Fc) ואנטיגן מחייב (Fab) (איור 1). התחום הקבוע מזהה את סוג הנוגדן ומכתיב פונקציה ב vivo. בדרך כלל, התחומים הקבועים של נוגדנים המשמשים IP הם עכבר, חולדה, או ארנב IgG. החלק המחייב של האנטיגן בנוגדן מזהה אפיטופ ספציפי של חלבון מסוים. נוגדנים יכולים לזהות אפיטופים על חלבונים מקופלים שאולי לא קיימים כאשר החלבון מושחת ולהיפך. לכן, הזמינות של האפיטופ תלויה קיפול חלבון - זיהוי גורם חשוב שיש לקחת בחשבון בעת בחירת נוגדנים ותנאים עבור IP.
הן למערכות פרוקריוטיות והן למערכות אאוקריוטיות יש חלבונים מחייבי נוגדנים. במערכות אאוקריוטיות, המטרה היא הגנה חיסונית מפני חיידקים בעוד במערכות פרוקריוטיות, המטרה היא הגנה מפני המערכת החיסונית. חלבונים מחייבי נוגדנים משפיעים על מתודולוגיית הקניין הרוחני בשתי דרכים. ראשית, יש צורך בצעד הכרחי לפני הסליקה (איור 1) כדי לפטור את הריסאט מחלבונים שקושרים נוגדנים - ובכך להפחית כריכה לא ספציפית במוצר הסופי. שלב זה משתמש בנוגדן איזוטיפ בעל אותו תחום קבוע כמו תחום מחייב נוגדנים שונה מאשר הנוגדן הספציפי לחלבון שלך. חלבונים מחייבי נוגדנים חיידקיים הם המרכיב המרכזי השני בשיטה זו. לאחר שהנוגדן הספציפי לחלבון קושר את חלבון המטרה, יש להוריד את קומפלקס החלבון (איור 1). חלבונים A, G ו- L הם חלבונים חיידקיים הקושרים את התחום הקבוע של נוגדנים. בעוד חיידקים להשתמש בזה כדי לחתור תחת המערכת החיסונית, החוקרים בחרו יחד מערכת זו לטיהור נוגדנים קל, והוא משמש הן במהלך השלבים לפני ניקוי ומשיכה למטה. חלבונים אלה יש זיקה מחייבת שונה עבור מינים שונים ותת-סוגים שונים של תחום קבוע - גורם נוסף שיש לקחת בחשבון בעת בחירת תנאים עבור IP. חברות רבות מוכרות חרוזי חלבון A/G המסומנים באגרוז (איור 1), עמודות ספין מראש או שרבפים להכנת עמודות. באופן כללי, חרוזים ועמודות ספין משמשים לגדלי מדגם קטנים יותר בעוד שריפים משמשים לטיהור בתפזורת.
בתרגיל מעבדה זה, אנו מדגימים כיצד לטהר את החלבון האנדוגני C-myc, מתימושיטים מורינים ראשוניים, באמצעות חרוזי חלבון A/G Plus agarose המבוססים על טכניקת אימונופרציפיטציה בסיסית. הפרוטוקול מתחיל מהכנת ליסאט התא ומסתיים באימות של משיכת חלבון מוצלחת למטה באמצעות ניתוח כתם מערבי.
Procedure
1. אימונופרציפיטציה באמצעות חרוזי אגרוז A/G PLUS של חלבון A/G PLUS
הכנת ליסאט תא
- צנטריפוגה 108 תימוקיטים במיקרוצנטריפוגה ב-13,000 סל"ד למשך 3 דקות ומסירים את הסופר-נט.
הערה: מספר התא ישתנה בהתאם לרמות הביטוי של החלבון הרצוי וסוג התא הנבחר. - השהה מחדש את התאים במאגר תמ זוזה μL 500 μL RIPA עם PMSF.
- לשבש תאים באמצעות כמה פולסים מהירים עם מערבולת ולאחר מכן לשאוף את lysate כמה פעמים עם מחט 25 G מחובר מזרק.
הערה: הימנע מיצירת בועות. השתמש במחט גדולה יותר כגון מחט 21G עבור סוגי תאים גדולים יותר. - לדגור על התא ליסייט על קרח במשך 10 דקות.
- צנטריפוגה ליסאט ב 13,000 סל"ד במשך 15 דקות ב 4°C.
- מעבירים את הסופר-נט לצינור מיקרוצנטריפוגה טרי ומסומן.
ניקוי מקדים
- הוסף 20 חרוזים אגרוז חלבון μL A/G PLUS ו 1 מיקרוגרם של נוגדן בקרת איזוטיפ (כאן, עכבר IgG1 איזוטיפ בקרת נוגדן משמש), כדי ליסאט.
הערה: הבחירה בנוגדן איזוטיפ בשימוש תהיה תלויה בנוגדן הספציפי לחלבון המשמש בהמשך במדרגת המשיכה כלפי מטה. - יש לדגור על תערובת ליסאט על סיבוב צנטריפוגות בחדר הקר (4 מעלות צלזיוס) למשך 30 דקות.
- צנטריפוגה הדגימה ב 3200 סל"ד עבור 30 s ב 4°C.
- מעבירים את הסופר-נט המנוקה מראש לצינור מיקרוצנטריפוגה טרי, מתויג, 1.5 מ"ל. להשליך את הכדור.
קביעת ריכוז חלבונים
- לקבוע את ריכוז החלבון של ליסייט התא על ידי ביצוע ברדפורד אסאי.
- Aliquot 1000 μL ברדפורד ריאגנט לתוך 7 צינורות microcentrifuge.
- הוסף את הכמויות הבאות של תקן חלבון BSA (2 מ"ג / מ"ל) לתוך 6 של הצינורות (טבלה 1).
| מספר צינור | נפח BSA (μL) (2 מ"ג/מ"ל) | ריכוז חלבונים (מיקרוגרם/מיקרו-אל) |
| 1 | 0 | 0 |
| 2 | 1 | 2 |
| 3 | 2 | 4 |
| 4 | 3 | 6 |
| 5 | 4 | 8 |
| 6 | 5 | 10 |
טבלה 1: כמויות סטנדרטיות של חלבון BSA
- בצינור7, להוסיף 1 μL של ליסייט פינה מראש.
הערה: כדי להבטיח שריכוז המדגם נמצא בטווח זיהוי ה- assay, להכין ולנתח דילול ליסאט 1:2 או 1:5 גם כן. - מניחים 200 μL מכל אחד מ-7 הצינורות לבארות בודדות של צלחת שטוחה עם תחתית, 96 בארות שחוזרת על כל דגימה במשולש.
- קרא לוחית על קורא לוחות ב 595 ננומטר.
- ליצור את העקומה הסטנדרטית ב- excel ולחשב את ריכוז החלבון של ליסאט שפונה מראש.
משוך כלפי מטה
- סמן שני צינורות מיקרוצנטריפוגה טריים בגודל 1.5 מ"ל- אחד כ'בקרה' והשני כ'בדיקה', שבדוגמה זו הוא c-myc.
- מניחים 500 מיקרוגרם של ליסאט פינה מראש לתוך כל אחד הצינורות האלה.
הערה: כמות החלבון המשמשת כאן תהיה תלויה בכמות החלבון הרצויה לטיהור. - העלה את הנפח הכולל עבור כל צינור עד 500 μL באמצעות מאגר תמן.
- הוסף 2 מיקרוגרם של נוגדן אנטי-C-myc למבחנה קבוצה ו 2 מיקרוגרם עכבר IgG1 איזוטיפ של שליטה לקבוצת הביקורת.
הערה: כמות הנוגדן תהיה תלויה ביעילות הנוגדנים ובכמות חלבון היעד. - לדגור על הצינורות על סיבוב בחדר הקר (4 מעלות צלזיוס) במשך 2 שעות.
- הוסיפו 20 חרוזים אגרוז A/G של חלבון μL PLUS לכל צינור.
הערה: מומלץ להשתמש טיפים pipette עם הקצה מנותק כדי למנוע נזק חרוזים. - יש לדגור על סיבוב בחדר קר (4 מעלות צלזיוס) למשך הלילה.
הערה: בהתאם לחלבון היעד ויעילות הנוגדנים, שלב זה יכול להשתנות בין שעה אחת ללילה. - צנטריפוגות הצינורות ב 3200 סל"ד עבור ב 30 s 4 מעלות צלזיוס כדי למשוך את החרוזים.
- שאפו את סופר-טבעי מכל צינור.
הערה: חלבון המטרה קשור כעת חרוזים. - לשטוף את החרוזים פעמיים באמצעות 500 μL 1X PBS של Dulbecco.
- צנטריפוגות הצינורות ב 3200 סל"ד עבור ב 30 s 4°C.
הערה: לכביסה מחמירה יותר, השתמש במאגרים מחמירים יותר, כגון RIPA. - שאף את החיץ מכל צינור. בעזרת טיפים לטעינת ג'ל, הסירו כל שאריות חוצץ מחרוזים ושמרו את החרוזים על הקרח כדי לחמוק מהחלבון.
הערה: בדוגמה זו, החלבון הוא eluted לתוך SDS-PAGE פועל חוצץ על ידי רותחים החרוזים, לניתוח כתם מערבי. גישה זו מתאימה לאימות תוצאות IP או לבחינת אינטראקציות חלבון-חלבון. עבור יישומים אחרים במורד הזרם, כגון טיהור חלבונים לניתוח מבני או אנזימטי, מערכות מתוחכמות יותר, כגון תגי אפיטופ (תג דגל או תג תפטיר) משמשות למניעת החמקה של הנוגדן עם חלבון מעניין.
2. אימות IP באמצעות ניתוח כתם מערבי
אלקטרופורזה SDS-PAGE:
- השהה מחדש חרוזים בצבע טעינה של 20 μL SDS-PAGE המכיל β-מרקפטו-אתנול.
- מרתיחים את הדגימות ב 95 °C (5 דקות).
- צנטריפוגות החרוזים ב 13,000 סל"ד עבור 10 s בטמפרטורת החדר.
- באמצעות טיפים לטעינת ג'ל, בזהירות pipet את הדגימות שהתקבלו מן החרוזים לטעון אותם לתוך בארות של 4-15% ג'ל SDS-PAGE הדרגתי.
- בנוסף לדגימות, לטעון נתיב עם סולם חלבון, כמו גם נתיב עם ליסאט פינה מראש לשמש בקרת טעינה.
- יש לרוץ ב-100 V עד שהצבע הקדמי יגיע לתחתית הג'ל (~1h).
ניתוח כתם מערבי:
- הפוך כריך כתם מערבי, להבטיח כי קרום PVDF הוא בין ג'ל קתודה אדומה.
- העברה עבור שעה ב 100 V.
- מניחים את הממברנה במאגר חסימה של 5 מ"ל בטמפרטורת החדר למשך שעה על רוקר בסביבה נמוכה, כדי לחסום את אתרי כריכת החלבון הלא ספציפיים.
הערה: ייתכן שיהיה צורך להגדיל את נפחי חסימת המאגר, הנוגדן העיקרי, הנוגדן המשני והכבסות עבור כתמים גדולים יותר. - לדגור את כתם עם 5 מ"ל נוגדן אנטי C-myc במאגר חסימה לילה ב 4°C על רוקר בסביבה נמוכה.
הערה: הנוגדן המשמש כאן צריך להיות שונה מזה המשמש בשלב המשיכה כלפי מטה. - לשטוף את כתם 3-6 פעמים באמצעות 5 מ"ל TBST עם כל לשטוף להיות 5 דקות בטמפרטורת החדר על רוקר בסביבה נמוכה.
- לדגור את כתם עם HRP מתויג נגד ארנב שרשרת נוגדן משני בחסימת חוצץ, עבור 1 שעה בטמפרטורת החדר על רוקר בסביבה נמוכה.
הערה: הבחירה בנוגדן משני תהיה תלויה בנוגדן העיקרי המשמש כתם מערבי. בנוסף, שרשרת אור ספציפי משני משמש בפרוטוקול כי חלבון היעד קרוב במשקל מולקולרי לשרשרת הכבדה של הנוגדן. אם חלבון היעד קרוב ל-50kDa, השתמש בשרשרת אור ספציפית משנית. אם חלבון היעד קרוב של 25kDa, להשתמש ושרשרת כבדה ספציפי משני. - לשטוף את כתם 3-6 פעמים באמצעות 5 מ"ל TBST עם כל לשטוף להיות 5 דקות בטמפרטורת החדר על רוקר בסביבה נמוכה.
- הסר נוזל מן כתם טיפה קצה של כתם על מגבוני מעבדה כדי להסיר נוזל עודף.
- לכסות כתם עם 1x זמילומינסנט זיהוי ריאגנט' ודגרה במשך 1 דקות.
הערה: השלבים הבאים צריכים להיעשות ברצף מהיר מכיוון שמריג האיתור הוא רגיש לאור וזמן. - יש לטפטפ את קצה הכתם על מגבוני מעבדה כדי להסיר ריאגנט לזיהוי עודף.
- הנח את הכתם על משטח ההדמיה של מגש Imager.
הערה: כתמים Chemiluminescent ניתן גם לדמיין באמצעות סרט. - תמונה המשתמשתב'תוכנית הכימותרפיה' כדי ללכוד נקודות זמן מרובות מ- 10 ל - 5 דקות.
הערה: הזמן האופטימלי עשוי להשתנות בהתבסס על כמות החלבון ואיכות הנוגדן. - בחר תמונה עם ניראות להקה אופטימלית ולאחר מכן יצא תמונה זו.
- לפני הזזת הכתם, צלם את הכתם באמצעות התמונה, כדי ללכוד את מיקום הסולם. לאחר מכן, לייצא את התמונה גם כן.
- באמצעות תוכנת הכנת שקופיות (כגון PowerPoint), יישר את הרצועות ותמונות הסולם כדי ליצור תמונה בודדת.
Results
תוצאות ההליך המפורט לעיל מוצגות באיור 2. משמאל לימין, הנתיבים מכילים את קבוצת הביקורת (איזוטיפ), את קבוצת הבדיקה (c-myc), את ליסאט שפונה מראש (ליסאט) ואת סולם המשקל המולקולרי (סולם). רצועות הסולם של 25 ו-75 kDa מסומנות. שתי הרצועות הבולטות ב- ~ 25 kDa ו - 50 kDa הן השרשרת הקלה והכבדה של הנוגדן המחייב, בהתאמה והן אינן ספציפיות ל- IP או לדגימות. חלבון c-myc אשר פועל סביב 67kDa על כתמים מערביים והוא נראה בדרך כלל ממש מתחת 75 kDa סולם הלהקה. בכתם זה, רצועת C-myc נראית בנתיב השני, אך נעדרת בנתיב הראשון, מה שמצביע על כך שנוגדן ה- IP משך בהצלחה את C-myc. אין רצועה גלויה בנתיב ליסאט שפונה מראש, מה שמרמז על כך שלחלבון זה יש רמות ביטוי אנדוגניות נמוכות.
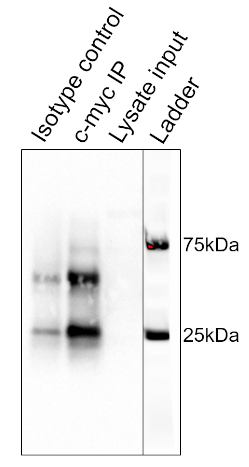
איור 2: תוצאות ניתוח כתם מערבי, המשמש להערכת טיהור c-myc על ידי אימונופרציפיטציה. רצועה ב 67 kDa, המקביל C-myc, גלוי בנתיב אנטי C-myc, אבל לא נתיב בקרת איזוטיפ. שים לב שרמות ה- c-myc לא היו גבוהות מספיק כדי להיות דמיינו בנתיב הליסייט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Application and Summary
בקיצור, אימונופרציפיטציה היא בידוד של חלבון מסוים באמצעות נוגדן. בדוגמה זו, התוצאות של אימונופרציפיטציה נותחו על ידי כתם מערבי כדי להעריך את הטוהר. החלבון המבודד יכול לשמש במספר יישומים לאחר מכן כולל: NMR למבנה חלבון, ספקטרומטריית מסה לרצף חומצות אמינו, או בדיקות במבחנה לאפיון אנזימטי. IPs יכול גם לאפיין את השותפים אינטראקציה של חלבונים. לדוגמה, לאחר בידוד, DNA או RNA יכול להיות מבודד לרצף. אימונופרציפיטציות משותפות מעריכות אינטראקציות בין חלבון לחלבון. כאשר חלבון היעד נשלף כלפי מטה במהלך IP, חלבונים אינטראקציה ניתן גם למשוך למטה. שותפים אינטראקציה אלה ניתן להעריך על ידי ספקטרומטריית מסה כתם מערבי. אימונופרציפיטציה היא טכניקה רבת עוצמה ללימוד ביולוגיה של חלבונים.
References
- Olliver, C. L. and Boyd, C. D. (1984). Immunoprecipitation of In Vitro Translation Products with Protein A Bound to Sepharose. In J. M. Walker (eds), Nucleic Acids. Methods in Molecular Biology (pp. 157-160). New Jersey: Humana Press.
- Thurston, C. F. and Henley, L. F. (1988). Direct Immunoprecipitation of Protein. In J. M. Walker (eds), New Protein Techniques. Methods in Molecular Biology (pp. 149-158). New Jersey: Humana Press.
- Anderson, N. G. (1998). Co-immunoprecipitation: Identification of Interacting Proteins. In R. A. Clegg (eds), Protein Targeting Protocols.Methods in Molecular Biology (pp. 35-45). New Jersey: Humana Press.
- Jackson, D. I. and Dickson, C. (1999). Protein Techniques: Immunoprecipitation, In Vitro Kinase Assays, and Western Blotting. In P.T. Sharpe and I. Mason (eds), Molecular Embryology. Methods in Molecular Biology (pp. 699-708). New Jersey: Humana Press.
- Trieu, E. P. and Targoff, I. N. (2015). Immunoprecipitation: Western Blot for Proteins of Low Abundance. In B. Kurien and R. Scofield (eds), Western Blotting. Methods in Molecular Biology (pp. 327-342). New York, NY: Humana Press.
Tags
Skip to...
Videos from this collection:

Now Playing
טכניקות מבוססות אימונופרציפיטציה: טיהור חלבונים אנדוגניים באמצעות חרוזי אגרוז
Immunology
87.8K Views

ציטומטריית זרימה ומיון תאים המופעלים על-ידי פלואורסצנטיות (FACS): בידוד של לימפוציטים מסוג Splenic B
Immunology
93.1K Views

מיון תאים המופעל מגנטי (MACS): בידוד של לימפוציטים T תימיים
Immunology
22.9K Views

אליסה אסייס: עקיפה, כריך ותחרותי
Immunology
238.9K Views

אליספוט אסאי: זיהוי של IFN-γ הפרשת טחול
Immunology
28.5K Views

אימונוהיסטוכימיה ואימונוציטוכימיה: הדמיית רקמות באמצעות מיקרוסקופיה קלה
Immunology
79.1K Views

יצירת נוגדנים: ייצור נוגדנים חד שבטיים באמצעות היברידיות
Immunology
43.6K Views

מיקרוסקופיה חיסונית: כתמי אימונופלואורסצנטיות של מקטעי רקמות משובצים בפרפין
Immunology
53.9K Views

מיקרוסקופיית פלואורסצנטיות קונפוקלית: טכניקה לקביעת לוקליזציה של חלבונים בפיברובלסטים של עכברים
Immunology
43.3K Views

ניתוח מחזור התא: הערכת התפשטות תאי CD4 ו- CD8 T לאחר גירוי באמצעות כתמי CFSE וציטומטריית זרימה
Immunology
24.3K Views

העברת תאים מאמצת: הצגת טחול עכבר תורם לעכבר מארח והערכה של הצלחה באמצעות FACS
Immunology
22.5K Views

ת לבדיקת מוות בתא: כרום שחרר את ההסתה של היכולת הציטוטוקסית
Immunology
151.4K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved