Method Article
שיטה מדרגית ומבוססת תאים להערכה פונקציונלית של גרסאות Ube3a
In This Article
Summary
שיטה פשוטה ומדרגית פותחה כדי להעריך את המשמעות התפקודית של גרסאות missense ב- Ube3a, גן שאובדן ורווח תפקודו קשורים הן לתסמונת אנג'למן והן להפרעת ספקטרום האוטיזם.
Abstract
השימוש המוגבר בריצוף ברפואה זיהה מיליוני גרסאות קידוד בגנום האנושי. רבים מהווריאנטים האלה מתרחשים בגנים הקשורים להפרעות נוירו-התפתחותיות, אך המשמעות התפקודית של הרוב המכריע של הווריאנטים עדיין לא ידועה. הפרוטוקול הנוכחי מתאר את המחקר של וריאנטים עבור Ube3a, גן המקודד E3 יוביקוויטין ליגאז הקשור הן לאוטיזם והן לתסמונת אנג'למן. שכפול או משולש של Ube3a קשור מאוד לאוטיזם, ואילו מחיקתו גורמת לתסמונת אנג'למן. לפיכך, הבנת הערכיות של שינויים בפעילות החלבון UBE3A חשובה לתוצאות קליניות. כאן מתוארת שיטה מהירה, מבוססת תאים, המשלבת גרסאות Ube3a עם כתב מסלול Wnt. בדיקה פשוטה זו ניתנת להרחבה וניתן להשתמש בה כדי לקבוע את הערכיות ואת גודל השינויים בפעילות בכל גרסה של Ube3a . יתר על כן, המתקן של שיטה זו מאפשר יצירת שפע של מידע מבנה-פונקציה, אשר ניתן להשתמש בו כדי לקבל תובנות עמוקות על מנגנונים אנזימטיים של UBE3A.
Introduction
ההתקדמות הטכנולוגית האחרונה הפכה את ריצוף האקסומים והגנומים לשגרתי במסגרות קליניות 1,2. זה הוביל לגילוי של מספר רב של וריאנטים גנטיים, כולל מיליוני וריאנטים של מיסנס שבדרך כלל משנים חומצת אמינו אחת בחלבון. הבנת המשמעות הפונקציונלית של וריאנטים אלה נותרה אתגר, ורק לחלק קטן (~2%) מהווריאנטים הידועים של מיסנס יש פרשנות קלינית 1,3.
דוגמה בולטת לבעיה זו היא Ube3a, גן המקודד יוביקוויטין ליגאז E3 המכוון לחלבוני סובסטרט לפירוק4. Ube3a שוכן בתוך כרומוזום 15q11-13 ומתבטא אך ורק באלל 5,6,7 שעבר בירושה אימהית. תצפיות מהגנטיקה של מחלות מצביעות על כך שפעילות לא מספקת או מוגזמת של האנזים UBE3A גורמת להפרעות נוירו-התפתחותיות מובהקות. מחיקת כרומוזום אימהי 15q11-13 גורמת לתסמונת אנג'למן (AS)8, הפרעה המאופיינת במוגבלות אינטלקטואלית קשה, ליקויים מוטוריים, התקפים, התנהגות שמחה עם חיוך תכוף, ותווי פנים דיסמורפיים 8,9,10. לעומת זאת, שכפול או שילוש של כרומוזום אימהי 15q11-13 גורם לתסמונת Dup15q, מצב הטרוגני המוכר כאחת הצורות הסינדרומיות הנפוצות ביותר של אוטיזם11,12,13. בנוסף, ישנם מאות וריאנטים שגויים שזוהו ב- Ube3a, שרובם נחשבים לווריאנטים בעלי משמעות לא ברורה (VUS) מכיוון שמשמעותם התפקודית והקלינית אינה ידועה. לפיכך, יש עניין רב בפיתוח שיטות שיכולות להעריך באופן אמפירי גרסאות Ube3a כדי לקבוע אם הם תורמים למחלות נוירו-התפתחותיות.
האנזים UBE3A שייך למשפחת התחום HECT (הומולוגית ל-E6-AP C-terminus) של ליגאזות יוביקוויטין E3 שכולן מחזיקות בתחום ה-HECT המפורסם, המכיל את המנגנון הביוכימי הדרוש כדי לקבל יוביקוויטין פעיל מאנזימי E2 ולהעבירו לחלבוני סובסטרט14. מבחינה היסטורית, האפיון של אנזימי E3 הסתמך על מערכות מבחנה משוחזרות הדורשות אנסמבל של חלבונים מטוהרים 4,15,16. שיטות כאלה הן איטיות ועתירות עבודה ואינן ניתנות להערכת הפעילות של מספר רב של גרסאות. בעבודה קודמת, UBE3A זוהה כמפעיל את מסלול ה-Wnt בתאי HEK293T על ידי ויסות תפקוד הפרוטאזום כדי להאט את הפירוק של β-קטנין17. תובנה זו מאפשרת את השימוש בכתבי מסלול Wnt כשיטה יעילה ומהירה לזיהוי גרסאות אובדן ורווח של פונקציה של Ube3a18. הפרוטוקול שלהלן מתאר בפירוט שיטה ליצירת וריאנטים של Ube3a וכן כתב מבוסס לוציפראז להערכת שינויים בפעילות של וריאנטים של Ube3a.
Protocol
1. שיבוט מוטגנזה ליצירת גרסאות Ube3a
- שכפלו את כל גרסאות Ube3a לפלסמיד pCIG2 (איור 1A), וקטור ביקיסטרוני המכיל מקדם עוף-β-אקטין ואתר כניסה לריבוזום פנימי (IRES) עבור ביטוי EGFP19. מבנים באורך מלא של Ube3a מכילים רצף תגי Myc מסוף N והם משוכפלים ל-pCIG2 באמצעות אתר SacI בגודל 5' ואתר XmaI בגודל 3 אינץ'. בנוסף, אתרי EcoRI, EcoRV ו-PstI טבעיים בתוך רצף הקידוד Ube3a משמשים גם להחלקת שברים.
הערה: ניתן להשיג גרסאות לא מזוהות עבור Ube3a באמצעות הספרות ובמאגרים נגישים לציבור כגון מסד הנתונים ClinVar1. גרסאות נוספות שאינן מדווחות ניתן להשיג באמצעות תקשורת אישית עם מרכזים רפואיים. - השתמש בשיטת מוטגנזה דו-שלבית מותאמת של מגה-פרימר20 כדי להכניס מוטציות למסגרת הקריאה של Ube3a . בשלב הראשון, תכננו את האוליגונוקלאוטיד המוטגני המכיל את המוטציה הרצויה (הדוגמה המוצגת בפרוטוקול זה היא יצירת וריאנט UBE3A Q588E) שלצדו לפחות 30 זוגות בסיסים (bp) של הומולוגיה 5′ ו-3′ למוטציה (איור 1B וטבלה 1).
- השתמשו באוליגונוקלאוטיד המוטגני יחד עם אוליגונוקלאוטיד משלים עבור ה-PCR בסיבוב הראשון כדי ליצור מגה-פרימר של 200-400 bp המכיל את המוטציה (איור 1C; טבלה 2 וטבלה 3). השתמש בכל 50 μL של נפח התגובה PCR עבור אלקטרופורזה ג'ל agarose באמצעות ג'ל 1% וטיהור ג'ל לאחר מכן (טבלת חומרים). יש להצמיד את מוצר ה-PCR ב-30 μL שלH2O שעבר דה-יוניזציה (diH2O) לשימוש בסיבוב השני של ה-PCR בשלב הבא.
- הגדר את ה-PCR בסיבוב השני כפי שצוין (איור 1C; טבלה 2 וטבלה 3). שלב זה ייצור מקטעי דנ"א גדולים יותר (בדרך כלל באורך של ~1-1.5 קילובייט) המכילים את אתרי המוטציה וההגבלה הסופית המתאימים לשיבוט משנה (איור 1C).
- לאחר השלמת תגובת ה-PCR, יש לטהר את המוצר המתקבל באמצעות ערכת טיהור PCR (טבלת חומרים). יש לעכל ב-30 μL ולעכל את כל המוצר המטוהר ואת מבנה ה-pCIG2 Ube3a WT עם אנזימי ההגבלה המתאימים (הדוגמה מראה עיכול עם EcoRI ו-XmaI).
- לאחר שעתיים של עיכול בטמפרטורה של 37 מעלות צלזיוס, פתרו את תוצרי העיכול באמצעות אלקטרופורזה בג'ל אגרוז (1% ג'ל), וטיהרו את המוצרים המתאימים באמצעות ג'ל. הגדר קשירת בהתאם לפרוטוקול היצרן (טבלת חומרים), הפוך את מוצרי הקשירה לזן חיידקים DH10B (טבלת חומרים), ולאחר מכן צלחת עם בחירת אמפיצילין (100 מיקרוגרם / מ"ל).
- למחרת, בחרו שתיים עד ארבע מושבות כדי לחסן תרביות של 3 מ"ל המכילות מרק לוריא (LB) ו-100 מיקרוגרם/מ"ל אמפיצילין. תנו לתרביות לגדול בן לילה בטמפרטורה של 37 מעלות צלזיוס באינקובטור מסלולי עם רעידות (225 סל"ד).
- למחרת, השתמש ב-1-1.5 מ"ל של תרבית החיידקים כדי למזער את הדנ"א הפלסמיד (טבלת החומרים). להציל את התרבות הנותרת על ידי הצבתם ב 4 °C (64 °F). סנן את הפלסמידים המצומצמים על ידי ריצוף סנגר באמצעות אוליגונוקלאוטיד שנקשר ~200 bp מהמוטציה הרצויה.
- השתמש בתרביות החיידקים שנשמרו בטמפרטורה של 4 מעלות צלזיוס כדי לחסן מחדש תרביות של 50 מ"ל כדי למידיפרפ את הפלסמיד הנכון (טבלת החומרים). רצף מלא של רצף הקידוד Ube3a כדי לאמת את הרצף הנכון של הדנ"א.
- צור מלאי עבודה של פלסמידים בגרסה Ube3a, כמו גם את הכתב המופעל על ידי β-קטנין (BAR)21, TK-Renilla luciferase, Ube3a מת ליגאז (מוטציית UBE3A C820A), וקטור ריק pCIG2 בריכוז של 100 ng/μL באמצעות H2O סטרילי עבור שלבי ההעברה הבאים.
2. הכנה והעברה של תאי כליה עובריים אנושיים 293T (HEK293T)
- בצע את הבדיקות בתאי HEK293T שגודלו במדיום הנשר המהונדס (DMEM) של דולבקו, בתוספת גלוטמין, 10% סרום בקר עוברי (FBS) וחומר אנטיביוטי-אנטימיקוטי כפי שתואר קודםלכן 17. לגדל את התאים באינקובטור סטרילי ולח בטמפרטורה של 37 מעלות צלזיוס עם 5% CO2.
- באמצעות ארון בטיחות ביולוגית, צלחת תחילה את תאי HEK293T המרחפים על לוחות 96 בעלי תחתית שטוחה שטופלו בתרבית רקמה בצפיפות של 2.2 × 104 תאים לכל באר ב-100 μL של מדיית תרבית ולאפשר להם לגדול בן לילה.
- ביום השני, העבירו את התאים בארון בטיחות ביולוגית עם פלסמידים של פיירפליי ורנילה לוציפראז (טבלה 4) ופלסמידים של Ube3a במשולש. בצע את הטרנספקציות ב-10 μL של הנפח הכולל לכל באר באמצעות יחס של 10:1:8 של פלסמידים (50 ng של BAR, 5 ng של TK-Renilla, ו-40 ng של Ube3a פלסמיד לכל באר, בהתאמה), כפי שתואר קודם לכן18, ו-0.4 μL של מגיב טרנספקציה (טבלה 4).
הערה: עבור כל ניסוי, וקטור ריק (GFP בלבד) וקידוד פלסמיד ליגאז-מת Ube3a גם הם מועברים כדי לשמש כבקרות שליליות. - צור תערובת אב עבור הטרנספקציות עבור כל גרסה בצינור מיקרוצנטריפוגה בגודל 1.5 מ"ל (טבלה 4) ודגירה בטמפרטורת החדר (RT) למשך 15 דקות. לאחר הדגירה, התסיסו בעדינות את תערובת הטרנספקציה על ידי הקשה על הצינור, ולאחר מכן הוסיפו 10 μL של תערובת הטרנספקציה ישירות למדיית הצמיחה הקיימת בבארות.
- לאחר מכן, החזירו את התאים לאינקובטור ואפשרו לפלסמידים להתבטא במשך 48 שעות. החלפת מדיית הצמיחה אינה הכרחית.
- נטר את יעילות ההעברה על ידי פלואורסצנציה של GFP באמצעות מיקרוסקופ פלואורסצנטי. תאי HEK293T עוברים טרנספקציה יעילה בשיטה זו, ו->80% מהתאים צריכים לבטא GFP לאחר 48 שעות.
3. מדידת פעילות לוציפראז
הערה: פעילות לוציפראז מוערכת באמצעות מערכת זמינה מסחרית הבודקת הן את Firefly והן את Renilla luciferase (טבלת חומרים) בהתאם לפרוטוקול היצרן.
- שאפו בזהירות את מדיית התרבית מתאי HEK293T שעברו טרנספקציה, ולאחר מכן שטפו את התאים בתמיסת מלח קרה עם מאגרי פוספט (PBS). שאפו את ה-PBS והניחו את התאים על ידי הוספת 25 μL של חיץ ליזיס שאינו דנטורינג ודגירה במשך 15 דקות עם נדנדה עדינה על קרח.
- לאחר מכן, הוסף 20 μL של ליזאט שנוצר (אין צורך בצנטריפוגה) לתוך צלחת בדיקה חדשה של 96 בארות המכילה 100 μL של מגיב מצע לוציפראז Firefly. מערבבים את הצלחת בעדינות על ידי הקשה.
- טען את הצלחת על קורא צלחות ומדוד את עוצמת האור באמצעות גלאי עליון עם גובה קריאה של 1 מ"מ וזמן אינטגרציה של 1 שניות.
הערה: ייתכן שיהיה צורך להתאים את הרווח של הגלאי בהתבסס על עוצמת האות. - מיד לאחר קריאת לומינסנציה של פיירפליי לוציפראז, הוסף 100 μL של מצע Renilla luciferase לבארות. צעד זה מרווה בו זמנית את פעילות לוציפראז Firefly תוך הערכת פעילות רנילה לוציפראז. מערבבים את הדגימות על ידי תסיסה עדינה של הצלחת ומודדים שוב את הלומינסנציה כדי להעריך את פעילות רנילה לוציפראז.
הערה: בעוד שניתן להשתמש בלוחות אחרים לבדיקה זו, שימוש בלוחות עם מסגרות שחורות ובארות לבנות יספק את התוצאות הרגישות ביותר מכיוון שהדבר מגביר את אות לוציפראז תוך מזעור הרעש. - לכמת את תגובות הכתבים כיחס לוציפראז של פיירפליי ל-Renilla luciferase (Firefly/Renilla), ולממוצע את הערכים של מדידות המשולש. לאחר מכן, נרמל את הערך Firefly/Renilla עבור כל וריאנט כנגד הערכים עבור תאים מסוג בר (WT) Ube3a המבטאים כדי להשוות את הפעילות היחסית של חלבונים משתנים.
תוצאות
סריקה פונקציונלית בקנה מידה גדול של וריאנטים של Ube3a missense מזהה נוף רחב של מוטציות אובדן ורווח של תפקוד
עבודה קודמת עם מוטנטים של Ube3a הציעה שתגובת Wnt יכולה לשמש ככתב של פעילות החלבון UBE3A התאית. תצפיות אלה הורחבו, ונערכו ניסויי ולידציה נוספים כדי לחקור אם בדיקת BAR מתאימה לדיווח על מגוון פעילויות UBE3A בתא. ראשית, תאי HEK293T עברו טרנספקציה עם כמויות משתנות של דנ"א פלסמיד המקודד ל-WT Ube3a אנושי. הניסוי הזה הראה שתגובת ה-BAR משתנה באופן ליניארי עם כמות ה-Ube3a המומרת לתאים (איור 2A). שנית, בדיקת BAR נבדקה באמצעות דנ"א פלסמיד המקודד למחלות וריאנטים הקשורים למחלות שאופיינו בעבר בספרות22. בין אלה היו וריאנטים שפירים (R39H ו-A178T), וריאנט אחד הקשור לעלייה בתפקוד (T458A), ואוסף של וריאנטים מאושרים הקשורים לתסמונת אנג'למן הגורמים לאובדן תפקוד UBE3A באמצעות מנגנונים שונים15,22. בדיקת BAR זיהתה נכונה כל וריאנט (איור 2B), כולל כל הווריאנטים של אובדן תפקוד, והדגימה את הדיוק והכלליות של שיטה זו18.
בדיקת BAR שימשה לסינון 152 גרסאות missense, שרובן זוהו ממסד הנתונים של ClinVar. בדומה לראיות גנטיות לגבי וריאציות של מספרי עותקים בהפרעות תלויות Ube3a, ההשפעה התפקודית של וריאנטים של מיסנס הייתה רחבה וכללה וריאנטים שפירים, כמו גם וריאנטים של אובדן תפקוד ורווח של תפקוד (איור 3)18. מעניין במיוחד, גרסאות רווח התפקוד שזוהו בשיטה זו היו כולן חדשניות, ואימות מאוחר יותר הציע מאוד שהן מגדירות תת-מחלקה של הפרעות תלויות Ube3a עם פנוטיפים השונים מתסמונת אנג'למן הקלאסית18.
ההשפעה של וריאנטים שגויים היא לעתים קרובות בלתי צפויה, ומדגישה את הצורך בהערכה תפקודית
תצפית מסקרנת מהסינון הפונקציונלי של גרסאות Ube3a היא ששינויים במיקומים מסוימים של חומצות אמינו מייצרים השפעות שונות באופן דרסטי, ובכך מדגישים את החשיבות של הערכת וריאנטים אמפירית18. לדוגמה, שלושה אנשים זוהו עם וריאנטים בעמדת גלוטמין 588 (Q588) ב-UBE3A שכללו החלפת גלוטמט רווח של פונקציה (Q588E), החלפת ארגינין של אובדן תפקוד (Q588R), והחלפת פרולין נוספת של אובדן פונקציה (Q588P; איור 4A). נעשה שימוש בגישת מוטציה מקיפה כדי לשנות את מיקום Q588 לכל חומצת אמינו אפשרית. כאשר הפעילות של הווריאנטים האלה נמדדה באמצעות בדיקת BAR, היא הראתה שכל חומצת אמינו טעונה שלילית במיקום 588 מייצרת אנזים היפראקטיבי (איור 4B). תובנה זו סיפקה רמזים פונקציונליים חשובים שאפשרו את גילויו של אתר חדש בתחום HECT של UBE3A המאפשר התארכות שרשרת יוביקוויטין18.

איור 1: מוטגנזה תלוית PCR של Ube3a. (A) ייצוג של וקטור הביטוי Ube3a המציין אתרי הגבלה רלוונטיים. (B) רצף הדנ"א המקודד UBE3A מוצג בחלק העליון. קודון Q588 מסומן באותיות מודגשות. פריימר המוטגנזה Q588E (פריימר מוט) מוצג מיושר לרצף UBE3A. הכיתוב האדום מציין את האתר שעבר מוטגניזציה. (C) מוצגת סכמה של ה-PCR ליצירת המגה-פרימר ומקטע הדנ"א המשמש להחלקת מקטע Q588E. המיקום של מוטציית Q588E מסומן על ידי הכוכבית האדומה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: אימות של בדיקת BAR כמדווח של פעילות יוביקוויטין ליגאז UBE3A. (A) תאי HEK293T שעברו טרנספקציה עם כמויות הולכות וגדלות של קידוד פלסמידים WT UBE3A מראים עלייה ליניארית בתגובת BAR. ערכים ממוצעים מוצגים עבור יחסי פיירפליי/רנילה לוציפראז ± שגיאת תקן (SE). N= 3 ניסויים עצמאיים. (B) גרסאות Ube3a שאופיינו בעבר נבדקו במבחן BAR. התגובות נורמלו ל- WT UBE3A, והערכים מוצגים כממוצע ± SE. מספר הניסויים (n) וערכי p המחושבים באמצעות מבחן t של מדגם אחד (דו-זנב) עם תיקון השוואות מרובות של בנימיני-הוכברג (FDR = 0.05) הם כדלקמן: GFP, n = 19, ***p = 1.733 × 10−31; WT UBE3A, n = 19; UBE3A LD, n = 19, ***p = 1.519 × 10−31; R39H, n = 3, p = 0.567; A178T, n = 4, p = 0.828; T485A, n = 5, *p = 0.019; C21Y, n = 3, ***p = 8.725 × 10−6; C117R, n = 3, ***p = 3.419 × 10−4; N243K, n = 3, **p = 0.0072; E269G, n = 3, **p = 7.787 × 10−4; L273F, n = 3, **p = 0.0052; S349P, n = 3, **p = 0.0016; L502P, n = 3, **p = 0.0033; R506C, n = 3, **p = 0.0033; T106K, n = 6, **p = 0.0.0078; T106P, n = 3, **p = 0.0013; I130T, n = 6, *p = 0.016; R477P, n = 3, ***p = 4.24 × 10−4; M478I, n = 3, ***p = 3.39 × 10−4; R482P, n = 3, **p = 5.82 × 10−4; I329T, n = 5, ***p = 1.22 × 10−5; E550L, n = 3, *p = 0.0013. הנתונים הודפסו מחדש באישור Weston et al.18. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
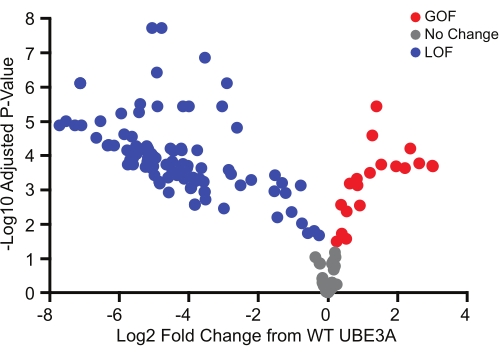
איור 3: גרסאות UBE3A המקיפות מגוון רחב של השפעות פונקציונליות. מסך בדיקת BAR של 152 גרסאות Ube3a המציגות מוטציות שפירות (אפור), אובדן פונקציה (כחול) ורווח פונקציה (אדום) ביחס ל- WT UBE3A . המשמעות נקבעה באמצעות מבחן t של מדגם אחד (דו-זנב) עם תיקון השוואות מרובות של בנימיני-הוכברג (FDR = 0.05). אדום, רווח של פונקציה; אפור, ללא שינוי מ- WT UBE3A; כחול, אובדן תפקוד. הנתונים הודפסו מחדש באישור Weston et al.18. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: גרסאות UBE3A המקיפות מגוון רחב של אפקטים פונקציונליים. (A) תוצאות בדיקת BAR של וריאנטים במיקום 588 של UBE3A המציגות הן תחליפי אובדן והן רווח של פונקציה. Q588E, n = 6; Q588P, n = 3; Q588R, n = 4; p < 0.0005, מבחן t מדגם אחד (דו-זנב) עם תיקון השוואה מרובה של בנימיני-הוכברג (FDR = 0.05). (B) עלילת חום המציגה תוצאות BAR מנורמלות לניתוח מוטציות מקיף בעמדה 588 ב- UBE3A. ההצללה הלבנה מייצגת את רמות הפעילות של WT UBE3A, ההצללה הכחולה מציינת אובדן תפקוד, וההצללה האדומה מציינת רווח של פונקציה. סרגל קנה המידה מציג את אחוז השינוי ביחס ל- WT UBE3A. N = 3 ניסויים עצמאיים עבור Q588S, Q588T, Q588N, Q588K, Q588P, Q588M, Q588G, Q588A, Q588F, Q588Y, Q588W, Q588L, Q588V, Q588I, Q588C; n = 8 עבור Q588E, n = 6 עבור Q588D, n = 5 עבור Q588R, n = 4 עבור Q588H, *p < 0.05, **p < 0.005, ***p < 0.0005. מבחן t מדגם אחד (דו-זנב) עם תיקון השוואות מרובות של בנימיני-הוכברג (FDR = 0.05). הנתונים הודפסו מחדש באישור Weston et al.18. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| שם | רצף | משמש עבור | |
| פריימר 1 | GATTATATTATGACAATAGAA TTCGCATGTACAGTGAAC | Ube3a חוש EcoRI | |
| מוט. פריימר | CCAGACCCAGTACTATGCCAAT CAGAGTAAACTCACCCTCAGTT TCAAAAGAAGATGGATTAAACC | UBE3A Q588E מוטגנזה אנטיסנס | |
| פריימר 2 | ATTATATTCCCGGGTTACAGCAT GCCAAATCCTTTGG | Ube3a XmaI אנטיסנס | |
טבלה 1: פריימרים המשמשים למוטגנזה של UBE3A Q588E.
| PCR סיבוב ראשון | |
| מגיב | כמות תגובה |
| מאגר 5x באיכות גבוהה | 10 מיקרוגרם |
| dNTP (מלאי של 10 מ"מ) | 1 מיקרון |
| פריימר 1 (10 מ"מ במלאי) | 1 מיקרון |
| פריימר 2 (10 מ"מ ממניה) | 1 מיקרון |
| דנ"א WT-Ube3a (מלאי של 150 ננוגרם/מיקרון) | 1 מיקרון |
| ח2או | 35 מיקרון |
| DNA פולימראז באיכות גבוהה | 1 מיקרון |
| נפח כולל | 50 מיקרון |
| סיבוב שני PCR | |
| מגיב | כמות תגובה |
| מאגר 5x באיכות גבוהה | 10 מיקרוגרם |
| dNTP (מלאי של 10 מ"מ) | 1 מיקרון |
| פריימר 3 (10 מ"מ מלאי) | 1 מיקרון |
| מוצר PCR מטוהר (מגה-פרימר) | 30 מיקרוגרם |
| דנ"א WT-Ube3a (מלאי של 150 ננוגרם/מיקרון) | 1 מיקרון |
| ח2או | 6 מיקרון |
| DNA פולימראז באיכות גבוהה | 1 מיקרון |
| נפח כולל | 50 מיקרון |
טבלה 2: פרמטרי PCR עבור מוטגנזה.
| PCR סיבוב ראשון | ||
| צעד | טמפרטורה | זמן |
| דנטורציה ראשונית | 95 °C | 2 דק' |
| (מחזור 1) | ||
| דנטורציה | 95 °C | 30 שניות |
| חישול | 50 מעלות צלזיוס | 20 שניות |
| סיומת | 72 °C | 15 שניות |
| (30 מחזורים) | ||
| הארכה סופית | 72 °C | 1 דקות |
| אחז | 4 °C | אינסופי |
| סיבוב שני PCR | ||
| צעד | טמפרטורה | זמן |
| דנטורציה ראשונית | 95 °C | 2 דק' |
| (מחזור 1) | ||
| דנטורציה | 95 °C | 30 שניות |
| חישול | 50 מעלות צלזיוס | 20 שניות |
| סיומת | 72 °C | 35 שניות |
| (30 מחזורים) | ||
| הארכה סופית | 72 °C | 1 דקות |
| אחז | 4 °C | אינסופי |
טבלה 3: פרמטרים של תוכנית PCR עבור מוטגנזה.
| מגיב | ריכוז עבודה | 1x טרנספקציה | 3.5x מאסטר מיקס |
| פלסמיד בר pGL3 | 100 ננוגרם/מיקרון | 0.5 מיקרון | 1.75 מיקרון |
| pTK רנילה פלסמיד | 100 ננוגרם/מיקרון | 0.05 מיקרון | 0.175 מיקרון |
| Ube3a פלסמיד | 100 ננוגרם/מיקרון | 0.4 מיקרון | 1.4 מיקרון |
| DMEM בתוספת גלוטמין | 8.65 מיקרון | 30.275 מיקרון | |
| מגיב טרנספקציה | 0.4 מיקרון | 1.4 מיקרון |
טבלה 4: תערובות טרנספקציה.
Discussion
הפרוטוקול המתואר כאן מספק שיטה יעילה ומדרגית להערכת הפעילות האנזימטית של גרסאות Ube3a. ישנם מספר פרטים טכניים המחייבים שיקול דעת זהיר בעת שימוש בבדיקה זו. שיקול אחד הוא הבחירה בפלסמידים של כתב Wnt המשמשים בבדיקה זו. הפרוטוקול המתואר כאן משתמש באופן ספציפי ב-β-catenin מופעל reporter (BAR)21, כתב המכיל שרשור של 12 רכיבי תגובה של גורם תאי T (TCF) המופרדים על ידי רצפי מקשרים שתוכננו במיוחד כדי למזער רקומבינציה ואובדן של אתרי קשירת TCF. ישנם פלסמידים נוספים מבוססי Wnt המבוססים על לוציפראז המתוארים בספרות23, ולמרות שמחקרים קודמים מצביעים על כך שניתן להשתמש בחלקם כדי להעריך את פעילות UBE3A, פלסמיד BAR אופיין בצורה היסודית ביותר למטרה זו17,18. שנית, הבחירה של Renilla luciferase פלסמיד היא קריטית. קידוד פלסמיד Renilla luciferase נכלל במהלך שלב הטרנספקציה כדי לנרמל את יעילות הטרנספקציה. הפלסמיד המשמש בפרוטוקול זה מבטא באופן מכונן את רנילה לוציפראז תחת שליטתו של מקדם תימידין קינאז (TK) (TK-Renilla). השימוש בפלסמידים המכילים מקדמים אחרים, כגון מקדם הציטומגלווירוס (CMV) הנמצא בשימוש נרחב, עשוי להוביל לתוצאות משתנות בביטוי Renilla luciferase.
שיקול שני הוא התנהגות התאים בהתאם לסוג והרבה FBS המשמשים לתרבית תאים. לדוגמה, FBS יכול להשפיע באופן משתנה על קצב הגדילה של תאי HEK293T. הפרוטוקול הנוכחי עבר אופטימיזציה כאשר התאים הציגו זמן הכפלה טיפוסי של 18-24 שעות, מה שהופך את צפיפות התאים בזמן הטרנספקציה ל-~4 × 104 תאים לכל באר. מכיוון שצפיפות התאים עשויה להשפיע על יעילות ההעברה, יש להעריך בזהירות את קצב גדילת התאים על ידי המשתמש ולהתאים את מספרי התאים בהתאם בזמן הציפוי. בנוסף, תגובת BAR תלוית UBE3A דורשת כמות מסוימת של ליגנד Wnt כדי להיות נוכחת במהלך הניסוי. ברוב התנאים הסטנדרטיים, יש מספיק Wnt ב- FBS כדי להניע את התגובה הזו; עם זאת, תגובה זו יכולה גם להשתנות. הטיטרציה של יחסי פלסמיד המשמשים להעברה מומלצת כדי להבטיח שתגובת ה- BAR נמדדת בטווח הליניארי המתאים. גישה חלופית היא לעורר איתות Wnt באמצעות ליגנד Wnt רקומביננטי או מדיית צמיחה עם תוספת Wnt17.
יתרון של בדיקת BAR הוא שהיא יכולה לדווח על פעילות יוביקוויטין ליגאז של כל האיזופורמים של Ube3a . בני אדם מבטאים שלושה איזופורמים של Ube3a הנבדלים זה מזה ב-N-termini הקיצוני שלהם בשל השימוש באתרי התחלה חלופיים של שעתוק24. בדיקת BAR מספקת את אותה קריאה אגנוסטית לאיזופורמים, ולכן, ניתן להשתמש בבדיקה זו כדי להעריך את כל גרסאות Ube3a . בנוסף, האפיון בקנה מידה גדול של גרסאות Ube3a מספק נתונים עמוקים של מבנה-תפקוד שיכולים לחשוף תחומים ומנגנונים חדשים שהם קריטיים לתפקוד אנזימים. מחקר קודם השתמש בנתוני וריאנטים כדי לגלות תחום קושר יוביקוויטין בתוך UBE3A המאפשר התארכות שרשרת יוביקוויטין18. מחקרים נוספים על מבנה ותפקוד צפויים לספק תובנות חדשות על המנגנונים הביוכימיים של UBE3A שעשויים להיות מנוצלים לפיתוח טיפולי.
ישנן כמה מגבלות לבדיקת BAR המצדיקות שיקול דעת זהיר בעת קביעת הפתוגניות של וריאנט. בשל ההטבעה האפיגנטית של Ube3a בנוירונים, בדיקה זו אינה יכולה להבחין בין אללים אימהיים ואבהיים, ויש לשקול ראיות גנטיות נוספות לצד נתונים פונקציונליים כדי לקבוע את הפתוגנטיות של וריאנט. יתר על כן, יש לקחת בחשבון משתנים נוספים מעבר לפעילות היוביקוויטין ליגאז של UBE3A בהקשר של מחלה. לדוגמה, עבודות קודמות הראו כי UBE3A מקומי גרעיני תורם לפתולוגיה של תסמונת אנג'למן25 וכי גרסאות מסוימות מפריעות לדפוס לוקליזציה זה של האנזים26. לפיכך, יש לבצע אפיונים נוספים במורד הזרם כדי לקבל הבנה מלאה של התרומה של גרסאות Ube3a לפתולוגיה נוירו-התפתחותית.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי פרס גשר לעצמאות של קרן סימונס (פרס SFARI #387972; J.J.Y.), פרס חוקר צעיר של NARSAD מהקרן לחקר המוח וההתנהגות (J.J.Y.), מלגת מחקר מקרן אלפרד פ. סלואן (J.J.Y.), ומענקי מחקר מקרן תסמונת אנג'למן (J.J.Y.), קרן וייטהול (J.J.Y.) ו- NIMH (R01MH122786; ג'יי.ג'יי.).
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1x), phenol red | Gibco | 25300-054 | |
| 1 Kb DNA ladder | Lambda Biotech | M108-S | |
| 100 bp DNA Ladder | Lambda Biotech | M107 | |
| 10x Buffer for T4 DNA Ligase with 10 mM ATP | New England BioLabs | B0202A | |
| 5x Phusion HF Reaction Buffer | New England BioLabs | B0518S | |
| Antibiotic-Antimycotic Solution | Corning | 30004CI | |
| Black/White Isoplate-96 Black Frame White Well plate | PerkinElmer | 6005030 | |
| Carbenicillin Disodium Salt | Midwest Scientific | KCC46000-5 | |
| Countess cell counting chamber slides | Invitrogen by Thermo Fisher Scientific | C10283 | |
| Countess II Automated Cell Counter | life technologies | Cell counting machine | |
| Custom DNA oligos | Integrated DNA Technologies (IDT) | ||
| Deoxynucleotide (dNTP) Solution Mix | New England BioLabs | N0447S | |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569044 | Basal medium for supporting the growth of HEK293T cell line |
| DPBS (1x) | Gibco | 14190-136 | |
| Dual-Luciferase Reporter Assay System | Promega | E1910 | |
| EcoRI-HF | New England BioLabs | R3101S | Restriction enzyme |
| Fetal Bovine Serum, qualified, heat inactivated | Gibco | 16140071 | Fetal bovine serum |
| Fisherbrand Surface Treated Tissue Culture Dishes | Fisherbrand | FB012924 | |
| FuGENE 6 Transfection Reagent | Promega | E2691 | |
| Gel Loading Dye Purple (6x) | New England BioLabs | B7024A | |
| HEK293T cells | ATCC | CRL-3216 | |
| High Efficiency ig 10B Chemically Competent Cells | Intact Genomics | 1011-12 | E. coli DH10B cells |
| HiSpeed Plasmid Midi Kit | Qiagen | 12643 | Midi prep |
| pCIG2 plasmid | |||
| pGL3 BAR plasmid | |||
| Phusion HF DNA Polymerase | New England BioLabs | M0530L | DNA polymerase |
| ProFlex 3 x 32 well PCR System | Applied biosystems by life technologies | Thermocycler | |
| pTK Renilla plasmid | |||
| QIAprep Spin Miniprep Kit (250) | Qiagen | 27106 | Mini prep |
| QIAquick Gel Extraction Kit (250) | Qiagen | 28706 | Gel purification |
| QIAquick PCR Purification Kit (250) | Qiagen | 28106 | PCR purification |
| rCutSmart Buffer | New England BioLabs | B6004S | |
| SacI-HF | New England BioLabs | R3156S | Restriction enzyme |
| Synergy HTX Multi-Mode Reader | BioTek | Plate reader runs Gen5 software v3.08 (BioTek) | |
| T4 DNA Ligase | New England BioLabs | M0202L | Ligase |
| TAE Buffer, Tris-Acetate-EDTA, 50x Solution, Electrophoresis | Fisher Scientific | BP13324 | |
| Tissue Culture Plate 96 wells, Flat Bottom | Fisherbrand | FB012931 | |
| UltraPure Ethidium Bromide Solution | Invitrogen by Thermo Fisher Scientific | 15585011 | |
| XmaI | New England BioLabs | R0180S | Restriction enzyme |
References
- Landrum, M. J., et al. ClinVar: Public archive of relationships among sequence variation and human phenotype. Nucleic Acids Research. 42, 980-985 (2014).
- Lek, M., et al. Analysis of protein-coding genetic variation in 60,706 humans. Nature. 536 (7616), 285-291 (2016).
- Starita, L. M., et al. Variant interpretation: Functional assays to the rescue. American Journal of Human Genetics. 101 (3), 315-325 (2017).
- Scheffner, M., Huibregtse, J. M., Vierstra, R. D., Howley, P. M. The HPV-16 E6 and E6-AP complex functions as a ubiquitin-protein ligase in the ubiquitination of p53. Cell. 75 (3), 495-505 (1993).
- Albrecht, U., et al. Imprinted expression of the murine Angelman syndrome gene, Ube3a, in hippocampal and Purkinje neurons. Nature Genetics. 17 (1), 75-78 (1997).
- Rougeulle, C., Glatt, H., Lalande, M. The Angelman syndrome candidate gene, UBE3A/E6-AP, is imprinted in brain. Nature Genetics. 17 (1), 14-15 (1997).
- Vu, T. H., Hoffman, A. R. Imprinting of the Angelman syndrome gene, UBE3A, is restricted to brain. Nature Genetics. 17 (1), 12-13 (1997).
- Kishino, T., Lalande, M., Wagstaff, J. UBE3A/E6-AP mutations cause Angelman syndrome. Nature Genetics. 15 (1), 70-73 (1997).
- Jiang, Y. H., et al. Mutation of the Angelman ubiquitin ligase in mice causes increased cytoplasmic p53 and deficits of contextual learning and long-term potentiation. Neuron. 21 (4), 799-811 (1998).
- Mabb, A. M., Judson, M. C., Zylka, M. J., Philpot, B. D. Angelman syndrome: Insights into genomic imprinting and neurodevelopmental phenotypes. Trends in Neuroscience. 34 (6), 293-303 (2011).
- Hogart, A., Wu, D., LaSalle, J. M., Schanen, N. C. The comorbidity of autism with the genomic disorders of chromosome 15q11.2-q13. Neurobiology of Disease. 38 (2), 181-191 (2010).
- Urraca, N., et al. The interstitial duplication 15q11.2-q13 syndrome includes autism, mild facial anomalies and a characteristic EEG signature. Autism Research. 6 (4), 268-279 (2013).
- de la Torre-Ubieta, L., Won, H., Stein, J. L., Geschwind, D. H. Advancing the understanding of autism disease mechanisms through genetics. Nature Medicine. 22 (4), 345-361 (2016).
- Scheffner, M., Staub, O. HECT E3s and human disease. BMC Biochemistry. 8, Suppl 1 (2007).
- Cooper, E. M., Hudson, A. W., Amos, J., Wagstaff, J., Howley, P. M. Biochemical analysis of Angelman syndrome-associated mutations in the E3 ubiquitin ligase E6-associated protein. Journal of Biological Chemistry. 279 (39), 41208-41217 (2004).
- Yi, J. J., Barnes, A. P., Hand, R., Polleux, F., Ehlers, M. D. TGF-beta signaling specifies axons during brain development. Cell. 142 (1), 144-157 (2010).
- Yi, J. J., et al. The autism-linked UBE3A T485A mutant E3 ubiquitin ligase activates the Wnt/beta-catenin pathway by inhibiting the proteasome. Journal of Biological Chemistry. 292 (30), 12503-12515 (2017).
- Weston, K. P., et al. Identification of disease-linked hyperactivating mutations in UBE3A through large-scale functional variant analysis. Nature Communications. 12 (1), 6809(2021).
- Hand, R., Polleux, F. Neurogenin2 regulates the initial axon guidance of cortical pyramidal neurons projecting medially to the corpus callosum. Neural Development. 6, 30(2011).
- Karginov, A. V., Ding, F., Kota, P., Dokholyan, N. V., Hahn, K. M. Engineered allosteric activation of kinases in living cells. Nature Biotechnology. 28 (7), 743-747 (2010).
- Biechele, T. L., Moon, R. T. Assaying beta-catenin/TCF transcription with beta-catenin/TCF transcription-based reporter constructs. Methods in Molecular Biology. , 99-110 (2008).
- Yi, J. J., et al. An Autism-linked mutation disables phosphorylation control of UBE3A. Cell. 162 (4), 795-807 (2015).
- Kuhnle, S., et al. Angelman syndrome-associated point mutations in the Zn(2+)-binding N-terminal (AZUL) domain of UBE3A ubiquitin ligase inhibit binding to the proteasome. Journal of Biological Chemistry. 293 (47), 18387-18399 (2018).
- Yamamoto, Y., Huibregtse, J. M., Howley, P. M. The human E6-AP gene (UBE3A) encodes three potential protein isoforms generated by differential splicing. Genomics. 41 (2), 263-266 (1997).
- Avagliano Trezza, R., et al. Loss of nuclear UBE3A causes electrophysiological and behavioral deficits in mice and is associated with Angelman syndrome. Nature Neuroscience. 22 (8), 1235-1247 (2019).
- Bossuyt, S. N. V., et al. Loss of nuclear UBE3A activity is the predominant cause of Angelman syndrome in individuals carrying UBE3A missense mutations. Human Molecular Genetics. 30 (6), 430-442 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved