Method Article
בדיקת קשירה של חלבון פני התא המבוסס על ציטומטריה של זרימה להערכת סלקטיביות וספציפיות של אפטמר אנטי-סרטני
In This Article
Summary
צעד הכרחי בפיתוח אפטמר נגד סרטן הוא לבחון את קשירתו למטרה. אנו מדגימים בדיקה מבוססת ציטומטריה של זרימה כדי לחקור את הקשירה הזו, תוך הדגשת החשיבות של הכללת אפטמר בקרה שלילית ותאים סרטניים חיוביים או שליליים עבור אותו חלבון מסוים.
Abstract
אתגר מרכזי בפיתוח אפטמר נגד סרטן הוא לקבוע ביעילות את הסלקטיביות והספציפיות של האפטמר המפותח לחלבון המטרה. בשל יתרונותיו הרבים על פני נוגדנים חד שבטיים, פיתוח אפטמר זכה לפופולריות עצומה בקרב חוקרי סרטן. אבולוציה שיטתית של ליגנדות על ידי העשרה מעריכית (SELEX) היא השיטה הנפוצה ביותר לפיתוח אפטמרים ספציפיים לחלבונים בעלי עניין. בעקבות SELEX, בדיקת קשירה מהירה ויעילה מאיצה את תהליך הזיהוי, ומאשרת את הסלקטיביות והספציפיות של האפטאמר.
מאמר זה מסביר שלב אחר שלב בדיקת קשירה מבוססת ציטומטריה של אפטמר ספציפי למולקולת הידבקות תאית אפיתל (EpCAM). הגליקופרוטאין EpCAM של טרנסממברנה מתבטא יתר על המידה ברוב הקרצינומות וממלא תפקידים בייזום סרטן, התקדמות וגרורות. לכן, הוא מועמד בעל ערך למתן תרופות ממוקדות לגידולים. כדי להעריך את הסלקטיביות והספציפיות של האפטמר ל- EpCAM הקשור לממברנה, נדרשים תאים חיוביים ושליליים של EpCAM. בנוסף, נדרש אפטמר EpCAM לא מחייב עם אורך דומה ומבנה דו-ממדי (2D) לאפטמר מחייב EpCAM. בדיקת האיגוד כוללת מאגרים שונים (מאגר חוסם, מאגר כביסה, מאגר דגירה ומאגר FACS) ושלבי דגירה.
האפטמר הוא דגירה עם קווי התא. לאחר שלבי הדגירה והשטיפה, התאים יוערכו באמצעות בדיקת ציטומטריה של זרימה רגישה. ניתוח התוצאות מראה את הקישור של האפטמר הספציפי ל- EpCAM לתאים חיוביים ל- EpCAM ולא לתאים השליליים של EpCAM. בתאים חיוביים ל-EpCAM, זה מתואר כהזזת פס בכריכה של אפטמר EpCAM מימין בהשוואה לבקרת האפטאמר הלא מחייבת. בתאים שליליים של EpCAM, הרצועות המתאימות של אפטמרים קושרי EpCAM ו--לא-מחייבים חופפים. זה מדגים את הסלקטיביות והספציפיות של אפטאמר EpCAM. בעוד שפרוטוקול זה מתמקד באפטמר EpCAM, הפרוטוקול חל על אפטאמרים אחרים שפורסמו.
Introduction
סרטן הוא עדיין אחד הגורמים המובילים לתמותה ברחבי העולם1. למרות השיפור המשמעותי בטיפול בסרטן בעשורים האחרונים, פיתוח תרופות נגד סרטן הוא עדיין נושא שנוי במחלוקת. הסיבה לכך היא שכימותרפיה, כעמוד התווך של הטיפול בסרטן, מלווה בתופעות לוואי חמורות המגבילות את ציות המטופל לטיפול. יתר על כן, עמידות לסרטן הנגרמת על ידי כימותרפיה לטיפול הגבילה את יישומו כבחירה היחידה של התערבות רפואית. היישום של נוגדנים חד שבטיים (mAbs) הציג תגובה משופרת לטיפולים בסרטן2. הרציונל של השימוש ב-mAbs היה לשפר את היעילות של כימותרפיה ולמזער את התגובות השליליות שלהם. עם זאת, הממשל של mAbs הפך גם אתגר. זה היה לא רק בגלל התגובות החיסוניות הנגרמות על ידי mAb, אלא גם בגלל עלויות הייצור התלויות והיקרות של בעלי חיים ותנאי אחסון קשים3. הצגת האפטמרים בשנות ה-90 של המאה ה-20העלתה תקוות חדשות בטיפול בסרטן, שכן היישום של אפטמרים יכול היה להתמודד עם האתגרים הקשורים ל-mAbs.
אפטמרים הם רצפי חומצות גרעין קצרים המיוצרים במיוחד עבור מטרה מסוימת. אבולוציה שיטתית של ליגנדות על ידי העשרה אקספוננציאלית (SELEX) היא שיטה נפוצה בייצור אפטמרים. ב-SELEX, החלבון המעניין מודגר עם ספרייה של רצפי נוקלאוטידים אקראיים, ובאמצעות סדרה של מחזורים איטרטיביים, האפטמר הספציפי לחלבון זה מטוהר. ל-Aptamers יש סלקטיביות מטרה וספציפיות דומות ל-mAbs, ולכן פיתוח תרופות בתחום זה מראה יישומים עתידיים מבטיחים. Aptamers ספציפיים עבור סמנים ביולוגיים לסרטן יכול להיות מיושם כתרופות בודדות וכלי אבחון סרטן 5,6,7. בשל המבנה הננו-גדול שלהם, אפטמרים אלה יכולים לשמש גם כנשאי תרופות כדי לספק חומרים ציטוטוקסיים במיוחד לגידול8. זה יגביר את היעילות של מתן תרופות ממוקדות ויפחית את התגובות השליליות הקשורות לכימותרפיה, מחוץ למטרה. יתר על כן, לננו-רפואה אלה יש חדירה גבוהה לרקמות, מה שהופך אותם למועמדים רצויים להעברת תרופות וטיפול בגידולים עמוקים. ניתן גם לתכנן את האפטמרים כך שיתמקדו במובילים המתבטאים במחסום הדם-מוח (BBB) כדי לשפר את אספקת התרופות לגידולי מוח9. דוגמה טובה לאפטמר כזה הם אפטמרים דו-כיווניים, המכוונים לקולטן טרנספרין (TfR)10 כדי לשפר את אספקת התרופות ברחבי ה-BBB, ומעבירים מטען של תרופה ציטוטוקסית לתאי הגידול11.
למרות כל היתרונות של אפטמרים, פיתוח תרופות בתחום זה עדיין לא הניב תרופה משווקת ומוצלחת נגד סרטן. סיבה אחת לכך יכולה להיות היעדר שיטות סטנדרטיות וניתנות לשחזור שניתן לעקוב אחריהן ברחבי העולם על ידי חוקרים בתחום. במאמר זה מודגם פרוטוקול שלב אחר שלב של קשירת אפטמר לחלבון מקומי המתבטא על פני התא. פרוטוקול זה הוא שלב מוקדם בהערכה הפרה-קלינית של אפטמרים נגד סרטן. הבדיקה מבוצעת כדי להראות את הסלקטיביות והספציפיות של האפטמר המטוהר שנאסף מ- SELEX או רצף אפטמר שפורסם לאישור סלקטיביות וספציפיות. בדיקה זו, המבוססת על ציטומטריה, היא בדיקה מהירה, אמינה ורגישה המציגה במדויק את הסלקטיביות והספציפיות של האפטאמר, כאשר האפטמר נבדק מול חלבונים על פני התא12,13,14. שיטה זו מודגמת באמצעות כריכה של aptamer ספציפי עבור EpCAM המוצג במאמר זה15. EpCAM, כגליקופרוטאין טרנסממברן, ממלא תפקידים באיתות תאי הגידול, התקדמות, נדידה וגרורות16,17. כדי להראות את הסלקטיביות והספציפיות של אפטמר זה, נעשה שימוש בתאי סרטן חיוביים ושליליים של EpCAM. האפטאמר הספציפי של EpCAM שפותח בעבר, TEPP (5′-GC GCG GTAC CGC GC TA ACG GA GGTTGCG TCC GT-3′), ואפטמר בקרה שלילית, TENN (5′-GC GCG TGCA CGC GC TA ACG GA TTCCTTT TCC GT-3), שימשו כמחייבים EpCAM ו--לא מחייבים aptamers, בהתאמה10. הקצה 3' של TEPP ו- TENN סומנו עם פלואורופור TYE665.
TEPP הוא אפטמר דו-תכליתי המכוון ל-EpCAM מקצה אחד ול-TfR מצד שני. עובדה זו הפכה את TEPP למועמדת מתאימה לאספקת תרופות לגידולי מוח מסוג EpCAM+ . באמצעות הקצה הספציפי ל-TfR, TEPP חוצה את מחסום הדם-מוח, ובאמצעות הקצה הספציפי ל-EpCAM, מוצא את הגידול ומעביר את המטען שלו (למשל, תרופות ציטוטוקסיות) לגידול. ל- TENN יש אורך ומבנה דו-ממדי דומה לזה של TEPP, אך אין לו זיקה ל- EpCAM או TfR, ולכן הוא אפתמר מתאים לבקרה שלילית. באמצעות TEPP ו- TENN, בדיקת קשירת אפטמר לחלבון המטרה באמצעות ציטומטריה של זרימה מוצגת במאמר זה. פרוטוקול זה חל על פיתוח של aptamers ספציפיים לתא. הוא ישים גם לניתוחים משלימים ומאשרים נוספים של רצפי האפטמרים הזמינים בספרות. הפרוטוקול יכול לשמש גם את אלה החדשים בתחום האפטמר אשר בוחנים שימוש באפטמר שפורסם בעבר למטרות המחקר והפיתוח (מו"פ) שלהם. במאמר זה נלמדים שני רצפי אפטאמרים הזמינים בספרות.
Protocol
הערה: לפני תחילת הניסוי, יש ללבוש ציוד מגן אישי, כולל מעיל מעבדה, כפפות ומשקפי מגן. עיין בטבלת החומרים לקבלת פרטים אודות חומרים, ריאגנטים, ציוד ותוכנות המשמשים בפרוטוקול זה.
1. מאגרים נדרשים לבדיקה
- הכן את המאגרים הדרושים לניסוי זה - מאגר SELEX הנדרש לקיפול אפטאמר, מאגר חוסם (BB), מאגר שטיפה (WB) וחיץ מחייב (BiB) (טבלה 1) - טרי ביום הניסוי ושמור אותם על קרח או בטמפרטורה של 4 מעלות צלזיוס.
הערה: כל אפטמר דורש תנאי קיפול ייחודי. זה כולל את חיץ SELEX ותנאי טמפרטורת קיפול. יש להקפיד על שכפול מלא של השיטות מהמאמר המקורי המתאר את האפתמר10. בניסוי זה, כל המאגרים מוכנים בתמיסת מלח עם אגירת פוספטים (DPBS) של דולבקו. נפח המאגר הנדרש בכל ניסוי תלוי במספר קווי התאים, מספר המשכפלים ומספר ריכוזי האפטמרים שנבדקים.
| מרכיבים | נפח נדרש | ||
| פריט | ריכוז | ||
| מאגר SELEX | מ.ג.ל.2 | 5 דקותמ' | 50 μL לכל דגימה + 10% שגיאת צנרת |
| חסימת מאגר | מ.ג.ל.2 | 5 דקותמ' | 500 μL לכל קו תא |
| BSA a | 1 מ"ג/מ"ל | ||
| tRNA b | 0.1 מ"ג/מ"ל | ||
| FBS c | 10% (וולט/ואט) | ||
| מאגר שטיפה | מ.ג.ל.2 | 5 דקותמ' | 1 מ"ל לשטיפה הראשונה + 100 μL לדגימת בדיקה + 10% שגיאת פיפטינג |
| מאגר כריכה | מ.ג.ל.2 | 5 דקותמ' | 50 μL לכל דגימה + 10% שגיאת צנרת |
| BSA | 2 מ"ג/מ"ל | ||
| tRNA | 0.2 מ"ג/מ"ל | ||
| FBS | 20% (לעומת וולט) | ||
טבלה 1: המאגרים הנדרשים לבדיקת הכריכה. א אלבומין בסרום בקר, b העברת חומצה ריבונוקלאית, סרוםבקר עוברי.
2. הכנת אפטאמרים
הערה: האפטמרים המשמשים בבדיקה מתויגים באמצעות מולקולת דיווח פלואורסצנטית, ולכן יש להקפיד להגן עליהם מפני אור.
- לפני הניסוי, הכינו מלאי של 100 מיקרומטר (מלאי A) של אפטמרים לבדיקה ובקרה באמצעות מים אולטרה-פוריים נטולי פירוגן ו-RNase (איור 1).
הערה: לשימור לטווח ארוך, יש לשמור מלאי A במקפיא בטמפרטורה של -20 מעלות צלזיוס. - הכן את מלאי B כריכוז העבודה של אפטאמרים על ידי דילול מלאי A באמצעות מאגר SELEX (טבלה 1). כדי לעקוב אחר פרוטוקול זה, דילל מלאי A למלאי של 1,000 ננומטר כדי להכין מלאי B (איור 1).
- כדי להכין את האפטאמר להיווצרות המבנה התלת-ממדי (3D), בצינור של 250 μL, דילל מלאי B עם חיץ SELEX כדי להכין את הנפח והריכוז הנדרשים של האפטמר לקיפול.
הערה: האפטמרים המקופלים ייחשפו לנפח שווה של תאים. לכן, ריכוז האפטמר שנקבע לקיפול צריך להיות מרוכז פי 2 מהריכוז הסופי הרצוי. השתמש במשוואה (1) כדי לחשב את הנפחים והריכוזים הנדרשים. זכור לשקול תוספת של 10% נפח עבור שגיאת הצנרת.
מלאי ריכוז A × מלאי נפחA = מלאי ריכוז B ×מלאי נפחB (1)

איור 1: דיאגרמה המציגה את השלבים בהכנת אפטמרים. 1 מלאי 1מאוחסן ב-20 מעלות צלזיוס לשימור לטווח ארוך. 2 ריכוזי העבודה מוכנים במאגר SELEX ואינם מאוחסנים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
3. תחזוקה של תאים סרטניים
הערה: לפני תחילת המחקר, ודא שהתאים נמצאים במספרי המעבר המוקדמים שלהם, מראים את התכונות המורפולוגיות האופייניות להם ושהם נטולי מיקופלסמה. כדי לבחון את הסלקטיביות והספציפיות של האפתמר, נדרשים באופן אידיאלי קווי תאים בעלי מבטא גבוה, בינוני ונמוך/שלילי של החלבון המעניין.
- זרעו את התאים בבקבוקון תרבית T75, תוך שימוש בתנאי תרבית מתאימים. לגדל אותם באינקובטור 5% CO2 לחות, ב 37 מעלות צלזיוס.
הערה: במחקר זה נעשה שימוש בסרום נשר מתוקן (DMEM) של Dulbecco בתוספת 10% סרום בקר עוברי (מדיום שלם). - כאשר התאים מגיעים למפגש של ~80%, מעבירים אותם לבקבוקון חדש המכיל מדיום שלם ורענן.
הערה: בהתאם לחלבון המעניין ולקו התאים, מפגש של 80% יכול לספק אוכלוסיית תאים מתאימה לבדיקה המחייבת. עבור קווי התאים בניסוי זה, MDA-MB-231 ו- HEK 293T, מתאים מפגש של 80%. בשלב זה, המשך לסעיף 4, המבחן המחייב. בדוק תמיד את הביטוי של החלבון המעניין, באמצעות mAbs ספציפי עבור חלבון זה.
4. בדיקה מחייבת
הערה: איור 2 מסכם את השלבים הנדרשים במבחן הכריכה בתאים דבקים.
- בארון בטיחות ביולוגית סוג II, לאסוף את התאים של כל בקבוק בצינורות כדלקמן:
- לאסוף ולהשליך את המדיה בבקבוקון, להוסיף 2 מ"ל של PBS, להפיץ אותו על התאים, ולאחר מכן, לאסוף ולהשליך את PBS. חזור על שלב זה פעמיים נוספות כדי להסיר את כל עקבות המדיה שעלולים להשבית טריפסין. יש להוסיף 1 מ"ל של 0.25% טריפסין/EDTA לכל בקבוקון ולדגור במשך 5-10 דקות ב-37 oC. דמיינו את ניתוק התאים תחת מיקרוסקופ.
- הוסף 1 מ"ל של מדיום שלם לתאים, ופיפט את התאים למעלה ולמטה כדי ליצור השעיה של תא יחיד. צנרת את התאים לתוך צינור מתאים צנטריפוגה ב 200 × גרם במשך 5 דקות.
הערה: עבור תאים שאינם דבקים, אסוף את התאים בצינור, צנטריפוגה (200 × גרם, 5 דקות), והמשך לשלב 4.1.3. - יש להשליך את הסופר-נאטנט ולהשהות את התאים ב-1 מ"ל של מדיום טרי. ספרו את התאים באמצעות צביעה כחולה טריפאן, על ידי דילול נפח מסוים של תרחיף תאים בכחול טריפאן. יש לפזר ~ 15 μL של התערובת בין המוציטומטר לכוס כיסוי. ספירת התאים כפי שתואר קודםלכן 18, באמצעות משוואה (2):
 (2)
(2)
הערה: השתמש בנפח המינימלי האפשרי של השעיית התא ורשום לעצמך את גורם הדילול. לדוגמה, ערבוב נפחים שווים של השעיית התא וכחול טריפן של 0.04% נותן מקדם דילול של 2. הבטח כדאיות גבוהה (תאים חיים/סך התאים × 100) של ~90% עבור רוב קווי התאים הדבקים לפני שתמשיך. תאים מתים באופן לא ספציפי קולטים אפטמרים ומשנים את התוצאות19. ניתן להשתמש בטכניקות אחרות של ספירת תאים, כגון שימוש במונה תאים. - אסוף את מספר התאים הנדרש, וודא שיש 10 × 104 תאים לכל דגימת בדיקה. שקול תוספת של 10% נפח עבור שגיאת צנרת.
הערה: חשוב תמיד לשמור על אותה ספירת תאים בין ניסויים ושכפולים. - דגירה של התאים בטמפרטורה של 37 מעלות צלזיוס למשך שעתיים כדי לאפשר ייצוב של החלבון המעניין על קרום התא לאחר ניתוק אנזימטי.
הערה: תקופת הדגירה עשויה להשתנות בהתאם לחלבון המעניין.
- במהלך דגירה זו של 2 שעות:
- הגדר את הטמפרטורה של הצנטריפוגה ל -4 מעלות צלזיוס. השאירו tRNA ומלאי של אפטמר בטמפרטורת החדר או על קרח להפשרה. כדי להגן על מולקולת כתב הפלואורסצנציה, הגן על צינורות האפטמר מפני אור.
הערה: תפקידו של tRNA הוא לחסום את אתרי הקישור של חומצות גרעין. - הכינו את מאגר SELEX, BB, WB ו-BiB (ראו סעיף 1), ושמרו את כולם על קרח או בטמפרטורה של 4 מעלות צלזיוס. הנח את מכונת התרמו-ציקלר על מחזור ריק. מניחים פלטה שחורה של 96 בארות ומזרימים צינורות ציטומטריה על קרח.
הערה: הצבת התרמוציקלר על מחזור ריק מכינה את מערכת הקירור והחימום ומסייעת בהפקת תוצאות הניתנות לשחזור יותר.
- הגדר את הטמפרטורה של הצנטריפוגה ל -4 מעלות צלזיוס. השאירו tRNA ומלאי של אפטמר בטמפרטורת החדר או על קרח להפשרה. כדי להגן על מולקולת כתב הפלואורסצנציה, הגן על צינורות האפטמר מפני אור.
- לאחר הדגירה של 2 שעות, צנטריפוגה התאים ב 500 × גרם במשך 5 דקות. השליכו את הסופר-נאטנט והחזירו את התאים ב-500 מיקרוגרם של BB. דגירה של התאים ב-4 מעלות צלזיוס למשך 30 דקות עם ערבוב לסירוגין.
- במהלך דגירה זו של 30 דקות, בצע קיפול aptamer כדלקמן:
- הרכיבו את ריכוזי האפטאמרים פי 2 (ראו סעיף 2), ולאחר מכן ערבבו ודגרו את האפטמרים במכונת התרמו-ציקלר, בהתאם לתנאי הקיפול הנדרשים. עבור אפתמר EpCAM זה, השתמש בתנאי הקיפול הבאים של 95 °C, 5 דקות, ואחריו 22 °C, 10 דקות, ו- 37 °C, 15 דקות.
הערה: כלול תמיד בקרה שלילית (כלומר, מאגר SELEX ללא aptamers).
- הרכיבו את ריכוזי האפטאמרים פי 2 (ראו סעיף 2), ולאחר מכן ערבבו ודגרו את האפטמרים במכונת התרמו-ציקלר, בהתאם לתנאי הקיפול הנדרשים. עבור אפתמר EpCAM זה, השתמש בתנאי הקיפול הבאים של 95 °C, 5 דקות, ואחריו 22 °C, 10 דקות, ו- 37 °C, 15 דקות.
- לאחר הדגירה של 30 דקות, צנטריפוגה של התאים (500 × גרם, 5 דקות, 4 מעלות צלזיוס), להסיר את supernatant, להוסיף 1 מ"ל של WB, צנטריפוגה את התאים שוב (500 × גרם, 5 דקות, 4 °C). הסר את supernatant ו resuse את התאים בנפח מתאים של BiB.
- פיפטה 50 μL של התאים המחודשים לתוך כל באר של צלחת קרה כקרח, 96 באר שחורה. שמור את התאים על הקרח כדי לעכב הפנמה של החלבון המעניין.
- פיפטה 50 μL של האפטמרים על נפח של 50 μL של תאים, מערבבים, ודוגרים בחושך בטמפרטורה של 4 מעלות צלזיוס למשך 30 דקות. צנטריפוגה את הצלחת ב 500 × גרם, 5 דקות, 4 מעלות צלזיוס, ולהסיר בזהירות את supernatant.
- בזהירות להשהות את הכדור ב WB וצנטריפוגה ב 500 × גרם במשך 5 דקות. חזור על שלב הכביסה (4.7) פי 2 והשהה מחדש ב- 100 μL של WB לצורך ניתוח ציטומטרי של זרימה.
הערה: ראו איור 3 עבור דיאגרמה של אינטראקציות בין אפטמרים ותאים.

איור 2: דיאגרמה המתארת את השלבים בביצוע בדיקה של קשירת חלבון אפתמר. קיצורים: SELEX = אבולוציה שיטתית של ליגנדות על ידי העשרה EXponential; BB = חסימת חיץ; WB = מאגר שטיפה; BiB = חיץ מחייב. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: דיאגרמה המציגה את הסוגים השונים של תאים ואפטמרים הנדרשים לביצוע בדיקת קשירת האפטמרים. קיצור: EpCAM = מולקולת הידבקות תאית אפיתליאלית. נתון זה נוצר באמצעות Biorender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
5. ציטומטריה של זרימה וניתוח נתונים
הערה: לפני הפעלת ציטומטר הזרימה, ודא שאין "בועות" ביחידות מסנן הממברנה עבור תמיסת הכיבוי, תמיסת הניקוי ונוזל המעטפת (0.9% NaCl). "לדמם החוצה" בועות אם יש בועות בקפסולות. ודאו שמיכל הפסולת ריק, ומיכלים של נוזל נדן, מים ואקונומיקה של 1% במים אולטרה-פוריים מלאים.
- הפעל את ציטומטר הזרימה ולאחר מכן את המחשב.
הערה: הפרטים של הפעלת ציטומטר הזרימה המוסברים כאן הם ספציפיים למכונה ולתוכנה המודגמות בסרטון (ראה טבלת חומרים). תוכנות אחרות ידרשו הכשרה מתאימה לשימוש. - פתח את תוכנת ניתוח ציטומטריה של זרימה, היכנס לתוכנית, ותחת הכרטיסייה Cytometer, הפעל את Fluidics Start.
- כדי ליצור ניסוי חדש, תחת הכרטיסיה ניסוי, לחץ על תיקיה חדשה ותן שם לתיקיה/ניסוי בהתאם.
- לחץ על תיקיה חדשה כדי להדגיש, ולאחר מכן, תחת הכרטיסיה ניסוי שוב, לחץ על ניסוי חדש ותן שם לניסוי בהתאם.
- כדי להוסיף את הדגימה/הדגימה הראשונה, תחת הכרטיסיה ניסוי, לחץ על דגימה חדשה ותן שם לדגימה זו כראוי (שם שורת התא/דגימת בקרה/דגימת ניסוי).
- כדי להוסיף דגימת צינור, סמן את הדגימה (קבוצה) ותחת הכרטיסיה ניסוי , לחץ על צינור חדש. הוסף את המספר המתאים של צינורות ושם.
- כדי להכין את הגרפים הנדרשים, תחת לשונית גליון העבודה, פתח גליון עבודה חדש. לאחר שחלון גליון העבודה החדש יופיע, פתח את האפשרויות הבאות באמצעות מסך גליון העבודה (רחף עם העכבר מעל הסמל/התמונות כדי למצוא את השמות):
- הכן גרף כתם נקודה של פיזור קדימה (FSC) לעומת פיזור צד (SCC) כדי לבחור את אוכלוסיית העניין. הגדר את השער הראשון על-ידי זיהוי ובחירה של אוכלוסיית העניין (P1) בחלקת צפיפות פיזור קדימה וצדדית. אל תכלול את הפסולת, המהווה את האוכלוסייה עם אות הפיזור הקדמי הנמוך ביותר.
הערה: הפרמטר FSC מזהה תאים או אירועים בהתבסס על גודלם וה- SCC מפלה אותם על סמך רמת הפירוט שלהם20. - הכן גרף כתם נקודה של אזור FSC (FSC-A) לעומת גובה FSC (FSC-H) כדי לבחור את אוכלוסיית התא הבודד. הגדר את השער השני על-ידי אי-הכללת אוכלוסיות תאים כפולים, שכן תאים כפולים משפיעים במידה ניכרת על התוצאות והמסקנות. אל תכלול כפילויות באמצעות חלקות צפיפות FSC-H לעומת FSC-A, שבהן תאים באותו גודל מציגים שטח וגובה דומים. לפיכך, הסינגלטים מקובצים באלכסון ומופרדים מכפילים.
הערה: FSC פרופורציונלי בערך לגודל התא. פולסי המתח מוגדרים כ- FSC-H, עוצמת האות, רוחב FSC המשקף את גודל התא ואת משך האות, ו- FSC-A, שהוא H × W. לכפילים יש רוחב כפול וערך שטח; לפיכך, סימון עבור סינגלטים מבוסס על זיהוי חוסר פרופורציות בין H, W ו- A הנגרמות על ידי כפילויות. - הכן היסטוגרמה של מספר האירועים נגד הפלואורופור של עניין.
- הכן גרף כתם נקודה של פיזור קדימה (FSC) לעומת פיזור צד (SCC) כדי לבחור את אוכלוסיית העניין. הגדר את השער הראשון על-ידי זיהוי ובחירה של אוכלוסיית העניין (P1) בחלקת צפיפות פיזור קדימה וצדדית. אל תכלול את הפסולת, המהווה את האוכלוסייה עם אות הפיזור הקדמי הנמוך ביותר.
- לפני תחילת ציטומטריה של זרימה, ודא שלוח המחוונים לרכישה לשליטה ברכישת הדגימה, המפקח והציטומטר כדי להתאים את פרמטרי המתח, כמו גם גליון העבודה עם כל הגרפים פתוחים.
הערה: יש צורך בלפחות 100 μL של תרחיף של 10 × 104 תאים בצינור ציטומטריה של זרימה כדי לבצע את הניתוח. במיוחד במקרה של כדאיות נמוכה יותר, ניתן לבצע צביעת פרופידיום יודיד כדי לבחור את אוכלוסיית התאים בת קיימא21,22. - כדי להפעיל את הדוגמה הראשונה, בצד שמאל של המסך ודא שהחץ המצביע על הצינור הוא ירוק. אם חץ זה אינו ירוק, לחץ על החץ כדי להפוך אותו לירוק.
- באמצעות פיפטה, העבירו כל דגימה מהצלחת השחורה בעלת 96 הבארות לצינור ציטומטריה של זרימה. הפעל את דגימת הבקרה הלא מטופלת והלא מוכתמת במהירות נמוכה.
- בלוח המחוונים של הרכישה, בחר מספר מתאים של אירועים לתיעוד (30,000), שנה את קצב הזרימה לנמוך ולחץ על קבל נתונים.
- התאם את המתח עבור הפרמטרים FSC ו- SCC. ודא שאוכלוסיית התאים מרוכזת בתוך מתווה הנקודה ושאף תא לא נוגע בשני הצירים של הגרף כדי למנוע אובדן של התאים המעניינים.
- הגדל את מהירות הרכישה לבינונית או גבוהה כדי לנתח את הדגימות מהר יותר, אך אל תעלה על יותר מ- 200 אירועים לשנייה. לאחר מכן, לחץ על הקלט נתונים.
- בצעו את ה-gating עבור P1 (איור 4A) ואוכלוסיית התא הבודד (איור 4B). בנה את ההיסטוגרמה של אירועים כנגד הפלואורוכרום המשומש ובחר P1 בהתבסס על הנתונים (אלופיקוציאנין (APC) במקרה זה) (איור 4C).
- לאחר התאמת המתח, gating ורישום הנתונים, להוציא את הדגימה ולחץ על צינור הבא.
- הוסף את הדוגמה הבאה וחזור על נתוני ההקלטה עבור כל דגימות הבקרה והבדיקה (איור 3).
- לאחר איסוף כל הנתונים, יש לשטוף את ציטומטר הזרימה על ידי הפעלת שלוש צינורות של 50% אקונומיקה, שטיפת FACS ומים אולטרה-טהורים, כל אחד למשך 5 דקות בקצב זרימה גבוה.
- לאחר מכן, מהתפריט הנפתח Cytometer , לחץ על כיבוי Fluidics.
- לפני סגירת התוכנה וכיבוי ההתקן והמחשב, ייצא את התוצאות כקבצי .fcs לכונן USB כדי להעביר ולנתח אותם, באופן הבא:
- בתוכנת הניתוח, לחץ על הלחצן NEW כדי ליצור מסמך וחלון חדשים לטיפול בניתוח. גרור את הקבצים לדוגמה לחלון החדש.
- לחץ פעמיים כדי לפתוח את הדוגמה שלא הוכתמה. בחר באוכלוסיית P1, לחץ פעמיים על אוכלוסיית P1 כדי ליצור גרף FSC-H לעומת FSC-A, ושער את אוכלוסיית התא הבודד.
- לחץ פעמיים על התאים הבודדים המגודרים כדי ליצור היסטוגרמה של אירועים כנגד הפלואורוכרום המשמש.
- בחלון המקורי, בחר P1 ותאים בודדים וגרור אותם אל כל הדגימות כך שכל הדגימות יכילו כעת את אותו gating.
- לחץ על עורך הפריסה כפתור כדי לפתוח את פריסות חלון. גרור שתי דוגמאות (בקרה ובדיקה) זו מעל זו כדי ליצור היסטוגרמה של שכבת-על.
תוצאות
היבט חשוב של גילוי ופיתוח תרופות חדשות הוא הבטחת הסלקטיביות והספציפיות של המועמד לתרופה. משמעות הדבר היא כי המועמד לתרופה צריך להיות מסוגל להפלות בין תאים שונים ולהשפיע רק על אוכלוסיית התא של עניין (סלקטיביות). סלקטיביות נחקרת באמצעות קווי תאים הנבדלים זה מזה מבחינת הביטוי של החלבון המעניין. במחקר זה, קווי התאים MDA-MB-231 ו-HEK 293T נבחרו כתאים חיוביים ל-EpCAM ו-שליליים. ספציפיות היא קביעה נוספת שמראה כי החלבון המעניין מגיב רק למועמד לתרופה אחת. כאן, על ידי שימוש באפטמר לא מחייב של EpCAM, TENN, הוכח שרק TEPP מחובר ל- EpCAM. בתאים חיוביים ל-EpCAM (MDA-MB-231), כיסוי ההיסטוגרמות המייצגות תאים שטופלו ב-TEPP וב-TENN מראה שהתאים שטופלו ב-TEPP זזים ימינה בהשוואה לתאים שטופלו ב-TENN. זה מראה את הקישור של האפתמר, TEPP, לחלבון המעניין, EpCAM (איור 4D). בתאי HEK 293T של בקרה שלילית, כיסוי היסטוגרמות של TEPP ו-TENN אינו משקף שום תזוזה (איור 4E). משמעות הדבר היא שבתאים המבטאים EpCAM, TEPP כאפטמר EpCAM המחובר לקולטן שלו, ויתרה מכך, לא נצפתה קשירה בתאים שליליים ל-EpCAM. תוצאות אלה מאשרות את הסלקטיביות והספציפיות של האפטאמר המפותח.
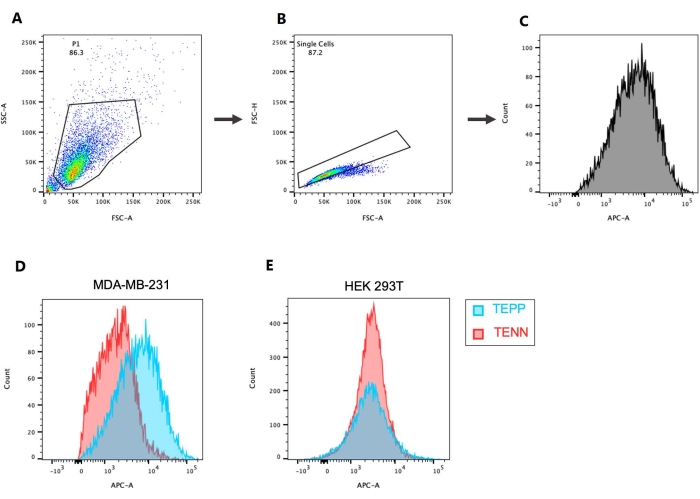
איור 4: גטינג והיסטוגרמות המראים את קשירת התאים לאפטמר. (A) בחירת אוכלוסיית התאים, (B) התאים הבודדים, ו-(C) ההיסטוגרמה של התאים המחוברים לאפטמר (200 ננומטר). משווים את הקשירה של אפטמר EpCAM (TEPP) לעומת אפטמר שאינו קושר EpCAM (TENN) בתאי EpCAM+ MDA-MB-231 ו-(E) בתאי EpCAM- HEK 293T. קיצורים: EpCAM = מולקולת הידבקות תאית אפיתליאלית; FSC-A = אזור פיזור-שיא קדימה; SSC-A = אזור פיזור צדדי; FSC-H = גובה שיא פיזור קדימה; APC = אלופיקוציאנין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
האתגר המרכזי בפיתוח אפטמרים חדשים הוא היעדר הנחיות סטנדרטיות החלות על שלבים שונים בתהליך זה. McKeague et al. הדגימו לאחרונה כמה מהאתגרים הנלווים, שמובילים להצגה לא ברורה של נתונים בפרסומים ואי שכפול המחקר. הם הציעו קווים מנחים יסודיים הדרושים לשיקול באפיון אפטאמרים19. בדיקת קשירת אפטמר היא שלב קריטי בסינון ו/או אפיון אפטמרים23, הנמצא בשימוש נרחב על ידי חוקרים בתחום. מכיוון שלא קיימת הנחיה אחת להצגת הפרוטוקול שלב אחר שלב, שיטת ציטומטריה של זרימה, המשמשת בדרך כלל לחקר קשירת חלבון האפתמר, מודגמת בפרוטוקול הווידאו הנלווה.
ישנן מספר שיטות המודדות את האינטראקציה של האפטמר ואת המטרה שלו. ציטומטריה של זרימה היא אחת השיטות הללו. דוגמאות אחרות כוללות קיטוב פלואורסצנטי, תהודה פלסמונית על פני השטח, אלקטרופורזה נימית וקלורימטריית טיטרציה איזותרמית24. בחירת השיטה הנכונה תלויה ביישום של aptamer. עם זאת, חשוב לדעת כי לכל שיטה יש את המגבלות שלה, וכי היישום של מספר מבחנים מועיל יותר לאפיון של מולקולות קטנות aptamers24. לשיטה המתוארת כאן יש מספר יתרונות. זוהי אחת השיטות האמינות, המדויקות והמדויקות ביותר, והיא גם מהירה וחסכונית. ניתן ליישם את הניתוח הציטומטרי של הזרימה של קשירת אפטמר בשלבים שונים של פיתוח אפטמר, כולל סינון מועמדים, חיתוך ואופטימיזציה, אפיון ותיקוף.
עם תיוג פלואורסצנטי, יש אפשרויות לתייג או להשתמש בפלואורסצנטיות הפנימית של המטרה או לתייג את האפטמר24. בחוויית המחברים, השימוש באפטמרים מסומנים הוא אמין וקל להתקנה. ניתן לסמן אפטאמרים עם פלואורופור בכל קצה (3' או 5')25; עם זאת, הסוף עם פחות גואנין הוא חיובי יותר, כמו guanine יכול להרוות את הפלואורסצנציה ואת הזיהוי שלה26. חסרון של שיטה זו הוא כי aptamer צריך להיות מתויג פלואורופור. יתר על כן, למרות ששיטה זו משקפת את קשירת האפטמר לחלבון הספציפי, היא אינה מציגה את מיקום אתר האינטראקציה. לפיכך, מחקרים נוספים, כגון מיקרוסקופיה פלואורסצנטית, עשויים להידרש כדי לאשר את מיקום האינטראקציה בין האפטאמר לחלבון25.
יש כמה הערות ביקורתיות שיש לקחת בחשבון בעת ביצוע בדיקה זו. חשוב לקחת בחשבון שלכל אפטמר יש דרישות ספציפיות לטיפול וקיפול. זה כולל את הבחירה של reconstitution ו דילול מאגרים ואת תנאי הקיפול. שחזור של אפטמרים ליופיליים מתרחש במים אולטרה-פוריים סטריליים מטוהרים ללא פירוגן ו-RNase. זאת כדי למזער את ריכוז היונים סביב הנוקלאוטידים. ריכוז היונים משפיע מאוד על היווצרותם של מבנים דו-ממדיים של אפטמרים ועל זיקתם ויציבותם. לפיכך, לצורך שחזור נוסף של מלאי האפטאמר, יש לנקוט בזהירות בהכנה נכונה של מאגרים אחרים ותמיסות קטיוניות מתכתיות, כגון MgCl225,27. הריכוז האופטימלי של תמיסה קטיונית מתכתית מגן על המטען השלילי של האפטמר עדיין, אינו מעכב את האינטראקציה של האפטמר עם המטרה שלו.
יתר על כן, מכיוון שלאפטאמר יש פוטנציאל לכריכה לא ספציפית, מחוץ למטרה, היישום של מאגר החסימה ממלא תפקיד קריטי בבדיקת הכריכה. בנוסף ל- BSA הטעון שלילית, המשמש בדרך כלל לנוגדנים, נדרש כאן גם DNA זרע סלמון או tRNA. תערובת זו חוסמת את החלבונים הטעונים חיובית ואת אתרי הקישור של חומצות גרעין. שלב חסימה זה חשוב במיוחד לסלקטיביות ולספציפיות של אפטמרים כלפי תאים סרטניים, בשל המטען השלילי שלהם בהשוואה לתאים נורמליים ניטרליים וטעונים חיובית28. יתר על כן, הקיפול התלת-ממדי של האפטמרים תלוי בגורמים אחרים כגון טמפרטורה. חשיבותם של התנאים המשפיעים על היווצרות התלת-ממד של האפתמר, כולל בחירת הצינור ומשך שלבי ה-PCR, נבדקה25. יתר על כן, זמן הדגירה של aptamer עם המטרה צריך להיות מותאם עבור כל aptamer ספציפי. גם טמפרטורת הדגירה חשובה ביותר. תחזוקה של טמפרטורה של 4 מעלות צלזיוס היא קריטית במיוחד עבור חלבונים על פני התא שניתן להפנים בקלות, כגון EpCAM25.
הגורם החשוב הנוסף בבדיקה זו הוא יישום של בקרות נאותות. יש להשתמש בתאים סרטניים המבטאים או לא מבטאים את חלבון המטרה כדי להעריך את הסלקטיביות של האפאמר. בכל ניסוי, בנוסף לאפטאמר המעניין, נדרש אפטמר בקרה שלילית (רצף אקראי או רצף מקושקש) כדי להראות את הספציפיות של האפטאמר. באופן אידיאלי, שליטה זו צריכה להיות באורך דומה של נוקלאוטידים ולעבור קיפול דומה כמו aptamer. בניסוי זה נעשה שימושב-10 בבקרה שלילית (TENN), אפטמר בעל מבנה דומה ל-TEPP שהוכח כבעל זיקה נמוכה ל-EpCAM.
הפרוטוקול המוצג כאן הוא מבחן איכותי וניתן להשתמש בו עוד יותר להערכה כמותית של זיקה מחייבת וקביעת קבוע הדיסוציאציה (Kd)29,30,31. עם זאת, חשוב להראות את השחזור של התוצאות באמצעות שכפולים טכניים וביולוגיים. כדי להשיג זאת, חשוב מאוד לשקול דטרמיננטות עיקריות כדי לבצע כראוי בדיקה זו. זה יכול לכלול, אך אינו מוגבל, לשימוש במספר מעבר נמוך של תאים נטולי מיקופלסמה הגדלים כראוי בתנאים האופטימליים שלהם, באמצעות מספר קבוע של תאים להיחשף עם האפטמר בכל שכפול, יישום של טמפרטורה נכונה ותנאי קיפול, שמירה על תנאי ניסוי דומים הן עבור האפטמר והן עבור הבקרה, שמירה על חשיפה מינימלית של האפטמרים לאור סביבתי, תוך שימוש בזמן חשיפה אופטימלי של תאי אפתמר וטמפרטורה, שמירה על טמפרטורה של 4 מעלות צלזיוס עבור התאים, הכוללת קירור מראש של הצנטריפוגה, צלחת 96 הבאר, וצינורות הציטומטריה של הזרימה, והכנה מדויקת של המאגרים, עם ריכוז יוני קרוב ככל האפשר לריכוזים הנטענים.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
המחברים מכירים במימון SEED של המכון לבריאות נפשית ופיזית ותרגום קליני (IMPACT), בתוכנית "מלגת מחקר פוסט-דוקטורט ע"ש אלפרד דיקין" באוניברסיטת דיקין, וב"מלגת תוכנית ההכשרה למחקר של ממשלת אוסטרליה".
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes with attached lid | Sigma-Aldrich | T6649 | |
| 15 mL CellStar blue screw cap, conical bottom tube | Greiner Bio One | 188271 | |
| 5 mL serological pipettes | Greiner Bio One | 606180 | |
| BD FACSCanto II Flow Becton Dickinson Cytometer | Becton Dickinson | N/A | |
| BD FACSDiva V9.0 | BD Biosciences | N/A | |
| Bovine Serum Albumin (BSA), Lyophilized powder | Sigma-AldrichTM | A7906-50G | |
| Bright-line Hemocytometer | Sigma-Aldrich | Z359629 | |
| Dulbecco’s Modified Eagle Medium (DMEM) High Glucose Media Powder | Life Technologies | 12100046 | |
| Dulbecco’s Phosphate- Buffered Saline (DPBS) | Life Technologies | 21300025 | |
| FlowJo, LLC 10.8.1 | BD Biosciences | N/A | |
| Foetal Bovine Serum (FBS) | Bovogen | SFBS-F | |
| HEK293T | American Type Culture Collection | ACS-4500 | |
| Heracell 150i CO2 Incubator | Thermo Fisher Scientific | N/A | |
| Heraeus Megafuge 16R Centrifuge | Thermo Fisher Scientific | N/A | |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | M8266 | |
| MDA-MB-231 | American Type Culture Collection | CRM-HTB-26 | |
| Microplate, PS, 96 well, F-bottom (Chimney well), Black | Greiner Bio One | 655076 | |
| MiniAmp Thermal Cycler | Thermo Fisher Scientific | A37834 | |
| Phosphate-Buffered Saline (PBS) tablets | Life Technologies | 18912014 | |
| Pyrogen- and RNase-free ultrapure water | Milli-Q | ||
| T75 Cell Culture flask | Cellstar | 658170 | |
| TENN | Integrated DNA Technologies | N/A | 5′-GC GCG TGCA CGC GC TA ACG GA TTCCTTT TCC GT-3 |
| TEPP | Integrated DNA Technologies | N/A | 5′-GC GCG GTAC CGC GC TA ACG GA GGTTGCG TCC GT-3′ |
| Transfer RNA (tRNA) | Sigma-Aldrich | R8508-5X1ML | |
| Trypan Blue Solution | Life Technologies | 15250061 | |
| Trypsin-EDTA | Gibco | 15400054 |
References
- Cancer. World Health Organization Available from: https://www.who.int/news-room/fact-sheets/detail/cancer#:~:text=Cancer%20is%20a%20leading%20cause.and%20rectum%20and%20prostate%20cancers (2022)
- Liu, J. K. H. The history of monoclonal antibody development - Progress, remaining challenges and future innovations. Annals of Medicine and Surgery. 3 (4), 113-116 (2014).
- Nakhjavani, M., Shigdar, S. Future of PD-1/PD-L1 axis modulation for the treatment of triple-negative breast cancer. Pharmacological Research. 175, 106019 (2022).
- Bukari, B., Samarasinghe, R. M., Noibanchong, J., Shigdar, S. L. Non-invasive delivery of therapeutics into the brain: the potential of aptamers for targeted delivery. Biomedicines. 8 (5), 120 (2020).
- Wu, X., Chen, J., Wu, M., Zhao, J. X. Aptamers: active targeting ligands for cancer diagnosis and therapy. Theranostics. 5 (4), 322 (2015).
- Feng, X., et al. The aptamer functionalized nanocomposite used for prostate cancer diagnosis and therapy. Journal of Nanomaterials. 2022, (2022).
- Huang, J., et al. Advances in aptamer-based biomarker discovery. Frontiers in Cell and Developmental Biology. 9, 571 (2021).
- Ashrafuzzaman, M. Aptamers as both drugs and drug-carriers. BioMed Research International. 2014, (2014).
- Nakhjavani, M., Samarasinghe, R. M., Shigdar, S. Triple-negative breast cancer brain metastasis: an update on druggable targets, current clinical trials, and future treatment options. Drug Discovery Today. , (2022).
- Macdonald, J., et al. Development of a bifunctional aptamer targeting the transferrin receptor and epithelial cell adhesion molecule (EpCAM) for the treatment of brain cancer metastases. ACS Chemical Neuroscience. 8 (4), 777-784 (2017).
- Macdonald, J., et al. Bifunctional aptamer-doxorubicin conjugate crosses the blood-brain barrier and selectively delivers its payload to EpCAM-positive tumor cells. Nucleic Acid Therapeutics. 30 (2), 117-128 (2020).
- Shigdar, S., Agnello, L., Fedele, M., Camorani, S., Cerchia, L. Profiling cancer cells by cell-SELEX: use of aptamers for discovery of actionable biomarkers and therapeutic applications thereof. Pharmaceutics. 14 (1), 28 (2021).
- Rahimizadeh, K., et al. Development of cell-specific aptamers: recent advances and insight into the selection procedures. Molecules. 22 (12), 2070 (2017).
- Chen, M., et al. Development of cell-SELEX technology and its application in cancer diagnosis and therapy. International Journal of Molecular Sciences. 17 (12), 2079 (2016).
- Shigdar, S., et al. The use of sensitive chemical antibodies for diagnosis: detection of low levels of EpCAM in breast cancer. PLoS One. 8 (2), 57613 (2013).
- Ni, J., et al. Role of the EpCAM (CD326) in prostate cancer metastasis and progression. Cancer and Metastasis Reviews. 31 (3), 779-791 (2012).
- Ni, J., et al. Epithelial cell adhesion molecule (EpCAM) is associated with prostate cancer metastasis and chemo/radioresistance via the PI3K/Akt/mTOR signaling pathway. The International Journal of Biochemistry & Cell Biology. 45 (12), 2736-2748 (2013).
- McKeague, M., Kruse, P. F., Patterson, M. K., et al. . Tissue Culture. , 395-397 (1973).
- McKeague, M., et al. The minimum aptamer publication standards (MAPS guidelines) for de novo aptamer selection. Aptamers. 6, 10-18 (2022).
- Schoofs, G., Van Hout, A., D'huys, T., Schols, D., Van Loy, T. A flow cytometry-based assay to identify compounds that disrupt binding of fluorescently-labeled CXC Chemokine ligand 12 to CXC Chemokine receptor 4. Journal of Visualized Experiments. (133), e57271 (2018).
- McKinnon, K. M. Flow cytometry: an overview. Current Protocols in Immunology. 120 (1), 1-11 (2018).
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglu, E. Guidelines for cell viability assays. Food Frontiers. 1 (3), 332-349 (2020).
- Ruscito, A., DeRosa, M. C. Small-molecule binding aptamers: Selection strategies, characterization, and applications. Frontiers in Chemistry. 4, 14 (2016).
- McKeague, M., et al. Comprehensive analytical comparison of strategies used for small molecule aptamer evaluation. Analytical Chemistry. 87 (17), 8608-8612 (2015).
- Henri, J., Bayat, N., Macdonald, J., Shigdar, S. A guide to using nucleic acid aptamers in cell based assays. Aptamers. 23, (2019).
- Mao, H., et al. The mechanism and regularity of quenching the effect of bases on fluorophores: the base-quenched probe method. Analyst. 143 (14), 3292-3301 (2018).
- McKeague, M., et al. Analysis of in vitro aptamer selection parameters. Journal of Molecular Evolution. 81 (5), 150-161 (2015).
- Chen, B., et al. Targeting negative surface charges of cancer cells by multifunctional nanoprobes. Theranostics. 6 (11), 1887 (2016).
- Shigdar, S., et al. RNA aptamers targeting cancer stem cell marker CD133. Cancer Letters. 330 (1), 84-95 (2013).
- Amraee, M., Oloomi, M., Yavari, A., Bouzari, S. DNA aptamer identification and characterization for E. coli O157 detection using cell based SELEX method. Analytical Biochemistry. 536, 36-44 (2017).
- Yu, X. -. X., et al. Selection and characterization of a novel DNA aptamer, Apt-07S specific to hepatocellular carcinoma cells. Drug Design, Development and Therapy. 14, 1535 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved