Method Article
שיטות אלקטרופיזיולוגיות למדידת רמות פוטופיגמנט בדרוזופילה פוטורצפטורים
In This Article
Summary
אנו מציגים פרוטוקול לאפיון אלקטרופיזיולוגי של פוטופיגמנטים דו-יציבים: (1) ניצול תזוזות המטען בתוך מולקולות הפוטוגמנט בעקבות בליעת הפוטונים וכמותם העצומה בפוטורצפטורים, ו-(2) ניצול הבדלי הספיגה-ספקטרום של מצבי הפוטוגמנט של רודופסין ומטרהודופסין. פרוטוקולים אלה שימושיים לסינון מוטציות המשפיעות על מערכות פוטופיגמנט דו-יציבותיות.
Abstract
רודופסין פוטופיגמנט מצומד לחלבון G של דרוזופילה G (R) מורכב מחלבון (אופסין) ומכרומופור. תהליך ההפעלה של רודופסין מתחיל על ידי איזומריזציה הגורמת לספיגת פוטונים של הכרומופור, מקדמת שינויים קונפורמיים של האופסין וגורמת למצב פוטופיגמנט שני יציב כהה (metarhodopsin, M). חקירת פוטופיגמנט דו-יציב זה באמצעות מוטגנזה אקראית דורשת שיטות פשוטות וחזקות לסינון זבובים מוטנטיים. לכן, תוכננו מספר שיטות למדידת הפחתה ברמות הפוטופיגמנט התפקודיות. שיטה אחת כזו מנצלת את תזוזות המטען בתוך הפוטופיגמנט לאחר בליעת הפוטונים ואת הכמויות העצומות של מולקולות הפוטופיגמנט המבוטאות בפוטורצפטורים. אות חשמלי זה, המכונה פוטנציאל הקולטן המוקדם (או זרם הקולטן המוקדם), נמדד על ידי מגוון שיטות אלקטרופיזיולוגיות (למשל, אלקטרורטינוגרמה ורישומי תאים שלמים) והוא פרופורציונלי באופן ליניארי לרמות פוטופיגמנט תפקודיות. היתרונות של שיטה זו הם יחס האות לרעש הגבוה, מדידה ליניארית ישירה של רמות הפוטופיגמנט ועצמאות של מנגנוני פוטו-טרנסדוקציה במורד הזרם להפעלת רודופסין או מטרהודופסין. שיטה אלקטרופיזיולוגית נוספת הנקראת דפולריזציה ממושכת (PDA) מנצלת את היציבות הדו-כיוונית של פוטופיגמנט דרוזופילה ואת ההבדלים הקליטה-ספקטרליים של מצבי פיגמנט R ו-M של זבובים. ה-PDA מושרה על ידי אור כחול עז, הממיר כמויות רוויות של רודופסין למטרהודופסין, וכתוצאה מכך כישלון של סיום תגובת האור למשך זמן ממושך בחושך, אך ניתן לסיים אותו על ידי המרת מטרהודופסין לרודופסין באמצעות אור כתום עז. מכיוון שה-PDA הוא אות חזק שדורש המרת פוטופיגמנט מסיבית, אפילו פגמים קטנים בביוגנזה של הפוטופיגמנט מובילים לזיהוי בקלות של מחשב כף יד חריג. ואכן, מוטציות PDA פגומות הובילו לזיהוי חלבוני איתות חדשניים החשובים לפוטו-טרנסדוקציה.
Introduction
הרודופסין המופעל באמצעות אור (R), שהוא קולטן מצומד לחלבון G (GPCR), מורכב מחלבון 7 טרנס-ממברנה (opsin) וכרומופור. ב-Drosophila melanogaster (זבוב הפירות) ספיגת הפוטונים גורמת לאיזומריזציה של כרומופור הרשתית 11-cis-3-OH ל-all-trans-3-OH-רשתית1, מה שמקדם את השינוי הקונפורמי של הרודופסין למטרהודופסין (M, איור 1A). שלא כמו רודופסין של בעלי חוליות, החלק השולט של כרומופור חסרי חוליות אינו מתנתק מהאופסין, וכתוצאה מכך מצב הפיגמנט הכהה-יציב הפעיל מבחינה פיזיולוגית M. בתורו, ספיגת פוטון נוספת על ידי כרומופור הרשתית all-trans-3-OH גורמת לאיזומריזציה של הכרומופור 2,3, ויוצרת את מצב הפיגמנט R עם כרומופור הרשתית 11-cis-3-OH. מצב R הוא פוטופיגמנט כהה, יציב ולא פעיל מבחינה פיזיולוגית. בנוסף לנתיב התחדשות הפוטונים המהיר ביותר של הכרומופור4, בדומה לפוטופיגמנטים של בעלי חוליות, קיים מסלול איטי אנזימטי חלופי להתחדשות כרומופורים אצל חסרי חוליות, שבו חלק מהשלבים מבוצעים בתאי רשתית המקיפים את תאי הפוטורצפטורים 5,6.
דרוזופילה טומנת בחובה יתרונות גדולים כאורגניזם מודל לחקר פוטורצפטורים חסרי חוליות. בפרט, הנגישות של ההכנה והיכולת ליישם גנטיקה מולקולרית הפכו את Drosophila למערכת מודל חזקה7. לפיכך, נקבעו מספר שיטות ניסיוניות in vivo ו- ex vivo לחקר פוטו-טרנסדוקציה בכלל ורמות פוטופיגמנט, בפרט. שיטת in-vivo הפשוטה ביותר מנצלת את תגובת המתח החוץ-תאית הגדולה יחסית שנרשמה לאור של עין דרוזופילה. בהתאם לכך, גירוי האור מעורר תגובת מתח חשמלית בעין כולה שניתן למדוד באמצעות הקלטת אלקטרורטינוגרמה חוץ-תאית (ERG), הגדולה בכ-3 סדרי גודל מתגובת ה-ERG לאור של עיניים של בעלי חוליות 8,9. תגובת Drosophila ERG חזקה ומתקבלת בקלות, מה שהופך אותה לשיטה נוחה לזיהוי חריגות בתגובת האור עקב מוטציות. תגובת ה-ERG לאור נובעת בעיקר מהפוטורצפטורים, מתאי הפיגמנט (גליה) ומהנוירונים המשניים של הלמינה (ראו איור 1B). המרכיבים העיקריים של ה-ERG הם (i) תגובת המתח החוץ-תאית של הפוטורצפטורים, (ii) החולפים "on" ו-"off" בתחילתו ובסיומו של גירוי האור הנובעים מתאי העצב של הלמינה (איור 2A, inset, ON, OFF), (iii) התגובה האיטית של תאי הגליה (איור 2A, inset, חצים), ו-(iv) התגובה הקצרה והחולפת, כתוצאה מתזוזת מטען במהלך הפעלת פוטופיגמנט שקדמה ל-ON ארעי10 (איור 2C [inset], D, E). תגובה קצרה זו מורכבת משני שלבים (M1 ו-M2, איור 2C [inset]) וניתן להשרות אותה רק על ידי גירוי אור חזק במיוחד, שמפעיל בו-זמנית מיליוני מולקולות פוטופיגמנט. הוא לא נצפה תחת גירוי כחול (איור 2D, עקבות כחולים) וגם לא אצל מוטנטים עם רמות פוטופיגמנט מופחתות מאוד (איור 2E, עקבות אדומים), אבל המשרעת שלו משופרת מעט במוטציה שמבטלת את פעילות ה-PLC (איור 2E, עקבות כתומים). שלב M1 הוא ERP טיפוסי של הזבוב הנובע מהפעלת M בפוטורצפטורים. פאזת M1, שיש לה קוטביות חיובית (תוך תאית), משחררת מוליך עצבי בדרך הרגילה בסינפסה הפוכה של סימנים ומפעילה את נוירוני הלמינה, המגיבים לדה-פולריזציה של פוטורצפטור על ידי יצירת שלב M2 המוגברת מבחינה סינפטית. לפיכך, הן שלב M1 והן שלב M2 משקפים הפעלת M10,11.
הדה-פולריזציה של הפוטורצפטור יוצרת את ה-"on" החצי-חיובי-חיובי של הקרנית, הנובעת מהסינפסה ההפוכה בין האקסון הפוטורצפטור לבין הנוירונים המונופולריים של הלמינה10,11 (איור 1B). העלייה האיטית והדעיכה של ה-ERG נובעות מדה-פולריזציה של תאי הפיגמנט (איור 2A, אינסט, חצים) בעיקר כתוצאה משטף K+ מתאי הפוטורצפטור12 דרך פוטנציאל הקולטן הארעי (TRP) ותעלות דמויות TRP (TRPL) 13,14,15. רכיבים קינטיים איטיים אלה מסתירים ומעוותים במידה רבה את צורת הגל של תגובת הפוטורצפטור בהשוואה להקלטות תוך-תאיות או של תאים שלמים של תגובת הפוטורצפטור לאור 9,10. בנוסף, בהארות חזקות מאוד, ניתן לראות תגובה חולפת נוספת, שקדמה ומתמזגת באופן חלקי עם הארעי "on", (איור 2C [inset],D,E). אות זה מקורו ישירות בהפעלה המסיבית של הפוטופיגמנט10.
מספר פרוטוקולים של משטר אור באמצעות צפיפות ניטרלית (ND) ומסנני צבע, כמו גם הבזקי תאורה חזקים, פותחו כדי לחקור את העין בכלל ואת מפל הפוטו-טרנסדוקציה בפרט. פרוטוקולים אלה שימשו גם כדי לחקור את המאפיינים של הפוטוגמנט.
פרוטוקול תגובת העוצמה מודד את משרעת השיא של תגובת מתח ה-ERG של העין כולה לעוצמות אור הולכות וגדלות (איור 2A,B). פרוטוקול זה מסייע באיתור שינויים ברגישות של תאי הפוטורצפטור לאור9.
פרוטוקול האפטר-פוטנטי הממושך של דה-פולריזציה (PDA) מנצל את ההבדלים בספקטרום הספיגה של רודופסין ומטרהודופסין המאפשר, בדרוזופילה, המרה פוטופית מסיבית של R למצב M הבינוני הפעיל מבחינה פיזיולוגית והיציב-כהה שלו2. בתגובת המתח ERG ניתנת פעימה קצרה יחסית של אור רווי, ותגובת המתח המתקבלת נרשמת. בתנאי זה, תקרה (פוטנציאל היפוך) מושגת על ידי אות הדפולריזציה מכיוון שהפעלת שבריר אחוז מהכמות העצומה של מולקולות רודופסין (~1 x 108) מספיקה כדי להגיע לתקרה. נוכחותם של רכיבי הפוטו-טרנסדוקציה בשפע רב מבטיחה כי תקרה זו תושג גם אצל מוטנטים עם ירידה משמעותית בריכוז או תקלה עדינה ברכיבי הפוטו-טרנסדוקציה. מצב זה מונע את בידודם של מוטנטים אלה. Pak et al. הציגו את בדיקת ה-PDA7 בחיפוש אחר בדיקה אמינה וחושפנית לבידוד מוטנטים חזותיים. בדרוזופילה, תגובת ה-PDA נגרמת על ידי הסרה גנטית של פיגמנט ההקרנה האדום, המאפשר המרת פוטופיגמנט, ויישום של אור כחול, אשר נספג באופן מועדף על ידי רודופסין (איור 3A), ובכך מביא להמרה נטו גדולה של ה-R למצב הפוטופיגמנט M. סיום הפוטו-טרנסדוקציה משובש ברמת הפוטופיגמנט על-ידי המרה נטו גדולה של R ל-M, שבתורה גורמת לעירור מתמשך הרבה אחרי שהאור כבוי (איור 2C, איור 4A [למעלה]). במהלך תקופת ה-PDA, הפוטורצפטורים רגישים פחות לנורות הבדיקה הבאות והם חסרי רגישות חלקית (ללא פעילות). ה-PDA מזהה אפילו פגמים קלים בביוגנזה של רודופסין ובודק את הקיבולת המקסימלית של תא הפוטורצפטור כדי לשמור על עירור למשך תקופה ממושכת. מאז זה תלוי לחלוטין בנוכחות של ריכוזים גבוהים של רודופסין, זה בקלות ציונים עבור חידוש לקוי של רכיבי phototransduction. למרבה הפלא, מסך ה-PDA הניב הרבה מוטנטים חזותיים חדשים וחשובים מאוד (שנסקרו ב-Pak et al.7). לפיכך, מוטציות ה-PDA שבודדו על ידי Pak et al.7 עדיין שימושיות ביותר לניתוח מערכת הראייה של דרוזופילה .
ה-PDA מושרה בדרוזופילה על-ידי הרוויה של אור כחול, וכתוצאה מכך נוצרת דה-פולריזציה רציפה זמן רב לאחר היסט האור (איור 4A [למעלה]). לאחר רוויית האור הכחול הגורם ל-PDA, הפוטורצפטורים ההיקפיים (R1-6) נשארים פעילים ברציפות בחושך בקיבולת המרבית שלהם, ומגיעים לרוויה. אורות כחולים רוויים נוספים במהלך ה-PDA אינם מייצרים תגובה נוספת בתאי R1-6 למשך שניות רבות, אלא גורמים לתגובה בתאי R7-8 שמונחת על גבי ה-PDA. התגובות העל-טבעיות מוסברות על ידי ספקטרום הספיגה השונה של הפוטופיגמנטים המתבטאים בתאים אלה (R7-8)16. ניתן להדחיק את ה-PDA על-ידי היפוך פוטו-קונטקסט של M בחזרה ל-R עם אור כתום רווי (איור 4A [למעלה]). היכולת של ה-PDA להביא את תאי הפוטורצפטור ליכולת הפעילה המקסימלית שלהם, מצב שלא ניתן להשיג על ידי אור לבן עז, מסבירה מדוע הוא היה כלי מרכזי לסינון מוטציות חזותיות של דרוזופילה. הסיבה לכך היא שהיא מאפשרת זיהוי של אפילו פגמים קלים בחלבונים המעורבים בביוגנזה של רמות פוטופיגמנט תקינות 17,18. שתי קבוצות של מוטנטים פגומים ב-PDA בודדו: לא מוטנטים של אי-פעילות ולא מוטנטים של אפטר-פוטנטים (נינה) והשבתה, אך לא מוטנטים אפטר-פוטנטיים (ina). הפנוטיפ של הראשון הוא היעדר PDA וההשבתה הנלווית הנובעת מירידה גדולה ברמות הפוטופיגמנט (איור 4A [באמצע]). הפנוטיפ של האחרון מראה חוסר פעילות אך אין דה-פולריזציה כהה לאחר אור כחול עקב מנגנון שעדיין לא ידוע במוטציה עם רמות רודופסין נורמליות אך חסרים חלבונים המקיימים אינטראקציה עם תעלות ה-TRP (איור 4A [למטה]).
ה-PDA נובע מההבדל בכמות הפוטופיגמנט ביחס לעצרין (ARR2), אשר קושר ומסיים פעילות M 19,20,21 (איור 1A). בפוטורצפטורים של דרוזופילה, כמות הפוטופיגמנט גדולה בערך פי חמישה מכמות ARR219. לפיכך, רמות ARR2 אינן מספיקות כדי להשבית את כל מולקולות ה-M הנוצרות על ידי פוטו-קונברסיה נטו גדולה של R ל-M, מה שמשאיר עודף של M פעיל כל הזמן בחושך 17,19,20,22,23. מנגנון זה מסביר את חיסול תגובת ה-PDA על ידי מוטציות או על ידי מניעת קרוטנואידים24,25, מה שגורם לירידה ברמת הפוטוגמנט, אך אינו משפיע על רמות העצורים. יתר על כן, הסבר זה מסביר גם את הפנוטיפים של אלל מוטנטי ריק ARR2 (arr23)21, שבו ניתן להשיג PDA בעוצמות אור כחול עמום פי 10 בערך 19,20,21 (איור 4B,C). ה-PDA אינו מאפיין ייחודי של פוטורצפטורים של זבובים, והוא מופיע בכל מין שנבדק שיש לו M יציב כהה עם ספקטרום בליעה שונה מזה של מצב R, מה שמאפשר היפוך פוטו-קונסטרוקטיבי מספיק של הפוטופיגמנט ממצב R למצב M. מין שנחקר ביסודיות ובו התגלתה הפנומנולוגיה של ה-PDA הוא הפוטורצפטור הברנקלי (Balanus), שבו ספקטרום הבליעה של מצב R נמצא באורך גל ארוך יותר ממצב M2 (איור 3B). לפיכך, בניגוד למצב בזבוב, בברנקל, אור כתום-אדום גורם ל-PDA, בעוד שאור כחול מדכא את ה-PDA2.
פרוטוקול פוטנציאל הקולטן המוקדם (ERP) מנצל את תזוזת המטען המתרחשת במהלך הפעלת R או M. הפיגמנט הראייתי הוא חלק בלתי נפרד מממברנת פני השטח של תא האיתות של ממברנות בעלי החוליות וחסרי החוליות3. בהתאם לכך, תהליך ההפעלה שבו מולקולות הפוטופיגמנט משתנות ממצב ביניים אחד למשנהו מלווה בתזוזת מטען 4,26. מכיוון שמולקולות הפוטופיגמנט מיושרות חשמלית במקביל לקיבוליות הממברנה4, שינוי קונפורמציה מסונכרן מהיר יוצר שינוי קיטוב מהיר של קרום פני השטח, אשר, בזבובים, מתרחש בתא האיתות המורכב מערימה של כ-30,000-50,000 מיקרו-וילי הנקראת rhabdomere. קיטוב זה פורק באופן פסיבי דרך קיבוליות הממברנה של גוף התא עד שקרום התא מקוטב באותה מידה. ה- ERP הוא ההקלטה החוץ-סלולרית של תזוזת המטען. ה-ERP המתועד באופן תוך-תאי מבטא את ה-ERP החוץ-תאי המשולב בקבוע הזמן של קרום התא 4,27,28. את הזרם המופעל על ידי תזוזת מטען הפיגמנט הראייתי ניתן למדוד גם בהקלטות של מהדק מתח של תאים שלמים29,30 (איור 5A-D), עם היתרון העיקרי (בהקלטות זרם קולטן מוקדם (ERC) של מזעור ההשפעה של קיבוליות הממברנה על הקינטיקה של האות.
פרק הפרוטוקול מתאר כיצד לבצע מדידות ERG ממדידות עין9 ו-ERC של דרוזופילה על ידי הקלטות של תאים שלמים מדרוזופילה מבודדת אומטידיה31,32. אנו מתארים גם פרוטוקולים ספציפיים המשמשים לחקר פוטו-טרנסדוקציה בכלל ופוטופיגמנטים בפרט.
Protocol
1. מדידת הקשר בין תגובת העוצמה, דה-פולריזציה ממושכת של האפטרפוטנציאל (PDA) ופוטנציאל הקולטן המוקדם (ERP) באמצעות האלקטרורטינוגרמה
- תנאי גידול מתאימים להכנת ד. מלנוגסטר
- העלאת זבובים D. melanogaster בבקבוקים המכילים תירס צהוב סטנדרטי המכיל מזון באינקובטור המתוחזק בטמפרטורה של 24 מעלות צלזיוס ובמחזור חשוך/אור של 12 שעות
- שמור את בקבוקי הזבובים בחושך לפחות 24 שעות לפני הניסוי.
- הגדרה כללית
- הכינו פיפטות הקלטה על ידי משיכת נימי זכוכית בורוסיליקט מלאים בסיבים בגודל 1 מ"מ x 0.58 מ"מ (O.D x I.D) (איור 6L, O). ההתנגדות של הפיפטות צריכה להיות 5-10 MΩ; ניתן להשתמש בכל מושך מתאים.
- מצפים שני חוטי כסף עם AgCl2, ומכניסים חוט כסף 0.25 מ"מ לפתרון KCl של 3 M המחובר לספק כוח 5 וולט בהתאמה אישית.
- הכנס כל חוט כסף מצופה למחזיקי האלקטרודות (איור 6N).
- מלאו את נימי הזכוכית בתמיסת רינגר מסוננת (ראו טבלה 1) באמצעות מזרק קצה מוארך (איור 6M).
- הכנס את אלקטרודת החוט לתוך נימי הזכוכית. ודא שהתמיסה בתוך הנימים נמצאת במגע עם חוט הכסף.
- הכנס את מחזיקי האלקטרודות (איור 7P, N) לשני המיקרומניפולטורים של האלקטרודות (איור 7G).
- נוהל הכנת הזבוב להקלטות חשמליות
הערה: כדי לשמור על הזבוב בתנאים המותאמים לחושך, השתמש רק בהארת אור אדום עמום במהלך השלבים הבאים.- מרדימים את הזבובים בבקבוק באמצעות גז CO2 באמצעות מערכת השינה של הזבובים (איור 6A, B) ושופכים אותם לתוך מיכל השינה.
- בחר זבוב אחד והחזק אותו בזהירות בכנף שלו באמצעות פינצטה חדה. מכסים את שאר הזבובים בצלחת פטרי.
- מקם את הזבוב על מחזיק הזבוב בכיוון הנכון - שוכב על צדו, כשגבו לכיוון היד (איור 6P).
- הפעל את ספק הכוח של ברזל ההלחמה. הגדר את הזרם ל~ 2.25 A. זרם זה אמור לחמם את חוט הפלטינה-אירידיום בקוטר 0.25 מ"מ ל-55-56 מעלות צלזיוס (ראו קובץ משלים).
- הניחו טיפת שעווה עם טמפרטורת התכה נמוכה (כ-55-56 מעלות צלזיוס) על הברזל המלחים (איור 6F).
- באמצעות פינצטה, הרימו את הזבוב מכנפיו וקבעו את כנפיו למחזיק הזבובים (איור 6I) באמצעות ברזל ההלחמה.
- באמצעות מגהץ ההלחמה, חברו את גב הזבוב למשטח העמידה באמצעות שעווה (איור 6P).
- הורידו את קצה הברזל ההלחמה לנקודת החיבור של הרגליים והמיסו את השעווה כדי לכסות את כל הרגליים יחד (איור 6P).
- הניחו טיפת שעווה קטנה בין הראש לגב באזור הצוואר (איור 6P).
הערה: יש להקפיד במיוחד כדי למנוע התחממות יתר של ראש הזבוב. ודא שהזבוב קבוע כראוי ואינו מסוגל לזוז במהלך הניסוי; תנועות קלות עשויות ליצור חפצים בהקלטות. יש לוודא כי פתחי קנה הנשימה (פתחי הנשימה) בבית החזה ובבטן אינם מכוסים בשעווה. - הניחו את מחזיק הזבוב (איור 7Q) בכלוב פאראדיי כהה על גוש מגנטי (איור 7I) וודאו שהזבוב נמצא במרחק של כ-5 מ"מ מקצה מדריך האור (איור 7L).
- מקם את אלקטרודת ההקלטה (איור 7P) מעל עין הזבוב ואת אלקטרודת הקרקע (איור 7N) מעל גבו העליון של הזבוב באמצעות המיקרומניפולטורים.
- הכנס את אלקטרודת הקרקע לחלק האחורי של הזבוב באמצעות המיקרומניפולטורים.
- הכנס את אלקטרודת ההקלטה לפריפריה החיצונית של עין הזבוב, רצוי, באמצעות המיקרומניפולטורים.
הערה: לאחר החדרת האלקטרודה לעין, תיראה גומה קטנה; למשוך את האלקטרודה כלפי מעלה מבלי להסיר אותה מהעין עד שהגומה נעלמת. האלקטרודות יכולות גם להיות שקועות בטיפות קטנות של ג'לי אלקטרודות המופעלות על פלג הגוף העליון והעין.
- פרוטוקול תגובת עוצמה
- הניחו מסנן כתום (מסנן קצה 590) מול מנורת ה-Xenon בלחץ גבוה. השתמש במסנן גדול (שישה סדרי גודל) המחליש את הצפיפות הניטרלית (ND).
- המתן 60 שניות בחושך ותן דופק אור של 5 שניות.
- החלף את מסנן ה- ND במסנן ND פחות מחליש בסדר גודל אחד של דרגות גודל.
- המתן 60 שניות בחושך ותן דופק אור שני של 5 שניות.
- חזור על שלבים 1.4.1.-1.4.4, תוך הגדלה הדרגתית של עוצמת האור באמצעות מסנני ND פחות מנחילים (יש ליצור את הפולס האחרון ללא מסנן ND כלל). הקפידו להשתמש בסדרת מסנני ה-ND בכיוון הנכון, החל מהנחתה גדולה והגיעו להנחתה נמוכה.
- פרוטוקול PDA (פרוטוקול זה יכול להתבצע רק על זבובים בעלי עיניים לבנות)
- תן פולס אור של 5 שניות בעוצמה מקסימלית באמצעות מסנן כתום (מסנן קצה 590, כדי להמיר פוטופיגמנט מקסימלי למצב R).
- החלף את המסנן הכתום במסנן כחול בפס רחב (BP450/40 ננומטר) ותן שלוש פעימות אור של 5 שניות בעוצמה מרבית.
הערה: ניתן גם לתת פולס אור כחול ארוך בעוצמה מרבית רציפה עד לתגובת מתח במצב יציב. - המתן 60 שניות בחושך, החלף את המסנן הכחול במסנן הכתום הקודם, ותן שני פולסים קלים של 5 שניות עם מרווחים של 60 שניות.
- פרוטוקול ERP/M-potential למדידת ספקטרום שיווי המשקל של תמונה של M (פרוטוקול זה יכול להתבצע רק על זבובים בעלי עיניים לבנות10,25)
- תן פולס אור כחול רציף (BP) 450/40 ננומטר) עד שתגיע לתגובת מתח במצב יציב, הממירה את הכמות המרבית של פוטופיגמנט ממצב R למצב M של תאי R1-6.
- תן הבזק אור עז קצר (<3 אלפיות השנייה) באורך גל בין 350-700 ננומטר (ספקטרום הבליעה הידוע של פוטופיגמנט תאי R1-6) באמצעות מסנני פס פס צרים (~ 20 ננומטר) ומדוד את משרעת השיא של שלב M1 של התגובה הפוטנציאלית M1 (המשקפת את בליעת המטארודופסין באורך גל ספציפי זה בשיווי משקל פוטו10,25).
הערה: להפעלה סינכרונית של מאגר גדול של מולקולות פוטופיגמנט, נדרש הבזק אור קצר ואינטנסיבי כדי שתכולת הפוטונים תיארז במשך זמן קצר. פוטנציאל M מורכב משני מרכיבים: M1 (פאזה שלילית של הקרנית), המשקף את תזוזת המטען של המטרהודופסין בפוטורצפטור, ו-M2 (פאזה חיובית של הקרנית 11,33), המשקף את תגובת M1 המוגברת של הפוטורצפטורים בלמינה 9,10,11 . ניתן לזהות ולמדוד כל אחד מרכיבים אלה. עם זאת, עדיף למדוד את פוטנציאל M1 שכן הוא ביטוי ליניארי ישיר של רמות M. אם נעשה שימוש ב-M2, ודא שהאמפליטודה שלו נמצאת בטווח הליניארי על ידי שימוש בחסך קרוטנואידיםקל 24,25. - תן שוב פולס אור כחול רציף (BP450/40 ננומטר), ולאחר מכן הבזק אור עז קצר (<1 אלפיות השנייה) באורך גל שונה.
- חזור על פרוטוקול זה עד שכל ספקטרום הקליטה של M בשיווי משקל תמונה יכוסה.
2. פרוטוקול ERC למדידת ספקטרום הפעולה של מצבי R ו-M של תאי R1-6 באמצעות הקלטות מהדקי מתח של תאים שלמים
הערה: לפרוטוקול מפורט לשימוש בהקלטות מהדקי מתח של תאים שלמים, ראו כץ ואח' 34. פוטנציאל M משתמש ב- ERG כדי למדוד את ההפעלה של מצב M רק משום שהתרומה של מצב R מדוכאת על ידי קיבוליות הממברנה. לעומת זאת, ה-ERC מודד את ההפעלה של שני מצבי R (ERC חיובי) ו-M (ERC שלילי) מכיוון שהקלטות מהדקי מתח מסירות את ההשפעה של קיבוליות הממברנה (ראו הקדמה).
- המרת הפוטוגמנט למצב הרצוי (R או M). עבור המרת R עד M, ראשית, התאימו את הזבובים על ידי הבזק קצר (<1 אלפיות השנייה) כחול אדפטיבי (BP450/40 ננומטר). להמרת M עד R, תן הבזק כתום אדפטיבי קצר (מסנן קצה OG590).
- תן הבזק אור קצר (<1 אלפיות השנייה) של אורך גל בין 350-700 ננומטר ומדוד את המשרעת השלילית או החיובית המקסימלית של תגובת ה-ERC, המשקפת את בליעת ה-M/R באורך גל ספציפי זה.
הערה: להפעלה סינכרונית של מאגר גדול של מולקולות פוטופיגמנט, נדרש הבזק אור קצר ואינטנסיבי כדי לארוז את תוכן הפוטונים בפרק זמן קצר. ההמרה המקסימלית של פוטופיגמנט מ-R ל-M על ידי הבזק כחול יכולה להגיע לכ-80% מסך מולקולות הפוטופיגמנט בגלל החפיפה בספקטרום הקליטה של R ו-M (איור 3A). לכן, באורכי גל הנמוכים מ-550 ננומטר, ל-ERC יש שני מרכיבים: פאזה שלילית המשקפת את התגובה של המטארודופסין, ופאזה חיובית המשקפת את התגובה של הרודופסין הנותרים. ה-ERC תלוי באופן ליניארי בעוצמת האור (איור 5D). לפיכך, כדי לגזור את הרגישות הספקטרלית של מצבי R ו-M, יש לנרמל כל פאזה של ה-ERC באורכי הגל השונים עבור אנרגיה שווה29. - חזור על שלבים 2.1.-2.2. באמצעות הבזקים של אורכי גל שונים.
- התוויית ה-ERC החיובית והשלילית המנורמלת כפונקציה של אורך הגל.
הערה: ההבזק החזק של האור משרה זרם מסיבי דרך הערוצים הרגישים לאור, מה שמוביל ללחץ מטבולי על הפוטורצפטור, אשר בתורו גורם לפתיחת תעלה שאינה תלויה באור. ה-ERC מונח על גבי הזרם המכונן הזה.
תוצאות
איור 2 מדגים את החוסן והקלות של השימוש בטכניקת ERG. הוא חזק משום שהוא נרשם בזבוב הכמעט שלם על ידי טכניקה פשוטה של הקלטות מתח חוץ-תאיות הדורשות מערך אלקטרופיזיולוגי פשוט. החוסן מתבטא בהשגת הקלטות של תגובות אור עם משרעת גדולה יחסית (בטווח המיליוולט) גם כאשר מוטציות מפחיתות או מעוותות מאוד את תגובת האור. לכן, אפילו נסיינית חסרת ניסיון יכולה להשתמש במערך הניסוי הפשוט ביותר וללמוד כיצד להשיג תוצאות משמעותיות תוך מספר ימים. המטרה העיקרית של הטכניקה שנועדה למדוד רמות פוטופיגמנט מושגת על ידי שיטות פשוטות ביותר של מחשב כף היד (איור 2C) ו-ERP (איור 2C-E). החלופה, כלומר מיקרו-ספקטרופוטומטריה, דורשת ציוד אופטי יקר והכשרה ומיומנות ניכרות (איור 3B). ה-ERC (איור 5A-D), למרות שהוא מאתגר מבחינה טכנית, הוא פחות רגיש לשימור תאים; הוא מאופיין ביחס אות לרעש גבוה וחיסול קיבוליות הממברנה.

איור 1: המחזור הפוטוכימי: ההפעלה וההשבתה של הפוטופיגמנט. (A) הארה כחולה רוויה (חץ כחול גלי) פוטו-קונברסת את רודופסין (R) למטרהודופסין (M). זרחון מרובה של M על ידי רודופסין קינאז והקשירה שלאחר מכן של arrestin 2 (ARR2) משביתים את M. אור כתום (חץ אדום גלי) פוטוס-קונברציה ללא זרחון M בחזרה ל-R. ה-M הלא-זרחני מפעיל את חלבון ה-G ההטרוטרימרי (Gqαβγ), וגורם לדיסוציאציה של Gqα מ-Gqβγ ולהחלפת התמ"ג המאוגד עם GTP ציטופלסמי. לאחר מכן, Gq α-GTP מפעיל את פוספוליפאז C (PLC), אשר מבצע הידרוליזה של PIP2 לדיאקילגליצרול (DAG) ואינוזיטול טריספוספט (IP3), ובכך מפעיל את תעלות ה-TRP/TRPL בצורה שעדיין לא ברורה. Ca2+ קינאז תלוי קלמודולין (CaMKII) פוספורלאטים של קומפלקס M pp-ARR2 ועובר אנדוציטוזה תלוית קלתרין והשפלה. תאורה עם אור כתום (חץ אדום גלי) הופכת את קומפלקס M pp-ARR2 ל-Rזרחני (R pp), ומשחררת את ARR2 לציטוזול. R זרחני (Rpp) עובר דה-פוספורילציה על ידי רודופסין פוספטאז (rdgC), ומייצר R מוכן למחזור נוסף של הפוטופיגמנט. (B) פרופיל עומק של ERG של זבוב לבן עיניים לגירוי לבן של 1 שניות (עמודה מרכזית) או מבזק סטרוב לבן (עמודה ימנית). גירויים מסומנים על ידי סורגים או נקודות מתחת לעקבות. העקבות מסודרים אנכית לפי סדר העומק, כאשר העקבות העליונים מתועדים כ-10 מיקרומטר מתחת לקרנית, כאשר כל אחד מהם רושם לאחר מכן 25 מיקרומטר עמוק יותר מהאחרון. משמאל מצלמה לוסידה ציור של קטע מקביל דרך עין אחרת, המציין רשתית, קרום מרתף (BM), קליפה למינרית, מחסניות למינריות (מחולקות באופן אלכסוני) וקליפה medullar. נתון זה שונה מסטיבנסון ופאק11. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: הקלטות אלקטרורטינוגרם (ERG) של תגובות אור מסוג פראי לבן עיניים (w1118) ודרוזופילה מוטנטית המראים את הקשר בין עוצמה לתגובה, דפולריזציה ממושכת של אפטרפוטנציאל (PDA) ופוטנציאל מטא-רהודופסין (M-potential). (A) יחסי עוצמה-תגובה של זבוב WT (w1118) המתקבל על ידי סדרה של אורות כתומים (מסנן קצה OG590, האנרגיה הכוללת הנפלטת מקצה מדריך האור באמצעות המסנן הכתום הייתה 4 mW ) עם עוצמת אור גוברת המסומנת בסולם -log. הכניסה מציגה את התגובה שצוינה על ציר זמן מהיר יותר. Inset: המרכיבים העיקריים של ה-ERG הם תגובת המתח החוץ-תאית של הפוטורצפטור (פוטנציאל הקולטן), הארעיים "on" ו-"off" (תגובת ON, OFF) בתחילת ובסוף גירוי האור, והתגובה האיטית של תאי הגליה (חצים). (B) משרעת השיא הממוצעת של תגובות ה-ERG משורטטת כפונקציה של עוצמת אור יחסית. (C) ה-ERP של זבוב WT (w1118) הושג על ידי יישום של אור כחול רווי (BP450/4 ננומטר, האנרגיה הכוללת שנפלטה מקצה מדריך האור באמצעות המסנן הכחול הייתה 1 mW) שמשרה בתחילה מחשב כף יד. ה- ERP (inset) הושג על ידי הבזק ירוק אינטנסיבי (~ 70 J, 2 אלפיות השנייה) (חץ, מסנן הפרעות בפס רחב של 550 ננומטר), אשר דיכא את ה- PDA. Inset: הרכיבים השונים של ה- ERP כוללים את פוטנציאל ה- M1 השלילי של הקרנית ואת פוטנציאל M2 החיובי, כפי שצוין. כמו כן מצוין שאריות על זמניות (תגובת "ON"). (ד-ה) המרת פוטופיגמנט נדרשת עבור אינדוקציה של פוטנציאל M: (D) פוטנציאל M הושג על ידי הבזק ירוק (מסנן הפרעה בפס רחב של 550 ננומטר) לאחר התאמה כחולה אך לא על ידי הבזק כחול (BP450/4 ננומטר) לאחר התאמה כחולה בזבוב WT (w1118). (E) הפרוטוקול של D חזר על עצמו ב-WT (w1118 , עקבות שחורים) ובשני זבובים מוטנטיים (מוטציה אפסית PLC, norpAP24, עקבות כתומים, ומוטנט רודופסין היפומורפי, נינהP318, עקבות אדומים). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: ספקטרום ספיגה של פוטופיגמנטים של זבובים וברנקלים. (A) ספקטרום ספיגה יחסי של רודופסין זבוב (R) ומטרהודופסין (M) המחושב ממדידות פוטומטריות של ספקטרום ההפרשים וספקטרום הפוטו-שיווי משקל. נתון זה שונה מסלינג'ר ומינקה35. (B) שתי נומוגרמות Dartnall עם אורכי גל שיא של 492 ננומטר ו-532 ננומטר, עם יחס של קליטת שיא של 1.63:1, בהתאמה. ההבדל בין עקומות אלה נותן את ההתאמה הטובה ביותר לספקטרום ההפרשים שנמדד מהאוקלי של הברנקל Balanus eborneus, המתקבל על ידי מדידות שידור בטווח של 400-650 ננומטר לאחר רוויה בכחול מונוכרומטי (442 ננומטר) וכתום (596 ננומטר) הסתגלות. נתון זה שונה ממינקה וקירשפלד36. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
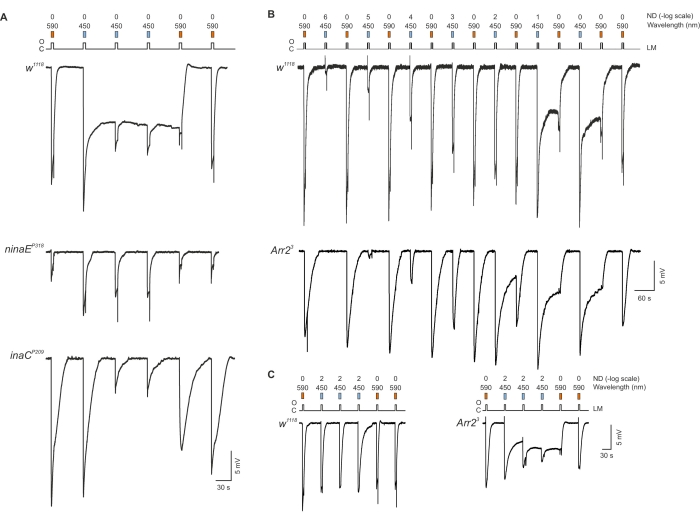
איור 4: פנוטיפ ה-PDA של המוטנטים נינה, ina ו-Arr2 . (A) פרוטוקול האינדוקציה והדיכוי של ה-PDA בדרוזופילה. פרוטוקול האינדוקציה של PDA מורכב מתאורה ראשונית באמצעות פולס אור כתום בעוצמה מקסימלית (מסנן קצה 590, האנרגיה הכוללת הנפלטת מקצה מדריך האור באמצעות המסנן הכתום הייתה 4 mW, פס כתום) ואחריה יישום של שלושה פולסים של אור כחול בעוצמה מקסימלית (הפולסים2 ו-3הם לאימות הגעה ל-PDA המקסימלי, מסנן BP450/40 ננומטר, האנרגיה הכוללת שנפלטה מקצה מדריך האור באמצעות המסנן הכחול הייתה 1 mW, שלושה פסים כחולים). דיכוי PDA הושג על ידי יישום של פולס האור הכתום ואחריו יישום של אור כתום נוסף (שני פסים כתומים). פרוטוקול האינדוקציה והדיכוי של PDA חזר על עצמו במוטציה בעלת העיניים הלבנות של הגן המבני של פוטופיגמנט R1-6, ninaEP318 7 (באמצע). פרוטוקול האינדוקציה והדיכוי של PDA חזר על עצמו גם במוטציה האפסית בעלת העיניים הלבנות של החלבון קינאז C הספציפי לעין (PKC32) inaCP209 (למטה). (B) השוואה בין כמות האור הכחול הנדרשת לאינדוקציה של מחשב כף יד בין WT לבן עיניים (W1118) לבין מוטציה Arr2 אפסית (Arr23). רכבת של פולסי אור כתומים מתחלפים (רוויים ב-590 קצוות) וכחולים (BP450/40 ננומטר) של עוצמות אור הולכות וגדלות (ND בסולם יחסית של לוגים). באור כחול בעוצמה של -log 1, מחשב כף יד מושרה (למעלה). הפרדיגמה של העקבות העליונים חזרה על עצמה במוטציה Arr23 שהראתה כי ה-PDA הושרה באור הכחול בעוצמה של כ-10 פעמים אור עמום (-log 2) (למטה). (C) רכבת של פולסים עמומים (-log 2) של אור כחול בעוצמה קבועה לא הצליחה לגרום ל-PDA ב-W1118 fly(משמאל), בעוד שאותה רכבת של אורות כחולים עמומים גרמה ל-PDA על-ידי פולס האורשל 1 st במוטאנט Arr23 (מימין). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: הקלטות של תאים שלמים של תאי תיקון-מהדקים של תגובות אור של אומטידיה מבודדת, שתועדו מ-WT לבן-עיניים (w1118), והראו דור של זרם קולטן מוקדם (ERC) ואת הקשר בין עוצמת התגובה שלו. (A) הקלטות של תאים שלמים המהדקים טלאי מתוך אומטידיום מבודד של זבוב WT (w1118) של תגובת ERC דו-פאזית עם השהיה תת-מיקרו-שנייה. גירוי האור מורכב מגירוי אור כחול אינטנסיבי (~220 J, 0.8 אלפיות השנייה משך) (מסנן פס רחב עם ספיגת שיא ב-425 ננומטר, חץ) המופעל לאחר הסתגלות חזקה לצהוב-ירוק (מסנן פס רחב עם ספיגת שיא באור של 546 ננומטר, עקבות שחורים). עם תחילת האור, ממצא חשמלי שלילי מהיר נצפה. השלב השלילי נובע מהפעלת M, והשלב החיובי נובע מהפעלת R. הפעלת הזרם המושרה באור (LIC) מתבטאת בפאזה השלילית המושהית הנובעת מפתיחת הערוצים הרגישים לאור. המוטאנט הריק ninaEI17 הראה חוסר בתגובת ERC לאותו הבזק אור המופעל על אומטידיום מבודד (עקבות אדומים). (B) מדידת ERC של פוטופיגמנטים מסוג Rh1 שתועדו מאותו תא כמו (A). העקבה השחורה מראה תגובה שלילית חד-פאזית (מצב M) לגירוי הבזק כתום של זבוב WT (w1118) לאחר הסתגלות חזקה לאור כחול. (C) דגימה של עקבות ERC דו-פאזיים שנמדדו מתא פוטורצפטור יחיד של דרוזופילה מהונדסת (opn4;ninaEI17) המבטאים באופן חוץ-רחמי פוטופידבק של עכברים מלנופסין (opn4) בפוטורצפטורים של זבוב R1-6 בתגובה לעוצמות הולכות וגדלות של אורות הבזק לבנים (בסולם יחסית של לוג I; ND מציין מסנני צפיפות ניטרליים). תחילת הפלאש מסומנת על ידי החץ. (D) העלייה בעוצמת האור באה לידי ביטוי בעלייה ליניארית באמפליטודה של ERC של opn4;ninaEI17. תרשים של משרעת השיא הממוצעת של הפאזה השלילית של תגובות ERC (סולם יומן) כפונקציה של עוצמת אור יחסית (I/Imax, גם בסולם לוגים). הקו הישר הרציף מייצג עקומת רגרסיה ליניארית המתאימה ביותר לנקודות הניסוי (R2 = 0.99, סרגלי השגיאה הם SEM, n = 5). נתון זה שונה מ-Yasin et al.29. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 6: כלים ומכשירים הדרושים לקיבוע זבובים ולהכנת פיפטות להקלטה. (B) דוושת מערכת השינה של זבוב; (ג) מקור אור קר; (ד) מיקרוסקופ סטריאוסקופי; (E) מחמם נימה שעווה; (ו) הלחמת ברזל; (ז) דוושת דודת מחמם נימה בשעווה; (ח) פינצטה גסה; (I) מעמד זבוב מגנטי; (J) שעווה בטמפרטורת התכה נמוכה; (יא) מגבונים עדינים; (L) מושך פיפטה אנכי; (ז) מזרק עם קצה מוארך; (N) מחזיקי אלקטרודות; (O) נימי זכוכית בורוסיליקטיים; (P) זבוב קבוע. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 7: סקירה כללית של מערך ה-ERG. (A) מחולל פולסים; (ב) מחשב; (C) ממיר A/D; (ד) מגבר; (E) מיקרוסקופ סטריאוסקופי; (ו) מיקרומניפולטור (קנס מכני); (G) מערכת מיקרו-אלקטרודה קדם-אמפליפייר עם שלב ראש; (ח) שולחן נגד רעידות; (I) בלוק מגנט מופעל / כבוי; (י) מיקרומניפולטור (גס מכני); (יא) כלוב פאראדיי; (L) מדריך אור ממקור אור קסנון; (ז) מדריך אור ממערכת אור הבזק; (N) מחזיק אלקטרודות קרקע; (O) גלאי אור; (P) הקלטת מחזיק אלקטרודות; (Q) מעמד זבוב מגנטי; (R) ספק כוח מנורת קסנון; (S) עמדת מסנני צבע ו-ND; (ט) ספסל אופטי; (U) מערכת מנורת פלאש; (V) נהג תריס; (W) ספק כוח מנורה; (X) מערכת אור הבזק Xenon אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| הפתרון של רינגר | |
| מגיב | ריכוז (mM) |
| NaCl | 130 |
| KCl | 2 |
| MgCl2 | 5 |
| CaCl2 | 2 |
| HEPES | 10 |
| טיטרציה של pH ל-7.15 באמצעות NaOH ו-HCl | |
טבלה 1: הרכב הפתרון של רינגר.
קובץ משלים 1: דיאגרמת מעגלים של וסת המסת השעווה. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
היתרון העיקרי של שימוש בהכנת הפוטורצפטור של Drosophila הוא הנגישות שלו, הקלות והדיוק של גירוי האור, והכי חשוב, היכולת ליישם את העוצמה של הגנטיקה המולקולרית7. מחקרים גנטיים נרחבים ביססו את Drosophila כמערכת מודל שימושית ביותר לניתוח גנטי של תהליכים ביולוגיים מורכבים7. המבנה הפשוט יחסית של הגנום של דרוזופילה (המורכב מארבעה כרומוזומים בלבד, כולל כרומוזומי המין X ו-Y, שני יסודות אוטוזומליים גדולים יותר, כרומוזומים 2 ו-3, והכרומוזום הרביעי של הנקודה הקטנה), קלות הצמיחה וזמן הדור המהיר (כשבועיים ב-24 מעלות צלזיוס) הופכים את דרוזופילה למתאימה לסינון מספר עצום של זבובים בודדים מוטגניים. יתר על כן, הבידוד והתחזוקה של כל מוטציה מבודדת מתאפשרים עקב יצירת כרומוזומים מאזנים, המכילים סמנים דומיננטיים והיפוכים מרובים, המונעים רקומבינציה עם הכרומוזומים המקומיים. הכלים המולקולריים הזמינים אפשרו לחקור תוצרי גנים שעברו שינוי במבחנה בסביבתם התאית הטבעית37. מתודולוגיה רבת עוצמה זו יצרה שפע של זבובים מוטנטיים עם פגמים בחלבונים חדשים שאחרת היה קשה לחזות7.
היתרון העיקרי של השימוש ב-ERG למדידות של רמות פוטופיגמנט ורגישות לאור הוא הפשטות וקלות היישום שלו ויחס האות לרעש הגדול. החיסרון בשימוש ב-ERG הוא מקורו ההטרוגני של התאים, המעוות את צורת הגל של תגובת האור הנובעת מהפוטורצפטורים9. היתרון העיקרי של הקלטות מתח-מהדק של תאים שלמים הוא היכולת להפיק שינוי מוליכות על ידי מדידת הקשר בין זרם למתח (I-V). הפתיחה והסגירה של ערוצי ה- TRP וה- TRPL במהלך התאורה ובעקבותיה משתקפות על ידי מדידה זו13. בנוסף, מתקבל יחס אות לרעש גבוה בגלל ההתנגדות הנמוכה של פיפטת ההקלטה (~10 MΩ) ומדידת הזרמים, מה שמאפשר מדידות אמינות של בליטות קוונטיות (תגובות של פוטון יחיד), מה שמועיל לכיול עוצמת האור האפקטיבית38. חיסרון מרכזי של הקלטות טלאי-מהדק תאים שלמים הוא שבעוד שהקלטות ERG יכולות להישמר במשך שעות גם בעוצמות אור קיצוניות, קשה לבצע הקלטות אמינות של תאים שלמים של הידוק טלאי במשך יותר מ-15-30 דקות, וגירוי אור עמום נדרש להקלטות ממושכות. כדי לקבל הקלטות של תאים שלמים, נדרש מגע ישיר בין פיפטת ההקלטה לבין קרום הפוטורצפטור. מגע ישיר מושג על ידי הסרת תאי הפיגמנט (גליה) המקיפים את האומטידיה34 (איור 1B). הסרת תאי פיגמנט גורמת ללחץ מטבולי מכיוון שתא הפוטורצפטור אינו יכול לסנתז את המטבוליטים הדרושים לייצור אדנוזין טריפוספט (ATP), מה שמשבש את האספקה המטבולית39. מכיוון שתעלות TRP ו- TRPL פגיעות לאנוקסיה ונפתחות בקלות באופן ספונטני בחושך עקב דלדול ATP, השימוש באומטידיה מבודדת מטיל קושי רב40,12. ההליך כולו צריך להיעשות תחת אור אדום עמום מכיוון שתגובת האור גורמת לצריכה גדולה של ATP34.
רוב המוטציות במפל הפוטו-טרנסדוקציה גורמות לירידה ברגישות לאור. הפחתה זו ברגישות לאור ניתנת לזיהוי בקלות על ידי מסך המבוסס על מדידת יחסי העוצמה-תגובה. פרדיגמות של תגובת עוצמה מושגות על ידי גירויי אור חוזרים ונשנים בעוצמה גוברת בסולם לוגריתמי. הגדלה (ולא ירידה) בעוצמות של אור כתום נדרשות כדי למנוע הסתגלות לאור. ה-ERG (M-potential) וה-PDA הן שיטות פשוטות ביותר למדידת רמות הפוטוגמנט. האלטרנטיבה, כלומר מיקרוספקטרופוטומטריה36, דורשת ציוד אופטי יקר והכשרה ומיומנות ניכרות.
לסיכום, ה- ERG הוא כלי פשוט ליישום אך לא מדויק יחסית. הקלטה של תאים שלמים31 מדויקת למדידת רמות הפוטוגמנט באמצעות ה-ERC, והיא חיונית לפיצוי על אי הדיוק והמגבלות של ה-ERG.
Disclosures
המחברים מצהירים על היעדר ניגוד עניינים.
Acknowledgements
מחקר זה נתמך על ידי מענקים מהקרן הישראלית למדע (ISF) ומהקרן הדו-לאומית למדע ארצות הברית-ישראל (BSF). אנו מודים למר אנטולי שאפוצ'ניקוב על בניית מחמם השעווה.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe with elongated tip | Figure 6M | ||
| 1 rough tweezers | Dumont #5, Standard | 0.1 mm x 0.06 mm, length 110 mm, Inox (Figure 6H) | |
| 2 condenser lenses | |||
| A/D converter | Molecular Device | Digidata 1200 | Possible replacement: any digidata from molecular devices (e.g 1440A) -Figure 7C |
| Amplifier | Almost perfect electronics | Possible replacement: Warner instruments- IE251A or IE-210 (comes with headstage)- Figure 7D | |
| Anti-vibration Table | Newport | VW-3036-OPT-01 | Figure 7H |
| Capillaries | Harvard Apparatus | Borosilicate glass capillaries | 1 mm x 0.58 mm (Figure 6O) |
| Clampex | Molecular Device | Software | |
| CO2 tank | |||
| Cold light source | Schott | KL1500 LCD | Figure 6C |
| Delicate wipers | Kimtech | Kimwipes (Figure 6K) | |
| Electrode holder | Suitable for capillary O.D. 1 mm (Figure 6N, Figure 7N, and Figure 7P) | ||
| Faraday cage | Home made | Electromagnetic noise shielding and black front curtain (Figure 7K) | |
| Filter (Color) | Schott | OG590, Edge filter | Figure 7S |
| Filter (Color) | Schott | BP450/40 nm | Figure 7S |
| Filter (Color) | Blazers | 550 nm | Figure 7S |
| Filter (Color) for cold light source | Schott | RG630 | Figure 6C |
| Filter (Heat) | Schott | KG3 | Figure 7S |
| Filters (Neutral density filter) | Chroma | 6,5,4,3,2,1,0.5,0.3 | Figure 7S |
| Flash Lamp system | Honeywell | Figure 7U | |
| Fly sleeper system with injector | Inject + matic | Figure 6A-B | |
| Lamp power supply | PTI | LPS-220 | Figure 7W |
| Light detector | Home made | Phototransistor (Figure 7O) | |
| Light guide | 3 mm diameter, 1.3 m long (Figure 7L,M) | ||
| Light source | High-pressure ozone-free 75 W Xenon lamp (operating on 50 W), possible replacement: Cairn research- OptoLED (Figure 7R) | ||
| Low temperature melting wax | Home made | Composed of mixture of beeswax (Tm≈62 °C) and paraffin at ~3:1 to reach a melting temperature of ~55–56 °C (Figure 6J) | |
| Magnetic stand for flies | Home made | Figure 6I and Figure 7Q | |
| Microelectrode preamplifier system with head-stage | Almost perfect electronics | Impedance tester (Figure 7G) | |
| Micromanipulator (mechanical coarse) | Tritech Research, Narishige | M-2 | |
| Micromanipulator (mechanical fine) | Leitz Microsystems | Leitz Mechanical Micromanipulator | Figure 7F |
| pCLAMP | Molecular Device | Software | |
| Petri dish | 60 mm | ||
| Pulse generator | AMPI | Master 8 | Figure 7A |
| Redux cream for electrocardiography | Parker Laboratories | Redux Electrolyte Crème | |
| Shutter driver | Uniblitz, Vincent Associates | VCM-D1 Single Channel Uni-stable | Figure 7V |
| Shutter system | Uniblitz, Vincent Associates | LS2 2 mm Uni-stable Shutters | Figure 7V |
| Silver Wire | Warner Instruments | 0.25–1 mm diameter, needs to be chloridized | |
| Soldering iron composed of a platinum-iridium filament | 0.25 mm diameter (Figure 6F) | ||
| Stereoscopic zoom Microscope | Nikon | SMZ-2B | Figure 6D |
| Stereoscopic zoom Microscope | Wild | Wild M5 | With 6, 12, 25 and 50 magnification settings (Figure 7E) |
| Syringe filters | Millex | 22 µm PVDF filter | |
| Vertical pipette puller | Sutter/ Narishige | Model P-97/PP-830 | Use either vertical or horizontal puller, as preferred (Figure 6L) |
| Wax filament heater | Home made | See figure S1 (Figure 6E-G) | |
| Xenon Flash Lamp system | Dr. Rapp OptoElectronic | JML-C2 | Figure 7X |
References
- Vogt, K., Kirschfeld, K. Chemical identity of the chromophores of fly visual pigment. Naturwissenschaften. 77, 211-213 (1984).
- Hillman, P., Hochstein, S., Minke, B. Transduction in invertebrate photoreceptors: role of pigment bistability. Physiological Reviews. 63 (2), 668(1983).
- Hamdorf, K. Handbook of Sensory Physiology. Comparative Physiology and Evolution of Vision in Invertebrates. Autrum, H. 7, Springer-Verlag. 145-224 (1979).
- Gagné, S., Roebroek, J. G., Stavenga, D. G. Enigma of early receptor potential in fly eyes. Vision Research. 29 (12), 1663-1670 (1989).
- Pak, W. L., Shino, S., Leung, H. T. PDA (prolonged depolarizing afterpotential)-defective mutants: the story of nina's and ina's--pinta and santa maria, too. Journal of Neurogenetics. 26 (2), 216-237 (2012).
- Wang, X., Wang, T., Jiao, Y., von, L. J., Montell, C. Requirement for an enzymatic visual cycle in Drosophila. Current Biology. 20 (2), 93-102 (2010).
- Pak, W. L. Drosophila in vision research. The Friedenwald lecture. Investigative Ophthalmology & Visual Science. 36 (12), 2340-2357 (1995).
- Pak, W. L. Neurogenetics, Genetic Approaches to the Nervous System. Breakfield, X. , Elsevier, North-Holland. 67-99 (1979).
- Minke, B. Light-induced reduction in excitation efficiency in the trp mutant of Drosophila. The Journal of General Physiology. 79, 361-385 (1982).
- Minke, B., Kirschfeld, K. Fast electrical potentials arising from activation of metarhodopsin in the fly. The Journal of General Physiology. 75 (4), 381-402 (1980).
- Stephenson, R. S., Pak, W. L. Heterogenic components of a fast electrical potential in Drosophila compound eye and their relation to visual pigment photoconversion. The Journal of General Physiology. 75 (4), 353-379 (1980).
- Agam, K., et al. Metabolic stress reversibly activates the Drosophila light-sensitive channels TRP and TRPL in vivo. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 20 (15), 5748-5755 (2000).
- Hardie, R. C., Minke, B. The trp gene is essential for a light-activated Ca2+ channel in Drosophila photoreceptors. Neuron. 8, 643-651 (1992).
- Niemeyer, B. A., Suzuki, E., Scott, K., Jalink, K., Zuker, C. S. The Drosophila light-activated conductance is composed of the two channels TRP and TRPL. Cell. 85 (5), 651-659 (1996).
- Phillips, A. M., Bull, A., Kelly, L. E. Identification of a Drosophila gene encoding a calmodulin-binding protein with homology to the trp phototransduction gene. Neuron. 8, 631-642 (1992).
- Minke, B., Wu, C. F., Pak, W. L. Isolation of light-induced response of the central retinular cells from the electroretinogram of Drosophila. Journal of Comparative Physiology. 98, 345-355 (1975).
- Selinger, Z., Doza, Y. N., Minke, B. Mechanisms and genetics of photoreceptors desensitization in Drosophila flies. Biochimica et Biophysica Acta. 1179, 283-299 (1993).
- Minke, B. The history of the prolonged depolarizing afterpotential (PDA) and its role in genetic dissection of Drosophila phototransduction. Journal of Neurogenetics. 26 (2), 106-117 (2012).
- Satoh, A. K., et al. Arrestin translocation is stoichiometric to rhodopsin isomerization and accelerated by phototransduction in Drosophila photoreceptors. Neuron. 67 (6), 997-1008 (2010).
- Byk, T., Bar Yaacov, M., Doza, Y. N., Minke, B., Selinger, Z. Regulatory arrestin cycle secures the fidelity and maintenance of the fly photoreceptor cell. Proceedings of the National Academy of Sciences of the United States of America. 90, 1907-1911 (1993).
- Dolph, P. J., et al. Arrestin function in inactivation of G protein-coupled receptor rhodopsin in vivo. Science. 260, 1910-1916 (1993).
- Belusic, G., Pirih, P., Stavenga, D. G. Photoreceptor responses of fruitflies with normal and reduced arrestin content studied by simultaneous measurements of visual pigment fluorescence and ERG. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural, and Behavioral Physiology. 196 (1), 23-35 (2010).
- Stavenga, D. G., Hardie, R. C. Metarhodopsin control by arrestin, light-filtering screening pigments, and visual pigment turnover in invertebrate microvillar photoreceptors. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural, and Behavioral Physiology. 197 (3), 227-241 (2011).
- Stark, W. S., Zitzmann, W. G. Isolation of adaptation mechanisms and photopigment spectra by vitamin A deprivation. Journal of Comparative Physiology. 105, 15-27 (1976).
- Minke, B., Kirschfeld, K. The contribution of a sensitizing pigment to the photosensitivity spectra of fly rhodopsin and metarhodopsin. The Journal of General Physiology. 73, 517-540 (1979).
- Cone, R. A., Cobbs, W. H. Rhodopsin cycle in the living eye of the rat. Nature. 221 (5183), 820-822 (1969).
- Murakami, M., Pak, W. L. Intracellularly recorded early receptor potential of the vertebrate photoreceptors. Vision Research. 10 (10), 965-975 (1970).
- Hodgkin, A. L., Obryan, P. M. Internal recording of the early receptor potential in turtle cones. The Journal of Physiology. 267 (3), 737-766 (1977).
- Yasin, B., et al. Ectopic expression of mouse melanopsin in Drosophila photoreceptors reveals fast response kinetics and persistent dark excitation. Journal of Biological Chemistry. 292 (9), 3624-3636 (2017).
- Hardie, R. C. Photolysis of caged Ca 2+ facilitates and inactivates but does not directly excite light-sensitive channels in Drosophila photoreceptors. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 15, 889-902 (1995).
- Hardie, R. C. Whole-cell recordings of the light induced current in dissociated Drosophila photoreceptors: evidence for feedback by calcium permeating the light-sensitive channels. Proceedings of the Royal Society of London. Series B, Containing Papers of a Biological Character. Royal Society (Great Britain). 245, 203-210 (1991).
- Ranganathan, R., Harris, G. L., Stevens, C. F., Zuker, C. S. A Drosophila mutant defective in extracellular calcium-dependent photoreceptor deactivation and rapid desensitization. Nature. 354, 230-232 (1991).
- Pak, W. L., Lidington, K. J. Fast electrical potential from a long-lived, long-wavelength photoproduct of fly visual pigment. The Journal of General Physiology. 63 (6), 740-756 (1974).
- Katz, B., Gutorov, R., Rhodes-Mordov, E., Hardie, R. C., Minke, B. Electrophysiological method for whole-cell voltage clamp recordings from drosophila photoreceptors. Journal of Visualized Experiments: JoVE. (124), e55627(2017).
- Selinger, Z., Minke, B. Inositol lipid cascade of vision studied in mutant flies. Cold Spring Harbor Symposia on Quantitative Biology. 53, 333-341 (1988).
- Minke, B., Kirschfeld, K. Microspectrophotometric evidence for two photoconvertible states of visual pigments in the barnacle lateral eye. The Journal of General Physiology. 71, 37-45 (1978).
- Ranganathan, R., Harris, W. A., Zuker, C. S. The molecular genetics of invertebrate phototransduction. Trends in Neurosciences. 14, 486-493 (1991).
- Henderson, S. R., Reuss, H., Hardie, R. C. Single photon responses in Drosophila photoreceptors and their regulation by Ca 2. The Journal of Physiology. 524, 179-194 (2000).
- Dimitracos, S. A., Tsacopoulos, M. The recovery from a transient inhibition of the oxidative metabolism of the photoreceptors of the drone (Apis mellifera). Journal of Experimental Biology. 119, 165-181 (1985).
- Agam, K., Frechter, S., Minke, B. Activation of the Drosophila TRP and TRPL channels requires both Ca 2+ and protein dephosphorylation. Cell Calcium. 35 (2), 87-105 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved